リバモリウム
| |||||||||||||||||||||||||||||||
| 外見 | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 不明 | |||||||||||||||||||||||||||||||
| 一般特性 | |||||||||||||||||||||||||||||||
| 名称, 記号, 番号 | リバモリウム, Lv, 116 | ||||||||||||||||||||||||||||||
| 分類 | 不明 | ||||||||||||||||||||||||||||||
| 族, 周期, ブロック | 16, 7, p | ||||||||||||||||||||||||||||||
| 原子量 | [293] | ||||||||||||||||||||||||||||||
| 電子配置 | [Rn] 5f14 6d10 7s2 7p4(推定) | ||||||||||||||||||||||||||||||
| 電子殻 | 2, 8, 18, 32, 32, 18, 6(画像) | ||||||||||||||||||||||||||||||
| 物理特性 | |||||||||||||||||||||||||||||||
| 密度(室温付近) | 12.9 (α-Lv) g/cm3 | ||||||||||||||||||||||||||||||
| 融点 | 300 (推定) °C | ||||||||||||||||||||||||||||||
| 沸点 | 900 (推定) °C | ||||||||||||||||||||||||||||||
| 原子特性 | |||||||||||||||||||||||||||||||
| 共有結合半径 | 175 pm | ||||||||||||||||||||||||||||||
| その他 | |||||||||||||||||||||||||||||||
| 結晶構造 | 単純立方格子 (α-Lv,推定)
単純菱面体格子 (β-Lv,推定) | ||||||||||||||||||||||||||||||
| CAS登録番号 | 54100-71-9 | ||||||||||||||||||||||||||||||
| 主な同位体 | |||||||||||||||||||||||||||||||
| 詳細はリバモリウムの同位体を参照 | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
リバモリウム(英: Livermorium)は、元素記号Lv、原子番号116の合成元素である。また、超重元素のひとつでもある。放射性が非常に強いため研究室でしか作られず天然には観察されない。2000年から2006年に行われた実験でロシア連邦のドゥブナ合同原子核研究所(JINR)とアメリカ合衆国のローレンス・リバモア国立研究所(LLNL)の共同でリバモリウムを発見した質量数290から293の4つの同位体が知られ、最も寿命が長いものはリバモリウム293で、半減期は約60ミリ秒である。質量数294の5番目の同位体が報告されているが、確認はされていない。
周期表上では、pブロックの超アクチノイド元素である。第7周期元素の第16族元素で、最も重いカルコゲンであるが、ポロニウムのホモログとして振る舞うかは確認されていない。リバモリウムは軽いホモログ(酸素、硫黄、セレン、テルル、ポロニウム)と似た性質を持つと計算されており、貧金属であるが、これらとはかなり異なる性質も示す。
名称
[編集]アメリカ合衆国のローレンス・リバモア国立研究所(LLNL)に因んで命名された。この名前は研究所の所在するカリフォルニア州リバモアに由来し、さらにこれは地主で農場主のロバート・リバモアに由来する。この名前は、2012年5月30日に国際純正・応用化学連合(IUPAC)に承認された[1]。
歴史
[編集]合成の失敗
[編集]248Cmと48Caの反応を用いた116番元素の最初の探索は1977年にLLNLでKen Huletらによって行われたが、彼らはリバモリウムを検出できなかった[2]。フリョロフ原子核反応研究所(FLNR)のユーリイ・オガネシアンらも1978年に試みたが、失敗した。1985年、ローレンス・バークレー国立研究所(LBNL)とドイツの重イオン研究所(GSI)のPeter Armbrusterのチームの間の実験も失敗したが、反応断面積の範囲が10-100 pbに限定されると計算された。natPb+48Caの反応でノーベリウムを合成するのに大変便利に用いられる48Caを用いた反応の研究は、1989年に開発された超重元素セパレータを用いてドゥブナで続けられたが、LLNLとの共同でのターゲット物質の探索が1990年から始まり、より強力な48Caビームの開発が1996年から、従来より3桁高精度な長期実験の準備が1990年代初めから始まった。48Caとアクチノイドのターゲットを反応させるこの研究により、112番から118番元素の新しい同位体が発見され、フレロビウム、モスコビウム、リバモリウム、テネシン、オガネソンという周期表上で最も重い5つの元素が発見された[3]。
1995年、GSIのシグルド・ホフマン率いる国際チームは、鉛208とセレン82を用いた放射捕獲反応により116番元素の合成を試みたが、116番元素は発見できなかった[4]。
「発見」の主張
[編集]1998年末、ポーランドの物理学者ロバート・スモランチュクは、オガネソンとリバモリウムを含む超重元素の合成のための原子核融合に関する計算を公表した[5]。彼の計算は、慎重に制御された環境下で鉛とクリプトンを融合させることで、これら2つの元素を合成できることを示していた[5]。
1999年、LBNLの研究者はこの予測を用いてリバモリウムとオガネソンを発見したとPhysical Review Letters誌の論文で公表し[6]、その直後、サイエンス誌でも結果を報告した[7]。この研究者は、以下の反応が起こったと報告した。
翌年、LBNL自体も含め、他のどの研究者もこの結果を再現できないということで、論文は取り下げられた[8]。2002年6月、LBNLの研究所長は、これら2つの元素の発見を最初に主張したのは、ヴィクトル・ニノフの捏造したデータに基づいていたと発表した[9][10]。
発見
[編集]リバモリウムは、2000年7月19日、JINRにおいてCm248にCa48を衝突させて初めて合成された。1つの原子が検出され、崩壊エネルギー10.54 MeVでアルファ崩壊してフレロビウムとなった。この結果は2000年12月に公表された[11]。
- 96248Cm + 2048Ca → 116296Lv* → 116293Lv + 3n → 114289Fl + α
崩壊生成物のフレロビウム同位体は、1999年6月に初めて合成されたフレロビウム同位体と一致した性質を示した。当初はこれは288Flと同定され[11]、合成されたリバモリウム同位体は292と考えられた。2002年12月に行われた研究で、このフレロビウム同位体は実は289Flであり、リバモリウム同位体は293であったことが示された[12]。
確認
[編集]2001年4-5月に行われた2度目の実験で、さらに2つの原子が報告された[13]。同じ実験で、1998年12月に初めて確認され289Flとされたフレロビウムの崩壊系列と同じ系列も検出された[13]。1998年2月に発見されたものと同じ性質を持つフレロビウム同位体は、同じ実験を繰り返しても再度観測されなかった。後にこれは289Flは異なる崩壊系列を持つことが明らかとなり、最初に観察されたフレロビウム原子は、核異性体289mFlとされた[11][14]。この一連の実験の中で289mFlが観察されたことは、崩壊前の原子が293mLvであったか、293Lvから289mFlに至る未発見の珍しい分岐経路があることを意味する。どちらの説も正しいとは考えられず、別の可能性として、1998年12月に確認された原子が実は290Flであり、崩壊前の原子が294Lvであったというものであるが、248Cm(48Ca,2n)294Lv反応でさらに確認する必要がある[11][14][15]。
研究チームはこの実験を2015年4月-5月に繰り返し、8つのリバモリウム原子を検出した。測定された崩壊データにより、最初に発見された同位体が293Lvであることが確認されたが、この期間の実験中に、292Lvが初めて観察された[12]。2004年から2006年にさらに行われた実験では、248Cmターゲットをより軽い245Cm同位体に置き換え、290Lvと291Lvの2つの同位体存在の証拠が発見された[16]。
2009年5月、IUPACと国際純粋・応用物理学連合(IUPAP)の合同作業部会(JWP)は、コペルニシウムの発見と、同位体283Cnの発見を承認したことを報告した[17]。これは、コペルニシウムの発見の証明にリバモリウムのデータは必須ではなかったものの、その孫娘原子核283Cnに関連するデータの承認から、291Lvが事実上の発見を示唆していた。また、同2009年にはリバモリウム同位体の直下の娘核である、質量数286から289のフレロビウムの同位体がLBNLとGSIによって確認された。2011年、IUPACは、2000年から2006年にJINRが得たデータを評価した。291Lvや283Cnが含まれない初期のデータは決定的ではなかったものの、2004年から2006年のデータはリバモリウムを同定しているものとして承認され、公式に発見が認められた[16]。
リバモリウムの合成は、GSIで2012年、理化学研究所で2014年と2016年にそれぞれ独立に確認された[18][19]。2016年の理研の実験では、294Lvが観測したと考えられたが、リバモリウム原子核からの最初のアルファ粒子を見失ってしまい、未だに公式には294Lvは認められていない[20]。
命名
[編集]未発見元素に対するメンデレーエフの命名法に基づき、エカポロニウムという名称でも知られる[21]。IUPACによる1979年の勧告により、発見が確定し命名されるまでは、一時的にウンウンヘキシウム(英: Ununhexium, 記号Uuh)とも呼ばれていた[22]。この分野の科学者の多くは[23][24]、「元素116」と呼び、E116または単に116という記号で表す[25]
IUPACのガイドラインでは、発見チームに新元素の命名権が与えられる[26]。リバモリウムの発見は、JWPにより2011年6月1日にフレロビウムとともに公式に認められた[16]。JINRの副所長によると、JINRのチームは当初は、研究所が所在するモスクワ州に因んでモスコビウムという名前にすることを考えていたが[27]、後にこの名前は115番元素に与えられることに決まった。リバモリウムという名前と記号のLvは、2012年[1][28]5月23日[29]に承認された。この名前は、カリフォルニア州リバモアに所在するLLNLがJINRと共同で発見したことに因んでいる[1] The naming ceremony for flerovium and livermorium was held in Moscow on 24 October 2012.[30]。フレロビウムとリバモリウムの命名の記念式典は、2012年10月24日にモスクワで開催された。
予測される性質
[編集]核安定性と同位体
[編集]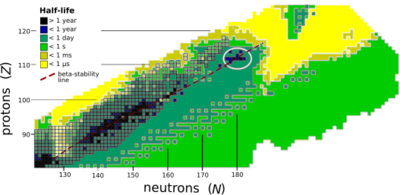
リバモリウムは、コペルニシウムとフレロビウムを中心とする安定の島の近くにあると考えられている。この島が存在する理由はまだ十分に解明されていない[31][32]。高い融合障壁のため、安定の島内の原子核の大部分はアルファ崩壊し、電子捕獲やベータ崩壊もいくらか起こる可能性がある[33]。既知のリバモリウムの同位体は、実際は中性子の数が足りず安定の島内にはないが、同位体が重くなり島に近づくほど一般に寿命が長くなる[11][16]。
超重元素は核融合により合成されるが、核融合は精製される複合核の励起エネルギーによって「熱い」核融合と「冷たい」核融合に分類できる。熱い核融合では、超重ターゲット(アクチノイド)に向かって非常に軽く高エネルギーの原子核を加速し、高励起エネルギー(~40-50 MeV)の複合原子核を生成し、この核は分裂するか、いくつか(3-5個)の中性子を手放す[34]。冷たい核融合では、鉛やビスマス等の軽いターゲットに第4周期等の重い原子を衝突させ、生成される複合核は比較的低い励起エネルギー(~10-20 MeV)を持ち、これらの生成物が分裂する確率は低くなる。融合した核が基底状態まで冷えると、1つか2つの中性子の放出が必要になる。巨視的な量を準備できる元素の中で、アクチノイドは最も高い中性子-陽子比率を持つため、熱い融合ではより中性子の多い生成物が作られる傾向がある[35]。
多くの種類の同位体、特に既知のものからいくつか中性子が多かったり少なかったりする286Lv、287Lv、288Lv、289Lv、294Lv、295Lv等を合成することで、超重原子核の性質について重要な情報を得ることができる。ターゲットとなるキュリウムには長寿命の同位体が多いため、これは可能かもしれない[31]。軽い同位体は、243Cmを48Caと融合させることで作られる。これらはアルファ崩壊の系列に入り、熱い融合で作られるには軽すぎ、冷たい融合で作るには重すぎる超アクチノイド元素で終わる[31]。
重い同位体294Lv、295Lvの合成は、250Cmを48Caと融合させることで作られる。この核反応の反応断面積は、約1 pbであるが、250Cmをターゲットとするのに必要な量だけ作ることはまだできていない[31]。何度かのアルファ崩壊後、これらの同位体はベータ安定性を持ったラインに至る。さらに、この領域では電子捕獲が重要な崩壊モードになり、島の中央に至ることを可能にする。例えば、295Lvはアルファ崩壊して291Flとなり、電子捕獲を繰り返して291Nhを経て、半減期約1200年d安定の島の中央に位置すると考えられる291Cnに至る。これは、現在の技術で島の中央に至る最も可能性の高い方法である。欠点は、ベータ安定のラインに近い超重原子核の崩壊の性質は、全く調べられていないことである[31]。
他に可能性のある、安定の島内の原子核を合成するための方法は、重い原子核の準核分裂である[36]。このような分裂では、カルシウム40、スズ132、鉛208、ビスマス209等の魔法数の2倍か2倍に近い断片を生成する傾向がある[37]。近年、ウランやキュリウム等のアクチノイド原子核の衝突による多核子移行反を安定の島にある中性子の多い超重原子核の合成に使うことができることが示されたが[36]、より軽い元素であるノーベリウムやシーボーギウムの合成に使うのにより便利である[31]。安定の島付近の同位体を合成するための最後の可能性は、制御された核爆発によって、258-260Fm及び質量数275(原子番号104-108)の位置にある安定性ギャップを迂するのに十分なエネルギーを持つ中性子束を作りだし、自然界で最初にアクチノイド元素が作られたr過程を模倣することでラドン周辺の不安定性を迂回することである[31]。そのような同位体のいくつか(特にコペルニシウム291や293)は天然でも合成されているが、崩壊が速すぎ(半減期数千年)、生成が少量すぎる(鉛の10-12)ので、宇宙線を除いては、原始核種として検出されないだろうと考えられている[31]。
物理と原子
[編集]周期表上では、リバモリウムは第16族元素(カルコゲン)であり、酸素、硫黄、セレン、テルル、ポロニウムの下に位置する。他のカルコゲンは全て価電子が6つであり、ns2np4という最外殻電子配置を取っており、リバモリウムの場合は7s27p4という配置であると予測され[25]、より軽い同族元素とある程度似た性質を持つと予測される。違いは、主にスピン軌道相互作用から来ていると考えられる。これは、重い元素では軽い元素と比べて電子が遥かに速く、光速に匹敵する速度で動くため、超重元素で特に相互作用が強くなるためである[38]。リバモリウムの場合、7sと7pの電子エネルギー準位を下げ(対応する電子より安定させ)るが、2つの7p電子エネルギー準位は他の4つよりも多く安定化される[39]。7s電子の安定化は、不活性電子対効果と呼ばれ、7p小軌道がより安定化された状態とあまり安定化されていない状態に「引き裂く」効果は、subshell splittingと呼ばれる。 コンピュータ化学者は、この分割を、7p小軌道の軌道角運動量の1から1/2(安定度高)と3/2(安定度低)への変化と理解する。7p1/2小軌道は、2番目の不活電子対として働くが、7s電子ほど不活ではない。一方、7p3/2小軌道は容易に化学反応に関与する[25][38]。7p小軌道の分割を考慮して、リバモリウムの価電子配置は7s27p21/27p23/2と書かれることもある[25]。
リバモリウムの不活電子対の効果はポロニウムよりも強く、従って+2の酸化数は、最も電気陰性なリガンドのみで安定化される+4の酸化数よりも安定である。これは、不活性な7p1/2小軌道による切れ目のため、第2と第3及び第4と第5のイオン化エネルギーの間に大きな差のあるリバモリウムのイオン化エネルギーに反映されている[33]。実際に、7s電子は非常に不活性なため、+6の酸化数を取ることはない[25]。リバモリウムの融点及び沸点はカルコゲンの傾向に従い、ポロニウムよりも高い温度で溶融し、低い温度で沸騰する[40]。また、ポロニウムよりも密度が高く(α-Lv: 12.9 g/cm3; α-Po: 9.2 g/cm3)、ポロニウム同様にαとβの同素体を持つ[33][41]。水素様リバモリウム原子の電子は非常に高速で動くため、その質量は相対論効果のため、不動電子の1.86倍になる。対照的に、水素様ポロニウムの場合は1.26倍、水素様テルルの場合は1.080倍である[38]。
化学
[編集]リバモリウムは、周期表上で7p系列の4番目、また第16族で最も重い元素である。理論研究によると、化学性質はポロニウムのものとよく似ている[33]。+6の酸化数は、超原子価のためのd軌道を欠き、それ自体が元素の中で最も強い酸化剤である酸素を除く全てのカルコゲンで知られている。酸素の酸化数は+2に限られ、フッ化物OF2を形成する。+4の酸化数は硫黄、セレン、テルル、ポロニウムで知られ、硫黄 (IV)及びセレン (IV)の還元から、テルル (IV)の最も安定な状態を経て、ポロニウム (IV)の酸化まで、安定性が変化する。これは、周期表の下方に行くに従って相対論効果、特に不活電子対効果の比重が増え、高い酸化数の安定性が減少することを示している[38]。そのため、リバモリウムの最も安定な酸化数は+2で、+4はかなり不安定である。+2の状態は、ベリリウムやマグネシウムに匹敵するほど取りやすく、+4の状態は、フッ化リバモリウム (IV)等、電気陰性度の強いリガンドの時のみ取ることができる[25]。+6の状態は、7s電子の非常に強い安定化のために取ることはなく、リバモリウムの最外殻は4つの電子で構成される[33]。軽いカルコゲンでは、酸化物、硫化物、セレニド、テルリド、ポロニウム化物等、酸化数-2の状態も知られているが[25]、リバモリウムの7p3/2小軌道の不安定性のため、リバモリウムの酸化数-2の状態は非常に不安定である[38]。
リバモリウム化水素(LvH2)は、最も重い水素化カルコゲン(カルコゲン化水素)であり、また最も重い水のホモログである。ポロニウムは金属と半金属を跨ぐ位置にあり、非金属の性質もいくらか持つことから、ポロニウム化水素はより共有結合性が強い。これは、塩酸等の水素ハロゲン化物とスタンナン等の金属ハロゲン化物の中間体である。LvH2はこの傾向を引き継ぎ、リバモリウム化物よりも水素化物の性質が強いが、まだ共有分子結合である[42]。スピン軌道相互作用のため、Lv-H結合は周期表の傾向から単純に予測されるよりも長く、H-Lv-H結合角も大きくなる。これは、非占有8s軌道のエネルギーが比較的低く、リバモリウムの7p価電子と混成軌道を形成するためである。"supervalent hybridization"と呼ばれる[42]この現象は、周期表の非相対論領域では見られず、例えばCaF2分子は、カルシウム原子由来の4s及び3d軌道を含む[43]。より重い二ハロゲン化リバモリウムは直線形であると予測されるが、より軽い分子は曲がっていると予測される[44]。
実験化学
[編集]リバモリウムの化学的性質の明確な決定はまだなされていない[45][46]。2011年、アメリシウム243とプルトニウム244をターゲットとしてカルシウム48を衝突させ、ニホニウム、フレロビウム、モスコビウムの同位体を作成する実験が行われた。しかしターゲットには不純物として鉛とビスマスが含まれていたため、核交換反応でビスマスとポロニウムの同位体が生成した。これは予期しない事態であったが、ビスマスとポロニウムのそれぞれ重いホモログであるモスコビウムとリバモリウムの化学的性質を将来調べる際に有益な情報を与えてくれた[46]。生成したビスマス213とポロニウム212mは、850℃の温度でタンタルによって支持された水晶羊毛フィルターを通って、水素化物213BiH3及び212mPoH2として運ばれ、驚いたことに熱安定性を示した。しかし、より重いホモログのMc3やLv2は、周期表上のpブロックの傾向から、ここまでの熱安定性はないと予測されている[46]。化学実験が行われる前には、BiH3、PoH2、McH3やLvH2について、安定性や電子構造についてのさらなる計算が必要である。純粋なモスコビウムとリバモリウムは、将来化学実験を行うのに十分な揮発性を持つと考えられ、リバモリウムの性質はより軽い同族体であるポロニウムと共通していると考えられる。しかし、既知の全てのリバモリウム同位体の半減期が短いことから、現時点では化学実験は不可能である[46][47]。
出典
[編集]- ^ a b c element-114-is-named-flerovium-and-element-116-is-named-livermorium, 3/11/2018. (dead link)
- ^ Hulet, E. K.; Lougheed, R.; Wild, J.; Landrum, J.; Stevenson, P.; Ghiorso, A.; Nitschke, J.; Otto, R. et al. (1977). “Search for Superheavy Elements in the Bombardment of 248Cm with48Ca”. Physical Review Letters 39 (7): 385-389. Bibcode: 1977PhRvL..39..385H. doi:10.1103/PhysRevLett.39.385.
- ^ Armbruster, P.; Agarwal, YK; Bruchle, W; Brugger, M; Dufour, JP; Gaggeler, H; Hessberger, FP; Hofmann, S et al. (1985). “Attempts to Produce Superheavy Elements by Fusion of 48Ca with 248Cm in the Bombarding Energy Range of 4.5-5.2 MeV/u”. Physical Review Letters 54 (5): 406-409. Bibcode: 1985PhRvL..54..406A. doi:10.1103/PhysRevLett.54.406. PMID 10031507.
- ^ Hofmann, Sigurd (1 December 2016). The discovery of elements 107 to 112 (PDF). Nobel Symposium NS160 - Chemistry and Physics of Heavy and Superheavy Elements. doi:10.1051/epjconf/201613106001。
- ^ a b Smolanczuk, R. (1999). “Production mechanism of superheavy nuclei in cold fusion reactions”. Physical Review C 59 (5): 2634-2639. Bibcode: 1999PhRvC..59.2634S. doi:10.1103/PhysRevC.59.2634.
- ^ Ninov, Viktor; Gregorich, K.; Loveland, W.; Ghiorso, A.; Hoffman, D.; Lee, D.; Nitsche, H.; Swiatecki, W. et al. (1999). “Observation of Superheavy Nuclei Produced in the Reaction of 86Kr with 208Pb”. Physical Review Letters 83 (6): 1104-1107. Bibcode: 1999PhRvL..83.1104N. doi:10.1103/PhysRevLett.83.1104.
- ^ Service, R. F. (1999). “Berkeley Crew Bags Element 118”. Science 284 (5421): 1751. doi:10.1126/science.284.5421.1751.
- ^ Public Affairs Department (2001年7月21日). “Results of element 118 experiment retracted”. Berkeley Lab 2008年1月18日閲覧。
- ^ Dalton, R. (2002). “Misconduct: The stars who fell to Earth”. Nature 420 (6917): 728-729. Bibcode: 2002Natur.420..728D. doi:10.1038/420728a. PMID 12490902.
- ^ Element 118 disappears two years after it was discovered. Physicsworld.com (August 2, 2001). Retrieved on 2012-04-02.
- ^ a b c d e Oganessian, Yu. Ts.; Utyonkov; Lobanov; Abdullin; Polyakov; Shirokovsky; Tsyganov; Gulbekian et al. (2000). “Observation of the decay of 292116”. Physical Review C 63: 011301. Bibcode: 2001PhRvC..63a1301O. doi:10.1103/PhysRevC.63.011301.
- ^ a b Oganessian, Yu. Ts.; Utyonkov, V.; Lobanov, Yu.; Abdullin, F.; Polyakov, A.; Shirokovsky, I.; Tsyganov, Yu.; Gulbekian, G. et al. (2004). “Measurements of cross sections and decay properties of the isotopes of elements 112, 114, and 116 produced in the fusion reactions 233,238U, 242Pu, and 248Cm+48Ca”. Physical Review C 70 (6): 064609. Bibcode: 2004PhRvC..70f4609O. doi:10.1103/PhysRevC.70.064609.
- ^ a b "Confirmed results of the 248Cm(48Ca,4n)292116 experiment", Patin et al., LLNL report (2003). Retrieved 2008-03-03
- ^ a b Oganessian, Yu. Ts.; Utyonkov, V. K.; Lobanov, Yu.; Abdullin, F.; Polyakov, A.; Shirokovsky, I.; Tsyganov, Yu.; Gulbekian, G. et al. (2004). “Measurements of cross sections and decay properties of the isotopes of elements 112, 114, and 116 produced in the fusion reactions 233,238U, 242Pu, and 248Cm + 48Ca”. Physical Review C 70 (6): 064609. Bibcode: 2004PhRvC..70f4609O. doi:10.1103/PhysRevC.70.064609. オリジナルのMay 28, 2008時点におけるアーカイブ。.
- ^ Hofmann, S.; Heinz, S.; Mann, R.; Maurer, J.; Munzenberg, G.; Antalic, S.; Barth, W.; Burkhard, H. G. et al. (2016). “Review of even element super-heavy nuclei and search for element 120”. The European Physics Journal A 2016 (52). Bibcode: 2016EPJA...52..180H. doi:10.1140/epja/i2016-16180-4.
- ^ a b c d Barber, R. C.; Karol, P. J.; Nakahara, H.; Vardaci, E.; Vogt, E. W. (2011). “Discovery of the elements with atomic numbers greater than or equal to 113 (IUPAC Technical Report)”. Pure and Applied Chemistry 83 (7): 1485. doi:10.1351/PAC-REP-10-05-01.
- ^ Barber, R. C.; Gaeggeler, H. W.; Karol, P. J.; Nakahara, H.; Verdaci, E.; Vogt, E. (2009). “Discovery of the element with atomic number 112” (IUPAC Technical Report). Pure Appl. Chem. 81 (7): 1331. doi:10.1351/PAC-REP-08-03-05.
- ^ Hofmann, S.; Heinz, S.; Mann, R.; Maurer, J.; Khuyagbaatar, J.; Ackermann, D.; Antalic, S.; Barth, W. et al. (2012). “The reaction 48Ca + 248Cm → 296116* studied at the GSI-SHIP”. The European Physical Journal A 48 (5). Bibcode: 2012EPJA...48...62H. doi:10.1140/epja/i2012-12062-1.
- ^ Morita, K. et al. (2014). “Measurement of the 248Cm + 48Ca fusion reaction products at RIKEN GARIS”. RIKEN Accel. Prog. Rep. 47: xi.
- ^ Kaji, Daiya; Morita, Kosuke; Morimoto, Kouji; Haba, Hiromitsu; Asai, Masato; Fujita, Kunihiro; Gan, Zaiguo; Geissel, Hans et al. (2017). “Study of the Reaction 48Ca + 248Cm → 296Lv* at RIKEN-GARIS”. Journal of the Physical Society of Japan 86: 034201-1-7. Bibcode: 2017JPSJ...86c4201K. doi:10.7566/JPSJ.86.034201.
- ^ Seaborg, Glenn T. (1974). “The Search for New Elements: The Projects of Today in a Larger Perspective”. Physica Scripta 10: 5-12. Bibcode: 1974PhyS...10S...5S. doi:10.1088/0031-8949/10/A/001.
- ^ Chatt, J. (1979). “Recommendations for the Naming of Elements of Atomic Numbers Greater than 100”. Pure Appl. Chem. 51 (2): 381-384. doi:10.1351/pac197951020381.
- ^ Folden, Cody (31 January 2009). “The Heaviest Elements in the Universe”. Saturday Morning Physics at Texas A&M. August 10, 2014時点のオリジナルよりアーカイブ。9 March 2012閲覧。 "
- ^ Hoffman, Darleane C.. “Darmstadtium and Beyond”. Chemical & Engineering News.
- ^ a b c d e f g Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). "Transactinides and the future elements". In Morss; Edelstein, Norman M.; Fuger, Jean. The Chemistry of the Actinide and Transactinide Elements (3rd ed.). Dordrecht, The Netherlands: Springer Science+Business Media. ISBN 1-4020-3555-1.
- ^ Koppenol, W. H. (2002). “Naming of new elements(IUPAC Recommendations 2002)”. Pure and Applied Chemistry 74 (5): 787. doi:10.1351/pac200274050787.
- ^ “Russian Physicists Will Suggest to Name Element 116 Moscovium”. rian.ru (2011年). 2011年5月8日閲覧。: Mikhail Itkis, the vice-director of JINR stated: "We would like to name element 114 after Georgy Flerov - flerovium, and another one [element 116] - moscovium, not after Moscow, but after Moscow Oblast".
- ^ “News: Start of the Name Approval Process for the Elements of Atomic Number 114 and 116”. International Union of Pure and Applied Chemistry. March 2, 2012時点のオリジナルよりアーカイブ。22 February 2012閲覧。
- ^ “Names and symbols of the elements with atomic numbers 114 and 116 (IUPAC Recommendations 2012)”. IUPAC; Pure and Applied Chemistry. IUPAC. 2 December 2015閲覧。
- ^ Popeko, Andrey G. (2016年). “Synthesis of superheavy elements”. jinr.ru. Joint Institute for Nuclear Research. 4 February 2018閲覧。
- ^ a b c d e f g h Zagrebaev, Valeriy; Karpov, Alexander; Greiner, Walter (2013). "Future of superheavy element research: Which nuclei could be synthesized within the next few years?" (PDF). Journal of Physics: Conference Series. Vol. 420. IOP Science. pp. 1–15. 2013年8月20日閲覧。
- ^ Considine, Glenn D.; Kulik, Peter H. (2002). Van Nostrand's scientific encyclopedia (9th ed.). Wiley-Interscience. ISBN 978-0-471-33230-5. OCLC 223349096
- ^ a b c d e Fricke, Burkhard (1975). "Superheavy elements: a prediction of their chemical and physical properties". Recent Impact of Physics on Inorganic Chemistry. 21: 89–144. doi:10.1007/BFb0116498, 3/11/2018.
- ^ Barber, Robert C.; Gaggeler, Heinz W.; Karol, Paul J.; Nakahara, Hiromichi; Vardaci, Emanuele; Vogt, Erich (2009). “Discovery of the element with atomic number 112 (IUPAC Technical Report)”. Pure and Applied Chemistry 81 (7): 1331. doi:10.1351/PAC-REP-08-03-05.
- ^ Armbruster, Peter & Munzenberg, Gottfried (1989). "Creating superheavy elements". Scientific American. 34: 36–42.
- ^ a b Zagrebaev, V.; Greiner, W. (2008). “Synthesis of superheavy nuclei: A search for new production reactions”. Physical Review C 78 (3): 034610. arXiv:0807.2537. Bibcode: 2008PhRvC..78c4610Z. doi:10.1103/PhysRevC.78.034610.
- ^ “JINR Annual Reports 2000-2006”. Joint Institute for Nuclear Research. 2013年8月27日閲覧。
- ^ a b c d e Thayer, John S. (2010). "Relativistic Effects and the Chemistry of the Heavier Main Group Elements": 83. doi:10.1007/978-1-4020-9975-5_2, 3/11/2018.
- ^ Faegri, K.; Saue, T. (2001). “Diatomic molecules between very heavy elements of group 13 and group 17: A study of relativistic effects on bonding”. Journal of Chemical Physics 115 (6): 2456. Bibcode: 2001JChPh.115.2456F. doi:10.1063/1.1385366.
- ^ Bonchev, Danail; Kamenska, Verginia (1981). "Predicting the Properties of the 113–120 Transactinide Elements". Journal of Physical Chemistry. American Chemical Society. 85 (9): 1177–1186. doi:10.1021/j150609a021, 3/11/2018.
- ^ Eichler, Robert (2015年). “Gas phase chemistry with SHE - Experiments”. cyclotron.tamu.edu. Texas A & M University. 27 April 2017閲覧。
- ^ a b Nash, Clinton S.; Crockett, Wesley W. (2006). “An Anomalous Bond Angle in (116)H2. Theoretical Evidence for Supervalent Hybridization.”. The Journal of Physical Chemistry A 110 (14): 4619-4621. Bibcode: 2006JPCA..110.4619N. doi:10.1021/jp060888z. PMID 16599427.
- ^ グリーンウッド, ノーマン; アーンショウ, アラン (1997). Chemistry of the Elements (英語) (2nd ed.). バターワース=ハイネマン. p. 117. ISBN 978-0-08-037941-8。
- ^ Van WuLlen, C.; Langermann, N. (2007). “Gradients for two-component quasirelativistic methods. Application to dihalogenides of element 116”. The Journal of Chemical Physics 126 (11): 114106. Bibcode: 2007JChPh.126k4106V. doi:10.1063/1.2711197. PMID 17381195.
- ^ Dullmann, Christoph E. (2012). “Superheavy elements at GSI: a broad research program with element 114 in the focus of physics and chemistry”. Radiochimica Acta 100 (2): 67-74. doi:10.1524/ract.2011.1842.
- ^ a b c d Eichler, Robert (2013). “First foot prints of chemistry on the shore of the Island of Superheavy Elements”. Journal of Physics: Conference Series (IOP Science) 420 (1): 012003. arXiv:1212.4292. Bibcode: 2013JPhCS.420a2003E. doi:10.1088/1742-6596/420/1/012003.
- ^ Moody, Ken. “Synthesis of Superheavy Elements”. In Schadel, Matthias; Shaughnessy, Dawn. The Chemistry of Superheavy Elements (2nd ed.). Springer Science & Business Media. pp. 24-8. ISBN 9783642374661
外部リンク
[編集]- Livermorium at The Periodic Table of Videos (University of Nottingham)
- CERN Courier - Second postcard from the island of stability
- Livermorium at WebElements.com
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| |||||||||||||||||||||||||||||||||

