モミラクトンB
| モミラクトンB | |
|---|---|

| |
4H-3,10b-Ethano-1H,3H-benzo(f)furo(4,3,2-de)-2-benzopyran-4-one, 8-ethenyl-3a,5a,7,8,9,10,10a,10c-octahydro-3a,8-dimethyl-, (3S-(3alpha,3abeta,5abeta,8alpha,10aalpha,10bbeta,10cbeta))- | |
| 識別情報 | |
| CAS登録番号 | 51415-08-8 |
| PubChem | 3084979 |
| 日化辞番号 | J22.140F |
| 特性 | |
| 化学式 | C20H26O4 |
| モル質量 | 330.42 g mol−1 |
| 融点 |
242 °C, 515 K, 468 °F |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
モミラクトンB(momilactone B)は、イネ(Oryza sativa L.)の根で生産されるアレロパシー物質の一種である(乾燥もみ殻200 kgから100 mg)[1]。イネ苗の根によって高濃度で生産されることが明らかにされている[2]。モミラクトンBの生産はまた、イネいもち病菌(Magnaporthe grisea syn. Pyricularia oryzae Cav.)の感染や紫外線の照射に応答して誘導される[3]。最近、ヒト大腸癌に対して細胞毒性ならびに抗腫瘍活性を示すことが明らかにされている[4]。
化合物名は、化合物が単離された「籾」と分子中のラクトン構造に由来する。類縁体としてモミラクトンAおよびCが同定されている。
生合成
[編集]イネから単離された天然物のうち、15種類がファイトアレキシンであることが示されている。これら15種類のうち、モミラクトンBを含む14種類が、一般的にゲラニルゲラニル二リン酸 (GGDP) から生合成されるジテルペンである。

モミラクトンBの生合成の第一段階は、GGDPのsyn-コパリル二リン酸(syn-CDP)への環化である(B型環化)。この反応はGGDPの末端オレフィンへのプロトンの付加によって開始される。syn-CDPシンターゼをコードする遺伝子は2004年に発見された[5]。この遺伝子はOsCyc1(Oryza sativa Cyclase 1)と命名された。イネゲノムデータベースによると、OsCyc1は2004年に発見された[6]第四染色体 (14.3 cM) 上のOsCPS4 (AL662933) と一致する。

第二段階はsyn-CDPの9β-pimara-7,15-dieneへの環化である。この段階は二リン酸基の脱離によって開始される。このA型シクラーゼ(環化酵素)をコードする遺伝子は2004年に発見された[7]。第四番染色体上に位置するOsKS4はファイトアレキシン生合成と関連する遺伝子の一つであることが示唆されている。紫外線照射後、OsKS4 mRNAレベルが劇的に上昇する。
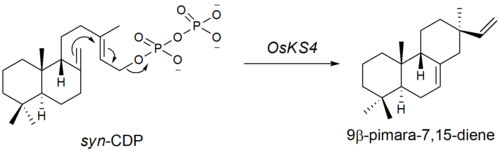
9β-Pimara-7,15-dieneの酸化と続くラクトンおよびラクトール形成によってモミラクトンが得られる。これらの酸化を担う遺伝子は不明であるが、第四染色体上のシクラーゼ遺伝子の近傍にP450モノオキシゲナーゼ遺伝子が同定されている。これは、モミラクトンBの生合成に関わる完全な遺伝子クラスターがイネの第四染色体上に位置していることを示唆している。

立体化学
[編集]単離の際に決定された立体化学[1]は生合成に関する文献に記載されたものとは異なっている。本項のモミラクトンBの立体化学は生合成文献に基づいている[5][6][7]。
脚注
[編集]- ^ a b Kato, T.; Kabuto, C.; Sasaki, N.; Tsunagawa, M.; Aizawa, H.; Fujita, K.; Kato, Y.; Kitahara, Y. (1973). “Momilactones, Growth Inhibitors from Rice, Oryza Sativa L.”. Tetrahedron Lett. 14 (39): 3861–3864. doi:10.1016/S0040-4039(01)87058-1.
- ^ Toyomasu, T.; Kagahara, T.; Okada, K.; Koga, J.; Hasegawa, M.; Mitsuhashi, W.; Sassa, T.; Yamane, H. (2008). “Diterpene Phytoalexins are Biosynthesized in and Exuded from the Roots of Rice Seedlings”. Biosci. Biotechnol. Biochem. 72 (2): 562–567. doi:10.1271/bbb.70677. PMID 18256463.
- ^ Cartwright, D. W.; Langcake, P.; Pryce, R. J.; Leworthy, D. P.; Ride, J. P. (1981). “Isolation and Characterization of Two Phytoalexins from Rice as Momilactones A and B”. Phytochemistry 20 (3): 535–537. doi:10.1016/S0031-9422(00)84189-8.
- ^ Kim, S.; Park, H.; Park, E.; Lee, S. (2007). “Cytotoxic and Antitumor Activity of Momilactone B from Rice Hulls”. J. Agric. Food Chem. 55 (5): 1702–1706. doi:10.1021/jf062020b. PMID 17326606.
- ^ a b Otomo, K.; Kenmoku, H.; Oikawa, H.; König, W. A.; Toshima, H.; Mitsuhashi, W.; Yamane, H.; Sassa, T.; Toyomasu, T. (2004). “Biological functions of ent- and syn-copalyl diphosphate synthases in rice: key enzymes for the branch point of gibberellin and phytoalexin biosynthesis”. Plant J. 39 (6): 886–893. doi:10.1111/j.1365-313X.2004.02175.x. PMID 15341631.
- ^ a b Sakamoto, T.; Miura, K.; Itoh, H.; Tatsumi, T.; Ueguchi-Tanaka, M.; Ishiyama, K.; Kobayashi, M.; Agrawal, G. K.; Takeda, S.; Abe, K.; Miyao, A.; Hirochika, H.; Kitano, H.; Ashikari, M.; Matsuoka, M. (2004). “An Overview of Gibberellin Metabolism Enzyme Genes and Their Related Mutants in Rice”. Plant Phys. 134 (4): 1642–1653. doi:10.1104/pp.103.033696. PMC 419838. PMID 15075394.
- ^ a b Otomo, K.; Kanno, Y.; Motegi, A.; Kenmoku, H.; Yamane, H.; Mitsuhashi, W.; Oikawa, H.; Toshima, H.; Itoh, H.; Matsuoka, M.; Sassa, T.; Toyomasu, T. (2004). “Diterpene Cyclases Responsible for the Biosynthesis of Phytoalexins, Momilactones A, B, and Oryzalexins A-F in Rice”. Biosci. Biotechnol. Biochem. 68 (9): 2001–2006. doi:10.1271/bbb.68.2001. PMID 15388982.
