内皮型一酸化窒素合成酵素
内皮型一酸化窒素合成酵素(ないひがたいっさんかちっそごうせいこうそ、英: endothelial nitric oxide synthase、略称: eNOS)または一酸化窒素合成酵素3(nitric oxide synthase 3、NOS3)は、ヒトでは7番染色体の7q35-7q36領域に位置するNOS3遺伝子によってコードされる酵素である[5]。この酵素は、一酸化窒素(NO)の合成を行う3つの一酸化窒素合成酵素のうちの1つである。NOは気体の親油性低分子で、いくつかの生物学的過程に関与する[6][7]。他の2つのアイソフォームは、脳の特定の神経細胞で恒常的に発現している神経型(nNOS、NOS1)[8]と、一般的には炎症性疾患で発現が誘導される誘導型(iNOS、NOS2)[9]である。eNOSは主に血管内皮でのNOの産生を担う[10]。血管内皮は血管の内側表面に並んだ単層の扁平細胞からなり、内腔を循環する血液と血管壁の残りの部分との境界面となる[11]。血管内皮でeNOSによって産生されるNOは、血管緊張、細胞増殖、白血球の接着、血小板の凝集の調節に重要な役割を果たす。そのため、健康な心臓血管系には機能的なeNOSが必要不可欠である。
構造と触媒活性
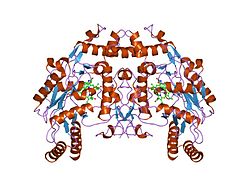
[編集]eNOSは同一な 134 kDaの単量体2つからなる二量体で、各単量体は、ニコチンアミドアデニンジヌクレオチドリン酸(NADPH)、フラビンモノヌクレオチド(FMN)、フラビンアデニンジヌクレオチド(FAD)の結合部位であるレダクターゼドメインと、ヘム、亜鉛、補因子のテトラヒドロビオプテリン(BH4)、基質のL-アルギニンの結合部位であるオキシダーゼドメインによって構成される[12]。レダクターゼドメインとオキシダーゼドメインはカルモジュリン結合配列によって連結されている[13]。血管内皮では、NOはeNOSによってL-アルギニンと、ヘム基に結合する酸素分子から合成され、最終的にはNOとL-シトルリンが形成される[14][15]。eNOSが効率的にNOを産生するためには、補因子BH4の結合が必要不可欠である[16]。この補因子がない場合、eNOSは二量体型から単量体型へと移行し、脱共役した状態(uncoupled eNOS)となる[17]。このコンフォメーションでは、eNOSはNOの代わりに、非常に反応性の高いフリーラジカルであるスーパーオキシドアニオンを産生し、心臓血管系に有害な結果をもたらす[18][19]。
機能
[編集]eNOSは心臓血管系に対する保護機能をもつが、それはNOの産生によるものである。血管緊張の調節は、NOの心臓血管系における役割のなかで最もよく知られたものの1つである。NOは内皮細胞で産生されると、血管平滑筋細胞へ細胞膜を越えて拡散し、グアノシン三リン酸から環状グアノシン一リン酸(cGMP)への変換を触媒する可溶性グアニル酸シクラーゼ(sGC)を活性化する[20]。その後cGMPはプロテインキナーゼG(PKG)を活性化し、PKGは複数の細胞内標的をリン酸化して細胞内のCa2+濃度を低下させ、血管の弛緩を促進する[21]。NOはcGMP依存的なCa2+流入阻害や、またはアルギナーゼやオルニチンデカルボキシラーゼを直接阻害しDNA合成に必要なポリアミドの産生を低下させることによって、抗増殖効果を発揮する[22][23]。また、NOは血小板の膜を越えてsGCの活性化を行い血小板凝集を阻害するため、抗血栓効果も示す[24]。さらにNOは、血管内皮でケモカインと細胞接着分子の発現を誘導するNF-κBを阻害することで、白血球の血管内皮への接着に影響を与える[25]。これらの機能に加えて、eNOSによって産生されるNOは、スパーオキシドアニオンから過酸化水素への変換を触媒する抗酸化酵素であるスーパーオキシドジスムターゼの発現を増加させることで抗酸化作用も示す[26]。NOの抗酸化作用の一部は、血管中のスパーオキシドアニオン濃度を低下させる、ヘムオキシゲナーゼ1とフェリチンのアップレギュレーションによるものでもある[27]。
調節
[編集]eNOSの発現と活性は、相互連結した複数の調節機構によって転写、転写後、翻訳後の段階で注意深く制御されている。NOS3のプロモーターに対するSp1、Sp3、Ets-1、Elf-1、YY1などの転写因子の結合とDNAメチル化は、転写調節の重要な機構である[28]。転写後の段階では、一次転写産物の修飾、mRNAの安定性、細胞内局在、核-細胞質間輸送によってeNOSは調節されている[29]。翻訳後の段階では、脂肪酸によるアシル化、タンパク質間相互作用、基質や補因子の利用可能性、リン酸化の程度によってeNOSは調節されている。eNOSがミリストイル化とパルミトイル化によって、コレステロールとスフィンゴ脂質に富む、ポケット状の膜陥入部であるカベオラに接着されていることは重要である[30]。eNOSがカベオラへ結合すると、カベオリン1との直接的で強固な相互作用によって酵素は不活性化される[31]。カルシウムによって活性化されたカルモジュリンはeNOSへ結合してカベオリン1に置き換わり、eNOSを活性化する。さらに、eNOSの活性は複数のチロシン、セリン、スレオニン残基のリン酸化によって動的な調節を受けている[12]。
臨床的意義
[編集]NO産生の異常は、高血圧、子癇前症、糖尿病、肥満、勃起不全、片頭痛などいくつかの疾患の病因に関係している。NOS3遺伝子の多型がこれらの疾患に対する感受性に影響を与えることが多数の研究によって示されている。NOS3は多型が非常に多い遺伝子であるが、広く研究されている多型は、g.-786T>C(NOS3のプロモーター領域(-786)でみられるTからCへの置換)、Glu298Asp(エクソン7に位置する298番残基でみられるGluからAspへのアミノ酸置換)、イントロン4の27ヌクレオチドのリピートによって特徴づけられる反復配列多型(VNTR)の3つである[32]。g.-786T>C多型に関して、C型アレルはeNOSの発現とNOの産生が低下し[33]、高血圧[34]、子癇前症[35]、糖尿病性腎症[36]、糖尿病網膜症[37]、片頭痛[38]、勃起不全[39]と関係している。Glu298Asp多型に関しては、Asp型アレルはeNOSの活性が低下し[40]、高血圧[41][42]、子癇前症[43]、糖尿病[44]、片頭痛[38]、勃起不全[45][46]に対する感受性の増大と関係している。イントロン4のVNTRはeNOSの発現に影響を与え[47]、高血圧[34]、子癇前症[35]、肥満[48]、糖尿病[44]に対する感受性に影響を与える。エビデンスの蓄積によって、NOS3のハプロタイプ(近接したDNAブロック内のアレルの組み合わせ)と疾患との関係が支持されるようになっている。このアプローチは、遺伝的多型を1つ1つ解析していくよりも多くの情報が得られる[49]。g.-786T>C、Glu298Asp、そしてイントロン4のVNTRを含むハプロタイプは、高血圧[50][51][52][53]、子癇前症[54]、糖尿病患者の高血圧[55]に対する感受性に影響を与える。NOS3の多様性は、スタチン、アンジオテンシン変換酵素(ACE)阻害薬、ホスホジエステラーゼ5(PDE-5)阻害薬など、NOシグナリングに影響を与える薬剤に対する応答に影響を及ぼす可能性がある。スタチンによる治療は、g.-786T>C多型がTT型の患者よりもCC型の患者でNOのバイオアベイラビリティを高める効果が高い[56][57]。TC型またはCC型の高血圧患者は、ACE阻害薬エナラプリルに対しより良い高血圧抑制応答を示す[58]。同様に、C型アレルを持つ勃起不全の患者はPDE-5阻害薬シルデナフィルに対しより良い応答を示す[59][60]。まとめると、これらの研究はスタチン、ACE阻害薬、PDE-5阻害薬がg.-786T>C多型に変異を有する患者のNO産生不全を改善し、それによって心臓血管系のリスクを低下させることを示唆している。個別の遺伝的多型の分析に加えて、g.-786T>C、Glu298Asp、イントロン4のVNTRを含むハプロタイプが勃起不全の患者のシルデナフィルへの応答に影響を与えることが示されている[59]。
出典
[編集]- ^ a b c GRCh38: Ensembl release 89: ENSG00000164867 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000028978 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ “Molecular cloning and characterization of human endothelial nitric oxide synthase”. FEBS Lett. 307 (3): 287–93. (August 1992). doi:10.1016/0014-5793(92)80697-F. PMID 1379542.
- ^ “Exploring vascular benefits of endothelium-derived nitric oxide”. American Journal of Hypertension 18 (12 Pt 2): 177S–183S. (Dec 2005). doi:10.1016/j.amjhyper.2005.09.001. PMID 16373196.
- ^ “Subcellular and cellular locations of nitric oxide synthase isoforms as determinants of health and disease”. Free Radical Biology & Medicine 49 (3): 307–16. (Aug 2010). doi:10.1016/j.freeradbiomed.2010.04.004. PMC 2900489. PMID 20388537.
- ^ “Nitric oxide synthases: regulation and function”. European Heart Journal 33 (7): 829–37, 837a–837d. (Apr 2012). doi:10.1093/eurheartj/ehr304. PMC 3345541. PMID 21890489.
- ^ “Inducible nitric oxide synthase as a possible target in hypertension”. Current Drug Targets 15 (2): 164–74. (Feb 2014). doi:10.2174/13894501113146660227. PMID 24102471.
- ^ “Endothelial nitric oxide synthase: insight into cell-specific gene regulation in the vascular endothelium”. Cellular and Molecular Life Sciences 63 (2): 144–62. (Jan 2006). doi:10.1007/s00018-005-5421-8. PMID 16416260.
- ^ “Cells in focus: endothelial cell”. The International Journal of Biochemistry & Cell Biology 34 (12): 1508–12. (Dec 2002). doi:10.1016/s1357-2725(02)00075-4. PMID 12379270.
- ^ a b “Post-translational regulation of endothelial nitric oxide synthase in vascular endothelium”. Frontiers in Physiology 4: 347. (2013). doi:10.3389/fphys.2013.00347. PMC 3861784. PMID 24379783.
- ^ “Nitric oxide synthases: structure, function and inhibition”. The Biochemical Journal 357 (Pt 3): 593–615. (Aug 2001). doi:10.1042/bj3570593. PMC 1221991. PMID 11463332.
- ^ “Signal transduction of eNOS activation”. Cardiovascular Research 43 (3): 532–41. (Aug 1999). doi:10.1016/s0008-6363(99)00094-2. PMID 10690325.
- ^ “Free radical production by dysfunctional eNOS”. Heart 90 (5): 494–5. (May 2004). doi:10.1136/hrt.2003.029405. PMC 1768213. PMID 15084540.
- ^ “The regulation and pharmacology of endothelial nitric oxide synthase”. Annual Review of Pharmacology and Toxicology 46: 235–76. (2006). doi:10.1146/annurev.pharmtox.44.101802.121844. PMID 16402905.
- ^ “Subcellular localization of oxidants and redox modulation of endothelial nitric oxide synthase”. Circulation Journal 76 (11): 2497–512. (2012). doi:10.1253/circj.cj-12-1207. PMID 23075817.
- ^ “Protective role of endothelial nitric oxide synthase”. The Journal of Pathology 199 (1): 8–17. (Jan 2003). doi:10.1002/path.1250. PMID 12474221.
- ^ “Molecular mechanisms of endothelial NO synthase uncoupling”. Current Pharmaceutical Design 20 (22): 3548–53. (2014). doi:10.2174/13816128113196660746. PMID 24180388.
- ^ “Guanylate cyclase and the .NO/cGMP signaling pathway”. Biochimica et Biophysica Acta 1411 (2–3): 334–50. (May 1999). doi:10.1016/s0005-2728(99)00024-9. PMID 10320667.
- ^ “Regulation of myosin phosphatase by a specific interaction with cGMP- dependent protein kinase Ialpha”. Science 286 (5444): 1583–7. (Nov 1999). doi:10.1126/science.286.5444.1583. PMID 10567269.
- ^ “Inhibition of smooth muscle cell growth by nitric oxide and activation of cAMP-dependent protein kinase by cGMP”. The American Journal of Physiology 267 (5 Pt 1): C1405–13. (Nov 1994). doi:10.1152/ajpcell.1994.267.5.C1405. PMID 7977701.
- ^ “Role of the arginine-nitric oxide pathway in the regulation of vascular smooth muscle cell proliferation”. Proceedings of the National Academy of Sciences of the United States of America 98 (7): 4202–8. (Mar 2001). doi:10.1073/pnas.071054698. PMC 31203. PMID 11259671.
- ^ “Nitric oxide in vascular biology”. Journal of Thrombosis and Haemostasis 1 (10): 2112–8. (Oct 2003). doi:10.1046/j.1538-7836.2003.00345.x. PMID 14521592.
- ^ “New insights into the role of nuclear factor-kappaB, a ubiquitous transcription factor in the initiation of diseases”. Clinical Chemistry 45 (1): 7–17. (Jan 1999). PMID 9895331.
- ^ “Regulation of the vascular extracellular superoxide dismutase by nitric oxide and exercise training”. The Journal of Clinical Investigation 105 (11): 1631–9. (Jun 2000). doi:10.1172/JCI9551. PMC 300857. PMID 10841522.
- ^ “Ferritin: a cytoprotective antioxidant strategem of endothelium”. The Journal of Biological Chemistry 267 (25): 18148–53. (Sep 1992). PMID 1517245.
- ^ “Characterization of the human endothelial nitric-oxide synthase promoter”. The Journal of Biological Chemistry 274 (5): 3076–93. (Jan 1999). doi:10.1074/jbc.274.5.3076. PMID 9915847.
- ^ “Transcriptional and posttranscriptional regulation of endothelial nitric oxide synthase expression”. American Journal of Physiology. Cell Physiology 291 (5): C803–16. (Nov 2006). doi:10.1152/ajpcell.00457.2005. PMID 16738003.
- ^ “Caveolae, caveolin and caveolin-rich membrane domains: a signalling hypothesis”. Trends in Cell Biology 4 (7): 231–5. (Jul 1994). doi:10.1016/0962-8924(94)90114-7. PMID 14731661.
- ^ “Direct interaction of endothelial nitric-oxide synthase and caveolin-1 inhibits synthase activity”. The Journal of Biological Chemistry 272 (30): 18522–5. (Jul 1997). doi:10.1074/jbc.272.30.18522. PMID 9228013.
- ^ “A pharmacogenetics-based approach to reduce cardiovascular mortality with the prophylactic use of statins”. Basic & Clinical Pharmacology & Toxicology 106 (5): 357–61. (May 2010). doi:10.1111/j.1742-7843.2010.00551.x. PMID 20210789.
- ^ “T-786→C mutation in the 5'-flanking region of the endothelial nitric oxide synthase gene is associated with coronary spasm”. Circulation 99 (22): 2864–70. (Jun 1999). doi:10.1161/01.cir.99.22.2864. PMID 10359729.
- ^ a b “An updated meta-analysis of endothelial nitric oxide synthase gene: three well-characterized polymorphisms with hypertension”. PLOS ONE 6 (9): e24266. (2011). doi:10.1371/journal.pone.0024266. PMC 3166328. PMID 21912683.
- ^ a b “The polymorphism for endothelial nitric oxide synthase gene, the level of nitric oxide and the risk for pre-eclampsia: a meta-analysis”. Gene 519 (1): 187–93. (Apr 2013). doi:10.1016/j.gene.2013.01.004. PMID 23375994.
- ^ “Endothelial nitric oxide synthase gene polymorphisms and the risk of diabetic nephropathy in type 2 diabetes mellitus”. Genetic Testing and Molecular Biomarkers 16 (6): 574–9. (Jun 2012). doi:10.1089/gtmb.2011.0218. PMID 22313046.
- ^ “The T-786C and C774T endothelial nitric oxide synthase gene polymorphisms independently affect the onset pattern of severe diabetic retinopathy”. Nitric Oxide 13 (1): 88–92. (Aug 2005). doi:10.1016/j.niox.2005.04.004. PMID 15890549.
- ^ a b “Association of endothelial nitric oxide synthase gene polymorphisms (894G/T, -786T/C, G10T) and clinical findings in patients with migraine”. Neuromolecular Medicine 16 (3): 587–93. (Sep 2014). doi:10.1007/s12017-014-8311-0. PMID 24845269.
- ^ “Association of the T-786C, G894T and 4a/4b polymorphisms of the endothelial nitric oxide synthase gene with vasculogenic erectile dysfunction in Iranian subjects”. BJU International 107 (12): 1994–2001. (Jun 2011). doi:10.1111/j.1464-410X.2010.09755.x. PMID 20955262.
- ^ “Biochemical consequences of the NOS3 Glu298Asp variation in human endothelium: altered caveolar localization and impaired response to shear”. FASEB Journal 21 (11): 2655–63. (Sep 2007). doi:10.1096/fj.06-7088com. PMID 17449720.
- ^ “The association between endothelial nitric oxide synthase gene G894T polymorphism and hypertension in Han Chinese: a case-control study and an updated meta-analysis”. Annals of Human Biology 42 (2): 184–94. (Mar 2015). doi:10.3109/03014460.2014.911958. PMID 24846690.
- ^ “Three endothelial nitric oxide (NOS3) gene polymorphisms in hypertensive and normotensive individuals: meta-analysis of 53 studies reveals evidence of publication bias”. Journal of Hypertension 25 (9): 1763–74. (Sep 2007). doi:10.1097/HJH.0b013e3281de740d. PMID 17762636.
- ^ “Endothelial NO synthase genotype and risk of preeclampsia: a multicenter case-control study”. Hypertension 44 (5): 702–7. (Nov 2004). doi:10.1161/01.HYP.0000143483.66701.ec. PMID 15364897.
- ^ a b “Association of endothelial nitric oxide synthase gene polymorphisms with type 2 diabetes mellitus: a meta-analysis”. Endocrine Journal 60 (7): 893–901. (2013). doi:10.1507/endocrj.ej12-0463. PMID 23563728.
- ^ “The association of eNOS G894T polymorphism with metabolic syndrome and erectile dysfunction”. The Journal of Sexual Medicine 9 (3): 837–43. (Mar 2012). doi:10.1111/j.1743-6109.2011.02588.x. PMID 22304542.
- ^ “eNOS [Glu298Asp] polymorphism, erectile function and ocular pressure in type 2 diabetes”. European Journal of Clinical Investigation 42 (7): 729–37. (Jul 2012). doi:10.1111/j.1365-2362.2011.02638.x. PMID 22224829.
- ^ “Effect of 27nt small RNA on endothelial nitric-oxide synthase expression”. Molecular Biology of the Cell 19 (9): 3997–4005. (Sep 2008). doi:10.1091/mbc.E07-11-1186. PMC 2526692. PMID 18614799.
- ^ “eNOS haplotype associated with hypertension in obese children and adolescents”. International Journal of Obesity 35 (3): 387–92. (Mar 2011). doi:10.1038/ijo.2010.146. PMID 20661250.
- ^ “Definition and clinical importance of haplotypes”. Annual Review of Medicine 56: 303–20. (2005). doi:10.1146/annurev.med.56.082103.104540. PMID 15660514.
- ^ “Susceptible and protective eNOS haplotypes in hypertensive black and white subjects”. Atherosclerosis 186 (2): 428–32. (Jun 2006). doi:10.1016/j.atherosclerosis.2005.08.003. PMID 16168996.
- ^ “Endothelial nitric oxide synthase haplotypes affect the susceptibility to hypertension in patients with type 2 diabetes mellitus”. Atherosclerosis 189 (1): 241–6. (Nov 2006). doi:10.1016/j.atherosclerosis.2005.12.011. PMID 16427644.
- ^ “Endothelial nitric oxide synthase haplotypes are related to blood pressure elevation, but not to resistance to antihypertensive drug therapy”. Journal of Hypertension 24 (12): 2393–7. (Dec 2006). doi:10.1097/01.hjh.0000251899.47626.4f. PMID 17082721.
- ^ “Endothelial nitric oxide synthase haplotypes associated with hypertension do not predispose to cardiac hypertrophy”. DNA and Cell Biology 29 (4): 171–6. (Apr 2010). doi:10.1089/dna.2009.0955. PMID 20070154.
- ^ “Effects of eNOS polymorphisms on nitric oxide formation in healthy pregnancy and in pre-eclampsia”. Molecular Human Reproduction 16 (7): 506–10. (Jul 2010). doi:10.1093/molehr/gaq030. PMID 20457799.
- ^ “Endothelial nitric oxide synthase genotype and haplotype are not associated with diabetic retinopathy in diabetes type 2 patients”. Nitric Oxide 15 (4): 417–22. (Dec 2006). doi:10.1016/j.niox.2006.02.002. PMID 16581274.
- ^ “eNOS gene T-786C polymorphism modulates atorvastatin-induced increase in blood nitrite”. Free Radical Biology & Medicine 41 (7): 1044–9. (Oct 2006). doi:10.1016/j.freeradbiomed.2006.04.026. PMID 16962929.
- ^ “Simvastatin treatment increases nitrite levels in obese women: modulation by T(-786)C polymorphism of eNOS”. Nitric Oxide 33: 83–7. (Sep 2013). doi:10.1016/j.niox.2013.07.005. hdl:11449/76257. PMID 23876348.
- ^ “eNOS and BDKRB2 genotypes affect the antihypertensive responses to enalapril”. European Journal of Clinical Pharmacology 69 (2): 167–77. (Feb 2013). doi:10.1007/s00228-012-1326-2. PMID 22706620.
- ^ a b “Endothelial nitric oxide synthase genotypes and haplotypes modify the responses to sildenafil in patients with erectile dysfunction”. The Pharmacogenomics Journal 13 (2): 189–96. (Apr 2013). doi:10.1038/tpj.2011.49. PMID 22064666.
- ^ “Pharmacogenetics of erectile dysfunction: navigating into uncharted waters”. Pharmacogenomics 15 (11): 1519–38. (Aug 2014). doi:10.2217/pgs.14.110. PMID 25303302.
関連文献
[編集]- “Aberrant expression of nitric oxide synthase III in Alzheimer's disease: relevance to cerebral vasculopathy and neurodegeneration”. Neurobiology of Aging 21 (2): 309–19. (2000). doi:10.1016/S0197-4580(99)00108-6. PMID 10867216.
- “Regulation of endothelial nitric oxide synthase: location, location, location”. Annual Review of Physiology 64: 749–74. (2002). doi:10.1146/annurev.physiol.64.081501.155952. PMID 11826287.
- “Regulation of endothelial nitric oxide synthase activity and gene expression”. Annals of the New York Academy of Sciences 962: 122–30. (May 2002). doi:10.1111/j.1749-6632.2002.tb04062.x. PMID 12076969.
- “Regulation of endothelial nitric oxide synthase by tetrahydrobiopterin in vascular disease”. Arteriosclerosis, Thrombosis, and Vascular Biology 24 (3): 413–20. (Mar 2004). doi:10.1161/01.ATV.0000110785.96039.f6. PMID 14656731.
- “Endothelial nitric oxide synthase: a new paradigm for gene regulation in the injured blood vessel”. Arteriosclerosis, Thrombosis, and Vascular Biology 24 (3): 405–12. (Mar 2004). doi:10.1161/01.ATV.0000109171.50229.33. PMID 14656742.
- “Dysfunction of endothelial nitric oxide synthase and atherosclerosis”. Arteriosclerosis, Thrombosis, and Vascular Biology 24 (6): 998–1005. (Jun 2004). doi:10.1161/01.ATV.0000125114.88079.96. PMID 15001455.
- “Role of eNOS in neovascularization: NO for endothelial progenitor cells”. Trends in Molecular Medicine 10 (4): 143–5. (Apr 2004). doi:10.1016/j.molmed.2004.02.001. PMID 15162796.