生体膜

生体膜(せいたいまく、英: biological membrane, biomembrane)は、細胞を外部環境から分離したり、細胞内区画を形成したりする選択的透過性の膜である。
真核細胞膜の形の生体膜は、化学物質やイオンの伝達や輸送に使われる膜内在性あるいは膜表在性のタンパク質が埋め込まれたリン脂質二重層によって構成されている。
細胞膜に含まれる大量の脂質は、生理学的機能を果たすためにタンパク質が回転したり横方向に拡散したりするための流体マトリックスを提供する。タンパク質は、脂質二重層の高い膜流動性環境に適応しており、内在性膜タンパク質の表面に脂質分子が強固に結合した環状脂質シェルが存在する。
細胞膜は、粘膜、基底膜、漿膜のような細胞の層で形成される隔離組織とは異なる。
構成
[編集]非対称性
[編集]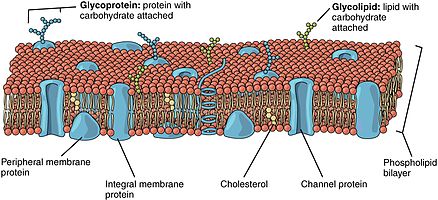
脂質二重層は、外側の小葉と内側の小葉の2つの層で構成されている[1]。二重膜を構成する成分は、2つの表面間で不均等に分散され、外面と内面の非対称性を生み出している[2]。このような非対称な組織は、細胞シグナル伝達などの細胞機能にとって重要である[3]。生体膜の非対称性は、膜の2つの小葉の異なる機能を反映している[4]。リン脂質二重膜の流体膜モデルに見られるように、膜の外側の小葉と内側の小葉は、その組成が非対称である。特定の種のタンパク質や脂質は、膜の一方の表面だけに存在し、もう一方の表面には存在しない。
原形質膜と内膜の両方に、細胞質ゾル面と細胞質外面がある。この配向(方向性)は、細胞膜輸送の間も維持され、小胞体(ER)やゴルジ体の内腔に面したタンパク質、脂質、糖鎖は、原形質膜の外面に発現する。真核細胞では、小胞体膜の細胞質に面した部分に結合した酵素によって、新しいリン脂質が作成される[5]。遊離脂肪酸を基質とするこれらの酵素は、新しく作られたすべてのリン脂質を二重層の細胞質ゾル側の半分に沈着させる。膜全体を均一に成長するためには、新しいリン脂質分子の半分を反対側の単分子層に移す必要がある。この移動は、フリッパーゼと呼ばれる酵素によって触媒される。原形質膜では、フリッパーゼが特定のリン脂質を選択的に移動させることで、それぞれの単層膜に異なる種類のリン脂質が集中する[5]。
ただし、選択的フリッパーゼを使うことは、脂質二重膜の非対称性を作り出す唯一の方法ではない。特に、動物細胞の中で最も顕著で一貫した非対称分布を示す脂質である糖脂質については、異なるメカニズムが働いている[5]。
脂質
[編集]生体膜は、疎水性尾部と親水性頭部を持つ脂質で構成されている[6]。疎水性尾部は炭化水素尾部であり、その長さや飽和度は細胞の特徴を把握する上で重要である[7]。
動物細胞においてはコレステロールが、植物細胞においてはシトステロールがかなりの割合で存在する[要出典]。リン脂質の種類としては、グリセロール骨格を有するグリセロリン脂質とスフィンゴシン骨格を有するスフィンゴリン脂質に大分される。グリセロール脂質の中では、ホスファチジルコリン、ホスファチジルエタノールアミン、ホスファチジルセリンなどが主である。スフィンゴリン脂質の中では、スフィンゴミエリンが主である。
脂質ラフトは、脂質種とタンパク質が膜内のドメインに凝集することで生じる。これらは、シグナル伝達などの特定のプロセスに関与する膜成分を、局所的な領域に組織化するのに役立つ。
赤血球は、独特の脂質組成を持っている。赤血球の二重層は、コレステロールとリン脂質が重量比で同じ割合で構成されている[7]。赤血球膜は、血液の凝固に重要な役割を果たしている。赤血球の二重層にはホスファチジルセリンがある[8]。これは通常、膜の細胞質側にある。しかし、血液凝固の際は使用するために外膜に反転される[8]。
タンパク質
[編集]リン脂質二重層には、さまざまなタンパク質が含まれている。これらの膜タンパク質は、さまざまな機能や特徴を持ち、さまざまな化学反応を触媒する。内在性膜タンパク質は、膜の両側に異なるドメインを持ち、膜にまたがっている[6]。内在性膜タンパク質は、脂質二重層と強固に結合しており、簡単に外れることはない。それらは、膜を破壊する化学処理によって解離する[9]。表在性膜タンパク質は、内在性膜タンパク質とは異なり、二重層の表面との相互作用が弱く、膜から容易に解離する可能性がある[6]。表在性膜タンパク質は、膜の一方の面だけに存在し、膜の非対称性を生み出す。
| 機能クラス | タンパク質の例 | 特定の機能 |
|---|---|---|
| 膜輸送体 | Na+ポンプ | Na+を細胞外に積極的に排出し、K+を細胞内に取り込む |
| アンカー | インテグリン | 細胞内アクチンフィラメントと細胞外マトリックスタンパク質をつなぐ |
| 受容体 | 血小板由来成長因子受容体 | 細胞外PDGFと結合し、その結果、細胞内でシグナルを発生させ、細胞を成長させたり分裂させる。 |
| 酵素 | アデニル酸シクラーゼ | 細胞外のシグナルに反応して、細胞内のシグナル伝達分子であるサイクリックAMPの産生を触媒する。 |
オリゴ糖
[編集]オリゴ糖は、糖を含むポリマーである。膜では、それらは脂質と共有結合して糖脂質を形成したり、タンパク質と共有結合して糖タンパク質を形成することができる。膜には、糖脂質と呼ばれる糖を含む脂質分子が存在する。二層層の中では、糖脂質の糖基は細胞表面に露出しており、そこで水素結合を形成することができる[9]。脂質二重層における非対称性の最も極端な例は、糖脂質である[10]。糖脂質は生体膜において、細胞認識や細胞間接着など、主に伝達性に関わる膨大な数の機能を果たしている。糖タンパク質は内在性膜タンパク質である[2]。それらは免疫応答や保護において重要な役割を果たしている[11]。
形成
[編集]リン脂質二重層は、水溶液中で膜脂質が凝集して形成される[4]。凝集は、疎水性の末端が互いに接触し、水から隔離される疎水効果によって起こる[6]。この配置により、親水性頭部と水の間の水素結合が最大化する一方で、疎水性尾部と水の間の不利な接触が最小に抑えられる[10]。利用可能な水素結合が増えることで、システムのエントロピーが増大し、自然発生的なプロセスが生成する。
機能
[編集]生体分子は両親媒性であり、すなわち疎水性と親水性を同時に持っている[6]。リン脂質二重層には、極性のある水と相互作用する荷電親水性頭部基がある。また、各層には疎水性尾部があり、相補層の疎水性尾部と接触する。疎水性尾部は通常、長さが異なる脂肪酸である[10]。脂質、特に疎水性尾部の相互作用が、流動性などの脂質二重層の物理的特性を決定する。
細胞内の膜は通常、密閉された空間や区画を形成し、その中で細胞は外部とは異なる化学的または生化学的環境を維持することができる。たとえば、ペルオキシソームの周りの膜は、細胞の残りの部分を過酸化物、つまり細胞に有害な化学物質から保護し、細胞膜は細胞を周囲の媒体から分離する。ペルオキシソームは、細胞内に存在する液胞の一つで、細胞内の化学反応による副産物を含んでいる。ほとんどの細胞小器官(オルガネラ)はこのような膜によって規定されており、膜結合型細胞小器官と呼ばれている。
選択的透過性
[編集]おそらく生体膜の最も重要な特徴は、選択的に透過性の構造であることと言える。つまり、それを通過しようとする原子や分子の大きさ、電荷、およびその他の化学的性質によって、それが成功するかどうかが決まることを意味する。細胞や細胞小器官を周囲から効果的に分離するためには、選択的な透過性が不可欠である。また、生体膜には、必要に応じて形状を変えたり移動したりすることができる、ある種の機械的または弾性的な特性もある。
一般に、小さな疎水性分子は、単純な拡散によって容易にリン脂質二重層を通過することができる[12]。
細胞機能に必要だが、膜を横切って自由に拡散できない粒子は、膜輸送タンパク質を通って入るか、またはエンドサイトーシスによって取り込まれる。エンドサイトーシスでは、膜の上に液胞が結合し、その内容物を細胞内に押し込むことができる。細胞を外部環境から隔てる特殊な原形質膜には多くの種類がある。たとえば頂端膜、側底膜、シナプス小胞膜(シナプス前膜およびシナプス後膜)、鞭毛膜、繊毛膜、微絨毛膜、糸状仮足および葉状仮足の膜、筋細胞のサルコメア、神経細胞の特殊なミエリン膜や樹状突起膜など、原形質膜はまた、カベオラ、シナプス後膜肥厚、ポドゾーム、浸潤突起、デスモゾーム、ヘミデスモゾーム、接着斑、細胞接合部など、さまざまなタイプの超膜構造を形成することができる。これらのタイプの膜は、脂質とタンパク質の組成が異なる。
異なる種類の膜も細胞内小器官を作り出している。エンドソーム、滑面小胞体および粗面小胞体、小胞体、ゴルジ体、リソソーム、ミトコンドリア(内膜と外膜)、核(内膜と外膜)、ペルオキシソーム、液胞、細胞質顆粒、細胞小胞(ファゴソーム、オートファゴソーム、クラスリン被覆小胞、COPI被覆小胞およびCOPII被覆小胞)、および分泌小胞(シナプトソーム、アクロソーム、メラノソーム、およびクロマフィン顆粒を含む)。生体膜は、その種類によって脂質やタンパク質の組成が異なっている。膜の内容は、それらの物理的および生物学的特性を決定する。膜の構成要素の中には、薬物を細胞外に送り出す排出ポンプなど、医学において重要な役割を果たしているものがある。
流動性
[編集]リン脂質二重層の疎水性コアは、脂質尾部の結合を中心に回転するため、常に動いている[13]。二重膜の疎水性尾部は折れ曲がって互いにロックしている。しかし、水との水素結合により、親水性頭部基は回転や移動が制限されるため、動きが少なくなる[13]。その結果、親水性頭部に近い部分の脂質二重層の粘度が増加する[6]。
転移温度以下では、移動性の高い脂質の動きが少なくなり、脂質二重層は流動性を失い、ゲル状の固体になる[14]。この転移温度は、炭化水素鎖の長さやその脂肪酸の飽和度など、脂質二重層の構成成分に依存する。細菌や冷血生物にとって、温度依存性のある流動性は重要な生理学的特性を構成する。これらの生物は、温度の違いに応じて膜脂質の脂肪酸組成を変化させることで、一定の流動性を維持している[6]。
動物細胞では、膜の流動性はステロールコレステロールの含有によって調整される。この分子は、特に原形質膜に多く存在し、膜中の脂質の約20重量%を占めている。コレステロール分子は短くて硬いので、不飽和炭化水素の尾部のねじれによってできた隣接するリン脂質分子間のスペースを埋める。このように、コレステロールは二重層を硬くし、透過性を低下させる傾向がある[5]。
すべての細胞にとって、膜の流動性は多くの理由で重要である。これにより、膜タンパク質が二重層の平面内を素早く拡散し、たとえば細胞シグナル伝達において重要な相互作用を行うことができる。膜脂質やタンパク質は、合成されて二重層に挿入された場所から、細胞内の他の領域に拡散することができる。膜同士を融合させて、分子を混ぜ合わせたり、細胞分裂のときに娘細胞間で膜分子が均等に分配されることを確実にする。もし生体膜が流動的でなければ、細胞がどのようにして生き、成長し、増殖できるのか想像もつかない[5]。
参照項目
[編集]脚注
[編集]- ^ Murate, Motohide; Kobayashi, Toshihide (2016). “Revisiting transbilayer distribution of lipids in the plasma membrane”. Chemistry and Physics of Lipids 194: 58–71. doi:10.1016/j.chemphyslip.2015.08.009. PMID 26319805.
- ^ a b Nickels, Jonathan D.; Smith, Jeremy C.; Cheng, Xiaolin (2015). “Lateral organization, bilayer asymmetry, and inter-leaflet coupling of biological membranes”. Chemistry and Physics of Lipids 192: 87–99. doi:10.1016/j.chemphyslip.2015.07.012. PMID 26232661.
- ^ Chong, Zhi-Soon; Woo, Wei-Fen; Chng, Shu-Sin (2015-12-01). “Osmoporin OmpC forms a complex with MlaA to maintain outer membrane lipid asymmetry in Escherichia coli”. Molecular Microbiology 98 (6): 1133–1146. doi:10.1111/mmi.13202. PMID 26314242.
- ^ a b Forrest, Lucy R. (2015-01-01). “Structural Symmetry in Membrane Proteins”. Annual Review of Biophysics 44 (1): 311–337. doi:10.1146/annurev-biophys-051013-023008. PMC 5500171. PMID 26098517.
- ^ a b c d e Alberts, Bray, Hopkin, Johnson, Lewis, Raff, Roberts, Walter, Bruce, Dennis, Karen, Alexander, Julian, Martin, Keith, Peter (2010). Essential Cell Biology third edition. 270 Madison Avenue, New York, NY 10016, USA, and 2 Park Square, Milton Park, Abingdon, OX14 4RN, UK: Garland Science, Taylor & Francis Group, LLC, an informa business. pp. 370. ISBN 978-0815341291
- ^ a b c d e f g Voet, Donald (2012). Fundamentals of Biochemistry: Life at the Molecular Level (4 ed.). Wiley. ISBN 978-1118129180
- ^ a b Dougherty, R. M.; Galli, C.; Ferro-Luzzi, A.; Iacono, J. M. (1987). “Lipid and phospholipid fatty acid composition of plasma, red blood cells, and platelets and how they are affected by dietary lipids: a study of normal subjects from Italy, Finland, and the USA”. The American Journal of Clinical Nutrition 45 (2): 443–455. doi:10.1093/ajcn/45.2.443. PMID 3812343.
- ^ a b Lentz, Barry R. (2003). “Exposure of platelet membrane phosphatidylserine regulates blood coagulation”. Progress in Lipid Research 42 (5): 423–438. doi:10.1016/s0163-7827(03)00025-0. PMID 12814644.
- ^ a b Lein, Max; deRonde, Brittany M.; Sgolastra, Federica; Tew, Gregory N.; Holden, Matthew A. (2015-11-01). “Protein transport across membranes: Comparison between lysine and guanidinium-rich carriers”. Biochimica et Biophysica Acta (BBA) - Biomembranes 1848 (11, Part A): 2980–2984. doi:10.1016/j.bbamem.2015.09.004. PMC 4704449. PMID 26342679.
- ^ a b c Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002-01-01). The Lipid Bilayer.
- ^ Daubenspeck, James M.; Jordan, David S.; Simmons, Warren; Renfrow, Matthew B.; Dybvig, Kevin (2015-11-23). “General N-and O-Linked Glycosylation of Lipoproteins in Mycoplasmas and Role of Exogenous Oligosaccharide”. PLOS ONE 10 (11): e0143362. Bibcode: 2015PLoSO..1043362D. doi:10.1371/journal.pone.0143362. PMC 4657876. PMID 26599081.
- ^ Brown, Bernard (1996). Biological Membranes. London, U.K.: The Biochemical Society. p. 21. ISBN 978-0904498325. オリジナルの2015-11-06時点におけるアーカイブ。 2014年5月1日閲覧。
- ^ a b Vitrac, Heidi; MacLean, David M.; Jayaraman, Vasanthi; Bogdanov, Mikhail; Dowhan, William (2015-11-10). “Dynamic membrane protein topological switching upon changes in phospholipid environment”. Proceedings of the National Academy of Sciences 112 (45): 13874–13879. Bibcode: 2015PNAS..11213874V. doi:10.1073/pnas.1512994112. PMC 4653158. PMID 26512118.
- ^ Rojko, Nejc; Anderluh, Gregor (2015-12-07). “How Lipid Membranes Affect Pore Forming Toxin Activity”. Accounts of Chemical Research 48 (12): 3073–3079. doi:10.1021/acs.accounts.5b00403. PMID 26641659.
外部リンク
[編集] ウィキメディア・コモンズには、生体膜に関するカテゴリがあります。
ウィキメディア・コモンズには、生体膜に関するカテゴリがあります。- Membranes - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス
