膜脂質
膜脂質(まくししつ、英: membrane lipids)は、細胞の二層構造表面(脂質二重層)または一重層を形成する化合物の一群(構造的には油脂に類似)である。動物における膜脂質の3つの主要なクラスは、リン脂質、糖脂質、コレステロールである。脂質は両親媒性で、水に溶ける末端(極性)と、脂肪に溶ける末端(非極性)を持っている。膜脂質は、極性のある端が外側を向き、極性のない端を内側を向いた二重層を形成することで、非極性部分が水と接触しない脂質二重層を形成し、水を含んだ細胞内部と水を含んだ細胞外部を分離することができる。膜の脂質とさまざまなタンパク質の配置は、受容体やチャネル孔として働き、細胞の代謝の一部として他の分子とイオンの出入りを制御する。膜タンパク質が生理機能を果たすために、タンパク質の表面に密着した脂質の殻(環状脂質シェルと呼ばれる)の存在によって、脂質二重層の二次元的な広がりの中で回転や横方向への拡散を容易にする。
生物学的役割
[編集]膜脂質によって形成された二重層は、生細胞の閉じ込め単位を形づくる。膜脂質はまた、膜タンパク質が存在するマトリックスも形成する。歴史的に、脂質は単に構造的な役割を果すと考えられていた。実際には脂質の機能的な役割は多岐にわたっており、細胞増殖や接着を調節するのに役立ち、他の生体分子の生合成に関与し、酵素の酵素活性を高める役割を果たしている[1]。
チラコイド膜の脂質の大半はモノガラクトシルジグリセリド(MGDG)のような非二重層形成脂質が占めており、単独で水和すると逆六角形の円筒相を形成する。しかし、チラコイド膜の他の脂質やカロテノイド/クロロフィルと組み合わさると、それらも脂質二重層として共形する[2]。
主な種類
[編集]リン脂質
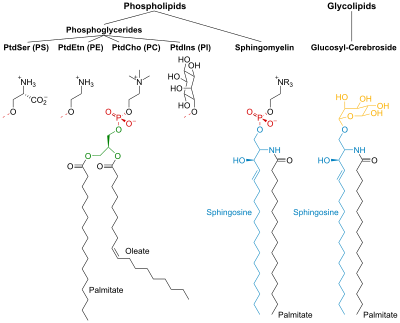
[編集]リン脂質および糖脂質は、2本の長い非極性(疎水性)の炭化水素鎖が親水性の頭部基に結合して構成されている。
リン脂質(phospholipids)の頭部基はリン酸化されており、次のどちらかで構成されている。
グリセロールジアルキルグリセロールテトラエーテル(GDGT)は、古代の環境要因の研究に役立っている[3]。
糖脂質
[編集]糖脂質の頭部基には、1つまたは複数の糖単位が結合したスフィンゴシンを含む。疎水性の鎖は、次のどちらかに属す。
- 2つの脂肪酸 - ホスホグリセリドの場合、または
- 1つの脂肪酸とスフィンゴシンの炭化水素尾部 - スフィンゴミエリンや糖脂質の場合。
ガラクト脂質 - モノガラクトシルジグリセリド(MGDG)とジガラクトシルジグリセリド(DGDG)は、高等植物の葉緑体のチラコイド膜の主要な脂質を形成する。チラコイド膜の全脂質を抽出して形成されたリポソーム構造は、ショ糖の影響を受けやすく、二重膜がミセル構造に変化することがわかった[4]。
脂肪酸
[編集]リン脂質および糖脂質に含まれる脂肪酸は、通常、14~24個の偶数個の炭素原子を含んでおり、16と18炭素が最も多い。脂肪酸は飽和または不飽和であり、二重結合の配置はほぼ常にシス(cis)である。脂肪酸鎖の長さと不飽和度は、膜の流動性に大きな影響をおよぼす。植物のチラコイド膜は、比較的低温の環境下でも高い流動性を維持しているが、13C NMR研究によって明らかにされたように、二重結合を3つ持つ炭素数18の脂肪アシル鎖のリノレン酸が豊富に含まれているためである[5]。
ホスホグリセリド
[編集]ホスホグリセリドでは、グリセロールのC-1位とC-2位のヒドロキシ基が脂肪酸のカルボキシ基とエステル化されている。C-3位ヒドロキシ基はリン酸エステル化される。得られた化合物は、ホスファチジン酸と呼ばれ、最も単純なホスホグリセリン酸である。膜には少量のホスファチジン酸塩しか存在しない。しかし、これは他のホスホグリセリドの生合成における重要な中間体でもある。
スフィンゴ脂質
[編集]スフィンゴシンは、長い不飽和炭化水素鎖を含むアミノアルコールである。スフィンゴミエリンと糖脂質では、スフィンゴシンのアミノ基と脂肪酸がアミド結合で結合している。スフィンゴミエリンでは、スフィンゴシンの一級ヒドロキシ基がエステル化されてホスホリルコリンになる。

糖脂質では、この基に糖成分が結合している。最も単純な糖脂質はセレブロシドであり、グルコースまたはガラクトースのいずれか1つの糖残基しか存在しない。ガングリオシドなどの、より複雑な糖脂質は7つもの糖残基からなる分岐鎖を持つ。
ステロール
[編集]ステロールで最もよく知られているコレステロールは人の体内で見られる。コレステロールは、他の真核生物の細胞膜にも自然に存在する。ステロールは、疎水性の四員縮合環の剛構造と、小さな極性頭部基を持つ。
コレステロールは、メバロン酸からテルペノイドのスクアレン環化を介して生体内で合成される。細胞膜は高レベルのコレステロールを必要とし、通常、膜全体で平均20%のコレステロールを含み、ラフト領域では局所的に50%まで増加する(%は分子比)[6]。真核細胞の膜に存在するコレステロールに豊む脂質ラフト領域で、コレステロールはスフィンゴ脂質と優先的に結合する(図を参照)[7]。脂質ラフトの形成は、SNAREおよびVAMPタンパク質のドッキングを含む、末梢および膜貫通型タンパク質の凝集を促進する[8]。植物や原核生物では、シトステロールやスチグマステロールなどの植物ステロールおよびホパノイドが同様の働きをしている。
脚注
[編集]- ^ R. B. Gennis (1989). Biomembranes - Molecular Structure and Function. New York: Springer-Verlag. ISBN 978-0387967608
- ^ Yashroy, R. C. (1990). “Lamellar dispersion and phase separation of chloroplast membrane lipids by negative staining electron microscopy”. Journal of Biosciences 15 (2): 93–98. doi:10.1007/BF02703373.
- ^ Weijers (2007). “Environmental controls on bacterial tetraether membrane lipid distribution in soils”. Geochimica et Cosmochimica Acta 71 (3): 703–713. doi:10.1016/j.gca.2006.10.003.
- ^ YashRoy, Rakesh C. (1994). “Destabilisation of lamellar dispersion of thylakoid membrane lipids by sucrose”. Biochimica et Biophysica Acta (BBA) - Lipids and Lipid Metabolism 1212 (1): 129–133. doi:10.1016/0005-2760(94)90198-8.
- ^ YashRoy, Rakesh C. (1991). “13C-NMR studies of membrane lipid-protein interactions upon protein heat denaturation”. Journal of Biochemical and Biophysical Methods 23 (3): 259–261. doi:10.1016/0165-022X(91)90019-S. PMID 3428918.
- ^ de Meyer, F.; Smit, B. (2009). “Effect of cholesterol on the structure of a phospholipid bilayer”. Proc. Natl. Acad. Sci. U.S.A. 106 (10): 3654–3658. doi:10.1073/pnas.0809959106. PMC 2656135. PMID 19225105.
- ^ Chen, Heshun; Born, Ella; Mathur, Satya N.; Field, F. Jeffrey (December 1, 1993). “Cholesterol and sphingomyelin syntheses are regulated independently in cultured human intestinal cells, CaCo-2: role of membrane cholesterol and sphingomyelin content”. Journal of Lipid Research 34 (12): 2159–2167. PMID 8301234.
- ^ Lang, T. (2001). “SNAREs are concentrated in cholesterol-dependent clusters that define docking and fusion sites for exocytosis”. The EMBO Journal 20 (9): 2202–2213. doi:10.1093/emboj/20.9.2202. PMC 125434. PMID 11331586.
関連項目
[編集]外部リンク
[編集]- Membrane lipids - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス
