単純芳香族化合物
単純芳香族化合物(たんじゅんほうこうぞくかごうぶつ)は、共役した平面環だけからなる芳香族化合物である。単純芳香族化合物の多くは慣用名を持ち、より複雑な分子の構造の一部になる。典型的な単純芳香族化合物には、ベンゼン、インドール、シクロテトラデカヘプタエン等がある[1][2]。
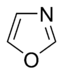
単純芳香族化合物が酸素、窒素、硫黄等の炭素以外の原子を含むと複素環式化合物となる。また、ベンゼンのような単環式、ナフタレンのような二環式、アントラセンのような多環式化合物がある。単純単環式芳香族化合物は、ピロールのような五員環かピリジンのような六員環のどちらかである。融合芳香族環は、結合を共有する単環からなる。
複素環式芳香族化合物
[編集]
| |||||||||||||||||||||||||||||||||||||||||||||||||
窒素を含む芳香族環は、容易にプロトン化されて芳香族カチオンと塩を形成する塩基性芳香族環と非塩基性芳香族環に分離できる。
塩基性芳香族環では、電子の孤立電子対は芳香系には局在せず、環の平面を伸長させる。この孤立電子対は、アミン中の窒素原子と同様に窒素塩基の塩基性の原因となっている。これらの化合物では、窒素原子は水素原子と結び付いていない。塩基性芳香族環の例には、ピリジンやキノリンがある。塩基性と非塩基性の窒素原子を含む環には、イミダゾールやプリンがある。
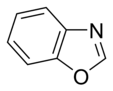
非塩基性芳香族環では、窒素原子の電子の孤立電子対は非局在化し、芳香族π電子系に寄与している。これらの化合物では、窒素原子は水素原子と結び付いている。非塩基性芳香族環の例には、ピロールやインドールがある。
酸素や硫黄を含む芳香族環では、ヘテロ原子の電子対の1つが、非塩基性芳香族環と同様に芳香族系に寄与しており、2つ目の孤立電子対は塩基性芳香族環と同様に環の平面を伸長させている。
芳香族性の基準
[編集]- 分子は環状でなければならない。
- 環の全ての原子のp軌道は満たされており、重なっていなければならない(完全共役)。
- 分子は平面でなければならない。
- 4n+2個のπ電子を持ち、ヒュッケル則を満たしていなければならない。
一方、4n個のπ電子を持つ分子は反芳香族性を持つ。
関連項目
[編集]出典
[編集]- ^ Clayden Jonathan, Nick Greeves, Stuart Warren, Peter Wothers (2001). Organic chemistry. Oxford, Oxfordshire: Oxford University Press. ISBN 0-19-850346-6
- ^ Eicher, T.; Hauptmann, S. (2003). The Chemistry of Heterocycles: Structure, Reactions, Syntheses, and Applications (2nd ed.). Wiley-VCH. ISBN 3-527-30720-6