塩化オスミウム(IV)
表示
| 塩化オスミウム(IV) | |
|---|---|
| |
Osmium(IV) chloride | |
別称 Osmium chloride, osmium tetrachloride | |
| 識別情報 | |
| CAS登録番号 | 10026-01-4 |
| PubChem | 4070891 |
| UNII | 950AA6B72O |
| |
| |
| 特性 | |
| 化学式 | OsCl4 |
| モル質量 | 332.041 g/mol |
| 外観 | 赤黒色斜方晶結晶 |
| 密度 | 4.38 g/cm3 |
| 融点 |
323℃で分解 |
| 水への溶解度 | 水と反応 |
| 溶解度 | 塩酸に可溶 |
| 構造 | |
| 結晶構造 | 斜方晶, oS10 |
| 空間群 | Cmmm, No. 65 |
| 関連する物質 | |
| その他の陰イオン | 酸化オスミウム(IV) |
| その他の陽イオン | 塩化鉄(III) 塩化ルテニウム(III) 塩化オスミウム(III) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
塩化オスミウム(IV)(Osmium(IV) chloride)または四塩化オスミウム(Osmium tetrachloride)は、オスミウムと塩素からなる無機化合物で、実験式はOsCl4である。2つの結晶形を持つ多形である。他のオスミウム複合体を合成するのに用いられる。
合成・構造・反応
[編集]金属オスミウムの塩素化の生成物として1909年に初めて報告された[1]。この方法では、2つの形のうち、高温の形が形成される[2]。
- Os + 2 Cl2 → OsCl4
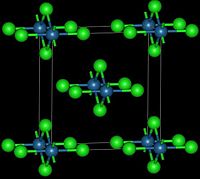
この赤黒い結晶は斜方晶であり、オスミウム中心は八面体配位し、OsCl6の端同士を共有して鎖状になっている[3]。一方、酸化オスミウム(VIII)を塩化チオニルで還元すると、茶色の立方晶が得られる[4]。
- OsO4 + 4 SOCl2 → OsCl4 + 2 Cl2 + 4 SO2
酸化オスミウム(VIII)は塩酸に溶解し、ヘキサクロロオスミウムアニオンが生成する。
- OsO4 + 10 HCl → H2OsCl6 + 2 Cl2 + 4 H2O
出典
[編集]- ^ Otto Ruff and Ferd. Bornemann (1910). “Uber das Osmium, seine analytische Bestimmung, seine Oxyde und seine Chloride”. Zeitschrift fur anorganische Chemie 65: 429-456. doi:10.1002/zaac.19100650126.
- ^ Cotton, S. A. (1997). Chemistry of Precious Metals. London: Chapman and Hall. ISBN 0-7514-0413-6
- ^ Wells A.F. (1984). Structural Inorganic Chemistry (5th ed.). Oxford Science Publications. ISBN 0-19-855370-6
- ^ Paul Machmer (1967). “On the polymorphism of osmium tetrachloride”. Chem. Commun. (12): 610a. doi:10.1039/C1967000610A.
