塩化タリウム(I)
表示
| 塩化タリウム(I) | |
|---|---|

| |
| |
別称 塩化第一タリウム、Thallous chloride | |
| 識別情報 | |
| CAS登録番号 | 7791-12-0 |
| ChemSpider | 23044 |
| |
| |
| 特性 | |
| 化学式 | TlCl |
| モル質量 | 239.82 g/mol |
| 外観 | 無臭の白色結晶 |
| 密度 | 7.004 g/cm3 (20 °C) |
| 融点 |
430 °C |
| 沸点 |
720 °C (分解) |
| 水への溶解度 | 0.29 g/100 mL (15.5 °C) 2.4 g/100 mL (100 °C) [1] |
| 溶解度 | アルコール, アセトン, NH4OHに不溶 |
| 危険性 | |
| EU分類 | Very toxic (T+) Dangerous for the environment (N) |
| EU Index | 081-002-00-9 |
| Rフレーズ | R26/28, R33, R51/53 |
| Sフレーズ | (S1/2), S13, S28, S45, S61 |
| 関連する物質 | |
| その他の陰イオン | フッ化タリウム(I) 臭化タリウム(I) ヨウ化カリウム(I) |
| その他の陽イオン | 塩化タリウム(III) 塩化銀 塩化鉛 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
塩化タリウム(I)(えんかタリウム、Thallium(I) chloride)は化学式TlClで表される無機化合物である。無色の固体であり、タリウム鉱石からタリウムを製錬する際の中間生成物。グリーンランドで産出する非常に珍しい鉱物であるlafossaite (Tl(Cl, Br))は塩化タリウム(I)の天然の形である[2]。
合成
[編集]硫酸タリウムの酸性溶液に塩酸を加えることで不溶性の塩化タリウム(I)が沈殿として得られる。
用途
[編集]塩化タリウムの低い溶解性は化学合成において利用される。例えば、金属塩化物錯体にヘキサフルオロリン酸タリウム (TlPF6)を加えることで、対応するヘキサフルオロリン酸誘導物が得られ、副生成物である塩化タリウム(I)は濾過によって容易に除去される。全体的な反応機序はヘキサフルオロリン酸銀のそれと同じであるが、Tl+の方が酸化力が低い。
また、タリウムを放射性同位体の201Tlに置換した塩化タリウムは核医療においてシンチグラフィに利用される。心筋血流シンチグラフィなどの心臓核医学に使われており、生体内におけるタリウムイオンの挙動がカリウムイオンと類似しているため悪性腫瘍に対する利用も研究されている[3]。
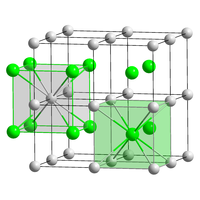
結晶構造
[編集]室温においては塩化セシウム形の結晶構造を有するが[4]、冷却されると即座にヨウ化タリウム型の単斜晶系に転移する。転移温度は不純物の影響を受ける[5][6][7]。
毒性
[編集]塩化タリウム(I)は他の多くのタリウム化合物と同様に非常に毒性が強いが、不溶性であるためにその毒性は多少制限される。
出典
[編集]- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0070494398
- ^ Lafossaite, mindat.org 2011年7月21日閲覧。
- ^ 福井聡ほか (1998). “転移性骨腫瘍における塩化タリウム(201TICI)による腫瘍シンチグラフィの有用性”. 日本医学放射線学会雑誌 58 (1): 25.
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ M Blackman et al "The Polymorphism of Thallium and Other Halides at Low Temperatures" Proc. Phys. Soc. 77 (1961) 471
- ^ A-V Mudring "Thallium Halides - New Aspects of the Stereochemical Activity of Electron Lone Pairs of Heavier Main-Group Elements" Eur. J. Inorg. Chem. 6 (2007) 882
- ^ R. P. Lowndes and C. H. Perry "Molecular structure and anharmonicity in thallium iodide" J. Chem. Phys. 58, 271 (1973) Archived 2012年7月10日, at Archive.is
