「心臓移植」の版間の差分
m →外部リンク |
|||
| (18人の利用者による、間の69版が非表示) | |||
| 1行目: | 1行目: | ||
{{Interventions infobox |
|||
{{正確性|date=2010年12月}} |
|||
| Name = 心臓移植 |
|||
'''心臓移植'''(しんぞういしょく)とは他人の[[心臓]]を移植手術することである。 |
|||
| Image = Heart transplant.jpg |
|||
| Caption = 同所性心移植 |
|||
通常は重大な心疾患によって他人の心臓を臓器移植する以外に存命する方法が無い場合に行われる。 |
|||
| ICD10 = |
|||
2006年現在で世界中で30年間に4万6千例以上が行われている。 |
|||
| ICD9 = 37.51 |
|||
| MeshID = D016027 |
|||
| MedlinePlus = 003003 |
|||
| OPS301 = |
|||
| OtherCodes = |
|||
| HCPCSlevel2 = |
|||
}} |
|||
'''心臓移植'''(しんぞういしょく、{{lang-en-short|Heart transplantation}})または'''心移植'''(しんいしょく)とは、重症[[心不全]]など他に代替[[治療]]手段の無い末期[[心疾患]]に罹患している患者である移植希望者([[レシピエント]])に対し、[[脳死]]状態にある[[臓器]]提供者([[ドナー]])の体から提供された[[心臓]]を[[移植 (医療)|移植]]する[[手術]]である<ref name="burch2004">{{Cite journal |author=Burch, M; Aurora, P |year=2004 |url=https://doi.org/10.1136/adc.2002.017186 |title=Current status of paediatric heart, lung, and heart-lung transplantation |journal=Archives of disease in childhood |volume=89 |issue=4 |pages=386-389 |publisher=BMJ Publishing Group |PMC=1719883 |PMID=15033856 |doi=10.1136/adc.2002.017186}}</ref><ref name="syg">{{Cite web|和書|url=http://www.syg.co.jp/public/jcs_ps4th/index05.html|title=「心臓移植の実際 -周術期管理と成績-」 - 第4回 日本循環器学会プレスセミナー|author=|publisher=|accessdate=2014-06-22}}</ref>。レシピエントの心臓を摘出してドナーの心臓を移植する術式('''同所性心移植''')が一般的であるが、レシピエント心を残し、ドナー心は別の場所に移植する術式('''異所性心移植''')も存在する。移植後は[[拒絶反応]]、[[感染症]]を予防するために種々の薬剤を服用する必要があるが、救命と[[余命]]の延長、[[クオリティ・オブ・ライフ]](QOL)の向上を図り、最終的に社会復帰が期待できる治療法である<ref name="housha">[[福嶌教偉]]. 第4回リフレッシュセミナー報告 心臓移植. [http://jsrtkinki.jp/magazine/825.html 日本放射線技術学会近畿部会雑誌 第10巻1号], p.65-70. {{要購読}}</ref>。 |
|||
== 歴史 == |
== 歴史 == |
||
心移植の研究の歴史は20世紀初頭から始まった。1905年に[[フランス]]の外科医[[アレクシス・カレル]]らが仔[[犬]]の心臓を成犬の頚部に血管[[吻合]]して移植したのが最初の[[動物実験]]例である<ref name="jshtw">{{Cite web|和書|url=http://www.jsht.jp/transplant/world.html|title=世界の心臓移植の歴史|author=|publisher=日本心臓移植研究会|accessdate=2014-06-22}}</ref><ref name="tcnet">{{Cite web|和書|url=http://www.medi-net.or.jp/tcnet/history/hstr_017.html|title=移植グラフィティー(17) 心臓移植への道|author=太田和夫|publisher=トランスプラント・コミュニケーション|accessdate=2014-06-22}}</ref><ref group="注釈">この実験では、ドナー心の[[心房]]は収縮したものの[[心室]]は1時間待っても収縮しなかった。</ref>。当初はこのように異所性心移植の研究からスタートしたが、第二次大戦後に本格的な心移植の試みが始まり、[[スタンフォード大学]]の{{仮リンク|ノーマン・シャムウェイ|en|Norman Shumway}}らのグループの精力的な研究により1960年代には犬の同所性心移植での長期生存に成功した<ref>小柳仁. 心臓移植と心肺移植. クリニシアン No.337, Vol.32. 45-53.</ref>。そして1964年に[[ミシシッピ大学]]病院で{{仮リンク|ジェームズ・ハーディ|en|James Hardy (surgeon)}}が[[チンパンジー]]から成人への心移植を試み、初の人間に対する[[移植 (医療)#ドナーとレシピエントの関係による分類|異種移植]]による心移植となった<ref name="tcnet" /><ref group="注釈">この移植では心臓は術後1時間で拍動を停止した。</ref>。 |
|||
ヒトへの心臓移植の試みは、[[1964年]]に[[ミシシッピー大学]]病院の[[ジェームズ・ハーディ]]によって[[チンパンジー]]の心臓を移植したのが最初の事例となっている。この時は、移植した心臓が90分しか鼓動せず、失敗に終わった。 |
|||
以後研究が重ねられ、1967年に[[南アフリカ共和国|南アフリカ]]・[[ケープタウン大学]]の[[クリスチャン・バーナード]]が、[[交通事故]]の女性から[[心停止]]後に[[人工心肺]]にのせて心臓の摘出・移植を行い、移植を受けた患者は18日間生存。これが初の人間同士による心移植の臨床例となった<ref name="jshtw" /><ref name="tcnet" /><ref name="isen">{{Cite web|和書|url=http://www.isen.ac.jp/cross/crosspoint/detail.html?id=1408|title=『心臓外科、心臓移植の現状と問題点』 T.O.L.(Top Opinion Leader)講義|author=川島康生|authorlink=川島康生|publisher=|accessdate=2014-06-22}}</ref><ref group="注釈">バーナードのケースではドナーの人工呼吸器を外し心停止を確認して5分間待ってから行われたものであり、脳死ドナーからの移植ではない。</ref>。 |
|||
世界初のヒトからヒトへの心臓移植は、[[1967年]]12月3日に[[南アフリカ共和国|南アフリカ]]の[[ケープタウン]]で[[クリスチャン・バーナード]]によって行われた。この時の心臓移植では、{{要出典範囲|執刀した医師が「この移植には、人にいちばん近い形をしたものを使った」と発言した上に|date=2010年10月}}、患者が[[コーカソイド|白人]]男性だったのに対し[[ドナー]]のデニス・ダーバルは[[ネグロイド|黒人]]女性だったことから、「黒人の人権を認めない南アフリカだから出来た非人道的な殺人手術」との批判を受け、[[人種差別]]や[[人権|人権問題]]に関わる論議を呼び起こすことになる。但しバーナード自身は、[[脳死]]を確認の上にドナーの父親からの許諾を得て移植手術を行ったと反論している。なお、世界初の移植を受けた患者は移植18日後に[[免疫抑制剤]]の[[副作用]]による[[肺炎]]で死亡した。バーナードは翌年にも移植手術を実施し、この時には患者を19ヶ月延命させることに成功した。 |
|||
[[1968年]]には22カ国で100以上の心臓移植手術が行われたが、当時の技術力では長期生存率が極めて低く、1969年(昭和44年)に行われた座談会における和田寿郎([[#日本の心臓移植の歴史|後述]]の日本初の心臓移植手術をした医者)の発言によると「'''(昭和44年7月2日現在で)世界全体で135例ぐらい人間の心臓移植は行われた'''」が「'''手術後1年以上生存しているレシピエントは3人'''」という状況で<ref>{{Cite journal|和書|author=木本誠二、和田寿郎、榊原仟、他 |title=心臓移植をめぐって|journal=日本胸部疾患学会雑誌|issn=1883-471X|publisher= 社団法人 日本呼吸器学会|year=1970|volume=8 |issue=2|pages=159・160|doi=10.11389/jjrs1963.8.154 |url=https://doi.org/10.11389/jjrs1963.8.154 }}<br>なお、この長期生存者3人のうち最長生存記録のブレイバーグ([[:en:Philip Blaiberg|英語版:Philip Blaiberg]])はこの翌月(1969年8月17日)に死亡している。</ref>、その後急速に下火となった。そうした中でも[[アメリカ合衆国|アメリカ]]では[[スタンフォード大学]]医学研究所を中心に地道な基礎的研究や手術法の開発が続けられ、[[1979年]]頃にはアメリカ国内で30-40例の移植手術が実施され生存率も高くなった<ref>心臓移植アメリカで復活 研究実り、死亡率低下 じん臓移植並みに『朝日新聞』1979年(昭和54年)7月5日夕刊 3版 14面</ref>。また並行して[[1970年代]]後半からは[[脳死]]の合意を作る努力がなされ、1981年にアメリカで、1983年に[[イギリス]]で脳死の判定基準が認められ、脳死下の臓器提供が合法化された<ref name="housha" />。心移植の手術成績は当初は不良であったものの、[[免疫抑制剤]]の[[サイクロスポリン]]の登場や[[開心術#心筋保護|心筋保護法]]の進歩により成績は著しく向上し、特に末期心不全患者の外科治療として定着するに至った<ref name="tatsuno">{{cite book|和書|author=龍野勝彦, 重松宏, 幕内晴朗, 四津良平, 安達秀雄 |title=心臓血管外科テキスト |publisher=中外医学社 |pages=589-596 |year=2007 |id={{全国書誌番号|21390178}} |ISBN=9784498039100 |url=https://id.ndl.go.jp/bib/000009118122}}</ref>。 |
|||
*[[1968年]][[8月8日]]に日本で初めての心臓移植が、[[札幌医科大学]]で実施された([[和田心臓移植事件]])。 |
|||
*[[1997年]][[7月16日]]に[[臓器の移植に関する法律]]が施行された。 |
|||
*[[1999年]]に日本国内で3人が移植を受ける。30年あまりを経て2回目の心臓移植が実施された。 |
|||
*[[2000年]]に日本国内で小児移植1人を含む4人が移植を受けた |
|||
*[[2001年]]に日本国内で小児移植1人を含む6人が移植を受けた |
|||
*[[2002年]]に日本国内で5人が移植を受けた |
|||
*[[2004年]]に日本国内で2人が移植を受けた |
|||
== 移植 |
=== 日本の心臓移植の歴史 === |
||
*{{要出典範囲|date=2010年12月|国際心臓・肺移植学会による世界中での心臓移植例40,755人の追跡調査による統計では移植後の生存率は1年目79%、3年目71%、5年目63%、10年目で45%}}{{いつ|date=2010年12月}} |
|||
*{{要出典範囲|date=2010年12月|日本循環器学会心臓移植委員会の近年5年の統計では1年目80%、5年目70%以上にまで生存率が向上しており医学の進歩と共に生存率は向上する傾向にある。}}{{いつ|date=2010年12月}} |
|||
日本においてはバーナードの第1例目の移植の1年後、1968年に[[札幌医科大学]]の[[和田寿郎]]により、国内第1例目・世界で30例目となる心移植が行われ<ref name="housha" />([[和田移植]])、患者は術後83日間生存した。患者の死後、[[脳死#脳死判定|脳死判定]]や移植適応に関する疑義が指摘され、和田は殺人罪で告発される事態となった。最終的には証拠不十分で不起訴<ref name="tcnet" />となるも、それ以降日本では臓器移植、特に脳死移植に対する不信感のために国民の合意が得られるのに時間を要し、世界では急速に移植医療が発展する中、日本の心移植適応患者は渡航移植以外の移植の道は約30年間にわたって閉ざされた<ref name="jsht">{{Cite web|和書|url=http://www.jsht.jp/transplant/|title=日本の心臓移植の歴史|author=|publisher=日本心臓移植研究会|accessdate=2014-06-22}}</ref>。 |
|||
== 問題点 == |
|||
*心臓が動いているのに死亡している提供者の存在が必要不可欠であるため[[脳死]]判定の是非、及びその基準が問題となった。 |
|||
*患者は提供者が現れるのを待たなければならないが、{{要出典範囲|date=2010年12月|提供者は希少であり患者の1年後の存命率が68%、7年後ではほぼ0%であり生きて移植を受けられる患者は3人に1人と言われている。}} |
|||
1990年代になってようやく脳死からの臓器移植を実現するために関連学会も含めた議論が始まり、1992年1月の脳死臨調の答申<ref>{{cite journal|和書|author=旗手俊彦 |date=1992-03 |url=https://sapporo-u.repo.nii.ac.jp/records/3461 |title=「脳死臨調最終答申と脳死・臓器移植の展望」 |journal=札幌法学 |publisher=札幌大学 |volume=3 |issue=2 |pages=99-130 |CRID=1050282812527091840}}</ref>を経て1997年10月に「[[臓器の移植に関する法律]]」(臓器移植法)が施行され、心臓移植適応患者の[[日本臓器移植ネットワーク]]への登録が開始された<ref name="housha" />。そして1999年2月に国内2例目、同法下では初となる心移植が行われた<ref name="tatsuno" />。 |
|||
*日本では非常に実施困難な状況であるため、患者の大半が[[アメリカ合衆国|アメリカ]]へ渡って移植を受けている。{{要出典範囲|date=2010年12月|2006年の時点では世界中の移植手術の60%がアメリカで行われている。}} |
|||
その後2008年5月に[[トルコ]]・[[イスタンブール]]にて、国際移植学会が「臓器取引と移植ツーリズムに関するイスタンブール宣言」<ref>[http://www.asas.or.jp/jst/pdf/20080805.pdf 臓器取引と移植ツーリズムに関するイスタンブール宣言] 国際移植学会 2008年5月2日 イスタンブール (翻訳 日本移植学会アドホック翻訳委員会)</ref>を発表し、「臓器取引と移植ツーリズムは、公平、正義、人間の尊厳の尊重といった原則を踏みにじるため、禁止されるべきである。移植商業主義は、貧困層や弱者層のドナーを標的にしており、容赦なく不公平や不正義を導くため、禁止されるべきである」「国外患者への治療は、それによって自国民が受ける移植医療の機会が減少しない場合にのみ許容される」といった趣旨が明文化された<ref>日本医師会. [https://www.mhlw.go.jp/stf/shingi/2r9852000000u8kz-att/2r9852000000u8sh.pdf 国民皆保険の崩壊につながりかねない最近の諸問題について -混合診療の全面解禁と医療ツーリズム-]. 社会保障審議会 医療部会.</ref>。これを受けて、2009年7月に臓器移植法が改正(2010年7月施行)され、本人の意思が不明な場合でも家族の書面による承諾で脳死臓器提供ができるようになり、日本国内での脳死臓器提供数が増加、また[[小児]](15歳未満)のドナーからの心移植が国内でも実施できるようになった。 |
|||
*日本では15歳未満の臓器提供が認められていなかったため、15歳未満の心臓しか合わない子どもが心臓移植を受けることが出来なかった。現在は、改正臓器移植法(2010年7月17日施行)が施行されたため、ドナーさえ見つかれば移植手術が受けられるようになった。改正臓器移植法に基づき2012年に初の10歳未満への心臓移植が行われた。この時国内レシピエントとしては初の6歳未満脳死判定が行われた。しかしいまだ渡米して移植手術を受ける必要があるのが実情である。 |
|||
== 各国の心臓移植実施体制 == |
|||
*米国で移植手術を受けるためには莫大な費用がかかるため、家族は募金を集める必要があるが、募金が十分に集まらずに亡くなってしまうケースもある。 |
|||
=== 臓器移植ネットワーク === |
|||
*米国内でも移植手術の順番を待つ患者は存在している。 |
|||
臓器移植においてはドナーから摘出された臓器をどのようにして公平に、かつ最適なレシピエントに移植するかという臓器の配分の問題が重要である。そのため、世界の各国・地域で臓器移植のためのネットワークの整備が進んでいる。主なネットワークとして、[[米国]]の全米臓器分配ネットワーク機構([[:en:United Network for Organ Sharing|United Network for Organ Sharing]]、'''UNOS''')、[[ヨーロッパ]](特に[[ドイツ]]・[[ベルギー]]・[[オーストリア]]など)のユーロトランスプラント([[:en:Eurotransplant|Eurotransplant]])、[[イギリス]]・[[アイルランド]]のUKトランスプラント、[[デンマーク]]・[[フィンランド]]・[[アイスランド]]・[[ノルウェー]]・[[スウェーデン]]など[[北欧]]諸国のスカンジナビアトランスプラント([[:de:Scandiatransplant]])などがある。心移植は脳死ドナーからの臓器提供が必要であり、脳死判定、臓器摘出のタイミングが重要な問題となるため明確な脳死基準が求められるが、こうしたネットワークや関連学会を中心として移植に関わるシステムの整備が進んでいる。またこれらは日本臓器移植ネットワークを中心とした日本における臓器移植のシステムを構築する際にも参考にされている<ref name="tcnet" />。 |
|||
=== 米国における心臓移植 === |
|||
米国で心移植が実施出来るのは、上記のUNOSのメンバー施設に限られる<ref name="frederick" />。UNOSの患者選択基準では、余命1年以内、手術不可能な重症[[狭心症]]、難治性の心室性[[不整脈]]、切除不可能な心臓[[腫瘍]]の患者が対象となる。移植の適応患者は多いが、実際の移植心の提供の割り当てはUNOSの優先順位基準に従って[[血液型]]、体格、ドナー病院からの距離で決まる。 |
|||
== 日本における心臓移植実施体制 == |
|||
本節では日本における心移植の実施体制について述べる。 |
|||
=== レシピエントの移植適応条件 === |
|||
心移植の適応となる疾患は、拡張型心筋症・拡張相肥大型心筋症による重症心不全、虚血性心疾患など、従来の治療法では救命が不可能な重症心疾患である。また移植適応の条件として、 |
|||
* 長期間または繰り返し[[入院]]治療を必要とする心不全 |
|||
* [[交感神経β受容体遮断薬|β遮断薬]]および[[ACE阻害薬]]を含む従来の治療法ではNYHA分類 III~IV度から改善しない心不全 |
|||
* 現存するいかなる治療法でも無効な致死的重症[[不整脈]]を有する症例であること |
|||
などが挙げられる<ref name="syg" />。 |
|||
==== 適応除外条件 ==== |
|||
以下の場合は心移植の適応から除外される<ref name="tatsuno" />。 |
|||
* 心臓以外の重症疾患([[肝機能障害]]・[[腎機能障害]]・[[慢性閉塞性肺疾患]]・[[悪性腫瘍]]・重症[[自己免疫疾患]]など)がある場合 |
|||
* 活動期の[[消化性潰瘍]]や[[感染症]]、重症[[糖尿病]]、重度の[[肥満]]および重症の[[骨粗鬆症]]のある場合 |
|||
* [[アルコール]]・薬癖、[[精神疾患]]のある場合 |
|||
* 重度の肺高血圧を伴う場合 |
|||
=== レシピエント選定の優先順位 === |
|||
心移植の待機患者がレシピエント候補に選定される優先順位は、虚血許容時間、医学的緊急度、血液型の適合、待機期間の順番で考慮して決定される<ref name="housha" />。 |
|||
* 虚血許容時間 |
|||
: ドナー心摘出から4時間以内に血流が再開されること |
|||
* 医学的緊急度 |
|||
: Status 1:[[補助人工心臓]]、{{仮リンク|大動脈内バルーンパンピング|en|Intra-aortic balloon pump}}、[[人工呼吸]]を必要とするか、[[集中治療室|ICU]]/CCUに収容され[[カテコラミン]]の持続点滴が必要な状態 |
|||
: Status 2:待機中の患者で上記以外の状態 |
|||
: Status 3:待機中に除外条件 (感染症等) にて一時的に待機患者としての選択対象から外れた状態 |
|||
* ABO[[血液型]] |
|||
: ABO血液型は一致を原則とする。但し適合者への移植も考慮する<ref group="注釈">ABO血液型一致の移植に加え、A→AB、B→AB、O→A、O→B、O→ABの移植。</ref>。 |
|||
* 待機期間 |
|||
: Status 1のレシピエント間では待機期間はStatus 1の状態の延べ日数、またStatus 2では待機期間は登録日からの延べ日数とする。 |
|||
=== ドナーの評価 === |
|||
[[脳死]]とされうる状態と診断され、臓器提供の可能性がある場合は、以下のプロセスを経て2回の法的脳死診断が行われ、移植に至るまでに計4回の評価が行われる<ref>Ono M. [https://www.molcom.jp/products/detail/79951/ 脳死臓器提供におけるメディカルコンサルタントの現状と展望]. 今日の移植 Vol.26 No.5 2013-09. 415-23, {{ISSN|09160094}}. {{要購読}}</ref>。 |
|||
==== 第1次評価 ==== |
|||
臓器提供病院に派遣された臓器移植ネットワークの[[移植コーディネーター#移植コーディネーター|ドナーコーディネーター]]は、まずドナーとしての基本情報を収集し、移植の適応基準と照らしあわせて不適応がないか確認する。適応と判断された場合は、コーディネーターは家族と面談し臓器提供について説明を行う。本人の拒否の意思表示が無く、家族の総意として臓器提供の承諾が得られた場合は臓器摘出承諾書を作成し、同時に[[脳死#脳死判定|脳死判定]]承諾書を作成する。 |
|||
なお、ドナーの適応基準には以下の項目が含まれる<ref name="tatsuno" />。 |
|||
* 全身性の活動性[[感染症]]や[[悪性腫瘍]]が無いこと |
|||
* [[心電図]]・[[心臓超音波検査|心エコー]]上の異常所見が無い |
|||
* [[ドパミン]] 10μg/kg/min 相当以上の[[カテコラミン]]の使用が無い |
|||
* 長時間の[[心停止]]や[[胸部外傷]]が無い |
|||
==== 第2次評価 ==== |
|||
6歳以上のドナーの場合は第1回の脳死判定終了から第2回の判定まで6時間以上、6歳未満の場合は24時間以上の間隔を置かなければならない。第2回の脳死判定終了時刻が死亡時刻となる<ref>[http://www.jotnw.or.jp/jotnw/law_manual/pdf/plant.pdf 臓器提供施設の手順書 - 日本臓器移植ネットワーク]</ref>。またメディカルコンサルタント(MC)<ref>福嶌教偉、「[http://www.jsht.jp/report/uploads/report20091006.pdf 脳死下臓器提供におけるメディカルコンサルタントの役割]」 第45回日本移植学会総会 イブニングセミナー1 脳死移植時代のドナー管理と多臓器摘出手技.</ref>は通常このタイミングで臓器提供病院へ派遣される。ドナー評価に必要な検査についてはMCとコーディネーターが協議して提供病院に依頼し、一般臨床データ・各種[[画像診断|画像検査]]が行われる。 |
|||
==== 第3次評価 ==== |
|||
2回の脳死判定で脳死が確定した後に適合するレシピエントが選定され、[[移植_(医療)#移植施設|移植実施施設]]へ連絡が入る。移植実施施設ではドナーチームとレシピエントチームを編成し、ドナーチームは提供病院に移動。到着次第移植実施の判断に必要な各種検査を必要に応じて行い、移植の可能性を再確認する。コーディネーターは必要に応じてドナーチームのサポートを行う。 |
|||
その間移植実施施設では、レシピエントチーム担当医からレシピエント候補の患者への連絡・最終意思確認を行い、患者の術前検査・再評価、[[手術室]]・[[麻酔]]・[[輸血]]・[[集中治療室|ICU]]等の各種準備を行う。第3次評価で移植可能であると判断されたらレシピエントへの[[全身麻酔]]が導入される<ref name="knack">{{cite book|和書 |author=許俊鋭, 高本真一 |year=2012 |title=心不全外科治療の要点と盲点 |publisher=文光堂 |pages=190-194 |series=心臓外科Knack & Pitfalls |ISBN=9784830623349 |id={{全国書誌番号|22182832}} |url=https://ndlsearch.ndl.go.jp/books/R100000002-I024089840}}</ref>。 |
|||
==== 最終評価 ==== |
|||
ドナーチームが臓器の状態を摘出手術中に評価する。心臓の場合は、特に高齢のドナーの場合に[[冠動脈]]の硬化・[[石灰化]]を触診で調べる。 |
|||
摘出が終了したら、ドナーチームのうち一部のメンバーは直ちに出発しドナー心を搬送し、残ったメンバーが創閉鎖、死後処置、[[遺体]]の見送りなどを行う。またレシピエントチームはドナーチームと連絡を取りながら、最終評価で移植に問題ないことを確認した後にレシピエントに対する皮膚切開を行い手術を開始する<ref name="knack" />。[[人工心肺]]開始、[[大動脈]]遮断前まで手術を進めておき、ドナー心が到着次第大動脈遮断、レシピエントへの移植手術を開始する。 |
|||
=== ドナー・レシピエントの適合条件 === |
|||
ドナーとレシピエントの適合条件には以下の各項目を考慮する必要がある<ref name="syg" />。 |
|||
* ABO血液型の適合 |
|||
* [[体重]]差が少ないこと(レシピエントの体重がドナーの-20%~+50%) |
|||
* 前感作[[抗体]]のないこと |
|||
: ドナー・レシピエント間で[[リンパ球]]交差試験を行って、レシピエントの抗Tリンパ球[[抗体]]が陰性であることを確認する。 |
|||
=== 費用 === |
|||
心移植を受けるのに要する費用は以下の通りである(いずれも2014年現在)<ref>[http://www.ncvc.go.jp/cvdinfo/pamphlet/heart/pamph75.html 心不全 - 国立循環器病情報サービス]</ref>。 |
|||
* 日本臓器移植ネットワーク登録料 |
|||
: 登録料は3万円である。また移植待機期間中は1年毎に5000円の更新料が必要となる。 |
|||
* 心移植手術にかかる経費 |
|||
: 2006年4月の[[診療報酬]]改定の際に心移植手術にかかる経費が[[保険]]適用となり、患者負担は各種[[健康保険]]の自己負担割合分となった。具体的には心臓移植手術費 1,041,000円、心臓採取術費 493,000円、脳死臓器提供管理料 142,000円となっているが、患者の[[身体障害]]等級や収入によって自己負担分は変わる(多くの場合自己負担は発生しない)。その他、ドナーチームの交通費・臓器搬送費(チャーター機の場合には100~400万円)については療養費払いとなり、一度全額支払った後に自己負担分を除いて返還される<ref>[http://www.medi-net.or.jp/tcnet/JST/fact_06/fact06_01.html I. 心臓[臓器移植ファクトブック2006]]</ref>。 |
|||
* コーディネート経費 |
|||
: 移植を受けた際に臓器移植ネットワークに支払うコーディネート経費として10万円が必要となる<ref>[http://www.jotnw.or.jp/studying/5-3.html 移植費用の保険適用 (生体移植除く) - 日本臓器移植ネットワーク]</ref>。 |
|||
=== 移植実施施設 === |
|||
2015年2月25日現在、日本国内において心臓移植実施施設として認定を受けているのは以下の9施設である<ref>[http://www.jotnw.or.jp/jotnw/facilities/04.html 移植施設一覧 - 日本臓器移植ネットワーク]</ref>。 |
|||
{| class="wikitable" style="text-align:center;" |
|||
|- |
|||
!施設名 |
|||
!心肺同時移植可 |
|||
!11歳未満移植可 |
|||
|- |
|||
|style="text-align:left;"|[[国立循環器病研究センター]]||○||○ |
|||
|- |
|||
|style="text-align:left;"|[[大阪大学医学部附属病院]]||○||○ |
|||
|- |
|||
|style="text-align:left;"|[[東京女子医科大学病院]]|| ||○ |
|||
|- |
|||
|style="text-align:left;"|[[東京大学医学部附属病院]]|| ||○ |
|||
|- |
|||
|style="text-align:left;"|[[東北大学病院]]||○|| |
|||
|- |
|||
|style="text-align:left;"|[[九州大学病院]]|| || |
|||
|- |
|||
|style="text-align:left;"|[[北海道大学病院]]|| || |
|||
|- |
|||
|style="text-align:left;"|[[埼玉医科大学国際医療センター]]|| || |
|||
|- |
|||
|style="text-align:left;"|[[岡山大学病院]]|| || |
|||
|- |
|||
|} |
|||
== 心臓移植の実際 == |
|||
=== ドナー心の摘出手技 === |
|||
[[胸骨正中切開]]で開胸し、視診・触診で最終評価を行った後に、心臓周囲を剥離。その後[[ヘパリン]]を投与する。続いて[[大動脈]]を遮断し、上下[[大静脈]]を遮断・切開して心臓を虚脱させた後に[[開心術#心筋保護|心停止液]]を注入してドナー心を停止させる。[[左房]]、大動脈、肺動脈の順に切離して心臓を摘出し、心保存液に入れて搬送する<ref name="tatsuno" />。 |
|||
=== レシピエントの移植術式 === |
|||
[[Image:Heart transplant.jpg|thumb|right|300px|同所性心移植(両大静脈法)のイラスト。移植された[[ドナー]]心(Donor heart)と、[[レシピエント]]の[[大動脈]](Aorta)・[[肺動脈]](Pulmonary artery)・上下[[大静脈]](Vena cava)・[[左房]](Left atrium)・[[肺]]との関係を示している。]] |
|||
==== 同所性心移植 ==== |
|||
臨床の場において行われている心移植の98%以上が同所性心移植(Orthotopic heart transplantation)である。以下にその大まかな手順を述べる<ref name="frederick">Frederick A. Hensley, Jr. 他, 新見能成 監訳. 心臓手術の麻酔 第3版. メディカル・サイエンス・インターナショナル.pp475-498. ISBN 4-89592-373-8.</ref>。 |
|||
# 体外循環開始 |
|||
#: レシピエントに人工心肺を接続する手順は通常の[[開心術]]と概ね同様である。[[肺動脈カテーテル]]が入っていれば上[[大静脈]]まで引き抜く。この時、過去に[[胸骨正中切開]]を繰り返している患者では、人工心肺のカニューレ(送血管・脱血管)の挿入を[[大腿動脈]]・大腿静脈で行うことが多い。あるいは、遠位上行[[大動脈]]に送血管を入れ、上下大静脈に脱血管を挿入、締めて心臓を[[体循環]]から分離する。 |
|||
#: [[補助人工心臓]](VAD)装着状態からの移植の場合は、人工心肺開始と同時にVADの駆動を停止してVAD送血管を遮断する<ref name="knack" />。 |
|||
# レシピエント心摘出 |
|||
#: ドナー心の手術室への到着を確認した後、大動脈を遮断する。VAD装着状態の場合はここでVADを切離、摘出する。大動脈と[[肺動脈]]をクランプ・切離した後、以下に述べる術式の違いにより、両[[心房]]、あるいは[[肺静脈]]を含む[[左房]]の一部を残してレシピエントの心臓を摘出する。 |
|||
#* '''両心房法''' |
|||
#: 両心房法またはLower-Shumway法(LS法)では、レシピエント側の左右心房の一部を残し、両心房を吻合する。心移植の歴史においては当初から30年以上用いられてきた基本的な術式である<ref>{{Cite journal |author=Nisco, Steven J; Reitz, Bruce A |year=1994 |url=https://europepmc.org/article/med/8199391 |title=Developments in cardiac transplantation |journal=Current opinion in cardiology |volume=9 |issue=2 |pages=237-246 |doi=10.1097/00001573-199403000-00014 |PMID=8199391}}</ref>。 |
|||
#* '''両大静脈法''' |
|||
#: 両大静脈法(bicaval法)は、従来のLS法に手を加えた方法である<ref>Aziz TM, Burgess MI, El-Gamel A, Campbell CS, Rahman AN, Deiraniya AK, Yonan NA. Orthotopic cardiac transplantation technique: a survey of current practice. Ann Thorac Surg. 1999 Oct;68(4):1242-6.</ref>。この方法では、レシピエント側に肺静脈を含む左房の一部が残され、上下大静脈と左房の吻合を行う。利点としては、[[僧帽弁]]輪の変形が少ない、[[僧帽弁閉鎖不全症|僧帽弁逆流]]の可能性・重症度が低くなる、心房の同期的収縮が保たれる、[[右室]]機能が改善する、[[血栓]]のリスクが減少する、等がある。日本においてはbicaval法を更に改良したmodified bicaval法が最も広く行われている<ref>{{Cite journal |author=Kitamura, Soichiro; Nakatani, Takeshi; Bando, Ko; Sasako, Yoshikado; Kobayashi, Junjiro; Yagihara, Toshikatsu |year=2001 |url=https://doi.org/10.1016/S0003-4975(01)02894-6 |title=Modification of bicaval anastomosis technique for orthotopic heart transplantation |journal=The Annals of thoracic surgery |volume=72 |issue=4 |pages=1405-1406 |publisher=Elsevier |doi=10.1016/S0003-4975(01)02894-6}}</ref>。 |
|||
# ドナー心吻合・体外循環離脱 |
|||
#: 次にドナー心の吻合を行う。まずドナー心を観察して[[卵円孔]]が開存していたら閉鎖する<ref group="注釈">閉鎖しておかないと、移植後に右心系の圧が上昇すると右左[[シャント]]や低酸素血症が生じやすい。</ref>。そしてドナーとレシピエントの左房、次に[[右房]]を、また両大静脈法を選択した場合は上下大静脈を吻合する。次に縫合する場所はドナー心の[[虚血]]時間などを考慮しながら決定する。ドナーとレシピエントの大動脈を吻合し、患者を{{仮リンク|トレンデレンブルグ位|en|Trendelenburg position}}にして空気[[塞栓]]を予防しながら、大動脈の遮断を解除する。肺動脈を吻合し、[[心臓ペースメーカー|ペーシング]]ワイヤーを縫着した後、心腔内を脱気して人工心肺から離脱する。 |
|||
==== 異所性心移植 ==== |
|||
異所性心移植(Heterotopic heart transplantation)は、全心移植症例の1~2%以下で行われている<ref>1999 Annual report of the US Scientific Registry of Transplant Recipients and the Organ Procurement and Transplantation Network: transplant data 1989-1998. Rockville, MD: United Network for Organ Sharing, 2000.</ref>。この方法ではレシピエントの心臓は摘出されない。ドナー心は右前[[胸郭]]部に置かれて、循環が並行して行われるように吻合する。まずレシピエントとドナーの心房、続いて大動脈が吻合される。二つの肺動脈間を導管で接続し、両方の[[右室]]からの血流がレシピエントの肺動脈に[[血流]]を送るようにする。同様にレシピエントとドナーの[[左室]]はレシピエントの大動脈に血流を送る。高い肺動脈圧に対抗して[[血液]]を駆出することに順応したレシピエントの右室は右心拍出量の多くを担当し、一方健康なドナーの左室は左室拍出量に大きく貢献する<ref>{{Cite journal |author=Addonizio, Linda J |year=1996 |title=Current status of cardiac transplantation in children |journal=Current Opinion in Pediatrics |volume=8 |issue=5 |pages=520-526 |publisher=LWW |url=https://journals.lww.com/co-pediatrics/Abstract/1996/10000/Current_status_of_cardiac_transplantation_in.17.aspx}} {{要購読}}</ref>。 |
|||
異所性移植が優れているのは以下の様なケースである<ref name="frederick" />。 |
|||
* 重症肺高血圧のレシピエント |
|||
* ドナーとレシピエントの体格比が小さい |
|||
* ドナー心の虚血時間が長い |
|||
異所性移植の欠点は以下の通りである<ref name="frederick" />。 |
|||
* 手術死亡率が高い |
|||
* レシピエントの不全心に対して[[薬物]]治療を続けなければならない |
|||
* レシピエント心が[[血栓]]の原因になる |
|||
* ドナー心を[[胸腔]]に入れることで[[呼吸]]機能が障害される |
|||
=== 術後管理 === |
|||
[[File:Orthotopic Heart Transplant.png|thumb|300px|両心房法による心移植後の[[心電図]]。[[ドナー]]心房由来のP波は小さくQRSに先行するのに対して、矢印で示した[[レシピエント]]の心房由来のP波はQRSとは無関係である。但し心電図上で認めてもレシピエントの心房からのP波が吻合線を越えて伝導することはない。]] |
|||
心移植の[[予後]]を最も左右するのは早期死亡(3ヶ月以内)であり、原因としては移植心機能不全、急性[[拒絶反応]]、および感染症がそれぞれ30%程度である。これらの[[合併症]]の予防を念頭に、術後管理の要点について述べる<ref name="tatsuno" />。 |
|||
==== 拒絶反応の予防(免疫抑制療法) ==== |
|||
心移植後の拒絶反応を予防する[[免疫抑制剤|免疫抑制療法]]には、[[カルシニューリン]]阻害剤としてサイクロスポリン(CSA)または[[タクロリムス]](FK)、[[核酸]]合成阻害剤として[[ミコフェノール酸モフェチル]](MMF)、[[ステロイド]]として[[プレドニゾロン]]の3剤を併用して用いるのが一般的である。拒絶反応が発症しても特異的な症状や臨床所見を示さないため、最終診断は心筋[[生検]]によって行う。臨床的に異常がなくとも定期的に心筋生検を行い、ISHLTの基準<ref name="ishlt2004">Stewart S, Winters GL, Fishbein MC, Tazelaar HD, Kobashigawa J, Abrams J, Andersen CB, Angelini A, Berry GJ, Burke MM, Demetris AJ, Hammond E, Itescu S, Marboe CC, McManus B, Reed EF, Reinsmoen NL, Rodriguez ER, Rose AG, Rose M, Suciu-Focia N, Zeevi A, Billingham ME. Revision of the 1990 working formulation for the standardization of nomenclature in the diagnosis of heart rejection. J Heart Lung Transplant. 2005 Nov;24(11):1710-20. Epub 2005 Jun 20.</ref><ref>[http://scvp.net/acr/grading.html SCVP Endomyocardial Biopsy Tutorial]</ref>に従って診断する。 |
|||
{| class="wikitable" |
|||
|+ 拒絶反応の診断基準(ISHLT-2004 Acute Cellular Rejection Grading Scheme)<ref name="ishlt2004" /><ref group="注釈">ISHLTの急性細胞性拒絶反応の診断基準は1990年に提唱され(ISHLT-1990)、その後2004年に改訂された(ISHLT-2004)。ISHLT-1990の診断基準(0, 1a, 1b, 2, 3a, 3b, 4)との混同を避けるため、0R、1R、2R、3RとR(revisedを意味する)を付けて記載されている。</ref> |
|||
! Grade !! 病理組織所見 |
|||
|- |
|||
! style="text-align:left" | 0R: none |
|||
| 拒絶反応無し |
|||
|- |
|||
! style="text-align:left" | 1R: mild |
|||
| 軽度拒絶反応(間質あるいは血管周囲へのリンパ球浸潤を認め、かつ心筋細胞障害が局在性の場合) |
|||
|- |
|||
! style="text-align:left" | 2R: moderate |
|||
| 中等度拒絶反応(炎症細胞浸潤巣の2箇所以上が心筋細胞障害を伴っている場合) |
|||
|- |
|||
! style="text-align:left" | 3R: severe |
|||
| 重度拒絶反応(びまん性の心筋細胞障害) |
|||
|} |
|||
==== 感染症の予防 ==== |
|||
移植後は免疫抑制剤を服用するために感染症に罹患しやすいが、[[耐性菌]]増加に繋がる広域スペクトラムの[[抗生剤]]を無闇に使用することは控えるべきである。一般開心術と同様に第1・第2世代の抗生剤に[[グロブリン]]製剤を併用する。また移植後3~6ヶ月目までは、[[アシクロビル]]と[[ST合剤]]を服用する。退院後も[[日和見感染症]]に罹患しやすいので、定期的なモニタリングと患者自身が感染症の知識を十分に持つことが重要である。 |
|||
==== 循環管理 ==== |
|||
一般の開心術に加え注意すべき点として、移植心は支配[[神経]]をもたないいわゆる除神経心である<ref group="注釈">従って、循環作動薬の中では[[カテコラミン]]のように直接作用する薬物には反応するが、[[自律神経系]]を介して作用する[[アトロピン]]などには反応しない。</ref>ため、循環血液量の変動に対応しにくいことを考慮に入れておく必要がある。また心移植後は一時的肺高血圧、[[肺塞栓]]、[[三尖弁]]閉鎖不全、肺動脈吻合部狭窄などにより右心不全を来すことが多い。[[プロスタグランジン|プロスタグランジンE<sub>1</sub>]]、[[ホスホジエステラーゼ|PDE-III]]阻害剤、[[一酸化窒素|NO]]吸入が有効であるが、右心補助人工心臓(RVAD)や再移植を必要とすることもある。 |
|||
==== 移植後冠動脈病変(慢性拒絶反応) ==== |
|||
移植後冠動脈病変とは移植後遠隔期(6ヶ月以降)に発症する冠動脈病変であり、[[免疫学]]的機序が引き金となりびまん性に冠動脈の内膜が肥厚し内腔が狭小化する。進行すると再移植しか治療法がない。前述の通り移植心は除神経されており[[狭心症|狭心痛]]を認めないため注意を要する。 |
|||
==== 心移植後の妊娠 ==== |
|||
一般に移植心は、[[妊娠]]による生理的変化に対応することが可能である<ref>{{Cite journal |author=Riley, Edward T |year=1995 |title=Obstetric management of patients with transplants |journal=International Anesthesiology Clinics |volume=33 |issue=2 |pages=125-140 |publisher=LWW |url=https://journals.lww.com/anesthesiaclinics/Citation/1995/03320/Obstetric_Management_of_Patients_with_Transplants.9.aspx |
|||
}} {{要購読}}</ref>。[[リトドリン]]などの[[早産]]防止薬はβ-[[アドレナリン受容体]]への感受性を増加させるので、代わりに[[マグネシウム]]や[[ニフェジピン]]などの使用を検討する。妊娠により移植心が悪影響を受けることはないが、[[出産]]後急性拒絶反応の危険性が高くなることには留意する必要がある。 |
|||
== 移植実績と長期予後 == |
|||
=== 移植実績 === |
|||
ISHLT(国際心肺移植学会)に登録された心移植<ref>HEART TRANSPLANTATION |
|||
Overall. JHLT. 2014 Oct; 33(10): 996-1008. (https://www.ishlt.org/downloadables/slides/2014/heart_overall.pptx)</ref>および{{仮リンク|心肺同時移植|en|Heart-lung transplant}}<ref>HEART-LUNG TRANSPLANTATION Overall. JHLT. 2014 Oct; 33(10): 1009-1024. (https://www.ishlt.org/downloadables/slides/2014/heart_lung_overall.pptx)</ref><ref group="注釈">肺単独の移植の経験が蓄積されるにつれて心肺同時移植の適応は減少しつつある。肺移植が不可逆性の心不全に至る前に行われるか、または単独の先天性心疾患の心内修復術と合わせて行われると、ほとんどの症例は肺移植だけで十分である。</ref>の症例数の推移を示す(1982~2012年)<ref>[https://www.ishlt.org/registries/slides.asp?slides=heartLungRegistry ISHLT Heart/Lung Transplant Registry]</ref>。 |
|||
<div class="NavFrame"> |
|||
<div class="NavHead" style="text-align:left">世界の心移植の移植実績(ISHLT登録症例)</div> |
|||
<div class="NavContent" style="text-align:left"> |
|||
{| class="wikitable" style="text-align:center;width:20em" |
|||
|- |
|||
!移植年 |
|||
!症例数 |
|||
|- |
|||
!1982 |
|||
|187 |
|||
|- |
|||
!1983 |
|||
|322 |
|||
|- |
|||
!1984 |
|||
|671 |
|||
|- |
|||
!1985 |
|||
|1261 |
|||
|- |
|||
!1986 |
|||
|2358 |
|||
|- |
|||
!1987 |
|||
|2997 |
|||
|- |
|||
!1988 |
|||
|3526 |
|||
|- |
|||
!1989 |
|||
|3823 |
|||
|- |
|||
!1990 |
|||
|4524 |
|||
|- |
|||
!1991 |
|||
|4747 |
|||
|- |
|||
!1992 |
|||
|4725 |
|||
|- |
|||
!1993 |
|||
|4921 |
|||
|- |
|||
!1994 |
|||
|4821 |
|||
|- |
|||
!1995 |
|||
|4801 |
|||
|- |
|||
!1996 |
|||
|4682 |
|||
|- |
|||
!1997 |
|||
|4604 |
|||
|- |
|||
!1998 |
|||
|4519 |
|||
|- |
|||
!1999 |
|||
|4202 |
|||
|- |
|||
!2000 |
|||
|4102 |
|||
|- |
|||
!2001 |
|||
|4033 |
|||
|- |
|||
!2002 |
|||
|3907 |
|||
|- |
|||
!2003 |
|||
|3830 |
|||
|- |
|||
!2004 |
|||
|3798 |
|||
|- |
|||
!2005 |
|||
|3913 |
|||
|- |
|||
!2006 |
|||
|3966 |
|||
|- |
|||
!2007 |
|||
|3994 |
|||
|- |
|||
!2008 |
|||
|3990 |
|||
|- |
|||
!2009 |
|||
|4024 |
|||
|- |
|||
!2010 |
|||
|4137 |
|||
|- |
|||
!2011 |
|||
|4188 |
|||
|- |
|||
!2012 |
|||
|4196 |
|||
|- |
|||
|} |
|||
</div> |
|||
</div> |
|||
<div class="NavFrame"> |
|||
<div class="NavHead" style="text-align:left">世界の心肺同時移植の移植実績(ISHLT登録症例)</div> |
|||
<div class="NavContent" style="text-align:left"> |
|||
{| class="wikitable" style="text-align:center;width:20em" |
|||
|- |
|||
!移植年 |
|||
!症例数 |
|||
|- |
|||
!1982 |
|||
|13 |
|||
|- |
|||
!1983 |
|||
|19 |
|||
|- |
|||
!1984 |
|||
|36 |
|||
|- |
|||
!1985 |
|||
|86 |
|||
|- |
|||
!1986 |
|||
|124 |
|||
|- |
|||
!1987 |
|||
|170 |
|||
|- |
|||
!1988 |
|||
|246 |
|||
|- |
|||
!1989 |
|||
|287 |
|||
|- |
|||
!1990 |
|||
|278 |
|||
|- |
|||
!1991 |
|||
|262 |
|||
|- |
|||
!1992 |
|||
|242 |
|||
|- |
|||
!1993 |
|||
|214 |
|||
|- |
|||
!1994 |
|||
|247 |
|||
|- |
|||
!1995 |
|||
|233 |
|||
|- |
|||
!1996 |
|||
|167 |
|||
|- |
|||
!1997 |
|||
|191 |
|||
|- |
|||
!1998 |
|||
|162 |
|||
|- |
|||
!1999 |
|||
|169 |
|||
|- |
|||
!2000 |
|||
|142 |
|||
|- |
|||
!2001 |
|||
|122 |
|||
|- |
|||
!2002 |
|||
|112 |
|||
|- |
|||
!2003 |
|||
|95 |
|||
|- |
|||
!2004 |
|||
|107 |
|||
|- |
|||
!2005 |
|||
|101 |
|||
|- |
|||
!2006 |
|||
|113 |
|||
|- |
|||
!2007 |
|||
|95 |
|||
|- |
|||
!2008 |
|||
|94 |
|||
|- |
|||
!2009 |
|||
|86 |
|||
|- |
|||
!2010 |
|||
|95 |
|||
|- |
|||
!2011 |
|||
|69 |
|||
|- |
|||
!2012 |
|||
|81 |
|||
|- |
|||
|} |
|||
</div> |
|||
</div> |
|||
==== 日本における移植実績 ==== |
|||
以下のデータは1997年に臓器移植法が施行されて以降の、日本での心移植および心肺同時移植の症例数である(2015年1月31日現在)<ref>[http://plaza.umin.ac.jp/~hearttp/PDF/jcshtpStat_shinpai_order.pdf 心臓移植及び心肺同時移植適応検討症例に関する現況] (2015年1月31日現在){{404|date=2024-01}}</ref>。また、日本循環器学会心臓移植委員会に申請があった症例のうち、報告または予後調査により国外で移植を受けたことが判明した数も参考に示す。 |
|||
<div class="NavFrame"> |
|||
<div class="NavHead" style="text-align:left">日本の心移植の移植実績</div> |
|||
<div class="NavContent" style="text-align:left"> |
|||
{| class="wikitable" style="text-align:center;width:25em" |
|||
|- |
|||
!移植年 |
|||
!国内 |
|||
!国外 |
|||
|- |
|||
!1997 |
|||
|0||4 |
|||
|- |
|||
!1998 |
|||
|0||5 |
|||
|- |
|||
!1999 |
|||
|3||3 |
|||
|- |
|||
!2000 |
|||
|3||9 |
|||
|- |
|||
!2001 |
|||
|6||8 |
|||
|- |
|||
!2002 |
|||
|5||7 |
|||
|- |
|||
!2003 |
|||
|0||6 |
|||
|- |
|||
!2004 |
|||
|5||8 |
|||
|- |
|||
!2005 |
|||
|7||14 |
|||
|- |
|||
!2006 |
|||
|10||5 |
|||
|- |
|||
!2007 |
|||
|10||7 |
|||
|- |
|||
!2008 |
|||
|11||12 |
|||
|- |
|||
!2009 |
|||
|6||9 |
|||
|- |
|||
!2010<ref group="注釈">2010年7月 改正臓器移植法施行</ref> |
|||
|23||3 |
|||
|- |
|||
!2011 |
|||
|31||4 |
|||
|- |
|||
!2012 |
|||
|28||4 |
|||
|- |
|||
!2013 |
|||
|37||4 |
|||
|- |
|||
!2014 |
|||
|37||2 |
|||
|- |
|||
!2015/1/1~1/31(1ヶ月) |
|||
|4||0 |
|||
|- |
|||
|} |
|||
</div> |
|||
</div> |
|||
<div class="NavFrame"> |
|||
<div class="NavHead" style="text-align:left">日本の心肺同時移植の移植実績</div> |
|||
<div class="NavContent" style="text-align:left"> |
|||
{| class="wikitable" style="text-align:center;width:25em" |
|||
|- |
|||
!移植年 |
|||
!国内 |
|||
!国外 |
|||
|- |
|||
!1997 |
|||
|‐||‐ |
|||
|- |
|||
!1998 |
|||
|‐||‐ |
|||
|- |
|||
!1999 |
|||
|‐||‐ |
|||
|- |
|||
!2000 |
|||
|‐||‐ |
|||
|- |
|||
!2001 |
|||
|‐||‐ |
|||
|- |
|||
!2002 |
|||
|‐||‐ |
|||
|- |
|||
!2003 |
|||
|0||1<ref group="注釈">心肺同時移植の「適応」であったが心移植のみを受けている。</ref> |
|||
|- |
|||
!2004 |
|||
|0||0 |
|||
|- |
|||
!2005 |
|||
|0||0 |
|||
|- |
|||
!2006 |
|||
|0||0 |
|||
|- |
|||
!2007 |
|||
|0||0 |
|||
|- |
|||
!2008 |
|||
|0||0 |
|||
|- |
|||
!2009 |
|||
|1||0 |
|||
|- |
|||
!2010 |
|||
|0||0 |
|||
|- |
|||
!2011 |
|||
|0||0 |
|||
|- |
|||
!2012 |
|||
|0||0 |
|||
|- |
|||
!2013 |
|||
|1||0 |
|||
|- |
|||
!2014 |
|||
|0||0 |
|||
|- |
|||
!2015/1/1~1/31(1ヵ月) |
|||
|0||0 |
|||
|- |
|||
|} |
|||
</div> |
|||
</div> |
|||
=== 長期予後と術後のQOL === |
|||
ISHLTに登録されている全移植症例の統計によると、世界の心移植成績は5年生存率70%、10年生存率50%程度であるが、2011年10月までの日本での113例の集計によると10年生存率は96%である<ref>The Registry of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant 3 0: 1071-132, 2011</ref><ref>{{cite journal|和書|author=許俊鋭, 西村隆, 小野稔 |title=臓器移植法改正後の心臓移植・補助人工心臓の現況と将来展望 |journal=人工臓器 |ISSN=03000818 |volume=41 |issue=1 |date=2012-06 |pages=21-23}}</ref>。移植後は多くの患者が社会復帰し、日常生活において全く介護を必要としない者の割合は96%程度である<ref>[http://www.jhf.or.jp/senmoni/q&a/isyoku.html 心臓移植の現状と経費について 日本心臓財団]</ref>。 |
|||
== 日本の心臓移植の課題 == |
|||
=== ドナー不足 === |
|||
臓器移植法改正に伴いドナー提供数が増加したとはいえ、未だ日本では待機患者に対するドナー数が大きく不足している。患者は長い待機期間を強いられており、90%以上の症例が補助人工心臓からのブリッジ症例([[補助人工心臓#BTT: bridge to transplant|BTT]])である<ref>{{cite journal|和書|author=許俊鋭, 高本眞一 |year=2008 |url=https://doi.org/10.4326/jjcvs.37.252 |title=諸外国に比較してわが国の治療成績が優れている手術 : 「心臓移植」と「補助人工心臓」治療 |journal=日本心臓血管外科学会雑誌 |ISSN=0285-1474 |publisher=日本心臓血管外科学会 |volume=37 |issue=4 |pages=252-253 |doi=10.4326/jjcvs.37.252}}</ref>。心移植に至った患者の待機期間の平均は853日(2012年3月末時点)<ref name="knack" />と、欧米の2ヶ月程度<ref name="tatsuno" />と比較して極めて長い。 |
|||
=== 小児に対する心臓移植 === |
|||
成人と異なる小児に対する心移植の特徴として、小児特有の[[先天性心疾患]]があること、一般に成人より病期の進行が早いことなどがある。また小児では移植適応を検討するにあたって前述のNYHA分類を当てはめることが困難であるなど、成人に対する心移植とは違った適応判定の基準が求められる<ref name="syg03">{{Cite web|和書|url=http://www.syg.co.jp/public/jcs_ps4th/index03.html|title=「小児における心臓移植の適応基準と施設認定基準」 - 第4回 日本循環器学会プレスセミナー|author=|publisher=|accessdate=2014-06-22}}</ref>。このため日本小児循環器学会では、小児(11歳未満)に対する移植適応基準として「小児心臓移植の適応判定ガイダンス」<ref>日本小児循環器学会臓器移植委員会.[http://plaza.umin.ac.jp/~hearttp/files/guidance.doc 小児心臓移植の適応判定ガイダンス] {{404|date=2024-01}}</ref>を策定している。また小児ドナーからの移植実施施設に必要とされる条件として、先天性心疾患を専門とする心臓外科医、小児循環器を専門とする小児科医を擁することが求められている。また2010年の改正臓器移植法では[[虐待]]により死亡した児童からの臓器提供が禁止されており、臓器提供施設には虐待防止委員会など虐待の有無を判断する体制が必要条件となっている。それらの要件を考慮し、改正臓器移植法施行に合わせて小児ドナーからの移植実施施設として[[東京大学医学部附属病院]]、[[大阪大学医学部附属病院]]、[[国立循環器病研究センター]]の3施設が日本で初めて認定された。2020年現在では[[東京女子医科大学病院]]、小児心臓移植専門認定施設として[[国立成育医療研究センター]]が認可されており、計5施設となった。 |
|||
== ブタから人への心臓移植 == |
|||
[[豚]]の心臓を人へ移植する試みが続けられている。 |
|||
* 1例目:[[2022年]]、手術実施。2か月後に死亡<ref>{{Cite web|和書|url=https://www.bbc.com/japanese/60686479|title=世界初のブタ心臓移植を受けた男性が死亡、術後2カ月 アメリカ|accessdate=2023-11-02|publisher=BBC}}</ref><ref>{{Cite web|和書|url=https://wired.jp/article/how-to-make-a-pig-heart-transplant-last-in-a-person/|title=ブタからヒトへ2例目の心臓移植が実施、最先端を切り拓く医師たちの挑戦|accessdate=2023-11-02|publisher=Wired}}</ref>。 |
|||
* 2例目:[[2023年]][[9月]]、手術実施。術後6週間で死亡<ref>{{Cite web|url=https://www.cnn.co.jp/usa/35211003.html|title=ブタからの心臓移植、2例目の患者が死亡 術後6週間 米|accessdate=2023-11-02|publisher=CNN.co.jp}}</ref>。 |
|||
== 術中写真 == |
|||
{{Hidden|[[File:Nuvola apps important.svg|left|30px]]右の[表示]をクリックすることで画像が開きます|[[File:Пересаженное сердце в грудной клетке реципиента.JPG|thumb|center|300px|同所性心移植]]}} |
|||
心移植の術中写真。移植された心臓が[[レシピエント]]の[[縦隔]]内におさまっている。 |
|||
== 脚注 == |
|||
=== 注釈 === |
|||
{{reflist|group="注釈"}} |
|||
=== 出典 === |
|||
{{reflist|2}} |
|||
== 関連項目 == |
== 関連項目 == |
||
* [[移植 (医療)]] |
|||
* [[心臓]] |
|||
* [[心不全]] |
|||
* [[補助人工心臓]] |
|||
* {{仮リンク|肺移植|en|Lung transplantation}} |
|||
* {{仮リンク|心肺同時移植|en|Heart–lung transplant}} |
|||
* [[臓器の移植に関する法律]] |
* [[臓器の移植に関する法律]] |
||
* [[脳死]] |
* [[脳死]] |
||
* [[ |
* [[心臓血管外科学]] |
||
* [[ |
* [[循環器学]] |
||
* [[ピギーバック法]] |
|||
* [[○○ちゃんを救う会]] |
|||
== 外部リンク == |
== 外部リンク == |
||
* [https://www.jotnw.or.jp/learn/about/circumstances/ 臓器ごとの移植事情] - 日本臓器移植ネットワーク |
|||
*[http://www.ishokushien.com/index.html NPO日本移植支援協会 ] |
|||
* [https://www.ncvc.go.jp/hospital/pub/knowledge/disease/artificialheart/ 補助人工心臓・心臓移植] - 国立循環器病研究センター 病院 |
|||
*[http://plaza.umin.ac.jp/~hearttp/ 日本循環器学会心臓移植委員会 ] |
|||
* [https://www.ishlt.org/ ISHLT] - 国際心肺移植学会 |
|||
*[http://www.osaka-transplant.in.arena.ne.jp/page/shinisyoku/01.html 大阪大学医学部附属病院・移植医療部 心臓移植 ] |
|||
{{心血管疾患}} |
|||
== 出典 == |
|||
*国際心臓・肺移植学会による世界中での心臓移植例40,755人の追跡調査による統計{{出典無効|date=2010年12月}} |
|||
*日本循環器学会心臓移植委員会の統計{{出典無効|date=2010年12月}} |
|||
{{Normdaten}} |
|||
{{DEFAULTSORT:しんそういしよく}} |
{{DEFAULTSORT:しんそういしよく}} |
||
[[Category:心臓外科学]] |
|||
[[Category:循環器学]] |
|||
[[Category:移植 (医療)]] |
[[Category:移植 (医療)]] |
||
2024年6月22日 (土) 08:56時点における最新版
| 心臓移植 | |
|---|---|
| 治療法 | |
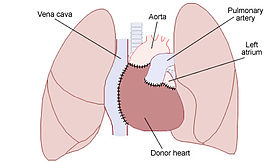 同所性心移植 | |
| 診療科 | 循環器学 |
| ICD-9-CM | 37.51 |
| MeSH | D016027 |
| MedlinePlus | 003003 |
心臓移植(しんぞういしょく、英: Heart transplantation)または心移植(しんいしょく)とは、重症心不全など他に代替治療手段の無い末期心疾患に罹患している患者である移植希望者(レシピエント)に対し、脳死状態にある臓器提供者(ドナー)の体から提供された心臓を移植する手術である[1][2]。レシピエントの心臓を摘出してドナーの心臓を移植する術式(同所性心移植)が一般的であるが、レシピエント心を残し、ドナー心は別の場所に移植する術式(異所性心移植)も存在する。移植後は拒絶反応、感染症を予防するために種々の薬剤を服用する必要があるが、救命と余命の延長、クオリティ・オブ・ライフ(QOL)の向上を図り、最終的に社会復帰が期待できる治療法である[3]。
歴史
[編集]心移植の研究の歴史は20世紀初頭から始まった。1905年にフランスの外科医アレクシス・カレルらが仔犬の心臓を成犬の頚部に血管吻合して移植したのが最初の動物実験例である[4][5][注釈 1]。当初はこのように異所性心移植の研究からスタートしたが、第二次大戦後に本格的な心移植の試みが始まり、スタンフォード大学のノーマン・シャムウェイらのグループの精力的な研究により1960年代には犬の同所性心移植での長期生存に成功した[6]。そして1964年にミシシッピ大学病院でジェームズ・ハーディがチンパンジーから成人への心移植を試み、初の人間に対する異種移植による心移植となった[5][注釈 2]。
以後研究が重ねられ、1967年に南アフリカ・ケープタウン大学のクリスチャン・バーナードが、交通事故の女性から心停止後に人工心肺にのせて心臓の摘出・移植を行い、移植を受けた患者は18日間生存。これが初の人間同士による心移植の臨床例となった[4][5][7][注釈 3]。
1968年には22カ国で100以上の心臓移植手術が行われたが、当時の技術力では長期生存率が極めて低く、1969年(昭和44年)に行われた座談会における和田寿郎(後述の日本初の心臓移植手術をした医者)の発言によると「(昭和44年7月2日現在で)世界全体で135例ぐらい人間の心臓移植は行われた」が「手術後1年以上生存しているレシピエントは3人」という状況で[8]、その後急速に下火となった。そうした中でもアメリカではスタンフォード大学医学研究所を中心に地道な基礎的研究や手術法の開発が続けられ、1979年頃にはアメリカ国内で30-40例の移植手術が実施され生存率も高くなった[9]。また並行して1970年代後半からは脳死の合意を作る努力がなされ、1981年にアメリカで、1983年にイギリスで脳死の判定基準が認められ、脳死下の臓器提供が合法化された[3]。心移植の手術成績は当初は不良であったものの、免疫抑制剤のサイクロスポリンの登場や心筋保護法の進歩により成績は著しく向上し、特に末期心不全患者の外科治療として定着するに至った[10]。
日本の心臓移植の歴史
[編集]日本においてはバーナードの第1例目の移植の1年後、1968年に札幌医科大学の和田寿郎により、国内第1例目・世界で30例目となる心移植が行われ[3](和田移植)、患者は術後83日間生存した。患者の死後、脳死判定や移植適応に関する疑義が指摘され、和田は殺人罪で告発される事態となった。最終的には証拠不十分で不起訴[5]となるも、それ以降日本では臓器移植、特に脳死移植に対する不信感のために国民の合意が得られるのに時間を要し、世界では急速に移植医療が発展する中、日本の心移植適応患者は渡航移植以外の移植の道は約30年間にわたって閉ざされた[11]。
1990年代になってようやく脳死からの臓器移植を実現するために関連学会も含めた議論が始まり、1992年1月の脳死臨調の答申[12]を経て1997年10月に「臓器の移植に関する法律」(臓器移植法)が施行され、心臓移植適応患者の日本臓器移植ネットワークへの登録が開始された[3]。そして1999年2月に国内2例目、同法下では初となる心移植が行われた[10]。
その後2008年5月にトルコ・イスタンブールにて、国際移植学会が「臓器取引と移植ツーリズムに関するイスタンブール宣言」[13]を発表し、「臓器取引と移植ツーリズムは、公平、正義、人間の尊厳の尊重といった原則を踏みにじるため、禁止されるべきである。移植商業主義は、貧困層や弱者層のドナーを標的にしており、容赦なく不公平や不正義を導くため、禁止されるべきである」「国外患者への治療は、それによって自国民が受ける移植医療の機会が減少しない場合にのみ許容される」といった趣旨が明文化された[14]。これを受けて、2009年7月に臓器移植法が改正(2010年7月施行)され、本人の意思が不明な場合でも家族の書面による承諾で脳死臓器提供ができるようになり、日本国内での脳死臓器提供数が増加、また小児(15歳未満)のドナーからの心移植が国内でも実施できるようになった。
各国の心臓移植実施体制
[編集]臓器移植ネットワーク
[編集]臓器移植においてはドナーから摘出された臓器をどのようにして公平に、かつ最適なレシピエントに移植するかという臓器の配分の問題が重要である。そのため、世界の各国・地域で臓器移植のためのネットワークの整備が進んでいる。主なネットワークとして、米国の全米臓器分配ネットワーク機構(United Network for Organ Sharing、UNOS)、ヨーロッパ(特にドイツ・ベルギー・オーストリアなど)のユーロトランスプラント(Eurotransplant)、イギリス・アイルランドのUKトランスプラント、デンマーク・フィンランド・アイスランド・ノルウェー・スウェーデンなど北欧諸国のスカンジナビアトランスプラント(de:Scandiatransplant)などがある。心移植は脳死ドナーからの臓器提供が必要であり、脳死判定、臓器摘出のタイミングが重要な問題となるため明確な脳死基準が求められるが、こうしたネットワークや関連学会を中心として移植に関わるシステムの整備が進んでいる。またこれらは日本臓器移植ネットワークを中心とした日本における臓器移植のシステムを構築する際にも参考にされている[5]。
米国における心臓移植
[編集]米国で心移植が実施出来るのは、上記のUNOSのメンバー施設に限られる[15]。UNOSの患者選択基準では、余命1年以内、手術不可能な重症狭心症、難治性の心室性不整脈、切除不可能な心臓腫瘍の患者が対象となる。移植の適応患者は多いが、実際の移植心の提供の割り当てはUNOSの優先順位基準に従って血液型、体格、ドナー病院からの距離で決まる。
日本における心臓移植実施体制
[編集]本節では日本における心移植の実施体制について述べる。
レシピエントの移植適応条件
[編集]心移植の適応となる疾患は、拡張型心筋症・拡張相肥大型心筋症による重症心不全、虚血性心疾患など、従来の治療法では救命が不可能な重症心疾患である。また移植適応の条件として、
- 長期間または繰り返し入院治療を必要とする心不全
- β遮断薬およびACE阻害薬を含む従来の治療法ではNYHA分類 III~IV度から改善しない心不全
- 現存するいかなる治療法でも無効な致死的重症不整脈を有する症例であること
などが挙げられる[2]。
適応除外条件
[編集]以下の場合は心移植の適応から除外される[10]。
- 心臓以外の重症疾患(肝機能障害・腎機能障害・慢性閉塞性肺疾患・悪性腫瘍・重症自己免疫疾患など)がある場合
- 活動期の消化性潰瘍や感染症、重症糖尿病、重度の肥満および重症の骨粗鬆症のある場合
- アルコール・薬癖、精神疾患のある場合
- 重度の肺高血圧を伴う場合
レシピエント選定の優先順位
[編集]心移植の待機患者がレシピエント候補に選定される優先順位は、虚血許容時間、医学的緊急度、血液型の適合、待機期間の順番で考慮して決定される[3]。
- 虚血許容時間
- ドナー心摘出から4時間以内に血流が再開されること
- 医学的緊急度
- Status 1:補助人工心臓、大動脈内バルーンパンピング、人工呼吸を必要とするか、ICU/CCUに収容されカテコラミンの持続点滴が必要な状態
- Status 2:待機中の患者で上記以外の状態
- Status 3:待機中に除外条件 (感染症等) にて一時的に待機患者としての選択対象から外れた状態
- ABO血液型
- ABO血液型は一致を原則とする。但し適合者への移植も考慮する[注釈 4]。
- 待機期間
- Status 1のレシピエント間では待機期間はStatus 1の状態の延べ日数、またStatus 2では待機期間は登録日からの延べ日数とする。
ドナーの評価
[編集]脳死とされうる状態と診断され、臓器提供の可能性がある場合は、以下のプロセスを経て2回の法的脳死診断が行われ、移植に至るまでに計4回の評価が行われる[16]。
第1次評価
[編集]臓器提供病院に派遣された臓器移植ネットワークのドナーコーディネーターは、まずドナーとしての基本情報を収集し、移植の適応基準と照らしあわせて不適応がないか確認する。適応と判断された場合は、コーディネーターは家族と面談し臓器提供について説明を行う。本人の拒否の意思表示が無く、家族の総意として臓器提供の承諾が得られた場合は臓器摘出承諾書を作成し、同時に脳死判定承諾書を作成する。
なお、ドナーの適応基準には以下の項目が含まれる[10]。
第2次評価
[編集]6歳以上のドナーの場合は第1回の脳死判定終了から第2回の判定まで6時間以上、6歳未満の場合は24時間以上の間隔を置かなければならない。第2回の脳死判定終了時刻が死亡時刻となる[17]。またメディカルコンサルタント(MC)[18]は通常このタイミングで臓器提供病院へ派遣される。ドナー評価に必要な検査についてはMCとコーディネーターが協議して提供病院に依頼し、一般臨床データ・各種画像検査が行われる。
第3次評価
[編集]2回の脳死判定で脳死が確定した後に適合するレシピエントが選定され、移植実施施設へ連絡が入る。移植実施施設ではドナーチームとレシピエントチームを編成し、ドナーチームは提供病院に移動。到着次第移植実施の判断に必要な各種検査を必要に応じて行い、移植の可能性を再確認する。コーディネーターは必要に応じてドナーチームのサポートを行う。
その間移植実施施設では、レシピエントチーム担当医からレシピエント候補の患者への連絡・最終意思確認を行い、患者の術前検査・再評価、手術室・麻酔・輸血・ICU等の各種準備を行う。第3次評価で移植可能であると判断されたらレシピエントへの全身麻酔が導入される[19]。
最終評価
[編集]ドナーチームが臓器の状態を摘出手術中に評価する。心臓の場合は、特に高齢のドナーの場合に冠動脈の硬化・石灰化を触診で調べる。
摘出が終了したら、ドナーチームのうち一部のメンバーは直ちに出発しドナー心を搬送し、残ったメンバーが創閉鎖、死後処置、遺体の見送りなどを行う。またレシピエントチームはドナーチームと連絡を取りながら、最終評価で移植に問題ないことを確認した後にレシピエントに対する皮膚切開を行い手術を開始する[19]。人工心肺開始、大動脈遮断前まで手術を進めておき、ドナー心が到着次第大動脈遮断、レシピエントへの移植手術を開始する。
ドナー・レシピエントの適合条件
[編集]ドナーとレシピエントの適合条件には以下の各項目を考慮する必要がある[2]。
費用
[編集]心移植を受けるのに要する費用は以下の通りである(いずれも2014年現在)[20]。
- 日本臓器移植ネットワーク登録料
- 登録料は3万円である。また移植待機期間中は1年毎に5000円の更新料が必要となる。
- 心移植手術にかかる経費
- 2006年4月の診療報酬改定の際に心移植手術にかかる経費が保険適用となり、患者負担は各種健康保険の自己負担割合分となった。具体的には心臓移植手術費 1,041,000円、心臓採取術費 493,000円、脳死臓器提供管理料 142,000円となっているが、患者の身体障害等級や収入によって自己負担分は変わる(多くの場合自己負担は発生しない)。その他、ドナーチームの交通費・臓器搬送費(チャーター機の場合には100~400万円)については療養費払いとなり、一度全額支払った後に自己負担分を除いて返還される[21]。
- コーディネート経費
- 移植を受けた際に臓器移植ネットワークに支払うコーディネート経費として10万円が必要となる[22]。
移植実施施設
[編集]2015年2月25日現在、日本国内において心臓移植実施施設として認定を受けているのは以下の9施設である[23]。
| 施設名 | 心肺同時移植可 | 11歳未満移植可 |
|---|---|---|
| 国立循環器病研究センター | ○ | ○ |
| 大阪大学医学部附属病院 | ○ | ○ |
| 東京女子医科大学病院 | ○ | |
| 東京大学医学部附属病院 | ○ | |
| 東北大学病院 | ○ | |
| 九州大学病院 | ||
| 北海道大学病院 | ||
| 埼玉医科大学国際医療センター | ||
| 岡山大学病院 |
心臓移植の実際
[編集]ドナー心の摘出手技
[編集]胸骨正中切開で開胸し、視診・触診で最終評価を行った後に、心臓周囲を剥離。その後ヘパリンを投与する。続いて大動脈を遮断し、上下大静脈を遮断・切開して心臓を虚脱させた後に心停止液を注入してドナー心を停止させる。左房、大動脈、肺動脈の順に切離して心臓を摘出し、心保存液に入れて搬送する[10]。
レシピエントの移植術式
[編集]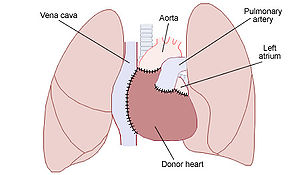
同所性心移植
[編集]臨床の場において行われている心移植の98%以上が同所性心移植(Orthotopic heart transplantation)である。以下にその大まかな手順を述べる[15]。
- 体外循環開始
- レシピエント心摘出
- ドナー心の手術室への到着を確認した後、大動脈を遮断する。VAD装着状態の場合はここでVADを切離、摘出する。大動脈と肺動脈をクランプ・切離した後、以下に述べる術式の違いにより、両心房、あるいは肺静脈を含む左房の一部を残してレシピエントの心臓を摘出する。
- 両心房法
- 両心房法またはLower-Shumway法(LS法)では、レシピエント側の左右心房の一部を残し、両心房を吻合する。心移植の歴史においては当初から30年以上用いられてきた基本的な術式である[24]。
- 両大静脈法
- ドナー心吻合・体外循環離脱
異所性心移植
[編集]異所性心移植(Heterotopic heart transplantation)は、全心移植症例の1~2%以下で行われている[27]。この方法ではレシピエントの心臓は摘出されない。ドナー心は右前胸郭部に置かれて、循環が並行して行われるように吻合する。まずレシピエントとドナーの心房、続いて大動脈が吻合される。二つの肺動脈間を導管で接続し、両方の右室からの血流がレシピエントの肺動脈に血流を送るようにする。同様にレシピエントとドナーの左室はレシピエントの大動脈に血流を送る。高い肺動脈圧に対抗して血液を駆出することに順応したレシピエントの右室は右心拍出量の多くを担当し、一方健康なドナーの左室は左室拍出量に大きく貢献する[28]。
異所性移植が優れているのは以下の様なケースである[15]。
- 重症肺高血圧のレシピエント
- ドナーとレシピエントの体格比が小さい
- ドナー心の虚血時間が長い
異所性移植の欠点は以下の通りである[15]。
術後管理
[編集]
心移植の予後を最も左右するのは早期死亡(3ヶ月以内)であり、原因としては移植心機能不全、急性拒絶反応、および感染症がそれぞれ30%程度である。これらの合併症の予防を念頭に、術後管理の要点について述べる[10]。
拒絶反応の予防(免疫抑制療法)
[編集]心移植後の拒絶反応を予防する免疫抑制療法には、カルシニューリン阻害剤としてサイクロスポリン(CSA)またはタクロリムス(FK)、核酸合成阻害剤としてミコフェノール酸モフェチル(MMF)、ステロイドとしてプレドニゾロンの3剤を併用して用いるのが一般的である。拒絶反応が発症しても特異的な症状や臨床所見を示さないため、最終診断は心筋生検によって行う。臨床的に異常がなくとも定期的に心筋生検を行い、ISHLTの基準[29][30]に従って診断する。
| Grade | 病理組織所見 |
|---|---|
| 0R: none | 拒絶反応無し |
| 1R: mild | 軽度拒絶反応(間質あるいは血管周囲へのリンパ球浸潤を認め、かつ心筋細胞障害が局在性の場合) |
| 2R: moderate | 中等度拒絶反応(炎症細胞浸潤巣の2箇所以上が心筋細胞障害を伴っている場合) |
| 3R: severe | 重度拒絶反応(びまん性の心筋細胞障害) |
感染症の予防
[編集]移植後は免疫抑制剤を服用するために感染症に罹患しやすいが、耐性菌増加に繋がる広域スペクトラムの抗生剤を無闇に使用することは控えるべきである。一般開心術と同様に第1・第2世代の抗生剤にグロブリン製剤を併用する。また移植後3~6ヶ月目までは、アシクロビルとST合剤を服用する。退院後も日和見感染症に罹患しやすいので、定期的なモニタリングと患者自身が感染症の知識を十分に持つことが重要である。
循環管理
[編集]一般の開心術に加え注意すべき点として、移植心は支配神経をもたないいわゆる除神経心である[注釈 7]ため、循環血液量の変動に対応しにくいことを考慮に入れておく必要がある。また心移植後は一時的肺高血圧、肺塞栓、三尖弁閉鎖不全、肺動脈吻合部狭窄などにより右心不全を来すことが多い。プロスタグランジンE1、PDE-III阻害剤、NO吸入が有効であるが、右心補助人工心臓(RVAD)や再移植を必要とすることもある。
移植後冠動脈病変(慢性拒絶反応)
[編集]移植後冠動脈病変とは移植後遠隔期(6ヶ月以降)に発症する冠動脈病変であり、免疫学的機序が引き金となりびまん性に冠動脈の内膜が肥厚し内腔が狭小化する。進行すると再移植しか治療法がない。前述の通り移植心は除神経されており狭心痛を認めないため注意を要する。
心移植後の妊娠
[編集]一般に移植心は、妊娠による生理的変化に対応することが可能である[31]。リトドリンなどの早産防止薬はβ-アドレナリン受容体への感受性を増加させるので、代わりにマグネシウムやニフェジピンなどの使用を検討する。妊娠により移植心が悪影響を受けることはないが、出産後急性拒絶反応の危険性が高くなることには留意する必要がある。
移植実績と長期予後
[編集]移植実績
[編集]ISHLT(国際心肺移植学会)に登録された心移植[32]および心肺同時移植[33][注釈 8]の症例数の推移を示す(1982~2012年)[34]。
| 移植年 | 症例数 |
|---|---|
| 1982 | 187 |
| 1983 | 322 |
| 1984 | 671 |
| 1985 | 1261 |
| 1986 | 2358 |
| 1987 | 2997 |
| 1988 | 3526 |
| 1989 | 3823 |
| 1990 | 4524 |
| 1991 | 4747 |
| 1992 | 4725 |
| 1993 | 4921 |
| 1994 | 4821 |
| 1995 | 4801 |
| 1996 | 4682 |
| 1997 | 4604 |
| 1998 | 4519 |
| 1999 | 4202 |
| 2000 | 4102 |
| 2001 | 4033 |
| 2002 | 3907 |
| 2003 | 3830 |
| 2004 | 3798 |
| 2005 | 3913 |
| 2006 | 3966 |
| 2007 | 3994 |
| 2008 | 3990 |
| 2009 | 4024 |
| 2010 | 4137 |
| 2011 | 4188 |
| 2012 | 4196 |
| 移植年 | 症例数 |
|---|---|
| 1982 | 13 |
| 1983 | 19 |
| 1984 | 36 |
| 1985 | 86 |
| 1986 | 124 |
| 1987 | 170 |
| 1988 | 246 |
| 1989 | 287 |
| 1990 | 278 |
| 1991 | 262 |
| 1992 | 242 |
| 1993 | 214 |
| 1994 | 247 |
| 1995 | 233 |
| 1996 | 167 |
| 1997 | 191 |
| 1998 | 162 |
| 1999 | 169 |
| 2000 | 142 |
| 2001 | 122 |
| 2002 | 112 |
| 2003 | 95 |
| 2004 | 107 |
| 2005 | 101 |
| 2006 | 113 |
| 2007 | 95 |
| 2008 | 94 |
| 2009 | 86 |
| 2010 | 95 |
| 2011 | 69 |
| 2012 | 81 |
日本における移植実績
[編集]以下のデータは1997年に臓器移植法が施行されて以降の、日本での心移植および心肺同時移植の症例数である(2015年1月31日現在)[35]。また、日本循環器学会心臓移植委員会に申請があった症例のうち、報告または予後調査により国外で移植を受けたことが判明した数も参考に示す。
| 移植年 | 国内 | 国外 |
|---|---|---|
| 1997 | 0 | 4 |
| 1998 | 0 | 5 |
| 1999 | 3 | 3 |
| 2000 | 3 | 9 |
| 2001 | 6 | 8 |
| 2002 | 5 | 7 |
| 2003 | 0 | 6 |
| 2004 | 5 | 8 |
| 2005 | 7 | 14 |
| 2006 | 10 | 5 |
| 2007 | 10 | 7 |
| 2008 | 11 | 12 |
| 2009 | 6 | 9 |
| 2010[注釈 9] | 23 | 3 |
| 2011 | 31 | 4 |
| 2012 | 28 | 4 |
| 2013 | 37 | 4 |
| 2014 | 37 | 2 |
| 2015/1/1~1/31(1ヶ月) | 4 | 0 |
| 移植年 | 国内 | 国外 |
|---|---|---|
| 1997 | ‐ | ‐ |
| 1998 | ‐ | ‐ |
| 1999 | ‐ | ‐ |
| 2000 | ‐ | ‐ |
| 2001 | ‐ | ‐ |
| 2002 | ‐ | ‐ |
| 2003 | 0 | 1[注釈 10] |
| 2004 | 0 | 0 |
| 2005 | 0 | 0 |
| 2006 | 0 | 0 |
| 2007 | 0 | 0 |
| 2008 | 0 | 0 |
| 2009 | 1 | 0 |
| 2010 | 0 | 0 |
| 2011 | 0 | 0 |
| 2012 | 0 | 0 |
| 2013 | 1 | 0 |
| 2014 | 0 | 0 |
| 2015/1/1~1/31(1ヵ月) | 0 | 0 |
長期予後と術後のQOL
[編集]ISHLTに登録されている全移植症例の統計によると、世界の心移植成績は5年生存率70%、10年生存率50%程度であるが、2011年10月までの日本での113例の集計によると10年生存率は96%である[36][37]。移植後は多くの患者が社会復帰し、日常生活において全く介護を必要としない者の割合は96%程度である[38]。
日本の心臓移植の課題
[編集]ドナー不足
[編集]臓器移植法改正に伴いドナー提供数が増加したとはいえ、未だ日本では待機患者に対するドナー数が大きく不足している。患者は長い待機期間を強いられており、90%以上の症例が補助人工心臓からのブリッジ症例(BTT)である[39]。心移植に至った患者の待機期間の平均は853日(2012年3月末時点)[19]と、欧米の2ヶ月程度[10]と比較して極めて長い。
小児に対する心臓移植
[編集]成人と異なる小児に対する心移植の特徴として、小児特有の先天性心疾患があること、一般に成人より病期の進行が早いことなどがある。また小児では移植適応を検討するにあたって前述のNYHA分類を当てはめることが困難であるなど、成人に対する心移植とは違った適応判定の基準が求められる[40]。このため日本小児循環器学会では、小児(11歳未満)に対する移植適応基準として「小児心臓移植の適応判定ガイダンス」[41]を策定している。また小児ドナーからの移植実施施設に必要とされる条件として、先天性心疾患を専門とする心臓外科医、小児循環器を専門とする小児科医を擁することが求められている。また2010年の改正臓器移植法では虐待により死亡した児童からの臓器提供が禁止されており、臓器提供施設には虐待防止委員会など虐待の有無を判断する体制が必要条件となっている。それらの要件を考慮し、改正臓器移植法施行に合わせて小児ドナーからの移植実施施設として東京大学医学部附属病院、大阪大学医学部附属病院、国立循環器病研究センターの3施設が日本で初めて認定された。2020年現在では東京女子医科大学病院、小児心臓移植専門認定施設として国立成育医療研究センターが認可されており、計5施設となった。
ブタから人への心臓移植
[編集]豚の心臓を人へ移植する試みが続けられている。
術中写真
[編集]心移植の術中写真。移植された心臓がレシピエントの縦隔内におさまっている。
脚注
[編集]注釈
[編集]- ^ この実験では、ドナー心の心房は収縮したものの心室は1時間待っても収縮しなかった。
- ^ この移植では心臓は術後1時間で拍動を停止した。
- ^ バーナードのケースではドナーの人工呼吸器を外し心停止を確認して5分間待ってから行われたものであり、脳死ドナーからの移植ではない。
- ^ ABO血液型一致の移植に加え、A→AB、B→AB、O→A、O→B、O→ABの移植。
- ^ 閉鎖しておかないと、移植後に右心系の圧が上昇すると右左シャントや低酸素血症が生じやすい。
- ^ ISHLTの急性細胞性拒絶反応の診断基準は1990年に提唱され(ISHLT-1990)、その後2004年に改訂された(ISHLT-2004)。ISHLT-1990の診断基準(0, 1a, 1b, 2, 3a, 3b, 4)との混同を避けるため、0R、1R、2R、3RとR(revisedを意味する)を付けて記載されている。
- ^ 従って、循環作動薬の中ではカテコラミンのように直接作用する薬物には反応するが、自律神経系を介して作用するアトロピンなどには反応しない。
- ^ 肺単独の移植の経験が蓄積されるにつれて心肺同時移植の適応は減少しつつある。肺移植が不可逆性の心不全に至る前に行われるか、または単独の先天性心疾患の心内修復術と合わせて行われると、ほとんどの症例は肺移植だけで十分である。
- ^ 2010年7月 改正臓器移植法施行
- ^ 心肺同時移植の「適応」であったが心移植のみを受けている。
出典
[編集]- ^ Burch, M; Aurora, P (2004). “Current status of paediatric heart, lung, and heart-lung transplantation”. Archives of disease in childhood (BMJ Publishing Group) 89 (4): 386-389. doi:10.1136/adc.2002.017186. PMC 1719883. PMID 15033856.
- ^ a b c “「心臓移植の実際 -周術期管理と成績-」 - 第4回 日本循環器学会プレスセミナー”. 2014年6月22日閲覧。
- ^ a b c d e 福嶌教偉. 第4回リフレッシュセミナー報告 心臓移植. 日本放射線技術学会近畿部会雑誌 第10巻1号, p.65-70. (
 要購読契約)
要購読契約)
- ^ a b “世界の心臓移植の歴史”. 日本心臓移植研究会. 2014年6月22日閲覧。
- ^ a b c d e 太田和夫. “移植グラフィティー(17) 心臓移植への道”. トランスプラント・コミュニケーション. 2014年6月22日閲覧。
- ^ 小柳仁. 心臓移植と心肺移植. クリニシアン No.337, Vol.32. 45-53.
- ^ 川島康生. “『心臓外科、心臓移植の現状と問題点』 T.O.L.(Top Opinion Leader)講義”. 2014年6月22日閲覧。
- ^ 木本誠二、和田寿郎、榊原仟、他「心臓移植をめぐって」『日本胸部疾患学会雑誌』第8巻第2号、社団法人 日本呼吸器学会、1970年、159・160、doi:10.11389/jjrs1963.8.154、ISSN 1883-471X。
なお、この長期生存者3人のうち最長生存記録のブレイバーグ(英語版:Philip Blaiberg)はこの翌月(1969年8月17日)に死亡している。 - ^ 心臓移植アメリカで復活 研究実り、死亡率低下 じん臓移植並みに『朝日新聞』1979年(昭和54年)7月5日夕刊 3版 14面
- ^ a b c d e f g 龍野勝彦, 重松宏, 幕内晴朗, 四津良平, 安達秀雄『心臓血管外科テキスト』中外医学社、2007年、589-596頁。ISBN 9784498039100。全国書誌番号:21390178。
- ^ “日本の心臓移植の歴史”. 日本心臓移植研究会. 2014年6月22日閲覧。
- ^ 旗手俊彦「「脳死臨調最終答申と脳死・臓器移植の展望」」『札幌法学』第3巻第2号、札幌大学、1992年3月、99-130頁、CRID 1050282812527091840。
- ^ 臓器取引と移植ツーリズムに関するイスタンブール宣言 国際移植学会 2008年5月2日 イスタンブール (翻訳 日本移植学会アドホック翻訳委員会)
- ^ 日本医師会. 国民皆保険の崩壊につながりかねない最近の諸問題について -混合診療の全面解禁と医療ツーリズム-. 社会保障審議会 医療部会.
- ^ a b c d Frederick A. Hensley, Jr. 他, 新見能成 監訳. 心臓手術の麻酔 第3版. メディカル・サイエンス・インターナショナル.pp475-498. ISBN 4-89592-373-8.
- ^ Ono M. 脳死臓器提供におけるメディカルコンサルタントの現状と展望. 今日の移植 Vol.26 No.5 2013-09. 415-23, ISSN 09160094. (
 要購読契約)
要購読契約)
- ^ 臓器提供施設の手順書 - 日本臓器移植ネットワーク
- ^ 福嶌教偉、「脳死下臓器提供におけるメディカルコンサルタントの役割」 第45回日本移植学会総会 イブニングセミナー1 脳死移植時代のドナー管理と多臓器摘出手技.
- ^ a b c d 許俊鋭, 高本真一『心不全外科治療の要点と盲点』文光堂〈心臓外科Knack & Pitfalls〉、2012年、190-194頁。ISBN 9784830623349。全国書誌番号:22182832。
- ^ 心不全 - 国立循環器病情報サービス
- ^ I. 心臓[臓器移植ファクトブック2006]
- ^ 移植費用の保険適用 (生体移植除く) - 日本臓器移植ネットワーク
- ^ 移植施設一覧 - 日本臓器移植ネットワーク
- ^ Nisco, Steven J; Reitz, Bruce A (1994). “Developments in cardiac transplantation”. Current opinion in cardiology 9 (2): 237-246. doi:10.1097/00001573-199403000-00014. PMID 8199391.
- ^ Aziz TM, Burgess MI, El-Gamel A, Campbell CS, Rahman AN, Deiraniya AK, Yonan NA. Orthotopic cardiac transplantation technique: a survey of current practice. Ann Thorac Surg. 1999 Oct;68(4):1242-6.
- ^ Kitamura, Soichiro; Nakatani, Takeshi; Bando, Ko; Sasako, Yoshikado; Kobayashi, Junjiro; Yagihara, Toshikatsu (2001). “Modification of bicaval anastomosis technique for orthotopic heart transplantation”. The Annals of thoracic surgery (Elsevier) 72 (4): 1405-1406. doi:10.1016/S0003-4975(01)02894-6.
- ^ 1999 Annual report of the US Scientific Registry of Transplant Recipients and the Organ Procurement and Transplantation Network: transplant data 1989-1998. Rockville, MD: United Network for Organ Sharing, 2000.
- ^ Addonizio, Linda J (1996). “Current status of cardiac transplantation in children”. Current Opinion in Pediatrics (LWW) 8 (5): 520-526. (
 要購読契約)
要購読契約)
- ^ a b Stewart S, Winters GL, Fishbein MC, Tazelaar HD, Kobashigawa J, Abrams J, Andersen CB, Angelini A, Berry GJ, Burke MM, Demetris AJ, Hammond E, Itescu S, Marboe CC, McManus B, Reed EF, Reinsmoen NL, Rodriguez ER, Rose AG, Rose M, Suciu-Focia N, Zeevi A, Billingham ME. Revision of the 1990 working formulation for the standardization of nomenclature in the diagnosis of heart rejection. J Heart Lung Transplant. 2005 Nov;24(11):1710-20. Epub 2005 Jun 20.
- ^ SCVP Endomyocardial Biopsy Tutorial
- ^ Riley, Edward T (1995). “Obstetric management of patients with transplants”. International Anesthesiology Clinics (LWW) 33 (2): 125-140. (
 要購読契約)
要購読契約)
- ^ HEART TRANSPLANTATION Overall. JHLT. 2014 Oct; 33(10): 996-1008. (https://www.ishlt.org/downloadables/slides/2014/heart_overall.pptx)
- ^ HEART-LUNG TRANSPLANTATION Overall. JHLT. 2014 Oct; 33(10): 1009-1024. (https://www.ishlt.org/downloadables/slides/2014/heart_lung_overall.pptx)
- ^ ISHLT Heart/Lung Transplant Registry
- ^ 心臓移植及び心肺同時移植適応検討症例に関する現況 (2015年1月31日現在)[リンク切れ]
- ^ The Registry of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant 3 0: 1071-132, 2011
- ^ 許俊鋭, 西村隆, 小野稔「臓器移植法改正後の心臓移植・補助人工心臓の現況と将来展望」『人工臓器』第41巻第1号、2012年6月、21-23頁、ISSN 03000818。
- ^ 心臓移植の現状と経費について 日本心臓財団
- ^ 許俊鋭, 高本眞一「諸外国に比較してわが国の治療成績が優れている手術 : 「心臓移植」と「補助人工心臓」治療」『日本心臓血管外科学会雑誌』第37巻第4号、日本心臓血管外科学会、2008年、252-253頁、doi:10.4326/jjcvs.37.252、ISSN 0285-1474。
- ^ “「小児における心臓移植の適応基準と施設認定基準」 - 第4回 日本循環器学会プレスセミナー”. 2014年6月22日閲覧。
- ^ 日本小児循環器学会臓器移植委員会.小児心臓移植の適応判定ガイダンス [リンク切れ]
- ^ “世界初のブタ心臓移植を受けた男性が死亡、術後2カ月 アメリカ”. BBC. 2023年11月2日閲覧。
- ^ “ブタからヒトへ2例目の心臓移植が実施、最先端を切り拓く医師たちの挑戦”. Wired. 2023年11月2日閲覧。
- ^ “ブタからの心臓移植、2例目の患者が死亡 術後6週間 米”. CNN.co.jp. 2023年11月2日閲覧。
関連項目
[編集]外部リンク
[編集]- 臓器ごとの移植事情 - 日本臓器移植ネットワーク
- 補助人工心臓・心臓移植 - 国立循環器病研究センター 病院
- ISHLT - 国際心肺移植学会


