相補性決定領域
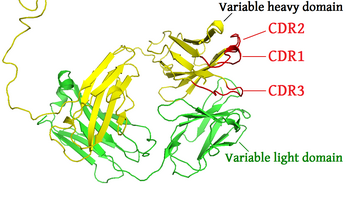
相補性決定領域(そうほせいけっていりょういき、英: complementarity determining region、略称: CDR)は、それぞれB細胞およびT細胞によって作られる免疫グロブリン(抗体)およびT細胞受容体中の可変鎖の一部である。これらの分子は相補性決定領域で特定の抗原と結合する。分子で最も変化しやすい部位であるため、CDRはリンパ球によって作られる抗原特異性の多様性のために極めて重要である。
位置および構造
[編集]
抗原受容体の可変ドメインのアミノ酸配列中には、3つのCDR(CDR1、CDR2、CDR3)があり、これらは連続して配置されていない。抗原受容体は通常(2つの異なるポリペプチド鎖である重鎖と軽鎖上の)2つの可変ドメインからなるため、それぞれの抗原受容体には6つのCDRが存在し、これらは共同で抗原と接触する。単一の抗体分子は2つの抗原受容体を持ち、ゆえに12のCDRを含む。5量体IgM分子には60のCDRが含まれる。
可変「ドメイン」内で、CDR1およびCDR2はポリペプチド鎖の可変(V)領域で見られ、CDR3はV領域の一部、多様性(D)領域(重鎖のみ)および連結(J)領域の全体を含む[1]。CDR3が最も変化しやすい。
免疫グロブリンとT細胞受容体と関連するほとんどの配列の変化はCDRにおいて見られるため、これらの領域は「超可変領域」と呼ばれることがある[2]。これらの中で、CDR3が最も変動が大きい。これはCDR3が軽鎖の場合はVJの再構成、重鎖の場合はVDJの再構成によってコードされるためである。
抗体の三次構造は、新たな抗体を分析、設計するために重要である。抗体のH3ループ以外のCDR領域の3次元構造は、Chothiaら[3]やNorth[4]らによってクラスタリング、分類されている。ホモロジーモデリングはアミノ酸配列から三次構造を構築するための計算手法である。いわゆるH3則はCDR3のモデルを構築するための経験則である[5]。
脚注
[編集]- ^ William E. Paul (2008). Fundamental Immunology (6th ed.). Lippincott Williams & Wilkins. ISBN 0-7817-6519-6
- ^ Abbas AK and Lichtman AH (2003). Cellular and Molecular Immunology (5th ed.). Saunders, Philadelphia. ISBN 0-7216-0008-5
- ^ Al-Lazikani B1, Lesk AM, Chothia C (1997). “Standard conformations for the canonical structures of immunoglobulins”. J. Mol. Biol. 273 (4): 927-948. doi:10.1006/jmbi.1997.1354. PMID 9367782.
- ^ North B, Lehmann A, Dunbrack RL Jr. (2011). “A new clustering of antibody CDR loop conformations”. J. Mol. Biol. 406 (2): 228-256. doi:10.1016/j.jmb.2010.10.030. PMC 3065967. PMID 21035459.
- ^ Shirai H, Kidera A, Nakamura H (1999). “H3-rules: identification of CDR-H3 structures in antibodies”. FEBS Lett. 455 (1-2): 188-197. doi:10.1016/S0014-5793(99)00821-2. PMID 10428499.
