硫化水銀(II)
表示
| 硫化水銀(II) | |
|---|---|
| |

| |
Mercury sulfide | |
| 識別情報 | |
| CAS登録番号 | 1344-48-5 |
| PubChem | 62402 |
| UNII | ZI0T668SF1 |
| EC番号 | 215-696-3 |
| 国連/北米番号 | 2025 |
| |
| |
| 特性 | |
| 化学式 | HgS |
| モル質量 | 232.66 g/mol |
| 密度 | 8.10 g/cm3 |
| 融点 |
580 °C, 853 K, 1076 °F (分解) |
| 水への溶解度 | 不溶 |
| バンドギャップ | 2.1 eV (direct, α-HgS) [1] |
| 磁化率 | −55.4·10−6 cm3/mol |
| 屈折率 (nD) | w=2.905, e=3.256, bire=0.3510 (α-HgS) [2] |
| 熱化学 | |
| 標準生成熱 ΔfH |
−58 kJ·mol−1[3] |
| 標準モルエントロピー S |
78 J·mol−1·K−1[3] |
| 危険性 | |
| 安全データシート(外部リンク) | ICSC 0981 |
| GHSピクトグラム |    
|
| GHSシグナルワード | 警告(WARNING) |
| Hフレーズ | H300, H310, H317, H330, H373, H400, H410 |
| Pフレーズ | P261, P272, P280, P302+352, P321, P333+313, P363, P501 |
| NFPA 704 | |
| 引火点 | Non-flammable |
| 関連する物質 | |
| その他の陰イオン | 酸化水銀 セレン化水銀 テルル化水銀 |
| その他の陽イオン | 硫化亜鉛 硫化カドミウム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
硫化水銀(II)(Mercury sulfide)は、水銀と硫黄からなる化学式HgSの化合物である。水にはほぼ溶けない[4]。
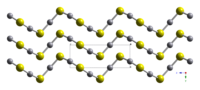
結晶構造
[編集]
硫化水銀(II)は二形であり、2つの結晶構造が存在する。
- 辰砂(赤色、α型、hP6、P3221):水銀が天然に存在する最も一般的な形態。菱面体晶である。結晶の赤色は、光学活性である。これは、構造中のHG-Sの螺旋のためである[5]。
- 黒辰砂(黒色、β型)は天然ではより珍しく、閃亜鉛鉱型の結晶構造を持つ。
合成と化学
[編集]Hg(II)塩を硫化水素で処理すると、β型の黒色固体が沈殿する。この反応は、酢酸水銀の酢酸溶液を用いて、簡便に行われる。このスラリーをゆっくり加熱すると、黒色が赤色に変化する[6]。β型は、濃酸以外とは反応しない[4]。
辰砂を空気中で焙焼し、蒸気を濃縮することで、水銀が得られる[4]。
- HgS → Hg + S
利用
[編集]α型は、朱色の色素に用いられる。朱色が暗くなる傾向は、α型からβ型への変換に起因するとされる。
しかし、もともと赤い壁が暗くなっていたポンペイの発掘においては、恐らく塩化水銀(コルデロアイト、カロメル、タリンガ石)、硫酸カルシウム、石膏等が形成されたため、β型の硫化水銀(II)が検出されなかった[7]。
塩素アルカリ産業(カストナー法)で用いられる水銀電池は水銀排出に関する懸念から段階的に廃止されているため、これらの装置から出る金属水銀は、地下貯蔵のため、硫化水銀に変換される。
バンドギャップが2.1 eVであることとその安定性から、光電気化学セルへの利用が研究されている[8]。
関連項目
[編集]出典
[編集]- ^ L. I. Berger, Semiconductor Materials (1997) CRC Press ISBN 0-8493-8912-7
- ^ Webminerals
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed.. Houghton Mifflin Company. p. A22. ISBN 978-0-618-94690-7
- ^ a b c Greenwood, Norman N.; Earnshaw, A. (1984), Chemistry of the Elements, Oxford: Pergamon, p. 1406, ISBN 0-08-022057-6
- ^ A. M. Glazer, K. Stadnicka (1986). “On the origin of optical activity in crystal structures”. J. Appl. Crystallogr. 19 (2): 108–122. doi:10.1107/S0021889886089823.
- ^ Newell, Lyman C.; Maxson, R. N.; Filson, M. H. (1939). “Red Mercuric Sulfide”. Inorganic Syntheses. Inorganic Syntheses. 1. pp. 19–20. doi:10.1002/9780470132326.ch7. ISBN 9780470132326
- ^ Cotte, M; Susini J; Metrich N; Moscato A; Gratziu C; Bertagnini A; Pagano M (2006). “Blackening of Pompeian Cinnabar Paintings: X-ray Microspectroscopy Analysis”. Anal. Chem. 78 (21): 7484–7492. doi:10.1021/ac0612224. PMID 17073416.
- ^ Davidson, R. S.; Willsher, C. J. (March 1979). “Mercury(II) sulphide: a photo-stable semiconductor” (英語). Nature 278 (5701): 238–239. doi:10.1038/278238a0. ISSN 1476-4687.

