血清蛋白分画
血清蛋白分画(けっせいたんぱくぶんかく、蛋白分画、(英語: Serum protein electrophoresis、SPEP))とは、血清中の各種の蛋白を電気泳動により解析する検査である。
検査の原理と検査法
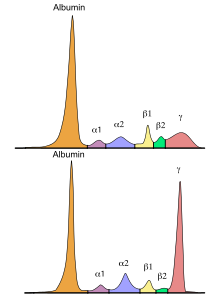
[編集]血清蛋白は血清のおよそ7-8 %程度を占め、100種類以上の蛋白から構成されている。これらの蛋白は両性の電解質であるのでアルカリ性の溶液中では陰性に荷電しており、電圧をかけると、その荷電と反対の電極、すなわち陽極に向けて移動する(電気泳動)。蛋白種により分子量(大きいほうが移動しにくい)や荷電(大きいほうが移動しやすい)などが異なるため、易動度に差が生じ、その結果、5つないし6つの群に分画される。分画は、陽極側から、アルブミン、α1-グロブリン、α2-グロブリン、β-グロブリン(β1-、β2-に分けられることもある)、γ-グロブリン、とよばれる。 各分画の構成比は、各種の炎症、蛋白の体外への漏出、蛋白の欠損、などの病態により特異的な変動を示す。また、泳動パターン(波形)から多発性骨髄腫などで出現する異常なM蛋白 (単クローン性蛋白)[※ 1]の存在を知ることもできる[1][2]。
血清蛋白分画の検査法としては、セルロースアセテート膜を利用した電気泳動法がよく用いられていた。これは試料をセルロースアセテート膜に塗布し、電気泳動の後、蛋白の固定と染色を行い、光学的に濃度を読み取る(デンシトメトリー)ものである[1]。近年は、分解能が高く高速なキャピラリー電気泳動法が主流となってきている[3]。キャピラリー電気泳動法は、ゲルなどの担体を用いず、液体を充填したキャピラリー(通常、シリカ(石英)で作られた毛細管)に電圧をかけて蛋白を分画し、紫外線吸光度により蛋白量を計測するものである[4][5]。
検査の目的・適応
[編集]血清蛋白分画は、単一の検査項目で、さまざまな病態を反映した血清蛋白の各分画の比率を得られる他、泳動パターンから多発性骨髄腫などでみられるM蛋白の存在を検出することができる[6][7]。また、比較的安価な検査でもある。 血清蛋白の各分画の変動は、急性炎症、慢性炎症、蛋白漏出、各種の血清蛋白の欠損症、液性免疫不全など、病態により特異的なパターンを示すことから、蛋白分画は病態像を把握するためのスクリーニング検査として広く用いられてきた。
なお、血清蛋白分画は、M蛋白や一部の蛋白欠損症を除き疾患特異的ではなく、病態全般を把握する検査である。近年は、アルブミン、免疫グロブリン、補体成分、炎症マーカー、など各種の血清蛋白の個別の検査が発達してきていること、および、血清蛋白の泳動パターンの解釈に熟練を要すること[※ 2] 、などから、蛋白分画の検査頻度は減少の傾向にあり、主に、M蛋白のスクリーニングの手段として用いられることが多い[※ 3]とされる[8]。 [6][3]
基準値
[編集]基準値は検査法や施設により異なる。 また、セルロースアセテート膜電気泳動による血清蛋白分画では5分画結果(アルブミン、α1-グロブリン、α2-グロブリン、β-グロブリン、γ-グロブリン)が報告されるのが通常であるが、 近年普及してきたキャピラリー電気泳動では、さらにβ-グロブリンをβ1-グロブリンとβ2-グロブリンにわけた6分画結果が報告されることが多い。
| アルブミン(ALB) | 60.5 ー 73.2 % |
|---|---|
| α1-グロブリン | 1.7 ー 2.9 % |
| α2-グロブリン | 5.3 ー 8.8 % |
| β-グロブリン | 6.4 ー 10.4 % |
| γ-グロブリン | 11 ー 21.1 % |
| アルブミン(ALB) | 55.8 ー 66.1 % |
|---|---|
| α1-グロブリン | 2.9 ー 4.9 % |
| α2-グロブリン | 7.1 ー 11.8 % |
| β1-グロブリン | 4.7 ー 7.2 % |
| β2-グロブリン | 3.2 ー 6.5 % |
| γ-グロブリン | 11.1 ー 18.8 % |
結果の解釈
[編集]
各分画の個々の増減のみならず、分画同士の変動のパターンや泳動像をあわせて解釈する必要がある。 [11]
各分画の増減
[編集]以下、血清蛋白分画の各分画の成分および増減する病態の概要を述べる。[1][12][7][2]
アルブミン
[編集]アルブミンは健常人の血清蛋白のおよそ半分を占める。
アルブミンが単独で増加する病態はしられていない。免疫不全においては免疫グロブリンの減少によりアルブミンの相対的な比率が増えることがある。
アルブミンの減少する病態としては、以下があげられる。
- 体外への喪失(ネフローゼ症候群、蛋白漏出性胃腸症、熱傷、出血、など)
- 合成低下(栄養失調、吸収不良、肝硬変など肝不全)
- 異化(分解)の亢進と合成の抑制(悪性腫瘍、炎症性疾患)
- 無アルブミン血症(まれ)
α1-グロブリン
[編集]α1-グロブリンの主要な成分としては、α1-アンチトリプシン、α1-酸性糖蛋白(いずれも急性相蛋白)があげられる。α1リポタンパク(HDLに相当)もこの分画に含まれる。
α1-グロブリンの増加する病態としては、炎症性疾患(膠原病、悪性腫瘍を含む)があげられる。
α1-グロブリンの減少する病態としては、慢性肝障害・肝硬変による合成低下、ネフローゼ症候群による体外喪失、先天的なα1-アンチトリプシン欠乏症などがある。
α2-グロブリン
[編集]α2-グロブリンの主要な成分としては、α2-マクログロブリン、ハプトグロビン、セルロプラスミン(いずれも急性相蛋白)などがあげられる。
α2-グロブリンの増加する病態としては、急性期蛋白の合成が亢進する各種の炎症性疾患(膠原病、悪性腫瘍を含む)がある。 ネフローゼ症候群においては、アルブミンなど分子量の小さい蛋白が失われ、蛋白合成が全般に亢進するため、分子量の大きいα2-マクログロブリンの増加が目立つ。
α2-グロブリンの減少する病態としては、慢性肝障害による蛋白合成低下、溶血性貧血 (ハプトグロビンがヘモグロビンと結合して失われるため)、などが知られている。
β-グロブリン
[編集]β-グロブリンの主要成分はβリポタンパク(LDL、VLDLに相当)とトランスフェリンである[11]。 セルロースアセテート膜電気泳動ではβ-グロブリンは一つのピークとなるが、 キャピラリー電気泳動ではβ1、β2の分画に分かれる。 β1分画の主要成分はトランスフェリン、ヘモペキシン、β2分画は主に補体第3成分(C3)である。
β-グロブリンの増加する病態としては、鉄欠乏性貧血(トランスフェリン増加のため)、脂質異常症(高脂血症、β-リポ蛋白増加のため)、ネフローゼ症候群、などがある。
β-グロブリンの減少する病態としては、全身性エリテマトーデスなど免疫複合体で補体が消費される病態(C3の低下)、肝疾患による合成低下、炎症性疾患・悪性腫瘍、まれに無トランスフェリン血症がある。
γ-グロブリン
[編集]γ-グロブリンは、主に免疫グロブリンからなり、その大部分はIgGである。 (IgAは主にβ-分画とγ-分画の間に分布する。)
多クローン性のγ-グロブリン増加がみられる疾患としては、肝硬変、膠原病、悪性腫瘍、など慢性炎症性疾患があげられる。多発性骨髄腫などBリンパ球系統の細胞の単クローン性増殖がみられる疾患ではM蛋白増加によりγ-グロブリン増加がみられる。 なお、IgAの増加する病態(肝硬変など)やIgG4の増加する病態(IgG4関連疾患)では、γ-グロブリン増加に加え、β-分画とγ-分画の間の谷が不明瞭になることがあり、β-γ ブリッジングという。
γ-グロブリンの減少する病態としては、免疫不全症でみられることがある無〜低ガンマグロブリン血症、ネフローゼや蛋白漏出性胃腸症などによる体外喪失、などがあげられる。 [6][13]
分画・泳動像のパターン
[編集]血清蛋白分画は、個々の分画の量の増減のみならず、増減のパターンにより病態を解釈することができる。 血清蛋白分画の検査結果報告書には、ソフトウェアにより自動分類したパターンが表記されることが多いが、微量のM蛋白などは見落とされることがあるため、 結果を解釈する場合にはパターンの視認も重要とされる。 以下、代表的なパターンをあげる[6][1][12][7][2]。
- 急性炎症型(高α型)
- 炎症に反応して、α1-アンチトリプシン(α1-分画)、ハプトグロビン(α2-分画)などの急性相蛋白が増加することによる。
- 慢性炎症型(多クローン性高γ・高α型)
- 炎症による急性相蛋白(α-分画)の増加に加え、免疫グロブリン(γ-分画)の増加がみられる。また、アルブミンやβ-分画は減少する。
- 慢性肝障害型/肝硬変型(多クローン性高γ・低α型)
- 慢性炎症により免疫グロブリン(γ-分画)が増加しているが、肝臓の蛋白合成能が低下してきているため、アルブミンやα-分画などは減少している。肝硬変では、IgAの増加のためにβ-分画とγ-分画の間がつながっているようにみえることがある(β-γ ブリッジング)。
- M蛋白型(単一クローン性高γ型)
- 通常、γ-分画にM蛋白[※ 1]による幅の狭い鋭いピークが認められる(β-分画やα2-分画にみられることもある)。M蛋白以外の免疫グロブリン(γ-分画)の減少を伴う場合がある。M蛋白の存在は、多発性骨髄腫、原発性マクログロブリン血症、などのBリンパ球系の腫瘍性疾患の可能性を示唆する[※ 4]
- ネフローゼ型(低γ・高α2・低アルブミン(・高β)型)
- 腎糸球体から低分子量の蛋白が選択的に尿に漏出するため、分子量の低いアルブミンや免疫グロブリンは尿に失われて減少する一方、体内の蛋白合成が全般に亢進するため、尿に失われにくい高分子量の蛋白(α2-分画)の増加がみられる。
- 栄養欠乏型(低アルブミン・低β型)
- アルブミンの著しい減少とβ-分画の低下であり、著しい蛋白摂取不足、吸収不良症候群など、蛋白の欠乏状態でみられる。
- 蛋白漏出型(非選択性蛋白漏出型)
- 蛋白漏出型胃腸症、大出血など、非選択性に蛋白が体外に漏出する病態でみられる。電気泳動パターンは栄養欠乏型と区別困難である。
- 蛋白欠乏型
- 特定の蛋白の欠損症や著しい低下により、特定の分画が低下がみられることがある。例をあげると、無アルブミン血症(アルブミン分画↓↓)、α1-アンチトリプシン欠乏症(α1-グロブリン分画↓)、無トランスフェリン血症(β-グロブリン分画↓)、無〜低ガンマグロブリン血症(γ-グロブリン分画↓)、などがある。
関連する検査
[編集]- 検査材料
医療分野では、通常、血清を材料として蛋白分画を行うが、尿[13]や脳脊髄液[14]など、その他の体液を用いて蛋白分画検査する場合もある。
- 検査対象物質
血清を電気泳動後、脂質を染色することにより、リポ蛋白の分画を行うことがある[15][16]。また、酵素活性を検出して酵素のアイソザイムの異常を分析することがある[16]。
- 抗原抗体反応との組み合わせ
血清蛋白の電気泳動にさらに抗原抗体反応を組み合わせた検査法として、免疫電気泳動、免疫固定法(免疫固定電気泳動)、などがあり、電気泳動のみでは検出が難しい微量のM蛋白の検索に用いられることがある[6][2][17]。
歴史
[編集]スウェーデンの生化学者、ウィルヘルム・ティセリウス(Arne Wilhelm Kaurin Tiselius、1902-1971)は1930年代に電気泳動法 の改良を進め、1937年には血清蛋白の分画装置を発表した。 また、血清蛋白がアルブミンと3つのグロブリンに分画されることを見出し、後者をα-グロブリン、β-グロブリン、γ-グロブリンと命名した。 ティセリウスはこの業績などにより1948年のノーベル化学賞を受賞した[18][19]。
ティセリウスの電気泳動装置は水溶液のみで担体をもちいないものであり、扱いが煩雑であった。[20] 第二次大戦後、膜やゲルなどの担体(支持体)をもちいる電気泳動法が発達し広く用いられるようになった。[18] 臨床検査で広く使われるセルロースアセテート膜電気泳動法は、1957年に、英国のコーン(Joachim Kohn、1912-1987)が発表した。 1978年には、セルロースアセテート膜電気泳動法を全自動化する血清蛋白分画装置が日本で開発され、広く普及した[21][20]。
キャピラリー電気泳動法は、1981年にジョルゲンソン(James W. Jorgenson)らによって発表された。高速で分解能が高いことにより、近年は、セルロースアセテート膜電気泳動法にかわる血清蛋白分画法として普及してきている[22][5][18]。
脚注
[編集]- ^ a b 免疫グロブリンはBリンパ球系の形質細胞が産生するが、多様な抗原に対応するため、Bリンパ球の分化の段階で遺伝子がランダムに組み換えられて、クローンごとに固有のアミノ酸配列をもつ免疫グロブリン(抗体)が産生されている。 多発性骨髄腫のように形質細胞のあるクローンが腫瘍性に増殖する場合、各腫瘍細胞は同一の免疫グロブリン(ないし、その構成成分)を産生する。 これを、M蛋白、ないし、パラプロテイン(paraprotein)という。なお、M蛋白の「M」は、monoclonal(モノクローナル、単一クローン性)、ないし、myeloma(骨髄腫)の頭文字である。
- ^ 近年は、血清蛋白分画検査装置で自動的にパターンを判定することが多い。ただし、微量のM蛋白は機械では見落とされることがある。
- ^ 原爆被爆者を対象とする健診においても、がん検診の一環として、多発性骨髄腫のスクリーニング目的で血清蛋白分画検査が行われることがある。
- ^ 腫瘍以外に、感染症などで特定の抗原に対する大量の抗体が産生されてM蛋白に類似のパターンを呈することがありうる。
出典
[編集]- ^ a b c d “血清蛋白電気泳動法”. 信州大学モジュール教材. 2024年1月21日閲覧。
- ^ a b c d “血清蛋白異常症における電気泳動解析の基礎と判読のポイント”. 2024年1月5日閲覧。
- ^ a b 櫻林郁之介 編『今日の臨床検査2021-2022』南江堂、2021年5月15日、267-268頁。ISBN 978-4-524-22803-4。
- ^ “キャピラリー電気泳動の基礎知識”. Chem-Station. 2024年1月21日閲覧。
- ^ a b 真鍋敬 (1996). “キャピラリー電気泳動による蛋白質分析の展望と課題”. 生物物理化学 40 (3): 155–159. doi:10.2198/sbk.40.155.
- ^ a b c d e f 高久史麿 編『臨床検査データブック2023-2024』医学書院、2023年1月15日、110-113頁。ISBN 978-4-260-05009-8。
- ^ a b c 河合忠 (1977). “セルロースアセテート電気泳動法による血清蛋白分画の臨床的意義”. 生物物理化学 21 (3): 159–167. doi:10.2198/sbk.21.159.
- ^ 井本真由美, 山田俊幸, 上硲俊法 (2017). “血清蛋白分画検査を院内で実施する意義”. 電気泳動 61 (2): 74–78. doi:10.2198/electroph.61.74 2024年1月3日閲覧。.
- ^ “HDSD-2203.pdf”. 2024年1月7日閲覧。
- ^ “蛋白分画(PR-F)|蛋白|生化学検査|WEB総合検査案内|臨床検査|LSIメディエンス”. LSIメディエンス. 2024年1月7日閲覧。
- ^ a b 金井正光 編『臨床検査法提要』(改定第31版)金原出版株式会社、1998年、481-490頁。ISBN 4-307-05033-9。
- ^ a b 右田俊介 (1973). “血清蛋白分画測定の意義”. 臨床化学 2 (1): 1–15. doi:10.14921/jscc1971b.2.1_1.
- ^ a b 芝紀代子 (2011). “電気泳動法による診断に有用な尿蛋白解析と尿プロテオーム解析”. 生物試料分析 34: 111-119.
- ^ Ninomiya, Takahiro (1983). “Cerebro-spinal fluid (CSF) protein fractions and immunoglobulins in various neurological diseases.”. Journal of Nippon Medical School 50 (3): 420–426. doi:10.1272/jnms1923.50.420 2024年1月7日閲覧。.
- ^ 松下 誠, 山口 奈摘美, 田中 満里奈 (2021). “酵素法でコレステロールとトリグリセライドを染色する全自動リポ蛋白分画法の考案”. 電気泳動 65 (2): 69–73. doi:10.2198/electroph.65.69.
- ^ a b 河合忠 (1980). “臨床検査領域における電気泳動法の有用性”. 生物物理化学 23: 329-333.
- ^ Katzmann, Jerry A (2009). “Screening Panels for Monoclonal Gammopathies: Time to Change”. The Clinical Biochemist Reviews 30 (3): 105–111. ISSN 0159-8090. PMC PMC2754998. PMID 19841692 2024年1月6日閲覧。.
- ^ a b c 菅野浩 (1977). “電気泳動法の発展の歴史”. 生物物理化学 21: 151-158. doi:10.2198/sbk.21.151}.
- ^ “The Nobel Prize in Chemistry 1948”. NobelPrize.org. 2024年1月4日閲覧。
- ^ a b “蛋白分画の検査と臨床的意義”. 広島市医師会. 2024年1月21日閲覧。
- ^ Rocco, Richard M (2005-10-01). “Joachim Kohn (1912–1987) and the Origin of Cellulose Acetate Electrophoresis”. Clinical Chemistry 51 (10): 1896–1901. doi:10.1373/clinchem.2005.056572 2024年1月7日閲覧。.
- ^ Jorgenson, James W.; Lukacs, Krynn DeArman. (1981-07-01). “Zone electrophoresis in open-tubular glass capillaries”. Analytical Chemistry 53 (8): 1298–1302. doi:10.1021/ac00231a037. ISSN 0003-2700 2024年1月21日閲覧。.
関連項目
[編集]- 血清総蛋白
- アルブミン
- アルブミン/グロブリン比
- グロブリン
- αグロブリン
- βグロブリン
- γグロブリン、免疫グロブリン
- 電気泳動、キャピラリー電気泳動、免疫電気泳動 、免疫固定法、ウェスタンブロッティング
- 臨床検査
