酢酸ロジウム(II)
表示
| 酢酸ロジウム(II) | |
|---|---|

| |

| |
Rhodium(II) acetate | |
別称 Dirhodium tetraacetate, Tetrakis(acetato)dirhodium(II), Rhodium diacetate dimer, Tetrakis(μ-acetato)dirhodium | |
| 識別情報 | |
| CAS登録番号 | 15956-28-2 |
| PubChem | 152122 |
| ChemSpider | 20370 |
| UNII | NK3058Z56X |
| EC番号 | 240-084-8 |
| RTECS番号 | VI9361000 |
| |
| |
| 特性 | |
| 化学式 | C8H12O8Rh2 |
| モル質量 | 441.99 g/mol |
| 外観 | Emerald green powder |
| 密度 | 1.126 g/cm3 |
| 融点 |
>100 °C |
| 沸点 |
decomposes |
| 水への溶解度 | soluble |
| other solventsへの溶解度 | polar organic solvents |
| 構造 | |
| 結晶構造 | monoclinic |
| 配位構造 | octahedral |
| 双極子モーメント | 0 D |
| 危険性 | |
| 安全データシート(外部リンク) | Coleparmer MSDS |
| NFPA 704 | |
| Rフレーズ | 36/38 |
| Sフレーズ | 15, 26, 28A, 37/39 |
| 引火点 | low flammability |
| 関連する物質 | |
| 関連物質 | 酢酸銅(II) 酢酸クロム(II) 酢酸モリブデン(II) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
酢酸ロジウム(II)(Rhodium(II) acetate)は、式Rh2(AcO)4で表される配位化合物である。AcO-は酢酸イオン(CH3CO−
2)を示す。暗緑色の粉末で、水などの極性溶媒にはわずかに溶解する。アルケンのシクロプロパン化の触媒として使用される。遷移金属カルボン酸錯体の例として、広く研究されている。
合成
[編集]通常、水和した塩化ロジウム(III)を酢酸(AcOH)で加熱することにより調製される[1]。
構造・性質
[編集]4つの酢酸酸素原子、水、もう一つのRh原子が頂点に位置する八面体形分子構造を持つ一対のRh原子を特徴とする。Rh-Rh結合長は239pm。水配位子は交換可能で、他のさまざまなルイス塩基が結合できる[2]。酢酸銅(II)、酢酸クロム(II)、酢酸モリブデン(II)も同様の構造をとる。
酢酸基は配位子交換反応により他のカルボン酸基や関連基に置換できる[3]。
化学的性質
[編集]有機合成の分野で[4]、結合への挿入、アルケン[5]や芳香族[6]のシクロプロパン化など、幅広い応用が可能である。
構造の類似する酢酸銅(II)はデオキシリボヌクレオシドよりリボヌクレオシドへの親和性が高いが、酢酸ロジウム(II)にこの性質はない。代わりに、酢酸ロジウム(II)は他のヌクレオシドよりアデノシンへの親和性が高い[7]。
選択的触媒反応
[編集]C-H結合やX-H結合(X=N、S、O)への挿入のための触媒としても使用される。
- シクロプロパン化
- 芳香族への環化付加反応
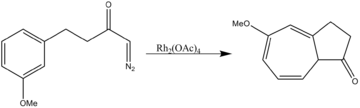
2成分系の環化付加反応だけでなく、3成分系の1,3-双極性環化付加反応も触媒する。
- C–H結合の挿入
- アルコールの酸化
- X–H結合の挿入(X=N、S、O)
出典
[編集]- ^ Rempel, G. A.; Legzdins, P.; Smith, H.; Wilkinson, G. (1972). Tetrakis(acetato)dirhodium(II) and Similar Carboxylato Compounds. Inorganic Syntheses. 13. 90–91. doi:10.1002/9780470132449.ch16. ISBN 9780470132449
- ^ Cotton, F. A.; Deboer, B. G.; Laprade, M. D.; Pipal, J. R.; Ucko, D. A. (1971). “The crystal and molecular structures of dichromium tetraacetate dihydrate and dirhodium tetraacetate dihydrate”. Acta Crystallogr B 27 (8): 1664. doi:10.1107/S0567740871004527.
- ^ Doyle, M. P. (2000). “Asymmetric Addition and Insertion Reactions of Catalytically-Generated Metal Carbenes”. In Ojima, Iwao. Catalytic Asymmetric Synthesis (2nd ed.). New York: Wiley. ISBN 978-0-471-29805-2
- ^ Paulissen, R.; Reimlinger, H.; Hayez, E.; Hubert, A. J.; Teyssié, P. (1973). “Transition metal catalysed reactions of diazocompounds. II: Insertion in the hydroxylic bond”. Tetrahedron Lett. 14 (24): 2233. doi:10.1016/S0040-4039(01)87603-6.
- ^ Hubert, A. J.; Feron, A.; Warin, R.; Teyssie, P. (1976). “Synthesis of iminoaziridines from carbodiimides and diazoesters : A new example of transition metal salt catalysed reactions of carbenes”. Tetrahedron Lett. 17 (16): 1317. doi:10.1016/S0040-4039(00)78050-6.
- ^ Anciaux, A. J.; Demonceau, A.; Hubert, A. J.; Noels, A. F.; Petiniot, N.; Teyssié, P. (1980). “Catalytic control of reactions of dipoles and carbenes; an easy and efficient synthesis of cycloheptatrienes from aromatic compounds by an extension of Buchner's reaction”. J. Chem. Soc., Chem. Commun. (16): 765–766. doi:10.1039/C39800000765.
- ^ Waysbort, D., E. Tarien, and G. L. Eichhorn (1993). “Nature of the specific interaction of rhodium acetate dimer with adenosin”. Inorganic Chemistry 32 (22): 4774-4779. doi:10.1021/ic00074a020.







