UVR8
| UV-B resistance 8 (UVR8) | |||||||
|---|---|---|---|---|---|---|---|
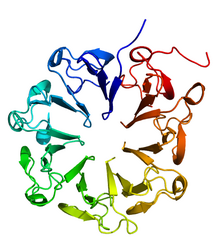 UVR8の結晶構造[1] | |||||||
| 識別子 | |||||||
| 由来生物 | |||||||
| 3文字略号 | UVR8 | ||||||
| Entrez | 836506 | ||||||
| PDB | 4DNW More structures | ||||||
| RefSeq (mRNA) | NM_125781 | ||||||
| RefSeq (Prot) | NP_201191 | ||||||
| UniProt | Q9XHD7 | ||||||
| 他データ | |||||||
| 染色体 | 5: 25.55 - 25.56 Mb | ||||||
| |||||||
UV-B RESISTANCE LOCUS 8 (UVR8)は、植物において紫外線のうちUV-Bの受容体としてはたらくタンパク質である[2][3]。波長280-315 nmの紫外線を受容して、植物のストレス応答を開始する役割を担っている。UV-Bの下限波長に近い波長285 nmで最も感度が高い。UVR8は植物のUV-B応答における必須の調節因子として、モデル植物のシロイヌナズナArabidopsis thaliana において初めて同定された。この時、UVR8に突然変異が起きたシロイヌナズナでは、UV-BによるDNA損傷の影響を受けやすいことが発見された[4]。植物における他の光受容体と異なるUVR8の特徴として、発色団となる補助的な小分子を必要とせず、タンパク質自体に光受容の能力が備わっていることが挙げられる[5]。タンパク質中に存在する3つ組のトリプトファン残基が発色団としてUV-Bセンサーの機能を果たしていると考えられている[2][6]。
進化
[編集]これまでに全ゲノムが解読された被子植物の中でも、バイオインフォマティクスの解析から多くのUVR8オーソログが存在することが示唆されている。UVR8中の重要なアミノ酸残基の数や位置は被子植物の間ではもちろん、例えばクラミドモナスChlamydomonas reinhardtii やボルボックスVolvox carteri といったその他の植物や藻類においてもよく保存されている。したがって、UVR8は維管束植物の出現よりも前に緑色植物の系統で獲得されていたことが示唆される。このことは、当時の地球ではオゾン層が十分に発達しておらず地表に届くUV-Bの量が現在よりも多かったため、UV-Bへの防御と馴化が非常に重要であったと推測できることを考えると、合理的だと言える[7]。
構造
[編集]UVR8はβプロペラ構造をとるタンパク質で、7つの羽根状のβシート構造をもつ。ヒトのRCC1タンパク質といった、哺乳類でクロマチンの凝集を制御しているタンパク質とアミノ酸配列上の相同性を示す。暗状態ではUVR8はホモ二量体を形成し細胞質に局在するが、UV-B照射を受けるとUVR8二量体は解離し、モノマーとなって核へ移行する[8]。暗状態下でのUVR8の二量体は塩橋構造によって安定化されている[2]。
機能
[編集]UV-Bの照射を受けると、その光はUVR8のトリプトファン残基に吸収される。トリプトファン残基は暗状態では隣り合うアルギニン残基との間で塩橋をつくってUVR8二量体を安定化しているが、光の吸収によってこの塩橋が解消され、UVR8の単量体化が誘導されると考えられている[2][3]。単量体化したUVR8は核に蓄積し、CONSTITUTIVELY PHOTOMORPHOGENIC 1 (COP1) タンパク質と相互作用する。COP1は通常E3ユビキチンリガーゼとして、光形態形成に関わる転写因子をユビキチン化し、プロテアソームでの分解へと導く役割を果たしている。しかしながら、UVR8と相互作用した際COP1は、UVR8を介したUV-Bストレス応答における正の制御因子としてはたらいている[9]。UV-B照射後はUVR8はCOP1のC末端にあるWD40リピートを介してCOP1と核内で相互作用し[10]、UV-B応答において鍵転写因子としてはたらいているELONGATED HYPOCOTYL 5 (HY5) タンパク質の発現を誘導する。HY5はUV-B応答に関わるいくつかの遺伝子の発現を誘導する。この過程により最終的にはフラボノイドやアントシアニンといった紫外線捕捉剤として機能する分子の生合成などが誘導され、UV-Bへの馴化が達成されることになる[6][11]。
出典
[編集]- ^ 4dnw; “Structural basis of ultraviolet-B perception by UVR8”. Nature 484 (7393): 214–9. (April 2012). doi:10.1038/nature10931. PMID 22388820.
- ^ a b c d “Plant UVR8 Photoreceptor Senses UV-B by Tryptophan-Mediated Disruption of Cross-Dimer Salt Bridges”. Science 335 (6075): 1492–6. (February 2012). doi:10.1126/science.1218091. PMC 3505452. PMID 22323738.
- ^ a b “Perception of UV-B by the Arabidopsis UVR8 protein”. Science 332 (6025): 103–6. (April 2011). doi:10.1126/science.1200660. PMID 21454788.
- ^ “Arabidopsis UVR8 regulates ultraviolet-B signal transduction and tolerance and contains sequence similarity to human regulator of chromatin condensation 1”. Plant Physiol. 130 (1): 234–43. (September 2002). doi:10.1104/pp.005041. PMC 166556. PMID 12226503.
- ^ Ulm, Roman; Jenkins, Gareth I (2015-06-30). “Q&A: How do plants sense and respond to UV-B radiation?” (英語). BMC Biology 13 (1): 45. doi:10.1186/s12915-015-0156-y. PMC 4484705. PMID 26123292.
- ^ a b 德富哲・岡島公司・吉原静恵「紫外光から遠赤色光まで,多様な植物光受容体」『生物物理』第55巻第4号、2015年、181-186頁、doi:10.2142/biophys.55.181。
- ^ Rizzini L (2010). "3.4 Evolutionary and Structural Considerations" (PDF). UVR8: a plant UV-B photoreceptor (Ph.D.). Albert-Ludwigs-Universität Freiburg.
- ^ “Interaction of the Arabidopsis UV-B-specific signaling component UVR8 with chromatin”. Mol Plant 1 (1): 118–28. (January 2008). doi:10.1093/mp/ssm012. PMID 20031919.
- ^ “Signal transduction in responses to UV-B radiation”. Annu Rev Plant Biol 60 ( ): 407–31. (2009). doi:10.1146/annurev.arplant.59.032607.092953. PMID 19400728.
- ^ “C-terminal region of the UV-B photoreceptor UVR8 initiates signaling through interaction with the COP1 protein”. Proc. Natl. Acad. Sci. U.S.A. 109 (40): 16366–70. (October 2012). doi:10.1073/pnas.1210898109. PMC 3479605. PMID 22988111.
- ^ “UV-B photoreceptor-mediated signalling in plants”. Trends Plant Sci. 17 (4): 230–7. (April 2012). doi:10.1016/j.tplants.2012.01.007. PMID 22326562.
