チオシアン酸塩
| チオシアン酸イオン | |
|---|---|

| |
チオシアン酸イオン | |
| 識別情報 | |
| PubChem | 9322 |
| |
| 特性 | |
| 化学式 | CNS- |
| モル質量 | 58.0824 g/mol |
| 熱化学 | |
| 標準生成熱 ΔfH |
76.44 kJ mol−1(水溶液)[1] |
| 標準モルエントロピー S |
144.3 J mol−1K−1(水溶液) |
| 標準定圧モル比熱, Cp |
−40.2 J mol−1K−1(水溶液) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
チオシアン酸塩(チオシアンさんえん、英: thiocyanate, sulphocyanate, thiocyanide, rhodanide)は、チオシアン酸の共役塩基である [SCN]- イオンを含む化合物である。チオシアン酸塩は一般に無色であり、チオシアン酸ナトリウム、チオシアン酸カリウムなどがある。チオシアン酸水銀(II)は以前は花火の打ち上げに使われていた。
チオシアン酸塩はシアン酸イオン [OCN]- の酸素が硫黄に置換されたアナログである。また、[SCN]- はハライドイオンとその反応が類似していることから擬ハロゲンの一つである。チオシアン酸塩は鉄との錯体が赤色であることから、以前はロダニド(英: rhodanide、ギリシア語のバラから)として知られていた。
合成
[編集]チオシアン酸塩はシアニドと単体硫黄またはチオ硫酸塩との反応で合成される。
後者の反応はロダナーゼとして知られるスルホトランスフェラーゼによって触媒される。これは、体内でのシアニドの解毒作用に関連している。
構造、結合、錯体化学
[編集]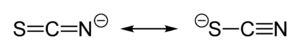
チオシアン酸イオンはその負電荷を硫黄と窒素の間で等しく分配しているため、硫黄または窒素のどちらも求核試薬として作用する両座配位子である。また、[SCN]- は2個 (M-SCN-M) または3個 (>SCN- or -SCN<) の金属原子を架橋することもできる。経験則から、硬い酸を形成する金属、例えばクロム(III)、コバルト(III)およびニッケル(II)とは N -結合性チオシアン酸錯体を、軟らかい酸を形成する金属、例えば銀(I)、カドミウム(II)および水銀(II)とは S -結合性チオシアン酸錯体を形成しやすいことが分かっている。この他、反応速度および溶解度もしばしば結合の異性化に関与する(例: と )[2]。
チオシアン酸銀は結晶中で のような一次元鎖を形成している。
性質
[編集]アルカリ金属およびアルカリ土類金属のチオシアン酸塩は水に可溶で潮解性のものも多いが、銅(I)塩、銀(I)塩、水銀(II)塩は難溶性、鉛塩も冷水には難溶性で、溶解度の挙動は塩化物に類似する。
また難溶性の塩も過剰のアルカリ金属チオシアン酸塩存在下では錯体を形成して溶解度が増す。
鉄(III)イオンの検出
[編集]
チオシアン酸イオンを鉄(III)イオンを含む溶液に加えるとペンタアクア(チオシアナト-N)鉄(III)イオン[Fe(NCS)(H2O)5]2+ を形成し、血赤色溶液となる。
脚注
[編集]- ^ D.D. Wagman, W.H. Evans, V.B. Parker, R.H. Schumm, I. Halow, S.M. Bailey, K.L. Churney, R.I. Nuttal, K.L. Churney and R.I. Nuttal, The NBS tables of chemical thermodynamics properties, J. Phys. Chem. Ref. Data 11 Suppl. 2 (1982).
- ^ グリーンウッド, ノーマン; アーンショウ, アラン (1997). Chemistry of the Elements (英語) (2nd ed.). バターワース=ハイネマン. ISBN 978-0-08-037941-8。 p.326



![{\displaystyle {\ce {[Co(NH3)5(NCS)]Cl2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/abba8aaf270e472352b451f47a9bd70ff14b119c)
![{\displaystyle {\ce {[Co(NH3)5(SCN)]Cl2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d17a4139accd1bf8d51d587a59e3cc115346c303)

![{\displaystyle {\ce {AgSCN\ +SCN^{-}(aq)\ \rightleftarrows \ [Ag(SCN)2]^{-}(aq)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2e58ae95bee51e8a59c1075922b0e861ac400b4a)