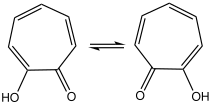
トロポロン
この項目「トロポロン」は翻訳されたばかりのものです。不自然あるいは曖昧な表現などが含まれる可能性があり、このままでは読みづらいかもしれません。(原文:en: Tropolone) 修正、加筆に協力し、現在の表現をより自然な表現にして下さる方を求めています。ノートページや履歴も参照してください。(2024年3月) |
| トロポロン[1] | |
|---|---|

|
|
2-Hydroxycyclohepta-2,4,6-trien-1-one | |
別称 2-ヒドロキシトロポン; プルプロカテコール; パープロカテコール | |
| 識別情報 | |
| CAS登録番号 | 533-75-5 |
| PubChem | 10789 |
| ChemSpider | 10333 |
| UNII | 7L6DL16P1T |
| EC番号 | 208-577-2 |
| KEGG | C15474 |
| MeSH | D014334 |
| ChEBI | |
| ChEMBL | CHEMBL121188 |
| |
| |
| 特性 | |
| 化学式 | C 7H 6O 2 |
| モル質量 | 122.12 g/mol |
| 融点 |
50 - 52 °C, 271 K, -12 °F |
| 沸点 |
80 - 84 °C, 269 K, -39 °F ((0.1 mmHg)) |
| 酸解離定数 pKa | 6.89 (共役酸: -0.5) |
| 磁化率 | −61×10−6 cm3/mol |
| 危険性 | |
| GHSピクトグラム |   
|
| GHSシグナルワード | 危険(DANGER) |
| Hフレーズ | H314, H317, H410 |
| Pフレーズ | P260, P261, P264, P272, P273, P280, P301+330+331, P302+352, P303+361+353, P304+340, P305+351+338, P310, P333+313, P363 |
| 引火点 | 112 °C (234 °F; 385 K) |
| 関連する物質 | |
| 関連物質 | Hinokitiol (4-isopropyl-tropolone) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
α-トロポロン(英: α-tropolone) 、または単にトロポロンとは、分子式C
7H
5(OH)Oで表わされる有機化合物である。淡黄色を呈する固体であり、有機溶媒によくとける。その特異な電子状態への興味や配位子前駆体としての役割から研究されている。実際の合成時にトロポンを出発物質とすることはほとんどないが、トロポンの2位にヒドロキシ基が導入された誘導体とみなすことができる。
合成法
[編集]トロポロンの合成法は数多くのものが開発されている[2]。その1つとして、1,2-シクロヘプタジオンをN-ブロモスクシンイミドにより臭素化したのち、加熱して脱ハロゲン化水素する方法があげられる(下図左の経路)。もうひとつは、 ピメリン酸のエチルエステルからアシロイン縮合により得られるアシロインを臭素により酸化する方法があげられる(下図右経路)[3]。
さらに別の経路として、シクロペンタジエンとケテンの一種とを[2+2] 環化付加反応させビシクロ[3.2.0]ヘプチル構造を得たのち、 加水分解により結合を解離させて単環化する方法もある[2]。
性質
[編集]トロポロンのヒドロキシ基は酸性を示し、pKa の値は7である。この値はフェノール(10)と安息香酸(4)の中間に位置する。フェノールにくらべ酸性が強い理由は、カルボニル基がビニローグ的カルボン酸構造との共鳴安定化をうけるためと説明される[3]。
トロポロンは容易にO-アルキル化を受け、シクロヘプタトリエニル誘導体を生じるため、合成中間体として有用である[4] 。金属カチオン存在下では脱プロトン化されて2座配位子となり、Cu(O
2C
7H
5)
2のような錯体を生じる[3]。
多くのトロポン類と同様、トロポロンのカルボニル基は強く分極しており、ヒドロキシ基との間に強い水素結合を生じるため、溶液中では高速な互変異性化反応を起こしており、NMRのタイムスケールでは対称な構造に見える[5]。固体状態でも速度は遅くなるが互変異性化する[6]。
自然界での分布
[編集]およそ200ほどのトロポロン誘導体が自然に得られており、主に植物および菌類により産生される[7]。トロポロン誘導体としては、ドラブリン、ドラブリノール、ツヤプリシン、ツヤプリシノール、スチピタト酸、スチピタトン酸、ノオトカチン、ノオトカチノール、プベルル酸、プベルロン酸、セペドニン、4-アセチルトロポン、pygmaein, isopygmaein, procein, カノーチン、ベンゾトロポロン類、(プルプロガリン、クロシポジン、グピオロン A および B)、テアフラビンおよびその誘導体、ブロモトロポロン類、トロポイソキノリン類、トロポロイソキノリン類(grandirubrine, イメルブリン、イソイメルブリン、パレイトロポン, パレイルブリン AおよびB)、コルヒチン、コルヒコンなどが知られる[8]。トロポロンはポリケチド経路にあらわれ、フェノール系中間体から環拡張により得られる[4]。
ヒノキ科やユリ科の植物種に特によくみられる[7]。トロポロン類がもっとも多量に見られるのは心材部、葉部、樹皮部であり、その精油には様々なトロポロン類が豊富に含まれる。自然界でトロポロン誘導体が研究・単離されはじめたのは1930年代中期から1940年代初頭にかけてで[9] 、アメリカネズコ、アスナロ、ヒノキ、タイワンヒノキ、スペインビャクシンなどの樹木から同定された。初めて合成されたトロポロン類はツヤプリシンで、Ralph Raphaelにより合成された[10]。
生活性
[編集]ブドウのポリフェノールオキシダーゼ およびマッシュルームのチロシナーゼインヒビターとしてはたらく。
トロポロン誘導体
[編集]| 化合物名 | 骨格式 | 自然産生者 |
|---|---|---|
| トロポロン |  |
Pseudomonas lindbergii, Pseudomonas plantarii[11] |
| ヒノキチオール |  |
ヒノキ科樹木[12] |
| スチピタト酸 |  |
Talaromyces stipitatus[13] |
| コルヒチン |  |
Colchicum autumnale, Gloriosa superba[14] |
出典
[編集]- ^ Tropolone[リンク切れ] at Sigma-Aldrich
- ^ a b Minns, Richard A. (1977). “Tropolone”. Org. Synth. 57: 117. doi:10.15227/orgsyn.057.0117.
- ^ a b c Pauson, Peter L. (1955). “Tropones and Tropolones”. Chem. Rev. 55 (1): 9–136. doi:10.1021/cr50001a002.
- ^ a b Pietra, F. (1973). “Seven-membered conjugated carbo- and heterocyclic compounds and their homoconjugated analogs and metal complexes. Synthesis, biosynthesis, structure, and reactivity”. Chemical Reviews 73 (4): 293–364. doi:10.1021/cr60284a002.
- ^ Jin, Lehong (February 1987). Detoxification of thujaplicins in living western red cedar (Thuja plicata Donn.) trees by microorganisms (Thesis).
- ^ Takegoshi, K.; Hikichi, Kunio (1993-10). “Tautomeric proton transfer of tropolone included in .alpha.- and .beta.-cyclodextrins” (英語). Journal of the American Chemical Society 115 (21): 9747–9749. doi:10.1021/ja00074a047. ISSN 0002-7863.
- ^ a b c d e Zhao, Jian Zhao and Jian (30 September 2007). “Plant Troponoids: Chemistry, Biological Activity, and Biosynthesis”. Current Medicinal Chemistry 14 (24): 2597–2621. doi:10.2174/092986707782023253. PMID 17979713.
- ^ a b c Liu, Na; Song, Wangze; Schienebeck, Casi M.; Zhang, Min; Tang, Weiping (December 2014). “Synthesis of naturally occurring tropones and tropolones”. Tetrahedron 70 (49): 9281–9305. doi:10.1016/j.tet.2014.07.065. PMC 4228802. PMID 25400298.
- ^ Nakanishi, Koji (June 2013). “Tetsuo Nozoe's "Autograph Books by Chemists 1953-1994": An Essay: Tetsuo Nozoe's "Autograph Books by Chemists 1953-1994": An Essay”. The Chemical Record 13 (3): 343–352. doi:10.1002/tcr.201300007. PMID 23737463.
- ^ Cook, J. W.; Raphael, R. A.; Scott, A. I. (1951). “149. Tropolones. Part II. The synthesis of α-, β-, and γ-thujaplicins”. J. Chem. Soc.: 695–698. doi:10.1039/JR9510000695.
- ^ Liu, Na; Song, Wangze; Schienebeck, Casi M.; Zhang, Min; Tang, Weiping (December 2014). “Synthesis of naturally occurring tropones and tropolones”. Tetrahedron 70 (49): 9281–9305. doi:10.1016/j.tet.2014.07.065. PMC 4228802. PMID 25400298.
- ^ Saniewski, Marian; Horbowicz, Marcin; Kanlayanarat, Sirichai (10 September 2014). “The Biological Activities of Troponoids and Their Use in Agriculture A Review”. Journal of Horticultural Research 22 (1): 5–19. doi:10.2478/johr-2014-0001.
- ^ Davison, J.; al Fahad, A.; Cai, M.; Song, Z.; Yehia, S. Y.; Lazarus, C. M.; Bailey, A. M.; Simpson, T. J. et al. (15 May 2012). “Genetic, molecular, and biochemical basis of fungal tropolone biosynthesis”. Proceedings of the National Academy of Sciences 109 (20): 7642–7647. doi:10.1073/pnas.1201469109. PMC 3356636. PMID 22508998.
- ^ Keith, Michael P.; Gilliland, William R.; Uhl, Kathleen (2009). “GOUT”. Pharmacology and Therapeutics: 1039–1046. doi:10.1016/B978-1-4160-3291-5.50079-2. ISBN 978-1-4160-3291-5.
- ^ Karchesy, Joseph J.; Kelsey, Rick G.; González-Hernández, M. P. (May 2018). “Yellow-Cedar, Callitropsis (Chamaecyparis) nootkatensis, Secondary Metabolites, Biological Activities, and Chemical Ecology”. Journal of Chemical Ecology 44 (5): 510–524. Bibcode: 2018JCEco..44..510K. doi:10.1007/s10886-018-0956-y. PMID 29654493.
- ^ Goldfrank's toxicologic emergencies. Nelson, Lewis, 1963- (Eleventh ed.). New York. (11 April 2019). ISBN 978-1-259-85961-8. OCLC 1020416505
- ^ Carlsson, Blenda; Erdtman, H.; Frank, A.; Harvey, W. E.; Östling, Sven (1952). “The Chemistry of the Natural Order Cupressales. VIII. Heartwood Constituents of Chamaecyparis nootkatensis - Carvacrol, Nootkatin, and Chamic Acid.”. Acta Chemica Scandinavica 6: 690–696. doi:10.3891/acta.chem.scand.06-0690.
- ^ Dalbeth, Nicola; Lauterio, Thomas J.; Wolfe, Henry R. (October 2014). “Mechanism of Action of Colchicine in the Treatment of Gout”. Clinical Therapeutics 36 (10): 1465–1479. doi:10.1016/j.clinthera.2014.07.017. PMID 25151572.
- ^ “Modern Genetic Analysis: Changes in Chromosome Number”. Modern Genetic Analysis (W. H. Freeman, New York). (1999).
- ^ US EPA (10 August 2020). “Nootkatone Now Registered by EPA” (英語). US EPA. 2024年4月1日閲覧。