バナジン酸塩
表示
(バナジン酸塩鉱物から転送)

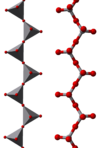
バナジン酸塩(バナジンさんえん、英語: vanadate)は、バナジウムのオキソアニオンを含む化合物である。一般にここでのバナジウムは最高酸化数+5を取っている。最も単純なバナジン酸イオンは四面体型のオルトバナジン酸イオン VO43- で、これは例えばオルトバナジン酸ナトリウムとして存在したり、V2O5 の強塩基溶液中に存在する。
さらに、オルトバナジン酸イオンが線状に重合したポリマーが存在する[1]。また、混合酸化物で陽イオンとバナジン酸陰イオンからなる結晶を持たないバナジン酸塩が存在する。例えばバナジン酸ロジウム (RhVO4) がそうで、これは全体としてはルチル型構造を持ち、Rh3+ と V5+ イオンがランダムに Ti4+ の位置を占めている[2]。
バナジン酸イオンの例
[編集]- VO3−
4 オルトバナジン酸イオン、四面体型[1]。 - V2O4−
7 ピロバナジン酸イオン、VO4 四面体の角を共有した構造(二クロム酸イオンに似ている)[1]。 - V3O3−
9 VO4 四面体の角を共有した環状構造[3]。 - V4O4−
12 VO4 四面体の角を共有した環状構造[4]。 - V5O3−
14 VO4 四面体の角を共有した構造[5]。 - V10O6−
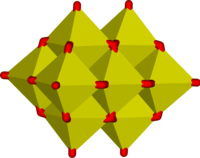
28 デカバナジン酸イオン、VO6 八面体の角と辺を共有した構造[1]。 - V12O4−
32[1] - V13O3−
34 VO6 八面体が融合した構造[6]。 - V18O12−
42[7] - [VO3]n-
n 例えば NaVO3、メタバナジン酸ナトリウム[1]。 - [V3O8]n-
n 例えば CaV6O16[8]。
上記のようにバナジウムはさまざまな形のイオンを持つ。この点においてバナジウムはタングステンやモリブデンに似ている。クロムに関しては、とりうるイオンの種類はもっと限られている。
水溶液
[編集]強塩基溶液への五酸化バナジウムの溶解により、無色の VO43– イオンができる。これを酸性化していくと、pH 7付近でゆっくりと橙色から赤色に変化する。pH 2あたりで V2O5 の褐色の水和物が沈殿し、黄色の [VO2(H2O)4]+ イオンが再溶解する。pH2-13において確認できるオキソアニオンの数は濃度に依存する。例えば、バナジン酸イオンのプロトン化は一連のポリオキソバナジン酸イオンの縮合反応を起こす[1]。
- pH 9–12 :
- pH 4–9 :
- pH 2–4 :
バナジン酸塩鉱物
[編集]→「鉱物の一覧 § バナジン酸塩鉱物」も参照
鉱物学において、バナジン酸塩からなる鉱物をバナジン酸塩鉱物(バナジンさんえんこうぶつ、英: vanadate mineral)という。
脚注
[編集]- ^ a b c d e f g グリーンウッド, ノーマン; アーンショウ, アラン (1997). Chemistry of the Elements (英語) (2nd ed.). バターワース=ハイネマン. ISBN 978-0-08-037941-8。
- ^ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ^ Hamilton E. E., Fanwick P.E., Wilker J.J. (2002). “The Elusive Vanadate (V3O9)3−: Isolation, Crystal Structure, and Nonaqueous Solution Behavior”. J. Am. Chem. Soc. 124 (1): 78. doi:10.1021/ja010820r.
- ^ G.-Y. Yang, D.-W. Gao, Y. Chen, J.-Q. Xu, Q.-X. Zeng, H.-R. Sun, Z.-W. Pei, Q. Su, Y. Xing, Y.-H. Ling and H.-Q. Jia (1998). “[Ni(C10H8N2)3]2[V4O12]·11H2O”. Acta Crystallographica Section C Crystal Structure Communications 54: 616. doi:10.1107/S0108270197018751.
- ^ V. W. Day, Walter G. Klemperer, O. M. Yaghi (1989). “A new structure type in polyoxoanion chemistry: synthesis and structure of the V5O143− anion”. J. Am. Chem. Soc. 111: 4518. doi:10.1021/ja00194a068.
- ^ Hou D., Hagen K.D., Hill C.L. (1992). “Tridecavanadate, [V13O34]3−, a new high-potential isopolyvanadate”. J. Am. Chem. Soc. 114: 5864. doi:10.1021/ja00040a061.
- ^ Müller A., Sessoli R., Krickemeyer E., Bögge H., Meyer J., Gatteschi D., Pardi L., Westphal J., Hovemeier K., Rohlfing R., Döring J, Hellweg F., Beugholt C., Schmidtmann M. (1997). “Polyoxovanadates: High-Nuclearity Spin Clusters with Interesting Host-Guest Systems and Different Electron Populations. Synthesis, Spin Organization, Magnetochemistry, and Spectroscopic Studies”. Inorg. Chem. 36: 5239. doi:10.1021/ic9703641.
- ^ Jouanneau, S.; Verbaere, A.; Guyomard, D. (2003). “On a new calcium vanadate: synthesis, structure and Li insertion behaviour”. Journal of Solid State Chemistry 172: 116. doi:10.1016/S0022-4596(02)00164-0.