硫酸塩
| 硫酸塩 | |
|---|---|

| |

|

|
Sulfate | |
| 識別情報 | |
| CAS登録番号 | 14808-79-8 |
| PubChem | 1117 |
| ChemSpider | 1085 |
| EC番号 | 233-334-2 |
| ChEBI | |
| |
| |
| 特性 | |
| 化学式 | SO2− 4 |
| モル質量 | 96.07 g mol−1 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
硫酸塩(りゅうさんえん、英語: sulfate, sulphate)とは、硫酸イオン(りゅうさんイオン sulfate; SO42-)を含む無機化合物の総称である。
構造および結合
[編集]硫酸陰イオンは中心の硫黄原子とそれを正四面体配置で囲む4つの等価な酸素原子からなる。この対称性はメタンの対称性と同一である。硫黄原子の酸化状態は+6であるのに対して、4つの酸素原子はそれぞれ−2の酸化状態にある。硫酸イオンは2価の負電荷を有しており、硫酸水素イオンHSO4−の共役塩基である。硫酸水素イオンは硫酸H2SO4の共役塩基である。硫酸ジメチルといった有機硫酸エステルは共有結合性化合物であり、硫酸のエステルである。
S-O結合長は149ピコメートル (pm) であり、S-O単結合から予測されるよりも短い。例えば、硫酸におけるS-OHの結合長は157 pmである。硫酸イオンの四面体形構造はVSEPR理論から予測される。

極性共有結合のみを持つ1; イオン結合を持つ2
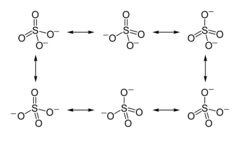
現代的な用語による硫酸イオン中の結合の初の描写はギルバート・ルイスによる1916年の革新的な論文でなされた。この論文でルイスは結合をそれぞれの原子を囲む電子オクテットの観点から説明した。すなわち、二重結合はなく硫酸イオンの形式電荷 (formal charge, FC) は+2である[1]。
後に、ライナス・ポーリングは最も重要な共鳴標準構造がd軌道が関与する2つのπ結合を持つことを提唱するために原子価結合理論を用いた。ポーリングの論拠は、自身の電気的中性の原理に従って硫黄の電荷が減少するというものであった[2]。S-O結合の短さ (149 pm) を説明するためには二重結合が使われた。ポーリングによるd軌道の使用は、S-O結合の短縮の原因となるπ結合と結合の極性(静電引力)の相対的重要性について論争を引き起こした。結果としては、d軌道は役割を果たしているものの、ポーリングが考えていたほど重要ではないという幅広い合意が得られた[3][4]。
ポーリングの構造における二重結合は、硫黄上の3d軌道と酸素上の2p軌道から形成される分子軌道の存在を暗示している。pπ-dπ結合を含む広く受け入れられた描写は当初、D.W.J. Cruickshankによって提唱された。このモデルでは、酸素上の占有されたp軌道が空の硫黄d軌道(主にdz2およびdx2-y2)と重なり合う[5]。しかしながら、この描写では、S-O結合にある程度のπ性があるにもかかわらず、結合は顕著なイオン性を有する。硫酸については、(自然結合軌道を用いた)計算解析によって硫黄上の明らかな正電荷(理論上+2.45)と低い3d占有率が確認されている。したがって、2つの二重結合を持つモデルよりも4つの単結合を持つ描写が最適なルイス構造である[6]。このモデルでは、構造はオクテット則に従い、電荷分布は原子の電気陰性度とよく一致する。しかしながら、酸素を有する硫酸イオンやその他の典型元素化合物についてのポーリングの二重結合を含む結合描写は、今でも多くの教科書において結合を説明する一般的な方法である[5][7]。
この明らかな矛盾は、共有二重結合は実際には、酸素原子の方に90 %を超える程に強く分極している結合を表わしている、と理解すれば取り除くことができる。一方、イオン結合を有する構造においては、電荷は酸素上の非共有電子対として局在している[6]。
性質
[編集]硫酸は2価のオキソ酸であり、硫酸塩は正塩 (MI2SO4; MIISO4)、水素塩 (MIHSO4)[8]、塩基性塩に分類される。また複塩も形成し、タットン塩 (MI2MII(SO4)2・6H2O) やミョウバン類 (MIMIII(SO4)2・12H2O) などが知られている。
いずれの硫酸塩でも硫酸イオンは、正四面体構造を取り、S–O間距離は149 pm(1.49オングストローム)であり、水和物結晶では水分子が配位していることも多い。
ほとんどすべての金属元素と安定な塩を形成する。バリウム塩、ストロンチウム塩、鉛(II)塩、カルシウム塩、銀(I)塩が水に難溶である以外は、硫酸塩は多くの場合水に溶けやすく、多くの場合硫酸水素塩は正塩に比べて水に対する溶解度が大である。一方、塩基性塩の多くは溶解度が低い。
また正塩のタリウム(I)塩、カリウム塩は無水塩が安定ではあるが、多くの場合には安定な水和物結晶を生成することが知られており、一般的に2価の金属塩は6ないしは7水和物が安定であり、3価の金属塩はさらに多価の水和物を形成する。
生成
[編集]硫酸は比較的弱い酸化力を持つため不動態を形成し反応しないこともあるが、多くの場合、金属の酸化物、水酸化物、炭酸塩は硫酸に溶解し硫酸塩となる。
揮発性の酸を成分に持つ塩化物,硝酸塩も過剰の硫酸と加熱すると,それぞれ HCl,NO2 を発生して分解し硫酸塩に変化する。
反応
[編集]塩基性塩が強熱で熱分解するのに対して、アルカリ金属、アルカリ土類金属元素の塩は熱に対しては比較的安定である。一方、水素塩は融点が低い。
硫酸塩を炭素を還元剤として強熱すると、硫化物を生成する場合が多い。また、金属元素の交換(複分解)を目的として炭酸アルカリ金属塩と強熱すると目的金属の炭酸塩が生成する。
一般に、金属の酸化物、水酸化物、炭酸塩は硫酸に溶解し硫酸塩となる。また、塩化物、硝酸塩も過剰の硫酸と加熱すると、それぞれ HCl、NO2 および O2 を発生して分解し、硫酸塩に変化する。
硫酸塩鉱物
[編集]鉱物学において、硫酸塩からなる鉱物を硫酸塩鉱物(りゅうさんえんこうぶつ、英語: sulphate mineral[9])という。
- 重晶石 — BaSO4
- 天青石 — SrSO4
- 硬石膏 — CaSO4
- 石膏 — CaSO4・2H2O
- 明ばん石 — KAl3(SO4)2(OH)6
- 鉄明ばん石(英語: Jarosite) — KFe3(SO4)2(OH)6
脚注
[編集]- ^ "The Atom and the Molecule" by Gilbert N. Lewis Journal of the American Chemical Society Volume 38, 1916, pages 762–785. See page 778
- ^ "The modern theory of valency" Linus Pauling J. Chem. Soc., 1948, 1461–1467, doi:10.1039/JR9480001461
- ^ C. A. Coulson, Nature, 221, 1106 (1969), doi:10.1038/2211106a0
- ^ K. A. R. Mitchell, Chem. Rev., 69, 157 (1969), doi:10.1021/cr60258a001
- ^ a b Cotton, F. Albert; Wilkinson, Geoffrey (1966). Advanced Inorganic Chemistry (2d Edn.). New York: Wiley.
- ^ a b Thorsten Stefan and Rudolf Janoschek: "How relevant are S=O and P=O Double Bonds for the Description of the Acid Molecules H2SO3, H2SO4, and H3PO4, respectively?". Journal of Molecular Modeling, Volume 6, Number 2 / February 2000, pp. 282–288. doi:10.1007/PL00010730
- ^ グリーンウッド, ノーマン; アーンショウ, アラン (1997). Chemistry of the Elements (英語) (2nd ed.). バターワース=ハイネマン. ISBN 978-0-08-037941-8。
- ^ 硫酸水素塩を重硫酸塩と呼ぶのは誤称(『岩波理化学辞典』)。
- ^ 文部省編『学術用語集 地学編』日本学術振興会、1984年、116頁。ISBN 4-8181-8401-2。
参考文献
[編集]- 長倉三郎ら編『岩波理化学辞典』第5版 CD-ROM版、岩波書店、1999年、ISBN 4-00-130102-4。
- 金澤孝文「硫酸」『世界大百科事典』CD-ROM版、平凡社、1998年、ISBN 4-582-04002-0、ISBN-13:978-4-582-04002-9。
- 湊秀雄「硫酸塩鉱物」『世界大百科辞典』CD-ROM版、平凡社、1998年。
