エプスタイン・バール・ウイルス
| エプスタイン・バール・ウイルス | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 EBウイルス(球状のものがウイルス)
| ||||||||||||||||||
| 分類 | ||||||||||||||||||
| ||||||||||||||||||
| 学名 | ||||||||||||||||||
| Human gammaherpesvirus 4 | ||||||||||||||||||
| シノニム | ||||||||||||||||||
|
Epstein-Barr virus |
エプスタイン・バール・ウイルス(Epstein-Barr virus)とは、ヘルペスウイルス科に属するウイルスの一種。日本ではよくEBウイルスと略して呼称される。学名はヒトヘルペスウイルス4型(Human herpesvirus 4、HHV-4)を経てヒトガンマヘルペスウイルス4型(Human gammaherpesvirus 4)と変更されたが[1]、今なお旧称が広く用いられている。
EBウイルス(以下EBVと略記)は、いわゆる「キス病」と言われる伝染性単核球症の原因ウイルスとして有名である。日本では成人までに90%〜ほぼ100%の人が唾液や性分泌液等を介してEBVに感染する[注釈 1]。巧妙に潜伏、また時に応じて再活性化を来たして維持拡大を図るため、ウイルスは終生にわたって持続感染し排除されない[注釈 2]。
またEBVは腫瘍形成に関わる腫瘍ウイルス(癌ウイルス)としても知られ、種々の悪性リンパ腫・胃癌・上咽喉癌・平滑筋肉腫・唾液腺癌といった種々の癌を引き起こすことも知られている[2]。最近では乳癌を引き起こすことができることも示されている[注釈 3]。
またEBVは近年、様々な自己免疫疾患(全身性エリテマトーデス・関節リウマチ・シェーグレン症候群・多発性硬化症・バセドウ病など)における自己抗体産生・自己免疫応答の引き金となり、自己免疫疾患の原因となっていることが明らかにされている[3][注釈 4][注釈 5][注釈 6][注釈 7][注釈 8][注釈 9][4]。EBVとパーキンソン病をはじめとする神経変性疾患との関連性も指摘されている[注釈 10]。
日本においてはEBVは、人気声優の松来未祐が慢性活動性EBウイルス感染症によって死亡し、マスコミで取り上げられたことにより広く知られた[5][6][7]。
EBVに有効なワクチンは今のところ存在しない[注釈 11]。EBVに有効な抗ウイルス剤のソリブジン・ブリブジンは存在するが、ソリブジンと抗がん剤5-FUの併用によって起きた薬害事故の影響で、日本においては使用不可能な状態にある[注釈 12][注釈 13]。
技術としては試験管内でのB細胞の不死化の手段として、B細胞のEBVによる形質転換がよく用いられる[注釈 14]。また近年、このEBVによるB細胞の形質転換を利用して抗体医薬(完全ヒトモノクローナル抗体)を作成する技術が開発された[注釈 15]。
名前の由来と歴史
[編集]エプスタイン・バール・ウイルス(Epstein-Barr virus)という名前は、発見者であるブリストル大学名誉教授のアンソニー・エプスタイン(Michael Anthony Epstein)とロンドン大学出身の1966年のPh.D.イヴォンヌ・バール(Yvonne Barr)にちなんで付けられた[8]。二人は1964年にEBウイルスの存在を発見し、それを論文にて発表した[9]。
1961年に病理学者かつ電子顕微鏡のエキスパートであったエプスタインは、「熱帯アメリカで最も普遍的な小児の癌—これまでに知られていない症候群について(The Commonest Children's Cancer in Tropical Africa—A Hitherto Unrecognised Syndrome)」という講義に出席した。この講義はウガンダにて外科医をしていたデニス・バーキット(Denis Persons Burkitt)による、彼の名を冠した風土的に特異な小児型の疾患(バーキットリンパ腫)についての講義であった。1963年にその疾患の検体が、培養のためにイギリス・ロンドンのミドルセックス病院にウガンダから送られた。ウイルス粒子がその培養細胞から同定され、その結果がエプスタインとバート・アチョング(Bert Achong)とバールの共著の形で、1964年に医学誌『ランセット』へ掲載された。
そしてその細胞株が、フィラデルフィア小児病院(The Children's Hospital of Philadelphia)のヴェルナー・ヘンレ(Werner Henle)とガートルード・ヘンレ(Gertrude Henle)に送られ、EBVの血清マーカーが開発された。1967年には、ある技術者が実験室で伝染性単核球症を発症し、貯蔵してあった血清を比べることで、EBVに対する抗体が生じたことを突き止めた[10][11][12]。1968年には彼らは、EBV関連感染症の形態を模倣することで[13]、EBVがB細胞を感染後に直接不死化させることを明らかにし、EBVと伝染性単核球症との関連を明らかにした[14]。
疫学と初感染時の兆候
[編集]EBウイルスは一般には唾液を介して伝搬する。出生後しばらくは母親からの受動免疫(移行抗体)により防御されているが、半年後頃から、おそらく母親を含めた家族からと思われる感染が始まり、2〜3歳までには感染率は70%前後に達する。
乳幼児期の感染の割合は、国家・生活レベルによって異なり、例えばアメリカの白人におけるこの時期の感染リスクは、20%前後と報告されている。乳幼児期の初感染は、不顕性感染もしくは低症候性に推移し、感染に気づかないことも多い[注釈 1]。
最終的に、日本では成人までに90%〜ほぼ100%が、唾液や性分泌液を介してEBVに感染する[注釈 1]。巧妙に潜伏、また時に応じて再活性化を来たして維持拡大を図るため、EBウイルスは終生に渡って持続感染し、体内から排除されない[注釈 2]。EBVの主要な感染細胞はB細胞や上皮系細胞であるが、その他T細胞・NK細胞にも感染しうる[注釈 1]。
伝染性単核球症
[編集]青年期以降に接吻による唾液の交換を介してEBVに初感染すると、伝染性単核球症(infectious mononucleosis;IM)俗にいう「キス病」を発症することがある。倦怠、発熱、リンパ節腫脹、咽頭炎、肝脾腫などを主徴とし、通常は一週間から一ヶ月程度で治癒する。欧米では乳幼児期のIMは極めて稀であるが、日本ではしばしば認められる[注釈 1]。
悪性腫瘍との関連
[編集]伝染性単核症のほか、EBVは腫瘍ウイルスとして下記のように多様ながん(増殖性疾患)の原因となる。EBV陽性がんは多段階発がんで、その原因としては、
が挙げられる。1. のがん遺伝子には、共刺激分子CD40の機能的なミミックであるLMP-1・B細胞受容体(B cell receptor;BCR)の機能的なミミックであるLMP-2Aなどが挙げられる。2. には、バーキットリンパ腫に見られるIg-Mycの転座や、各種のがんで報告されている特異的変異などが挙げられる。3. としては、細胞傷害性T細胞等による腫瘍免疫のほか、近年では逆に免疫/炎症システムががんの維持進展をサポートしている場合もある、との説も有力になってきている。
B細胞リンパ腫
[編集]ホジキンリンパ腫
[編集]ホジキンリンパ腫(Hodgkin's lymphoma;HL)においては、リード=シュテルンベルク細胞という胚中心由来の腫瘍細胞と、その周囲に高度に集簇する非腫瘍性のリンパ球が特徴であり、リード=シュテルンベルク細胞にEBVが検出される場合がある。EBV陰性、陽性に関わらずリード=シュテルンベルク細胞にはNF-kB関連分子の変異が多く報告されており、NF-kBシグナルががん化に大きく寄与しているものと考えられる。
バーキットリンパ腫
[編集]バーキットリンパ腫(Burkitt's Lymphoma;BL)はヒトで初めて発見されたウイルス陽性がんで、アフリカの小児に好発する。胚中心由来のB細胞リンパ腫で、Ig-Mycの転座を特徴とし、ほぼ100%においてEBV陽性である。アフリカ以外でもまれに発生するが、その場合EBV陽性率は10〜20%と低い[注釈 1]。Ig-Mycの転座のほか、TP53やRB2の変異が報告されている。
日和見リンパ腫
[編集]日和見リンパ腫(opportunistic lymphoma)とは、ウィスコット・アルドリッチ症候群(Wiskott-Aldrich syndrome;WAS)・毛細血管拡張性小脳失調症(ataxia telangiectasia;AT)等の先天的免疫不全、臓器移植に伴う免疫調節薬投与・後天的免疫不全症(AIDS)・種々の疾患の免疫抑制療法等による後天的免疫不全によって、EBV特異的細胞性免疫が破綻する結果生じるリンパ腫のことである[注釈 1]。
先天的EBV特異的免疫不全症であるX連鎖リンパ増殖症候群(X-linked lymphoproliferative syndrome;XLP、ダンカン病)では致死的伝染性単核球症やBリンパ腫が高率に発生する[注釈 1][15]。
移植後リンパ増殖性疾患(post-transplant lymphoproliferative disorder;PTLD)・免疫不全関連リンパ増殖性疾患(immunodeficiency-associated lymphoproliferative disorder)は、AIDSや臓器移植に伴う免疫不全に起因する。増殖性を獲得しているのはEBVによって不死化されたBリンパ球である。通常であれば腫瘍免疫によって排除されているが、免疫抑制状態では排除できずに発症する。ヒト免疫不全ウイルスによるAIDSの免疫不全の状況下においては、EBVは毛状白板症(hairy leukoplakia)・中枢神経系原発悪性リンパ腫(primary central nervous system lymphoma;PCNSL)の原因ともなり[16]、PCNSLにおいてはEBV陽性率が著しく高い[17]。
類縁の病態として、加齢等に伴う免疫能の低下によって生じると考えられる、老人性EBV陽性びまん性大細胞型B細胞性リンパ腫(EBV-positive diffuse large B cell lymphoma of eldery)、膿胸関連リンパ腫(pyrothrax-associated lymphoma;PAL)が挙げられる[注釈 1]。
T/NKリンパ腫
[編集]T/NKリンパ腫のうち、鼻型節外性NK/Tリンパ腫(extranodal NK/T cell lymphoma;ENKTL, nasal type)、アグレッシブNK細胞白血病(aggressive NK cell leukemia;ANKL)においては、ほぼ100%でEBV陽性となっている。少なくとも一部のケースにおいては、慢性活動性EBウイルス感染症から悪性転化してT/NKリンパ腫を生じる。TP53, K-ras, β-カテニン, FoxO3などの変異が報告されている。日本を含む東アジアでは比較的発症率が高い。
上咽喉癌
[編集]中国南部に多い上咽頭癌(nasopharyngeal carcinoma;NPC)では、やはりほぼ100%の腫瘍細胞からEBVが検出されるため、EBVが主因であると考えられる。上咽頭上部には扁桃があり、解剖学的位置関係からEBV陽性リンパ球やEBVに暴露する機会が高いであろうことも特筆される。EBVの他では、塩漬けの魚の消費と強い相関が見られ、含有されるニトロソアミンなどの変異原性物質の関与が推定されている。高度なリンパ球の浸潤がみられることから以前はリンパ上皮腫(lymphoepithelioma)と呼ばれていたが、癌の本態はリンパ球ではなく上皮細胞である。随伴する変異としてRassif1A, P16, TP53, Cyclin D1などの報告がある。
胃癌
[編集]胃癌(gastric carcinoma;GC)のうち約10%弱からEBVが検出される。上咽頭癌同様、EBV陽性胃癌においてはほぼ全例に高度なリンパ球の浸潤が伴う。TP53, ARID1の変異が報告されているほか、P16やE-cadherinなどのサイレンシングもEBV陽性胃癌に随伴する事象として明らかにされている。
平滑筋肉腫
[編集]1994年に成人のAIDS患者にてEBV陽性の平滑筋肉腫(smooth-muscle tumors)を発症した例が世界で初めて報告された[18][19]。その後もAIDSや臓器移植の患者が、EBV陽性の平滑筋肉腫を発症したことが続けて報告されている[20][21][注釈 1]。
唾液腺癌
[編集]唾液腺癌からEBVが陽性となったことが報告されている[22][注釈 1]。
乳癌
[編集]インド[23]・中国[24][25]・北アフリカ[26][27]・南ヨーロッパ[28][29][30]にて、EBVと乳癌(breast cancer;BC)との関連が指摘されていた。乳癌検体からのEBV検出率としては約30%ほどである。2016年にはハーバード大学らの研究グループが、EBVがCD21を発現した乳腺上皮細胞に感染し、悪性形質転換させることを示している[注釈 3]。
EBVは感染した幹細胞型の初期乳腺上皮前駆細胞の分裂を加速させ、METシグナルを活性化することで分化を阻害する。EBVに感染した乳腺上皮細胞が異種移植片として移植された際には、EBVは活性化されたRasと共同して乳癌の形成を促進する。EBVの潜伏感染パターンとしては上咽喉癌と同じII型をとっていることも明らかとなっており、EBVに感染した乳腺上皮細胞に特徴的なヒト遺伝子発現パターンは、エストロゲン受容体陰性の高度な乳癌の遺伝子発現パターン・p53の変異・予後の悪さと関わっていることも明らかとなった[注釈 3]。
自己免疫疾患との関連
[編集]
オーストラリアのクイーンズランド大学医学部のマイケル・P・ペンダー(Michael P. Pender)によって、EBVによる自己免疫疾患発症のメカニズム仮説が提示されている[31][32][注釈 4]。
この仮説は「ペンダーの仮説(Pender's hypothesis)」と呼ばれており、様々な自己免疫疾患とEBVとの関わりが指摘されていることから、多発性硬化症、関節リウマチ、全身性エリテマトーデス、シェーグレン症候群、全身性強皮症、皮膚筋炎、原発性胆汁性肝硬変、原発性硬化性胆管炎、潰瘍性大腸炎、クローン病、乾癬、尋常性白斑、水疱性類天疱瘡、円形脱毛症、突発性拡張型心筋症、1型糖尿病、バセドウ病、橋本病、重症筋無力症、IgA腎症、膜性腎症、悪性貧血、といった自己免疫疾患の発症に、どのように細胞傷害性T細胞の機能不全・ビタミンDの欠乏・EBVがどのように関わってくるかを考察したものである。

簡単のために、この絵ではCD8+細胞傷害性T細胞の機能不全・EBV感染・代表的なHLAアレルに焦点を当てており、自己免疫疾患の病態にまた関わるであろう、他の遺伝的要因ないしは環境要因の相互作用については描かれていない。
このペンダーの仮説は、遺伝等の原因によってEBVに対するCD8+T細胞応答に何らかの不全が起き、EBVに感染した自己反応性の記憶B細胞が抗原提示細胞として働き、通常は禁止された自己抗原のT細胞認識が可能となり、自己免疫応答が生ずるというものである[注釈 4]。
最近では、大阪大学微生物病研究所/免疫学フロンティア研究センター・ハーバード大学の研究グループは2015年、EBVによる全身性エリテマトーデス・多発性硬化症などの自己免疫疾患発症のメカニズムを突き止め、その結果が米国科学アカデミー紀要(Proceedings of the National Academy of Sciences of the United States of America;PNAS)のオンライン版に公開されている[注釈 5][注釈 6][注釈 7]。
通常、胚中心B細胞(成熟段階にあるB細胞)の表面に、排除する抗原に合わないB細胞受容体や、自分の抗原に反応するB細胞受容体があれば、そのB細胞はアポトーシスにより排除される。しかし、その胚中心B細胞がEBVに感染すると、EBVの潜伏感染Ⅲ型遺伝子のLMP-2AがB細胞受容体シグナルを模倣し、さらに形質細胞(抗体産生細胞)への分化を促進する因子(Zbtb20)が出現して、本来はアポトーシスにより排除されるべき自己反応性B細胞が生き残り(B細胞選択異常)、自己反応性受容体などの抗体を出し続ける形質細胞になる結果、自己免疫疾患が発症するということである[注釈 5]。
また同様に鳥取大学医学部医学科分子病理学分野の研究グループは2017年、EBVに感染したB細胞から自己免疫性甲状腺機能亢進症であるバセドウ病の自己抗体である抗甲状腺刺激ホルモンレセプター抗体(TRAb)が産生されるメカニズムを突き止め、さらにバセドウ病を含めた自己免疫疾患全般の成立にEBVが関わることを示唆している[注釈 8][注釈 9]。
EBVに感染したB細胞は自己反応性か否かによらず、EBVの潜伏感染Ⅲ型遺伝子のLMP-1によるT細胞非依存性のCD40共刺激シグナルの模倣によるNF-κBの活性化で、活性化誘導シチジンデアミナーゼ(AID)の発現が促進されT細胞非依存性にクラススイッチが可能となり、多クローン性にあらゆるアイソタイプの抗体の産生をし得る。EBVに感染したB細胞が自己反応性の抗体の可変部を持っていた時、自己抗体を産生し得るということである[注釈 8][注釈 9]。
全身性エリテマトーデス
[編集]EBVの潜伏感染遺伝子抗原のEBNA-1と全身性エリテマトーデス(systemic lupus erythematosus;SLE)の自己抗原とされているSmとの分子相同性(molecular mimicry)が明らかになっており、EBNA-1に対して作られた抗体が自己抗原のSmに交叉反応(クロスリアクション)し、SLEの自己抗体の抗Sm抗体となっていることも示唆されている[36][37][38]。
さらに上述のように、大阪大学微生物病研究所/免疫学フロンティア研究センター・ハーバード大学の研究グループは2015年、EBVによる全身性エリテマトーデス含めた自己免疫疾患発症のメカニズムを突き止めている[注釈 5][注釈 6][注釈 7]。
関節リウマチ
[編集]関節リウマチ(rheumatoid arthritis;RA)に特異的な自己抗体である抗 cyclic citrullinated peptide(CCP)抗体が、EBNA-1のグリシン-アルギニンの繰り返し構造のアルギニンをシトルリンに変換し viral citrullinated peptides となり交叉反応(クロスリアクション)することが報告されている[注釈 16]。RA滑膜にはEBNA-1と構造が似ている蛋白が報告されており分子相同性(molecular mimicry)の機序が病因として重要な働きをしている可能性が報告されている[注釈 16]。
また、EBVがRA滑膜そのものから検出されている[注釈 16]。
シェーグレン症候群
[編集]2012年に鶴見大学歯学部の研究グループは、ダイオキシンの一種であるTCDDがEBVを活性化することでシェーグレン症候群(Sjögren's syndrome)の発症に関与することを発表している[39]。
多発性硬化症
[編集]多発性硬化症(multiple sclerosis;MS)は、血清中のEBV抗体価と発症リスクが強く相関しているとの報告が多い[40]。しかし、多発性硬化症患者の脳ないしは脳脊髄液(cerebrospinal fluid;CSF)といった中枢神経系(central nervous system;CNS)における直接のEBVの感染は稀であるという報告もあり[41][42][43]、2011年時点では多発性硬化症とEBVの直接の関連については議論の的となっていた[44]。
しかし上述のように、大阪大学微生物病研究所/免疫学フロンティア研究センター・ハーバード大学の研究グループは2015年、EBVによる多発性硬化症を含めた自己免疫疾患発症のメカニズムを突き止めている[注釈 5][注釈 6][注釈 7]。
また上述のペンダーの仮説は2018年現在でも検証段階であるが、実際に多発性硬化症の患者においてはEBVに対するT細胞応答の疲弊が起こっていること、またこの仮説により先ほどの様な中枢神経系における直接のEBVの感染は稀である、という様な現象を説明しうるということまで判明してきている[45][46]。
バセドウ病
[編集]2011年から鳥取大学医学部医学科分子病理学分野の研究グループは、EBVの再活性化と自己免疫性甲状腺機能亢進症であるバセドウ病の自己抗体(抗甲状腺刺激ホルモンレセプター抗体;TRAb)産生との関連を指摘し始めた[47][48][49][50][51]。
そして上述のように、その研究グループは2017年に、EBVに感染したB細胞からバセドウ病の自己抗体である抗甲状腺刺激ホルモンレセプター抗体(TRAb)が産生されるメカニズムを突き止めた[注釈 8][注釈 9]。特に、バセドウ病を引き起こすのはIgG1のアイソタイプを持ったTRAbであり、そのためにはTRAb陽性B細胞で免疫グロブリン(抗体)のクラススイッチ遺伝子再編成を引き起こす活性化誘導シチジンデアミナーゼ(AID)の発現が必須となるが、EBVの潜伏感染Ⅲ型遺伝子のLMP-1はT細胞非依存性にCD40のシグナルを模倣しNF-κBを活性化させることができ、NF-κBはAID遺伝子(AICDA)の転写を促進するので、バセドウ病を引き起こすIgG1のアイソタイプを持ったTRAbの産生が可能になるということである[注釈 8][注釈 9]。
同研究グループは2018年、11例のリンパ球・形質細胞の浸潤を認めるバセドウ病患者の、7例の甲状腺摘出検体においてEBV(+)B細胞・IgG4(+)形質細胞の存在をそれぞれ EBV-encoded small RNA 1(EBER-1)の in situ ハイブリダイゼーション・免疫組織科学により調べ、実際にEBV(+)細胞とIgG4(+)形質細胞が甲状腺組織の同じ位置に存在していることを確認している。また、14例の健常対照群と13例のバセドウ病患者のリンパ球におけるEBVの再活性化を誘導し、両方のリンパ球においてIgG4の産生を確認している。特に、病状のコントロールができなくなり甲状腺の摘出を受けた患者においては血清におけるIgG4/IgG比がとても高く、IgG4関連疾患に認められる tumefactive な病変・花筵状線維化・閉塞性静脈炎は認められず、IgG4関連疾患とは診断し難いがIgG4関連疾患様の状態にあることが分かった。これは2014年の和歌山大学の研究グループによる、バセドウ病患者の一部において血清IgG4価が高いという結果[52]に一致している。B細胞におけるIgG4へのクラススイッチ遺伝子再編成にはTh2細胞性サイトカインとIL-10という免疫抑制系のサイトカインが必要である[53][54]が、EBVのBCRF-1遺伝子の転写産物はIL-10のホモログ[55]であり、さらに EBV-encoded small RNAs (EBERs) は宿主のB細胞にIL-10の産生を促す[56]ので、EBVのIL-10のホモログとEBERsによって産生が促されたIL-10が、制御性T細胞の産生するIL-10の代わりにIgG4へのクラススイッチに寄与しているようである(さらにこのEBVのIL-10のホモログとEBERsによって産生が促された宿主のB細胞のIL-10は、免疫抑制系サイトカインとしてEBV特異的細胞傷害性T細胞の働きを阻害し、ゆえにEBVの免疫からの逃避を助ける[57])。通常、形質細胞は抗原に対して高い親和性(high-affinity)を示すIgGを産生する[58][59]が、IgG4は抗原に対し高い親和性を示す抗体ではない[60][61][62]ので、胚中心におけるB細胞の抗原に対しての親和性成熟においてはIgG4へのクラススイッチは非常に稀にしか起こらないと考えてよい。それゆえにこの研究におけるバセドウ病患者の甲状腺切除組織におけるIgG4(+)形質細胞は胚中心におけるB細胞の親和性成熟以外の過程で発生したものと考えられ、そしてその過程はEBVの再活性化によって誘導されたIgG4産生であるということが結論づけられた[63]。
炎症性腸疾患
[編集]炎症性腸疾患(inflammatory bowel disease;IBD)とは、主として消化管に慢性炎症を引き起こす疾患の総称であり、大腸に原因不明の炎症を起こす潰瘍性大腸炎(ulcerative colitis;UC)と、全消化管(主として小腸・大腸)に原因不明の炎症を起こすクローン病(Crohn's disease;CD)の2疾患からなる。
古くには日本で、1999年に当時山口大学の研究者らが、外科的に切除した結腸検体(11例:クローン病、5例:潰瘍性大腸炎、9例:大腸癌における非病変部、10例:虫垂炎)におけるEBV感染を EBER-1(EBV-encoded small RNA 1)の in situ ハイブリダイゼーションによって調査している。結果としてはクローン病患者の切除標本11例中7例(63.6%)に、潰瘍性大腸炎患者の切除標本5例中3例(60.0%)にEBV感染が確認され、さらに潰瘍・びらんの分布とEBER-1陽性EBV感染細胞の分布が一致し、主なEBV感染細胞は粘膜上皮系細胞ではなく粘膜固有層のB細胞であった[64]。
40例のIBD患者のうち17例の難治性のIBDにおいては定量リアルタイムPCR・免疫組織科学の検出により、EBVと同じヘルペスウイルス科のサイトメガロウイルス(cytomegalovirus;CMV)・EBVの腸管感染が全員に確認でき、難治性でない23例からは13例(56.5%)に確認できたという研究もある[65]。さらに定量リアルタイムPCR・免疫組織科学に加え in situ ハイブリダイゼーションによってCMV・EBVのIBD患者における感染を調べ、難治性かどうかによらずCMV・EBV感染細胞とそうでない細胞の分布が炎症した粘膜の分布と一致していること、CMV・EBVのウイルス量に比例して炎症の度合いや病気の活動度が高くなっていることを突き止めた研究もある[66]。しかし、PCRによる検出のみの結果ではあるが、炎症部とそうでない部分にあまりウイルス量の差異がないという結果もある(それでもなおEBV、続いてCMV、の感染はIBD患者において普遍的であると結論づけている)[67]。2018年には、62例の潰瘍性大腸炎・3例のクローン病・2例の中間性腸炎患者からの結腸切除検体におけるEBV感染を高感度EBER-1(EBV-encoded small RNA 1)の in situ ハイブリダイゼーションによって調べ、67例中40例(60%)の切除検体からEBVが検出され、難治性IBD患者においては炎症・潰瘍の深度とEBER-1の陽性度に正相関があることが結論づけられた研究もある[68]。
近年、日本においてもEBVとIBDの関連が明らかとなっている。2017年に国立国際医療研究センターの研究グループは、PCRにて89例のIBD患者の大腸内視鏡における潰瘍の細胞検体におけるヘルペスウイルス感染を調べ、EBV:59.3%、CMV:24.4%、ヒトヘルペスウイルス6型(HHV-6):39%、ヒトヘルペスウイルス7型(HHV-7):39%、という存在率になっていたことを報告している[69]。2018年に大阪市立大学・兵庫医科大学の研究者らは、PCRにて66例の潰瘍性大腸炎患者・54例のクローン病患者、29例の健常対照群の大腸粘膜細胞検体におけるヘルペスウイルス感染を調べ、潰瘍性大腸炎に関してはEBVが21.2%・CMVが15.1%、クローン病患者においてはEBVが9.3%・CMVが0%、健常対照群においてはEBVが0%・CMVが3.4%の存在率であり、HHV-6・HHV-7の存在率に関してはこの3つの群の中で統計的な差は見られなかったと報告し、CMVとEBVないしはHHV-6の共感染は結腸切除の重要かつ独立したリスク因子となっていると結論づけている[70]。
また2001年に東海大の研究者らが参加した研究で、クローン病の腸管組織において産生が過多となっている炎症性のTh1サイトカインの一つIL-12と、そのIL-12のp40ユニットのホモログであるEpstein-Barr virus-induced gene 3(EBI3)のIBD患者の結腸粘膜における発現を、それらのmRNAをRT-PCRを用いることで検出し調べ(EBI3はEBVに潜伏感染したB細胞にて発現誘導される遺伝子である[71])、結果としてほとんど全ての潰瘍性大腸炎患者の炎症部・非炎症部両方に於いてEBI3の発現が増大しており、クローン病に於いては一部に認められた[72]。また、IBD患者の回結腸の切除標本36例(うち潰瘍性大腸炎16例、クローン病20例)におけるEBV感染細胞・EBI3の発現をそれぞれ in situ ハイブリダイゼーション・免疫組織科学によって調べた研究では、潰瘍性大腸炎・クローン病の切除標本両方とも非活動的炎症部に比べ活動的炎症部に於いてEBV感染細胞・EBI3陽性細胞の数が増大していることがわかっており(この2疾患の間に特に統計的な差はなかった)、EBV感染細胞に於いてのEBI3の発現は潰瘍性大腸炎・クローン病共に限定的に起こっており、炎症性細胞の流入・増殖に続いて活動的な炎症部におけるEBV感染細胞の増大が起こり、これは局所的なEBI3の産生には寄与しないことが分かった[73]。抗原提示細胞(樹状細胞・単球・マクロファージ)は、免疫応答を引き起こし持続させるために重要なIL-12ファミリーのサイトカインを放出し、IL-12p35・IL-12p19はIL-12p40と二量体を形成しそれぞれIL-12(IL-12p75)・IL-23を形成する。EBI3はIL-12p28と二量体を形成し、IL-27を形成する(IL-27はIL-6とTGF-βによるIL-17産生Th17細胞の誘導を直接的に抑制し、IL-6によるT細胞の増殖を阻止する。IL-27受容体を欠損させたマウスではIL-17を産生するTh17細胞性の実験的自己免疫性脳脊髄炎に非常にかかりやすくなることが知られている[74])。EBVに感染した腸管の粘膜上皮細胞はEBI3・IL-12p35・IL-12p19を発現するが、IL-12(IL-12p75)・IL-23・IL-27の形成に必要なIL-12p40・IL-12p28の共発現は起こさないので、EBI3・IL-12p35・IL-12p19と関わる未知のIL-12関連分子の存在が示唆された[75]。最終的には、EBI3が制御性T細胞の転写因子Foxp3の下流標的遺伝子であることが判明し、EBI3はIL-12p35と二量体を形成することで免疫抑制系のサイトカインの一種であるIL-35を形成し、このIL-35はFoxp3を発現する制御性T細胞の増大と免疫抑制系サイトカインのIL-10の産生増大に寄与しTh17細胞への分化を阻止することが判明した(IL-35はマウスのコラーゲン関節炎を効率的に抑制したが、IFN-γの合成も増大した)[76][77]。EBI3をノックアウトしIL-35を欠損させたマウスではTh1・Th17細胞性の腸炎が発症することが分かっている[78]。
IBDの治療においてよくアザチオプリン・メルカプトプリンといったチオプリン系の免疫抑制剤、TNF-α拮抗剤(インフリキシマブ・アダリムマブ)が用いられるが、これはEBVによる日和見リンパ腫のリスク因子となることが分かっている[79][80][81]。IBD患者における悪性リンパ腫発症のスペクトルを調べた研究もあり、腸粘膜において異型性浸潤が見つかった場合、EBVの検査をするべきと結論づけている研究もある[82]。
また、小児のIBDに先天的EBV特異的免疫不全症を引き起こすX連鎖リンパ増殖症候群(X-linked lymphoproliferative syndrome;XLP、ダンカン病)の原因遺伝子のうちの一つXIAPに変異があることがよくある(4%)[83]。
その他の疾患との関連
[編集]慢性活動性EBウイルス感染症
[編集]慢性活動性EBウイルス感染症(chronic active EBV infection;CAEBV)は、EBVが感染しているNK細胞もしくはT細胞の増殖性疾患である。抗ウイルスカプシド抗原(anti-viral capsid antigens;VCA)-IgG・抗初期抗原(anti-early antigens;EA)-IgGといった溶解感染関連遺伝子に対する抗体価が高いケースが多いために“慢性活動性“という名称をつけられている[注釈 17]が、増殖しているT/NK細胞においてEBVは、他のEBV陽性がん同様、溶解感染ではなく潜伏状態にある。
伝染性単核球症においてはEBVはB細胞を感染ターゲットとしているのに対し、CAEBVにおいてはNK細胞やT細胞がEBVの感染ターゲットとしている点が異なる。CAEBV患者の組織においては、EBER-1の in situ ハイブリダイゼーションによって多くのEBV感染に感染したリンパ球を認めることができ、患者の末梢血単核球(peripheral blood mononuclear cells ; PBMC)でEBVゲノムが高値となることが多い[注釈 17]。
伝染性単核症様の症状が長期継続するほか、蚊刺過敏症、種痘様水疱症、赤血球貪食症候群などが随伴する場合がある。まれな疾患ではあるが、日本を含む東アジアでは比較的発症率が高い。少なくとも一部のケースにおいては、慢性活動性EBウイルス感染症から悪性転化してT/NKリンパ腫を生じる。また、主たるEBV感染細胞がT細胞かNK細胞かによって予後が異なる[注釈 17]。EBV感染細胞の主体が CD3+細胞の場合はT細胞型とし、さらにCD4+細胞とCD8+細胞に分類される。EBVによる赤血球貪食症候群の場合にはEBVの感染しているリンパ球はCD8+細胞であることがほとんどであり、CAEBVでは主にCD4+細胞に感染していることが多い。特に活性化したT細胞により多くのEBV感染細胞が認められる。CD3-かつCD16+またはCD56+細胞にEBVが感染している場合にはNK細胞型と分類される[注釈 17]。
T細胞型CAEBVは、高熱とVCA-IgG・EA-IgGの抗体価が高いことが特徴である。これは、EBVに感染したT細胞が活性化し、インターフェロンγ・IL-6・TNF-αなどの炎症性サイトカインを放出した結果、重症な炎症と発熱が引き起こされると考えられている[注釈 17]。
一方NK細胞型CAEBVは・HMB・大顆粒リンパ球増加症・IgE抗体価が高いことが特徴である[注釈 17]。
EBVはB細胞においてCD40L発現を誘発し、CD40とCD40Lの共発現を引き起こす[84]。この2分子間の相互作用は、共刺激(co-stimulation)による細胞生存シグナルを出すことでB細胞形質転換において大きな役割を担う。また、今までEBV感染による CD40とCD40L共発現はB細胞についてのみ言われてきたが、EBVに関連したT/NK細胞の増殖においても、CD40-CD40LシグナルがT細胞やNK細胞の不死化を促進しているのではないかと考えられている[85]。
α-シヌクレイン凝集が関与する疾患
[編集]パーキンソン病・レビー小体型認知症・多系統萎縮症といったα-シヌクレイン凝集が関与する神経変性疾患とEBVの関わりが指摘されている。EBVの潜伏感染遺伝子産物のLMP-1に対する抗体が、α-シヌクレインに対して交叉反応(クロスリアクション)することが示されている[注釈 10]。
不思議の国のアリス症候群
[編集]不思議の国のアリス症候群(Alice in Wonderland syndrome;AIWS)とは、知覚された外界のものの大きさや自分の体の大きさが通常とは異なって感じられることを主症状とし、様々な主観的なイメージの変容を引き起こす症候群である。
この症状はEBVの初感染によって引き起こされた中枢神経系での報告が多い[86][87]。EBウイルスに罹患した患者において、限定された画像法でのみ短期間で一過性の大脳皮質の広範囲の変異が認められたという報告があるが[88]、限局した病巣を認めるような報告はなく、脳の広い範囲が関わっているものと示唆される。
急性腎不全
[編集]EBVの初感染に伴い、急性腎不全を起こすことがある。原因不明の急性腎不全を起こした小児においては、EBVを病因として考慮すべきである[89]。
予防と治療
[編集]ワクチン
[編集]EBVに対するワクチンは今の所できていない[注釈 11]。2006年から2008年にかけて何回かの臨床試験が行われていた[90][91][注釈 18]。EBVのgp350などがワクチンの標的として支持されてきた[92][注釈 18]。また、EBVのウイルス様粒子(virus-like particle;VLP)を用いたEBVワクチンの開発が活発に行われている[93]。
EBVに対するワクチンを開発する際に障害となっているのは、EBVが潜伏感染と溶解感染で全く違ったウイルス蛋白を発現するというところである。EBVの溶解感染遺伝子の転写産物(gp350など)を標的としたワクチンを作ったとしても、EBVの潜伏感染時には発現されない。
特にEBVが感染したB細胞内で潜伏感染のI型をとっている時にはEBNA-1とEBERsのみの発現となっているので、CD8+細胞傷害性T細胞がそのEBV感染B細胞を排除することは困難を極める。
抗ウイルス剤
[編集]
EBVに対して有効な抗ウイルス剤は存在するが、以下に述べる理由で日本においては使用できない状況にある[注釈 1]。ゆえに、伝染性単核球症などのEBV感染症の治療法は対症療法となっており、重症例には主に副腎皮質ステロイド投与やガンマグロブリン大量投与が用いられる[注釈 1]。
過去にはEBVに有効な抗ウイルス剤であるソリブジンがあった[94][注釈 12][94]が、抗がん剤5-FUとの併用で薬害事故が起き、現在販売は自主的に停止されている状態にある。ソリブジンの代謝産物であるブロモビニルウラシル(BVU)は、5-FUの代謝酵素であるDPD(dihydropyrimidine dehydrogenase)と結合して、不可逆的に阻害し、5-FUの血中濃度を上げ、5-FUの副作用である白血球減少、血小板減少などの血液障害や重篤な消化管障害を引き起こす。これがソリブジン薬害事故の原因である。
しかし、ソリブジンは安全情報や5-FUとの併用禁忌などの情報周知を徹底すれば、存続可能な薬であった[注釈 13]。
ソリブジンに類似した抗ウイルス剤のブリブジンもまたEBVに有効であるが[注釈 12]、ソリブジン薬害事故があった日本においては、ブリブジンの代謝産物はソリブジンと同じBVUであるがゆえに、使用できない状況にある。
また、現行の抗ヘルペスウイルス剤のアシクロビルのEBVに対する効果は限定的である[注釈 12]。慢性活動性EBウイルス感染症の治療の一つとしてアシクロビルの大量投与があるが、これも効果は限定的である[注釈 1]。
ウイルス学
[編集]この節は内容が専門的であり、一般の閲覧者にはわかりにくくなっているおそれがあります。 |
構造とゲノム
[編集]
EBウイルス(EBV, Epstein-Barr virus)は直径約122〜180nmであり、約17万2千対の塩基対と約85個の遺伝子をコードする二本鎖DNAで構成されている[注釈 2]。
ガンマヘルペスウイルス亜科リンフォクリプトウイルス(Lymphocryptovirus)属に分類されるウイルスで、ヒトヘルペスウイルス4型(HHV-4, Human herpesvirus 4)とも呼ばれるヒトに感染するヘルペスウイルスの一種である。
ウイルスのDNAはタンパク質のヌクレオカプシド(nucleocapsid)に包まれている。このヌクレオカプシドはタンパク質でできたテグメント(tegument)に囲われ、そのテグメントはさらに脂質と宿主の細胞への感染時に必要不可欠な膜糖タンパク質を含むエンベロープ(envelop)で覆われている[注釈 19]。
指向性
[編集]指向性とは、EBVがどの細胞に感染するかについてである。EBVはB細胞(B cell)や上皮系細胞(epithelial cells)をはじめ、T細胞やNK細胞など様々な細胞に感染する[95][注釈 1]。
EBVの膜糖タンパク質のgH・gL・gp42複合体は、B細胞膜へのフュージョンを引き起こすが、gH・gL複合体はそれで上皮系細胞膜へのフュージョンを引き起こす。B細胞の中で複製されたEBVはgH・gL・gp42複合体をあまり発現していない。その理由はgH・gL・gp42複合体はB細胞の小胞体に発現しているMHC(HLA)クラスⅡ分子に反応し分解されてしまうからである。対して、上皮系細胞は通常MHCクラスⅡ分子を発現していないので、上皮系細胞にて複製されたEBVはgH・gL・gp42複合体を豊富に発現している。結果として、B細胞にて複製されたEBVは上皮系細胞に、上皮系細胞にて複製されたEBVはB細胞により感染指向性を持つことになる。gp42を欠いたEBVはB細胞に結合はするものの、感染はできない[96]。
複製周期
[編集]細胞への侵入
[編集]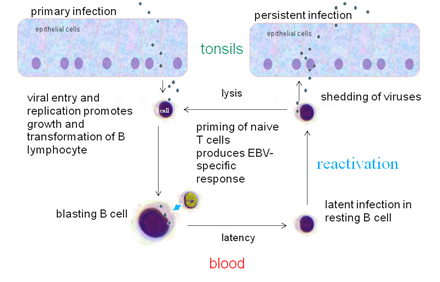
EBVはB細胞と上皮系細胞に主に感染できる。これら二つの細胞への侵入機構は異なっている。
B細胞に侵入する際、EBVの膜糖タンパク質であるgp350はB細胞の補体レセプターであるCR2(complement receptor 2)に結合する(CR2はCD21としても知られている)。そして、EBVの膜糖タンパク質であるgp42がB細胞のMHC(HLA)クラスⅡ分子に作用する。これはウイルスのエンベロープと細胞膜とのフュージョンを引き起こし、EBVがB細胞内に侵入することを許してしまう[注釈 19]。CR2(CD21)陰性の細胞、例えば未成熟B細胞は補体レセプターCR1(complement receptor 1)またの名をCD35を発現しているが、これがもう一つのEBV膜タンパク質gp350/220の接着因子として働き、CR2(CD21)陰性の細胞への感染も可能としている。EBVの感染はCR1(CD35)の発現を低下させる[97]。
上皮系細胞への侵入に関しては、EBVのBMRF-2が上皮系細胞のβ1インテグリンに作用する。そしてEBVのgH・gL複合体が上皮系細胞のαvβ6・αvβ8インテグリンに作用する。これはウイルスのエンベロープと細胞膜とのフュージョンを引き起こし、EBVが上皮系細胞内に侵入することを許してしまう[注釈 19]。B細胞への侵入とは異なり、EBVのgp42はEBVの上皮系細胞への侵入を妨げてしまう。
EBVは細胞内に侵入すると、ウイルスカプシドは分解されウイルスゲノムは宿主の細胞核に輸送される。
溶解感染
[編集]溶解感染(lytic infection)、またの名をウイルス産生感染(productive infection)とは、感染力のあるウイルス粒子(ビリオン)の産生が行われることである。EBVは細胞に感染すると、多くは後述の潜伏感染を成立させて持続的に維持されるが、ごく一部が再活性化し、溶解感染を引き起こして子孫ウイルスを産生する。EBVはB細胞ないしは上皮系細胞にて溶解感染を行うことができる。B細胞においては、EBVの溶解感染は通常EBVの潜伏感染からの再活性化の後のみに行われる。上皮系細胞においてはしばしば、EBVの侵入とともに溶解感染が直ちに行われる[注釈 19]。
潜伏状態のEBVゲノムは円環状であり、溶解感染を引き起こす再活性化の過程においてそのゲノムは直線状にされなければならない。溶解感染におけるウイルス粒子複製においてウイルスのDNAポリメラーゼがウイルスゲノムの複製を担う。潜伏感染においてはウイルスゲノムの複製を宿主のDNAポリメラーゼが担うのとは対照的である[注釈 19]。
溶解感染遺伝子産物は連続した三段階のカスケードにおいて産生される。一般にヘルペスウイルス溶解感染の遺伝子は、厳密に制御されたカスケード様の発現パターンを示す。その三段階は前初期(immediate-early;IE)、初期(early;E)、後期(late;L)と区別されている[注釈 19]。最も始めに前初期(IE)遺伝子が発現する。前初期遺伝子には転写活性化因子など遺伝子発現に関わる遺伝子が含まれており、これによって初期(E)、および後期(L)遺伝子の発現が誘導される。初期遺伝子にはウイルスDNA複製に関係する酵素などが含まれており、後期遺伝子には糖タンパクなどウイルス粒子構成タンパクが含まれる。発現した材料でウイルス粒子を再構成し、複製したウイルスDNAをパッケージングした上、成熟して細胞の外に放出する。
前初期遺伝子産物としてはBZLF-1(別名Zta, EB-1, ZEBRA)・BRLF-1(別名Rta)があり、初期遺伝子の転写活性化因子として働き、潜伏状態にあったウイルスを溶解感染に誘導する上で非常に重要な働きをする。
初期遺伝子産物はより多くの機能を持ち、ウイルス粒子の複製・代謝・宿主の抗原処理の阻害などを行う。初期遺伝子として、BALF-5と呼ばれるウイルスDNAポリメラーゼ、BMRF-1(early antigen diffuse;EA-Dとしても知られる)と呼ばれるDNAポリメラーゼプロセッシビティファクターなどのDNA合成関連遺伝子群のほか、Bcl-2のホモログであるBHRF-1(vBcl-2)なども発現する。BNLF-2も初期遺伝子に含まれる[注釈 19]。
後期遺伝子産物は主にEBVの構成因子であり、例えばEBVウイルスカプシド抗原(Epstein-Barr virus viral capsid antigen;EBV-VCA)といったウイルスのヌクレオカプシドの構成因子、糖タンパクなどである。他の後期遺伝子産物、例えばBCRF-1は、EBVの宿主の免疫機構からの隠避を補助する[注釈 19]。
ある研究では、緑茶のポリフェノールの一種であるEGCG(Epigallocatechin gallate)によって、ウイルスDNA・溶解感染遺伝子転写・EBVの溶解感染遺伝子のZta・Rta、Rtaによって誘導される初期抗原複合体EA-D等の遺伝子転写産物の時間当たりの量が、用量依存的に阻害されていくことが示されている(しかしながら、EBVの感染ステージにおいて高く定常的に発現される遺伝子のEBNA-1の発現には影響がなかった)[注釈 20]。そのシグナル経路の特異的な阻害因子によって、Ras/MEK/MAPK経路がBZLF-1を通して、PI3-K経路がBRLF-1を通してEBVの溶解感染に寄与していることが支持された。後者の場合において、EGCGはEBVの溶解感染を誘導するBRLF-1アデノウイルスベクターの能力を完全に阻止したのである[注釈 20]。さらに、腫瘍プロモーター12-O-テトラデカノイルホルボール13-アセタート・酪酸ナトリウムを用いて潜伏感染状態にあるEBV感染B細胞の免疫による破壊をどのように誘導するかを決定づけるために、EBVの遺伝子の発現・不発現が今現在も研究されている[注釈 20]。
潜伏感染
[編集]前述の溶解感染とは異なり、潜伏感染(latent infection, latency)は感染力のあるウイルス粒子(ビリオン)の産生が行われない[注釈 19]。潜伏期においては、EBVはごく限られた遺伝子群(latent genes;潜伏感染遺伝子)のみを発現し[注釈 2]、ウイルスゲノムは細胞核内で宿主染色体に付着してエピソームとして存在する[注釈 19]。宿主の細胞分裂サイクルに同調してS期に一回複製し、娘染色体に付着して分配されることで宿主が複製、分裂してもウイルスが希釈、減少することなく維持される。
EBV潜伏感染は潜伏感染遺伝子の発現パターンによってI型・II型・III型の3つに分類されており、限られた種類の異なるウイルスタンパク質・ウイルスRNAの産生が行われる[98][99]。
| 潜伏感染遺伝子 | EBNA-1 | EBNA-2 | EBNA-3A | EBNA-3B | EBNA-3C | EBNA-LP | LMP-1 | LMP-2A | LMP-2B | EBER |
|---|---|---|---|---|---|---|---|---|---|---|
| 産生物 | 蛋白 | 蛋白 | 蛋白 | 蛋白 | 蛋白 | 蛋白 | 蛋白 | 蛋白 | 蛋白 | ノンコーディングRNA |
| I型 | + | – | – | – | – | – | – | – | – | + |
| II型 | + | – | – | – | – | + | + | + | + | + |
| III型 | + | + | + | + | + | + | + | + | + | + |
EBVはB細胞と上皮系細胞で潜伏的に持続感染できるが、その時の潜伏感染遺伝子の発現パターンは潜伏感染している細胞がB細胞か上皮系細胞かによって異なる。なお、メモリーB細胞でのEBV感染様式として、EBER以外ウイルス遺伝子の発現がほとんど確認できない0型という潜伏様式の存在も確認されている。
B細胞においてはI型・II型・III型全ての潜伏感染遺伝子発現パターンが可能である[注釈 2]。EBVの潜伏感染は通常III型・II型・I型の順に進む。それぞれの発現パターンはB細胞の振る舞いに特異な影響を与える[注釈 2]。休眠中のナイーブB細胞に感染する際には、EBVはIII型の潜伏感染から行う。III型の潜伏感染において産生されるタンパク質とRNAによってその休眠中のナイーブB細胞は形質転換により増殖性芽球(ないしはB細胞の活性化として知られる)になる[注釈 2][注釈 19]。その後、EBVはその潜伏感染遺伝子の発現を制限し、II型の潜伏感染へと突入する。II型の潜伏感染で発現されたタンパク質とRNAはB細胞をメモリーB細胞へと分化させる[注釈 2][注釈 19]。最終的にはEBVはさらにその潜伏感染遺伝子の発現を制限し、I型の潜伏感染へと移行する。I型の潜伏感染において産生されるEBNA-1はEBVゲノムを宿主染色体につなぎ止めるアンカーとして働き、メモリーB細胞が分裂する際に複製されることを可能としている[注釈 2][注釈 19]。
上皮系細胞においては、II型の潜伏感染のみが可能である[要出典]。
初感染時には、EBVは口腔咽頭の上皮系細胞にて自身の複製を行い、そしてB細胞にてIII型・II型・I型の潜伏感染を成立させる。B細胞における潜伏感染はEBVの持続感染には欠かせず、その後に上皮系細胞での複製・唾液への感染力のあるウイルス粒子の排出が行われる。EBVのB細胞におけるIII型・II型、口腔内上皮系細胞におけるII型、ないしはT細胞・NK細胞におけるII型の潜伏感染は悪性腫瘍になることもあり、これらは一様のEBVゲノムの存在と遺伝子発現によって特徴付けられる[100]。
EBV陽性がん細胞においてもウイルスは基本的には潜伏状態にあり、LMP-1などのがん遺伝子を発現して腫瘍性増殖をサポートする。一方でEBVの再活性化や溶解感染も、がんの発生維持進展に一定の貢献をしていると考えられる。
I型潜伏感染はバーキットリンパ腫、胃癌などに見られる様式で、EBNA-1・EBERを発現している。II型感染はホジキンリンパ腫、NK/Tリンパ腫、上咽頭癌、乳癌などに見られ、I型で発現している遺伝子に加えてLMP-1・LMP-2A,Bを発現する。III型は日和見リンパ腫や、培養細胞レベルでEBVをBリンパ球に感染、不死化させた場合(リンパ芽球様細胞, LCLs, lymphoblastoid cell linesと呼ばれる)に見られ、II型に加えてEBNA-2・EBNA-3A,B,C・EBNA-LPなどを発現する。
以下、代表的な潜伏感染遺伝子について簡単に説明する。LMP-1はEBVのコードする最も主要ながん遺伝子である。細胞膜上に存在し、CD40のシグナルを模倣して恒常的にNF-kB・MAPK・STAT・Aktなどを活性化することでB細胞増殖を亢進する。LMP-2AはB細胞受容体を模倣して、AKTやカルシウムシグナルを活性化する。EBERはタンパクをコードしていない低分子量RNAで、RNApol IIIによって極めて多量に転写されるため、in situ ハイブリダイゼーションなどによるウイルス検出のマーカーとしてよく利用される。EBNA-2はIII型の潜伏感染においてLMP-1などの転写を増強することで不死化に関与する。EBNA-2自身はDNAに結合できないため転写因子としては働けないが、RBP-JκやPU.1など宿主の転写因子と結合することで転写補助因子として機能する。
再活性化
[編集]潜伏感染状態にあるEBVは溶解感染(ウイルス産生感染)へと感染形式を切り替えることができ、これを再活性化(reactivation)という。生体内(in vivo)においてこの切り替えが起こることは知られているが、何が引き金となっているのかは十分には明らかとなっていない。
特に溶解感染の前初期遺伝子 BZLF-1 は b-Zip 型の転写因子をコードしており、潜伏状態からの再活性化に必要かつ十分な再活性化責任遺伝子である。しかし BZLF-1 の発現は転写レベルで厳密に制御されているため、BZLF-1 の転写を研究することはすなわち、EBV 再活性化のメカニズムについて明らかにすることと同値となる。ゆえに、世界中の多くの研究者がこの BZLF-1 のプロモーター領域に注目して研究を行っている[101]。
実験環境下(in vitro)においては、潜伏感染状態にあるEBVはB細胞受容体(免疫グロブリン;Ig)を抗Ig抗体でクロスリンクすることなどにより誘導できることが分かっており、ゆえに生体内におけるEBVの再活性化は潜伏感染状態にあるB細胞に特異な抗原刺激により起こると思われる[注釈 1][注釈 19]。また実験環境下(in vitro)においては、EBVの潜伏感染状態にあるB細胞を腫瘍プロモーター12-O-テトラデカノイルホルボール13-アセタート・酪酸ナトリウムに曝露することでEBVの再活性化が行われることが確かめられている[注釈 1]。
B細胞の形質転換
[編集]実験環境下(in vitro)において培養B細胞にEBVを感染させると、そのB細胞はEBVのウイルスタンパク質によって形質転換しリンパ芽球様細胞(lymphoblastoid cell lines;LCLs)と呼ばれ、不死化し無限に成長することが可能となる。
EBNA-2・EBNA-3C・LMP-1がB細胞の形質転換に必須であるが、EBNA-LPとEBERsはそうではない[102]。
EBVの自然感染の後、持続感染を成立させるためにEBVはその遺伝子のいくつかないしは全ての発現を実行すると考えられている。宿主のEBVに対する免疫が無いとすると、宿主の他の(おそらく)B細胞に感染するために溶解感染サイクルが大量の感染性のウイルスが産生するだろう。
潜伏感染遺伝子発現パターンは再構成され、EBVに感染したB細胞を増殖させ、EBVに感染したB細胞をEBVが持続感染するであろう器官に運搬することになる。結果として、宿主のEBVに対する獲得免疫が確立した時には、もう既にウイルスの遺伝子の殆ど(ないしは全て)の発現をオフにすることで、ウイルスは持続感染を成立させているのである。そして時たま再活性化して新しい感染性のウイルス粒子(ビリオン)を産生する。ウイルスの再活性化とウイルスの遺伝子発現を活性化している細胞を除去する免疫監視機構とのある種の均衡は結果的には崩れる。
EBVの持続感染器官として骨髄が選ばれることもありうる。EBV陽性の骨髄移植患者が、EBV陰性のドナーから骨髄の提供を受けた後にEBVが陰性となったこともある[103]。
潜伏感染遺伝子抗原
[編集]全てのEBV核抗原(EBV nuclear antigens;EBNAs)は、EBVのゲノム左端のC/Wプロモーター領域から始まる遺伝子を転写した伝令RNAの選択的スプライシングにより産生される。6種類のEBNAsが、EBNA-LP・EBNA-2・EBNA-3A・EBNA-3B・EBNA-3C・EBNA-1の順番で並んでいる[注釈 1]。EBNA-1の転写に固有のプロモーターであるQプロモーターの存在も知られており、EBV関連の癌細胞ではもっぱらこのプロモーターが用いられている。したがって、殆どのEBV関連の癌細胞では6種類のEBNAsのうちEBNA-1のみが発現している[注釈 1]。
EBNA-LPコーディング領域の開始コドンは、その遺伝子を転写した伝令RNAの選択的スプライシングにより構成される。この開始コドンが無い状態では、EBNA-2・EBNA-3A・EBNA-3B・EBNA-3C・EBNA-1の各々の発現は、これらの遺伝子のうちどれが選択的スプライジングされてそのEBV核抗原として転写されたかに依って決まる。
ウイルスタンパク質・遺伝子・抗原
[編集]| 蛋白・遺伝子・抗原 | 感染形式 | 機能など |
|---|---|---|
| EBNA-1 | 潜伏
・ 溶解 |
EBNA-1蛋白はEBVゲノムの複製起点(oriP)に結合し、宿主の感染細胞の分裂の際にEBVの複製とエピゾームの分割を引き起こす。この蛋白は潜伏感染のI型のみで発現されるEBV蛋白である。転写活性能をもち、EBV感染細胞の形質転換に必要な, EBNAs・LMP1遺伝子を発現させ・アポトーシス阻害などにより感染細胞の増殖・生存に働く[注釈 21]。 |
| EBNA-2 | 潜伏
・ 溶解 |
EBVの主要な転写促進因子である。 |
| EBNA-3 | 潜伏
・ 溶解 |
これらのEBV蛋白は宿主のRBP-Jκ蛋白に結合する。 |
| LMP-1 | 潜伏 | LMP-1は6個の膜貫通ドメインをもつ膜タンパク質で細胞膜上で二量体を形成する。C末端細胞内領域には transformation effector site (TES)-1, -2とよばれる不死化活性を担うドメインが存在し、EBV感染したB細胞の不死化に必須なEBV蛋白でもある。TES-1, 2に TNF-receptor-associated factor(TRAF)と TNF-receptor-associated death domain(TRADD)が会合し, 細胞内シグナルを惹起し、NF-κB・c-JUN N-terminal kinase(JNK)・p38MAPK経路などがリガンド非依存的に恒常的に活性化される。この活性化経路は、B細胞活性化・増殖・免疫グロブリン(Ig)クラススイッチ・胚中心形成に必要なCD40シグナル伝達と同じ経路であり、LMP-1は共刺激分子CD40からのシグナル伝達を模倣している[104][注釈 21]。NF-κBの活性化を通して、CD23・CD39・CD40・CD44・LFA-1・LFA-3・ICAM-1発現活性化、免疫グロブリン(Ig)クラススイッチに必要な活性化誘導シチジンデアミナーゼ(AID)の遺伝子AICDAの転写が活性化される[105]。Bcl-2誘導によるアポトーシス回避。 |
| LMP-2 | 潜伏 | LMP-2A・LMP-2Bはチロシンキナーゼシグナル経路を阻害する膜貫通型蛋白である。LMP-2AのN末端細胞内領域は、ITAMをもち、Lyn・SykなどSrc family thyrosin kinaseが会合してMAPキナーゼ・PI3K・Aktなどの活性化を来す。この活性化経路は、B細胞受容体(BCR)が活性化されたのと同様のシグナル活性化経路であり、LMP-2AはこのB細胞受容体(BCR)活性化経路を摸倣している[106][注釈 21]。 |
| EBER | 潜伏 | EBER-1/EBER-2は核小体低分子RNAであり、ある種の核蛋白粒子に結合しPKR (二重RNA依存性セリン・トレオニンプロテインキナーゼ) に結合することを可能とさせ、ゆえにその機能を阻害する。EBER粒子はまたIL-10の産生を誘導し、EBVに感染した細胞の成長と細胞傷害性T細胞の働きを阻害する。 |
| v-snoRNA1 | 潜伏 | v-snoRNA1(Epstein–Barr virus snoRNA1)はEBVの潜伏感染期に産生される核小体低分子RNAのうちboxC/Dに分類されるものである。v-snoRNA1はマイクロRNAのような24ヌクレオチドのRNAへと切断される前駆体で、ウイルスのDNAポリメラーゼの伝令RNAの3'UTRを標的とする。 |
| ebv-sisRNA | 潜伏 | ebv-sisRNA-1は潜伏感染のIII型において生成されるstable intronic sequence RNAである。EBERsに次いでebv-sisRNA-1はIII型において3番目に多いsmallRNAである。 |
| miRNAs | 潜伏 | EBVのマイクロRNA(miRNAs)は二つの遺伝子(BART遺伝子の中とBHRF-1遺伝子クラスターの近く)によってエンコードされている。3種のBHRF-1マイクロRNAは潜伏感染のIII型で産生されるのに対し、BARTのマイクロRNAの多く(多くて20種のマイクロRNA)は潜伏感染のII型で産生される。これらのマイクロRNAの働きは未だよく分かっていない。 |
| EBV-EA | 溶解 | 溶解感染初期抗原 |
| EBV-MA | 溶解 | 膜抗原 |
| EBV-VCA | 溶解 | ウイルスカプシド抗原 |
| EBV-AN | 溶解 | アルカリヌクレアーぜ |
EBVの種類
[編集]EBVは2つの種類、EBV type 1とEBV type 2に分けられる。これら二つの種は異なるEBNA-3遺伝子を持つ。結果として、これらのEBV種の違いによって形質転換能力と再活性化能力に違いが起こる。EBV type 1は殆ど全世界において主要な種となっているが、アフリカでは両種とも同等に普遍的である。これら二つの種は、ウイルスのゲノムを制限酵素によって切断し、ゲル電気泳動によって得られる切断パターンを比べることで見分けることができる[注釈 19]。
技術と応用
[編集]先に述べたようにEBVはB細胞(Bリンパ球)に感染してそれを形質転換でき、試験管内(in vitro)ではB細胞クローンを不死化させる手段に応用される[注釈 14]。さらに、EBVはBリンパ球の増殖及び抗体産生を誘導する活性を有している[注釈 15]。至適な条件ではほぼ100%のBリンパ球に増殖を誘導でき、感染した細胞は6ヶ月間以上安定に増殖する[注釈 15]。
EBVによりヒトBリンパ球の増殖を誘導し、そこから特定の抗体を産生するリンパ球クローンを分離することはスウェーデンの研究者によって1977年に報告されている[107]。また、日本でも1980年代前半に日本大学の研究グループが各種抗体の作製を報告している[108]。
近年、このEBVのBリンパ球の形質転換を利用した完全ヒトモノクローナル抗体を作成する技術が確立された[注釈 15]。EBV法で作製した抗体は中和活性・結合活性が高く、主要な抗体作成法であるハイブリドーマ法よりも活性の高い抗体を作製できる[注釈 15]。EBV法には自己成分に対する抗体は特殊な場合を除いて作製し難いという欠点があるが、外来抗原に対する抗体作製では素晴らしい方法となっている[注釈 15]。
注釈
[編集]- ^ a b c d e f g h i j k l m n o p q r s 新村眞人, 山西弘一 (1996).「ヘルペスウイルス感染症」中外医学社. ISBN 4-947623-18-7.
- ^ a b c d e f g h i Amon W, Farrell PJ (2004). "Reactivation of Epstein–Barr virus from latency". Reviews in Medical Virology. 15 (3): 149–56., PMID 15546128, doi:10.1002/rmv.456
- ^ a b c Hu H, Luo ML, Desmedt C, Nabavi S, Yadegarynia S, Hong A, Konstantinopoulos PA, Gabrielson E, Hines-Boykin R, Pihan G, Yuan X, Sotirious C, Dittmer DP, Fingeroth JD, Wulf GM (2016). "Epstein-Barr Virus Infection of Mammary Epithelial Cells Promotes Malignant Transformation". EBioMedicine. 9: 148-60., PMC 4972522, PMID 27333046, doi:10.1016/j.ebiom.2016.05.025
- ^ a b c Pender MP (2012). "CD8+ T-Cell Deficiency, Epstein-Barr Virus Infection, Vitamin D Deficiency, and Steps to Autoimmunity: A Unifying Hypothesis". Autoimmune Diseases. 2012: 189096., PMC 3270541, PMID 22312480, doi:10.1155/2012/189096
- ^ a b c d e Minamitani T, Yasui T, Ma Y, Zhou H, Okuzaki D, Tsai CY, Sakakibara S, Gewurz BE, Kieff E, Kikutani H (2015). "Evasion of affinity-based selection in germinal centers by Epstein-Barr virus LMP2A". Proceedings of the National Academy of Sciences of the United States of America. 112 (37): 11612-7., PMC 4577157, PMID 26305967, doi:10.1073/pnas.1514484112
- ^ a b c d 自己免疫疾患の引き金となるウイルス因子を同定 リソウ 2015年8月25日
- ^ a b c d 【坂口至徳の科学の現場を歩く】 誰もが感染ヘルペス…EBウイルスの因子を解明 阪大、自己免疫疾患の治療に道産経WEST 2015年8月28日
- ^ a b c d e Nagata K, Kumata K, Nakayama Y, Satoh Y, Sugihara H, Hara S, Matsushita M, Kuwamoto S, Kato M, Murakami I, Hayashi K (2017). "Epstein-Barr Virus Lytic Reactivation Activates B Cells Polyclonally and Induces Activation-Induced Cytidine Deaminase Expression: A Mechanism Underlying Autoimmunity and Its Contribution to Graves' Disease". Viral Immunology. 30 (3): 240-249., PMC 5393416, PMID 2833576, doi:10.1089/vim.2016.0179
- ^ a b c d e 長田佳子、林一彦「EBウイルスはバセドウ病の発症や憎悪の最終因子となる」臨床免疫・アレルギー科 = Clinical immunology & allergology. 66 (3), 261-266, 2016-09. 科学評論社
- ^ a b Woulfe J, Hoogendoorn H, Tarnopolsky M, Muñoz DG (2000). “Monoclonal antibodies against Epstein-Barr virus cross-react with alpha-synuclein in human brain”. Neurology 55 (9): 1398-1401., PMID 11087792, doi:10.1212/WNL.55.9.1398
- ^ a b Sokal EM, Hoppenbrouwers K, Vandermeulen C, Moutschen M, Léonard P, Moreels A, Haumont M, Bollen A, Smets F, Denis M (2007). “Recombinant gp350 vaccine for infectious mononucleosis: a phase 2, randomized, double-blind, placebo-controlled trial to evaluate the safety, immunogenicity, and efficacy of an Epstein-Barr virus vaccine in healthy young adults”. The Journal of Infectious Diseases. 196 (12): 1749–53., PMID 18190254, doi:10.1086/523813
- ^ a b c d Lin, J. C.; Machida, H. (1988-7). “Comparison of two bromovinyl nucleoside analogs, 1-beta-D-arabinofuranosyl-E-5-(2-bromovinyl)uracil and E-5-(2-bromovinyl)-2'-deoxyuridine, with acyclovir in inhibition of Epstein-Barr virus replication”. Antimicrobial Agents and Chemotherapy 32 (7): 1068–1072. ISSN 0066-4804. PMC 172345. PMID 2847639.
- ^ a b “ソリブジン物語:この世から消えた有用な医薬品”. kusuri-jouhou.com. 2018年7月13日閲覧。
- ^ a b Janeway's men'eki seibutsugaku. Murphy, Kenneth P., Travers, Paul, 1956-, Walport, Mark., Sasazuki, Takehiko, 1940-, 笹月, 健彦, 1940-. Tōkyō: Nankōdō. (2010). ISBN 9784524253197. OCLC 703356094
- ^ a b c d e f 高田賢蔵 (2012).「特集 基礎から拓くDDS創薬フロンティア 抗体ベンチャー(イーベック)」. Drug Delivery System. 2012年 27巻 1号 p.40-46, doi:10.2745/dds.27.40
- ^ a b c 武井正美 (2014)「関節リウマチの原因としてのEpstein-Barr ウイルス」 日大医誌. 2014年 73巻 1号 p.45-49, doi:10.4264/numa.73.45
- ^ a b c d e f 金兼弘和, 新井真理奈, 谷内江昭宏 (2010).「【話題の感染症】 慢性活動性EBウイルス感染症」. モダンメディア. 2010年 56 (5): p.93-99.
- ^ a b Moutschen, Michel; Léonard, Philippe; Sokal, Etienne M.; Smets, Françoise; Haumont, Michèle; Mazzu, Pasqualina; Bollen, Alex; Denamur, Francoise et al. (2007-06-11). “Phase I/II studies to evaluate safety and immunogenicity of a recombinant gp350 Epstein-Barr virus vaccine in healthy adults”. Vaccine 25 (24): 4697–4705. doi:10.1016/j.vaccine.2007.04.008. ISSN 0264-410X. PMID 17485150.
- ^ a b c d e f g h i j k l m n o Odumade OA, Hogquist KA, Balfour HH Jr (2011). "Progress and Problems in Understanding and Managing Primary Epstein–Barr Virus Infections". American Society for Microbiology. 24 (1): 193–209., PMC 3021204 , PMID 21233512, doi:10.1128/CMR.00044-10
- ^ a b c Liu S, Li H, Chen L, Yang L, Li L, Tao Y, Li W, Li Z, Liu H, Tang M, Bode AM, Dong Z, Cao Y (2013). "(-)-Epigallocatechin-3-gallate inhibition of Epstein-Barr virus spontaneous lytic infection involves ERK1/2 and PI3-K/Akt signaling in EBV-positive cells". Carcinogenesis. 34 (3): 627-37., PMID 23180656, doi:10.1093/carcin/bgs364.
- ^ a b c WikiPathologica「Epstein-Barr virus(EBV)」
脚注
[編集]- ^ “ICTV Taxonomy history: Human gammaherpesvirus 4”. International Committee on Taxonomy of Viruses (ICTV). 16 August 2022時点のオリジナルよりアーカイブ。10 January 2019閲覧。
- ^ Maeda E, Akahane M, Kiryu S, Kato N, Yoshikawa T, Hayashi N, Aoki S, Minami M, Uozaki H, Fukayama M, Ohtomo K (2009). "Spectrum of Epstein–Barr virus-related diseases: a pictorial review". Japanese Journal of Radiology. 27 (1): 4–19., PMID 19373526, doi:10.1007/s11604-008-0291-2
- ^ Dreyfus DH (2011). "Autoimmune disease: A role for new anti-viral therapies?". Autoimmunity Reviews. 11 (2): 88–97., PMID 21871974, doi:10.1016/j.autrev.2011.08.005
- ^ Toussirot E, Roudier J (2008). "Epstein–Barr virus in autoimmune diseases". Best Practice & Research. Clinical Rheumatology. 22 (5): 883–96., PMID 19028369, doi:10.1016/j.berh.2008.09.007
- ^ “人気声優の死 異常なしがEBV感染症…難病指定訴え”. 毎日新聞 (毎日新聞). (2016年2月3日) 2016年5月15日閲覧.
- ^ matsukimiyu. “松来未祐日記”. 松来未祐日記. 2018年7月13日閲覧。
- ^ “病名が分からない苦しみと闘った女性|ザ!世界仰天ニュース”. 日本テレビ. 2018年7月13日閲覧。
- ^ McGrath P (2014). "Cancer virus discovery helped by delayed flight". BBC News, Health.
- ^ Epstein MA, Achong BG, Barr YM (1964). "Virus particles in cultured lymphoblasts from Burkitt's lymphoma". The Lancet. 1: 702–703., doi:10.1016/s0140-6736(64)91524-7
- ^ Epstein MA (2005). "1. The origins of EBV research: discovery and characterization of the virus". In Robertson, Earl S. Epstein–Barr Virus. Trowbridge: Cromwell Press. pp. 1–14. ISBN 1-904455-03-4.
- ^ Erle S. Robertson (2005). Epstein–Barr Virus. Horizon Scientific Press. p. 18. ISBN 978-1-904455-03-5.
- ^ Miller G (2006). "Book Review: Epstein–Barr Virus". New England Journal of Medicine. 355 (25): 2708–2709., doi:10.1056/NEJMbkrev39523
- ^ Henle W, Henle G (1980). "Epidemiologic aspects of Epstein–Barr virus (EBV)-associated diseases". Annals of the New York Academy of Sciences. 354: 326–31., PMID 6261650, doi:10.1111/j.1749-6632.1980.tb27975.x
- ^ Young LS (2009). Desk Encyclopedia of Human and Medical Virology. Boston: Academic Press. pp. 532–533.
- ^ Grierson H, Purtilo DT (1987). "Epstein-Barr virus infections in males with the X-linked lymphoproliferative syndrome". Annals of Internal Medicine. 106 (4): 538-45., PMID 3030174
- ^ Cherry-Peppers G, Daniels CO, Meeks V, Sanders CF, Reznik D (2003). "Oral manifestations in the era of HAART". Journal of the National Medical Association. 95 (2 Suppl 2): 21S–32S., PMC 2568277, PMID 12656429
- ^ MacMahon EM, Glass JD, Hayward SD, Mann RB, Becker PS, Charache P, McArthur JC, Ambinder RF (1991). "Epstein-Barr virus in AIDS-related primary central nervous system lymphoma". The Lancet. 338 (8773): 969-73., PMID 1681341
- ^ Prévot, S.; Néris, J.; de Saint Maur, P. P. (1994). “Detection of Epstein Barr virus in an hepatic leiomyomatous neoplasm in an adult human immunodeficiency virus 1-infected patient”. Virchows Archiv: An International Journal of Pathology 425 (3): 321–325. ISSN 0945-6317. PMID 7812519.
- ^ Wood, Dale; Matsika, Admire; Srinivasan, Bhuvana; Watson, Roger (2017-11-22). “Epstein Barr virus-associated smooth muscle tumour (EBV-SMT) of the urinary bladder”. Urology Case Reports 16: 89–91. doi:10.1016/j.eucr.2017.11.015. ISSN 2214-4420. PMC 5705795. PMID 29226094.
- ^ Lee, E. S.; Locker, J.; Nalesnik, M.; Reyes, J.; Jaffe, R.; Alashari, M.; Nour, B.; Tzakis, A. et al. (1995-01-05). “The association of Epstein-Barr virus with smooth-muscle tumors occurring after organ transplantation”. The New England Journal of Medicine 332 (1): 19–25. doi:10.1056/NEJM199501053320104. ISSN 0028-4793. PMID 7990861.
- ^ McClain, K. L.; Leach, C. T.; Jenson, H. B.; Joshi, V. V.; Pollock, B. H.; Parmley, R. T.; DiCarlo, F. J.; Chadwick, E. G. et al. (01 05, 1995). “Association of Epstein-Barr virus with leiomyosarcomas in young people with AIDS”. The New England Journal of Medicine 332 (1): 12–18. doi:10.1056/NEJM199501053320103. ISSN 0028-4793. PMID 7990860.
- ^ Hamilton-Dutoit, S. J.; Therkildsen, M. H.; Neilsen, N. H.; Jensen, H.; Hansen, J. P.; Pallesen, G. (1991-8). “Undifferentiated carcinoma of the salivary gland in Greenlandic Eskimos: demonstration of Epstein-Barr virus DNA by in situ nucleic acid hybridization”. Human Pathology 22 (8): 811–815. ISSN 0046-8177. PMID 1651284.
- ^ Joshi D, Quadri M, Gangane N, Joshi R, Gangane N (2009). "Association of Epstein Barr virus infection (EBV) with breast cancer in rural Indian women". ProS One. 4 (12): e8180.,PMC 2782138, PMID 19997605, doi:10.1371/journal.pone.0008180
- ^ He JR, Chen LJ, Su Y, Cen YL, Tang LY, Yu DD, Chen WQ, Wang SM, Song EW, Ren ZF (2012). "Joint effects of Epstein-Barr virus and polymorphisms in interleukin-10 and interferon-γ on breast cancer risk". The Journal of Infectious Disease. 205 (1): 64-71., PMID 22095765, doi:10.1093/infdis/jir710
- ^ Peng J, Wang T, Zhu H, Guo J, Li K, Yao Q, Lv Y, Zhang J, He C, Chen J, Wang L, Jin Q (2014). "Multiplex PCR/mass spectrometry screening of biological carcinogenic agents in human mammary tumors". Journal of Clinical Virology. 61 (2): 255-9., PMID 25088618, doi:10.1016/j.jcv.2014.07.010
- ^ Fina F, Romain S, Ouafik L, Palmari J, Ben Ayed F, Benharkat S, Bonnier P, Spyratos F, Foekens JA, Rose C, Buisson M, Gérard H, Reymond MO, Seigneurin JM, Martin PM (2001). "Frequency and genome load of Epstein-Barr virus in 509 breast cancers from different geographical areas". British Journal of Cancer. 84 (6): 783-90., PMC 2363823, PMID 11259092, doi:10.1054/bjoc.2000.1672
- ^ Hachana M, Amara K, Ziadi S, Romdhane E, Gacem RB, Trimeche M (2011). "Investigation of Epstein-Barr virus in breast carcinomas in Tunisia". Pathology - Research and Practice. 207 (11): 695-700., PMID 22024152, doi:10.1016/j.prp.2011.09.007
- ^ Labrecque LG, Barnes DM, Fentiman IS, Griffin BE (1995). "Epstein–Barr virus in epithelial cell tumors: a breast cancer study". Cancer Research. 55 (1): 39-45., PMID 7805038
- ^ Mazouni C, Fina F, Romain S, Ouafik L, Bonnier P, Brandone JM, Martin PM (2011). "Epstein–Barr virus as a marker of biological aggressiveness in breast cancer". British Journal of Cancer. 104 (2): 332-7.,PMC 3031896, PMID 21179039, doi:10.1038/sj.bjc.6606048
- ^ Marrão G, Habib M, Paiva A, Bicout D, Fallecker C, Franco S, Fafi-Kremer S, Simões da Silva T, Morand P, Freire de Oliveira C, Drouet E (2014). "Epstein–Barr virus infection and clinical outcome in breast cancer patients correlate with immune cell TNF-alpha/IFN-gamma response". BMC Cancer. 14: 665., PMC 4171567, PMID 25213133, doi:10.1186/1471-2407-14-665.
- ^ Pender MP (2003). "Infection of autoreactive B lymphocytes with EBV, causing chronic autoimmune diseases". Trends in Immunology. 24(11): 584-8., PMID 14596882, doi:10.1016/j.it.2003.09.005
- ^ Pender MP (2011). "The essential role of Epstein-Barr virus in the pathogenesis of multiple sclerosis". The Neuroscientist. 17 (4): 351-67., PMC 3764840, PMID 21075971, doi:10.1177/107385841038153
- ^ Jin, B.; Ni, H.; Geshang, Q.; Li, Y.; Shen, W.; Shi, H. (2011-2). “HLA-DR4 antigen and idiopathic dilated cardiomyopathy susceptibility: a meta-analysis involving 11,761 subjects”. Tissue Antigens 77 (2): 107–111. doi:10.1111/j.1399-0039.2010.01589.x. ISSN 1399-0039. PMID 21214522.
- ^ Invernizzi, Pietro; Selmi, Carlo; Poli, Francesca; Frison, Sara; Floreani, Annarosa; Alvaro, Domenico; Almasio, Piero; Rosina, Floriano et al. (2008-12). “Human leukocyte antigen polymorphisms in Italian primary biliary cirrhosis: a multicenter study of 664 patients and 1992 healthy controls”. Hepatology (Baltimore, Md.) 48 (6): 1906–1912. doi:10.1002/hep.22567. ISSN 1527-3350. PMC 2592501. PMID 19003916.
- ^ Ahmad, Tariq; Marshall, Sara-E.; Jewell, Derek (2006-06-21). “Genetics of inflammatory bowel disease: the role of the HLA complex”. World Journal of Gastroenterology 12 (23): 3628–3635. doi:10.3748/wjg.v12.i23.3628. ISSN 1007-9327. PMC 4087453. PMID 16773677.
- ^ Sabbatini A, Bombardieri S, Migliorini P (1993). "Autoantibodies from patients with systemic lupus erythematosus bind a shared sequence of SmD and Epstein-Barr virus-encoded nuclear antigen EBNA I". European Journal of Immunology. 23 (5): 1146-52., PMID 8386666, doi:10.1002/eji.1830230525
- ^ Incaprera M, Rindi L, Bazzichi A, Garzelli C (1998). "Potential role of the Epstein-Barr virus in systemic lupus erythematosus autoimmunity". Clinical & Experimental Rheumatology. 16 (3): 289-94., PMID 9631751
- ^ Poole BD, Scofield RH, Harley JB, James JA (2006). "Epstein-Barr virus and molecular mimicry in systemic lupus erythematosus". Autoimmunity. 39 (1): 63-70., PMID 16455583, doi:10.1080/08916930500484849
- ^ Inoue H, Mishima K, Yamamoto-Yoshida S, Ushikoshi-Nakayama R, Nakagawa Y, Yamamoto K, Ryo K, Ide F, Saito I. (2012). “Aryl hydrocarbon receptor-mediated induction of EBV reactivation as a risk factor for Sjogren's syndrome”. Journal of immunology: 188 (9): 4654-62., PMID 22467650, doi:10.4049/jimmunol.1101575
- ^ Ascherio A, Munger KL (2010). "Epstein–Barr Virus Infection and Multiple Sclerosis: A Review". Journal of Neuroimmune Pharmacology. 5 (3): 271-7., PMID 20369303, doi:10.1007/s11481-010-9201-3
- ^ Sargsyan SA, Shearer AJ, Ritchie AM, Burgoon MP, Anderson S, Hemmer B, Stadelmann C, Gattenlöhner S, Owens GP, Gilden D, Bennett JL (2010). "Absence of Epstein-Barr virus in the brain and CSF of patients with multiple sclerosis". Neurology. 74 (14): 1127-35., PMC 2865779, PMID 20220124, doi:10.1212/WNL.0b013e3181d865a1
- ^ Willis SN, Stadelmann C, Rodig SJ, Caron T, Gattenloehner S, Mallozzi SS, Roughan JE, Almendinger SE, Blewett MM, Brück W, Hafler DA, O'Connor KC (2009). "Epstein-Barr virus infection is not a characteristic feature of multiple sclerosis brain". Brain. 132 (Pt 12): 3318-28., PMC 2792367, PMID 19638446, doi:10.1093/brain/awp200
- ^ Hilton DA, Love S, Fletcher A, Pringle JH (1994). "Absence of Epstein-Barr virus RNA in multiple sclerosis as assessed by in situ hybridisation". Journal of Neurology, Neurosurgery & Psychiatry. 57 (8): 975-6., PMC 1073085, PMID 7520057
- ^ Lassmann H, Niedobitek G, Aloisi F, Middeldorp JM; NeuroproMiSe EBV Working Group (2011). "Epstein-Barr virus in the multiple sclerosis brain: a controversial issue--report on a focused workshop held in the Centre for Brain Research of the Medical University of Vienna, Austria". Brain. 134 (Pt 9): 2772-86., PMC 3170536, PMID 21846731, doi:10.1093/brain/awr197
- ^ Laurence M, Benito-León J (2017). "Epstein-Barr virus and multiple sclerosis: Updating Pender's hypothesis". Multiple Sclerosis and Related Disorders. 16: 8-14., PMID 28755684, doi:10.1016/j.msard.2017.05.009
- ^ Pender MP, Csurhes PA, Burrows JM, Burrows SR (2017). "Defective T-cell control of Epstein-Barr virus infection in multiple sclerosis". Clinical & Translational Immunology. 6 (1): e126., PMC 292561, PMID 28197337, doi:10.1038/cti.2016.87
- ^ Nagata K, Fukata S, Kanai K, Satoh Y, Segawa T, Kuwamoto S, Sugihara H, Kato M, Murakami I, Hayashi K, Sairenji T (2011). "The influence of Epstein-Barr virus reactivation in patients with Graves' disease". Viral Immunology. 24 (2): 143-9., PMID 21449724, doi:10.1089/vim.2010.0072
- ^ Nagata K, Nakayama Y, Higaki K, Ochi M, Kanai K, Matsushita M, Kuwamoto S, Kato M, Murakami I, Iwasaki T, Nanba E, Kimura H, Hayashi K (2015). "Reactivation of persistent Epstein-Barr virus (EBV) causes secretion of thyrotropin receptor antibodies (TRAbs) in EBV-infected B lymphocytes with TRAbs on their surface". Autoimmunity. 48(5): 328-35., PMID 25759125, doi:10.3109/08916934.2015.1022163
- ^ Nagata K, Higaki K, Nakayama Y, Miyauchi H, Kiritani Y, Kanai K, Matsushita M, Iwasaki T, Sugihara H, Kuwamoto S, Kato M, Murakami I, Nanba E, Kimura H, Hayashi K (2015). "Presence of Epstein-Barr virus-infected B lymphocytes with thyrotropin receptor antibodies on their surface in Graves' disease patients and in healthy individuals". Autoimmunity. 47 (3):193-200., PMC 5351790, PMID 24467196, doi:10.3109/08916934.2013.8798
- ^ Nagata K, Okuno K, Ochi M, Kumata K, Sano H, Yoneda N, Ueyama J, Matsushita M, Kuwamoto S, Kato M, Murakami I, Kanzaki S, Hayashi K (2015). "Production of thyrotropin receptor antibodies in acute phase of infectious mononucleosis due to Epstein-Barr virus primary infection: a case report of a child". Springerplus. 27; 4: 456., PMC 4549369, PMID 26322262, doi:10.1186/s40064-015-1236-8
- ^ Kumata K, Nagata K, Matsushita M, Kuwamoto S, Kato M, Murakami I, Fukata S, Hayashi K (2016). "Thyrotropin Receptor Antibody (TRAb)-IgM Levels Are Markedly Higher Than TRAb-IgG Levels in Graves' Disease Patients and Controls, and TRAb-IgM Production Is Related to Epstein-Barr Virus Reactivation". Viral Immunology. 29(8): 459-463., PMID 27529807, doi:10.1089/vim.2016.0043
- ^ Takeshima, Ken; Inaba, Hidefumi; Furukawa, Yasushi; Nishi, Masahiro; Yamaoka, Hiroyuki; Miyamoto, Waka; Ota, Takayuki; Doi, Asako et al. (2014-4). “Elevated serum immunoglobulin G4 levels in patients with Graves' disease and their clinical implications”. Thyroid: Official Journal of the American Thyroid Association 24 (4): 736–743. doi:10.1089/thy.2013.0448. ISSN 1557-9077. PMID 24256421.
- ^ Aalberse, R. C.; Stapel, S. O.; Schuurman, J.; Rispens, T. (2009-4). “Immunoglobulin G4: an odd antibody”. Clinical and Experimental Allergy: Journal of the British Society for Allergy and Clinical Immunology 39 (4): 469–477. doi:10.1111/j.1365-2222.2009.03207.x. ISSN 1365-2222. PMID 19222496.
- ^ Nirula, Ajay; Glaser, Scott M.; Kalled, Susan L.; Taylor, Frederick R.; Taylora, Frederick R. (2011-1). “What is IgG4? A review of the biology of a unique immunoglobulin subtype”. Current Opinion in Rheumatology 23 (1): 119–124. doi:10.1097/BOR.0b013e3283412fd4. ISSN 1531-6963. PMID 21124094.
- ^ Henle, W.; Henle, G. E.; Horwitz, C. A. (1974-9). “Epstein-Barr virus specific diagnostic tests in infectious mononucleosis”. Human Pathology 5 (5): 551–565. ISSN 0046-8177. PMID 4368691.
- ^ Samanta, M.; Iwakiri, D.; Takada, K. (2008-07-10). “Epstein-Barr virus-encoded small RNA induces IL-10 through RIG-I-mediated IRF-3 signaling”. Oncogene 27 (30): 4150–4160. doi:10.1038/onc.2008.75. ISSN 1476-5594. PMID 18362887.
- ^ M.),, Murphy, Kenneth (Kenneth. Janeway's immunobiology. Weaver, Casey, (Ninth edition ed.). New York, NY, USA. ISBN 9780815345053. OCLC 933586700
- ^ Manz, R. A.; Thiel, A.; Radbruch, A. (1997-07-10). “Lifetime of plasma cells in the bone marrow”. Nature 388 (6638): 133–134. doi:10.1038/40540. ISSN 0028-0836. PMID 9217150.
- ^ 1950-, Parham, Peter, (2009). The immune system. Janeway, Charles. (3rd ed ed.). London: Garland Science. ISBN 9780815341468. OCLC 240989634
- ^ Canfield, S. M.; Morrison, S. L. (1991-06-01). “The binding affinity of human IgG for its high affinity Fc receptor is determined by multiple amino acids in the CH2 domain and is modulated by the hinge region”. The Journal of Experimental Medicine 173 (6): 1483–1491. ISSN 0022-1007. PMC 2190830. PMID 1827828.
- ^ van der Neut Kolfschoten, Marijn; Schuurman, Janine; Losen, Mario; Bleeker, Wim K.; Martínez-Martínez, Pilar; Vermeulen, Ellen; den Bleker, Tamara H.; Wiegman, Luus et al. (2007-09-14). “Anti-inflammatory activity of human IgG4 antibodies by dynamic Fab arm exchange”. Science (New York, N.Y.) 317 (5844): 1554–1557. doi:10.1126/science.1144603. ISSN 1095-9203. PMID 17872445.
- ^ Tao, M. H.; Smith, R. I.; Morrison, S. L. (1993-08-01). “Structural features of human immunoglobulin G that determine isotype-specific differences in complement activation”. The Journal of Experimental Medicine 178 (2): 661–667. ISSN 0022-1007. PMC 2191116. PMID 8340761.
- ^ Nagata, Keiko; Hara, Sayuri; Nakayama, Yuji; Higaki, Katsumi; Sugihara, Hirotsugu; Kuwamoto, Satoshi; Matsushita, Michiko; Kato, Masako et al. (2018-09-17). “Epstein-Barr Virus Lytic Reactivation Induces IgG4 Production by Host B Lymphocytes in Graves' Disease Patients and Controls: A Subset of Graves' Disease Is an IgG4-Related Disease-Like Condition”. Viral Immunology. doi:10.1089/vim.2018.0042. ISSN 1557-8976. PMID 30222515.
- ^ Yanai, H.; Shimizu, N.; Nagasaki, S.; Mitani, N.; Okita, K. (1999-6). “Epstein-Barr virus infection of the colon with inflammatory bowel disease”. The American Journal of Gastroenterology 94 (6): 1582–1586. doi:10.1111/j.1572-0241.1999.01148.x. ISSN 0002-9270. PMID 10364028.
- ^ Ciccocioppo, Rachele; Racca, Francesca; Paolucci, Stefania; Campanini, Giulia; Pozzi, Lodovica; Betti, Elena; Riboni, Roberta; Vanoli, Alessandro et al. (2015-02-14). “Human cytomegalovirus and Epstein-Barr virus infection in inflammatory bowel disease: need for mucosal viral load measurement”. World Journal of Gastroenterology 21 (6): 1915–1926. doi:10.3748/wjg.v21.i6.1915. ISSN 2219-2840. PMC 4323471. PMID 25684960.
- ^ Ciccocioppo, Rachele; Racca, Francesca; Scudeller, Luigia; Piralla, Antonio; Formagnana, Pietro; Pozzi, Lodovica; Betti, Elena; Vanoli, Alessandro et al. (2016-2). “Differential cellular localization of Epstein-Barr virus and human cytomegalovirus in the colonic mucosa of patients with active or quiescent inflammatory bowel disease”. Immunologic Research 64 (1): 191–203. doi:10.1007/s12026-015-8737-y. ISSN 1559-0755. PMID 26659090.
- ^ Lopes, Susana; Andrade, Patricia; Conde, Silvia; Liberal, Rodrigo; Dias, Cláudia C.; Fernandes, Salomão; Pinheiro, Jorge; Simões, Joana S. et al. (08 2017). “Looking into Enteric Virome in Patients with IBD: Defining Guilty or Innocence?”. Inflammatory Bowel Diseases 23 (8): 1278–1284. doi:10.1097/MIB.0000000000001167. ISSN 1536-4844. PMID 28617757.
- ^ Pezhouh, Maryam Kherad; Miller, James Adam; Sharma, Rajni; Borzik, David; Eze, Ogechukwu; Waters, Kevin; Westerhoff, Maria A.; Parian, Alyssa M. et al. (2018-08-15). “Refractory inflammatory bowel disease: is there a role for Epstein-Barr virus? A case controlled study using highly sensitive EBV encoded small RNA1 In Situ hybridization”. Human Pathology. doi:10.1016/j.humpath.2018.08.001. ISSN 1532-8392. PMID 30120969.
- ^ Shimada, Takayuki; Nagata, Naoyoshi; Okahara, Koki; Joya, Akane; Hayashida, Tsunefusa; Oka, Shinichi; Sakurai, Toshiyuki; Akiyama, Junichi et al. (2017). “PCR detection of human herpesviruses in colonic mucosa of individuals with inflammatory bowel disease: Comparison with individuals with immunocompetency and HIV infection”. PloS One 12 (9): e0184699. doi:10.1371/journal.pone.0184699. ISSN 1932-6203. PMC 5597220. PMID 28902907.
- ^ Hosomi, Shuhei; Watanabe, Kenji; Nishida, Yu; Yamagami, Hirokazu; Yukawa, Tomomi; Otani, Koji; Nagami, Yasuaki; Tanaka, Fumio et al. (2018-05-18). “Combined Infection of Human Herpes Viruses: A Risk Factor for Subsequent Colectomy in Ulcerative Colitis”. Inflammatory Bowel Diseases 24 (6): 1307–1315. doi:10.1093/ibd/izy005. ISSN 1536-4844. PMID 29668948.
- ^ Devergne, O.; Hummel, M.; Koeppen, H.; Le Beau, M. M.; Nathanson, E. C.; Kieff, E.; Birkenbach, M. (1996-2). “A novel interleukin-12 p40-related protein induced by latent Epstein-Barr virus infection in B lymphocytes”. Journal of Virology 70 (2): 1143–1153. ISSN 0022-538X. PMC 189923. PMID 8551575.
- ^ Omata, F.; Birkenbach, M.; Matsuzaki, S.; Christ, A. D.; Blumberg, R. S. (2001-8). “The expression of IL-12 p40 and its homologue, Epstein-Barr virus-induced gene 3, in inflammatory bowel disease”. Inflammatory Bowel Diseases 7 (3): 215–220. ISSN 1078-0998. PMID 11515847.
- ^ Gehlert, Thomas; Devergne, Odile; Niedobitek, Gerald (2004-7). “Epstein-Barr virus (EBV) infection and expression of the interleukin-12 family member EBV-induced gene 3 (EBI3) in chronic inflammatory bowel disease”. Journal of Medical Virology 73 (3): 432–438. doi:10.1002/jmv.20109. ISSN 0146-6615. PMID 15170639.
- ^ Batten, Marcel; Li, Ji; Yi, Sothy; Kljavin, Noelyn M.; Danilenko, Dimitry M.; Lucas, Sophie; Lee, James; de Sauvage, Frederic J. et al. (2006-9). “Interleukin 27 limits autoimmune encephalomyelitis by suppressing the development of interleukin 17-producing T cells”. Nature Immunology 7 (9): 929–936. doi:10.1038/ni1375. ISSN 1529-2908. PMID 16906167.
- ^ Maaser, Christian; Egan, Laurence J.; Birkenbach, Mark P.; Eckmann, Lars; Kagnoff, Martin F. (2004-7). “Expression of Epstein-Barr virus-induced gene 3 and other interleukin-12-related molecules by human intestinal epithelium”. Immunology 112 (3): 437–445. doi:10.1111/j.1365-2567.2004.01895.x. ISSN 0019-2805. PMC 1782502. PMID 15196212.
- ^ Collison, Lauren W.; Workman, Creg J.; Kuo, Timothy T.; Boyd, Kelli; Wang, Yao; Vignali, Kate M.; Cross, Richard; Sehy, David et al. (2007-11-22). “The inhibitory cytokine IL-35 contributes to regulatory T-cell function”. Nature 450 (7169): 566–569. doi:10.1038/nature06306. ISSN 1476-4687. PMID 18033300.
- ^ Niedbala, Wanda; Wei, Xiao-Qing; Cai, Beilei; Hueber, Axel J.; Leung, Bernard P.; McInnes, Iain B.; Liew, Foo Y. (2007-11). “IL-35 is a novel cytokine with therapeutic effects against collagen-induced arthritis through the expansion of regulatory T cells and suppression of Th17 cells”. European Journal of Immunology 37 (11): 3021–3029. doi:10.1002/eji.200737810. ISSN 0014-2980. PMID 17874423.
- ^ Wirtz, Stefan; Billmeier, Ulrike; Mchedlidze, Tamuna; Blumberg, Richard S.; Neurath, Markus F. (2011-11). “Interleukin-35 mediates mucosal immune responses that protect against T-cell-dependent colitis”. Gastroenterology 141 (5): 1875–1886. doi:10.1053/j.gastro.2011.07.040. ISSN 1528-0012. PMC 3624892. PMID 21820391.
- ^ Vos, A. C. W.; Bakkal, N.; Minnee, R. C.; Casparie, M. K.; de Jong, D. J.; Dijkstra, G.; Stokkers, P.; van Bodegraven, A. A. et al. (2011-9). “Risk of malignant lymphoma in patients with inflammatory bowel diseases: a Dutch nationwide study”. Inflammatory Bowel Diseases 17 (9): 1837–1845. doi:10.1002/ibd.21582. ISSN 1536-4844. PMID 21830262.
- ^ Sokol, Harry; Beaugerie, Laurent; Maynadié, Marc; Laharie, David; Dupas, Jean-Louis; Flourié, Bernard; Lerebours, Eric; Peyrin-Biroulet, Laurent et al. (2012-11). “Excess primary intestinal lymphoproliferative disorders in patients with inflammatory bowel disease”. Inflammatory Bowel Diseases 18 (11): 2063–2071. doi:10.1002/ibd.22889. ISSN 1536-4844. PMID 22271569.
- ^ Afif, Waqqas; Sandborn, William J.; Faubion, William A.; Rahman, Meher; Harmsen, Scott W.; Zinsmeister, Alan R.; Loftus, Edward V. (2013-6). “Risk factors for lymphoma in patients with inflammatory bowel disease: a case-control study”. Inflammatory Bowel Diseases 19 (7): 1384–1389. doi:10.1097/MIB.0b013e318281325e. ISSN 1536-4844. PMID 23535248.
- ^ Nissen, Loes H. C.; Nagtegaal, Iris D.; de Jong, Dirk J.; Kievit, Wietske; Derikx, Lauranne A. A. P.; Groenen, Patricia J. T. A.; van Krieken, J. Han J. M.; Hoentjen, Frank (2015-5). “Epstein-Barr virus in inflammatory bowel disease: the spectrum of intestinal lymphoproliferative disorders”. Journal of Crohn's & Colitis 9 (5): 398–403. doi:10.1093/ecco-jcc/jjv040. ISSN 1876-4479. PMID 25740811.
- ^ Zeissig, Yvonne; Petersen, Britt-Sabina; Milutinovic, Snezana; Bosse, Esther; Mayr, Gabriele; Peuker, Kenneth; Hartwig, Jelka; Keller, Andreas et al. (2015-1). “XIAP variants in male Crohn's disease”. Gut 64 (1): 66–76. doi:10.1136/gutjnl-2013-306520. ISSN 1468-3288. PMID 24572142.
- ^ Imadome K, Shirakata M, Shimizu N, Nonoyama S, Yamanashi Y (2003). "CD40 ligand is a critical effector of Epstein-Barr virus in host cell survival and transformation". Proceedings of the National Academy of Sciences of the United States of America. 100 (13): 7836-40., PMC 164674, PMID 12805559, doi:10.1073/pnas.1231363100
- ^ Imadome K, Shimizu N, Arai A, Miura O, Watanabe K, Nakamura H, Nonoyama S, Yamamoto K, Fujiwara S (2005). "Coexpression of CD40 and CD40 ligand in Epstein-Barr virus-infected T and NK cells and their role in cell survival". The Journal of Infectious Diseases. 192 (8): 1340-8., PMID 16170750, doi:10.1086/466530
- ^ Cinbis, M.; Aysun, S. (1992-5). “Alice in Wonderland syndrome as an initial manifestation of Epstein-Barr virus infection”. The British Journal of Ophthalmology 76 (5): 316. ISSN 0007-1161. PMC 504267. PMID 1390519.
- ^ Copperman, S. M. (1977-2). “"Alice in Wonderland" syndrome as a presenting symptom of infectious mononucleosis in children: a description of three affected young people”. Clinical Pediatrics 16 (2): 143–146. doi:10.1177/000992287701600205. ISSN 0009-9228. PMID 832438.
- ^ 亀井 淳、佐々木 真理, 赤坂 真奈美, 千田 勝 (2002).「核磁気共鳴画像で異常を認めた EB ウイルス脳症による不思議の国のアリス症候群の 1 例」. 脳と発達. 34: 348–352., doi:10.11251/ojjscn1969.34.348
- ^ Tsai, Jeng-Daw; Lee, Hung-Chang; Lin, Chun-Chen; Liang, Der-Cherng; Chen, Shu-Huey; Huang, Fu-Yuan (2003-7). “Epstein-Barr virus-associated acute renal failure: diagnosis, treatment, and follow-up”. Pediatric Nephrology (Berlin, Germany) 18 (7): 667–674. doi:10.1007/s00467-003-1152-y. ISSN 0931-041X. PMID 12750978.
- ^ Crawford, Dorothy H.; Macsween, Karen F.; Higgins, Craig D.; Thomas, Ranjit; McAulay, Karen; Williams, Hilary; Harrison, Nadine; Reid, Stuart et al. (2006-08-01). “A cohort study among university students: identification of risk factors for Epstein-Barr virus seroconversion and infectious mononucleosis”. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America 43 (3): 276–282. doi:10.1086/505400. ISSN 1537-6591. PMID 16804839.
- ^ Elliott, Suzanne L.; Suhrbier, Andreas; Miles, John J.; Lawrence, Greg; Pye, Stephanie J.; Le, Thuy T.; Rosenstengel, Andrew; Nguyen, Tam et al. (2008-2). “Phase I trial of a CD8+ T-cell peptide epitope-based vaccine for infectious mononucleosis”. Journal of Virology 82 (3): 1448–1457. doi:10.1128/JVI.01409-07. ISSN 1098-5514. PMC 2224445. PMID 18032491.
- ^ Taylor, G. S.; Haigh, T. A.; Gudgeon, N. H.; Phelps, R. J.; Lee, S. P.; Steven, N. M.; Rickinson, A. B. (2004-1). “Dual stimulation of Epstein-Barr Virus (EBV)-specific CD4+- and CD8+-T-cell responses by a chimeric antigen construct: potential therapeutic vaccine for EBV-positive nasopharyngeal carcinoma”. Journal of Virology 78 (2): 768–778. doi:10.1128/JVI.78.2.768-778.2004. ISSN 0022-538X. PMC 368843. PMID 14694109.
- ^ Shumilov, Anatoliy; Tsai, Ming-Han; Schlosser, Yvonne T.; Kratz, Anne-Sophie; Bernhardt, Katharina; Fink, Susanne; Mizani, Tuba; Lin, Xiaochen et al. (2017-02-10). “Epstein-Barr virus particles induce centrosome amplification and chromosomal instability”. Nature Communications 8: 14257. doi:10.1038/ncomms14257. ISSN 2041-1723. PMC 5309802. PMID 28186092.
- ^ a b Lin, J. C.; Reefschläger, J.; Herrmann, G.; Pagano, J. S. (1992-1). “Structure-activity relationship between (E)-5-(2-bromovinyl)- and 5-vinyl-1-beta-D-arabinofuranosyluracil (BV-araU, V-araU) in inhibition of Epstein-Barr virus replication”. Antiviral Research 17 (1): 43–52. ISSN 0166-3542. PMID 1310582.
- ^ Shannon-Lowe C, Rowe M (2014). "Epstein Barr virus entry; kissing and conjugation". Current Opinion in Virology. 4: 78–84., PMID 24553068, doi:10.1016/j.coviro.2013.12.001
- ^ Wang X, Hutt-Fletcher LM (1998). "Epstein–Barr virus lacking glycoprotein gp42 can bind to B cells but is not able to infect". Journal of Virology. 72: 158–63. PMC 109360, PMID 9420211
- ^ Ogembo JG, Kannan L, Ghiran I, Nicholson-Weller A, Finberg RW, Tsokos GC, Fingeroth JD (2013). "Human complement receptor type 1/CD35 is an Epstein–Barr Virus receptor". Cell Reports. 3 (2): 371–385., PMC 3633082, PMID 23416052, doi:10.1016/j.celrep.2013.01.023
- ^ Calderwood MA, Venkatesan K, Xing L, Chase MR, Vazquez A, Holthaus AM, Ewence AE, Li N, Hirozane-Kishikawa T, Hill DE, Vidal M, Kieff E, Johannsen E (2007). "Epstein–Barr virus and virus human protein interaction maps". Proceedings of the National Academy of Sciences of the United States of America. 104 (18): 7606–11., PMC 1863443,{{[PMID|17446270}}, doi:10.1073/pnas.0702332104
- ^ Hutzinger R, Feederle R, Mrazek J, Schiefermeier N, Balwierz PJ, Zavolan M, Polacek N, Delecluse HJ, Hüttenhofer A (2009). "Expression and processing of a small nucleolar RNA from the Epstein-Barr virus genome". PLoS Pathogens. 5 (8): e1000547., PMC 2718842, PMID 19680535, doi:10.1371/journal.ppat.1000547
- ^ Robertson ES (2010). Epstein–Barr Virus: Latency and Transformation. Caister Academic Press. ISBN 978-1-904455-62-2.
- ^ 村田貴之 (2014).「EBウイルスの感染様式とがん」.ウイルス. 2014年 64巻 1号 p.95-104, doi:10.2222/jsv.64.95
- ^ Yates JL, Warren N, Sugden B (1985). "Stable replication of plasmids derived from Epstein–Barr virus in various mammalian cells". Nature. 313 (6005): 812–5., PMID 2983224, doi:10.1038/313812a0.
- ^ Gratama JW, Oosterveer MA, Zwaan FE, Lepoutre J, Klein G, Ernberg I (1988). "Eradication of Epstein–Barr virus by allogeneic bone marrow transplantation: implications for sites of viral latency". Proceedings of the National Academy of Sciences of the United States of America. 85 (22): 8693–6., PMC 282526, PMID 2847171, doi:10.1073/pnas.85.22.8693
- ^ Uchida J, Yasui T, Takaoka-Shichijo Y, Muraoka M, Kulwichit W, Raab-Traub N, Kikutani H (1999). "Mimicry of CD40 signals by Epstein-Barr virus LMP1 in B lymphocyte responses". Science. 286 (5438): 300-3., PMID 10514374, doi:10.1126/science.286.5438.300.
- ^ Nagata K, Kumata K, Nakayama Y, Satoh Y, Sugihara H, Hara S, Matsushita M, Kuwamoto S, Kato M, Murakami I, Hayashi K (2017). "Epstein-Barr Virus Lytic Reactivation Activates B Cells Polyclonally and Induces Activation-Induced Cytidine Deaminase Expression: A Mechanism Underlying Autoimmunity and Its Contribution to Graves' Disease". Viral Immunology. 30 (3): 240-249., PMC 5393416, PMID 2833576, doi:10.1089/vim.2016.0179
- ^ Hammerschmidt W, Sugden B (2004). "Epstein-Barr virus sustains Burkitt's lymphomas and Hodgkin's disease". Trends in Molecular Medicine. 10 (7): 331-6., PMID 15242681, doi:10.1016/j.molmed.2004.05.006
- ^ Steinitz, M.; Klein, G.; Koskimies, S.; Makel, O. (1977-09-29). “EB virus-induced B lymphocyte cell lines producing specific antibody”. Nature 269 (5627): 420–422. ISSN 0028-0836. PMID 198669.
- ^ Takayama, T.; Sakabe, T.; Fujii, M.; Yamada, E.; Uno, M.; Ono, Y. (1987-11). “In vitro production of human antibodies specifically reactive with human gastric cancer cells of established lines and autologous tissues”. Journal of Surgical Oncology 36 (3): 215–224. ISSN 0022-4790. PMID 2824934.
関連項目
[編集]- 伝染性単核球症(IM)
- 慢性活動性EBウイルス感染症(CAEBV)
- シェーグレン症候群
- ソリブジン(EBウイルスに効果のある抗ヘルペスウイルス剤だが、併用薬剤との相互作用による薬害事件を起こして回収)
