フッ化セシウム
| フッ化セシウム | |
|---|---|

| |
| IUPAC名 | フッ化セシウム |
| 組成式 | CsF |
| 式量 | 151.90 g/mol |
| 形状 | 白色固体 |
| CAS登録番号 | 13400-13-0 |
| 密度と相 | 4.115 g/cm3, 固体 |
| 水への溶解度 | 367 g/100 mL (18 °C) |
| 融点 | 682 °C |
| 沸点 | 1251 °C |
フッ化セシウム(フッかセシウム、cesium fluoride)は組成式 CsF で表されるイオン性の化合物で、吸湿性の白色固体である[1][2]。フッ化ナトリウムやフッ化カリウムよりも溶解性が高く、容易に解離する。無水物の形で市販されているが、水を吸ってしまった場合は減圧下で 100 ℃に加熱すれば簡単に乾燥できる[3]。吸湿性がそれほど高くないため、水分子を含まない「裸の」フッ化物イオンが必要な場合、より吸湿性が高いテトラブチルアンモニウムフルオリド (TBAF) やトリス(ジメチルアミノ)スルホニウムジフルオロトリメチルシリケート (TASF) に代わって用いられる。
化学的性質[編集]
一般的にフッ化物イオンの発生源としての反応性を示し、他の溶解性のフッ化物塩と同様に反応する。例えば、
非水性の溶液中でもほぼ完全に解離するため反応性が高く、電子不足な塩化アリールと反応してフッ化アリールを与える(ハレックス反応)。他のフッ化物塩の例にもれず弱い塩基性を示す。酸と混合すると毒性・腐食性の高いフッ化水素が発生するので注意を要する。
調製[編集]
フッ化水素と水酸化セシウムまたは炭酸セシウムを反応させ、水を除去することによって合成できる。
用途[編集]
フッ化物イオンは求核性が低いので有機合成における有用な塩基である。クネーフェナーゲル縮合に用いた場合、フッ化カリウムやフッ化ナトリウムよりも良好な結果が得られる[4]。
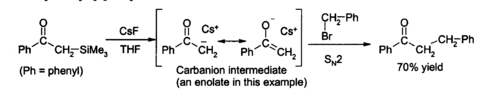
ケイ素−フッ素結合は生成しやすく、フッ化物イオンはケイ素置換基と容易に反応する。この性質を利用して有機合成で脱シリル化反応に用いられる。吸湿性が低いため水に敏感な中間体を含む反応も収率良く進行させることができる。テトラヒドロフランやジメチルホルムアミド中で様々な有機ケイ素化合物と反応し、ケイ素フッ化物とカルバニオンを発生させる。これは次の例[5]のように求電子剤と反応させられる[3]。
脱シリル化はシリルエーテルの脱保護にも用いられる。
有機フッ素化学ではフッ素化物イオン源として利用される。例えば、ヘキサフルオロアセトンと反応させるとセシウムパーフルオロアルコキシドが得られる。これはナトリウムやカリウムの塩と異なり 60 ℃まで安定である[6]。
フッ化セシウムの単結晶は遠赤外領域まで透過性が高い。このため、赤外分光法においてしばしば測定に用いるセルの窓として使われる。
取り扱い上の注意[編集]
一般的な溶解性のフッ化物と同様、中程度の毒性を持つ。フッ化水素が発生するので酸との接触は避ける。セシウムイオン (Cs+) 自体は毒性を持たないと考えられている。
参考文献[編集]
- ^ Greenwood, N. N.; Earnshaw, A. (1984). Chemistry of the Elements, Oxford, UK: Pergamon Press.
- ^ (1990) Handbook of Chemistry and Physics, 71st edition, Ann Arbor, Michigan: CRC Press.
- ^ a b Friestad, G. K.; Branchaud, B. P. (1999). Reich, H. J., Rigby, J. H. (eds.) Handbook of Reagents for Organic Synthesis: Acidic and Basic Reagents, pp. 99–103, New York: Wiley.
- ^ Rand, L.; Swisher, J. V.; Cronin, C. J. (1962). "Reactions catalyzed by potassium fluoride. III. The Knoevenagel reaction". J. Org. Chem. 27: 3505–3507. DOI: 10.1021/jo01057a024
- ^ Fiorenza, M.; Mordini, A.; Papaleo, S.; Pastorelli, S.; Ricci, A. (1985). "Fluoride ion induced reactions of organosilanes: the preparation of mono and dicarbonyl compounds from β-ketosilanes". Tetrahedron Lett. 26: 787–788. DOI: 10.1016/S0040-4039(00)89137-6
- ^ Evans, F. W.; Litt, M. H.; Weidler-Kubanek, A. M.; Avonda, F. P. (1968). "Formation of adducts between fluorinated ketones and metal fluorides". J. Org. Chem. 33: 1837–1839. DOI: 10.1021/jo01269a028