強迫性障害の原因
強迫性障害の原因(きょうはくせいしょうがいのげんいん)では、強迫性障害(obsessive-compulsive disorder、OCD)の症状の発現に関与する生物学的危険因子の同定に関して述べる。有力な仮説では神経解剖学、神経化学、神経免疫学、神経遺伝学及び神経行動学の分野での発見と共に眼窩前頭皮質、大脳基底核及び/または大脳辺縁系の関与が提唱されている。
神経解剖学
[編集]OCDの評価に関してかなりの議論があった。ただ、21世紀初頭における研究では構造的及び機能的なニューロイメージングに重点を置いている。これらの技術革新によりOCDの神経解剖学的危険因子のさらなる理解がなされた。これらの研究では以下の4つの基本的なカテゴリーに分かれている[1]。
- 安静時のOCD患者の脳活動を対称群と比較する安静時研究
- 症状の誘発前後の脳活動を比較する症状誘発研究
- 薬物療法による治療前後の脳活動を比較する治療研究
- OCD患者の課題遂行時における脳活動を対称群と比較する認知活性化研究
この研究で得られたデータでは、眼窩前頭皮質(OFC)と前帯状皮質(ACC)及び尾状核頂部の3箇所の脳領域が、OCDに関与していることを示唆している[1]。
また、一部研究ではOCD患者においてこれらの領域では、
- (a) 健常の対称群と比較して安静時に過度に活動的である。
- (b) 症状の誘発で更に活発になる。
- (c) SSRI薬物治療や認知療法による治療の成功後は活動亢進を示さなくなる。
以上、3点も指摘されている[2]。この理解はこれらの神経解剖学的領域における異常がOCDを引き起こす可能性があるというエビデンスとして頻繁に引用されている。
眼窩前頭皮質と前帯状皮質は、皮質-大脳基底核-視床-皮質ループ(CBGTCループ)を経由して大脳基底核と複雑につながっている[3]。現在の理論では、OCDは大脳基底核を通る「直接」経路と「間接」経路間の不均衡の結果である可能性を示唆している。直接経路は皮質から線条体へと走り、その後は淡蒼球内節(GPi)、黒質網様部(SNr)、視床を通り最後に皮質へと戻るとされている。間接経路は皮質から線条体へと走り、その後淡蒼球外節(GPe)、視床下核(STN)、GPi、SNr、視床を通って最後に皮質へと戻るとされている[4]。直接経路の正味の効果は興奮性であり関節経路は抑制性である。したがって、眼窩前頭皮質と前帯状皮質とそれをつなぐニューロンのCBGTCループの中で、直接経路で行われる相対的に過度な活動が、強迫観念が囚われる正のフィードバックのループをもたらす可能性があるとの仮説が提唱されている[4]。構造的・機能的ニューロイメージング研究がこの仮説に強い根拠を与えているものの、OCD患者があらゆることに対する全般性の強迫行動ではなく、特定の強迫を持つようになる原因はわかっていない。研究者達は汚染など、特定の刺激に対する反応バイアスが存在すると示唆しているものの、根本的原因は不明のままである[5]。
神経化学
[編集]神経化学機能がOCDの症状を媒介する役割があることについては、普遍的な事実だと見られている。その中でも、近年の精神薬理学の研究では、セロトニン(5-HT)神経伝達物質系が特に重要な役割を担っていることが判明している[6]。健常対照群との比較において、OCDの治療には選択的セロトニン再取り込み阻害薬(SSRI)の長期投与が、ノルアドレナリン再取り込み阻害薬よりも効果的であることがわかっている[6]。例としてRapoport et al. は、セロトニン再取り込みの阻害作用が比較的強い抗うつ薬として知られるクロミプラミンは、デシプラミンよりも、一部の反復行動を減少させるのに有効であることを示した[7]。また、他の研究では、5-HT拮抗薬の投与はしばしばOCDの症状を悪化させることが示されている[8]。
これが真実の場合、ミルタザピン (5-HT2A受容体拮抗薬)と、この受容体に対しても拮抗作用を有する非定型抗精神病薬がSSRIの効果を弱めることが予期されるものの、これらの薬物の臨床試験では反対の結果が示された。ミルタザピンはそれ自体は効果的ではないが、パロキセチンの効果を早めることが示されており[9]、一部研究では非定型抗精神病薬は難治性OCD患者のSSRIの効果を増強することが示されている(Bloch et al., 2006)[10]。
これらの発見は明確な原因を提供してはいないが、精神状態は薬理学的に解剖可能であるとの考えの土台を形成した。SSRIでの強迫観念と強迫行為の制御効果はOCDの根底に神経化学的病因があることを示唆している。
ドーパミン作動系はドーパミン作用薬の働き、小児自己免疫性溶連菌関連性精神神経障害(PANDAS)が関係している可能性があるとの事実[11]、そして様々なニューロイメージング研究[12]によりOCDに関係している。OCDは抗精神病薬で治療する可能だが、精神刺激薬もまたOCD症状を軽減することにおいて一定の見込みがあることを示している[13] 。これらは調整する必要があるが、両方ともドーパミン作動系に関係している。また、OCD患者は、ADHDの併存率も高率であり[14]、これは精神刺激薬で治療されドーパミン作動系の一過性シグナルの増加と持続性シグナルの減少が原因の可能性がある。小児自己免疫性溶連菌関連性精神神経障害は、ドーパミンが神経伝達物質として大きな役割を担っている、大脳基底核にも影響を与えていると見られている。
神経免疫学
[編集]ヘンリエッタ・レオナルドとスーザン・スウェドは彼らの論文「Paediatric autoimmune neuropsychiatric disorders associated with streptococcal infection (PANDAS)」で神経免疫学的危険因子ついてのエビデンスを提供した[15]。研究者達はレンサ球菌に感染後に起こる場合のある自己免疫反応が、小児期のOCD発症の潜在的環境要因である可能性を示唆している。1980年代にOCDの子供達の大規模なコホートが前向きに評価されていた。レンサ球菌感染の後、子供のサブグループは「一晩中発症する(coming on overnight)」と特徴づけられるほどのOCD症状の悪化を示す[15]。この研究から導かれる一次仮説では、場合によってはレンサ球菌感染症に対する抗体が、大脳基底核を攻撃し損傷させる自己免疫反応の結果としてOCDを発症する可能性があるというものである。
強迫観念と強迫行為はトゥレット障害、パーキンソン病、てんかん、統合失調症、ハンチントン病、嗜眠性脳炎、シデナム舞踏病及び特定の脳領域の損傷を含む他の一部病状において非常に一般的であり[16]、OCDと同様にこれらの症状でも大脳基底核に異常を示している。大脳基底核では認知、感情、動作の仲介を担っており、本領域の混乱は強迫(繰り返し放出される行動パターン)と衝動(様々な刺激により突然放出される行動パターン)を特徴とする多くの症状を引き起こす[1]。これはOCD患者の症状は大脳基底核の異常な機能の結果である可能性を示唆している。
神経遺伝学
[編集]OCDの遺伝的要因を示唆する研究
[編集]双生児研究[17]と親族研究では強迫性障害の根底に明確な遺伝的要因が存在することを示している。親族研究の大半は、少なくともOCDの一部タイプは家族性であることを証明している。罹患した個人の親族間におけるOCDの割合はOCDの推定人口罹患率及び対称群間の割合よりも有意に高い。成人のOCD患者の親族は対称群より罹患する可能性が約2倍高く、小児期や思春期のOCD患者の親族は同様にOCDに罹患する可能性が約10倍高かった。しかしながら、その家族性関連は文化や環境要因によっても引き起こされる可能性もある[18]。2007年現在、OCDの背後にある環境要因を調査している研究は僅かしかないが、環境リスク要因の遡及的研究において研究者達は妊娠中の遷延分娩と浮腫はOCDとの相関があることを発見しており[19]、環境は症状の発現を決定する上で何らかの役割を果たすと示唆している。
結果として、OCDの症状が遺伝性であり、したがって遺伝的に関連していることを示すために双生児研究が行われた[17]。一卵性双生児は基本的に遺伝子が100%同じであるのに対して、二卵性双生児は遺伝子の平均50%を共有している。古典的な双生児研究は一卵性と二卵性双生児を比較するものであり、一卵性双生児が二卵性よりもはるかに密接に似ている場合、関心の形質の発達に遺伝学が強い役割を担っている可能性がある。これらの研究で強迫性障害における遺伝的影響は小児で45〜65%であると示された。成人では遺伝の影響は減少し27〜47%の範囲である[17]。しかしながら、研究結果はサンプルにおけるOCDを持つ個人の存在がしばしば不足するという事実によって複雑化しており、結果として研究者達はしばしば強迫症状または無症状OCDを有する個人を対象に含めている[18]。そうすることで彼らは恐らく他の関連障害に罹患している被験者を含めていた。初期の双生児研究はDSM基準と発端者の確認を満たしたOCDの双子を用いて後に再現されたが、実施されたのはほんの数例である[17]。
早期発症型OCD
[編集]小児期や思春期に発現する早期発症型OCDは、成人発症型OCDとは病因的に異なるOCDのサブタイプ(亜型)である。早発型OCDの患者は、トゥレット障害や他のチック症の発症率が高いことが研究でわかっていることから、この早発型OCDはチック症やトゥレット障害と遺伝的に関連していると報告されている[19]。家族性関連研究[20]では早期発症型OCDは家族性及び恐らく遺伝的リスクの増加と相関があると示唆されている。小児期や思春期にOCDを発症した発端者の親族間でのOCD・無症状OCDの割合は、成人期にOCDを発症した発端者の親族間の少なくとも2倍であった[20]。他の研究でも、発端者の発症年齢と近親者のOCDリスクとの間には逆相関があることが示されている[21]。結果的に2種類のOCDには異なる遺伝メカニズムが存在する可能性があるため、候補遺伝子の検査時には発症年齢を管理する必要が出てくる可能性がある。
候補遺伝子SLC1A1
[編集]多数の遺伝子がOCDの進行に重要である可能性がある。これらの候補遺伝子の一部は同定されているが、グルタミン酸トランスポーターのEAAC1をコードする、グルタミン酸トランスポーター遺伝子SLC1A1(溶質キャリアファミリー1、メンバー1)に関連するものを除いて、候補遺伝子研究のどれも一貫して再現されていない[18]。候補遺伝子の同定の難しさは、大半の遺伝子研究が環境要因を無視しているという事実に関連している可能性がある。結果的に、さらなる遺伝子研究を行うためには、OCDの特定のサブタイプの遺伝子と環境要因間の相互作用モデルを開発する必要がある可能性がある。OCDの3つのゲノムワイド関連解析も完了しており、SLC1A1を内包する領域9p24を含む潜在的な関心領域が示唆されている[18]。SLC1A1は皮質、線条体、視床(皮質-線条体-視床皮質回路、CSTC)内で発現しグルタミン酸神経伝達と関連している[22]。ニューロイメージング、候補遺伝子及び動物モデル研究によりSLC1A1とグルタミン酸シグナリングを、OCDの発生に関連付けるエビデンスが提供されている。ニューロイメージング研究では早期発症型のOCD患者は、対称群と比較して尾状グルタミン酸濃度は前帯状皮質で低く尾状で高いことがわかっており、グルタミン酸トランスポーター(同様にグルタミン酸トランスポーター遺伝子SLC1A1)が、OCDの発症に関連していることを示唆している[23]。
遺伝子SLC1A1内の一塩基多型 (SNPs)は一貫してOCDに関連することがわかっている。グルタミン酸トランスポーターに加えて、SLC1A1によってコード化されたトランスポーターEAAC1もまたOCDに対する感受性を促進し得るGABAの合成に関係している。初期の研究ではOCDとSLC1A1遺伝子の3つの連鎖遺伝子多型に有意な関連があることを示した[24]。この結果は多くの研究で再現されている。ある研究では漢民族集団の早期発症型OCD患者のSLC1A1遺伝子内の4つのSNPsをテストし[25]、SNPsのうちの1つであるrs10491734が、対称群よりもOCD患者において有意に頻度が高いことが判明した。異なる研究で同定された正確なSNPsは異なっているものの、これは異なる民族集団で行われたことが原因の可能性もある[25]。例えば、家族ベースの関連研究ではアメリカ合衆国の家族におけるSLC1A1内及びその周辺のSNPsの事例を分析し、異なるSNPのrs4740788と3-SNPハプロタイプrs4740788-rs10491734-rs10491733は、両方ともOCDに関連するものであることがわかった[26]。
強迫性障害の研究用にいくつかのマウスのモデルが開発されている。モデル生物はある種(この場合、ヒト)の一部の精神障害の特徴を他の種(この場合、マウス)で調査できるようにするために有用である。特に、SLC1A1ヌルマウスは攻撃性の増大と毛皮の喪失につながる過度の自己グルーミング(毛づくろい)を示すことで強迫行動を示した。しかしながら、これらはOCDと大まかに関連する2つの行動に過ぎないため、EAAC1の欠如とOCDのような行動間の関係性の強い証拠を提供するものではなかった。SLC1A1遺伝子とOCD間の強い相関を考慮するとEAAC1の欠如は、視床の皮質-線条体-視床皮質回路(CSTC)の関連遺伝子の他の稀な突然変異と組み合わさった時に、OCDのような行動をもたらすだけであることを示唆している[27]。
神経行動学
[編集]精神医学研究では一般的に病気の原因として近因メカニズムに重点を置いている。対照的に、進化理論は遠因メカニズムがどのように病因と関係しているかについて疑問を投げかけてきた。OCDは進化史を通じて保存されてきた可能性があるいくつかの行動スキーマを含んでおり、危険性の確認や汚染の回避、食糧の貯蔵に役立つ認知パターンを多くの種が受け継いでいる[28]。理論家達はこれらの戦略のいずれかが機能不全になることでOCDの発症につながり得るとの仮説を立てた。この推論はそのような受け継がれる種族特有の戦略は大脳基底核に保存されているとのエビデンスにより更に支持されている[1]。
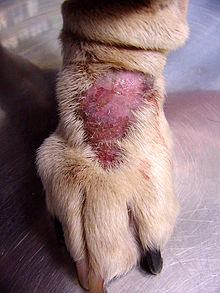
ヒト以外の種族における強迫性障害の発症を検討する際に研究者達は、大型犬における肢端舐性皮膚炎(舐性皮膚炎としても知られる)を研究した。この症例は過度に舐めたり引っ掻いたりすることによる脱毛と、その後の肉芽腫性病変(創傷表面の血管組織)を特徴としている[7]。Rapoport et al.は罹患犬のこの強迫行動がクロミプラミンの投与後に軽減したことを発見した[7]。そのため進化的に選択された形質が不適応の進行性神経機能障害になり得ると考えられる。
脚注
[編集]- ^ a b c d Maia, T. V., Cooney, R. E., & Peterson, B. S. (2008). The neural bases of obsessive-compulsive disorder in children and adults. Development and Psychopathology, 1251-1283.
- ^ Whiteside, S.P., Port, J.D., & Abramowitz, J.S. (2004). A meta-analysis of functional neuroimaging in obsessive-compuslive disorder. Psychiatry Research, 132, 69-79.
- ^ Alexander, G.E., DeLong, M. R., & Strick, P. L. (1986). Parallel organization of functionally segregated circuits linking basal ganglia and cortex. Annual Review of Neuroscience, 9, 357-381.
- ^ a b Saxena, S., & Rauch, S. L. (2000). Functional neuroimaging and the neuroanatomy of obsessive-compulsive disorder. Psychiatric Clinics of North America, 23, 563-586.
- ^ Sasson, Y., Zohar, J., Chopra, M., Lustig, M., Iancu, I., & Hendler, T. (1997). Epidemiology of obsessive-compulsive disorder. Seminars in Clinical Neuropsychiatry, 6, 82-101
- ^ a b Zohar, J. (1987). Obsessive-compulsive disorder: psychobiological approaches to diagnosis, treatment, and pathophysiology. Biological Psychiatry, 22, 667-687.
- ^ a b c Rapoport, J. L., Ryland, D. H., Kriete, M. (1992). Drug treatment of canine acral lick: an animal model of obsessive-compulsive disorder. Archive of General Psychiatry, 49, 517-521.
- ^ Hollander, E., Liebowitz, M. R., DeCaria, C. M. (1994). Serotonergic sensitivity in borderline personality disorder: preliminary findings. American Journal of Psychiatry, 151, 277-280.
- ^ (Pallanti et al.,2004)
- ^ van Dijk, Addy; Klompmakers, Andre; Denys, Damiaan. The Serotonergic System in Obsessive-Compulsive Disorder. pp. 547–563. doi:10.1016/s1569-7339(10)70100-4
- ^ Orefici, Graziella; Cardona, Francesco; Cox, Carol; Cunningham, Madeleine. Pediatric Autoimmune Neuropsychiatric Disorders Associated with Streptococcal Infections (PANDAS). Oklahoma City: University of Oklahoma Health Sciences Center
- ^ Maia, Tiago; Cooney, Rebecca; Peterson, Bradley (2008). “The Neural Bases of Obsessive-Compulsive Disorder in Children and Adults”. Dev Psychopathology.
- ^ Koran, Lorrin; Aboujaoude, Elias; Gamel, Nona (2009). “DoubleBlind Study of Dextroamphetamine Versus Caffeine Augmentation for TreatmentResistant ObsessiveCompulsive Disorder”. he Journal of Clinical Psychiatry: 1530–1535.
- ^ Dar, Reuven; Mittelman, Andrew; Wilhelm, Sabine (2015). “Comorbidity Between Attention Deficit/Hyperactivity Disorder and ObsessiveCompulsive Disorder Across the Lifespan”. Harvard Review of Psychiatry: 245–262.
- ^ a b Leonard, H. L., & Swedo, S. E. (2001). Paediatric autoimmune neuropsychiatric disorders associated with treptococcal infection (PANDAS). International Journal of Neuropsychopharmacology (4), 191-198
- ^ Nestadt, G., Grados, M., & Samuels, J. F. (2010). Genetics of Obsessive-Compulsive Disorder. Psychiatric Clinics of North America, 141-158.
- ^ a b c d Daniel S. van Grootheest, Danielle C. Cath, Aartjan T. Beekman, and Dorret I. Boomsma, “Twin Studies on Obsessive-Compulsive Disorder: A Review,” Twin Research and Human Genetics 8, no. 5 (2005): 450-458.
- ^ a b c d David L. Pauls, “The Genetics of Obsessive-Compulsive Disorder: A Review,” Dialogues in Clinical Neuroscience 12, no. 2 (2010): 149-163.
- ^ a b Marcos Salem Vasconcelos, Aline Santos Sampaio, et al., “Prenatal, Perinatal, and Postnatal Risk Factors in Obsessive-Compulsive Disorder,” Biological Psychiatry 61 (2007): 301-307. Doi:10.1016/j.biopsych.2006.07.014
- ^ a b Julie A. Eichstedt and Sharon L. Arnold, “Childhood-onset Obsessive Compulsive Disorder: A Tic-Related Subtype of OCD?”, Clinical Psychology Review 21, no. 1 (2001): 137-158.
- ^ Gerald Nestadt, Marco Grados, and J. F. Samuels, “Genetics of OCD,” Psychiatric Clinics of North America 33, no. 1 (2010): 141-158. doi:10.1016/j.psc.2009.11.001
- ^ Yoshikatsu Kanai and Matthias A. Hediger, “The glutamate/neutral amino acid transporter family SLC1: Molecular, Physiological, and Pharmacological aspects,” Pflügers Archiv: European Journal of Physiology 447, no. 5 (2003): 467-479.
- ^ David R. Rosenberg, Frank P. MacMaster, Matcheri S. Keshavan, et al., “Decrease in Caudate Glutamatergic Concentrations in Pediatric Obsessive-Compulsive Disorder Patients Taking Paroxetine,” Journal of the American Academy of Child and Adolescent Psychiatry 39, no. 9 (2000): 1096-1103.
- ^ Paul Daniel Arnold, Tricia Sicard, Eliza Burroughs, Margaret A. Richter, and James L. Kennedy, “Glutamate Transporter Gene SLC1A1 Associated With Obsessive-compulsive Disorder,” Archives of General Psychiatry 63 (2006): 769-776.
- ^ a b Haisu Wu, Xuemei Wang, Zeping Xiao, et al., “Association Between SLC1A1 Gene and Early-Onset OCD in the Han Chinese Population: A Case-Control Study,” Journal of Molecular Neuroscience 50 (2013): 353-359. doi:10.1007/s12031-013-9995-6
- ^ Jack Samuels, Ying Wang, Mark A. Riddle, et al., “Comprehensive Family-Based Association Study of the Glutamate Transporter Gene SLC1A1 in Obsessive-Compulsive Disorder,” American Journal of Medical Genetics Part B Neuropsychiatric Genetics 156, no. 4 (2011): 472-477.
- ^ Jonathan T. Ting and Guoping Feng, “Neurobiology of Obsessive-compulsive Disorder: Insights into Neural Circuitry Dysfunction through Mouse Genetics,” Current Opinion in Neurobiology 21 (2011): 842-848. doi: 10.1016/j.conb.2011.04.010
- ^ O'Connor, J. J. (2008). A Flaw in the Fabric. Journal of Contemporary Psychotherapy, 87-96.
