「DNAナノテクノロジー」の版間の差分
Smilesworth (会話 | 投稿記録) m →ナノメカニカル素子: リンクの追加 |
|||
| 1行目: | 1行目: | ||
[[ファイル:DNA_tetrahedron_white.png|サムネイル|300x300ピクセル| DNAナノテクノロジーでは人工的な[[核酸]]ナノ構造の設計と作製が行われる。図の[[DNA]]四面体は一例<ref name="Goodman05">'''DNA polyhedra:''' {{Cite journal|last=Goodman|first=Russel P.|last2=Schaap, Iwan A. T.|last3=Tardin, C. F.|last4=Erben, Christof M.|last5=Berry, Richard M.|last6=Schmidt, C.F.|last7=Turberfield, Andrew J.|date=9 December 2005|title=Rapid chiral assembly of rigid DNA building blocks for molecular nanofabrication|journal=Science|volume=310|issue=5754|pages=1661–1665|bibcode=2005Sci...310.1661G| |
[[ファイル:DNA_tetrahedron_white.png|サムネイル|300x300ピクセル| DNAナノテクノロジーでは人工的な[[核酸]]ナノ構造の設計と作製が行われる。図の[[DNA]]四面体は一例<ref name="Goodman05">'''DNA polyhedra:''' {{Cite journal|last=Goodman|first=Russel P.|last2=Schaap, Iwan A. T.|last3=Tardin, C. F.|last4=Erben, Christof M.|last5=Berry, Richard M.|last6=Schmidt, C.F.|last7=Turberfield, Andrew J.|date=9 December 2005|title=Rapid chiral assembly of rigid DNA building blocks for molecular nanofabrication|journal=Science|volume=310|issue=5754|pages=1661–1665|bibcode=2005Sci...310.1661G|doi=10.1126/science.1120367|pmid=16339440}}</ref>。四面体の各辺は20[[塩基対]]からなるDNA[[二重らせん]]であり、頂点は3アーム・ジャンクションとなっている。4つの面に対応する4本のDNA鎖は色分けされている。 ]] |
||
'''DNAナノテクノロジー'''({{Lang-en-short|DNA nanotechnology}})とは、有用な[[核酸]]構造を人工的に設計・作製する技術をいう。[[デオキシリボ核酸|DNA]]の名が冠されているが、他の種類の核酸も用いられるため「核酸ナノテクノロジー」という別名がある。この分野では核酸を生[[細胞]]の遺伝情報キャリアとしてではなく、非生物学的な[[ナノテクノロジー|ナノ]]材料として用いる。これまでの研究で、[[DNA]]を用いた2次元・3次元の[[結晶構造|結晶格子]]や[[ナノチューブ]]、[[多面体]]、さらに任意形状の静的構造が作製されており、[[分子マシン|分子機械]]や[[DNAコンピュータ|DNAコンピューター]]のような機能デバイスも得られている。[[X線結晶構造解析|X線構造解析]]や{{仮リンク|タンパク質の核磁気共鳴スペクトロスコピー|en|Nuclear magnetic resonance spectroscopy of proteins|label=核磁気共鳴スペクトロスコピー}}による[[タンパク質構造|タンパク質の構造]]同定など、[[構造生物学]]や[[生物物理学]]における[[基礎研究|基礎的な問題]]を解決するツールとしても用いられ始めた。将来的な{{仮リンク|分子スケールエレクトロニクス|en|Molecular scale electronics|label=}}や{{仮リンク|ナノ医療|en|Nanomedicine|label=}}への応用も研究されている。 |
'''DNAナノテクノロジー'''({{Lang-en-short|DNA nanotechnology}})とは、有用な[[核酸]]構造を人工的に設計・作製する技術をいう。[[デオキシリボ核酸|DNA]]の名が冠されているが、他の種類の核酸も用いられるため「核酸ナノテクノロジー」という別名がある。この分野では核酸を生[[細胞]]の遺伝情報キャリアとしてではなく、非生物学的な[[ナノテクノロジー|ナノ]]材料として用いる。これまでの研究で、[[DNA]]を用いた2次元・3次元の[[結晶構造|結晶格子]]や[[ナノチューブ]]、[[多面体]]、さらに任意形状の静的構造が作製されており、[[分子マシン|分子機械]]や[[DNAコンピュータ|DNAコンピューター]]のような機能デバイスも得られている。[[X線結晶構造解析|X線構造解析]]や{{仮リンク|タンパク質の核磁気共鳴スペクトロスコピー|en|Nuclear magnetic resonance spectroscopy of proteins|label=核磁気共鳴スペクトロスコピー}}による[[タンパク質構造|タンパク質の構造]]同定など、[[構造生物学]]や[[生物物理学]]における[[基礎研究|基礎的な問題]]を解決するツールとしても用いられ始めた。将来的な{{仮リンク|分子スケールエレクトロニクス|en|Molecular scale electronics|label=}}や{{仮リンク|ナノ医療|en|Nanomedicine|label=}}への応用も研究されている。 |
||
| 6行目: | 6行目: | ||
== 基本的なコンセプト == |
== 基本的なコンセプト == |
||
=== 核酸の特性 === |
=== 核酸の特性 === |
||
[[ナノテクノロジー]]は多くの場合、100[[ナノメートル]]スケールより小さい構造を持つ材料や素子を研究する分野と定義される。その中でもDNAナノテクノロジーは、分子部品が自発的に組織化して安定構造を作る[[トップダウン設計とボトムアップ設計|ボトムアップ]]型{{仮リンク|分子の自己集合|en|Molecular self-assembly|label=自己集合プロセス}}の一例である。この種の構造では、設計者が選んだ部品の物理的・化学的特性が元になって特定の形状が発現する<ref>'''Background:''' {{Cite book|last=Pelesko|first=John A.|title=Self-assembly: the science of things that put themselves together|year=2007|publisher=Chapman & Hall/CRC|location=New York|isbn=978-1-58488-687-7|pages=5, 7}}</ref>。DNAナノテクノロジーで部品となるのはDNAなどの核酸鎖である。核酸鎖は多くの場合人工的に合成され、ほとんどのケースで生細胞内の役割とは関係のないところで使用される。DNAがナノスケール構造の作製に適している理由は、核酸鎖間の結合が既知の単純な[[塩基対|塩基対合]]則に従っており、それによって特有の二重らせん型ナノ構造を形成する点である。この性質を利用すれば、核酸鎖の設計を通じて構造のアセンブリを制御することが容易になる。他のナノテクノロジー材料はこのような特性を持たない。たとえば[[タンパク質]]は構成要素であるアミノ酸の種類が多く{{仮リンク|タンパク質の設計|en|Protein design|label=設計}}が非常に困難であり<ref name=murata2016>{{cite journal|和書|journal=現代化学|year=2016|title=DNAナノテクノロジーへの招待|author=村田智|pages=47-51|series=DNAナノテクノロジー 構造をつくり、計算し、ナノロボットを動かす|volume=541|naid= 40020759717}}</ref>、[[ナノ粒子]]は自ら特定のアセンブリを行う能力がない<ref name="Seeman2010">'''Overview:''' {{Cite journal|last=Seeman|first=Nadrian C.|year=2010|title=Nanomaterials based on DNA|journal=Annual Review of Biochemistry|volume=79|pages=65–87| |
[[ナノテクノロジー]]は多くの場合、100[[ナノメートル]]スケールより小さい構造を持つ材料や素子を研究する分野と定義される。その中でもDNAナノテクノロジーは、分子部品が自発的に組織化して安定構造を作る[[トップダウン設計とボトムアップ設計|ボトムアップ]]型{{仮リンク|分子の自己集合|en|Molecular self-assembly|label=自己集合プロセス}}の一例である。この種の構造では、設計者が選んだ部品の物理的・化学的特性が元になって特定の形状が発現する<ref>'''Background:''' {{Cite book|last=Pelesko|first=John A.|title=Self-assembly: the science of things that put themselves together|year=2007|publisher=Chapman & Hall/CRC|location=New York|isbn=978-1-58488-687-7|pages=5, 7}}</ref>。DNAナノテクノロジーで部品となるのはDNAなどの核酸鎖である。核酸鎖は多くの場合人工的に合成され、ほとんどのケースで生細胞内の役割とは関係のないところで使用される。DNAがナノスケール構造の作製に適している理由は、核酸鎖間の結合が既知の単純な[[塩基対|塩基対合]]則に従っており、それによって特有の二重らせん型ナノ構造を形成する点である。この性質を利用すれば、核酸鎖の設計を通じて構造のアセンブリを制御することが容易になる。他のナノテクノロジー材料はこのような特性を持たない。たとえば[[タンパク質]]は構成要素であるアミノ酸の種類が多く{{仮リンク|タンパク質の設計|en|Protein design|label=設計}}が非常に困難であり<ref name=murata2016>{{cite journal|和書|journal=現代化学|year=2016|title=DNAナノテクノロジーへの招待|author=村田智|pages=47-51|series=DNAナノテクノロジー 構造をつくり、計算し、ナノロボットを動かす|volume=541|naid= 40020759717}}</ref>、[[ナノ粒子]]は自ら特定のアセンブリを行う能力がない<ref name="Seeman2010">'''Overview:''' {{Cite journal|last=Seeman|first=Nadrian C.|year=2010|title=Nanomaterials based on DNA|journal=Annual Review of Biochemistry|volume=79|pages=65–87|doi=10.1146/annurev-biochem-060308-102244|pmid=20222824|pmc=3454582}}</ref>。 |
||
核酸分子は[[ヌクレオチド]]の[[核酸構造|配列]]からなり、ヌクレオチドはそれに含まれる[[核酸塩基]]によって区別される。DNAのヌクレオチドには[[アデニン]] (A)、[[シトシン]] (C)、[[グアニン]] (G)、[[チミン]] (T) の四種の塩基が含まれる。核酸分子どうしが結合して二重らせんを構成するのは、それらの塩基配列が[[相補的塩基対|相補的]]である場合のみである。すなわち、出来上がった二重らせんはA-TおよびC-Gという二種類の塩基対の配列にならなければならない<ref name="Seeman2010"/><ref>'''Background:''' {{Cite book|last=Long|first=Eric C.|chapter=Fundamentals of nucleic acids|editor-first=Sidney M|editor-last=Hecht|title=Bioorganic chemistry: nucleic acids|year=1996|publisher=Oxford University Press|location=New York|isbn=978-0-19-508467-2|pages=4–10}}</ref>。塩基が正しく対合すると{{仮リンク|核酸の熱力学|en|Nucleic acid thermodynamics|label=エネルギー的に有利}}であるため、ほとんどのケースでは核酸鎖どうしが正しい塩基対の数が最大になるような[[立体配座]]で結合すると予想される。このように核酸鎖系で結合パターンと全体構造を決定するのは塩基配列であり、それを利用すれば容易に制御が行える。DNAナノテクノロジーの研究者は、塩基対形成作用によって望ましい立体配座がアセンブルされるように、核酸鎖の塩基配列を合理的に設計する<ref name="Seeman2010"/><ref name="Seeman-sciam"/>。用いられる分子は[[デオキシリボ核酸|DNA]]が主流だが、[[リボ核酸|RNA]]や[[ペプチド核酸]] (PNA) など他の核酸分子を組み込んだ構造も作製されている<ref>'''RNA nanotechnology:''' {{Cite journal|last=Chworos, Arkadiusz|last2=Severcan, Isil|last3=Koyfman, Alexey Y.|last4=Weinkam, Patrick|last5=Oroudjev, Emin|last6=Hansma, Helen G.|last7=Jaeger, Luc|year=2004|title=Building Programmable Jigsaw Puzzles with RNA|journal=Science|volume=306|issue=5704|pages=2068–2072|bibcode=2004Sci...306.2068C| |
核酸分子は[[ヌクレオチド]]の[[核酸構造|配列]]からなり、ヌクレオチドはそれに含まれる[[核酸塩基]]によって区別される。DNAのヌクレオチドには[[アデニン]] (A)、[[シトシン]] (C)、[[グアニン]] (G)、[[チミン]] (T) の四種の塩基が含まれる。核酸分子どうしが結合して二重らせんを構成するのは、それらの塩基配列が[[相補的塩基対|相補的]]である場合のみである。すなわち、出来上がった二重らせんはA-TおよびC-Gという二種類の塩基対の配列にならなければならない<ref name="Seeman2010"/><ref>'''Background:''' {{Cite book|last=Long|first=Eric C.|chapter=Fundamentals of nucleic acids|editor-first=Sidney M|editor-last=Hecht|title=Bioorganic chemistry: nucleic acids|year=1996|publisher=Oxford University Press|location=New York|isbn=978-0-19-508467-2|pages=4–10}}</ref>。塩基が正しく対合すると{{仮リンク|核酸の熱力学|en|Nucleic acid thermodynamics|label=エネルギー的に有利}}であるため、ほとんどのケースでは核酸鎖どうしが正しい塩基対の数が最大になるような[[立体配座]]で結合すると予想される。このように核酸鎖系で結合パターンと全体構造を決定するのは塩基配列であり、それを利用すれば容易に制御が行える。DNAナノテクノロジーの研究者は、塩基対形成作用によって望ましい立体配座がアセンブルされるように、核酸鎖の塩基配列を合理的に設計する<ref name="Seeman2010"/><ref name="Seeman-sciam"/>。用いられる分子は[[デオキシリボ核酸|DNA]]が主流だが、[[リボ核酸|RNA]]や[[ペプチド核酸]] (PNA) など他の核酸分子を組み込んだ構造も作製されている<ref>'''RNA nanotechnology:''' {{Cite journal|last=Chworos, Arkadiusz|last2=Severcan, Isil|last3=Koyfman, Alexey Y.|last4=Weinkam, Patrick|last5=Oroudjev, Emin|last6=Hansma, Helen G.|last7=Jaeger, Luc|year=2004|title=Building Programmable Jigsaw Puzzles with RNA|journal=Science|volume=306|issue=5704|pages=2068–2072|bibcode=2004Sci...306.2068C|doi=10.1126/science.1104686|pmid=15604402}}</ref><ref>'''RNA nanotechnology:''' {{Cite journal|last=Guo|first=Peixuan|year=2010|title=The Emerging Field of RNA Nanotechnology|journal=Nature Nanotechnology|volume=5|issue=12|pages=833–842|bibcode=2010NatNa...5..833G|doi=10.1038/nnano.2010.231|pmid=21102465|pmc=3149862}}</ref>。 |
||
=== 下位分野 === |
=== 下位分野 === |
||
| 16行目: | 16行目: | ||
| header = |
| header = |
||
| image1 = Неподвижная_структура_Холлидея_(англ.).svg |
| image1 = Неподвижная_структура_Холлидея_(англ.).svg |
||
| caption1 =4本の核酸鎖 (strand 1~4) が結合した4アームDNAジャンクション。この構造を取ることで正しい[[塩基対]]([[アデニン|A]]-[[チミン|T]]および[[シトシン|C]]-[[グアニン|G]])の数が最大になるため、鎖は自然にこの形へと結合する<ref name="Mao04">'''Overview:''' {{Cite journal|last=Mao|first=Chengde|date=December 2004|title=The emergence of complexity: lessons from DNA|journal=PLoS Biology|volume=2|issue=12|pages=2036–2038| |
| caption1 =4本の核酸鎖 (strand 1~4) が結合した4アームDNAジャンクション。この構造を取ることで正しい[[塩基対]]([[アデニン|A]]-[[チミン|T]]および[[シトシン|C]]-[[グアニン|G]])の数が最大になるため、鎖は自然にこの形へと結合する<ref name="Mao04">'''Overview:''' {{Cite journal|last=Mao|first=Chengde|date=December 2004|title=The emergence of complexity: lessons from DNA|journal=PLoS Biology|volume=2|issue=12|pages=2036–2038|doi=10.1371/journal.pbio.0020431|pmid=15597116|pmc=535573}}</ref><ref name="Seeman-sciam">'''Overview:''' {{Cite journal|last=Seeman|first=Nadrian C.|date=June 2004|title=Nanotechnology and the double helix|journal=Scientific American|volume=290|issue=6|pages=64–75|bibcode=2004SciAm.290f..64S|doi=10.1038/scientificamerican0604-64|pmid=15195395}}</ref>。 |
||
| width1 = 240 |
| width1 = 240 |
||
| image2 = Holliday junction coloured.png |
| image2 = Holliday junction coloured.png |
||
| 25行目: | 25行目: | ||
[[ファイル:Mao-DX-schematic-2.svg|サムネイル|「ダブルクロスオーバー (DX)」{{仮リンク|超分子化学|en|Supramolecular chemistry|label=超分子複合体}}。5本のDNA一本鎖からなり、平行に並んだ二つの二重らせんドメインに分けられる。二か所のクロスオーバー点において、青と黒の鎖が交差して上下のドメインをつないでいる<ref name="Mao04"/>。]] |
[[ファイル:Mao-DX-schematic-2.svg|サムネイル|「ダブルクロスオーバー (DX)」{{仮リンク|超分子化学|en|Supramolecular chemistry|label=超分子複合体}}。5本のDNA一本鎖からなり、平行に並んだ二つの二重らせんドメインに分けられる。二か所のクロスオーバー点において、青と黒の鎖が交差して上下のドメインをつないでいる<ref name="Mao04"/>。]] |
||
構造DNAナノテクノロジーと動的DNAナノテクノロジーという二つの下位分野に分けられる場合がある(これらには重複する部分もある)。構造DNAナノテクノロジーの対象は、静的な[[化学平衡|平衡]]形へアセンブリを行う核酸複合体の合成や分析である。動的DNAナノテクノロジーが対象とするのは、化学的・物理的刺激に応じて再配列を行う機能など、有用な非平衡的挙動を持つ複合体である。核酸ナノメカニカル素子のようにこれら二分野の特色を併せ持つ複合体もある<ref name="DDNreview">'''Dynamic DNA nanotechnology:''' {{Cite journal|last=Zhang|first=D. Y.|last2=Seelig|first2=G.|date=February 2011|title=Dynamic DNA nanotechnology using strand-displacement reactions|journal=Nature Chemistry|volume=3|issue=2|pages=103–113|bibcode=2011NatCh...3..103Z| |
構造DNAナノテクノロジーと動的DNAナノテクノロジーという二つの下位分野に分けられる場合がある(これらには重複する部分もある)。構造DNAナノテクノロジーの対象は、静的な[[化学平衡|平衡]]形へアセンブリを行う核酸複合体の合成や分析である。動的DNAナノテクノロジーが対象とするのは、化学的・物理的刺激に応じて再配列を行う機能など、有用な非平衡的挙動を持つ複合体である。核酸ナノメカニカル素子のようにこれら二分野の特色を併せ持つ複合体もある<ref name="DDNreview">'''Dynamic DNA nanotechnology:''' {{Cite journal|last=Zhang|first=D. Y.|last2=Seelig|first2=G.|date=February 2011|title=Dynamic DNA nanotechnology using strand-displacement reactions|journal=Nature Chemistry|volume=3|issue=2|pages=103–113|bibcode=2011NatCh...3..103Z|doi=10.1038/nchem.957|pmid=21258382|pmc=}}</ref><ref name="SDNreview">'''Structural DNA nanotechnology:''' {{Cite journal|last=Seeman|first=Nadrian C.|date=November 2007|title=An overview of structural DNA nanotechnology|journal=Molecular Biotechnology|volume=37|issue=3|pages=246–257|doi=10.1007/s12033-007-0059-4|pmid=17952671|pmc=3479651}}</ref>。 |
||
構造DNAナノテクノロジーで構築される複合体はトポロジカルに分岐した核酸構造を取っており、複数のジャンクション部を持つ(生物学的なDNAはそれと対照的に分岐を持たない二重らせん構造を取るのがほとんどである)。最も単純な分岐構造には、相補的パターンを持つ部分どうしで結合したDNA鎖4本からなる4アーム・ジャンクションがある(右図上)。似た形態を持つ天然の{{仮リンク|ホリデイ・ジャンクション|en|Holliday junction|label=}}とは異なり、人工的な固定4アーム・ジャンクションはそれぞれのアームが異なる[[塩基配列]]を持っており、ジャンクション位置は特定の場所からずれることができない。一つの複合体が複数のジャンクションを持つこともある。例えば広く用いられているダブルクロスオーバー (DX) [[モチーフ (生物学)|モチーフ]]では(右図下)、二つの平行な二重らせんドメインが二つのジャンクションで結合しており、それらのジャンクションは核酸鎖が交差するクロスオーバー点となっている。DXモチーフのクロスオーバー点はトポロジー的に4アーム・ジャンクションと同一だが、独立した4アーム・ジャンクションが柔軟性を持つのとは異なり、4本のアームが一つの軸に揃えられていて自由に動かすことができない。これにより、DXモチーフは堅固なブロックとして大きなDNA複合体を組み上げられるようになる<ref name="Seeman-sciam"/><ref name="Seeman2010"/>。 |
構造DNAナノテクノロジーで構築される複合体はトポロジカルに分岐した核酸構造を取っており、複数のジャンクション部を持つ(生物学的なDNAはそれと対照的に分岐を持たない二重らせん構造を取るのがほとんどである)。最も単純な分岐構造には、相補的パターンを持つ部分どうしで結合したDNA鎖4本からなる4アーム・ジャンクションがある(右図上)。似た形態を持つ天然の{{仮リンク|ホリデイ・ジャンクション|en|Holliday junction|label=}}とは異なり、人工的な固定4アーム・ジャンクションはそれぞれのアームが異なる[[塩基配列]]を持っており、ジャンクション位置は特定の場所からずれることができない。一つの複合体が複数のジャンクションを持つこともある。例えば広く用いられているダブルクロスオーバー (DX) [[モチーフ (生物学)|モチーフ]]では(右図下)、二つの平行な二重らせんドメインが二つのジャンクションで結合しており、それらのジャンクションは核酸鎖が交差するクロスオーバー点となっている。DXモチーフのクロスオーバー点はトポロジー的に4アーム・ジャンクションと同一だが、独立した4アーム・ジャンクションが柔軟性を持つのとは異なり、4本のアームが一つの軸に揃えられていて自由に動かすことができない。これにより、DXモチーフは堅固なブロックとして大きなDNA複合体を組み上げられるようになる<ref name="Seeman-sciam"/><ref name="Seeman2010"/>。 |
||
動的DNAナノテクノロジーでは、{{仮リンク|トーホールド配列を介した鎖置換|en|Toehold mediated strand displacement|label=}}と呼ばれるメカニズムを利用して、新しい核酸鎖を追加することで核酸複合体に再配列を行わせる。この反応では、新たな核酸鎖は二本鎖複合体の端に設けられた{{仮リンク|粘着末端と平滑末端|en|Sticky and blunt ends|label=一本鎖領域}}(「トーホールド(足がかり)」と呼ばれる)と結合し、さらに{{仮リンク|分岐移動|en|Branch migration|label=}}プロセスによって元の複合体に含まれる鎖の1つと入れ替わる。これで全体としては、元の複合体の核酸鎖の1つが新たに加えた鎖と置換されたことになる<ref name="DDNreview"/>。再配列を行える構造や素子を作る別の方法としては、化学反応を引き起こす{{仮リンク|デオキシリボザイム|en|Deoxyribozyme|label=}}や[[リボザイム]]、あるいは特定のタンパク質や低分子と選択的に結合できる[[アプタマー]]のような機能性核酸を用いるものがある<ref>'''Dynamic DNA nanotechnology:''' {{Cite journal|last=Lu|first=Y.|last2=Liu|first2=J.|date=December 2006|title=Functional DNA nanotechnology: Emerging applications of DNAzymes and aptamers|journal=Current Opinion in Biotechnology|volume=17|issue=6|pages=580–588| |
動的DNAナノテクノロジーでは、{{仮リンク|トーホールド配列を介した鎖置換|en|Toehold mediated strand displacement|label=}}と呼ばれるメカニズムを利用して、新しい核酸鎖を追加することで核酸複合体に再配列を行わせる。この反応では、新たな核酸鎖は二本鎖複合体の端に設けられた{{仮リンク|粘着末端と平滑末端|en|Sticky and blunt ends|label=一本鎖領域}}(「トーホールド(足がかり)」と呼ばれる)と結合し、さらに{{仮リンク|分岐移動|en|Branch migration|label=}}プロセスによって元の複合体に含まれる鎖の1つと入れ替わる。これで全体としては、元の複合体の核酸鎖の1つが新たに加えた鎖と置換されたことになる<ref name="DDNreview"/>。再配列を行える構造や素子を作る別の方法としては、化学反応を引き起こす{{仮リンク|デオキシリボザイム|en|Deoxyribozyme|label=}}や[[リボザイム]]、あるいは特定のタンパク質や低分子と選択的に結合できる[[アプタマー]]のような機能性核酸を用いるものがある<ref>'''Dynamic DNA nanotechnology:''' {{Cite journal|last=Lu|first=Y.|last2=Liu|first2=J.|date=December 2006|title=Functional DNA nanotechnology: Emerging applications of DNAzymes and aptamers|journal=Current Opinion in Biotechnology|volume=17|issue=6|pages=580–588|doi=10.1016/j.copbio.2006.10.004|pmid=17056247|pmc=}}</ref>。 |
||
== 構造DNAナノテクノロジー == |
== 構造DNAナノテクノロジー == |
||
| 47行目: | 47行目: | ||
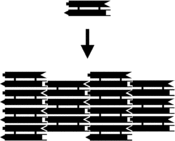
| footer = DXアレイのアセンブリ。(左): 模式図。一本の棒が一つの[[DNA]]二重らせんドメインにあたる。棒の両端の凸部と凹部はそれぞれ二種類あり、[[相補性 (分子生物学)|相補的]]な相手とのみ結合する[[粘着末端]]を表している。上から来たDX複合体が下方に集まっているDX複合体に加わって2次元アレイを作る<ref name="Mao04" />。(右): 完成したアレイの[[原子間力顕微鏡]]像。集合的な構造に含まれる個々のDXタイルが明確に見える。視野は一辺150 [[ナノメートル|nm]]。 |
| footer = DXアレイのアセンブリ。(左): 模式図。一本の棒が一つの[[DNA]]二重らせんドメインにあたる。棒の両端の凸部と凹部はそれぞれ二種類あり、[[相補性 (分子生物学)|相補的]]な相手とのみ結合する[[粘着末端]]を表している。上から来たDX複合体が下方に集まっているDX複合体に加わって2次元アレイを作る<ref name="Mao04" />。(右): 完成したアレイの[[原子間力顕微鏡]]像。集合的な構造に含まれる個々のDXタイルが明確に見える。視野は一辺150 [[ナノメートル|nm]]。 |
||
}} |
}} |
||
[[ファイル:DNA_nanostructures.png|サムネイル|350x350ピクセル| (左)上図とは異なる種類の2次元周期格子を作るDNAタイルのモデル。(右)できあがった格子の[[原子間力顕微鏡]]像<ref>'''Other arrays:''' {{Cite journal|last=Strong|first=Michael|date=March 2004|title=Protein Nanomachines|journal=PLoS Biology|volume=2|issue=3|page=e73| |
[[ファイル:DNA_nanostructures.png|サムネイル|350x350ピクセル| (左)上図とは異なる種類の2次元周期格子を作るDNAタイルのモデル。(右)できあがった格子の[[原子間力顕微鏡]]像<ref>'''Other arrays:''' {{Cite journal|last=Strong|first=Michael|date=March 2004|title=Protein Nanomachines|journal=PLoS Biology|volume=2|issue=3|page=e73|doi=10.1371/journal.pbio.0020073|pmid=15024422|pmc=368168}}</ref><ref>{{Cite journal|last=Yan|first=H.|last2=Park|first2=S. H.|last3=Finkelstein|first3=G.|last4=Reif|first4=J. H.|last5=Labean|first5=T. H.|date=26 September 2003|title=DNA-templated self-assembly of protein arrays and highly conductive nanowires|journal=Science|volume=301|issue=5641|pages=1882–1884|bibcode=2003Sci...301.1882Y|doi=10.1126/science.1089389|pmid=14512621|pmc=}}</ref>。]] |
||
{{multiple image |
{{multiple image |
||
| 62行目: | 62行目: | ||
}} |
}} |
||
小さい核酸複合体に粘着末端を持たせて互いに結合させると、分子をタイルとした[[平面充填|充填]]パターンを持つ大きな2次元周期格子が得られる<ref name="SDNreview"/>。この種の構造で最初のものは基本タイルとしてDX複合体を使用していた。DX複合体が持つ四つの粘着末端の塩基配列をデザインすることで、複合体がユニットとなって周期的に配列し、剛性を持つ2次元DNA結晶とみなせる平坦な2次元シートを構成する仕組みだった(右図上)<ref>'''DX arrays:''' {{Cite journal|last=Winfree|first=Erik|last2=Liu, Furong|last3=Wenzler, Lisa A.|last4=Seeman, Nadrian C.|date=6 August 1998|title=Design and self-assembly of two-dimensional DNA crystals|journal=Nature|volume=394|issue=6693|pages=529–544|bibcode=1998Natur.394..539W| |
小さい核酸複合体に粘着末端を持たせて互いに結合させると、分子をタイルとした[[平面充填|充填]]パターンを持つ大きな2次元周期格子が得られる<ref name="SDNreview"/>。この種の構造で最初のものは基本タイルとしてDX複合体を使用していた。DX複合体が持つ四つの粘着末端の塩基配列をデザインすることで、複合体がユニットとなって周期的に配列し、剛性を持つ2次元DNA結晶とみなせる平坦な2次元シートを構成する仕組みだった(右図上)<ref>'''DX arrays:''' {{Cite journal|last=Winfree|first=Erik|last2=Liu, Furong|last3=Wenzler, Lisa A.|last4=Seeman, Nadrian C.|date=6 August 1998|title=Design and self-assembly of two-dimensional DNA crystals|journal=Nature|volume=394|issue=6693|pages=529–544|bibcode=1998Natur.394..539W|doi=10.1038/28998|pmid=9707114}}</ref><ref>'''DX arrays:''' {{Cite journal|last=Liu|first=Furong|last2=Sha, Ruojie|last3=Seeman, Nadrian C.|date=10 February 1999|title=Modifying the surface features of two-dimensional DNA crystals|journal=Journal of the American Chemical Society|volume=121|issue=5|pages=917–922|doi=10.1021/ja982824a}}</ref>。ほかのモチーフを用いた2次元配列も作製されており、ホリデイ・ジャンクション[[菱形]]格子や<ref>'''Other arrays:''' {{Cite journal|last=Mao|first=Chengde|last2=Sun, Weiqiong|last3=Seeman, Nadrian C.|date=16 June 1999|title=Designed two-dimensional DNA Holliday junction arrays visualized by atomic force microscopy|journal=Journal of the American Chemical Society|volume=121|issue=23|pages=5437–5443|doi=10.1021/ja9900398}}</ref>、double-cohesionスキームによる様々なDXベースアレイなどがある<ref>'''Other arrays:''' {{Cite journal|last=Constantinou, Pamela E.|last2=Wang, Tong|last3=Kopatsch, Jens|last4=Israel, Lisa B.|last5=Zhang, Xiaoping|last6=Ding, Baoquan|last7=Sherman, William B.|last8=Wang, Xing|last9=Zheng, Jianping|date=21 September 2006|title=Double cohesion in structural DNA nanotechnology|journal=Organic and Biomolecular Chemistry|volume=4|issue=18|pages=3414–3419|doi=10.1039/b605212f|pmid=17036134|pmc=3491902}}</ref><ref>'''Other arrays:''' {{Cite journal|last=Mathieu|first=Frederick|last2=Liao, Shiping|last3=Kopatsch, Jens|last4=Wang, Tong|last5=Mao, Chengde|last6=Seeman, Nadrian C.|date=April 2005|title=Six-helix bundles designed from DNA|journal=Nano Letters|volume=5|issue=4|pages=661–665|bibcode=2005NanoL...5..661M|doi=10.1021/nl050084f|pmid=15826105|pmc=3464188}}</ref>。右に示す画像の上から2つはタイルベース周期格子の例を示している。 |
||
2次元アレイには、そのアセンブリがある種のアルゴリズムを内包するような非周期構造を取らせることも可能である。これは[[DNAコンピュータ|DNAコンピューティング]]の1つの形である<ref name="SeemanGrowing">'''History''': {{Cite journal|last=Seeman|first=Nadrian|date=9 June 2010|title=Structural DNA nanotechnology: growing along with Nano Letters|journal=Nano Letters|volume=10|issue=6|pages=1971–1978|bibcode=2010NanoL..10.1971S| |
2次元アレイには、そのアセンブリがある種のアルゴリズムを内包するような非周期構造を取らせることも可能である。これは[[DNAコンピュータ|DNAコンピューティング]]の1つの形である<ref name="SeemanGrowing">'''History''': {{Cite journal|last=Seeman|first=Nadrian|date=9 June 2010|title=Structural DNA nanotechnology: growing along with Nano Letters|journal=Nano Letters|volume=10|issue=6|pages=1971–1978|bibcode=2010NanoL..10.1971S|doi=10.1021/nl101262u|pmid=20486672|pmc=2901229}}</ref>。粘着末端の塩基配列の選び方によっては、DX複合体は[[ワンのタイル]]となって演算処理を行えるようになる。実際に、DXアレイのアセンブリに[[排他的論理和|XOR]]演算をエンコードすることでDNAアレイを[[セル・オートマトン]]とし、[[シェルピンスキーのギャスケット]]と呼ばれる[[フラクタル]]構造を生成させた例がある(右図上から3番目)<ref name="rothemund04winfree">'''Algorithmic self-assembly:''' {{Cite journal|last=Rothemund|first=Paul W. K.|last2=Papadakis, Nick|last3=Winfree, Erik|date=December 2004|title=Algorithmic self-assembly of DNA Sierpinski triangles|journal=PLoS Biology|volume=2|issue=12|pages=2041–2053|doi=10.1371/journal.pbio.0020424|pmid=15583715|pmc=534809}}</ref>。ほかにも、DNAアレイの構造を2進数と対応させ、アレイの成長とともに数が増加していくバイナリ[[カウンタ (電子回路)|カウンタ]]システムを作った例がある。これらの結果はDNAアレイのアセンブリに計算処理が組み込めることを実証している<ref>'''Algorithmic self-assembly:''' {{Cite journal|last=Barish|first=Robert D.|last2=Rothemund|first2=Paul W. K.|last3=Winfree|first3=Erik|date=December 2005|title=Two computational primitives for algorithmic self-assembly: copying and counting|journal=Nano Letters|volume=5|issue=12|pages=2586–2592|bibcode=2005NanoL...5.2586B|doi=10.1021/nl052038l|pmid=16351220}}</ref>。 |
||
DXアレイから中空の[[ナノチューブ]]を形成することも行われている。チューブの直径は4–20 [[ナノメートル|nm]]で、2次元格子が反って丸まったものとみられる<ref name="Feldkamp">'''Design:''' {{Cite journal|last=Feldkamp|first=U.|last2=Niemeyer|first2=C. M.|date=13 March 2006|title=Rational design of DNA nanoarchitectures|journal=Angewandte Chemie International Edition|volume=45|issue=12|pages=1856–1876| |
DXアレイから中空の[[ナノチューブ]]を形成することも行われている。チューブの直径は4–20 [[ナノメートル|nm]]で、2次元格子が反って丸まったものとみられる<ref name="Feldkamp">'''Design:''' {{Cite journal|last=Feldkamp|first=U.|last2=Niemeyer|first2=C. M.|date=13 March 2006|title=Rational design of DNA nanoarchitectures|journal=Angewandte Chemie International Edition|volume=45|issue=12|pages=1856–1876|doi=10.1002/anie.200502358|pmid=16470892}}</ref>。サイズと形状は[[カーボンナノチューブ]] (CNT) に近い。DNAナノチューブはCNTのように[[電気伝導性]]は持たない代わりに、構造を変更したり他の構造と連結することが容易である。DNAナノチューブの作製スキームはいくつもあり、曲率を持つDXタイルに格子を組ませて丸まったチューブを作る方法はその一つである<ref>'''DNA nanotubes:''' {{Cite journal|last=Rothemund, Paul W. K.|last2=Ekani-Nkodo, Axel|last3=Papadakis, Nick|last4=Kumar, Ashish|last5=Fygenson, Deborah Kuchnir|last6=Winfree, Erik|date=22 December 2004|title=Design and Characterization of Programmable DNA Nanotubes|url=https://authors.library.caltech.edu/22765/2/ja044319lsi20041022_031528.pdf|journal=[[Journal of the American Chemical Society]]|volume=126|issue=50|pages=16344–16352|doi=10.1021/ja044319l|pmid=15600335}}</ref>。輪を描いた一本鎖をタイルとすることでチューブの周長を固定する方法もあり、そこではチューブの剛性は[[創発|創発的]]に生じる<ref>'''DNA nanotubes:''' {{Cite journal|last=Yin|first=P.|last2=Hariadi|first2=R. F.|last3=Sahu|first3=S.|last4=Choi|first4=H. M. T.|last5=Park|first5=S. H.|last6=Labean|first6=T. H.|last7=Reif|first7=J. H.|date=8 August 2008|title=Programming DNA Tube Circumferences|url=https://authors.library.caltech.edu/27328/2/YinP.SOM.pdf|journal=Science|volume=321|issue=5890|pages=824–826|bibcode=2008Sci...321..824Y|doi=10.1126/science.1157312|pmid=18687961}}</ref>。 |
||
DNAによって3次元格子を作ることはDNAナノテクノロジーの初期から目標とされてきたが、実現は非常に難しかった。2009年になってようやく、[[張力]]と[[圧縮力]]をバランスさせる[[テンセグリティ]]の概念に基づくモチーフによって実現されたことが報告された<ref name="SeemanGrowing"/><ref name="3Darrays">'''Three-dimensional arrays:''' {{Cite journal|last=Zheng|first=Jianping|last2=Birktoft|first2=Jens J.|last3=Chen|first3=Yi|last4=Wang|first4=Tong|last5=Sha|first5=Ruojie|last6=Constantinou|first6=Pamela E.|last7=Ginell|first7=Stephan L.|last8=Mao|first8=Chengde|last9=Seeman|first9=Nadrian C.|date=3 September 2009|title=From molecular to macroscopic via the rational design of a self-assembled 3D DNA crystal|journal=Nature|volume=461|issue=7260|pages=74–77|bibcode=2009Natur.461...74Z| |
DNAによって3次元格子を作ることはDNAナノテクノロジーの初期から目標とされてきたが、実現は非常に難しかった。2009年になってようやく、[[張力]]と[[圧縮力]]をバランスさせる[[テンセグリティ]]の概念に基づくモチーフによって実現されたことが報告された<ref name="SeemanGrowing"/><ref name="3Darrays">'''Three-dimensional arrays:''' {{Cite journal|last=Zheng|first=Jianping|last2=Birktoft|first2=Jens J.|last3=Chen|first3=Yi|last4=Wang|first4=Tong|last5=Sha|first5=Ruojie|last6=Constantinou|first6=Pamela E.|last7=Ginell|first7=Stephan L.|last8=Mao|first8=Chengde|last9=Seeman|first9=Nadrian C.|date=3 September 2009|title=From molecular to macroscopic via the rational design of a self-assembled 3D DNA crystal|journal=Nature|volume=461|issue=7260|pages=74–77|bibcode=2009Natur.461...74Z|doi=10.1038/nature08274|pmid=19727196|pmc=2764300}}</ref>。 |
||
=== 離散構造 === |
=== 離散構造 === |
||
一つ一つが[[多面体]]と同じ連結性を持つ3次元複合体をDNAから合成できることも実証されている。そこではDNA二重鎖が多面体の[[辺]]となり、DNAジャンクションが[[頂点]]となる。多面体の種類は[[正六面体|立方体]]や[[八面体]]など数多い<ref name="ShihYanChallenges"/>。初期の例では、複数の[[DNAリガーゼ|ライゲーション]]と[[固相合成法|固相合成]]ステップを繰り返して[[カテナン|連環DNA]]多面体を作り出しており、大きな労力を要した<ref>'''DNA polyhedra:''' {{Cite journal|last=Zhang|first=Yuwen|last2=Seeman, Nadrian C.|date=1 March 1994|title=Construction of a DNA-truncated octahedron|journal=Journal of the American Chemical Society|volume=116|issue=5|pages=1661–1669| |
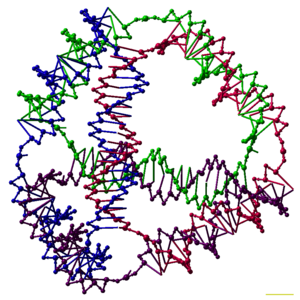
一つ一つが[[多面体]]と同じ連結性を持つ3次元複合体をDNAから合成できることも実証されている。そこではDNA二重鎖が多面体の[[辺]]となり、DNAジャンクションが[[頂点]]となる。多面体の種類は[[正六面体|立方体]]や[[八面体]]など数多い<ref name="ShihYanChallenges"/>。初期の例では、複数の[[DNAリガーゼ|ライゲーション]]と[[固相合成法|固相合成]]ステップを繰り返して[[カテナン|連環DNA]]多面体を作り出しており、大きな労力を要した<ref>'''DNA polyhedra:''' {{Cite journal|last=Zhang|first=Yuwen|last2=Seeman, Nadrian C.|date=1 March 1994|title=Construction of a DNA-truncated octahedron|journal=Journal of the American Chemical Society|volume=116|issue=5|pages=1661–1669|doi=10.1021/ja00084a006}}</ref>。研究が進むと合成がはるかに容易な多面体構造が作り出された。例としては、たった一本のDNA鎖が正しく折りたたまれて形成される八面体や<ref>'''DNA polyhedra:''' {{Cite journal|last=Shih|first=William M.|last2=Quispe, Joel D.|last3=Joyce, Gerald F.|date=12 February 2004|title=A 1.7-kilobase single-stranded DNA that folds into a nanoscale octahedron|journal=Nature|volume=427|issue=6975|pages=618–621|bibcode=2004Natur.427..618S|doi=10.1038/nature02307|pmid=14961116}}</ref>、4本のDNA鎖から1ステップで生成する四面体(記事冒頭の図に示されている)がある<ref name="Goodman05"/>。 |
||
不規則な任意形状のナノ構造を作る場合、通常は[[DNAオリガミ]]法が用いられる。「スキャフォールド(足場)」と呼ばれる天然の長い一本鎖ウィルスDNAを、コンピュータで設計された多数の短い「ステープル(かすがい)」鎖によって折りたたんで望みの形状を作り出す方法である。その利点は、[[塩基配列]]が足場鎖によって事前に決定されており、ほかのほとんどのDNAナノテクノロジー技術と違って核酸鎖の純度や[[化学量論|化学量論性]]を高く保つ必要がないため、設計が容易だというところにある。DNAオリガミ法はまず2次元形状で実証された。最初に作られた形状には[[スマイリーフェイス]]や[[西半球]]の略地図、[[モナリザ]]の絵などがあった<ref name="ShihYanChallenges"/><ref name="rothemundorigami">'''DNA origami:''' {{Cite journal|last=Rothemund|first=Paul W. K.|date=16 March 2006|title=Folding DNA to create nanoscale shapes and patterns|url=https://authors.library.caltech.edu/22244/2/nature04586-s1.pdf|journal=Nature|volume=440|issue=7082|pages=297–302|bibcode=2006Natur.440..297R| |
不規則な任意形状のナノ構造を作る場合、通常は[[DNAオリガミ]]法が用いられる。「スキャフォールド(足場)」と呼ばれる天然の長い一本鎖ウィルスDNAを、コンピュータで設計された多数の短い「ステープル(かすがい)」鎖によって折りたたんで望みの形状を作り出す方法である。その利点は、[[塩基配列]]が足場鎖によって事前に決定されており、ほかのほとんどのDNAナノテクノロジー技術と違って核酸鎖の純度や[[化学量論|化学量論性]]を高く保つ必要がないため、設計が容易だというところにある。DNAオリガミ法はまず2次元形状で実証された。最初に作られた形状には[[スマイリーフェイス]]や[[西半球]]の略地図、[[モナリザ]]の絵などがあった<ref name="ShihYanChallenges"/><ref name="rothemundorigami">'''DNA origami:''' {{Cite journal|last=Rothemund|first=Paul W. K.|date=16 March 2006|title=Folding DNA to create nanoscale shapes and patterns|url=https://authors.library.caltech.edu/22244/2/nature04586-s1.pdf|journal=Nature|volume=440|issue=7082|pages=297–302|bibcode=2006Natur.440..297R|doi=10.1038/nature04586|pmid=16541064}}</ref><ref>{{Cite journal|last=Tikhomirov|first=Grigory|last2=Petersen|first2=Philip|last3=Qian|first3=Lulu|date=December 2017|title=Fractal assembly of micrometre-scale DNA origami arrays with arbitrary patterns|url=https://authors.library.caltech.edu/82063/3/nature24655-s1.pdf|journal=Nature|volume=552|issue=7683|pages=67–71|bibcode=2017Natur.552...67T|doi=10.1038/nature24655|issn=1476-4687|pmid=29219965}}</ref>。平行にした多くのDNA鎖をハニカム状に積み上げて堅固な3次元構造を作成したり<ref name="origami">'''DNA origami:''' {{Cite journal|last=Douglas|first=Shawn M.|last2=Dietz|first2=Hendrik|last3=Liedl|first3=Tim|last4=Högberg|first4=Björn|last5=Graf|first5=Franziska|last6=Shih|first6=William M.|date=21 May 2009|title=Self-assembly of DNA into nanoscale three-dimensional shapes|journal=Nature|volume=459|issue=7245|pages=414–418|bibcode=2009Natur.459..414D|doi=10.1038/nature08016|pmid=19458720|pmc=2688462}}</ref>、2次元面構造を折りたたんで段ボール箱のような中空の3次元的形状とすることもできる。箱状構造は刺激を受けると蓋が開いて分子貨物を露出ないし放出するようにプログラムできるため、プログラマブルな{{仮リンク|分子カプセル|en|Molecular encapsulation|label=分子ケージ}}としての応用が見込まれる<ref name="AndersenBox">'''DNA boxes:''' {{Cite journal|last=Andersen|first=Ebbe S.|last2=Dong|first2=Mingdong|last3=Nielsen|first3=Morten M.|last4=Jahn|first4=Kasper|last5=Subramani|first5=Ramesh|last6=Mamdouh|first6=Wael|last7=Golas|first7=Monika M.|last8=Sander|first8=Bjoern|last9=Stark|first9=Holger|date=7 May 2009|title=Self-assembly of a nanoscale DNA box with a controllable lid|journal=Nature|volume=459|issue=7243|pages=73–76|bibcode=2009Natur.459...73A|doi=10.1038/nature07971|pmid=19424153}}</ref><ref>'''DNA boxes:''' {{cite journal |doi=10.1021/nl901165f |title=Scaffolded DNA origami of a DNA tetrahedron molecular container |date=10 June 2009 |last1=Ke |first1=Yonggang |last2=Sharma |first2=Jaswinder |last3=Liu |first3=Minghui |last4=Jahn |first4=Kasper |last5=Liu |first5=Yan |last6=Yan |first6=Hao |journal=Nano Letters |volume=9 |pages=2445–2447 |pmid=19419184 |issue=6|bibcode= 2009NanoL...9.2445K}}</ref>。 |
||
=== テンプレートによるアセンブリ === |
=== テンプレートによるアセンブリ === |
||
| 80行目: | 80行目: | ||
== 動的DNAナノテクノロジー == |
== 動的DNAナノテクノロジー == |
||
[[ファイル:Strand_displacement.svg|サムネイル| 動的DNAナノテクノロジーでは「トーホールド」と呼ばれる部位を利用した鎖置換反応が行われる。図 (a) では緑色の鎖の一本鎖となった部分(領域1)がトーホールドである。そこに赤い鎖が結合し (b)、領域2に沿って{{仮リンク|分岐点移動|en|Branch migration|label=分岐点が進んでいく}}(c)。最終的に青い鎖が赤い鎖によって置換され、複合体から切り離される (d)。このような反応によって核酸ナノ構造の動的な再配列もしくはアセンブリが行われる。赤と青の鎖が[[分子論理ゲート]]の信号を表すようにもできる。]] |
[[ファイル:Strand_displacement.svg|サムネイル| 動的DNAナノテクノロジーでは「トーホールド」と呼ばれる部位を利用した鎖置換反応が行われる。図 (a) では緑色の鎖の一本鎖となった部分(領域1)がトーホールドである。そこに赤い鎖が結合し (b)、領域2に沿って{{仮リンク|分岐点移動|en|Branch migration|label=分岐点が進んでいく}}(c)。最終的に青い鎖が赤い鎖によって置換され、複合体から切り離される (d)。このような反応によって核酸ナノ構造の動的な再配列もしくはアセンブリが行われる。赤と青の鎖が[[分子論理ゲート]]の信号を表すようにもできる。]] |
||
動的DNAナノテクノロジーで中心となるのは、計算や機械的運動など、所定の動的機能を発現させるような全体構造を持つ核酸系の構築である。アニーリングから動的な再配列を行うことで構造を得たり、最初から動的に構造形成を行うこともできるため、構造的DNAナノテクノロジーと重なる部分がある<ref name="ShihYanChallenges"/><ref name="nanomachines">'''DNA machines:''' {{Cite journal|last=Bath|first=Jonathan|last2=Turberfield|first2=Andrew J.|date=May 2007|title=DNA nanomachines|journal=Nature Nanotechnology|volume=2|issue=5|pages=275–284|bibcode=2007NatNa...2..275B| |
動的DNAナノテクノロジーで中心となるのは、計算や機械的運動など、所定の動的機能を発現させるような全体構造を持つ核酸系の構築である。アニーリングから動的な再配列を行うことで構造を得たり、最初から動的に構造形成を行うこともできるため、構造的DNAナノテクノロジーと重なる部分がある<ref name="ShihYanChallenges"/><ref name="nanomachines">'''DNA machines:''' {{Cite journal|last=Bath|first=Jonathan|last2=Turberfield|first2=Andrew J.|date=May 2007|title=DNA nanomachines|journal=Nature Nanotechnology|volume=2|issue=5|pages=275–284|bibcode=2007NatNa...2..275B|doi=10.1038/nnano.2007.104|pmid=18654284}}</ref>。 |
||
=== ナノメカニカル素子 === |
=== ナノメカニカル素子 === |
||
[[ナノロボット]]の一つの形として、何らかの刺激によって立体配座を変化させるDNA複合体が作製されている。作製には構造的DNAナノテクノロジーにおいて静的構造を作るのと同様な方法がとられるが、アセンブリ後に動的な再配列が可能なように設計される<ref name="DDNreview"/><ref name="nanomachines"/>。この種の素子で最初のものは[[二重らせん#様々な二重らせん構造|B-DNA]](右巻き)と[[Z-DNA]](左巻き)の間の遷移を利用しており、[[緩衝液|バッファー]]条件の変化に応じてねじれ運動を行った<ref>'''DNA machines:''' {{Cite journal|last=Mao|first=Chengde|last2=Sun, Weiqiong|last3=Shen, Zhiyong|last4=Seeman, Nadrian C.|date=14 January 1999|title=A DNA nanomechanical device based on the B-Z transition|journal=Nature|volume=397|issue=6715|pages=144–146|bibcode=1999Natur.397..144M| |
[[ナノロボット]]の一つの形として、何らかの刺激によって立体配座を変化させるDNA複合体が作製されている。作製には構造的DNAナノテクノロジーにおいて静的構造を作るのと同様な方法がとられるが、アセンブリ後に動的な再配列が可能なように設計される<ref name="DDNreview"/><ref name="nanomachines"/>。この種の素子で最初のものは[[二重らせん#様々な二重らせん構造|B-DNA]](右巻き)と[[Z-DNA]](左巻き)の間の遷移を利用しており、[[緩衝液|バッファー]]条件の変化に応じてねじれ運動を行った<ref>'''DNA machines:''' {{Cite journal|last=Mao|first=Chengde|last2=Sun, Weiqiong|last3=Shen, Zhiyong|last4=Seeman, Nadrian C.|date=14 January 1999|title=A DNA nanomechanical device based on the B-Z transition|journal=Nature|volume=397|issue=6715|pages=144–146|bibcode=1999Natur.397..144M|doi=10.1038/16437|pmid=9923675}}</ref>。バッファー条件をトリガーとする系ではすべての素子が同時に状態変化を起こしたが、後には制御ストランドが状態変化を起こさせるような系を用いて溶液中の各素子を独立して操作できるようになった。その例としては、開状態と閉状態を持つ「[[分子ピンセット]]」の仕組みや<ref>'''DNA machines:''' {{Cite journal|last=Yurke, Bernard; Turberfield, Andrew J.; Mills, Allen P., Jr; Simmel, Friedrich C.; Neumann, Jennifer L.|date=10 August 2000|title=A DNA-fuelled molecular machine made of DNA|journal=Nature|volume=406|issue=6796|pages=605–609|bibcode=2000Natur.406..605Y|doi=10.1038/35020524|pmid=10949296}}</ref>、パラネミック・クロスオーバー配位 (PX) とダブルジャンクション配位 (JX2) とを切り替えることで回転運動を生じる素子<ref>'''DNA machines:''' {{Cite journal|last=Yan|first=Hao|last2=Zhang, Xiaoping|last3=Shen, Zhiyong|last4=Seeman, Nadrian C.|date=3 January 2002|title=A robust DNA mechanical device controlled by hybridization topology|journal=Nature|volume=415|issue=6867|pages=62–65|bibcode=2002Natur.415...62Y|doi=10.1038/415062a|pmid=11780115}}</ref>、制御ストランドと出会うと動的に伸縮を行う2次元アレイがある<ref>'''DNA machines:''' {{Cite journal|last=Feng|first=L.|last2=Park|first2=S. H.|last3=Reif|first3=J. H.|last4=Yan|first4=H.|date=22 September 2003|title=A two-state DNA lattice switched by DNA nanoactuator|journal=Angewandte Chemie|volume=115|issue=36|pages=4478–4482|doi=10.1002/ange.200351818|pmid=|pmc=}}</ref>。動的に開閉を行えるケージ構造も作られており、機能性分子貨物を自在に露出ないし放出させる分子ケージとして期待されている<ref name="AndersenBox"/><ref>'''DNA machines:''' {{Cite journal|last=Goodman|first=R. P.|last2=Heilemann|first2=M.|last3=Doose|first3=S. R.|last4=Erben|first4=C. M.|last5=Kapanidis|first5=A. N.|last6=Turberfield|first6=A. J.|date=February 2008|title=Reconfigurable, braced, three-dimensional DNA nanostructures|journal=Nature Nanotechnology|volume=3|issue=2|pages=93–96|bibcode=2008NatNa...3...93G|doi=10.1038/nnano.2008.3|pmid=18654468|pmc=}}</ref><ref name="DouglasRobot">'''Applications:''' {{Cite journal|last=Douglas|first=Shawn M.|last2=Bachelet|first2=Ido|last3=Church|first3=George M.|date=17 February 2012|title=A logic-gated nanorobot for targeted transport of molecular payloads|journal=Science|volume=335|issue=6070|pages=831–834|bibcode=2012Sci...335..831D|doi=10.1126/science.1214081|pmid=22344439|pmc=}}</ref>。 |
||
{{仮リンク|DNAウォーカー|en|DNA walker|label=}}は一次元的なトラックに沿って指向性運動を行う核酸ナノマシンの一種であり、多くのスキームが確立されている<ref name="nanomachines"/>。たとえば一連の順番で制御ストランドを添加することでトラックに沿って一歩ずつウォーカーを動かす戦略がある<ref>'''DNA walkers:''' {{Cite journal|last=Shin|first=Jong-Shik|last2=Pierce|first2=Niles A.|date=8 September 2004|title=A synthetic DNA walker for molecular transport|url=https://authors.library.caltech.edu/74531/2/ja047543jsi20040702_013316.pdf|journal=Journal of the American Chemical Society|volume=126|issue=35|pages=10834–10835| |
{{仮リンク|DNAウォーカー|en|DNA walker|label=}}は一次元的なトラックに沿って指向性運動を行う核酸ナノマシンの一種であり、多くのスキームが確立されている<ref name="nanomachines"/>。たとえば一連の順番で制御ストランドを添加することでトラックに沿って一歩ずつウォーカーを動かす戦略がある<ref>'''DNA walkers:''' {{Cite journal|last=Shin|first=Jong-Shik|last2=Pierce|first2=Niles A.|date=8 September 2004|title=A synthetic DNA walker for molecular transport|url=https://authors.library.caltech.edu/74531/2/ja047543jsi20040702_013316.pdf|journal=Journal of the American Chemical Society|volume=126|issue=35|pages=10834–10835|doi=10.1021/ja047543j|pmid=15339155}}</ref><ref>'''DNA walkers:''' {{Cite journal|last=Sherman|first=William B.|last2=Seeman|first2=Nadrian C.|date=July 2004|title=A precisely controlled DNA biped walking device|journal=Nano Letters|volume=4|issue=7|pages=1203–1207|bibcode=2004NanoL...4.1203S|doi=10.1021/nl049527q}}</ref>。別のアプローチとして、[[制限酵素]]またはデオキシリボザイムを備えたウォーカーがトラックの核酸鎖を切断しながら一方向に進む自律的なシステムもある<ref>'''DNA walkers:''' {{Cite journal|last=Tian|first=Ye|last2=He|first2=Yu|last3=Chen|first3=Yi|last4=Yin|first4=Peng|last5=Mao|first5=Chengde|date=11 July 2005|title=A DNAzyme that walks processively and autonomously along a one-dimensional track|journal=Angewandte Chemie|volume=117|issue=28|pages=4429–4432|doi=10.1002/ange.200500703}}</ref><ref>'''DNA walkers:''' {{Cite journal|last=Bath|first=Jonathan|last2=Green|first2=Simon J.|last3=Turberfield|first3=Andrew J.|date=11 July 2005|title=A free-running DNA motor powered by a nicking enzyme|journal=Angewandte Chemie International Edition|volume=44|issue=28|pages=4358–4361|doi=10.1002/anie.200501262|pmid=15959864}}</ref>。後には一次元的なトラックの代わりに2次元面を歩きながら分子貨物を選択的に拾い上げて運ぶウォーカーも実現された<ref>'''Functional DNA walkers:''' {{Cite journal|last=Lund|first=Kyle|last2=Manzo|first2=Anthony J.|last3=Dabby|first3=Nadine|last4=Michelotti|first4=Nicole|last5=Johnson-Buck|first5=Alexander|last6=Nangreave|first6=Jeanette|last7=Taylor|first7=Steven|last8=Pei|first8=Renjun|last9=Stojanovic|first9=Milan N.|date=13 May 2010|title=Molecular robots guided by prescriptive landscapes|journal=Nature|volume=465|issue=7295|pages=206–210|bibcode=2010Natur.465..206L|doi=10.1038/nature09012|pmid=20463735|pmc=2907518}}</ref>。また、トラックに沿って進みながら{{仮リンク|核酸テンプレート化学|en|Nucleic acid templated chemistry|label=DNAテンプレート合成}}を行うことで自律的に多段階化学合成を進める一次元ウォーカーも実現している<ref>'''Functional DNA walkers:''' {{Cite journal|last=He|first=Yu|last2=Liu|first2=David R.|date=November 2010|title=Autonomous multistep organic synthesis in a single isothermal solution mediated by a DNA walker|journal=Nature Nanotechnology|volume=5|issue=11|pages=778–782|bibcode=2010NatNa...5..778H|doi=10.1038/nnano.2010.190|pmid=20935654|pmc=2974042}}</ref>。化学合成DNAウォーカーの機能は天然のタンパク質[[ダイニン]]と[[キネシン]]に通じる<ref>{{Cite journal|last=Pan|first=J|last2=Li|first2=F|last3=Cha|first3=TG|last4=Chen|first4=H|last5=Choi|first5=JH|year=2015|title=Recent progress on DNA based walkers|url=|journal=Current Opinion in Biotechnology|volume=34|pages=56–64|doi=10.1016/j.copbio.2014.11.017|pmid=25498478}}</ref>。 |
||
=== 鎖置換カスケード === |
=== 鎖置換カスケード === |
||
鎖置換反応のカスケードを利用して計算や構造形成を行うことができる。何らかのイニシエーター鎖への応答として新しい配列が露出するのが一つの鎖置換反応である。多数の反応をつなげることで、ある反応で露出した配列が次の反応のイニシエーターとなるような{{仮リンク|生化学カスケード|en|Biochemical cascade|label=}}を構築できる。さらにそれを組み合わせて、多数の要素からなる化学反応ネットワークを構築すれば複雑な計算や情報処理を行わせられる。カスケード反応は新しい塩基対の形成によるエネルギー利得と分解反応による[[エントロピー]]増大によりエネルギー的に有利となる。鎖置換カスケードを用いれば等温操作によってアセンブリや計算プロセスを行うことが可能で、従来の核酸アセンブリにおいて加熱後にゆっくり冷却することで目的の構造を形成させる熱的アニーリングステップが必要だったとは対照的である。また鎖置換カスケードのイニシエーター種に触媒機能を持たせて、1当量未満のイニシエーターによって反応を一方向に進める<!-- "cause the reaction to go to completion" -->こともできる<ref name="DDNreview"/><ref name="YinDynamic">'''Kinetic assembly:''' {{Cite journal|last=Yin|first=Peng|last2=Choi|first2=Harry M. T.|last3=Calvert|first3=Colby R.|last4=Pierce|first4=Niles A.|date=17 January 2008|title=Programming biomolecular self-assembly pathways|url=https://authors.library.caltech.edu/74529/2/nature06451-s1.pdf|journal=Nature|volume=451|issue=7176|pages=318–322|bibcode=2008Natur.451..318Y| |
鎖置換反応のカスケードを利用して計算や構造形成を行うことができる。何らかのイニシエーター鎖への応答として新しい配列が露出するのが一つの鎖置換反応である。多数の反応をつなげることで、ある反応で露出した配列が次の反応のイニシエーターとなるような{{仮リンク|生化学カスケード|en|Biochemical cascade|label=}}を構築できる。さらにそれを組み合わせて、多数の要素からなる化学反応ネットワークを構築すれば複雑な計算や情報処理を行わせられる。カスケード反応は新しい塩基対の形成によるエネルギー利得と分解反応による[[エントロピー]]増大によりエネルギー的に有利となる。鎖置換カスケードを用いれば等温操作によってアセンブリや計算プロセスを行うことが可能で、従来の核酸アセンブリにおいて加熱後にゆっくり冷却することで目的の構造を形成させる熱的アニーリングステップが必要だったとは対照的である。また鎖置換カスケードのイニシエーター種に触媒機能を持たせて、1当量未満のイニシエーターによって反応を一方向に進める<!-- "cause the reaction to go to completion" -->こともできる<ref name="DDNreview"/><ref name="YinDynamic">'''Kinetic assembly:''' {{Cite journal|last=Yin|first=Peng|last2=Choi|first2=Harry M. T.|last3=Calvert|first3=Colby R.|last4=Pierce|first4=Niles A.|date=17 January 2008|title=Programming biomolecular self-assembly pathways|url=https://authors.library.caltech.edu/74529/2/nature06451-s1.pdf|journal=Nature|volume=451|issue=7176|pages=318–322|bibcode=2008Natur.451..318Y|doi=10.1038/nature06451|pmid=18202654}}</ref>。 |
||
鎖置換複合体からは複雑な計算を行う[[分子論理ゲート]]を作成することができる<ref>'''Fuzzy and Boolean logic gates based on DNA:''' {{Cite journal|last=Zadegan|first=R. M.|last2=Jepsen|first2=M. D. E.|last3=Hildebrandt|first3=L. L.|last4=Birkedal|first4=V.|last5=Kjems|first5=J. R.|year=2015|title=Construction of a Fuzzy and Boolean Logic Gates Based on DNA|journal=Small|volume=11|issue=15|pages=1811–7| |
鎖置換複合体からは複雑な計算を行う[[分子論理ゲート]]を作成することができる<ref>'''Fuzzy and Boolean logic gates based on DNA:''' {{Cite journal|last=Zadegan|first=R. M.|last2=Jepsen|first2=M. D. E.|last3=Hildebrandt|first3=L. L.|last4=Birkedal|first4=V.|last5=Kjems|first5=J. R.|year=2015|title=Construction of a Fuzzy and Boolean Logic Gates Based on DNA|journal=Small|volume=11|issue=15|pages=1811–7|doi=10.1002/smll.201402755|pmid=25565140}}</ref>。[[電流]]によって入出力を行う従来の電子計算機とは異なり、分子コンピュータは特定の化学種の濃度を信号とする。核酸鎖置換回路では、置換複合体上のほかの鎖と結合して消費されたり、また切断されて出現したりする核酸鎖の存在が信号となる。このアプローチによって[[ANDゲート|AND]]、[[ORゲート|OR]]、[[NOTゲート]]のような[[論理回路|論理ゲート]]が作製されている<ref>'''Strand displacement cascades:''' {{Cite journal|last=Seelig|first=G.|last2=Soloveichik|first2=D.|last3=Zhang|first3=D. Y.|last4=Winfree|first4=E.|date=8 December 2006|title=Enzyme-free nucleic acid logic circuits|journal=Science|volume=314|issue=5805|pages=1585–1588|bibcode=2006Sci...314.1585S|doi=10.1126/science.1132493|pmid=17158324|pmc=}}</ref>。より近年では、130本のDNA鎖からなるゲート系によって0〜15の整数の[[平方根]]を計算できる4ビット回路が構成されている<ref>'''Strand displacement cascades:''' {{Cite journal|last=Qian|first=Lulu|last2=Winfree|first2=Erik|date=3 June 2011|title=Scaling up digital circuit computation with DNA strand displacement cascades|journal=Science|volume=332|issue=6034|pages=1196–1201|bibcode=2011Sci...332.1196Q|doi=10.1126/science.1200520|pmid=21636773|pmc=}}</ref>。 |
||
[[ファイル: Stem-loop.svg|サムネイル|RNAによるステム・ループ構造(ヘアピン構造)の例。]] |
[[ファイル: Stem-loop.svg|サムネイル|RNAによるステム・ループ構造(ヘアピン構造)の例。]] |
||
| 96行目: | 96行目: | ||
== 応用 == |
== 応用 == |
||
DNAナノテクノロジーは、正確に制御されたナノスケールの構成部品を持つ複雑な構造を設計・構築する数少ない方法の1つである。[[構造生物学]]と[[生物物理学]]では基礎的な問題を解決するためにDNAナノテクノロジーが応用され始めている。最初に考えられたのは[[結晶学]]への応用で、単独では結晶化が困難な分子を3次元核酸格子内に周期配置することで構造同定を行うというものだったが、現在でも研究が進められている。ほかにも、タンパク質NMR分光で{{仮リンク|残留双極子カップリング|en|Residual dipolar coupling|label=}}を測定する際に[[液晶]]の代わりとしてDNAオリガミロッドを使用することがある。DNAオリガミロッドは[[膜タンパク質]]を液中に分散させるのに必要な界面活性剤に耐性がある点で液晶より優れている。DNAウォーカーはナノ粒子を運んで[[化学合成]]を進めるナノスケールの組み立てラインとして応用されている。さらに、[[酵素]]の機能や[[フォールディング|タンパク質の折りたたみ]]に関する生物物理学的な研究でもDNAオリガミ構造が役立てられている<ref name="SDNreview"/><ref name="growsup">'''History/applications:''' {{Cite journal|last=Service|first=Robert F.|date=3 June 2011|title=DNA nanotechnology grows up|journal=Science|volume=332|issue=6034|pages=1140–1143| |
DNAナノテクノロジーは、正確に制御されたナノスケールの構成部品を持つ複雑な構造を設計・構築する数少ない方法の1つである。[[構造生物学]]と[[生物物理学]]では基礎的な問題を解決するためにDNAナノテクノロジーが応用され始めている。最初に考えられたのは[[結晶学]]への応用で、単独では結晶化が困難な分子を3次元核酸格子内に周期配置することで構造同定を行うというものだったが、現在でも研究が進められている。ほかにも、タンパク質NMR分光で{{仮リンク|残留双極子カップリング|en|Residual dipolar coupling|label=}}を測定する際に[[液晶]]の代わりとしてDNAオリガミロッドを使用することがある。DNAオリガミロッドは[[膜タンパク質]]を液中に分散させるのに必要な界面活性剤に耐性がある点で液晶より優れている。DNAウォーカーはナノ粒子を運んで[[化学合成]]を進めるナノスケールの組み立てラインとして応用されている。さらに、[[酵素]]の機能や[[フォールディング|タンパク質の折りたたみ]]に関する生物物理学的な研究でもDNAオリガミ構造が役立てられている<ref name="SDNreview"/><ref name="growsup">'''History/applications:''' {{Cite journal|last=Service|first=Robert F.|date=3 June 2011|title=DNA nanotechnology grows up|journal=Science|volume=332|issue=6034|pages=1140–1143|doi=10.1126/science.332.6034.1140|pmid=21636754}}</ref>。 |
||
DNAナノテクノロジーは将来の実用的な応用に向けて発展を続けている。核酸アレイには他の分子を配列させる能力があるため[[分子スケールエレクトロニクス]]への応用が期待される。核酸構造のアセンブリをテンプレートとして{{仮リンク|分子ワイヤ|en|Molucular wire|label=}}のような分子エレクトロニクス素子のアセンブリを行えば、[[ブレッドボード]]に相当する分子素子のアーキテクチャやチップ上の配置をナノメートルの精度で制御できるようになる<ref name="SDNreview"/><ref name="ShihYanChallenges"/>。DNAナノテクノロジーは計算処理を物質の特性と結び付けた点で[[プログラマブルマター]]の概念と比べられてきた<ref>'''Applications:''' {{Cite book|last=Rietman|first=Edward A.|title=Molecular engineering of nanosystems|year=2001|publisher=Springer|isbn=978-0-387-98988-4|pages=209–212|url=https://books.google.com/books?id=ga2DKYCm7xMC&pg=PA209|accessdate=17 April 2011}}</ref>。 |
DNAナノテクノロジーは将来の実用的な応用に向けて発展を続けている。核酸アレイには他の分子を配列させる能力があるため[[分子スケールエレクトロニクス]]への応用が期待される。核酸構造のアセンブリをテンプレートとして{{仮リンク|分子ワイヤ|en|Molucular wire|label=}}のような分子エレクトロニクス素子のアセンブリを行えば、[[ブレッドボード]]に相当する分子素子のアーキテクチャやチップ上の配置をナノメートルの精度で制御できるようになる<ref name="SDNreview"/><ref name="ShihYanChallenges"/>。DNAナノテクノロジーは計算処理を物質の特性と結び付けた点で[[プログラマブルマター]]の概念と比べられてきた<ref>'''Applications:''' {{Cite book|last=Rietman|first=Edward A.|title=Molecular engineering of nanosystems|year=2001|publisher=Springer|isbn=978-0-387-98988-4|pages=209–212|url=https://books.google.com/books?id=ga2DKYCm7xMC&pg=PA209|accessdate=17 April 2011}}</ref>。 |
||
[[オーフス大学]]iNANOセンターおよびCDNAセンターで行われた研究で、複数回のスイッチングが可能な3次元ボックス構造がDNAオリガミによって構築された。その性質は[[原子間力顕微鏡]] (AFM)、[[透過型電子顕微鏡]] (TEM)、および[[蛍光共鳴エネルギー移動]] (FRET) によって確かめられた。このボックスは蓋を閉じ直す独自の機構を備えており、決められたDNAもしくはRNAの組を鍵として何度も開閉を行うことができる。この研究の著者は「DNAデバイスには、単一分子の機能制御、[[ドラッグデリバリー]]制御、分子計算など幅広い応用が考えられる」と主張した<ref>{{Cite journal|last=M. Zadegan|first=Reza|last2=et|first2=al.|year=2012|title=Construction of a 4 Zeptoliters Switchable 3D DNA Box Origami|journal=[[ACS Nano]]|volume=6|issue=11|pages=10050–10053| |
[[オーフス大学]]iNANOセンターおよびCDNAセンターで行われた研究で、複数回のスイッチングが可能な3次元ボックス構造がDNAオリガミによって構築された。その性質は[[原子間力顕微鏡]] (AFM)、[[透過型電子顕微鏡]] (TEM)、および[[蛍光共鳴エネルギー移動]] (FRET) によって確かめられた。このボックスは蓋を閉じ直す独自の機構を備えており、決められたDNAもしくはRNAの組を鍵として何度も開閉を行うことができる。この研究の著者は「DNAデバイスには、単一分子の機能制御、[[ドラッグデリバリー]]制御、分子計算など幅広い応用が考えられる」と主張した<ref>{{Cite journal|last=M. Zadegan|first=Reza|last2=et|first2=al.|year=2012|title=Construction of a 4 Zeptoliters Switchable 3D DNA Box Origami|journal=[[ACS Nano]]|volume=6|issue=11|pages=10050–10053|doi=10.1021/nn303767b|pmid=23030709}}</ref>。 |
||
ナノ医療においても、[[生体適合性]]のあるDNAナノテクノロジーの計算方式を利用して{{仮リンク|標的化ドラッグデリバリー|en|Targeted drug delivery|label=}}用の「スマートドラッグ」を作成できる可能性がある。研究中のシステムには、[[アポトーシス]](細胞死)を誘導するタンパク質を中空のDNAボックスに入れて運び、{{仮リンク|癌細胞|en|Cancer cell|label=}}の近傍で放出するというものがある<ref name="growsup"/><ref>'''Applications:''' {{Cite journal|last=Jungmann|first=Ralf|last2=Renner|first2=Stephan|last3=Simmel|first3=Friedrich C.|date=March 2008|title=From DNA nanotechnology to synthetic biology|journal=HFSP Journal|volume=2|issue=2|pages=99–109| |
ナノ医療においても、[[生体適合性]]のあるDNAナノテクノロジーの計算方式を利用して{{仮リンク|標的化ドラッグデリバリー|en|Targeted drug delivery|label=}}用の「スマートドラッグ」を作成できる可能性がある。研究中のシステムには、[[アポトーシス]](細胞死)を誘導するタンパク質を中空のDNAボックスに入れて運び、{{仮リンク|癌細胞|en|Cancer cell|label=}}の近傍で放出するというものがある<ref name="growsup"/><ref>'''Applications:''' {{Cite journal|last=Jungmann|first=Ralf|last2=Renner|first2=Stephan|last3=Simmel|first3=Friedrich C.|date=March 2008|title=From DNA nanotechnology to synthetic biology|journal=HFSP Journal|volume=2|issue=2|pages=99–109|doi=10.2976/1.2896331|pmid=19404476|pmc=2645571}}</ref>。またこのような人工的な構造を生きた細菌の細胞中で[[遺伝子発現|発現]]させることにも関心が寄せられている。そのアセンブリには[[転写 (生物学)|転写]]産物RNAが利用できると見られているが、細胞質中で複雑な構造を効率的に折りたたんだりアセンブリしたりできるかは分かっていない。これが成功すれば、核酸ナノ構造に{{仮リンク|定向進化 (進化分子工学)|en|Directed evolution|label=定向進化}}を行わせることができるようになる<ref name="ShihYanChallenges"/>。[[オックスフォード大学]]の研究者は、短い合成DNA鎖4本が自己集積したケージ構造が細胞に侵入したまま少なくとも48時間生存したと報告した。[[蛍光標識]]されたDNA[[三角錐|四面体]]ケージは、実験室で培養されたヒト[[腎臓|腎]]細胞の中で細胞[[酵素]]による攻撃を受けながらも2日後まで損傷しなかった。この実験によりDNAケージによる生細胞中でのドラッグデリバリーの可能性が示された<ref>{{Cite web|url=http://www.fiercedrugdelivery.com/story/dna-cages-can-unleash-meds-inside-cells/2011-07-05|title=DNA cages can unleash meds inside cells|author=Lovy, Howard|publisher=fiercedrugdelivery.com|date=5 July 2011|accessdate=22 September 2013}}</ref><ref>{{Cite journal|last=Walsh|first=Anthony|last2=Yin|first2=Hai|last3=Erben|first3=Christoph|last4=Wood|first4=Matthew|last5=Turberfield|first5=Andrew|year=2011|title=DNA Cage Delivery to Mammalian Cells|journal=ACS Nano|volume=5|issue=7|pages=5427–5432|doi=10.1021/nn2005574|pmid=21696187}}</ref>。DNA[[三角錐|四面体]]を用いてマウスモデルに[[RNA干渉]] (RNAi) を起こせることも[[マサチューセッツ工科大学|MIT]]のチームによって報告されている。[[重合体|ポリマー]]や[[脂質]]によって干渉RNAをデリバリーする治療法はすでにある程度の成功を収めていたが、血流中での寿命が短く、安全性や送達の正確性にも課題があった。MITで作成されたDNAナノ構造は、6本のDNA鎖が四面体を形成し、それぞれの辺に1本のRNA鎖を付与する構造だった。四面体にはそのほか標的化のために[[葉酸]]分子が3つ付与されており、いくつかの腫瘍で豊富に見られる葉酸受容体にナノ粒子を誘導する仕組みになっていた。その結果、RNAiの標的であった[[ルシフェラーゼ]]の遺伝子発現が半分以下に低下することが示された。この研究により、DNAナノテクノロジーが新しいRNA干渉技術を通して有効な治療ツールを生み出しうる見通しが高まった<ref>{{Cite web|url=http://web.mit.edu/newsoffice/2012/rna-interference-lightweight-nanoparticle-0604.html|title=Researchers achieve RNA interference, in a lighter package|author=Trafton, Anne|publisher=MIT News|date=4 June 2012|accessdate=22 September 2013}}</ref><ref>{{Cite journal|last=Lee|first=Hyukjin|last2=Lytton-Jean|first2=Abigail|last3=Chen|first3=Yi|last4=Love|first4=Kevin|last5=Park|first5=Angela|last6=Karagiannis|first6=Emmanouil|last7=Sehgal|first7=Alfica|last8=Querbes|first8=William|last9=Zurenko|first9=Christopher|year=2012|title=Molecularly self-assembled nucleic acid nanoparticles for targeted in vivo siRNA delivery|journal=[[Nature Nanotechnology]]|volume=7|issue=6|pages=389–393|bibcode=2012NatNa...7..389L|doi=10.1038/NNANO.2012.73|pmid=22659608|pmc=3898745}}</ref>。DNA四面体構造を用いて[[薬剤耐性#多剤耐性|多剤耐性]]現象を克服しようとする試みもある。[[P糖タンパク質]]による薬物排出ポンプ機能を有するMCF-7乳がん細胞に対し、四面体と複合させた[[ドキソルビシン]] (DOX) を負荷した結果、DOXが排出されずにがん細胞のアポトーシスが達成された。生態適合性をテストするため、DOXを含まない四面体を細胞に負荷したところ、四面体自身は細胞毒性を示さなかった<ref>{{Cite journal|last=Kim|first=Kyoung-Ran|last2=Kim|first2=Da-Rae|last3=Lee|first3=Taemin|last4=Yhee|first4=Ji Young|last5=Kim|first5=Byeong-Su|last6=Kwon|first6=Ick Chan|last7=Ahn|first7=Dae-Ro|date=2013|title=Drug delivery by a self-assembled DNA tetrahedron for overcoming drug resistance in breast cancer cells|journal=Chemical Communications|volume=49|issue=20|pages=2010–2|language=en|doi=10.1039/c3cc38693g|issn=1359-7345|pmid=23380739}}</ref>。 |
||
DNAナノテクノロジーの医療応用としては、天然の[[膜タンパク質|膜タンパク質の]]構造と機能を模倣するように設計されたDNAナノ構造も注目されている。2012年、ランゲッカーら<ref name="LangeckerDNAchannel">'''DNA ion channels:''' {{Cite journal|last=Langecker|first=M|last2=Arnaut|first2=V|last3=Martin|first3=TG|last4=List|first4=J|last5=Renner|first5=S|last6=Mayer|first6=M|last7=Dietz|first7=H|last8=Simmel|first8=FC|date=16 November 2012|title=Synthetic lipid membrane channels formed by designed DNA nanostructures|journal=Science|volume=338|issue=6109|pages=932–936| |
DNAナノテクノロジーの医療応用としては、天然の[[膜タンパク質|膜タンパク質の]]構造と機能を模倣するように設計されたDNAナノ構造も注目されている。2012年、ランゲッカーら<ref name="LangeckerDNAchannel">'''DNA ion channels:''' {{Cite journal|last=Langecker|first=M|last2=Arnaut|first2=V|last3=Martin|first3=TG|last4=List|first4=J|last5=Renner|first5=S|last6=Mayer|first6=M|last7=Dietz|first7=H|last8=Simmel|first8=FC|date=16 November 2012|title=Synthetic lipid membrane channels formed by designed DNA nanostructures|journal=Science|volume=338|issue=6109|pages=932–936|doi=10.1126/science.1225624|pmid=23161995|pmc=3716461}}</ref>は、茎状のDNAオリガミ構造が疎水性[[コレステロール]]修飾を利用して[[脂質二重層|脂質膜]]に自己挿入し、膜を通してイオン電流を流す細孔として機能したと発表した。これは最初に実現された合成DNAイオンチャネルであり、後には単一のDNA二重鎖や<ref name="GoepfrichDuplex">'''DNA ion channels:''' {{Cite journal|last=Göpfrich|first=K|last2=Li|first2=CY|last3=Mames|first3=I|last4=Bhamidimarri|first4=SP|last5=Ricci|first5=M|last6=Yoo|first6=J|last7=Mames|first7=A|last8=Ohmann|first8=A|last9=Winterhalter|first9=M|date=13 July 2016|title=Ion Channels Made from a Single Membrane-Spanning DNA Duplex|journal=Nano Letters|volume=16|issue=7|pages=4665–4669|doi=10.1021/acs.nanolett.6b02039|pmid=27324157|pmc=4948918}}</ref>、小さいタイルベース構造<ref name="Burns2013_1">'''DNA ion channels:''' {{Cite journal|last=Burns|first=JR|last2=Stulz|first2=E|last3=Howorka|first3=S|date=12 June 2013|title=Self-assembled DNA nanopores that span lipid bilayers|journal=Nano Letters|volume=13|issue=6|pages=2351–2356|doi=10.1021/nl304147f|pmid=23611515}}</ref><ref name="Burns2013_2">'''DNA ion channels:''' {{Cite journal|last=Burns|first=JR|last2=Göpfrich|first2=K|last3=Wood|first3=JW|last4=Thacker|first4=VV|last5=Stulz|first5=E|last6=Keyser|first6=UF|last7=Howorka|first7=S|date=11 November 2013|title=Lipid-bilayer-spanning DNA nanopores with a bifunctional porphyrin anchor|journal=Angewandte Chemie (International Ed. In English)|volume=52|issue=46|pages=12069–12072|doi=10.1002/anie.201305765|pmid=24014236|pmc=4016739}}</ref><ref name="Seifert2015">'''DNA ion channels:''' {{Cite journal|last=Seifert|first=A|last2=Göpfrich|first2=K|last3=Burns|first3=JR|last4=Fertig|first4=N|last5=Keyser|first5=UF|last6=Howorka|first6=S|date=24 February 2015|title=Bilayer-spanning DNA nanopores with voltage-switching between open and closed state|journal=ACS Nano|volume=9|issue=2|pages=1117–1126|doi=10.1021/nn5039433|pmid=25338165|pmc=4508203}}</ref><ref name="Goepfrich2015">'''DNA ion channels:''' {{cite journal |last1=Göpfrich |first1=Kerstin |last2=Zettl |first2=Thomas |last3=Meijering |first3=Anna E. C. |last4=Hernández-Ainsa |first4=Silvia |last5=Kocabey |first5=Samet |last6=Liedl |first6=Tim |last7=Keyser |first7=Ulrich F. |title=DNA-Tile Structures Induce Ionic Currents through Lipid Membranes |journal=Nano Letters |date=8 April 2015 |volume=15 |issue=5 |pages=3134–3138 |doi=10.1021/acs.nanolett.5b00189 |pmid=25816075 |url=https://www.repository.cam.ac.uk/handle/1810/259995 }}</ref><ref name="Burns2016">'''DNA ion channels:''' {{Cite journal|last=Burns|first=Jonathan R.|last2=Seifert|first2=Astrid|last3=Fertig|first3=Niels|last4=Howorka|first4=Stefan|date=11 January 2016|title=A biomimetic DNA-based channel for the ligand-controlled transport of charged molecular cargo across a biological membrane|url=http://discovery.ucl.ac.uk/1474103/1/Howorka_Burns%20Howorka%20Nat%20Nano%20accepted%20not%20typeset.pdf|journal=Nature Nanotechnology|volume=11|issue=2|pages=152–156|doi=10.1038/nnano.2015.279|pmid=26751170}}</ref>、あるいはDNAオリガミによる大きな膜貫通[[ポリン (タンパク質)|ポリン]]など、多くの方式で細孔が作られた<ref name="GoepfrichPorin">'''DNA ion channels:''' {{Cite journal|last=Göpfrich|first=Kerstin|last2=Li|first2=Chen-Yu|last3=Ricci|first3=Maria|last4=Bhamidimarri|first4=Satya Prathyusha|last5=Yoo|first5=Jejoong|last6=Gyenes|first6=Bertalan|last7=Ohmann|first7=Alexander|last8=Winterhalter|first8=Mathias|last9=Aksimentiev|first9=Aleksei|date=23 August 2016|title=Large-Conductance Transmembrane Porin Made from DNA Origami|journal=ACS Nano|volume=10|issue=9|pages=8207–8214|doi=10.1021/acsnano.6b03759|pmid=27504755|pmc=5043419}}</ref>。天然のタンパク質[[イオンチャネル]]と同じように、多様な設計が可能な合成DNAチャネルはコンダクタンスに数桁の幅を持たせることができる。単一のDNA二重鎖によって[[脂質二重層]]にイオンチャネルを形成する研究では、DNA鎖自体には内腔が存在せず、イオン電流はDNAと脂質の界面を流れる。このチャネルの周辺で[[脂質|脂質頭基]]はDNAの方を向くため、細孔形状は単純な円筒ではなく[[トーラス|トロイダル]]型となっている<ref name="GoepfrichDuplex"/>。[[ケンブリッジ大学|ケンブリッジ大]]と[[イリノイ大学アーバナ・シャンペーン校|イリノイ大アーバナ・シャンペーン校]]の研究者は、そのようなDNA誘導トロイダル孔が脂質二重層の層間で脂質の高速な反転を引き起こすことを示した。この効果を利用して、{{仮リンク|リン脂質スクランブラーゼ|en|Phospholipid scramblase|label=スクランブラーゼ}}と呼ばれる天然タンパク質よりも桁違いに大きい速度で生体膜の脂質を反転させる合成DNA製[[酵素]]が設計されている<ref name="OhmannDNAscramblase">'''DNA scramblase:''' {{Cite journal|last=Ohmann|first=Alexander|last2=Li|first2=Chen-Yu|last3=Maffeo|first3=Christopher|last4=Al Nahas|first4=Kareem|last5=Baumann|first5=Kevin N.|last6=Göpfrich|first6=Kerstin|last7=Yoo|first7=Jejoong|last8=Keyser|first8=Ulrich F.|last9=Aksimentiev|first9=Aleksei|date=21 June 2018|title=A synthetic enzyme built from DNA flips 10<sup>7</sup> lipids per second in biological membranes|journal=Nature Communications|volume=9|issue=1|pages=2426|doi=10.1038/s41467-018-04821-5|pmid=29930243|pmc=6013447}}</ref>。この研究は合成DNAナノ構造によるパーソナルドラッグや個別化治療法の可能性を指し示している。 |
||
== 設計 == |
== 設計 == |
||
DNAナノ構造は個々の核酸鎖が集合して目的の構造を作るように合理的に設計する必要がある。通常、まずは標的とする[[核酸の三次構造|三次構造]]または機能を特定しなければならない。次に、標的複合体全体の[[核酸の二次構造|二次構造]]が決められる。すなわち核酸鎖の配置と、それぞれの鎖のどの部分を互いに結合するかを特定する。最後のステップは[[塩基配列|一次構造]]の設計、つまり核酸鎖の具体的な塩基配列の決定である<ref name="Feldkamp"/><ref name="Brenneman02">'''Design:''' {{Cite journal|last=Brenneman|first=Arwen|last2=Condon|first2=Anne|date=25 September 2002|title=Strand design for biomolecular computation|journal=Theoretical Computer Science|volume=287|pages=39–58| |
DNAナノ構造は個々の核酸鎖が集合して目的の構造を作るように合理的に設計する必要がある。通常、まずは標的とする[[核酸の三次構造|三次構造]]または機能を特定しなければならない。次に、標的複合体全体の[[核酸の二次構造|二次構造]]が決められる。すなわち核酸鎖の配置と、それぞれの鎖のどの部分を互いに結合するかを特定する。最後のステップは[[塩基配列|一次構造]]の設計、つまり核酸鎖の具体的な塩基配列の決定である<ref name="Feldkamp"/><ref name="Brenneman02">'''Design:''' {{Cite journal|last=Brenneman|first=Arwen|last2=Condon|first2=Anne|date=25 September 2002|title=Strand design for biomolecular computation|journal=Theoretical Computer Science|volume=287|pages=39–58|doi=10.1016/S0304-3975(02)00135-4}}</ref>。 |
||
=== 構造設計 === |
=== 構造設計 === |
||
核酸ナノ構造を設計する最初のステップは、与えられた構造をどうやって核酸鎖の配列として表すかを決めることである。このステップでは求める形状の中で鎖をつなぐ塩基対の位置(二次構造)が決められる<ref name="Feldkamp"/>。これまでに複数のアプローチが確立されている。 |
核酸ナノ構造を設計する最初のステップは、与えられた構造をどうやって核酸鎖の配列として表すかを決めることである。このステップでは求める形状の中で鎖をつなぐ塩基対の位置(二次構造)が決められる<ref name="Feldkamp"/>。これまでに複数のアプローチが確立されている。 |
||
;タイルベースの構造:このアプローチではターゲット構造を小さなユニットに分割する。それぞれのユニットに含まれる鎖どうしは強く結合しているが、ユニット間の相互作用はそれより弱い。周期格子の作製に用いられることが多いが、アルゴリズミック・セルフアセンブリにも応用できるため[[DNAコンピュータ|DNAコンピューティング]]のプラットフォームになりうる。1990年代半ばから2000年代半ばまで主要な戦略だったが、DNAオリガミの方法論が発展するとその地位を失った<ref name="Feldkamp"/><ref>'''Overview:''' {{Cite journal|last=Lin|first=Chenxiang|last2=Liu|first2=Yan|last3=Rinker|first3=Sherri|last4=Yan|first4=Hao|date=11 August 2006|title=DNA tile based self-assembly: building complex nanoarchitectures|journal=ChemPhysChem|volume=7|issue=8|pages=1641–1647| |
;タイルベースの構造:このアプローチではターゲット構造を小さなユニットに分割する。それぞれのユニットに含まれる鎖どうしは強く結合しているが、ユニット間の相互作用はそれより弱い。周期格子の作製に用いられることが多いが、アルゴリズミック・セルフアセンブリにも応用できるため[[DNAコンピュータ|DNAコンピューティング]]のプラットフォームになりうる。1990年代半ばから2000年代半ばまで主要な戦略だったが、DNAオリガミの方法論が発展するとその地位を失った<ref name="Feldkamp"/><ref>'''Overview:''' {{Cite journal|last=Lin|first=Chenxiang|last2=Liu|first2=Yan|last3=Rinker|first3=Sherri|last4=Yan|first4=Hao|date=11 August 2006|title=DNA tile based self-assembly: building complex nanoarchitectures|journal=ChemPhysChem|volume=7|issue=8|pages=1641–1647|doi=10.1002/cphc.200600260|pmid=16832805}}</ref>。 |
||
;折りたたみ構造:タイルベースのアプローチに代わるもので、1本の長い鎖を折りたたんでナノ構造を作る。長い鎖の各部が互いに結合するように設計することで折り畳みを行うか、あるいは短い「ステープル」鎖が留め金の役割を果たす。後者の方法はDNAオリガミと呼ばれており、2次元・3次元のナノスケール形状を作製することができる([[DNAナノテクノロジー#離散構造|離散構造]]節参照)<ref name="ShihYanChallenges">'''Overview:''' {{Cite journal|last=Pinheiro|first=A. V.|last2=Han|first2=D.|last3=Shih|first3=W. M.|last4=Yan|first4=H.|date=December 2011|title=Challenges and opportunities for structural DNA nanotechnology|journal=Nature Nanotechnology|volume=6|issue=12|pages=763–772|bibcode=2011NatNa...6..763P| |
;折りたたみ構造:タイルベースのアプローチに代わるもので、1本の長い鎖を折りたたんでナノ構造を作る。長い鎖の各部が互いに結合するように設計することで折り畳みを行うか、あるいは短い「ステープル」鎖が留め金の役割を果たす。後者の方法はDNAオリガミと呼ばれており、2次元・3次元のナノスケール形状を作製することができる([[DNAナノテクノロジー#離散構造|離散構造]]節参照)<ref name="ShihYanChallenges">'''Overview:''' {{Cite journal|last=Pinheiro|first=A. V.|last2=Han|first2=D.|last3=Shih|first3=W. M.|last4=Yan|first4=H.|date=December 2011|title=Challenges and opportunities for structural DNA nanotechnology|journal=Nature Nanotechnology|volume=6|issue=12|pages=763–772|bibcode=2011NatNa...6..763P|doi=10.1038/nnano.2011.187|pmid=22056726|pmc=3334823}}</ref><ref name="rothemundorigami"/>。 |
||
;動的アセンブリ:最終的な生成物だけでなく、[[反応機構]]の[[反応中間体|中間]]ステップすべてを設計することでDNAセルフアセンブリの[[反応速度論|動力学]]を直接制御するアプローチ。ヘアピン構造を持つ出発物質が決まった順序で{{仮リンク|生化学的カスケード|en|Biochemical cascade|label=カスケード反応}}を起こして最終的な配座にアセンブルする([[DNAナノテクノロジー#鎖置換カスケード|鎖置換カスケード]]節参照)。このアプローチには一定温度で[[等温過程|等温]]的に進行する利点があり、アセンブリをトリガーして正しく構造形成を行うために高温の熱アニーリングステップを必要とする熱力学的アプローチとは対照的である<ref name="ShihYanChallenges"/><ref name="YinDynamic"/>。 |
;動的アセンブリ:最終的な生成物だけでなく、[[反応機構]]の[[反応中間体|中間]]ステップすべてを設計することでDNAセルフアセンブリの[[反応速度論|動力学]]を直接制御するアプローチ。ヘアピン構造を持つ出発物質が決まった順序で{{仮リンク|生化学的カスケード|en|Biochemical cascade|label=カスケード反応}}を起こして最終的な配座にアセンブルする([[DNAナノテクノロジー#鎖置換カスケード|鎖置換カスケード]]節参照)。このアプローチには一定温度で[[等温過程|等温]]的に進行する利点があり、アセンブリをトリガーして正しく構造形成を行うために高温の熱アニーリングステップを必要とする熱力学的アプローチとは対照的である<ref name="ShihYanChallenges"/><ref name="YinDynamic"/>。 |
||
=== 塩基配列の設計 === |
=== 塩基配列の設計 === |
||
{{Main|核酸の設計}} |
{{Main|核酸の設計}} |
||
いずれかのアプローチによって標的複合体の二次構造を設計した後は、それを実現する具体的なヌクレオチド配列を考えなければならない。構成鎖が結合して求める立体配座となるように鎖に対して核酸塩基配列を割り当るプロセスが核酸設計である。配列の設計では、標的構造が{{仮リンク|ギブス自由エネルギー|en|Gibbs free energy|label=エネルギー}}的に最低で熱力学的に最も有利になり、アセンブルに誤りが生じた場合はエネルギーが高く不利になることを狙うのがほとんどである。実際に設計を行うには、sequence symmetry minimization 法などの単純で高速な[[ヒューリスティクス|発見的手法]]のほか、計算量が多く時間がかかるが正確な方法として、最近接塩基対の熱力学的モデル(Nearest-neighbor法)を正面から扱うやり方がある。幾何学的モデルを用いてナノ構造の三次構造を検査し、複合体に過度の[[ひずみ (化学)|ひずみ]]が生じていないか確かめることもある<ref name="Brenneman02"/><ref name="paradigms">'''Design:''' {{Cite journal|last=Dirks|first=Robert M.|last2=Lin, Milo|last3=Winfree, Erik|last4=Pierce, Niles A.|date=15 February 2004|title=Paradigms for computational nucleic acid design|journal=Nucleic Acids Research|volume=32|issue=4|pages=1392–1403| |
いずれかのアプローチによって標的複合体の二次構造を設計した後は、それを実現する具体的なヌクレオチド配列を考えなければならない。構成鎖が結合して求める立体配座となるように鎖に対して核酸塩基配列を割り当るプロセスが核酸設計である。配列の設計では、標的構造が{{仮リンク|ギブス自由エネルギー|en|Gibbs free energy|label=エネルギー}}的に最低で熱力学的に最も有利になり、アセンブルに誤りが生じた場合はエネルギーが高く不利になることを狙うのがほとんどである。実際に設計を行うには、sequence symmetry minimization 法などの単純で高速な[[ヒューリスティクス|発見的手法]]のほか、計算量が多く時間がかかるが正確な方法として、最近接塩基対の熱力学的モデル(Nearest-neighbor法)を正面から扱うやり方がある。幾何学的モデルを用いてナノ構造の三次構造を検査し、複合体に過度の[[ひずみ (化学)|ひずみ]]が生じていないか確かめることもある<ref name="Brenneman02"/><ref name="paradigms">'''Design:''' {{Cite journal|last=Dirks|first=Robert M.|last2=Lin, Milo|last3=Winfree, Erik|last4=Pierce, Niles A.|date=15 February 2004|title=Paradigms for computational nucleic acid design|journal=Nucleic Acids Research|volume=32|issue=4|pages=1392–1403|doi=10.1093/nar/gkh291|pmid=14990744|pmc=390280}}</ref>。 |
||
核酸設計の戦略は{{仮リンク|タンパク質の設計|en|Protein design|label=}}と似ている。いずれの場合も、求める標的構造が有利となり、ほかの構造が不利となるようにモノマー配列の設計が行われる。核酸設計では構造のエネルギー的な有利不利を予測するには単純な塩基対合則だけを考慮すれば十分であり、構造全体の3次元的な折りたたみについての細かい情報は不要であるため、計算の容易さという点でタンパク質の設計に勝っている。このため単純な発見的手法を用いてロバストなデザインを実験的に得ることが可能になる。ただし核酸構造はタンパク質と比べて機能の多様性では劣る。タンパク質は折りたたみによって複雑な構造を作る能力が高く、また核酸が4種の[[ヌクレオチド]]のみからなり化学的な多様性が低いのに対してタンパク質では20種の[[タンパク質を構成するアミノ酸|タンパク質構成アミノ酸]]を用いることができる<ref name="paradigms"/>。 |
核酸設計の戦略は{{仮リンク|タンパク質の設計|en|Protein design|label=}}と似ている。いずれの場合も、求める標的構造が有利となり、ほかの構造が不利となるようにモノマー配列の設計が行われる。核酸設計では構造のエネルギー的な有利不利を予測するには単純な塩基対合則だけを考慮すれば十分であり、構造全体の3次元的な折りたたみについての細かい情報は不要であるため、計算の容易さという点でタンパク質の設計に勝っている。このため単純な発見的手法を用いてロバストなデザインを実験的に得ることが可能になる。ただし核酸構造はタンパク質と比べて機能の多様性では劣る。タンパク質は折りたたみによって複雑な構造を作る能力が高く、また核酸が4種の[[ヌクレオチド]]のみからなり化学的な多様性が低いのに対してタンパク質では20種の[[タンパク質を構成するアミノ酸|タンパク質構成アミノ酸]]を用いることができる<ref name="paradigms"/>。 |
||
| 141行目: | 141行目: | ||
1991年、DNAを用いて立方体構造を作製したことがシーマンの研究室から報告された。これは初めて合成された3次元核酸ナノ構造であり、シーマンは1995年にナノテクノロジーに関する賞である{{仮リンク|ファインマン賞|en|Feynman Prize in Nanotechnology|label=}}を受賞した。DNAによる[[切頂八面体]]も続いて報告された。しかし間もなく、柔軟なジャンクションを[[頂点]]に持つ多面体構造は拡張3次元格子を作れるほどの剛性を持たないことが明らかになった。シーマンは剛性の高いダブルクロスオーバー[[モチーフ (生物学)|構造モチーフ]] (DX) を開発し、1998年には{{仮リンク|エリック・ウィンフリー|en|Erik Winfree|label=}}と共同でDXタイルからなる2次元格子の作製を報告した<ref name="Seeman-sciam"/><ref name="Pelesko"/><ref name="origamichapter">'''DNA origami:''' {{Cite book|doi=10.1007/3-540-30296-4_1|editor-first=Junghuei|editor-last=Chen|editor2-first=Natasha|editor2-last=Jonoska|editor3-first=Grzegorz|editor3-last=Rozenberg|title=Nanotechnology: science and computation|series=Natural Computing Series|year=2006|publisher=Springer|location=New York|isbn=978-3-540-30295-7|first=Paul W. K.|last=Rothemund|chapter=Scaffolded DNA origami: from generalized multicrossovers to polygonal networks|pages=3–21}}</ref>。この種のタイルベース構造にはDNAコンピューティングの手段となりえる利点があり、ウィンフリーと{{仮リンク|ポール・W・K・ロザムンド|en|Paul W. K. Rothemund|label=ポール・ロザムンド}}による2004年の論文でそれが実証された。この研究はアルゴリズミック・セルフアセンブリによる[[シェルピンスキーのギャスケット|シェルピンスキー・ギャスケット]]構造の形成に関するもので、2006年のファインマン賞を獲得した。ウィンフリーの慧眼は、DXタイルは[[ワンのタイル]]としても機能し、すなわちそのアセンブリによって計算を行えるという発想にあった<ref name="Pelesko"/>。3次元格子の合成は、シーマンが最初に志してから30年近く後の2009年になってようやく、彼自身によって報告された<ref name="growsup"/>。 |
1991年、DNAを用いて立方体構造を作製したことがシーマンの研究室から報告された。これは初めて合成された3次元核酸ナノ構造であり、シーマンは1995年にナノテクノロジーに関する賞である{{仮リンク|ファインマン賞|en|Feynman Prize in Nanotechnology|label=}}を受賞した。DNAによる[[切頂八面体]]も続いて報告された。しかし間もなく、柔軟なジャンクションを[[頂点]]に持つ多面体構造は拡張3次元格子を作れるほどの剛性を持たないことが明らかになった。シーマンは剛性の高いダブルクロスオーバー[[モチーフ (生物学)|構造モチーフ]] (DX) を開発し、1998年には{{仮リンク|エリック・ウィンフリー|en|Erik Winfree|label=}}と共同でDXタイルからなる2次元格子の作製を報告した<ref name="Seeman-sciam"/><ref name="Pelesko"/><ref name="origamichapter">'''DNA origami:''' {{Cite book|doi=10.1007/3-540-30296-4_1|editor-first=Junghuei|editor-last=Chen|editor2-first=Natasha|editor2-last=Jonoska|editor3-first=Grzegorz|editor3-last=Rozenberg|title=Nanotechnology: science and computation|series=Natural Computing Series|year=2006|publisher=Springer|location=New York|isbn=978-3-540-30295-7|first=Paul W. K.|last=Rothemund|chapter=Scaffolded DNA origami: from generalized multicrossovers to polygonal networks|pages=3–21}}</ref>。この種のタイルベース構造にはDNAコンピューティングの手段となりえる利点があり、ウィンフリーと{{仮リンク|ポール・W・K・ロザムンド|en|Paul W. K. Rothemund|label=ポール・ロザムンド}}による2004年の論文でそれが実証された。この研究はアルゴリズミック・セルフアセンブリによる[[シェルピンスキーのギャスケット|シェルピンスキー・ギャスケット]]構造の形成に関するもので、2006年のファインマン賞を獲得した。ウィンフリーの慧眼は、DXタイルは[[ワンのタイル]]としても機能し、すなわちそのアセンブリによって計算を行えるという発想にあった<ref name="Pelesko"/>。3次元格子の合成は、シーマンが最初に志してから30年近く後の2009年になってようやく、彼自身によって報告された<ref name="growsup"/>。 |
||
2000年代を通じてDNA人工構造の新しい機能が発見され続けた。最初の{{仮リンク|DNAマシン|en|DNA machine|label=DNAナノマシン}}(入力に応じて構造を変えるモチーフ)は1999年にシーマンによって実現した。翌年、バーナード・ユルケはより進んだシステムを作り出した。これは「トーホールド」を介して鎖置換を行う最初の核酸素子だった。次の進展は鎖置換を機械的な運動に変換することであり、2004年から2005年にかけて、シーマンやナイルズ・ピアース、アンドルー・ターバーフィールド、チェンデ・マオらがそれぞれ率いるグループによっていくつものDNAウォーカー系が作り出された<ref name="nanomachines"/>。ナノ粒子やタンパク質など他の分子をアセンブリさせるテンプレートとしてDNAアレイを用いるアイディアは、1987年にブリュッヘ・ロビンソンとシーマンによって最初に提案され<ref name="biochip">'''Nanoarchitecture:''' {{Cite journal|last=Robinson|first=Bruche H.|last2=Seeman, Nadrian C.|date=August 1987|title=The design of a biochip: a self-assembling molecular-scale memory device|journal=Protein Engineering|volume=1|issue=4|pages=295–300| |
2000年代を通じてDNA人工構造の新しい機能が発見され続けた。最初の{{仮リンク|DNAマシン|en|DNA machine|label=DNAナノマシン}}(入力に応じて構造を変えるモチーフ)は1999年にシーマンによって実現した。翌年、バーナード・ユルケはより進んだシステムを作り出した。これは「トーホールド」を介して鎖置換を行う最初の核酸素子だった。次の進展は鎖置換を機械的な運動に変換することであり、2004年から2005年にかけて、シーマンやナイルズ・ピアース、アンドルー・ターバーフィールド、チェンデ・マオらがそれぞれ率いるグループによっていくつものDNAウォーカー系が作り出された<ref name="nanomachines"/>。ナノ粒子やタンパク質など他の分子をアセンブリさせるテンプレートとしてDNAアレイを用いるアイディアは、1987年にブリュッヘ・ロビンソンとシーマンによって最初に提案され<ref name="biochip">'''Nanoarchitecture:''' {{Cite journal|last=Robinson|first=Bruche H.|last2=Seeman, Nadrian C.|date=August 1987|title=The design of a biochip: a self-assembling molecular-scale memory device|journal=Protein Engineering|volume=1|issue=4|pages=295–300|doi=10.1093/protein/1.4.295|pmid=3508280}}</ref>、2002年にシーマンとキール他が実証すると<ref name="Nanoparticles on DNA">'''Nanoarchitecture:''' {{Cite journal|last=Xiao|first=Shoujun|last2=Liu, Furong|last3=Rosen, Abbey E.|last4=Hainfeld, James F.|last5=Seeman, Nadrian C.|last6=Musier-Forsyth, Karin|last7=Kiehl, Richard A.|date=August 2002|title=Selfassembly of metallic nanoparticle arrays by DNA scaffolding|journal=Journal of Nanoparticle Research|volume=4|issue=4|pages=313–317|bibcode=2002JNR.....4..313X|doi=10.1023/A:1021145208328}}</ref>、多くのグループが後に続いた。 |
||
2006年、ロザムンドはDNAオリガミ法によって任意の形状を持つ堅固なDNA折りたたみ構造が容易に作製できることを示した。ロザムンドはそのコンセプトを、多数の短い核酸鎖を用いるシーマンのDX格子と、主に一本の長い鎖からなるウィリアム・シーのDNA八面体の中間だと考えていた。ロザムンドのDNAオリガミは一本の長い鎖が多数の短い鎖の助けを借りて折りたたまれる仕組みだった。これにより、それまでの限界を超えた大きさの構造を形成することができるようになった上に、設計や合成にともなう技術的な困難が低減された<ref name="origamichapter"/>。『[[ネイチャー]]』誌2006年3月15日号ではDNAオリガミが表紙を飾った<ref name="rothemundorigami"/>。2次元のDNAオリガミ構造を実証したロザムンドの研究に続いて、2009年にはダグラスらによって密な3次元構造が<ref name="origami"/>、Jørgen KjemsとYanの研究室では2次元面からなる中空の3次元構造が作り出された<ref name="growsup"/>。 |
2006年、ロザムンドはDNAオリガミ法によって任意の形状を持つ堅固なDNA折りたたみ構造が容易に作製できることを示した。ロザムンドはそのコンセプトを、多数の短い核酸鎖を用いるシーマンのDX格子と、主に一本の長い鎖からなるウィリアム・シーのDNA八面体の中間だと考えていた。ロザムンドのDNAオリガミは一本の長い鎖が多数の短い鎖の助けを借りて折りたたまれる仕組みだった。これにより、それまでの限界を超えた大きさの構造を形成することができるようになった上に、設計や合成にともなう技術的な困難が低減された<ref name="origamichapter"/>。『[[ネイチャー]]』誌2006年3月15日号ではDNAオリガミが表紙を飾った<ref name="rothemundorigami"/>。2次元のDNAオリガミ構造を実証したロザムンドの研究に続いて、2009年にはダグラスらによって密な3次元構造が<ref name="origami"/>、Jørgen KjemsとYanの研究室では2次元面からなる中空の3次元構造が作り出された<ref name="growsup"/>。 |
||
| 158行目: | 158行目: | ||
== 関連文献 == |
== 関連文献 == |
||
'''全般:''' |
'''全般:''' |
||
* {{Cite journal|last=Seeman|first=Nadrian C.|date=June 2004|title=Nanotechnology and the double helix|journal=Scientific American|volume=290|issue=6|pages=64–75|bibcode=2004SciAm.290f..64S| |
* {{Cite journal|last=Seeman|first=Nadrian C.|date=June 2004|title=Nanotechnology and the double helix|journal=Scientific American|volume=290|issue=6|pages=64–75|bibcode=2004SciAm.290f..64S|doi=10.1038/scientificamerican0604-64|pmid=15195395}}—分野の創設者による一般向けの記事。 |
||
* {{Cite journal|last=Seeman|first=Nadrian C.|date=9 June 2010|title=Structural DNA nanotechnology: growing along with Nano Letters|journal=Nano Letters|volume=10|issue=6|pages=1971–1978|bibcode=2010NanoL..10.1971S| |
* {{Cite journal|last=Seeman|first=Nadrian C.|date=9 June 2010|title=Structural DNA nanotechnology: growing along with Nano Letters|journal=Nano Letters|volume=10|issue=6|pages=1971–1978|bibcode=2010NanoL..10.1971S|doi=10.1021/nl101262u|pmid=20486672|pmc=2901229}}— 2001–2010年の期間に報告された研究結果の総説。 |
||
* {{Cite journal|last=Seeman|first=Nadrian C.|year=2010|title=Nanomaterials based on DNA|journal=Annual Review of Biochemistry|volume=79|pages=65–87| |
* {{Cite journal|last=Seeman|first=Nadrian C.|year=2010|title=Nanomaterials based on DNA|journal=Annual Review of Biochemistry|volume=79|pages=65–87|doi=10.1146/annurev-biochem-060308-102244|pmid=20222824|pmc=3454582}}—古今の研究を紹介する包括的な総説。 |
||
* {{Cite journal|last=Service|first=Robert F.|date=3 June 2011|title=DNA nanotechnology grows up|journal=Science|volume=332|issue=6034|pages=1140–1143| |
* {{Cite journal|last=Service|first=Robert F.|date=3 June 2011|title=DNA nanotechnology grows up|journal=Science|volume=332|issue=6034|pages=1140–1143|doi=10.1126/science.332.6034.1140|pmid=21636754}}.—分野の歴史と応用展開を中心とするニュース記事。 |
||
* {{Cite journal|last=Zadegan|first=Reza M.|last2=Norton|first2=Michael L.|date=June 2012|title=Structural DNA Nanotechnology: From Design to Applications|journal=Int. J. Mol. Sci.|volume=13|issue=6|pages=7149–7162| |
* {{Cite journal|last=Zadegan|first=Reza M.|last2=Norton|first2=Michael L.|date=June 2012|title=Structural DNA Nanotechnology: From Design to Applications|journal=Int. J. Mol. Sci.|volume=13|issue=6|pages=7149–7162|doi=10.3390/ijms13067149|pmid=22837684|pmc=3397516}}—近年の包括的な総説。 |
||
* {{Cite journal|和書|author=村田智 他|title=【連載】DNAナノテクノロジー ― 構造を作り,計算し,ナノロボットを動かす|journal=現代化学|issue=541-549|date=2016年4月―12月}}—初心者向けの解説記事。 |
* {{Cite journal|和書|author=村田智 他|title=【連載】DNAナノテクノロジー ― 構造を作り,計算し,ナノロボットを動かす|journal=現代化学|issue=541-549|date=2016年4月―12月}}—初心者向けの解説記事。 |
||
'''分野ごとの文献:''' |
'''分野ごとの文献:''' |
||
* {{Cite journal|last=Bath|first=Jonathan|last2=Turberfield|first2=Andrew J.|date=5 May 2007|title=DNA nanomachines|journal=Nature Nanotechnology|volume=2|issue=5|pages=275–284|bibcode=2007NatNa...2..275B| |
* {{Cite journal|last=Bath|first=Jonathan|last2=Turberfield|first2=Andrew J.|date=5 May 2007|title=DNA nanomachines|journal=Nature Nanotechnology|volume=2|issue=5|pages=275–284|bibcode=2007NatNa...2..275B|doi=10.1038/nnano.2007.104|pmid=18654284}}—核酸ナノメカニカル素子のレビュー論文。 |
||
* {{Cite journal|last=Feldkamp|first=Udo|last2=Niemeyer|first2=Christof M.|date=13 March 2006|title=Rational design of DNA nanoarchitectures|journal=Angewandte Chemie International Edition|volume=45|issue=12|pages=1856–76| |
* {{Cite journal|last=Feldkamp|first=Udo|last2=Niemeyer|first2=Christof M.|date=13 March 2006|title=Rational design of DNA nanoarchitectures|journal=Angewandte Chemie International Edition|volume=45|issue=12|pages=1856–76|doi=10.1002/anie.200502358|pmid=16470892}}—二次的な構造デザインの観点から書かれた総説。 |
||
* {{Cite journal|last=Lin|first=Chenxiang|last2=Liu|first2=Yan|last3=Rinker|first3=Sherri|last4=Yan|first4=Hao|date=11 August 2006|title=DNA tile based self-assembly: building complex nanoarchitectures|journal=ChemPhysChem|volume=7|issue=8|pages=1641–1647| |
* {{Cite journal|last=Lin|first=Chenxiang|last2=Liu|first2=Yan|last3=Rinker|first3=Sherri|last4=Yan|first4=Hao|date=11 August 2006|title=DNA tile based self-assembly: building complex nanoarchitectures|journal=ChemPhysChem|volume=7|issue=8|pages=1641–1647|doi=10.1002/cphc.200600260|pmid=16832805}}—タイルベースのアセンブリに注目した短いレビュー。 |
||
* {{Cite journal|last=Zhang|first=David Yu|last2=Seelig|first2=Georg|date=February 2011|title=Dynamic DNA nanotechnology using strand-displacement reactions|journal=Nature Chemistry|volume=3|issue=2|pages=103–113|bibcode=2011NatCh...3..103Z| |
* {{Cite journal|last=Zhang|first=David Yu|last2=Seelig|first2=Georg|date=February 2011|title=Dynamic DNA nanotechnology using strand-displacement reactions|journal=Nature Chemistry|volume=3|issue=2|pages=103–113|bibcode=2011NatCh...3..103Z|doi=10.1038/nchem.957|pmid=21258382}}—鎖置換機構を利用したDNA系のレビュー。 |
||
== 外部リンク == |
== 外部リンク == |
||
2020年1月25日 (土) 18:44時点における版
DNAナノテクノロジー(英: DNA nanotechnology)とは、有用な核酸構造を人工的に設計・作製する技術をいう。DNAの名が冠されているが、他の種類の核酸も用いられるため「核酸ナノテクノロジー」という別名がある。この分野では核酸を生細胞の遺伝情報キャリアとしてではなく、非生物学的なナノ材料として用いる。これまでの研究で、DNAを用いた2次元・3次元の結晶格子やナノチューブ、多面体、さらに任意形状の静的構造が作製されており、分子機械やDNAコンピューターのような機能デバイスも得られている。X線構造解析や核磁気共鳴スペクトロスコピーによるタンパク質の構造同定など、構造生物学や生物物理学における基礎的な問題を解決するツールとしても用いられ始めた。将来的な分子スケールエレクトロニクスやナノ医療への応用も研究されている。
DNAナノテクノロジーの概念的基盤は1980年代初頭にネイドリアン・シーマンによって築かれた。広く関心を集め始めたのは2000年代半ば以降である。核酸を用いる利点は、核酸鎖のうち互いに相補的な塩基配列を持つ部分だけが結合して強固な二重らせん構造を形成するという厳しい塩基対合則の存在である。この規則を利用して合理的な塩基配列デザインを行えば、ナノスケールの精密なパーツが自然に組みあがって複雑な標的構造を形成することが可能になる。構造のアセンブル方式としては、より小さな構造(DNAタイル)をアセンブルさせるタイルベース構造や、核酸の折りたたみによって望みの形状を得るDNAオリガミ法、鎖置換法によって動的な再配置を行う方式などがある。
基本的なコンセプト
核酸の特性
ナノテクノロジーは多くの場合、100ナノメートルスケールより小さい構造を持つ材料や素子を研究する分野と定義される。その中でもDNAナノテクノロジーは、分子部品が自発的に組織化して安定構造を作るボトムアップ型自己集合プロセスの一例である。この種の構造では、設計者が選んだ部品の物理的・化学的特性が元になって特定の形状が発現する[2]。DNAナノテクノロジーで部品となるのはDNAなどの核酸鎖である。核酸鎖は多くの場合人工的に合成され、ほとんどのケースで生細胞内の役割とは関係のないところで使用される。DNAがナノスケール構造の作製に適している理由は、核酸鎖間の結合が既知の単純な塩基対合則に従っており、それによって特有の二重らせん型ナノ構造を形成する点である。この性質を利用すれば、核酸鎖の設計を通じて構造のアセンブリを制御することが容易になる。他のナノテクノロジー材料はこのような特性を持たない。たとえばタンパク質は構成要素であるアミノ酸の種類が多く設計が非常に困難であり[3]、ナノ粒子は自ら特定のアセンブリを行う能力がない[4]。
核酸分子はヌクレオチドの配列からなり、ヌクレオチドはそれに含まれる核酸塩基によって区別される。DNAのヌクレオチドにはアデニン (A)、シトシン (C)、グアニン (G)、チミン (T) の四種の塩基が含まれる。核酸分子どうしが結合して二重らせんを構成するのは、それらの塩基配列が相補的である場合のみである。すなわち、出来上がった二重らせんはA-TおよびC-Gという二種類の塩基対の配列にならなければならない[4][5]。塩基が正しく対合するとエネルギー的に有利であるため、ほとんどのケースでは核酸鎖どうしが正しい塩基対の数が最大になるような立体配座で結合すると予想される。このように核酸鎖系で結合パターンと全体構造を決定するのは塩基配列であり、それを利用すれば容易に制御が行える。DNAナノテクノロジーの研究者は、塩基対形成作用によって望ましい立体配座がアセンブルされるように、核酸鎖の塩基配列を合理的に設計する[4][6]。用いられる分子はDNAが主流だが、RNAやペプチド核酸 (PNA) など他の核酸分子を組み込んだ構造も作製されている[7][8]。
下位分野

構造DNAナノテクノロジーと動的DNAナノテクノロジーという二つの下位分野に分けられる場合がある(これらには重複する部分もある)。構造DNAナノテクノロジーの対象は、静的な平衡形へアセンブリを行う核酸複合体の合成や分析である。動的DNAナノテクノロジーが対象とするのは、化学的・物理的刺激に応じて再配列を行う機能など、有用な非平衡的挙動を持つ複合体である。核酸ナノメカニカル素子のようにこれら二分野の特色を併せ持つ複合体もある[10][11]。
構造DNAナノテクノロジーで構築される複合体はトポロジカルに分岐した核酸構造を取っており、複数のジャンクション部を持つ(生物学的なDNAはそれと対照的に分岐を持たない二重らせん構造を取るのがほとんどである)。最も単純な分岐構造には、相補的パターンを持つ部分どうしで結合したDNA鎖4本からなる4アーム・ジャンクションがある(右図上)。似た形態を持つ天然のホリデイ・ジャンクションとは異なり、人工的な固定4アーム・ジャンクションはそれぞれのアームが異なる塩基配列を持っており、ジャンクション位置は特定の場所からずれることができない。一つの複合体が複数のジャンクションを持つこともある。例えば広く用いられているダブルクロスオーバー (DX) モチーフでは(右図下)、二つの平行な二重らせんドメインが二つのジャンクションで結合しており、それらのジャンクションは核酸鎖が交差するクロスオーバー点となっている。DXモチーフのクロスオーバー点はトポロジー的に4アーム・ジャンクションと同一だが、独立した4アーム・ジャンクションが柔軟性を持つのとは異なり、4本のアームが一つの軸に揃えられていて自由に動かすことができない。これにより、DXモチーフは堅固なブロックとして大きなDNA複合体を組み上げられるようになる[6][4]。
動的DNAナノテクノロジーでは、トーホールド配列を介した鎖置換と呼ばれるメカニズムを利用して、新しい核酸鎖を追加することで核酸複合体に再配列を行わせる。この反応では、新たな核酸鎖は二本鎖複合体の端に設けられた一本鎖領域(「トーホールド(足がかり)」と呼ばれる)と結合し、さらに分岐移動プロセスによって元の複合体に含まれる鎖の1つと入れ替わる。これで全体としては、元の複合体の核酸鎖の1つが新たに加えた鎖と置換されたことになる[10]。再配列を行える構造や素子を作る別の方法としては、化学反応を引き起こすデオキシリボザイムやリボザイム、あるいは特定のタンパク質や低分子と選択的に結合できるアプタマーのような機能性核酸を用いるものがある[12]。
構造DNAナノテクノロジー
構造DNAナノテクノロジーでは、静的な平衡形を作るための部品となる核酸複合体などの物質の合成と分析が中心となる。核酸の二重らせん構造は確定したロバストな3次元形状を持つため、より複雑な核酸複合体の構造を予測したり設計したりすることが可能になる。実際に、2次元や3次元の構造、もしくは周期的、非周期的、離散的な構造など、多くの複合体構造が作製されている[11]。
拡張格子

小さい核酸複合体に粘着末端を持たせて互いに結合させると、分子をタイルとした充填パターンを持つ大きな2次元周期格子が得られる[11]。この種の構造で最初のものは基本タイルとしてDX複合体を使用していた。DX複合体が持つ四つの粘着末端の塩基配列をデザインすることで、複合体がユニットとなって周期的に配列し、剛性を持つ2次元DNA結晶とみなせる平坦な2次元シートを構成する仕組みだった(右図上)[16][17]。ほかのモチーフを用いた2次元配列も作製されており、ホリデイ・ジャンクション菱形格子や[18]、double-cohesionスキームによる様々なDXベースアレイなどがある[19][20]。右に示す画像の上から2つはタイルベース周期格子の例を示している。
2次元アレイには、そのアセンブリがある種のアルゴリズムを内包するような非周期構造を取らせることも可能である。これはDNAコンピューティングの1つの形である[21]。粘着末端の塩基配列の選び方によっては、DX複合体はワンのタイルとなって演算処理を行えるようになる。実際に、DXアレイのアセンブリにXOR演算をエンコードすることでDNAアレイをセル・オートマトンとし、シェルピンスキーのギャスケットと呼ばれるフラクタル構造を生成させた例がある(右図上から3番目)[15]。ほかにも、DNAアレイの構造を2進数と対応させ、アレイの成長とともに数が増加していくバイナリカウンタシステムを作った例がある。これらの結果はDNAアレイのアセンブリに計算処理が組み込めることを実証している[22]。
DXアレイから中空のナノチューブを形成することも行われている。チューブの直径は4–20 nmで、2次元格子が反って丸まったものとみられる[23]。サイズと形状はカーボンナノチューブ (CNT) に近い。DNAナノチューブはCNTのように電気伝導性は持たない代わりに、構造を変更したり他の構造と連結することが容易である。DNAナノチューブの作製スキームはいくつもあり、曲率を持つDXタイルに格子を組ませて丸まったチューブを作る方法はその一つである[24]。輪を描いた一本鎖をタイルとすることでチューブの周長を固定する方法もあり、そこではチューブの剛性は創発的に生じる[25]。
DNAによって3次元格子を作ることはDNAナノテクノロジーの初期から目標とされてきたが、実現は非常に難しかった。2009年になってようやく、張力と圧縮力をバランスさせるテンセグリティの概念に基づくモチーフによって実現されたことが報告された[21][26]。
離散構造
一つ一つが多面体と同じ連結性を持つ3次元複合体をDNAから合成できることも実証されている。そこではDNA二重鎖が多面体の辺となり、DNAジャンクションが頂点となる。多面体の種類は立方体や八面体など数多い[27]。初期の例では、複数のライゲーションと固相合成ステップを繰り返して連環DNA多面体を作り出しており、大きな労力を要した[28]。研究が進むと合成がはるかに容易な多面体構造が作り出された。例としては、たった一本のDNA鎖が正しく折りたたまれて形成される八面体や[29]、4本のDNA鎖から1ステップで生成する四面体(記事冒頭の図に示されている)がある[1]。
不規則な任意形状のナノ構造を作る場合、通常はDNAオリガミ法が用いられる。「スキャフォールド(足場)」と呼ばれる天然の長い一本鎖ウィルスDNAを、コンピュータで設計された多数の短い「ステープル(かすがい)」鎖によって折りたたんで望みの形状を作り出す方法である。その利点は、塩基配列が足場鎖によって事前に決定されており、ほかのほとんどのDNAナノテクノロジー技術と違って核酸鎖の純度や化学量論性を高く保つ必要がないため、設計が容易だというところにある。DNAオリガミ法はまず2次元形状で実証された。最初に作られた形状にはスマイリーフェイスや西半球の略地図、モナリザの絵などがあった[27][30][31]。平行にした多くのDNA鎖をハニカム状に積み上げて堅固な3次元構造を作成したり[32]、2次元面構造を折りたたんで段ボール箱のような中空の3次元的形状とすることもできる。箱状構造は刺激を受けると蓋が開いて分子貨物を露出ないし放出するようにプログラムできるため、プログラマブルな分子ケージとしての応用が見込まれる[33][34]。
テンプレートによるアセンブリ
核酸構造にはタンパク質、金属ナノ粒子、量子ドット、フラーレンなど核酸以外の分子(ヘテロエレメントとも呼ばれる)を組み込むこともでき、それにより核酸だけではできなかったような幅広い機能を持つ材料や素子を構築することが可能になる。核酸構造の自己アセンブリがテンプレートとなり、ホストしたナノ粒子をアセンブリさせるとともに位置や時には方位の制御を行う[27][35]。それらのスキームの多くでは共有付加スキームが取られ、化学的ハンドルとしてアミド基やチオール基を持つオリゴヌクレオチドがヘテロエレメントと結合する。共有結合スキームにより、DXアレイ上で金ナノ粒子を配列させたり[36]ストレプトアビジンタンパク質分子に特定のパターンを取らせることが行われている[37]。ストレプトアビジンの配列はDXアレイ上のダーバン型ポリアミドを利用した非共有型のホスティングによっても行われている[38]。DNAアレイへのホスティングによってカーボンナノチューブのアセンブリを行い、分子エレクトロニクス素子(CNT電界効果型トランジスタ)として機能するようなパターンを取らせた研究もある[39]。そのほか、最初の核酸構造の形を保ったまま金属で核酸を置換する核酸金属化法や[40]、核酸ナノ構造をフォトリソグラフィのマスクとして利用してパターンを固体表面に転写するスキームがある[41]。
動的DNAナノテクノロジー
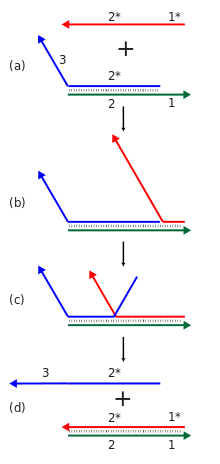
動的DNAナノテクノロジーで中心となるのは、計算や機械的運動など、所定の動的機能を発現させるような全体構造を持つ核酸系の構築である。アニーリングから動的な再配列を行うことで構造を得たり、最初から動的に構造形成を行うこともできるため、構造的DNAナノテクノロジーと重なる部分がある[27][42]。
ナノメカニカル素子
ナノロボットの一つの形として、何らかの刺激によって立体配座を変化させるDNA複合体が作製されている。作製には構造的DNAナノテクノロジーにおいて静的構造を作るのと同様な方法がとられるが、アセンブリ後に動的な再配列が可能なように設計される[10][42]。この種の素子で最初のものはB-DNA(右巻き)とZ-DNA(左巻き)の間の遷移を利用しており、バッファー条件の変化に応じてねじれ運動を行った[43]。バッファー条件をトリガーとする系ではすべての素子が同時に状態変化を起こしたが、後には制御ストランドが状態変化を起こさせるような系を用いて溶液中の各素子を独立して操作できるようになった。その例としては、開状態と閉状態を持つ「分子ピンセット」の仕組みや[44]、パラネミック・クロスオーバー配位 (PX) とダブルジャンクション配位 (JX2) とを切り替えることで回転運動を生じる素子[45]、制御ストランドと出会うと動的に伸縮を行う2次元アレイがある[46]。動的に開閉を行えるケージ構造も作られており、機能性分子貨物を自在に露出ないし放出させる分子ケージとして期待されている[33][47][48]。
DNAウォーカーは一次元的なトラックに沿って指向性運動を行う核酸ナノマシンの一種であり、多くのスキームが確立されている[42]。たとえば一連の順番で制御ストランドを添加することでトラックに沿って一歩ずつウォーカーを動かす戦略がある[49][50]。別のアプローチとして、制限酵素またはデオキシリボザイムを備えたウォーカーがトラックの核酸鎖を切断しながら一方向に進む自律的なシステムもある[51][52]。後には一次元的なトラックの代わりに2次元面を歩きながら分子貨物を選択的に拾い上げて運ぶウォーカーも実現された[53]。また、トラックに沿って進みながらDNAテンプレート合成を行うことで自律的に多段階化学合成を進める一次元ウォーカーも実現している[54]。化学合成DNAウォーカーの機能は天然のタンパク質ダイニンとキネシンに通じる[55]。
鎖置換カスケード
鎖置換反応のカスケードを利用して計算や構造形成を行うことができる。何らかのイニシエーター鎖への応答として新しい配列が露出するのが一つの鎖置換反応である。多数の反応をつなげることで、ある反応で露出した配列が次の反応のイニシエーターとなるような生化学カスケードを構築できる。さらにそれを組み合わせて、多数の要素からなる化学反応ネットワークを構築すれば複雑な計算や情報処理を行わせられる。カスケード反応は新しい塩基対の形成によるエネルギー利得と分解反応によるエントロピー増大によりエネルギー的に有利となる。鎖置換カスケードを用いれば等温操作によってアセンブリや計算プロセスを行うことが可能で、従来の核酸アセンブリにおいて加熱後にゆっくり冷却することで目的の構造を形成させる熱的アニーリングステップが必要だったとは対照的である。また鎖置換カスケードのイニシエーター種に触媒機能を持たせて、1当量未満のイニシエーターによって反応を一方向に進めることもできる[10][56]。
鎖置換複合体からは複雑な計算を行う分子論理ゲートを作成することができる[57]。電流によって入出力を行う従来の電子計算機とは異なり、分子コンピュータは特定の化学種の濃度を信号とする。核酸鎖置換回路では、置換複合体上のほかの鎖と結合して消費されたり、また切断されて出現したりする核酸鎖の存在が信号となる。このアプローチによってAND、OR、NOTゲートのような論理ゲートが作製されている[58]。より近年では、130本のDNA鎖からなるゲート系によって0〜15の整数の平方根を計算できる4ビット回路が構成されている[59]。

鎖置換カスケードを動的な構造アセンブリに用いた例もある。そこでは反応体としてヘアピン構造を用いており、入力鎖が結合したときに鎖が切り離されるのではなく、ヘアピンが開くことによって配列が新しく露出するようになっている。開いたヘアピンは成長中の複合体に追加される。このアプローチからは3~4アームのジャンクションやデンドリマーのような単純な構造が作製されている[56]。
応用
DNAナノテクノロジーは、正確に制御されたナノスケールの構成部品を持つ複雑な構造を設計・構築する数少ない方法の1つである。構造生物学と生物物理学では基礎的な問題を解決するためにDNAナノテクノロジーが応用され始めている。最初に考えられたのは結晶学への応用で、単独では結晶化が困難な分子を3次元核酸格子内に周期配置することで構造同定を行うというものだったが、現在でも研究が進められている。ほかにも、タンパク質NMR分光で残留双極子カップリングを測定する際に液晶の代わりとしてDNAオリガミロッドを使用することがある。DNAオリガミロッドは膜タンパク質を液中に分散させるのに必要な界面活性剤に耐性がある点で液晶より優れている。DNAウォーカーはナノ粒子を運んで化学合成を進めるナノスケールの組み立てラインとして応用されている。さらに、酵素の機能やタンパク質の折りたたみに関する生物物理学的な研究でもDNAオリガミ構造が役立てられている[11][60]。
DNAナノテクノロジーは将来の実用的な応用に向けて発展を続けている。核酸アレイには他の分子を配列させる能力があるため分子スケールエレクトロニクスへの応用が期待される。核酸構造のアセンブリをテンプレートとして分子ワイヤのような分子エレクトロニクス素子のアセンブリを行えば、ブレッドボードに相当する分子素子のアーキテクチャやチップ上の配置をナノメートルの精度で制御できるようになる[11][27]。DNAナノテクノロジーは計算処理を物質の特性と結び付けた点でプログラマブルマターの概念と比べられてきた[61]。
オーフス大学iNANOセンターおよびCDNAセンターで行われた研究で、複数回のスイッチングが可能な3次元ボックス構造がDNAオリガミによって構築された。その性質は原子間力顕微鏡 (AFM)、透過型電子顕微鏡 (TEM)、および蛍光共鳴エネルギー移動 (FRET) によって確かめられた。このボックスは蓋を閉じ直す独自の機構を備えており、決められたDNAもしくはRNAの組を鍵として何度も開閉を行うことができる。この研究の著者は「DNAデバイスには、単一分子の機能制御、ドラッグデリバリー制御、分子計算など幅広い応用が考えられる」と主張した[62]。
ナノ医療においても、生体適合性のあるDNAナノテクノロジーの計算方式を利用して標的化ドラッグデリバリー用の「スマートドラッグ」を作成できる可能性がある。研究中のシステムには、アポトーシス(細胞死)を誘導するタンパク質を中空のDNAボックスに入れて運び、癌細胞の近傍で放出するというものがある[60][63]。またこのような人工的な構造を生きた細菌の細胞中で発現させることにも関心が寄せられている。そのアセンブリには転写産物RNAが利用できると見られているが、細胞質中で複雑な構造を効率的に折りたたんだりアセンブリしたりできるかは分かっていない。これが成功すれば、核酸ナノ構造に定向進化を行わせることができるようになる[27]。オックスフォード大学の研究者は、短い合成DNA鎖4本が自己集積したケージ構造が細胞に侵入したまま少なくとも48時間生存したと報告した。蛍光標識されたDNA四面体ケージは、実験室で培養されたヒト腎細胞の中で細胞酵素による攻撃を受けながらも2日後まで損傷しなかった。この実験によりDNAケージによる生細胞中でのドラッグデリバリーの可能性が示された[64][65]。DNA四面体を用いてマウスモデルにRNA干渉 (RNAi) を起こせることもMITのチームによって報告されている。ポリマーや脂質によって干渉RNAをデリバリーする治療法はすでにある程度の成功を収めていたが、血流中での寿命が短く、安全性や送達の正確性にも課題があった。MITで作成されたDNAナノ構造は、6本のDNA鎖が四面体を形成し、それぞれの辺に1本のRNA鎖を付与する構造だった。四面体にはそのほか標的化のために葉酸分子が3つ付与されており、いくつかの腫瘍で豊富に見られる葉酸受容体にナノ粒子を誘導する仕組みになっていた。その結果、RNAiの標的であったルシフェラーゼの遺伝子発現が半分以下に低下することが示された。この研究により、DNAナノテクノロジーが新しいRNA干渉技術を通して有効な治療ツールを生み出しうる見通しが高まった[66][67]。DNA四面体構造を用いて多剤耐性現象を克服しようとする試みもある。P糖タンパク質による薬物排出ポンプ機能を有するMCF-7乳がん細胞に対し、四面体と複合させたドキソルビシン (DOX) を負荷した結果、DOXが排出されずにがん細胞のアポトーシスが達成された。生態適合性をテストするため、DOXを含まない四面体を細胞に負荷したところ、四面体自身は細胞毒性を示さなかった[68]。
DNAナノテクノロジーの医療応用としては、天然の膜タンパク質の構造と機能を模倣するように設計されたDNAナノ構造も注目されている。2012年、ランゲッカーら[69]は、茎状のDNAオリガミ構造が疎水性コレステロール修飾を利用して脂質膜に自己挿入し、膜を通してイオン電流を流す細孔として機能したと発表した。これは最初に実現された合成DNAイオンチャネルであり、後には単一のDNA二重鎖や[70]、小さいタイルベース構造[71][72][73][74][75]、あるいはDNAオリガミによる大きな膜貫通ポリンなど、多くの方式で細孔が作られた[76]。天然のタンパク質イオンチャネルと同じように、多様な設計が可能な合成DNAチャネルはコンダクタンスに数桁の幅を持たせることができる。単一のDNA二重鎖によって脂質二重層にイオンチャネルを形成する研究では、DNA鎖自体には内腔が存在せず、イオン電流はDNAと脂質の界面を流れる。このチャネルの周辺で脂質頭基はDNAの方を向くため、細孔形状は単純な円筒ではなくトロイダル型となっている[70]。ケンブリッジ大とイリノイ大アーバナ・シャンペーン校の研究者は、そのようなDNA誘導トロイダル孔が脂質二重層の層間で脂質の高速な反転を引き起こすことを示した。この効果を利用して、スクランブラーゼと呼ばれる天然タンパク質よりも桁違いに大きい速度で生体膜の脂質を反転させる合成DNA製酵素が設計されている[77]。この研究は合成DNAナノ構造によるパーソナルドラッグや個別化治療法の可能性を指し示している。
設計
DNAナノ構造は個々の核酸鎖が集合して目的の構造を作るように合理的に設計する必要がある。通常、まずは標的とする三次構造または機能を特定しなければならない。次に、標的複合体全体の二次構造が決められる。すなわち核酸鎖の配置と、それぞれの鎖のどの部分を互いに結合するかを特定する。最後のステップは一次構造の設計、つまり核酸鎖の具体的な塩基配列の決定である[23][78]。
構造設計
核酸ナノ構造を設計する最初のステップは、与えられた構造をどうやって核酸鎖の配列として表すかを決めることである。このステップでは求める形状の中で鎖をつなぐ塩基対の位置(二次構造)が決められる[23]。これまでに複数のアプローチが確立されている。
- タイルベースの構造
- このアプローチではターゲット構造を小さなユニットに分割する。それぞれのユニットに含まれる鎖どうしは強く結合しているが、ユニット間の相互作用はそれより弱い。周期格子の作製に用いられることが多いが、アルゴリズミック・セルフアセンブリにも応用できるためDNAコンピューティングのプラットフォームになりうる。1990年代半ばから2000年代半ばまで主要な戦略だったが、DNAオリガミの方法論が発展するとその地位を失った[23][79]。
- 折りたたみ構造
- タイルベースのアプローチに代わるもので、1本の長い鎖を折りたたんでナノ構造を作る。長い鎖の各部が互いに結合するように設計することで折り畳みを行うか、あるいは短い「ステープル」鎖が留め金の役割を果たす。後者の方法はDNAオリガミと呼ばれており、2次元・3次元のナノスケール形状を作製することができる(離散構造節参照)[27][30]。
- 動的アセンブリ
- 最終的な生成物だけでなく、反応機構の中間ステップすべてを設計することでDNAセルフアセンブリの動力学を直接制御するアプローチ。ヘアピン構造を持つ出発物質が決まった順序でカスケード反応を起こして最終的な配座にアセンブルする(鎖置換カスケード節参照)。このアプローチには一定温度で等温的に進行する利点があり、アセンブリをトリガーして正しく構造形成を行うために高温の熱アニーリングステップを必要とする熱力学的アプローチとは対照的である[27][56]。
塩基配列の設計
いずれかのアプローチによって標的複合体の二次構造を設計した後は、それを実現する具体的なヌクレオチド配列を考えなければならない。構成鎖が結合して求める立体配座となるように鎖に対して核酸塩基配列を割り当るプロセスが核酸設計である。配列の設計では、標的構造がエネルギー的に最低で熱力学的に最も有利になり、アセンブルに誤りが生じた場合はエネルギーが高く不利になることを狙うのがほとんどである。実際に設計を行うには、sequence symmetry minimization 法などの単純で高速な発見的手法のほか、計算量が多く時間がかかるが正確な方法として、最近接塩基対の熱力学的モデル(Nearest-neighbor法)を正面から扱うやり方がある。幾何学的モデルを用いてナノ構造の三次構造を検査し、複合体に過度のひずみが生じていないか確かめることもある[78][80]。
核酸設計の戦略はタンパク質の設計と似ている。いずれの場合も、求める標的構造が有利となり、ほかの構造が不利となるようにモノマー配列の設計が行われる。核酸設計では構造のエネルギー的な有利不利を予測するには単純な塩基対合則だけを考慮すれば十分であり、構造全体の3次元的な折りたたみについての細かい情報は不要であるため、計算の容易さという点でタンパク質の設計に勝っている。このため単純な発見的手法を用いてロバストなデザインを実験的に得ることが可能になる。ただし核酸構造はタンパク質と比べて機能の多様性では劣る。タンパク質は折りたたみによって複雑な構造を作る能力が高く、また核酸が4種のヌクレオチドのみからなり化学的な多様性が低いのに対してタンパク質では20種のタンパク質構成アミノ酸を用いることができる[80]。
作製方法
ターゲット構造を作るためのDNA鎖の配列設計は分子モデリングおよび熱力学モデリングソフトウェアによってコンピュータ上で行われる[78][80]。次に、標準的なオリゴヌクレオチド合成法によって核酸そのものを合成する。このステップは自動化された合成装置によるのが普通である。特定用途向けに配列された核酸鎖は市販もされている[81]。必要に応じて変性ゲル電気泳動によって核酸鎖の精製を行い[82]、さらに紫外線吸収分光法を用いた核酸定量法によって濃度を正確に決定する[83]。
標的構造が完成したかどうかは非変性ゲル電気泳動で検証できる。この方法からは核酸複合体のサイズと形状に関する情報が得られる。ゲルシフトアッセイを行えば構造に必要な鎖がすべて組み込まれたかを評価できる[84]。蛍光標識とフェルスター共鳴エネルギー移動 (FRET) による構造評価も行われることがある[85]。
核酸構造を直接観察するには原子間力顕微鏡があり、これは拡張2次元格子には有効だが、離散3次元構造では核酸構造が脆く探針から影響を受けるため適していない。その場合、代わりに透過型電子顕微鏡と低温電子顕微鏡法が用いられることが多い。拡張3次元格子ではX線構造解析が行われる[86][87]。
歴史
| エッシャー作『深み』 (外部リンク) |
|---|
| ネイドリアン・シーマンはDNA3次元格子を利用して結晶化しにくい分子の配向を行うアイディアをエッシャーの木版画『深み』から得たという。DNAナノテクノロジーの分野はここから始まった。 |
DNAナノテクノロジーの概念的基盤は1980年代初頭にネイドリアン・シーマンによって築かれた[88]。シーマンの元々の動機は3次元DNA格子を利用して大分子の配向を行うことだった。これにより、大分子から高純度の結晶を作る困難なプロセスが省かれて結晶構造解析が容易になるはずだった。シーマンは1980年の末に、M・C・エッシャーによる木版画『深み』がDNAの6アーム・ジャンクション・アレイと似ていると気づいたことからこのアイディアを得たという[6][89]。そのころすでにDNA複製フォークや可動ホリディ・ジャンクションなど天然のDNA分岐構造はいくつか知られていたが、シーマンは先見の明を発揮させて、構成分子の塩基配列を適切に設計して核酸ジャンクションの対称性を失わせればそれを固定化でき、さらに固定化したジャンクションを結合させて堅固な結晶格子を作ることが原理的に可能だと考えた。このスキームは1982年の理論的な論文で最初に提案され、翌年には固定DNAジャンクションが実験的に証明された[4][27]。
1991年、DNAを用いて立方体構造を作製したことがシーマンの研究室から報告された。これは初めて合成された3次元核酸ナノ構造であり、シーマンは1995年にナノテクノロジーに関する賞であるファインマン賞を受賞した。DNAによる切頂八面体も続いて報告された。しかし間もなく、柔軟なジャンクションを頂点に持つ多面体構造は拡張3次元格子を作れるほどの剛性を持たないことが明らかになった。シーマンは剛性の高いダブルクロスオーバー構造モチーフ (DX) を開発し、1998年にはエリック・ウィンフリーと共同でDXタイルからなる2次元格子の作製を報告した[6][88][90]。この種のタイルベース構造にはDNAコンピューティングの手段となりえる利点があり、ウィンフリーとポール・ロザムンドによる2004年の論文でそれが実証された。この研究はアルゴリズミック・セルフアセンブリによるシェルピンスキー・ギャスケット構造の形成に関するもので、2006年のファインマン賞を獲得した。ウィンフリーの慧眼は、DXタイルはワンのタイルとしても機能し、すなわちそのアセンブリによって計算を行えるという発想にあった[88]。3次元格子の合成は、シーマンが最初に志してから30年近く後の2009年になってようやく、彼自身によって報告された[60]。
2000年代を通じてDNA人工構造の新しい機能が発見され続けた。最初のDNAナノマシン(入力に応じて構造を変えるモチーフ)は1999年にシーマンによって実現した。翌年、バーナード・ユルケはより進んだシステムを作り出した。これは「トーホールド」を介して鎖置換を行う最初の核酸素子だった。次の進展は鎖置換を機械的な運動に変換することであり、2004年から2005年にかけて、シーマンやナイルズ・ピアース、アンドルー・ターバーフィールド、チェンデ・マオらがそれぞれ率いるグループによっていくつものDNAウォーカー系が作り出された[42]。ナノ粒子やタンパク質など他の分子をアセンブリさせるテンプレートとしてDNAアレイを用いるアイディアは、1987年にブリュッヘ・ロビンソンとシーマンによって最初に提案され[91]、2002年にシーマンとキール他が実証すると[92]、多くのグループが後に続いた。
2006年、ロザムンドはDNAオリガミ法によって任意の形状を持つ堅固なDNA折りたたみ構造が容易に作製できることを示した。ロザムンドはそのコンセプトを、多数の短い核酸鎖を用いるシーマンのDX格子と、主に一本の長い鎖からなるウィリアム・シーのDNA八面体の中間だと考えていた。ロザムンドのDNAオリガミは一本の長い鎖が多数の短い鎖の助けを借りて折りたたまれる仕組みだった。これにより、それまでの限界を超えた大きさの構造を形成することができるようになった上に、設計や合成にともなう技術的な困難が低減された[90]。『ネイチャー』誌2006年3月15日号ではDNAオリガミが表紙を飾った[30]。2次元のDNAオリガミ構造を実証したロザムンドの研究に続いて、2009年にはダグラスらによって密な3次元構造が[32]、Jørgen KjemsとYanの研究室では2次元面からなる中空の3次元構造が作り出された[60]。
DNAナノテクノロジーは当初のうち懐疑的な態度で迎えられることもあった。核酸を構造材料や計算処理のような非生物学的な用途に用いる発想が異例だったことや、分野の可能性を広げる一方で実際の応用には程遠い原理実証実験が多かったことがその理由である。シーマンが1991年に書いたDNA立方体の合成に関する論文は『サイエンス』誌からリジェクトされた。査読者の一人はその独創性を賞賛したが、別の査読者は生物学的な重要性に欠けるという批判を寄せた(その論文[93]は結局『ネイチャー』誌に掲載された)。2010年代に入ると、基礎科学への応用が現実的になるほど分野が発展したことが認められ、医療などの分野で実用的な応用が考えられ始めた[60][94]。2001年にはこの分野で活動する研究室はわずかしかなかったが、2010年には少なくとも60グループにまで拡大した。この10年間は人材が増えたこともあって分野の進歩も目覚ましいものがあった[21]。
関連項目
- International Society for Nanoscale Science, Computation, and Engineering
- 核酸のシミュレーションソフトウェアの比較
- DNAの分子モデル
- ナノバイオテクノロジー
脚注
- ^ a b DNA polyhedra: Goodman, Russel P.; Schaap, Iwan A. T.; Tardin, C. F.; Erben, Christof M.; Berry, Richard M.; Schmidt, C.F.; Turberfield, Andrew J. (9 December 2005). “Rapid chiral assembly of rigid DNA building blocks for molecular nanofabrication”. Science 310 (5754): 1661–1665. Bibcode: 2005Sci...310.1661G. doi:10.1126/science.1120367. PMID 16339440.
- ^ Background: Pelesko, John A. (2007). Self-assembly: the science of things that put themselves together. New York: Chapman & Hall/CRC. pp. 5, 7. ISBN 978-1-58488-687-7
- ^ 村田智「DNAナノテクノロジーへの招待」『現代化学』第541巻、2016年、47-51頁、NAID 40020759717。
- ^ a b c d e Overview: Seeman, Nadrian C. (2010). “Nanomaterials based on DNA”. Annual Review of Biochemistry 79: 65–87. doi:10.1146/annurev-biochem-060308-102244. PMC 3454582. PMID 20222824.
- ^ Background: Long, Eric C. (1996). “Fundamentals of nucleic acids”. In Hecht, Sidney M. Bioorganic chemistry: nucleic acids. New York: Oxford University Press. pp. 4–10. ISBN 978-0-19-508467-2
- ^ a b c d e Overview: Seeman, Nadrian C. (June 2004). “Nanotechnology and the double helix”. Scientific American 290 (6): 64–75. Bibcode: 2004SciAm.290f..64S. doi:10.1038/scientificamerican0604-64. PMID 15195395.
- ^ RNA nanotechnology: Chworos, Arkadiusz; Severcan, Isil; Koyfman, Alexey Y.; Weinkam, Patrick; Oroudjev, Emin; Hansma, Helen G.; Jaeger, Luc (2004). “Building Programmable Jigsaw Puzzles with RNA”. Science 306 (5704): 2068–2072. Bibcode: 2004Sci...306.2068C. doi:10.1126/science.1104686. PMID 15604402.
- ^ RNA nanotechnology: Guo, Peixuan (2010). “The Emerging Field of RNA Nanotechnology”. Nature Nanotechnology 5 (12): 833–842. Bibcode: 2010NatNa...5..833G. doi:10.1038/nnano.2010.231. PMC 3149862. PMID 21102465.
- ^ a b c Overview: Mao, Chengde (December 2004). “The emergence of complexity: lessons from DNA”. PLoS Biology 2 (12): 2036–2038. doi:10.1371/journal.pbio.0020431. PMC 535573. PMID 15597116.
- ^ a b c d Dynamic DNA nanotechnology: Zhang, D. Y.; Seelig, G. (February 2011). “Dynamic DNA nanotechnology using strand-displacement reactions”. Nature Chemistry 3 (2): 103–113. Bibcode: 2011NatCh...3..103Z. doi:10.1038/nchem.957. PMID 21258382.
- ^ a b c d e Structural DNA nanotechnology: Seeman, Nadrian C. (November 2007). “An overview of structural DNA nanotechnology”. Molecular Biotechnology 37 (3): 246–257. doi:10.1007/s12033-007-0059-4. PMC 3479651. PMID 17952671.
- ^ Dynamic DNA nanotechnology: Lu, Y.; Liu, J. (December 2006). “Functional DNA nanotechnology: Emerging applications of DNAzymes and aptamers”. Current Opinion in Biotechnology 17 (6): 580–588. doi:10.1016/j.copbio.2006.10.004. PMID 17056247.
- ^ Other arrays: Strong, Michael (March 2004). “Protein Nanomachines”. PLoS Biology 2 (3): e73. doi:10.1371/journal.pbio.0020073. PMC 368168. PMID 15024422.
- ^ Yan, H.; Park, S. H.; Finkelstein, G.; Reif, J. H.; Labean, T. H. (26 September 2003). “DNA-templated self-assembly of protein arrays and highly conductive nanowires”. Science 301 (5641): 1882–1884. Bibcode: 2003Sci...301.1882Y. doi:10.1126/science.1089389. PMID 14512621.
- ^ a b Algorithmic self-assembly: Rothemund, Paul W. K.; Papadakis, Nick; Winfree, Erik (December 2004). “Algorithmic self-assembly of DNA Sierpinski triangles”. PLoS Biology 2 (12): 2041–2053. doi:10.1371/journal.pbio.0020424. PMC 534809. PMID 15583715.
- ^ DX arrays: Winfree, Erik; Liu, Furong; Wenzler, Lisa A.; Seeman, Nadrian C. (6 August 1998). “Design and self-assembly of two-dimensional DNA crystals”. Nature 394 (6693): 529–544. Bibcode: 1998Natur.394..539W. doi:10.1038/28998. PMID 9707114.
- ^ DX arrays: Liu, Furong; Sha, Ruojie; Seeman, Nadrian C. (10 February 1999). “Modifying the surface features of two-dimensional DNA crystals”. Journal of the American Chemical Society 121 (5): 917–922. doi:10.1021/ja982824a.
- ^ Other arrays: Mao, Chengde; Sun, Weiqiong; Seeman, Nadrian C. (16 June 1999). “Designed two-dimensional DNA Holliday junction arrays visualized by atomic force microscopy”. Journal of the American Chemical Society 121 (23): 5437–5443. doi:10.1021/ja9900398.
- ^ Other arrays: Constantinou, Pamela E.; Wang, Tong; Kopatsch, Jens; Israel, Lisa B.; Zhang, Xiaoping; Ding, Baoquan; Sherman, William B.; Wang, Xing et al. (21 September 2006). “Double cohesion in structural DNA nanotechnology”. Organic and Biomolecular Chemistry 4 (18): 3414–3419. doi:10.1039/b605212f. PMC 3491902. PMID 17036134.
- ^ Other arrays: Mathieu, Frederick; Liao, Shiping; Kopatsch, Jens; Wang, Tong; Mao, Chengde; Seeman, Nadrian C. (April 2005). “Six-helix bundles designed from DNA”. Nano Letters 5 (4): 661–665. Bibcode: 2005NanoL...5..661M. doi:10.1021/nl050084f. PMC 3464188. PMID 15826105.
- ^ a b c History: Seeman, Nadrian (9 June 2010). “Structural DNA nanotechnology: growing along with Nano Letters”. Nano Letters 10 (6): 1971–1978. Bibcode: 2010NanoL..10.1971S. doi:10.1021/nl101262u. PMC 2901229. PMID 20486672.
- ^ Algorithmic self-assembly: Barish, Robert D.; Rothemund, Paul W. K.; Winfree, Erik (December 2005). “Two computational primitives for algorithmic self-assembly: copying and counting”. Nano Letters 5 (12): 2586–2592. Bibcode: 2005NanoL...5.2586B. doi:10.1021/nl052038l. PMID 16351220.
- ^ a b c d Design: Feldkamp, U.; Niemeyer, C. M. (13 March 2006). “Rational design of DNA nanoarchitectures”. Angewandte Chemie International Edition 45 (12): 1856–1876. doi:10.1002/anie.200502358. PMID 16470892.
- ^ DNA nanotubes: Rothemund, Paul W. K.; Ekani-Nkodo, Axel; Papadakis, Nick; Kumar, Ashish; Fygenson, Deborah Kuchnir; Winfree, Erik (22 December 2004). “Design and Characterization of Programmable DNA Nanotubes”. Journal of the American Chemical Society 126 (50): 16344–16352. doi:10.1021/ja044319l. PMID 15600335.
- ^ DNA nanotubes: Yin, P.; Hariadi, R. F.; Sahu, S.; Choi, H. M. T.; Park, S. H.; Labean, T. H.; Reif, J. H. (8 August 2008). “Programming DNA Tube Circumferences”. Science 321 (5890): 824–826. Bibcode: 2008Sci...321..824Y. doi:10.1126/science.1157312. PMID 18687961.
- ^ Three-dimensional arrays: Zheng, Jianping; Birktoft, Jens J.; Chen, Yi; Wang, Tong; Sha, Ruojie; Constantinou, Pamela E.; Ginell, Stephan L.; Mao, Chengde et al. (3 September 2009). “From molecular to macroscopic via the rational design of a self-assembled 3D DNA crystal”. Nature 461 (7260): 74–77. Bibcode: 2009Natur.461...74Z. doi:10.1038/nature08274. PMC 2764300. PMID 19727196.
- ^ a b c d e f g h i Overview: Pinheiro, A. V.; Han, D.; Shih, W. M.; Yan, H. (December 2011). “Challenges and opportunities for structural DNA nanotechnology”. Nature Nanotechnology 6 (12): 763–772. Bibcode: 2011NatNa...6..763P. doi:10.1038/nnano.2011.187. PMC 3334823. PMID 22056726.
- ^ DNA polyhedra: Zhang, Yuwen; Seeman, Nadrian C. (1 March 1994). “Construction of a DNA-truncated octahedron”. Journal of the American Chemical Society 116 (5): 1661–1669. doi:10.1021/ja00084a006.
- ^ DNA polyhedra: Shih, William M.; Quispe, Joel D.; Joyce, Gerald F. (12 February 2004). “A 1.7-kilobase single-stranded DNA that folds into a nanoscale octahedron”. Nature 427 (6975): 618–621. Bibcode: 2004Natur.427..618S. doi:10.1038/nature02307. PMID 14961116.
- ^ a b c DNA origami: Rothemund, Paul W. K. (16 March 2006). “Folding DNA to create nanoscale shapes and patterns”. Nature 440 (7082): 297–302. Bibcode: 2006Natur.440..297R. doi:10.1038/nature04586. PMID 16541064.
- ^ Tikhomirov, Grigory; Petersen, Philip; Qian, Lulu (December 2017). “Fractal assembly of micrometre-scale DNA origami arrays with arbitrary patterns”. Nature 552 (7683): 67–71. Bibcode: 2017Natur.552...67T. doi:10.1038/nature24655. ISSN 1476-4687. PMID 29219965.
- ^ a b DNA origami: Douglas, Shawn M.; Dietz, Hendrik; Liedl, Tim; Högberg, Björn; Graf, Franziska; Shih, William M. (21 May 2009). “Self-assembly of DNA into nanoscale three-dimensional shapes”. Nature 459 (7245): 414–418. Bibcode: 2009Natur.459..414D. doi:10.1038/nature08016. PMC 2688462. PMID 19458720.
- ^ a b DNA boxes: Andersen, Ebbe S.; Dong, Mingdong; Nielsen, Morten M.; Jahn, Kasper; Subramani, Ramesh; Mamdouh, Wael; Golas, Monika M.; Sander, Bjoern et al. (7 May 2009). “Self-assembly of a nanoscale DNA box with a controllable lid”. Nature 459 (7243): 73–76. Bibcode: 2009Natur.459...73A. doi:10.1038/nature07971. PMID 19424153.
- ^ DNA boxes: Ke, Yonggang; Sharma, Jaswinder; Liu, Minghui; Jahn, Kasper; Liu, Yan; Yan, Hao (10 June 2009). “Scaffolded DNA origami of a DNA tetrahedron molecular container”. Nano Letters 9 (6): 2445–2447. Bibcode: 2009NanoL...9.2445K. doi:10.1021/nl901165f. PMID 19419184.
- ^ Overview: Endo, M.; Sugiyama, H. (12 October 2009). “Chemical approaches to DNA nanotechnology”. ChemBioChem 10 (15): 2420–2443. doi:10.1002/cbic.200900286. PMID 19714700.
- ^ Nanoarchitecture: Zheng, Jiwen; Constantinou, Pamela E.; Micheel, Christine; Alivisatos, A. Paul; Kiehl, Richard A.; Seeman Nadrian C. (July 2006). “2D Nanoparticle Arrays Show the Organizational Power of Robust DNA Motifs”. Nano Letters 6 (7): 1502–1504. Bibcode: 2006NanoL...6.1502Z. doi:10.1021/nl060994c. PMC 3465979. PMID 16834438.
- ^ Nanoarchitecture: Park, Sung Ha; Pistol, Constantin; Ahn, Sang Jung; Reif, John H.; Lebeck, Alvin R.; Dwyer, Chris; LaBean, Thomas H. (October 2006). “Finite-size, fully addressable DNA tile lattices formed by hierarchical assembly procedures”. Angewandte Chemie 118 (40): 749–753. doi:10.1002/ange.200690141.
- ^ Nanoarchitecture: Cohen, Justin D.; Sadowski, John P.; Dervan, Peter B. (22 October 2007). “Addressing single molecules on DNA nanostructures”. Angewandte Chemie International Edition 46 (42): 7956–7959. doi:10.1002/anie.200702767. PMID 17763481.
- ^ Nanoarchitecture: Maune, Hareem T.; Han, Si-Ping; Barish, Robert D.; Bockrath, Marc; Goddard III, William A.; Rothemund, Paul W. K.; Winfree, Erik (January 2009). “Self-assembly of carbon nanotubes into two-dimensional geometries using DNA origami templates”. Nature Nanotechnology 5 (1): 61–66. Bibcode: 2010NatNa...5...61M. doi:10.1038/nnano.2009.311. PMID 19898497.
- ^ Nanoarchitecture: Liu, J.; Geng, Y.; Pound, E.; Gyawali, S.; Ashton, J. R.; Hickey, J.; Woolley, A. T.; Harb, J. N. (22 March 2011). “Metallization of branched DNA origami for nanoelectronic circuit fabrication”. ACS Nano 5 (3): 2240–2247. doi:10.1021/nn1035075. PMID 21323323.
- ^ Nanoarchitecture: Deng, Z.; Mao, C. (6 August 2004). “Molecular lithography with DNA nanostructures”. Angewandte Chemie International Edition 43 (31): 4068–4070. doi:10.1002/anie.200460257. PMID 15300697.
- ^ a b c d DNA machines: Bath, Jonathan; Turberfield, Andrew J. (May 2007). “DNA nanomachines”. Nature Nanotechnology 2 (5): 275–284. Bibcode: 2007NatNa...2..275B. doi:10.1038/nnano.2007.104. PMID 18654284.
- ^ DNA machines: Mao, Chengde; Sun, Weiqiong; Shen, Zhiyong; Seeman, Nadrian C. (14 January 1999). “A DNA nanomechanical device based on the B-Z transition”. Nature 397 (6715): 144–146. Bibcode: 1999Natur.397..144M. doi:10.1038/16437. PMID 9923675.
- ^ DNA machines: Yurke, Bernard; Turberfield, Andrew J.; Mills, Allen P., Jr; Simmel, Friedrich C.; Neumann, Jennifer L. (10 August 2000). “A DNA-fuelled molecular machine made of DNA”. Nature 406 (6796): 605–609. Bibcode: 2000Natur.406..605Y. doi:10.1038/35020524. PMID 10949296.
- ^ DNA machines: Yan, Hao; Zhang, Xiaoping; Shen, Zhiyong; Seeman, Nadrian C. (3 January 2002). “A robust DNA mechanical device controlled by hybridization topology”. Nature 415 (6867): 62–65. Bibcode: 2002Natur.415...62Y. doi:10.1038/415062a. PMID 11780115.
- ^ DNA machines: Feng, L.; Park, S. H.; Reif, J. H.; Yan, H. (22 September 2003). “A two-state DNA lattice switched by DNA nanoactuator”. Angewandte Chemie 115 (36): 4478–4482. doi:10.1002/ange.200351818.
- ^ DNA machines: Goodman, R. P.; Heilemann, M.; Doose, S. R.; Erben, C. M.; Kapanidis, A. N.; Turberfield, A. J. (February 2008). “Reconfigurable, braced, three-dimensional DNA nanostructures”. Nature Nanotechnology 3 (2): 93–96. Bibcode: 2008NatNa...3...93G. doi:10.1038/nnano.2008.3. PMID 18654468.
- ^ Applications: Douglas, Shawn M.; Bachelet, Ido; Church, George M. (17 February 2012). “A logic-gated nanorobot for targeted transport of molecular payloads”. Science 335 (6070): 831–834. Bibcode: 2012Sci...335..831D. doi:10.1126/science.1214081. PMID 22344439.
- ^ DNA walkers: Shin, Jong-Shik; Pierce, Niles A. (8 September 2004). “A synthetic DNA walker for molecular transport”. Journal of the American Chemical Society 126 (35): 10834–10835. doi:10.1021/ja047543j. PMID 15339155.
- ^ DNA walkers: Sherman, William B.; Seeman, Nadrian C. (July 2004). “A precisely controlled DNA biped walking device”. Nano Letters 4 (7): 1203–1207. Bibcode: 2004NanoL...4.1203S. doi:10.1021/nl049527q.
- ^ DNA walkers: Tian, Ye; He, Yu; Chen, Yi; Yin, Peng; Mao, Chengde (11 July 2005). “A DNAzyme that walks processively and autonomously along a one-dimensional track”. Angewandte Chemie 117 (28): 4429–4432. doi:10.1002/ange.200500703.
- ^ DNA walkers: Bath, Jonathan; Green, Simon J.; Turberfield, Andrew J. (11 July 2005). “A free-running DNA motor powered by a nicking enzyme”. Angewandte Chemie International Edition 44 (28): 4358–4361. doi:10.1002/anie.200501262. PMID 15959864.
- ^ Functional DNA walkers: Lund, Kyle; Manzo, Anthony J.; Dabby, Nadine; Michelotti, Nicole; Johnson-Buck, Alexander; Nangreave, Jeanette; Taylor, Steven; Pei, Renjun et al. (13 May 2010). “Molecular robots guided by prescriptive landscapes”. Nature 465 (7295): 206–210. Bibcode: 2010Natur.465..206L. doi:10.1038/nature09012. PMC 2907518. PMID 20463735.
- ^ Functional DNA walkers: He, Yu; Liu, David R. (November 2010). “Autonomous multistep organic synthesis in a single isothermal solution mediated by a DNA walker”. Nature Nanotechnology 5 (11): 778–782. Bibcode: 2010NatNa...5..778H. doi:10.1038/nnano.2010.190. PMC 2974042. PMID 20935654.
- ^ Pan, J; Li, F; Cha, TG; Chen, H; Choi, JH (2015). “Recent progress on DNA based walkers”. Current Opinion in Biotechnology 34: 56–64. doi:10.1016/j.copbio.2014.11.017. PMID 25498478.
- ^ a b c Kinetic assembly: Yin, Peng; Choi, Harry M. T.; Calvert, Colby R.; Pierce, Niles A. (17 January 2008). “Programming biomolecular self-assembly pathways”. Nature 451 (7176): 318–322. Bibcode: 2008Natur.451..318Y. doi:10.1038/nature06451. PMID 18202654.
- ^ Fuzzy and Boolean logic gates based on DNA: Zadegan, R. M.; Jepsen, M. D. E.; Hildebrandt, L. L.; Birkedal, V.; Kjems, J. R. (2015). “Construction of a Fuzzy and Boolean Logic Gates Based on DNA”. Small 11 (15): 1811–7. doi:10.1002/smll.201402755. PMID 25565140.
- ^ Strand displacement cascades: Seelig, G.; Soloveichik, D.; Zhang, D. Y.; Winfree, E. (8 December 2006). “Enzyme-free nucleic acid logic circuits”. Science 314 (5805): 1585–1588. Bibcode: 2006Sci...314.1585S. doi:10.1126/science.1132493. PMID 17158324.
- ^ Strand displacement cascades: Qian, Lulu; Winfree, Erik (3 June 2011). “Scaling up digital circuit computation with DNA strand displacement cascades”. Science 332 (6034): 1196–1201. Bibcode: 2011Sci...332.1196Q. doi:10.1126/science.1200520. PMID 21636773.
- ^ a b c d e History/applications: Service, Robert F. (3 June 2011). “DNA nanotechnology grows up”. Science 332 (6034): 1140–1143. doi:10.1126/science.332.6034.1140. PMID 21636754.
- ^ Applications: Rietman, Edward A. (2001). Molecular engineering of nanosystems. Springer. pp. 209–212. ISBN 978-0-387-98988-4 2011年4月17日閲覧。
- ^ M. Zadegan, Reza; et, al. (2012). “Construction of a 4 Zeptoliters Switchable 3D DNA Box Origami”. ACS Nano 6 (11): 10050–10053. doi:10.1021/nn303767b. PMID 23030709.
- ^ Applications: Jungmann, Ralf; Renner, Stephan; Simmel, Friedrich C. (March 2008). “From DNA nanotechnology to synthetic biology”. HFSP Journal 2 (2): 99–109. doi:10.2976/1.2896331. PMC 2645571. PMID 19404476.
- ^ Lovy, Howard (2011年7月5日). “DNA cages can unleash meds inside cells”. fiercedrugdelivery.com. 2013年9月22日閲覧。
- ^ Walsh, Anthony; Yin, Hai; Erben, Christoph; Wood, Matthew; Turberfield, Andrew (2011). “DNA Cage Delivery to Mammalian Cells”. ACS Nano 5 (7): 5427–5432. doi:10.1021/nn2005574. PMID 21696187.
- ^ Trafton, Anne (2012年6月4日). “Researchers achieve RNA interference, in a lighter package”. MIT News. 2013年9月22日閲覧。
- ^ Lee, Hyukjin; Lytton-Jean, Abigail; Chen, Yi; Love, Kevin; Park, Angela; Karagiannis, Emmanouil; Sehgal, Alfica; Querbes, William et al. (2012). “Molecularly self-assembled nucleic acid nanoparticles for targeted in vivo siRNA delivery”. Nature Nanotechnology 7 (6): 389–393. Bibcode: 2012NatNa...7..389L. doi:10.1038/NNANO.2012.73. PMC 3898745. PMID 22659608.
- ^ Kim, Kyoung-Ran; Kim, Da-Rae; Lee, Taemin; Yhee, Ji Young; Kim, Byeong-Su; Kwon, Ick Chan; Ahn, Dae-Ro (2013). “Drug delivery by a self-assembled DNA tetrahedron for overcoming drug resistance in breast cancer cells” (英語). Chemical Communications 49 (20): 2010–2. doi:10.1039/c3cc38693g. ISSN 1359-7345. PMID 23380739.
- ^ DNA ion channels: Langecker, M; Arnaut, V; Martin, TG; List, J; Renner, S; Mayer, M; Dietz, H; Simmel, FC (16 November 2012). “Synthetic lipid membrane channels formed by designed DNA nanostructures”. Science 338 (6109): 932–936. doi:10.1126/science.1225624. PMC 3716461. PMID 23161995.
- ^ a b DNA ion channels: Göpfrich, K; Li, CY; Mames, I; Bhamidimarri, SP; Ricci, M; Yoo, J; Mames, A; Ohmann, A et al. (13 July 2016). “Ion Channels Made from a Single Membrane-Spanning DNA Duplex”. Nano Letters 16 (7): 4665–4669. doi:10.1021/acs.nanolett.6b02039. PMC 4948918. PMID 27324157.
- ^ DNA ion channels: Burns, JR; Stulz, E; Howorka, S (12 June 2013). “Self-assembled DNA nanopores that span lipid bilayers”. Nano Letters 13 (6): 2351–2356. doi:10.1021/nl304147f. PMID 23611515.
- ^ DNA ion channels: Burns, JR; Göpfrich, K; Wood, JW; Thacker, VV; Stulz, E; Keyser, UF; Howorka, S (11 November 2013). “Lipid-bilayer-spanning DNA nanopores with a bifunctional porphyrin anchor”. Angewandte Chemie (International Ed. In English) 52 (46): 12069–12072. doi:10.1002/anie.201305765. PMC 4016739. PMID 24014236.
- ^ DNA ion channels: Seifert, A; Göpfrich, K; Burns, JR; Fertig, N; Keyser, UF; Howorka, S (24 February 2015). “Bilayer-spanning DNA nanopores with voltage-switching between open and closed state”. ACS Nano 9 (2): 1117–1126. doi:10.1021/nn5039433. PMC 4508203. PMID 25338165.
- ^ DNA ion channels: Göpfrich, Kerstin; Zettl, Thomas; Meijering, Anna E. C.; Hernández-Ainsa, Silvia; Kocabey, Samet; Liedl, Tim; Keyser, Ulrich F. (8 April 2015). “DNA-Tile Structures Induce Ionic Currents through Lipid Membranes”. Nano Letters 15 (5): 3134–3138. doi:10.1021/acs.nanolett.5b00189. PMID 25816075.
- ^ DNA ion channels: Burns, Jonathan R.; Seifert, Astrid; Fertig, Niels; Howorka, Stefan (11 January 2016). “A biomimetic DNA-based channel for the ligand-controlled transport of charged molecular cargo across a biological membrane”. Nature Nanotechnology 11 (2): 152–156. doi:10.1038/nnano.2015.279. PMID 26751170.
- ^ DNA ion channels: Göpfrich, Kerstin; Li, Chen-Yu; Ricci, Maria; Bhamidimarri, Satya Prathyusha; Yoo, Jejoong; Gyenes, Bertalan; Ohmann, Alexander; Winterhalter, Mathias et al. (23 August 2016). “Large-Conductance Transmembrane Porin Made from DNA Origami”. ACS Nano 10 (9): 8207–8214. doi:10.1021/acsnano.6b03759. PMC 5043419. PMID 27504755.
- ^ DNA scramblase: Ohmann, Alexander; Li, Chen-Yu; Maffeo, Christopher; Al Nahas, Kareem; Baumann, Kevin N.; Göpfrich, Kerstin; Yoo, Jejoong; Keyser, Ulrich F. et al. (21 June 2018). “A synthetic enzyme built from DNA flips 107 lipids per second in biological membranes”. Nature Communications 9 (1): 2426. doi:10.1038/s41467-018-04821-5. PMC 6013447. PMID 29930243.
- ^ a b c Design: Brenneman, Arwen; Condon, Anne (25 September 2002). “Strand design for biomolecular computation”. Theoretical Computer Science 287: 39–58. doi:10.1016/S0304-3975(02)00135-4.
- ^ Overview: Lin, Chenxiang; Liu, Yan; Rinker, Sherri; Yan, Hao (11 August 2006). “DNA tile based self-assembly: building complex nanoarchitectures”. ChemPhysChem 7 (8): 1641–1647. doi:10.1002/cphc.200600260. PMID 16832805.
- ^ a b c Design: Dirks, Robert M.; Lin, Milo; Winfree, Erik; Pierce, Niles A. (15 February 2004). “Paradigms for computational nucleic acid design”. Nucleic Acids Research 32 (4): 1392–1403. doi:10.1093/nar/gkh291. PMC 390280. PMID 14990744.
- ^ Methods: Ellington, A.; Pollard, J. D. (1 May 2001). “Synthesis and purification of oligonucleotides”. Current Protocols in Molecular Biology. Chapter 2. Unit2.11. doi:10.1002/0471142727.mb0211s42. ISBN 978-0471142720. PMID 18265179
- ^ Methods: Ellington, A.; Pollard, J. D. (1 May 2001). “Purification of oligonucleotides using denaturing polyacrylamide gel electrophoresis”. Current Protocols in Molecular Biology. Chapter 2. Unit2.12. doi:10.1002/0471142727.mb0212s42. ISBN 978-0471142720. PMID 18265180
- ^ Methods: Gallagher, S. R.; Desjardins, P. (1 July 2011). “Quantitation of nucleic acids and proteins”. Current Protocols Essential Laboratory Techniques. doi:10.1002/9780470089941.et0202s5. ISBN 978-0470089934
- ^ Methods: Chory, J.; Pollard, J. D. (1 May 2001). “Separation of small DNA fragments by conventional gel electrophoresis”. Current Protocols in Molecular Biology. Chapter 2. Unit2.7. doi:10.1002/0471142727.mb0207s47. ISBN 978-0471142720. PMID 18265187
- ^ Methods: Walter, N. G. (1 February 2003). “Probing RNA structural dynamics and function by fluorescence resonance energy transfer (FRET)”. Current Protocols in Nucleic Acid Chemistry. Chapter 11. 11.10.1–11.10.23. doi:10.1002/0471142700.nc1110s11. ISBN 978-0471142706. PMID 18428904
- ^ Methods: Lin, C.; Ke, Y.; Chhabra, R.; Sharma, J.; Liu, Y.; Yan, H. (2011). “Synthesis and Characterization of Self-Assembled DNA Nanostructures”. In Zuccheri, G. and Samorì, B. DNA Nanotechnology: Methods and Protocols. Methods in Molecular Biology. 749. pp. 1–11. doi:10.1007/978-1-61779-142-0_1. ISBN 978-1-61779-141-3. PMID 21674361
- ^ Methods: Bloomfield, Victor A.; Crothers, Donald M.; Tinoco, Jr., Ignacio (2000). Nucleic acids: structures, properties, and functions. Sausalito, Calif: University Science Books. pp. 84–86, 396–407. ISBN 978-0-935702-49-1
- ^ a b c History: Pelesko, John A. (2007). Self-assembly: the science of things that put themselves together. New York: Chapman & Hall/CRC. pp. 201, 242, 259. ISBN 978-1-58488-687-7
- ^ History: See “Current crystallization protocol”. Nadrian Seeman Lab. 2019年10月2日閲覧。 for a statement of the problem, and “DNA cages containing oriented guests”. Nadrian Seeman Laboratory. 2019年10月2日閲覧。 for the proposed solution.
- ^ a b DNA origami: Rothemund, Paul W. K. (2006). “Scaffolded DNA origami: from generalized multicrossovers to polygonal networks”. In Chen, Junghuei; Jonoska, Natasha; Rozenberg, Grzegorz. Nanotechnology: science and computation. Natural Computing Series. New York: Springer. pp. 3–21. doi:10.1007/3-540-30296-4_1. ISBN 978-3-540-30295-7
- ^ Nanoarchitecture: Robinson, Bruche H.; Seeman, Nadrian C. (August 1987). “The design of a biochip: a self-assembling molecular-scale memory device”. Protein Engineering 1 (4): 295–300. doi:10.1093/protein/1.4.295. PMID 3508280.
- ^ Nanoarchitecture: Xiao, Shoujun; Liu, Furong; Rosen, Abbey E.; Hainfeld, James F.; Seeman, Nadrian C.; Musier-Forsyth, Karin; Kiehl, Richard A. (August 2002). “Selfassembly of metallic nanoparticle arrays by DNA scaffolding”. Journal of Nanoparticle Research 4 (4): 313–317. Bibcode: 2002JNR.....4..313X. doi:10.1023/A:1021145208328.
- ^ Junghuei Chen; Nadrian C. Seeman (1991). “Synthesis from DNA of a molecule with the connectivity of a cube”. Nature 350: 631-633. doi:10.1038/350631a0.
- ^ History: Hopkin, Karen (August 2011). “Profile: 3-D seer”. The Scientist 2011年8月8日閲覧。.
関連文献
全般:
- Seeman, Nadrian C. (June 2004). “Nanotechnology and the double helix”. Scientific American 290 (6): 64–75. Bibcode: 2004SciAm.290f..64S. doi:10.1038/scientificamerican0604-64. PMID 15195395.—分野の創設者による一般向けの記事。
- Seeman, Nadrian C. (9 June 2010). “Structural DNA nanotechnology: growing along with Nano Letters”. Nano Letters 10 (6): 1971–1978. Bibcode: 2010NanoL..10.1971S. doi:10.1021/nl101262u. PMC 2901229. PMID 20486672.— 2001–2010年の期間に報告された研究結果の総説。
- Seeman, Nadrian C. (2010). “Nanomaterials based on DNA”. Annual Review of Biochemistry 79: 65–87. doi:10.1146/annurev-biochem-060308-102244. PMC 3454582. PMID 20222824.—古今の研究を紹介する包括的な総説。
- Service, Robert F. (3 June 2011). “DNA nanotechnology grows up”. Science 332 (6034): 1140–1143. doi:10.1126/science.332.6034.1140. PMID 21636754..—分野の歴史と応用展開を中心とするニュース記事。
- Zadegan, Reza M.; Norton, Michael L. (June 2012). “Structural DNA Nanotechnology: From Design to Applications”. Int. J. Mol. Sci. 13 (6): 7149–7162. doi:10.3390/ijms13067149. PMC 3397516. PMID 22837684.—近年の包括的な総説。
- 村田智 他「【連載】DNAナノテクノロジー ― 構造を作り,計算し,ナノロボットを動かす」『現代化学』第541-549号、2016年4月―12月。—初心者向けの解説記事。
分野ごとの文献:
- Bath, Jonathan; Turberfield, Andrew J. (5 May 2007). “DNA nanomachines”. Nature Nanotechnology 2 (5): 275–284. Bibcode: 2007NatNa...2..275B. doi:10.1038/nnano.2007.104. PMID 18654284.—核酸ナノメカニカル素子のレビュー論文。
- Feldkamp, Udo; Niemeyer, Christof M. (13 March 2006). “Rational design of DNA nanoarchitectures”. Angewandte Chemie International Edition 45 (12): 1856–76. doi:10.1002/anie.200502358. PMID 16470892.—二次的な構造デザインの観点から書かれた総説。
- Lin, Chenxiang; Liu, Yan; Rinker, Sherri; Yan, Hao (11 August 2006). “DNA tile based self-assembly: building complex nanoarchitectures”. ChemPhysChem 7 (8): 1641–1647. doi:10.1002/cphc.200600260. PMID 16832805.—タイルベースのアセンブリに注目した短いレビュー。
- Zhang, David Yu; Seelig, Georg (February 2011). “Dynamic DNA nanotechnology using strand-displacement reactions”. Nature Chemistry 3 (2): 103–113. Bibcode: 2011NatCh...3..103Z. doi:10.1038/nchem.957. PMID 21258382.—鎖置換機構を利用したDNA系のレビュー。
外部リンク
- What is Bionanotechnology?—DNAナノテクノロジーを紹介する動画(英語)。