遺伝子変換
遺伝子変換(いでんしへんかん、英: gene conversion)は、あるDNA配列が相同な配列によって置換され、同一な配列となる過程である。遺伝子変換は対立遺伝子間(alleic)の変換、すなわちある遺伝子の一方のアレルが同じ遺伝子の他方のアレルを置換する場合と、異所性(ectopic)の変換、すなわちあるパラログ配列が他のパラログ配列を置換する場合とがある。
対立遺伝子変換
[編集]対立遺伝子変換(Allelic gene conversion)は、減数分裂過程でのヘテロ接合部位間の相同組換えによって塩基対のミスマッチが生じた際に起こる。このミスマッチは細胞内の装置によって認識されて修正され、一方のアレルは他方のアレルへと変換される。これによって生殖細胞でアレルの非メンデル型分離が引き起こされる場合がある[1]。
非対立/異所性遺伝子変換
[編集]組換えは減数分裂時だけでなく、DNA損傷によって引き起こされた二本鎖切断の修復機構としても起こる。二本鎖切断は通常は壊れた二本鎖の相同染色体ではなく姉妹染色分体を用いて修復されるため、対立遺伝子変換は生じない。また、組換えはゲノム上の異なる遺伝子座に存在する相同配列(パラログ配列)間でも生じることがあり、こうしたパラログ配列は以前の遺伝子重複の結果生じたものである場合がある。パラログ配列間で生じた遺伝子変換(異所性遺伝子変換、ectopic gene conversion)は、遺伝子ファミリーの協調進化を担うと推測されている[1][2][3]。
機構
[編集]
あるアレルから他のアレルへの変換は、減数分裂時の相同組換えのミスマッチ修復によるものであることが多い。この過程では4つの染色分体のうちの1つが他の染色分体と対合し、DNA鎖の移行とそれに続いてミスマッチ修復が起こる。これによって染色体の1つの配列が変化し、他方と同一なものとなる。
減数分裂時の組換えは、二本鎖切断の形成によって開始される。切断部の5'末端は分解され、数百ヌクレオチドからなる長い3'オーバーハングが残される。その後、これらの3'一本鎖DNA断片は相同染色体の相同配列へ侵入し(strand invasion)、さまざまな経路によって修復されて乗換え型(CO)または非乗換え型(NCO)の染色体となる。組換え過程のさまざまな段階で、ヘテロ二本鎖DNA(2つの相同染色体に由来する1本ずつから構成される二本鎖DNA、完全に相補的である場合もそうでない場合もある)が形成される。ヘテロ二本鎖DNAにミスマッチが存在する場合、一方の鎖の配列は他方の鎖に完全に相補的となるよう修復され、その結果、一方の配列は他方の配列へと変換される。この修復過程は、図で示されている2つの経路のいずれかによって行われる。一方の経路では、ダブルホリデイジャンクション(DHJ)と呼ばれる構造が形成され、DNA鎖の交換が行われる。他方の経路はSynthesis Dependent Strand Annealing(SDSA)経路と呼ばれ、情報の交換は行われるが物理的な交換は行われない。遺伝子変換は、組換え部位のDNAがヘテロ接合型であり、SDSA経路による相同組換えが行われた場合に生じる。遺伝子変換はDHJを伴う組換え修復過程でも生じることがあるが、この遺伝子変換はDHJの両側でのDNA二本鎖の物理的な組換えと関係している。
偏った遺伝子変換
[編集]偏った遺伝子変換(biased gene conversion)は、ある遺伝子変換のイベントにおいて、あるアレルが他のアレルよりも供与側となる可能性が高いような場合を指す。例えば、T:Gミスマッチが起こった場合、T:A塩基対よりもC:G塩基対へと修正される可能性が多少高い。その結果、特定のアレルが次世代へ受け継がれる可能性が高くなる。偏りのない遺伝子変換(unbiased gene conversion)は、双方の可能性が等しい確率で起こる場合を指す。
GCに偏った遺伝子変換
[編集]GCに偏った遺伝子変換(GC-biased gene conversion)は、組換え時の遺伝子変換によってDNAのGC含量が増加する過程である[2]。酵母とヒトではGCに偏った遺伝子変換の証拠が存在し、近年では他の真核生物系統でも検証が行われている[4]。解析されたヒトのDNA配列では、乗換え率とGC含量には正の相関があることが判明している[2]。ヒトのX染色体とY染色体の偽常染色体領域(PAR)は組換え率が高く、またGC含量も高いことが知られている[1]。協調進化が起こっている特定の哺乳類遺伝子(リボソームオペロン、tRNA、ヒストン遺伝子など)は、非常にGC含量が高い[1]。ヒトとマウスのヒストン遺伝子パラログの比較からは、類似した配列からなるサブファミリーに属する遺伝子(おそらく協調進化が起こっている)は、比較的独特な配列を持つ遺伝子よりもGC含量が高いことが示されている[5]。また、ミスマッチ修復過程にもGCへの偏りの証拠が存在する[1]。これは、メチル化シトシンの脱アミノ化によるC→T変換に対する適応である可能性が考えられている。
マウスFxy遺伝子
[編集]マウスに近縁な一部の哺乳類では、FxyまたはMid1遺伝子はX染色体の性連鎖領域に位置している。しかしMus musculusでは、遺伝子の3'末端がX染色体のPARと重複する転位が起こっている。PARは組換えのホットスポットとして知られている。遺伝子のPARに位置する領域ではコドンの3番目の塩基やイントロンで劇的なGC含量と置換率の増加がみられるが、遺伝子の5'側の性連鎖領域に位置する領域ではみられない。組換え率が増加した遺伝子領域でのみGC含量の増加がみられることは、この変化が選択圧ではなく偏りのある遺伝子変換によるものであることを示している[2]。
ヒトゲノムへの影響
[編集]ヒトゲノムのGC含量には大きな多様性が存在するが(40–80%)、平均的なGC含量が他の領域よりも高かったり低かったりするゲノム領域が存在するようである[1]。こうした領域は常に明確な境界がみられるわけではないが、アイソコアとして知られている。GCに富むアイソコアが存在する説明の1つとして、それらが組換え率が高い領域でのGCに偏った遺伝子変換によって進化した可能性を挙げることができる。
進化的重要性
[編集]組換えの適応的機能
[編集]遺伝子変換の研究は、減数分裂時の組換えの適応的機能についての理解に寄与してきた。あるアレル対(Aa)の減数分裂による通常の分離パターンは2A:2aである。低頻度な遺伝子変換(減数分裂によって3:1または1:3の分離パターンとなる)を検出することで、乗換え型または非乗換え型染色体のいずれかが形成される2つの組換え修復経路に関する知見が得られる。遺伝子変換は、Aまたはaのアレルの近傍で分子的な組換えが起こったときに生じると考えられている。そのため、遺伝子変換に伴って、変換部位に近接した外部の染色体領域が乗換え型または非乗換え型となる頻度を測定することが可能である。遺伝子変換の研究はさまざまな菌類で多数行われており(こうした研究には菌類が特に適している)、得られた知見はWhitehouseによる総説[6]としてまとめられている。この総説では、研究が行われたいくつかの異なる菌類において、遺伝子変換の大部分は外部マーカーの交換と関係しておらず、すなわち非乗換え型の組換えと関係していることが明らかにされている。こうした非乗換え型の遺伝子変換は主にSDSA経路によって行われる[7]。この過程は、変換部位で2つの相同染色体間での限られた情報の交換を伴うが、DNAの物理的な交換は伴わず、遺伝子の多様性はほとんど産み出されない。そのため、減数分裂時の組換えの適応的機能について、新たな遺伝的多様性の産生や遺伝子の物理的交換による適応的利点にのみ焦点を当てた説明は不適切であるようである。一方、減数分裂時の組換えの大部分は、配偶子へ受け継がれるDNA中の損傷を修復するための適応としての説明が可能である[8]。組換えがDNA修復への適応であるという観点からは興味深いことであるが、酵母では有糸分裂を行う細胞での遺伝子変換は紫外線[9][10]や電離放射線[11]の照射によって増加することが示されている。
ヒトの遺伝子疾患
[編集]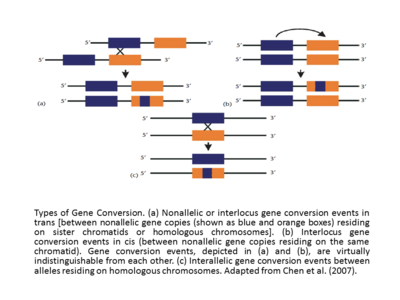
ヒトの遺伝子疾患に関する議論において、偽遺伝子を介した遺伝子変換によって機能的遺伝子に病原性変異が導入されるというのはよく知られた変異の機構である。反対に、偽遺伝子が鋳型として機能する可能性もある。偽遺伝子を鋳型とした変化は、有害な影響を持たない限り、最終的には固定される可能性がある[13]。事実、偽遺伝子は配列の多様性の源として機能し、機能的遺伝子に新たな組み合わせをもたらし、選択に際して作用する可能性がある。シアル酸に結合するヒトの免疫グロブリンであるレクチン11(SIGLEC11)は、こうした遺伝子変換が進化で大きな役割を果たした例であると考えられている。ヒトのSIGLEC11の配列とチンパンジー、ボノボ、ゴリラ、オランウータンの偽遺伝子を比較すると、ヒトのSIGLEC11では5'上流領域と、隣接して存在するヒトSIGLECP16偽遺伝子の約 2 kbのシアル酸認識ドメインをコードするエクソンとの間で遺伝子変換が生じたようである[14]。この出来事がヒト属の進化に非常に重要な適応的変化を果たしたことを示唆する3つのエビデンスが存在する。その1つとして、ヒト系統でのみこの遺伝子変換が起こったことで、大脳皮質でのSIGLEC11の発現を獲得し、チンパンジーのものと比較して大きな基質結合性の変化が生じていることが挙げられる。一方でヒトの進化過程における機能的また適応的な変化に対する偽遺伝子を介した遺伝子変換機構の寄与の頻度は未知であり、これまで研究はほとんど行われていない[12]。時には遺伝子ファミリーの一部のメンバーに対するトランスポゾンの介入によってメンバー間の多様性が生じ、最終的には配列類似性が失われて遺伝子変換率は低下し、分岐進化へとつながる可能性がある。
出典
[編集]- ^ a b c d e f “GC-content evolution in mammalian genomes: the biased gene conversion hypothesis”. Genetics 159 (2): 907–11. (October 2001). PMC 1461818. PMID 11693127.
- ^ a b c d “Biased gene conversion and the evolution of mammalian genomic landscapes”. Annu Rev Genom Hum Genet 10: 285–311. (2009). doi:10.1146/annurev-genom-082908-150001. PMID 19630562.
- ^ Harpak, Arbel; Lan, Xun; Gao, Ziyue; Pritchard, Jonathan K. (2017-11-28). “Frequent nonallelic gene conversion on the human lineage and its effect on the divergence of gene duplicates” (英語). Proceedings of the National Academy of Sciences 114 (48): 12779–12784. doi:10.1073/pnas.1708151114. ISSN 0027-8424. PMC 5715747. PMID 29138319.
- ^ “Evidence for widespread GC-biased gene conversion in eukaryotes”. Genome Biol Evol 4 (7): 675–82. (2012). doi:10.1093/gbe/evs052. PMC 5635611. PMID 22628461.
- ^ Galtier N (February 2003). “Gene conversion drives GC content evolution in mammalian histones”. Trends Genet. 19 (2): 65–8. doi:10.1016/s0168-9525(02)00002-1. PMID 12547511.
- ^ Whitehouse, HLK (1982). Genetic Recombination: understanding the mechanisms. Wiley. p. 321 & Table 38. ISBN 978-0471102052
- ^ “Synthesis-dependent strand annealing in meiosis”. PLoS Biol. 5 (11): e299. (November 2007). doi:10.1371/journal.pbio.0050299. PMC 2062477. PMID 17988174.
- ^ Bernstein, Harris; Bernstein, Carol; Michod, Richard E. (2011). “19. Meiosis as an Evolutionary Adaptation for DNA Repair”. In Kruman, Inna. DNA Repair. 2011: InTech. doi:10.5772/25117. ISBN 978-953-307-697-3
- ^ “Studies on the induction of mitotic gene conversion by ultraviolet irradiation. II. Action spectra”. Mutat. Res. 30 (1): 43–54. (October 1975). doi:10.1016/0027-5107(75)90251-1. PMID 1101053.
- ^ “Recombinagenic and mutagenic effects of sunlamp (UV-B) irradiation in Saccharomyces cerevisiae”. Mol. Gen. Genet. 177 (4): 577–80. (1980). doi:10.1007/bf00272666. PMID 6991864.
- ^ “Induction of heteroallelic reversions and lethality in Saccharomyces cerevisiae exposed to radiations of various LET ( 60 Co rays, heavy ions and — mesons) in air and nitrogen atmospheres”. Radiat. Res. 47 (3): 635–43. (September 1971). doi:10.2307/3573356. JSTOR 3573356. PMID 5119583.
- ^ a b Chen, Jian-Min; Cooper, David N.; Chuzhanova, Nadia; Férec, Claude; Patrinos, George P. (2007). “Gene conversion: mechanisms, evolution and human disease”. Nature Reviews Genetics 8 (10): 762–775. doi:10.1038/nrg2193. ISSN 1471-0056. PMID 17846636.
- ^ Chen, Jain-Min (2001). Gene Conversion in Evolution and Disease. Wiley. ISBN 9780470015902
- ^ Hayakawa, Toshiyuki; Angata, Takashi; Lewis, Amanda L.; Mikkelsen, Tarjei S.; Varki, Nissi M.; Varki, Ajit (2005-09-09). “A human-specific gene in microglia”. Science (New York, N.Y.) 309 (5741): 1693. doi:10.1126/science.1114321. ISSN 1095-9203. PMID 16151003.
