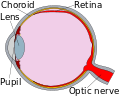
酸素中毒
| 酸素中毒 | |
|---|---|
| 別称 | 酸素毒性 |
 | |
| 1942年から1943年にかけて、英国政府はダイバーの酸素毒性に関する広範なテストを実施した。室内は3.7 barの空気で加圧されている。中央の被験者は、マスクから100%の酸素を吸入している[1]。 | |
| 概要 | |
| 診療科 | 潜水医学、高気圧酸素治療、新生児学 |
| 分類および外部参照情報 | |
酸素中毒(さんそちゅうどく、oxygen intoxication[2]、または酸素毒性(英: oxygen toxicity)[注釈 1])とは、分圧が上昇した酸素分子(O2)を吸入することで生じる有害な生体への影響である。その影響は中枢神経系、肺、および目に最もよく見られ、重症の場合、細胞損傷が進行して死に至る可能性がある。歴史的に、中枢神経系の症状(脳酸素中毒)はポール・ベール効果、肺の症状(肺酸素中毒)はローレン・スミス効果と呼ばれ[3]、19世紀後半にそれらを発見して記述した研究者にちなんで名付けたものである。酸素の発見は、1774年のイギリスのジョセフ・プリーストリーによるが、その後100年以上、その毒性が知られることは無かった。ただ、フランスのジュール・ベルヌはこの間、酸素の有害作用を主題とした短編SF小説を遺した(オクス博士の幻想)。
ダイバー、高濃度の酸素吸入を受けているヒト、高圧酸素療法を受けているヒトは酸素中毒に留意する必要がある。酸素曝露の種類に応じて、受ける影響はさまざまである。中枢神経系の毒性は、大気圧よりも高い酸素分圧に短時間さらされることによって引き起こされる。視野狭窄、耳鳴り、吐き気、痙攣、不快感、めまいなどの急性症状が中心である[3]。肺および眼の毒性は、常圧下で高濃度酸素への長時間の曝露に起因する。症状には、息切れ、咳、呼吸障害、網膜剥離、近視などの視力悪化など、慢性症状が多い[3]。正常値を超える酸素分圧への長時間の曝露、または非常に高い酸素分圧への短い曝露により、体内で活性酸素が産生され、細胞膜の酸化ストレスから、各種の障害が引き起こされると考えられている。
圧縮呼吸ガスを使用する潜水、高圧酸素療法、新生児医療など、通常よりも高い分圧で酸素を呼吸する分野では、高酸素症の影響を回避するためのプロトコルが存在する。これらのプロトコルの進歩により、酸素中毒は減少しつつある。酸素中毒の管理は、曝露されている酸素の濃度を減らすことと、中毒症状に対する対症療法による。長期的には、ほとんどのタイプの酸素中毒から、着実に回復が可能であることが研究により示されている。
近年、酸素は酸素バーで娯楽的に利用できるようになった。米食品医薬品局は、心臓や肺に疾患のある人は酸素バーを使用しないよう警告している。スキューバダイバーは分圧の高い酸素を含む呼吸ガスを使用するため、そのようなガスを使用するための特別な訓練を受ける必要がある。
分類
[編集]
酸素中毒の影響は、影響を受ける臓器によって分類され、次の3つの主な形態がある[4][5][6]。
- 高気圧条件下で起こるけいれん発作とそれに続く意識消失を特徴とする中枢神経系症状
- 長時間にわたって高分圧の酸素を吸入した場合に起こる呼吸困難と胸部の痛みを特徴とする肺症状
- 長時間にわたって高分圧の酸素を吸入した場合に起こる目の変化を特徴とする眼症状(網膜症[要曖昧さ回避])。
中枢神経系の酸素中毒は、発作、短時間の硬直から痙攣や意識消失を引き起こすことがあり、大気圧を越える水圧に遭遇するダイバーにとっては脅威である。肺の酸素中毒は肺傷害から、胸の痛みや呼吸困難を引き起こす[4]。眼の酸化的損傷は、近視や網膜の部分剥離を引き起こすことがある。肺および眼への障害は、治療の一環として酸素吸入が行われる場合、特に新生児に最も起こりやすいが、高気圧酸素療法中にも懸念される[7][8]。
酸化的障害は体内のどの細胞にも起こりうるが、最も影響を受けやすい3つの臓器(脳、肺、目)への影響が最も懸念される。赤血球(溶血)[9][10]、肝臓[11]、心臓[12]、内分泌腺(副腎、性腺、甲状腺)[13][14][15]、または腎臓[16]、および細胞全般の損傷にも関与している可能性がある[4][17]。
特殊な状況では、他の組織への影響が観察されることがある。宇宙飛行士においては、高濃度の酸素が骨障害の一因になる可能性が疑われている[18]。高酸素症は、慢性閉塞性肺疾患などの肺疾患や中枢性呼吸抑制を有する患者において、間接的にCO2ナルコーシスを引き起こすこともある[18]。海面気圧の酸素分圧は0.21 バール(21 kPa)であるのに対し、0.3 バール(30 kPa)以下では酸素による毒性は生じないため、大気圧下での空気の過換気は酸素中毒を引き起こさない[19]。
症状と徴候
[編集]| 曝露 (分) | 人数 | 症状 |
|---|---|---|
| 96 | 1 | 長時間の眩暈、激しい痙攣性嘔吐 |
| 60–69 | 3 | 激しい唇のぴくつき、多幸感、吐き気とめまい、腕のぴくつき |
| 50–55 | 4 | 激しい唇のぴくつき、眩暈、唇の水ぶくれ、睡眠、意識朦朧 |
| 31–35 | 4 | 吐き気、めまい、唇のぴくつき、けいれん |
| 21–30 | 6 | 痙攣、眠気、激しい唇のぴくつき、上腹部不快感、腕のぴくつき、健忘 |
| 16–20 | 8 | 痙攣、めまいと激しい唇のぴくつき、上腹部不快感、痙攣性呼吸; |
| 11–15 | 4 | 吸気優位、唇のぴくつきと失神、吐き気と錯乱 |
| 6–10 | 6 | 眩暈と唇のぴくつき、パレステジア、めまい、横隔膜痙攣、激しい吐き気 |
中枢神経系
[編集]中枢神経系の酸素中毒は、視力低下、耳鳴り、吐き気、痙攣、不快感、めまいなどの症状として現れる[20]。数秒間の激しい筋収縮(強直期)と、筋弛緩と筋収縮が交互に起こる急激な痙攣(間代期)の2相からなる強直間代発作を伴うこともあり、この発作後は意識が消失する(発作後状態(postictal state))[21][22]。発作が起こるかどうかは、呼吸ガス中の酸素分圧と曝露時間次第である[22]。しかし、発症までの曝露時間は予測不可能であり、個人間でも同一人物でも日によっても大きなばらつきがあることが研究で示されている[21][23][24]。さらに、水中への浸漬、寒冷への曝露、運動など多くの外的要因により、中枢神経系症状の発症までの時間が短縮される[1]。この耐性の低下は、二酸化炭素の血中濃度と密接に関連している[25][26][27]。暗闇やカフェインなどの他の要因は、実験動物において耐性を増加させるが、これらの効果はヒトでは証明されていない[28][29]。
肺
[編集]潜水、飛行前の酸素予備吸入、高気圧療法など、0.5気圧を超える酸素分圧への暴露は、肺の中毒症状の発現と関連している[30]。肺の中毒症状は、肺につながる気道から始まり、肺そのものに広がる炎症に起因する。 症状は、上胸部(胸骨下ないしは気管分岐部)に現れる[31][32][33]。これは、吸気時の軽いくすぐったさから始まり、頻繁な咳へと進行する[31]。酸素分圧が高い状況で呼吸し続けると、患者は、咳が制御不能となり、時折息切れを生じ、吸気時の軽い熱感を自覚する[31]。肺毒性に関連する身体所見には、聴診器で聴こえる水泡音、発熱、鼻粘膜の充血などがある[33]。組織学的検査では、間質腔の幅の増大がみられることがある[30]。肺のX線検査では、短期的にはほとんど変化がみられないが、長期間の高濃度酸素暴露により、両肺全体にびまん性陰影が増加する[31]。スパイロメトリーでは、肺機能が低下する。すなわち、肺が保持できる空気の量(肺活量)が減少し、呼気機能および肺弾性が悪化する[33][34]。肺拡散能は低下し、最終的には低酸素血症に至る[30]。動物実験では、中枢神経系毒性にみられるのと同様の耐性のばらつきが示され、種間でも大きなばらつきがある。0.5バール(50 kPa)以上の酸素への曝露が断続的である場合、肺の回復が可能となり、中毒症状発現が遅れる[35]。同様の経過はすべての哺乳類に共通である[30]。数日間酸素曝露しても低酸素血症による死亡が生じない場合、増殖期に移行し、肺胞膜の慢性的肥厚と肺拡散能の低下が生じる。これらの変化は正常酸素濃度環境に戻ればほとんど可逆的であるが、完全な回復に要する時間は不明である[30]。
眼
[編集]未熟児の場合、眼球の障害(未熟児網膜症)の徴候は、眼底検査で乳児の網膜の血管のある領域と血管のない領域の境界として、観察される[7]。この境界の程度は、以下の4つの病期に分類される[7]。
(I)境界は線状。
(II)境界が隆起。
(III)新生血管が隆起の周囲で成長している。
(IV)網膜が眼球の内壁(脈絡膜)から剥離し始める。
原因
[編集]酸素中毒は、高酸素症、すなわち身体が通常曝される酸素分圧よりも高い分圧の酸素に曝されることによって引き起こされる[36]。これは、潜水[37]、高気圧酸素療法[38]、そして集中治療(特に未熟児に対する酸素補給[39])や慢性疾患の長期治療目的の酸素吸入[40]、という3つの主な状況で生じる。それぞれの場合において、危険因子は著しく異なる[37][38][39]。
通常の、または低下した周囲圧の下では、高酸素症の影響は、最初は直接曝露される肺に限定されるが、長期間の曝露後または高気圧環境では、他の臓器が危険にさらされる可能性がある[41]。
中枢神経毒性
[編集]中枢神経系の酸素毒性、すなわち脳酸素中毒は、酸素分圧が1.3バール (130 kPa)を越えると発症する可能性がある[3][注釈 2]。海面気圧は約1バール (100 kPa)であるため、中枢神経系毒性は、周囲圧力が通常より高い高気圧条件下でのみ起こりうる[38][42]。純酸素であれば水深3mを超える深度でダイバーは、脳酸素中毒の発作のリスクが高まる[3]。ナイトロックスのような酸素が濃縮された混合ガスを吸入するダイバーも同様に、その混合ガスで許容される最大許容深度(MOD)より深くまで潜降すると、発作を起こすリスクが高まる[43]。中枢神経系毒性は、高二酸化炭素分圧、ストレス、疲労、寒さによって悪化するが、これらはすべて、高気圧療法よりもダイビングの方がはるかに起こりやすい[44]。
肺毒性
[編集]
肺と気道は、人体で最も高濃度の酸素にさらされるため、最初に酸素による毒性が生じる臓器である[45]。肺の酸素毒性は、0.5バール (50 kPa)を超える酸素分圧にさらされた場合にのみ発生する[45]。肺毒性の最も早い徴候は、95%以上の酸素で4時間から22時間の無症状期間の後、気管気管支炎、すなわち上気道の炎症で始まる[45]が、このレベルの酸素では、通常約14時間後に症状が始まることを示唆する研究もある[46]。
2~3 バールの酸素分圧(大気圧の2~3倍で100%酸素)では、これらの症状は酸素暴露後3時間で始まる可能性がある[45]。1~3バール(100~300kPa)の圧力で酸素を吸入したラットの実験から、酸素中毒の肺症状は、常圧条件と高気圧条件とでは同じではないかもしれないことが示唆されている[47]。肺機能検査で測定される肺機能の低下所見は、100%酸素に連続暴露して24時間という短時間で生じることがあり[46]、びまん性肺胞傷害の所見と急性呼吸窮迫症候群の発症は、通常100%酸素に48時間暴露した後に生じる[45]。大気圧下100%酸素の吸入も最終的には肺胞の虚脱(無気肺)ももたらすが、加圧下での同じ酸素分圧では、かなりの分圧の不活性ガス(典型的には窒素)が存在することでこの影響が防止される[48]。
早産の新生児は、高濃度の酸素に長時間さらされることで、気管支肺異形成症のリスクが高くなることが知られている[49]。酸素中毒のリスクが高い他のグループは、吸入酸素濃度が50%を超える人工呼吸中の患者、化学療法剤ブレオマイシンなど酸素毒性のリスクを高める化学物質にさらされた患者である[46]。そのため、集中治療室で機械換気を行っている患者に対する現在のガイドラインでは、酸素濃度を60%未満に保つことが推奨されている[45]。同様に、減圧症の治療を受けるダイバーは、ダイビング中の酸素曝露に加えて、高気圧条件下での長時間の酸素呼吸にさらされる治療が必要となるため、酸素中毒のリスクが高くなる[38]。
眼毒性
[編集]高濃度酸素吸入に長期間さらされると、網膜に損傷が生じる[50][51][52]。常圧で高酸素吸入率にさらされた乳幼児の発達中の眼球への傷害は、高気圧条件下で成人ダイバーに起こる眼球傷害とはメカニズムも影響も異なる[53][54]。
高酸素症は、乳児の未熟児網膜症(ROP)と呼ばれる障害の一因である可能性がある[53][55]。早産児では、網膜の血管が未発達なことが多い。未熟児網膜症は、網膜血管系の発達が停止し、その後異常に進行することによって起こる。新生血管の成長に伴って線維組織(瘢痕組織)が収縮し、網膜剥離を引き起こすことがある。酸素補充は危険因子ではあるが、本疾患発症の主な危険因子ではない。補助酸素の使用を制限しても未熟児網膜症の発症率が低下するとは限らず、低酸素症に関連した全身合併症のリスクを高める可能性がある[53]。
高酸素性近視は、閉鎖回路のリブリーザーを用いる潜水士が長期にわたって酸素に曝露した場合に発生している[54][56][57]。また、高気圧酸素療法を繰り返し受けた場合にも起こりやすい[51][58]。眼軸長や角膜形状測定では近視シフトの原因となるような角膜や眼球測定の所見が明らかではないため、これは水晶体の屈折力の増加によるものである[58][59]。この病変は時間が経てば通常可逆的である[51][58]。
高気圧酸素療法のまれな副作用として、白内障が起こることもある[8]。白内障では、眼の水晶体の混濁が増大し、視力が低下し、最終的には失明に至る可能性がある[8]。これは、酸素濃度上昇に頻回にさらされることに関連するまれな事象であり、非常にゆっくりと発症するため、見落とされている可能性がある[8]。原因は完全には解明されていないが、酸素濃度が上昇すると、水晶体のクリスタリンが架橋によって変性し、光を散乱させる凝集体が形成されるため、硝子体の劣化が促進される可能性があることが示唆されている[8]。加齢は高濃度酸素曝露による白内障の重要な危険因子である[8]。
機序
[編集]
酸素毒性の生化学的基盤は、酸素が1つまたは2つの電子によって部分的に還元され、活性酸素種を形成することである[60]。これらは酸素の通常の代謝の自然な副産物であり、細胞シグナル伝達において重要な役割を果たしている[61]。体内で生成される一種の超酸化物アニオン (O−
2)[62]は、鉄の獲得に関与している可能性がある[63]。酸素濃度が通常より高いと、活性酸素濃度が増加する[64]。酸素は細胞代謝に必要であり、血液が体のすべての部分に酸素を供給している。酸素が高い分圧で呼吸されると、酸素過剰状態が急速に広がり、最も血管が豊富な組織が最も影響を受けやすくなる。ストレス環境の時期には、活性酸素のレベルが劇的に増加し、細胞構造に損傷を与え、酸化ストレスを引き起こすことがある[24][65]。
これらの活性酸素が体内でどのように作用するかのメカニズムはまだ完全には理解されていないが[66]、酸化ストレスの最も反応性が高い生成物の一つはヒドロキシルラジカル(·OH)であり、これは細胞膜内の不飽和脂質における脂質過酸化反応の有害な連鎖反応を引き起こす可能性がある[67]。高濃度の酸素は、一酸化窒素、過酸化亜硝酸塩、トリオキシダンなどの他のフリーラジカルの生成も増加させ、これらはデオキシリボ核酸(DNA)やその他の生体分子に損傷を与える[24][68]。体内にはグルタチオンなどの酸化ストレスを防ぐための多くの抗酸化物質システムが存在するが、非常に高い濃度の遊離酸素が存在すると、これらのシステムは最終的に飽和し、細胞損傷の速度がシステムが防御または修復する能力を上回るようになる[69][70][71]。その結果、細胞損傷や細胞死が引き起こされる[72]。
診断
[編集]肺酸素中毒は、肺機能検査や胸部X線撮影で評価できる[44]。脳酸素中毒は上記の症状と徴候に加えて、多くの場合、頻脈と発汗を伴う[44]。
乳幼児の未熟児網膜症の診断は、眼底検査による[73]。出生体重1500g未満または在胎30週未満の全ての乳児に行う[73]。未熟児、低出生体重、および酸素曝露歴が主な指標であるが、遺伝性因子の関与は示されていない[74]。
鑑別診断
[編集]臨床診断は、動脈血酸素濃度で確認できる[44]。中神経系または呼吸器系の酸素中毒と混同される可能性のある他の疾患には、以下のようなものがある[44]。
予防
[編集]
酸素中毒の予防は、酸素分圧上昇への曝露を減らし、分割することによる[44]。未熟児の場合、早産による合併症の治療のため、酸素の補充が一般的に必要となる[73]。この場合、気管支肺異形成や未熟児網膜症の予防は、乳児の生命を維持するのに十分な酸素供給を損なうことなく行わなければならない[75]。
ダイビング
[編集]脳酸素中毒は、スクーバダイビングにおける壊滅的な危険であり、けいれん発作が発生すると溺死の高いリスクが伴う[3][43][76]。発作は突然発生し、警告症状がないこともある[22]。その影響として、突然の痙攣や意識消失が起こり、その間に被害者はレギュレーターを失い、溺れる可能性がある[77][78]。フルフェイスダイビングマスクの利点の一つは、発作が発生した際にレギュレーターの喪失を防ぐことができる点である。マウスピース固定ストラップは、これと似ているもののやや効果の低い機能を持つ比較的安価な代替手段である[76]。高深度、長時間のダイビング、酸素濃度の高い呼吸ガスを使用するダイビングでは中枢神経系酸素中毒のリスクが高まるため、ダイバーは酸素濃度の高い呼吸ガスに対して最大許容深度(maximum operating depth: MOD)[79]を計算する方法を教わり、そうした混合ガスが入ったボンベはその深度の明確な表示がなされるべきである[27][80]。
発作のリスクは、酸素分圧と曝露時間の累積的な組み合わせである「投与量」の関数である[76]。発作が決して発生しない酸素分圧の閾値は確立されておらず、多くの変数、特に個人差に依存する可能性がある[76]。個人の感受性、運動強度、そして呼吸負荷によって影響される二酸化炭素の血中濃度に応じて、リスクは大きく異なる可能性がある[76]。
酸素曝露が重大なリスクレベルに達する可能性のあるダイビングモードにおけるダイバー訓練コースでは、ダイバーは潜水時の「オキシジェンクロック(oxygen clock: 酸素時計)」[79]を計画・監視する方法を教わる[80]。これは仮想的なアラーム時計であり、酸素圧が高くなるほど早く進み、NOAAのダイビングマニュアルで推奨される最大単一曝露限界に達すると作動するように設定されている[27][80]。純酸素の場合、潜水時間の限界は次の通りである:海水深度 25 ft (7.6 m)では240分、30 ft (9.1 m)では80分、35 ft (11 m)では25分、40 ft (12 m)では15分、50 ft (15 m)では10分しかない[81]。ただし、酸素中毒の症状がいつ発生するかを信頼性をもって予測することは不可能である[82][81]。多くのナイトロックス対応のダイブコンピュータは、酸素負荷を計算し、複数回の潜水にわたってそれを追跡できる。目標は、呼吸ガス中の酸素分圧を低減するか、酸素分圧の高いガスを呼吸する時間を短縮することで、アラームを作動させないようにすることである。酸素分圧は、呼吸ガス中の酸素濃度と潜水深度に応じて増加するため、ダイバーは浅い深度で潜るか、酸素濃度の低いガスを呼吸するか、酸素濃度の高いガスへの曝露時間を短縮することでオキシジェンクロックの時間を延ばすことができる[83][84]。この機能は、いくつかのテクニカルダイビング用減圧コンピュータやリブリーザーの制御および監視ハードウェアによって提供されている[85][86]。
空気で56 m (184 ft)以上の深度で潜ると、酸素分圧が1.4 bar (140 kPa)を超えるため、酸素中毒の危険性が高まり、21%未満の酸素を含む混合ガス(hypoxic mixtureと呼ばれる)を使用する必要がある[87]。窒素の割合を増やすことは、高圧環境では窒素に催眠作用が生じる(窒素中毒)ため望ましくない[87]。しかし、ヘリウムは催眠作用がないため、ガス混合によって窒素を完全にヘリウムに置き換える(ヘリオックスと呼ばれる混合ガス)、または窒素の一部をヘリウムに置き換えたトライミックスも使用される[88]。
ほとんどのダイビングが限られた時間で自然に断続的となるため、酸素中毒はダイバーにとって比較的稀であり、それに加え、可逆的な合併症でもある[89]。 定められたガイドラインに従えば、ダイバーは肺の酸素中毒のリスクを計算することができる[90][91][92]。飽和潜水では、活動エリア内のガス中の酸素含有量を0.4バール以下に制限することで、酸素中毒を回避することができる[93]。
スクリーニング
[編集]酸素耐性テストを使用したスクリーニングの目的は、潜水作業中や減圧症の高気圧治療中に酸素痙攣を起こしやすい、低耐性のダイバーを特定することである[94]。このテストの有効性については疑問が呈されており、統計的研究によれば、標準的な高気圧治療スケジュール中の発作の発生率は低いため、一部の海軍ではこのテストの使用を中止しているが、他の海軍では引き続き全ての候補ダイバーに対してこのテストを要求している[94]。
1976年から1997年までに実施された6,250件の酸素耐性テストのうち、酸素中毒が観察されたのは6例(0.1%)に過ぎなかった[95][96]。
インド海軍が使用する酸素耐性テストは、アメリカ海軍およびアメリカ海洋大気庁の勧告に従い、呼吸装置つきマスクを介して100%酸素を絶対圧 2.8バールの周囲圧で30分間、乾燥した高気圧チャンバー内で安静時に呼吸するというものである[94]。付添者は中枢神経系酸素中毒の発作が起きた場合の緊急処置の訓練をあらかじめ受けていなければならない[94]。
高圧環境
[編集]発熱やけいれん発作の既往がある場合は、高気圧酸素治療の相対的禁忌である[97]。減圧症の治療には高気圧酸素治療が行われることがあるが、発作や肺損傷の可能性を減らすために、米海軍のプロトコールでは、100%の酸素吸入の間に空気を吸う期間(空気休憩)を設けている[98][99]。米海軍では、100%酸素と空気を交互に使用する期間に基づく治療表を使用している[99]。例えば、米海軍潜水マニュアルの第6表では、水深18メートルに相当する2.8標準気圧 (280 kPa)で75分間(酸素20分/空気5分を3回)を必要とする[99]。この後、酸素で30分かけて1.9標準気圧 (190 kPa)までゆっくりと減圧する[99]。その後、患者はさらに150分間(15分空気/60分酸素を2回)、より低い圧力にとどめおかれ、酸素吸入で30分かけて大気圧まで減圧する[99]。
ビタミンEとセレンは、肺酸素毒性に対する潜在的な保護方法として提案されたが、後に却下された[100][101][102]。しかし、ビタミンEとセレンが生体内での脂質過酸化とフリーラジカルによる、損傷防止の助けとなり、したがって反復的な高気圧酸素曝露後の網膜の変化を防ぐというラットにおける実験的エビデンスがいくつかある[103]。
大気圧環境
[編集]気管支肺異形成症は、初期段階では低分圧酸素での中断時間を挟むことで可逆的であるが、進行すると最終的に不可逆的な肺損傷を引き起こす可能性がある。そのような損傷を引き起こすには、酸素投与中断なしで1〜2日間の曝露が必要である[18]。
未熟児網膜症は、スクリーニングによって大部分が予防可能である。現在のガイドラインでは、妊娠週数が32週未満での出生、または出生時体重が1.5 kg未満のすべての赤ちゃんが、少なくとも2週間ごとに未熟児網膜症のスクリーニングを受ける必要があるとされている[104]。1954年の「National Cooperative Study」では、補助酸素と未熟児網膜症の因果関係が示されたが、補助酸素の制限により乳児死亡率が増加した。低酸素症と未熟児網膜症のリスクをバランスさせるために、現代のプロトコルでは、酸素を受けている未熟児の血中酸素レベルの監視が求められている[105]。
酸素中毒のリスクと長期治療で使用される酸素の量を最小限に抑えるためには、目標とする酸素化レベルを達成しつつ、供給濃度を慎重に調整することが重要である[41]。酸素療法を受ける際の典型的な酸素飽和度の目標は、正期産児でも早産児でも91-95%の範囲である[75]。
低圧環境
[編集]酸素の割合が高いことではなく、酸素の分圧が高いことによって酸素中毒は引き起こされるため、低圧環境では避けることができる。これは、低圧で活動しなければならない宇宙服での純酸素の使用や、初期の宇宙船、例えばジェミニ計画やアポロ宇宙船での高酸素濃度と通常の大気圧よりも低い機内圧力の使用によって例証される[106]。船外活動のような応用では、呼吸ガスの酸素の割合が100%に近づいても、酸素は無毒である。これは、酸素分圧が慢性的に0.3バール (4.4 psi)を超えるようになっていないためである[106]。
治療
[編集]高気圧酸素治療中の酸素中毒
[編集]高気圧酸素療法では、患者は通常、約2-3気圧の圧力環境下で、高濃度の酸素を吸入する[107]。この間にけいれん発作が起きれば、患者からマスクを外して吸入酸素分圧を0.6気圧(60kPa)以下に下げる[22]。
ダイビング中の酸素中毒
[編集]水中での発作時は、可能な限り早くダイバーを水面に引き上げなければならない。長年、動脈ガス塞栓症(AGE)の危険性から、発作そのものが起きている間はダイバーを浮上させないことが推奨されてきたが[108]、声門が完全に気道を閉鎖するわけではないというエビデンスもある[109]。これにより、潜水医学および高気圧医学協会のダイビング委員会(Diving Committee of the Undersea and Hyperbaric Medical Society)は、発作の痙攣(けいれん)期にレギュレーターがダイバーの口にない場合には、溺れる危険が動脈ガス塞栓症(AGE)の危険よりも大きいため、ダイバーを引き上げるべきだが、そうでない場合は痙攣期が終わるまで浮上を遅らせるべきだという現在の推奨を行っている[77]。救助者は、痙攣期中に自身の安全が損なわれないようにする[110]。その後、被害者の空気供給が確立されていることを確認し、浮力制御下での引き上げ(controlled buoyant lift)を行う[110]。水面に到達したら、さらなる合併症が医療の介入を必要とする可能性があるため、必ず緊急医療サービスに連絡する[110]。水中で発作以外の症状が現れた場合、ダイバーは直ちに酸素分圧の低いガスに切り替えるか、浅い深度に浮上するべきである[111]。しかし、実際に水中で酸素中毒に遭遇した場合、事態は複雑であり、救助のための急速な浮上により、減圧症の重篤な症状である空気塞栓を併発するリスクもある[112]。水面に減圧チャンバーがある場合は、水面減圧が推奨される選択肢であり、米国海軍は、再圧タンクがすぐに利用できない場合、減圧を完了するための手順を公開している[113]。実際の呼吸ガスの組成に基づき、潜水時間や減圧症予防のための浮上時間を計算する携行用コンピュータもある[85]。
ダイバーは、実験に基づくエビデンスによって一般的に許容可能とされるレベルに酸素曝露を制限することで、肺損傷のリスクを管理する。これは、特定の分圧での曝露時間に基づく酸素中毒単位(oxygen toxicity unit: OTU)のシステムを使用する。減圧症の緊急治療の場合、より重大な症状を治療するために通常の酸素曝露限界を超える必要があることがある[37]。
未熟児における酸素毒性
[編集]気管支肺異形成症の症状が現れた場合、投与する酸素濃度を可能な限り下げ、酸素曝露時間を短縮することで対処するが、かといって乳児を低酸素症に陥らせるべきではない[114]。他の疾患(特に乳児の場合)の治療のために補助酸素が必要な場合、肺組織の膨張を維持するために人工呼吸器が必要になることがある[115]。気管支拡張薬や肺サーファクタントなどの薬剤が使用されることもある[115]。気管支肺異形成症は、この疾患の治療である、人工呼吸そのものによって生じる疾患でもある[114]。
未熟児網膜症は自然に軽快することがあるが、重症例ではレーザー手術が異常血管の増殖を阻止し、網膜剥離のリスクを軽減する[116]。分子標的治療薬の一種、ベバシズマブの注射も異常血管の増殖阻止に有効である[116]。疾患がさらに進行した場合、強膜バックルや硝子体手術などの手術が網膜の再接着に役立つ場合がある[117]。
-
網膜(赤)が眼球の上部で剥離している。
-
網膜剥離に対する強膜バックル、青色部分)治療。 これにより眼球の壁が剥離した網膜に接触し、網膜が再接着される。
反復暴露
[編集]呼吸ガス中の潜在的に毒性のある酸素濃度への繰り返しの曝露は、特に高気圧酸素治療[118]、飽和潜水[119]、など、高気圧環境では一般的に起こり得る。アメリカ海洋大気庁(NOAA)でのロバート・ハミルトン・ジュニアらによる研究は、単回および繰り返しの曝露に対する許容レベルを決定した[37]。急性および慢性毒性に対する許容曝露は区別されるが、これらは実際には可能な連続的な曝露範囲の両極端である[37]。さらに、日常的な曝露と緊急治療が必要な曝露を区別することができる[37]。後者では、より危険な傷害(例えば減圧症)を軽減するために、特に比較的安全な管理・モニターされた環境下で、より高い酸素中毒のリスクが正当化される場合がある[37][120]。
1988年に開発されたRepex(反復曝露)法は、大気圧下で100%酸素を1分間吸入することに相当する単一の用量値を酸素耐性単位(Oxygen Tolerance Unit: OTU)[121]と呼び、これを用いて酸素中毒の用量を計算し、数日間の作業曝露による酸素毒性による影響を回避することができる[37]。測定された水深と選択された呼吸ガス混合物に基づいて自動的にOTUを記録・追跡する潜水作業用のコンピュータがある。これにより、計算された制限値により、最近曝露していない人はより多くの曝露が許容され、連続した曝露日数が増えるにつれて1日の許容用量が減少する[37]。しかし、これらの値は、現在のデータで完全に裏付けられているわけではないかもしれない[122]。
| 曝露日数 | 1日平均量 (OTU) | 合計量 (OTU) |
|---|---|---|
| 1 | 850 | 850 |
| 2 | 700 | 1400 |
| 3 | 620 | 1860 |
| 4 | 525 | 2100 |
| 5 | 460 | 2300 |
| 6 | 420 | 2520 |
| 7 | 380 | 2660 |
| 8 | 350 | 2800 |
| 9 | 330 | 2970 |
| 10 | 310 | 3100 |
| 11 - 30 | 300 | 300×日数 |
| PO2 (atm) | OTU per minute |
|---|---|
| 0.50 | 0.00 |
| 0.55 | 0.15 |
| 0.60 | 0.27 |
| 0.65 | 0.37 |
| 0.70 | 0.47 |
| 0.75 | 0.56 |
| 0.80 | 0.65 |
| 0.85 | 0.74 |
| 0.90 | 0.83 |
| 0.95 | 0.92 |
| 1.00 | 1.00 |
| 1.05 | 1.08 |
| 1.10 | 1.16 |
| 1.15 | 1.24 |
| 1.20 | 1.32 |
| 1.25 | 1.40 |
| 1.30 | 1.48 |
| 1.35 | 1.55 |
| 1.40 | 1.63 |
| 1.45 | 1.70 |
| 1.50 | 1.78 |
| 1.55 | 1.85 |
| 1.60 | 1.92 |
| 1.65 | 2.00 |
| 1.70 | 2.07 |
| 1.75 | 2.14 |
| 1.80 | 2.21 |
| 1.85 | 2.28 |
| 1.90 | 2.35 |
| 1.95 | 2.42 |
| 2.00 | 2.49 |
2019年の研究では下式による中毒指数(Toxicity Index: TI)も提案されている[122]。
TI = t2 × PO2c
t: 時間、c: べき乗項、PO2 : 酸素分圧
これは、活性酸素または活性窒素種を生成する化学反応から導き出されたもので、中枢神経系毒性についてはc=6.8、肺毒性についてはc=4.57で、良好な予測が得られることが示されている[122]。
肺毒性については、時間は時間単位であり、PO2は絶対圧であり、TIは250に制限されるべきである[122]。中枢神経系毒性については、時間は分単位、PO2は絶対圧で大気圧、TIは26,108で1%のリスクを示す[122]。
予後
[編集]中枢神経系の酸素中毒によって引き起こされるけいれんによって、偶発的に被害者が怪我をする可能性があるが、発作後の神経系への損傷が起こりうるかどうかは長年不確かなままで、いくつかの研究がそのような損傷の証拠を探した。2004年のビッターマンによるこれらの研究の概要は、高濃度の酸素を含む呼吸ガスを除去した後では、発作による長期的な神経学的損傷は残らないと結論づけた[24][123]。
気管支肺異形成症の発症後に生存した乳児の大多数は、最終的にほぼ正常な肺機能を回復する。これは、肺が生後5〜7年間成長を続け、気管支肺異形成症によって引き起こされた損傷がある程度可逆的だからである(成人でも)。しかし、彼らは生涯を通じて呼吸器感染症にかかりやすくなる可能性が高く、後の感染症の重症度は同年齢の他の人々よりもしばしば大きくなる[124][125]。
乳児の未熟児網膜症(ROP)は、しばしば介入なしで退縮し、後年の視力は正常になることがある[116]。疾患が手術を必要とする段階まで進行した場合、ステージ3 ROPの治療結果は一般的に良好だが、ステージ後期ではかなり悪化する[126]。手術は通常、目の解剖学的構造を修復するのには成功するが、疾患の進行による神経系への損傷により、視力回復の結果は比較的悪い[126]。他の合併症も存在すると、好ましいアウトカムが得られる可能性が低下する[126]。
補助酸素の提供は重症患者の生命維持に重要であり続け、一部の慢性疾患では生存率を高めることができるが、高酸素症と活性酸素種の生成はいくつかの生命を脅かす疾患の病因に関与している[41]。高酸素の毒性の影響は特に肺で顕著であり、血管変化が起こると脳循環と冠循環がリスクにさらされる[41]。長期的な高酸素症は免疫応答を害し、感染性合併症と組織損傷への感受性が高まる[41]。
疫学
[編集]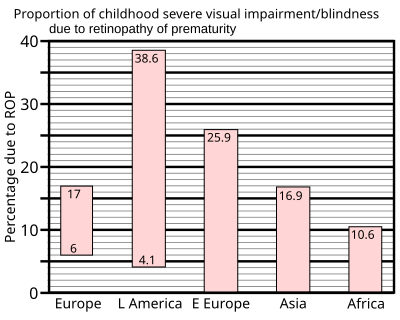
ダイバーの中枢神経系毒性の発生率は時代と共に減少している[127]。これは、酸素曝露と吸入酸素分圧を制限するガイドラインが開発されたためである[127]。1947年、ドナルドは純酸素を呼吸する深度を7.6 m (25 ft)に制限することを推奨した。これは酸素分圧1.8バール (180 kPa)に相当する[128]。 時間とともにこの制限は低下し、現在ではレクリエーションダイビング中は1.4バール (140 kPa)、浅い減圧停止中は1.6バール (160 kPa)の制限が一般的に推奨されている[129]。ただし、酸素リブリーザーを使用する軍のダイバーは、より大きなリスクを伴いながら、限られた期間でより深い深度で活動することがある[130]。酸素中毒は現在、機器の故障や人為的ミス以外では稀な出来事となっている。歴史的に、米海軍は酸素中毒事故を減らすために、海軍潜水マニュアルの空気および混合ガス表を改良してきた。1995年から1999年の間、ヘリウム-酸素表を使用した405回の水面支援下潜水の報告があり、そのうち6回の潜水(1.5%)で酸素中毒症状が観察された。その結果、米海軍は2000年にスケジュールを修正し、150回の潜水の現場テストを実施した。これらの潜水では酸素中毒の症状は一切見られなかった。改訂された表は2001年に発表された[131]。
耐性の変動性や作業負荷などの他の変動要因により、米海軍は酸素耐性のスクリーニングを廃止した。1976年から1997年の間に行われた6,250回の酸素耐性テストのうち、酸素中毒のエピソードは6回(0.1%)しか観察されなかった[95][96]。
高圧酸素療法を受けている患者の中枢神経系酸素中毒は稀であり、個人の感受性や治療プロトコル、おそらく治療の適応や使用機器など、多くの要因の影響を受ける。1996年のヴェルスラウの研究では、107,264人の患者集団のうち16件の事例(0.015%)が報告され、2003年のハンプソンとアティクの研究では発生率は0.03%であった[132][133]。イルディズ、アイ、キルデディは、1996年から2003年の間の36,500件の患者治療の要約で、酸素中毒事例はわずか3件で、発生率は0.008%だったと報告している[132]。その後の80,000件以上の患者治療のレビューでは、さらに低い発生率0.0024%が明らかになった。この発生率の低下は、酸素を供給するのにフードではなくマスクを使用するようになったことが一因かもしれない。マスクの方が死腔が少ないためである[134]。
高圧酸素療法の中枢神経毒性の全体的なリスクは2000〜3000回の治療に1回程度かもしれないが、圧力によって変動し、2.8〜3.0 絶対圧(ATA)より高圧の治療スケジュールでは200回に1回程度まで高くなることがあり、2 ATA以下のスケジュールでは10,000回に1回程度まで低くなることがある[44]。
気管支肺異形成症は早産児の最も一般的な合併症の一つであり、その発生率は極低出生体重児の生存率が向上するにつれて増加している。しかし、補助酸素の管理が改善されたことで重症度は低下し、現在ではこの疾患は主に高酸素症以外の要因に関連していると考えられている[49]。
1997年の先進国の新生児集中治療室の研究のまとめによると、低出生体重児の最大60%が未熟児網膜症を発症し、出生時体重が1 kg未満の超低出生体重児では72%まで上昇した。しかし、重症例の頻度は遥かに低く、出生時体重が1.5 kg未満の超低出生体重児の失明率は8%以下であることが分かった[39]。
補助酸素の投与は救急医療や集中治療医学で広範かつ効果的に使用されているが、過剰な酸素化によって生じる活性酸素種は、主に肺において細胞損傷、細胞死、炎症を特徴とする組織傷害の悪循環を引き起こす傾向があり、補助酸素が治療として意図された組織酸素化の問題を逆に悪化させる可能性がある[41]。同様の問題は、低酸素症を伴う慢性疾患の酸素療法でも起こりうる[41]。生理的必要性を超える過剰を最小限に抑えるよう酸素供給を慎重に調整することで、肺の高酸素曝露も合理的に実行可能な最小限に抑えられる[41]。 酸素中毒の肺症状の発生率は約5%で、抗がん剤のブレオマイシンなど、一部の薬剤がリスクを高める可能性がある[44]。
歴史
[編集]
酸素の発見は、1774年のイギリスのジョゼフ・プリーストリーによる[135][136][137]が、100年以上、その毒性が知られることはなかった。
中枢神経系の酸素毒性は、1878年にポール・ベール(Paul Bert)によって初めて記述された[138][139]。彼は高圧の酸素は、生物全般に非常に毒性が高いことを示した[140]。例えば、15-20気圧の空気にヒバリを曝すと、痙攣から死に至ることを実験で示した[140]。彼は酸素の分圧が急性毒性の決定的な要因であることを示したのである[140]。この業績にちなんで、中枢神経系の毒性は「ポール・ベール効果」と呼ばれることがある[18][3][140]。
肺への酸素毒性は、1899年にローレン・スミスによって初めて記述された[140]。彼は中枢神経系の毒性に注目し、マウスと鳥類を用いた実験で、0.43 bar (43 kPa)では影響がないが、0.75 bar (75 kPa)の酸素は肺に刺激を与えることを発見した[35]。肺毒性は「ローレン・スミス効果」と呼ばれることがある[18][3]。最初に記録されたヒトへの曝露は、1910年にボーンスタインによって行われ、2人の男性が30分間2.8バール (280 kPa)の酸素を呼吸し、彼自身は48分間まで症状なく続けた。1912年、ボーンスタインは51分間2.8 bar (280 kPa)の酸素を呼吸している間に手足のけいれんを起こした[5]。その後スミスは、酸素の少ない呼吸ガスに断続的に曝露することで肺が回復し、肺毒性の発症を遅らせることを示した[35]。
1935年、アルバート・ベーンケらが初めて、1.0バール (100 kPa)から4.1バール (410 kPa)の潜水で視野が狭くなる(視野狭窄)のを観察した[141][142]。第二次世界大戦中、ドナルドとヤーブローらは閉鎖式酸素リブリーザーの初期使用を支援するために、2,000回以上の酸素毒性実験を行った[50][143]。リブリーザー潜水の初期の海軍ダイバーたちは、海軍実験潜水部隊の「ウェットポット」(水を満たした高圧チャンバー)の底に潜んで不用心なダイバーを捕まえる"Oxygen Pete"という怪物についての神話を作り上げた。彼らは酸素中毒発作を起こすことを「Peteに捕まる」と呼んだ[144][145]。
第二次世界大戦後の10年間で、クリスチャン・ランバーツェンらは加圧下での酸素呼吸の影響と中毒の予防法についてさらなる発見を行った[146][147]。 酸素耐性の延長のための断続的曝露と、肺機能に基づく肺酸素毒性予測モデルに関する彼らの研究は、高圧酸素を呼吸する際の標準作業手順書の開発における重要な文書である[148]。中枢神経系症状の発症時間を短縮する二酸化炭素の影響を示したランバーツェンの研究は、当時の曝露ガイドラインから、その後のスキューバセット設計に至るまで影響を与えている[26][27][149]。
未熟児網膜症は第二次世界大戦以前には観察されなかったが、その後の10年間で補助酸素が利用可能になり、急速に先進国での乳児失明の主要な原因の一つとなった。1960年には、酸素の使用はリスク要因として特定され、その投与は制限された。その結果、未熟児網膜症は減少したが、乳児死亡率と低酸素症関連の合併症が増加した。それ以来、より洗練されたモニタリングと診断により、低酸素状態と未熟児網膜症の問題のバランスを取ることを目的とした酸素使用のプロトコルが確立された[39]。
気管支肺異形成症は1967年にノースウェイによって初めて記述され、診断につながる条件が概説された[150]。これは後にバンカラリによって拡張され、1988年にシェナンが、36週での補助酸素の必要性が長期的な結果を予測できると提案した[151]。しかし、1998年にパルタらは、X線撮影所見が長期的な影響の最も正確な予測因子であると結論づけた[152]。

1986年と1995年、ビッターマンらは暗闇とカフェインがラットの脳波活動の変化の発症を遅らせることを示した[28][29]。それ以来、中枢神経系毒性に関する研究は予防法と安全な耐性延長の方法に焦点が当てられてきた[153]。中枢神経系の酸素毒性への感受性は、概日リズム、薬物、年齢、性別などの要因の影響を受けることが示されている[154][155][156][157]。1988年、ロバート・ハミルトン・ジュニアらは海中居住施設運用のための酸素曝露限界を設定するために、アメリカ海洋大気庁(NOAA)のための手順を作成した[90][91][92]。しかし、今日でも、肺酸素毒性の予測モデルは高分圧酸素曝露のすべての結果を説明できていない[158]。
社会と文化
[編集]レクリエーションスキューバダイバーは一般的に40%までの酸素を含むナイトロックスを呼吸し、テクニカルダイバーは減圧を加速するために純酸素や80%までの酸素を含むナイトロックスを使用する。空気(21%)以上の酸素濃度を呼吸するダイバーは、酸素中毒の危険性とそのリスク管理方法について教育を受ける必要がある[80]。ナイトロックスを購入するには、ダイバーは関連する資格の証明を示すよう求められることがある[159]。
1990年代後半以来、酸素の娯楽的使用が酸素バーによって推進されており、顧客は鼻カニューレを通して酸素を呼吸する。これがストレスを軽減し、活力を増加させ、二日酔いや頭痛の影響を軽減するという主張がされているが、それを裏付ける科学的証拠は不足している[160]。また、体内の毒素を除去し、体脂肪を減少させるという主張とともに、「酸素マッサージ」や「酸素デトックス」を提供する装置も販売されている[161]。アメリカ肺協会(American Lung Association)は「バーで使用される低流量の酸素が正常な人の健康に危険であるというエビデンスはない」と述べているが、米国の医薬品評価研究センター(Center for Drug Evaluation and Research)は、心臓や肺の疾患を持つ人は補助酸素を慎重に調整する必要があり、酸素バーを使用すべきではないと注意を促している[160]。
サイエンス・フィクションの先駆者[162]、フランスのジュール・ヴェルヌが1872年に書いた短編小説「オクス博士の幻想」では、主人公のオクス(Ox)博士と助手のイグネ(Ygène)が疑わしい科学実験の果てに純酸素をキケンドーネ町全体にポンプで送り込み、その影響でいつもは穏やかな住民を攻撃的にしてしまうというものであった[163]。なお、OxとYgeneはあわせて、フランス語のOxygène、すなわち酸素を寓意している[163]。また、ヴェルヌの「月世界旅行」にも酸素中毒の短いエピソードがある[164]。なお、酸素の毒性が判明したのは、ヴェルヌによる「オクス博士の幻想」刊行から6年後の1878年のポール・ベール(Paul Bert)による実験によってである[138][139]。
脚注
[編集]注釈
[編集]- ^ 日本医学会医学用語辞典では酸素中毒にoxygen intoxication、酸素毒性にoxygen toxicityの訳語があてられている。oxygen toxicityは文脈で酸素による中毒とも毒性とも解される。
- ^ 酸素分圧の限度を1.46としている書籍もある[3]。
出典
[編集]- ^ a b c Donald, Part I 1947.
- ^ “酸素中毒 [JSME Mechanical Engineering Dictionary]”. www.jsme.or.jp. 日本機械学会. 2024年10月11日閲覧。
- ^ a b c d e f g h i 日本水中科学協会 2012, p. 56.
- ^ a b c Clark & Thom 2003, pp. 358–60.
- ^ a b Acott, Chris (1999). “Oxygen toxicity: A brief history of oxygen in diving”. South Pacific Underwater Medicine Society Journal 29 (3): 150–55. ISSN 0813-1988. OCLC 16986801. オリジナルの20 August 2008時点におけるアーカイブ。 29 April 2008閲覧。.
- ^ Beehler, CC (1964). “Oxygen and the eye”. Survey of Ophthalmology 9: 549–60. PMID 14232720.
- ^ a b c Fielder, Alistair R (1993). Fielder, Alistair R; Best, Anthony; Bax, Martin C O. eds. The Management of Visual Impairment in Childhood. London: Mac Keith Press : Distributed by Cambridge University Press. p. 33. ISBN 0-521-45150-7
- ^ a b c d e f Bennett, Michael H.; Cooper, Jeffrey S. (21 June 2022). Hyperbaric Cataracts. StatPearls Publishing LLC.. PMID 29261974 30 July 2022閲覧。.
- ^ Goldstein, JR; Mengel, CE (1969). “Hemolysis in mice exposed to varying levels of hyperoxia”. Aerospace Medicine 40 (1): 12–13. PMID 5782651.
- ^ Larkin, EC; Adams, JD; Williams, WT; Duncan, DM (1972). “Hematologic responses to hypobaric hyperoxia”. American Journal of Physiology 223 (2): 431–37. doi:10.1152/ajplegacy.1972.223.2.431. PMID 4403030.
- ^ Schaffner, Fenton; Felig, Philip (1965). “Changes in Hepatic Structure in Rats Produced by Breathing Pure Oxygen”. Journal of Cell Biology 27 (3): 505–17. doi:10.1083/jcb.27.3.505. PMC 2106769. PMID 5885427.
- ^ Caulfield, JB; Shelton, RW; Burke, JF (1972). “Cytotoxic effects of oxygen on striated muscle”. Archives of Pathology 94 (2): 127–32. PMID 5046798.
- ^ Bean, JW; Johnson, PC (1954). “Adrenocortical response to single and repeated exposure to oxygen at high pressure”. American Journal of Physiology 179 (3): 410–44. doi:10.1152/ajplegacy.1954.179.3.410. PMID 13228600.
- ^ Edstrom, JE; Rockert, H (1962). “The effect of oxygen at high pressure on the histology of the central nervous system and sympathetic and endocrine cells”. Acta Physiologica Scandinavica 55 (2–3): 255–63. doi:10.1111/j.1748-1716.1962.tb02438.x. PMID 13889254.
- ^ Gersh, I; Wagner, CE (1945). “Metabolic factors in oxygen poisoning”. American Journal of Physiology 144 (2): 270–77. doi:10.1152/ajplegacy.1945.144.2.270.
- ^ Hess, RT; Menzel, DB (1971). “Effect of dietary antioxidant level and oxygen exposure on the fine structure of the proximal convoluted tubules”. Aerospace Medicine 42 (6): 646–49. PMID 5155150.
- ^ Clark, John M (1974). “The toxicity of oxygen”. American Review of Respiratory Disease 110 (6 Pt 2): 40–50. doi:10.1164/arrd.1974.110.6P2.40. PMID 4613232. (subscription required)
- ^ a b c d e Patel, Dharmeshkumar N; Goel, Ashish; Agarwal, SB; Garg, Praveenkumar; Lakhani, Krishna K (2003). “Oxygen toxicity”. Journal, Indian Academy of Clinical Medicine 4 (3): 234–37. オリジナルの22 September 2015時点におけるアーカイブ。 28 September 2008閲覧。.
- ^ Clark & Lambertsen 1970, p. 159.
- ^ 日本水中科学協会 2012, pp. 144–145.
- ^ a b Clark & Thom 2003, p. 376.
- ^ a b c d Bitterman, N (2004). “CNS oxygen toxicity”. Undersea and Hyperbaric Medicine 31 (1): 63–72. PMID 15233161. オリジナルの20 August 2008時点におけるアーカイブ。 29 April 2008閲覧。.
- ^ Lang 2001, p. 82.
- ^ a b Richardson, Drew; Menduno, Michael; Shreeves, Karl, eds (1996). “Proceedings of rebreather forum 2.0”. Diving Science and Technology Workshop: 286. オリジナルの15 September 2008時点におけるアーカイブ。 20 September 2008閲覧。.
- ^ a b c d Richardson, Drew; Shreeves, Karl (1996). “The PADI enriched air diver course and DSAT oxygen exposure limits”. South Pacific Underwater Medicine Society Journal 26 (3). ISSN 0813-1988. OCLC 16986801. オリジナルの24 October 2008時点におけるアーカイブ。 2 May 2008閲覧。.
- ^ a b Bitterman, N; Melamed, Y; Perlman, I (1986). “CNS oxygen toxicity in the rat: role of ambient illumination”. Undersea Biomedical Research 13 (1): 19–25. PMID 3705247. オリジナルの13 January 2013時点におけるアーカイブ。 20 September 2008閲覧。.
- ^ a b Bitterman, N; Schaal, S (1995). “Caffeine attenuates CNS oxygen toxicity in rats”. Brain Research 696 (1–2): 250–53. doi:10.1016/0006-8993(95)00820-G. PMID 8574677.
- ^ a b c d e Loveman, Geoff A.M. (January 2017). Physical and physiological aspects of submarine tower escape (PDF) (Report). p. 16.
- ^ a b c d Clark & Thom 2003, p. 383.
- ^ Clark, John M; Lambertsen, Christian J (1971). “Pulmonary oxygen toxicity: a review”. Pharmacological Reviews 23 (2): 37–133. PMID 4948324.
- ^ a b c Clark, John M; Lambertsen, Christian J (1971). “Rate of development of pulmonary O2 toxicity in man during O2 breathing at 2.0 Ata”. Journal of Applied Physiology 30 (5): 739–52. doi:10.1152/jappl.1971.30.5.739. PMID 4929472.
- ^ Clark & Thom 2003, pp. 386–87.
- ^ a b c Smith, J Lorrain (1899). “The pathological effects due to increase of oxygen tension in the air breathed”. Journal of Physiology (London: The Physiological Society and Blackwell Publishing) 24 (1): 19–35. doi:10.1113/jphysiol.1899.sp000746. PMC 1516623. PMID 16992479. Note: 1 atmosphere (atm) is 1.013 bars.
- ^ Singer, Mervyn; Young, Paul J.; Laffey, John G.; Asfar, Pierre; Taccone, Fabio Silvio; Skrifvars, Markus B.; Meyhoff, Christian S.; Radermacher, Peter (2021-12-19). “Dangers of hyperoxia”. Critical Care 25 (1): 440. doi:10.1186/s13054-021-03815-y. ISSN 1364-8535. PMC PMC8686263. PMID 34924022.
- ^ a b c d e f g h i j k NOAA Diving Program (U.S.) (2001). Joiner, James T.. ed. NOAA Diving Manual, Diving for Science and Technology (4th ed.). Silver Spring, Maryland: National Oceanic and Atmospheric Administration, Office of Oceanic and Atmospheric Research, National Undersea Research Program. ISBN 978-0-941332-70-5
- ^ a b c d Smerz, RW (2004). “Incidence of oxygen toxicity during the treatment of dysbarism”. Undersea and Hyperbaric Medicine 31 (2): 199–202. PMID 15485081. オリジナルの13 May 2011時点におけるアーカイブ。 30 April 2008閲覧。.
- ^ a b c d e Gilbert, Clare (1997). “Retinopathy of prematurity: epidemiology”. Journal of Community Eye Health (London: International Centre for Eye Health) 10 (22): 22–24. オリジナルの31 January 2013時点におけるアーカイブ。 4 October 2008閲覧。.
- ^ Hochberg, C.H.; Semler, M.W.; Brower, R.G. (15 September 2021). “Oxygen Toxicity in Critically Ill Adults”. Am J Respir Crit Care Med 204 (6): 632–641. doi:10.1164/rccm.202102-0417CI. PMC 8521700. PMID 34086536.
- ^ a b c d e f g h
Helmerhorst, Hendrik J.F.; Schultz, Marcus J.; van der Voort, Peter H.J.; de Jonge, Evert; van Westerloo, David J. (1 December 2015). “Bench-to-bedside review: the effects of hyperoxia during critical illness”. Critical Care 19 (284): 284. doi:10.1186/s13054-015-0996-4. PMC 4538738. PMID 26278383.
 This article incorporates text from this source, which is available under the CC BY 4.0 license.
This article incorporates text from this source, which is available under the CC BY 4.0 license.
- ^ Hampson, Neal B; Simonson, Steven G; Kramer, CC; Piantadosi, Claude A (1996). “Central nervous system oxygen toxicity during hyperbaric treatment of patients with carbon monoxide poisoning”. Undersea and Hyperbaric Medicine 23 (4): 215–19. PMID 8989851. オリジナルの14 May 2011時点におけるアーカイブ。 29 April 2008閲覧。.
- ^ a b Lang 2001, p. 7.
- ^ a b c d e f g h Cooper, Jeffrey S.; Phuyal, Prabin; Shah, Neal (2024), Oxygen Toxicity, StatPearls Publishing, PMID 28613494 2024年12月14日閲覧。
- ^ a b c d e f Bitterman, H (2009). “Bench-to-bedside review: Oxygen as a drug”. Critical Care 13 (1): 205. doi:10.1186/cc7151. PMC 2688103. PMID 19291278.
- ^ a b c Jackson, RM (1985). “Pulmonary oxygen toxicity”. Chest 88 (6): 900–05. doi:10.1378/chest.88.6.900. PMID 3905287.
- ^ Demchenko, Ivan T; Welty-Wolf, Karen E; Allen, Barry W; Piantadosi, Claude A (2007). “Similar but not the same: normobaric and hyperbaric pulmonary oxygen toxicity, the role of nitric oxide”. American Journal of Physiology. Lung Cellular and Molecular Physiology 293 (1): L229–38. doi:10.1152/ajplung.00450.2006. PMID 17416738. オリジナルの22 March 2009時点におけるアーカイブ。 29 June 2009閲覧。.
- ^ Wittner, M; Rosenbaum, RM (1966). Pathophysiology of pulmonary oxygen toxicity. Proceedings of the Third International Conference on Hyperbaric Medicine. NAS/NRC, 1404, Washington DC. pp. 179–88. – and others as discussed by Clark & Lambertsen 1970, pp. 256–60
- ^ a b Bancalari, Eduardo; Claure, Nelson; Sosenko, Ilene RS (2003). “Bronchopulmonary dysplasia: changes in pathogenesis, epidemiology and definition”. Seminars in Neonatology (London: Elsevier Science) 8 (1): 63–71. doi:10.1016/S1084-2756(02)00192-6. PMID 12667831.
- ^ a b Yarbrough, OD; Welham, W; Brinton, ES; Behnke, Alfred R (1947). “Symptoms of Oxygen Poisoning and Limits of Tolerance at Rest and at Work”. Navy Experimental Diving Unit Technical Report 47-01 (United States Navy Experimental Diving Unit Technical Report). オリジナルの13 January 2013時点におけるアーカイブ。 29 April 2008閲覧。.
- ^ a b c Anderson, B; Farmer, Joseph C (1978). “Hyperoxic myopia”. Transactions of the American Ophthalmological Society 76: 116–24. PMC 1311617. PMID 754368.
- ^ Ricci, B; Lepore, D; Iossa, M; Santo, A; D'Urso, M; Maggiano, N (1990). “Effect of light on oxygen-induced retinopathy in the rat model. Light and OIR in the rat”. Documenta Ophthalmologica 74 (4): 287–301. doi:10.1007/BF00145813. PMID 1701697.
- ^ a b c Drack, AV (1998). “Preventing blindness in premature infants”. New England Journal of Medicine 338 (22): 1620–21. doi:10.1056/NEJM199805283382210. PMID 9603802.
- ^ a b Butler, Frank K; White, E; Twa, M (1999). “Hyperoxic myopia in a closed-circuit mixed-gas scuba diver”. Undersea and Hyperbaric Medicine 26 (1): 41–45. PMID 10353183. オリジナルの7 October 2008時点におけるアーカイブ。 29 April 2009閲覧。.
- ^ Nichols, CW; Lambertsen, Christian (1969). “Effects of high oxygen pressures on the eye”. New England Journal of Medicine 281 (1): 25–30. doi:10.1056/NEJM196907032810106. PMID 4891642.
- ^ Shykoff, Barbara E (2005). “Repeated Six-Hour Dives 1.35 ATM Oxygen Partial Pressure”. Nedu-Tr-05-20 (Panama City, FL: US Navy Experimental Diving Unit Technical Report). オリジナルの22 November 2008時点におけるアーカイブ。 19 September 2008閲覧。.
- ^ Shykoff, Barbara E (2008). “Pulmonary effects of submerged oxygen breathing in resting divers: repeated exposures to 140 kPa”. Undersea and Hyperbaric Medicine 35 (2): 131–43. PMID 18500077.
- ^ a b c Anderson Jr, B; Shelton, DL (1987). “Axial length in hyperoxic myopia”. In: Bove, Alfred A; Bachrach, Arthur J; Greenbaum, Leon (Eds.) Ninth International Symposium of the UHMS (Undersea and Hyperbaric Medical Society): 607–11.
- ^ Schaal, S; Beiran, I; Rubinstein, I; Miller, B; Dovrat, A (2005). “Oxygen effect on ocular lens” (ヘブライ語). Harefuah 144 (11): 777–80, 822. PMID 16358652.
- ^ Clark & Thom 2003, p. 360.
- ^ Rhee, SG (2006). “Cell signaling. H2O2, a necessary evil for cell signaling”. Science 312 (5782): 1882–83. doi:10.1126/science.1130481. PMID 16809515.
- ^ Thom, Steven R (1992). “Inert gas enhancement of superoxide radical production”. Archives of Biochemistry and Biophysics 295 (2): 391–96. doi:10.1016/0003-9861(92)90532-2. PMID 1316738.
- ^ Ghio, Andrew J; Nozik-Grayck, Eva; Turi, Jennifer; Jaspers, Ilona; Mercatante, Danielle R; Kole, Ryszard; Piantadosi, Claude A (2003). “Superoxide-dependent iron uptake: a new role for anion exchange protein 2”. American Journal of Respiratory Cell and Molecular Biology 29 (6): 653–60. doi:10.1165/rcmb.2003-0070OC. PMID 12791678. オリジナルの30 September 2011時点におけるアーカイブ。 29 June 2009閲覧。.
- ^ Fridovich, I (1998). “Oxygen toxicity: a radical explanation”. Journal of Experimental Biology 201 (8): 1203–09. doi:10.1242/jeb.201.8.1203. PMID 9510531.
- ^ Piantadosi, Claude A (2008). “Carbon Monoxide, Reactive Oxygen Signaling, and Oxidative Stress”. Free Radical Biology & Medicine 45 (5): 562–69. doi:10.1016/j.freeradbiomed.2008.05.013. PMC 2570053. PMID 18549826.
- ^ Imlay, JA (2003). “Pathways of oxidative damage”. Annual Review of Microbiology 57: 395–418. doi:10.1146/annurev.micro.57.030502.090938. PMID 14527285.
- ^ Bowen, R. “Free Radicals and Reactive Oxygen”. Colorado State University. 12 May 2008時点のオリジナルよりアーカイブ。26 September 2008閲覧。
- ^ Oury, TD; Ho, YS; Piantadosi, Claude A; Crapo, JD (1992). “Extracellular superoxide dismutase, nitric oxide, and central nervous system O2 toxicity”. Proceedings of the National Academy of Sciences of the United States of America 89 (20): 9715–19. Bibcode: 1992PNAS...89.9715O. doi:10.1073/pnas.89.20.9715. PMC 50203. PMID 1329105.
- ^ Thom, Steven R; Marquis, RE (1987). “Free radical reactions and the inhibitory and lethal actions of high-pressure gases”. Undersea Biomedical Research 14 (6): 485–501. PMID 2825395. オリジナルの13 January 2013時点におけるアーカイブ。 26 September 2008閲覧。.
- ^ Djurhuus, R; Svardal, AM; Thorsen, E (1999). “Glutathione in the cellular defense of human lung cells exposed to hyperoxia and high pressure”. Undersea and Hyperbaric Medicine 26 (2): 75–85. PMID 10372426. オリジナルの11 August 2011時点におけるアーカイブ。 26 September 2008閲覧。.
- ^ Freiberger, John J; Coulombe, Kathy; Suliman, Hagir; Carraway, Martha-sue; Piantadosi, Claude A (2004). “Superoxide dismutase responds to hyperoxia in rat hippocampus”. Undersea and Hyperbaric Medicine 31 (2): 227–32. PMID 15485085. オリジナルの13 January 2013時点におけるアーカイブ。 26 September 2008閲覧。.
- ^ Kim, YS; Kim, SU (1991). “Oligodendroglial cell death induced by oxygen radicals and its protection by catalase”. Journal of Neuroscience Research 29 (1): 100–06. doi:10.1002/jnr.490290111. PMID 1886163.
- ^ a b c “未熟児網膜症 - 19. 小児科”. MSDマニュアル プロフェッショナル版. 2024年12月14日閲覧。
- ^ Regillo, Brown & Flynn 1998, p. 178.
- ^ a b “Nursing guidelines: Oxygen saturation SpO2 level targeting in neonates”. The Royal Children's Hospital, Melbourne. 22 December 2023閲覧。
- ^ a b c d e Doolette, D.J.; Mitchell, S.J. (June 2018). “In-water recompression”. Diving Hyperb Med 48 (2): 84–95. doi:10.28920/dhm48.2.84-95. PMC 6156824. PMID 29888380.
- ^ a b Mitchell, Simon J; Bennett, Michael H; Bird, Nick; Doolette, David J; Hobbs, Gene W; Kay, Edward; Moon, Richard E; Neuman, Tom S et al. (2012). “Recommendations for rescue of a submerged unresponsive compressed-gas diver”. Undersea & Hyperbaric Medicine 39 (6): 1099–108. PMID 23342767. オリジナルの15 April 2013時点におけるアーカイブ。 13 March 2013閲覧。.
- ^ Clark & Thom 2003, p. 375.
- ^ a b 日本水中科学協会 2012, p. 146.
- ^ a b c d Lang 2001, p. 195.
- ^ a b Butler, F. K. (2004). “Closed-circuit oxygen diving in the U.S. Navy” (PDF). Undersea & Hyperbaric Medicine: Journal of the Undersea and Hyperbaric Medical Society, Inc 31 (1): 3–20. ISSN 1066-2936. PMID 15233156.
- ^ Butler, F. K.; Thalmann, E. D. (1986-06). “Central nervous system oxygen toxicity in closed circuit scuba divers II”. Undersea Biomedical Research 13 (2): 193–223. ISSN 0093-5387. PMID 3727183.
- ^ Clark & Lambertsen 1970, pp. 157–62.
- ^ Baker, Erik C (2000年). “Oxygen toxicity calculations”. 29 June 2009閲覧。
- ^ a b Shearwater Research (15 January 2020). Perdix Operating Manual (DOC. 13007-SI-RevD (2020-01-15) ed.) 16 July 2020閲覧。
- ^ Parker, Martin (Nov 2012). “Rebreather user manual”. www.apdiving.com. Ambient Pressure Diving Ltd. 11 May 2021閲覧。
- ^ a b “The Difference Between Scuba Diving Gas Mixes” (英語). Diving in Elba (2019年7月30日). 2024年12月15日閲覧。
- ^ Hamilton & Thalmann 2003, pp. 475, 479.
- ^ Clark & Lambertsen 1970, p. 270.
- ^ a b Hamilton, RW; Kenyon, David J; Peterson, RE; Butler, GJ; Beers, DM (1988). “Repex habitat diving procedures: Repetitive vertical excursions, oxygen limits, and surfacing techniques”. Technical Report 88-1A (Rockville, MD: NOAA Office of Undersea Research). オリジナルの22 November 2008時点におけるアーカイブ。 29 April 2008閲覧。.
- ^ a b Hamilton, Robert W; Kenyon, David J; Peterson, RE (1988). “Repex habitat diving procedures: Repetitive vertical excursions, oxygen limits, and surfacing techniques”. Technical Report 88-1B (Rockville, MD: NOAA Office of Undersea Research). オリジナルの22 November 2008時点におけるアーカイブ。 29 April 2008閲覧。.
- ^ a b Hamilton, Robert W (1997). “Tolerating oxygen exposure”. South Pacific Underwater Medicine Society Journal 27 (1). ISSN 0813-1988. OCLC 16986801. オリジナルの20 August 2008時点におけるアーカイブ。 29 April 2008閲覧。.
- ^ Kot, Jacek; Sicko, Zdzislaw; Doboszynski, Tadeusz (2015). “The Extended Oxygen Window Concept for Programming Saturation Decompressions Using Air and Nitrox”. PLOS ONE 10 (6): 1–20. Bibcode: 2015PLoSO..1030835K. doi:10.1371/journal.pone.0130835. PMC 4482426. PMID 26111113.
- ^ a b c d Ghosh, D.K.; Kodange, C.; Mohanty, C.S.; Sarkar, S.; Verma, Rohit (2015). “Oxygen tolerance test : A standardised protocol”. Journal of Marine Medical Society 17: 30. doi:10.4103/0975-3605.203391.
- ^ a b Walters, KC; Gould, MT; Bachrach, EA; Butler, Frank K (2000). “Screening for oxygen sensitivity in U.S. Navy combat swimmers”. Undersea and Hyperbaric Medicine 27 (1): 21–26. PMID 10813436. オリジナルの7 October 2008時点におけるアーカイブ。 2 October 2008閲覧。.
- ^ a b Butler, Frank K; Knafelc, ME (1986). “Screening for oxygen intolerance in U.S. Navy divers”. Undersea Biomedical Research 13 (1): 91–98. PMID 3705251. オリジナルの20 August 2008時点におけるアーカイブ。 2 October 2008閲覧。.
- ^ Latham, Emi (7 November 2008). “Hyperbaric Oxygen Therapy: Contraindications”. Medscape. 25 September 2008閲覧。
- ^ Moon, Richard E.; Mitchell, Simon (2019 Sep - Dec - Fourth Quarter). “Hyperbaric treatment for decompression sickness: current recommendations”. Undersea & Hyperbaric Medicine: Journal of the Undersea and Hyperbaric Medical Society, Inc 46 (5): 685–693. ISSN 1066-2936. PMID 31683368.
- ^ Schatte, CL (1977). “Dietary selenium and vitamin E as a possible prophylactic to pulmonary oxygen poisoning”. Proceedings of the Sixth International Congress on Hyperbaric Medicine, University of Aberdeen, Aberdeen, Scotland (Aberdeen: Aberdeen University Press): 84–91. ISBN 0-08-024918-3. OCLC 16428246.
- ^ Boadi, WY; Thaire, L; Kerem, D; Yannai, S (1991). “Effects of dietary supplementation with vitamin E, riboflavin and selenium on central nervous system oxygen toxicity”. Pharmacology & Toxicology 68 (2): 77–82. doi:10.1111/j.1600-0773.1991.tb02039.x. PMID 1852722.
- ^ Piantadosi, Claude A (2006). In: The Mysterious Malady: Toward an understanding of decompression injuries (DVD). Global Underwater Explorers. 2012年4月2日閲覧。
- ^ Stone, WL; Henderson, RA; Howard, GH; Hollis, AL; Payne, PH; Scott, RL (1989). “The role of antioxidant nutrients in preventing hyperbaric oxygen damage to the retina”. Free Radical Biology & Medicine 6 (5): 505–12. doi:10.1016/0891-5849(89)90043-9. PMID 2744583.
- ^ “UK Retinopathy of Prematurity Guideline”. Royal College of Paediatrics and Child Health, Royal College of Ophthalmologists & British Association of Perinatal Medicine. p. i (2007年). 18 February 2012時点のオリジナルよりアーカイブ。2 April 2009閲覧。
- ^ Silverman, William (1980). Retrolental Fibroplasia: A Modern Parable. Grune & Stratton. pp. 39, 41, 143. ISBN 978-0-8089-1264-4
- ^ a b Webb, James T; Olson, RM; Krutz, RW; Dixon, G; Barnicott, PT (1989). “Human tolerance to 100% oxygen at 9.5 psia during five daily simulated 8-hour EVA exposures”. Aviation, Space, and Environmental Medicine 60 (5): 415–21. doi:10.4271/881071. PMID 2730484.
- ^ “高気圧酸素療法”. 日本救急医学会. 日本救急医学会. 2024年12月20日閲覧。
- ^ “Standardizing CCR rescue skills”. RebreatherWorld (20 January 2008). 3 March 2012時点のオリジナルよりアーカイブ。26 May 2009閲覧。 This forum post's author chairs the diving committee of the Undersea and Hyperbaric Medical Society.
- ^ a b c Thalmann, Edward D (2 December 2003). “OXTOX: If You Dive Nitrox You Should Know About OXTOX”. Divers Alert Network. 11 October 2015閲覧。 – Section "What do you do if oxygen toxicity or a convulsion happens?"
- ^ 池田知純 1995, pp. 56–57.
- ^ a b “気管支肺異形成症(Bronchopulmonary Dysplasia:BPD) - 19. 小児科”. MSDマニュアル プロフェッショナル版. 2024年12月20日閲覧。
- ^ a b “Bronchopulmonary dysplasia: MedlinePlus Medical Encyclopedia” (英語). medlineplus.gov. 2024年12月20日閲覧。
- ^ a b c “未熟児網膜症(ROP) - 23. 小児の健康上の問題”. MSDマニュアル家庭版. 2024年12月20日閲覧。
- ^ Regillo, Brown & Flynn 1998, p. 184.
- ^ de Jong, Feiko J. M.; Wingelaar, Thijs T.; Brinkman, Paul; van Ooij, Pieter-Jan A. M.; Maitland-van der Zee, Anke-Hilse; Hollmann, Marcus W.; van Hulst, Rob A. (2022-05-10). “Pulmonary Oxygen Toxicity Through Exhaled Breath Markers After Hyperbaric Oxygen Treatment Table 6” (English). Frontiers in Physiology 13. doi:10.3389/fphys.2022.899568. ISSN 1664-042X.
- ^ 山見信夫 2021, pp. 198–200.
- ^ “Suunto EON Core - 参照 - ダイビング用語”. Suunto. 2024年10月12日閲覧。
- ^ a b c d e Arieli, R. (30 September 2019). “Calculated risk of pulmonary and central nervous system oxygen toxicity: a toxicity index derived from the power equation”. Diving Hyperb Med 49 (3): 154–160. doi:10.28920/dhm49.3.154-160. PMC 6881196. PMID 31523789.
- ^ Lambertsen, Christian J (1965). Fenn, WO; Rahn, H. eds. “Effects of oxygen at high partial pressure”. Handbook of Physiology: Respiration (American Physiological Society) Sec 3 Vol 2: 1027–46.
- ^ “National Institutes of Health: What is bronchopulmonary dysplasia?”. U.S. Department of Health & Human Services. 2 October 2008閲覧。
- ^ Spear, Michael L – reviewer (June 2008). “Bronchopulmonary dysplasia (BPD)”. Nemours Foundation. 3 October 2008閲覧。
- ^ a b c Regillo, Brown & Flynn 1998, p. 190.
- ^ a b “Developing Oxygen Toxicity Guidelines” (英語). Divers Alert Network. 2024年12月15日閲覧。
- ^ Donald, Part II 1947.
- ^ Lang 2001, p. 183.
- ^ Wingelaar, T.T.; van Ooij, P.A.M; Van Hulst, R.A. (2017). “Oxygen Toxicity and Special Operations Forces Diving: Hidden and Dangerous”. Frontiers in Psychology 8: 1263. doi:10.3389/fpsyg.2017.01263. PMC 5524741. PMID 28790955.
- ^ Gerth, Wayne A (2006). “Decompression sickness and oxygen toxicity in U.S. Navy surface-supplied He-O2 diving”. Proceedings of Advanced Scientific Diving Workshop (Smithsonian Institution). オリジナルの21 February 2009時点におけるアーカイブ。 2 October 2008閲覧。.
- ^ a b Yildiz, S; Ay, H; Qyrdedi, T (2004). “Central nervous system oxygen toxicity during routine hyperbaric oxygen therapy”. Undersea and Hyperbaric Medicine (Undersea and Hyperbaric Medical Society, Inc) 31 (2): 189–90. PMID 15485078. オリジナルの13 January 2013時点におけるアーカイブ。 3 October 2008閲覧。.
- ^ Hampson, Neal; Atik, D (2003). “Central nervous system oxygen toxicity during routine hyperbaric oxygen therapy”. Undersea and Hyperbaric Medicine (Undersea and Hyperbaric Medical Society, Inc) 30 (2): 147–53. PMID 12964858. オリジナルの13 January 2013時点におけるアーカイブ。 20 October 2008閲覧。.
- ^ Yildiz, S; Aktas, S; Cimsit, M; Ay, H; Togrol, E (2004). “Seizure incidence in 80,000 patient treatments with hyperbaric oxygen”. Aviation, Space, and Environmental Medicine 75 (11): 992–94. PMID 15559001 1 July 2009閲覧。.
- ^ Cook & Lauer (1968).
- ^ Emsley (2001), p. 299.
- ^ Cook & Lauer (1968), p. 499.
- ^ a b Bert, Paul (1943). Barometric pressure: Researches in Experimental Physiology. Columbus, OH: College Book Company Translated by: Hitchcock, Mary Alice; Hitchcock, Fred A
- ^ a b British Sub-aqua Club (1985). Sport diving : the British Sub-Aqua Club diving manual. London: Stanley Paul. p. 110. ISBN 0-09-163831-3. OCLC 12807848
- ^ a b c d e Zhu, Hong; Traore, Kassim; Santo, Arben; Trush, Michael A.; Li, Y. Robert (2016-01). “Oxygen and Oxygen Toxicity: The Birth of Concepts”. Reactive Oxygen Species (Apex, N.C.) 1 (1): 1–8. doi:10.20455/ros.2016.801. ISSN 2380-2367. PMC 5921831. PMID 29707642.
- ^ Behnke, Alfred R; Johnson, FS; Poppen, JR; Motley, EP (1935). “The effect of oxygen on man at pressures from 1 to 4 atmospheres”. American Journal of Physiology 110 (3): 565–72. doi:10.1152/ajplegacy.1934.110.3.565. Note: 1 atmosphere (atm) is 1.013 bars.
- ^ Behnke, Alfred R; Forbes, HS; Motley, EP (1935). “Circulatory and visual effects of oxygen at 3 atmospheres pressure”. American Journal of Physiology 114 (2): 436–42. doi:10.1152/ajplegacy.1935.114.2.436. Note: 1 atmosphere (atm) is 1.013 bars.
- ^ Donald 1992.
- ^ “Oxygen Enriched Air: A New Breathing Mix?”. IANTD Journal (1993年). 10 June 2020時点のオリジナルよりアーカイブ。29 May 2008閲覧。
- ^ Davis, Robert H (1955). Deep Diving and Submarine Operations (6th ed.). Tolworth, Surbiton, Surrey: Siebe Gorman & Company Ltd. p. 291
- ^ Lambertsen, Christian J; Clark, John M; Gelfand, R (2000). “The Oxygen research program, University of Pennsylvania: Physiologic interactions of oxygen and carbon dioxide effects and relations to hyperoxic toxicity, therapy, and decompression. Summation: 1940 to 1999”. EBSDC-IFEM Report No. 3-1-2000 (Philadelphia, PA: Environmental Biomedical Stress Data Center, Institute for Environmental Medicine, University of Pennsylvania Medical Center).
- ^ Vann, Richard D (2004). “Lambertsen and O2: Beginnings of operational physiology”. Undersea and Hyperbaric Medicine 31 (1): 21–31. PMID 15233157. オリジナルの13 June 2008時点におけるアーカイブ。 29 April 2008閲覧。.
- ^ Clark & Lambertsen 1970.
- ^ Lang 2001, pp. 81–86.
- ^ Northway, WH; Rosan, RC; Porter, DY (1967). “Pulmonary disease following respirator therapy of hyaline-membrane disease. Bronchopulmonary dysplasia”. New England Journal of Medicine 276 (7): 357–68. doi:10.1056/NEJM196702162760701. PMID 5334613.
- ^ Shennan, AT; Dunn, MS; Ohlsson, A; Lennox, K; Hoskins, EM (1988). “Abnormal pulmonary outcomes in premature infants: prediction from oxygen requirement in the neonatal period”. Pediatrics 82 (4): 527–32. doi:10.1542/peds.82.4.527. PMID 3174313.
- ^ Palta, Mari; Sadek, Mona; Barnet, Jodi H et al. (January 1998). “Evaluation of criteria for chronic lung disease in surviving very low birth weight infants. Newborn Lung Project”. Journal of Pediatrics 132 (1): 57–63. doi:10.1016/S0022-3476(98)70485-8. PMID 9470001.
- ^ Natoli, MJ; Vann, Richard D (1996). “Factors Affecting CNS Oxygen Toxicity in Humans”. Report to the U.S. Office of Naval Research (Durham, NC: Duke University). オリジナルの20 August 2008時点におけるアーカイブ。 29 April 2008閲覧。.
- ^ Hof, DG; Dexter, JD; Mengel, CE (1971). “Effect of circadian rhythm on CNS oxygen toxicity”. Aerospace Medicine 42 (12): 1293–96. PMID 5130131.
- ^ Torley, LW; Weiss, HS (1975). “Effects of age and magnesium ions on oxygen toxicity in the neonate chicken”. Undersea Biomedical Research 2 (3): 223–27. PMID 15622741. オリジナルの13 January 2013時点におけるアーカイブ。 20 September 2008閲覧。.
- ^ Troy, SS; Ford, DH (1972). “Hormonal protection of rats breathing oxygen at high pressure”. Acta Neurologica Scandinavica 48 (2): 231–42. doi:10.1111/j.1600-0404.1972.tb07544.x. PMID 5061633.
- ^ Hart, George B; Strauss, Michael B (2007). “Gender differences in human skeletal muscle and subcutaneous tissue gases under ambient and hyperbaric oxygen conditions”. Undersea and Hyperbaric Medicine 34 (3): 147–61. PMID 17672171. オリジナルの13 January 2013時点におけるアーカイブ。 20 September 2008閲覧。.
- ^ Shykoff, Barbara E (2007). “Performance of various models in predicting vital capacity changes caused by breathing high oxygen partial pressures”. Nedu-Tr-07-13 (Panama City, FL: U.S. Naval Experimental Diving Unit Technical Report). オリジナルの22 November 2008時点におけるアーカイブ。 6 June 2008閲覧。.
- ^ British Sub-Aqua Club (2006年). “The Ocean Diver Nitrox Workshop”. British Sub-Aqua Club. p. 6. 16 July 2011時点のオリジナルよりアーカイブ。15 September 2010閲覧。
- ^ a b Bren, Linda (November–December 2002). "Oxygen Bars: Is a Breath of Fresh Air Worth It?". FDA Consumer. Vol. 36, no. 6. pp. 9–11. PMID 12523293. 2020年3月25日閲覧。
- ^ “O2 Planet – Exercise and Fitness Equipment”. O2Planet LLC (2006年). 15 April 2006時点のオリジナルよりアーカイブ。21 October 2008閲覧。
- ^ Verne 2004, p. vii.
- ^ a b Verne 2004, p. ix.
- ^ Verne, Jules (1877). “VIII [At seventy-eight thousand one hundred and fourteen leagues]”. Autour de la Lune [Round the Moon]. London: Ward Lock. ISBN 2-253-00587-8 2 September 2009閲覧。 Translated from French
参考文献
[編集]- Clark, James M; Thom, Stephen R (2003). “Oxygen under pressure”. In Brubakk, Alf O; Neuman, Tom S. Bennett and Elliott's physiology and medicine of diving (5th ed.). United States: Saunders. pp. 358–418. ISBN 978-0-7020-2571-6. OCLC 51607923
- Clark, John M; Lambertsen, Christian J (1970). “Pulmonary oxygen tolerance in man and derivation of pulmonary oxygen tolerance curves”. IFEM Report No. 1-70 (Philadelphia, PA: Environmental Biomedical Stress Data Center, Institute for Environmental Medicine, University of Pennsylvania Medical Center).
- Donald, Kenneth W (1947). “Oxygen Poisoning in Man: Part I”. British Medical Journal 1 (4506): 667–72. doi:10.1136/bmj.1.4506.667. PMC 2053251. PMID 20248086.
- Donald, Kenneth W (1947). “Oxygen Poisoning in Man: Part II”. British Medical Journal 1 (4507): 712–17. doi:10.1136/bmj.1.4507.712. PMC 2053400. PMID 20248096.
- Revised version of Donald's articles also available as:
- Donald, Kenneth W (1992). Oxygen and the diver. UK: Harley Swan, 237 pages. ISBN 1-85421-176-5. OCLC 26894235
- Hamilton, Robert W; Thalmann, Edward D (2003). “Decompression practice”. In Brubakk, Alf O; Neuman, Tom S. Bennett and Elliott's physiology and medicine of diving (5th ed.). United States: Saunders. pp. 475–79. ISBN 978-0-7020-2571-6. OCLC 51607923
- Lang, Michael A, ed (2001). DAN nitrox workshop proceedings. Durham, NC: Divers Alert Network, 197 pages. オリジナルの16 September 2011時点におけるアーカイブ。 20 September 2008閲覧。
- Regillo, Carl D; Brown, Gary C; Flynn, Harry W (1998). Vitreoretinal Disease: The Essentials. New York: Thieme, 693 pages. ISBN 978-0-86577-761-3. OCLC 39170393
- U.S. Navy Supervisor of Diving (2011). U.S. Navy Diving Manual (SS521-AG-PRO-010 0910-LP-106-0957, revision 6 with Change A entered ed.). U.S. Naval Sea Systems Command. オリジナルの10 December 2014時点におけるアーカイブ。 29 January 2015閲覧。
- 日本水中科学協会 (2012). 最新ダイビング用語事典. 成山堂書店. ISBN 9784425954810
- 池田知純『潜水医学入門』大修館書店、1995年8月20日。ISBN 4469263125。
- 山見信夫『ドクター山見のダイビング医学』成山堂書店、2021年7月18日。ISBN 9784425956319。
- Verne, Jules (2004) [1872]. A Fantasy of Dr Ox. Hesperus Press. ISBN 978-1-84391-067-1 8 May 2009閲覧。
- Cook, Gerhard A.; Lauer, Carol M. (1968). “Oxygen”. In Hampel, Clifford A. The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. pp. 499-512. LCCN 68--29938
- Emsley, John (2001). “Oxygen”. Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. pp. 297-304. ISBN 0198503407
関連文献
[編集]- Lamb, John S. (1999). The Practice of Oxygen Measurement for Divers. Flagstaff: Best Publishing, 120 pages. ISBN 0-941332-68-3. OCLC 44018369
- Lippmann, John; Bugg, Stan (1993). The Diving Emergency Handbook. Teddington, UK: Underwater World Publications. ISBN 0-946020-18-3. OCLC 52056845
- Lippmann, John; Mitchell, Simon (2005). “Oxygen”. Deeper into Diving (2nd ed.). Victoria, Australia: J.L. Publications. pp. 121–24. ISBN 0-9752290-1-X. OCLC 66524750
- 眞野喜洋 編『潜水医学』朝倉書店、1992年6月15日。ISBN 4254310722。