水素化アルミニウム
| 水素化アルミニウム | |
|---|---|
| |
Aluminium hydride | |
Alumane | |
別称 アラン Aluminic hydride | |
| 識別情報 | |
| CAS登録番号 | 7784-21-6 |
| PubChem | 1448814399066 (2H3)16721258 (3H3) |
| ChemSpider | 13833 17625618 (3H3) |
| ChEBI | |
| Gmelin参照 | 245 |
| |
| |
| 特性 | |
| 化学式 | AlH3 |
| モル質量 | 29.99 g/mol |
| 外観 | 白色の結晶 |
| 密度 | 1.486 g/cm3, 固体 |
| 融点 |
150 °C |
| 沸点 |
分解 |
| 関連する物質 | |
| 関連物質 | 水素化アルミニウムリチウム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
水素化アルミニウム(すいそかアルミニウム、aluminum hydride)またはアラン(alane)は、無色の固体で化学式がAlH3で表される無機化合物である。極めて酸化されやすく空気中で自然発火するため危険物第3類に分類されている。そのため研究室内で還元剤として有機合成に使われる[1]以外ほとんど見られない。
構造
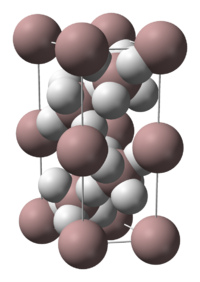
[編集]アランはポリマー構造をとり、その化学式はよく(AlH3)nと表される。アランは多数の多形体をとり、それぞれα-アラン、α’-アラン、β-アラン、δ-アラン、ε-アラン、θ-アラン、およびγ-アランと名付けられている。α-アランは立方晶または菱面体晶の形態ととるのに対し、α’-アランは針状結晶、γ-アランは結合した針の束状構造を作る。アランはテトラヒドロフランとエーテルに溶け、エーテルでの沈殿量はその調製法に依存する[2]。
α-アランは、アルミニウム原子が6個の水素原子に囲まれ、別のアルミニウム原子とはそれで架橋されている構造で決定された。Al-H間の距離はすべて同じ172 pmで、Al-H-Alの角度は141°である[3]。
 |
 |
 |
α-アランは、最も熱的に安定な多形体である。β-アランとγ-アランは同時に合成され、熱するとα-アランに変わる。δ、ε、θ-アランはいろいろな結晶化条件で合成される。それらは安定ではないが、熱してもα-アランにはならない[2]。
アランの分子構造
[編集]単量体のAlH3は、固体の希ガスマトリックス内の低温条件下で単離したところ平面形であることが示された[4]。二量体のAl2H6 を固体水素中で単離したところ、ジボラン(B2H6)とジガラン(Ga2H6)と同形であった[5][6]。
合成
[編集]水素化アルミニウムの不純物と関連化合物は古くから報告されている[7]。初めて合成法が公開されたのは1947年で、アメリカでは合成の特許が1999年にペトリらに割り当てられている[8][9]。
現在では水素貯蔵に利用するためよりアミンを利用したより簡単で水素・アルミ以外の原料を必要としない合成法が研究されている。
塩化物を利用した合成法
[編集]主に水素化アルミニウムリチウムのエーテル溶液と塩化アルミニウムから合成される[10]。この合成法は手順が複雑であり、反応後に塩化リチウムを除去しなければならないことにも留意する必要がある。
塩化リチウムの沈殿の後、水素化アルミニウムのエーテル溶液が得られる。
なお、水素化アルミニウムリチウムからの生成は以下の方法でもできる。
アミンを利用した合成法
[編集]アランのアミン付加化合物はアルミ・アラン・水素を直接反応させて合成することができる(安定化(stabilization))。これからアミンを取り外してアランを合成する。(分離(separation))[13][14]
- 水素・アミン・アルミの直接合成
- 触媒作用のあるアルミおよび安定化分子(例:アミン(TEDA、TMA)、エーテル(THF、Et2O、Me2O))を以て安定な分子を作成する。
- 例1:トリメチルアミン(TMA)アラン
- P < 230 bar T = 300 K
- 例2:ジメチルエチルアミン(DMEA)アラン
- P < 60 bar T = 300 K
- アミン交換 (transamination)
- アミンをトリエチルアミン(TEA)に置き換える。
- T = 50℃, Pi = 1 bar
- Pf = 26 mbar, 4.5 hrs
- 分離
- 70℃,<100mbarの真空中でTEAを分離する
電気化学的合成
[編集]いくつかのグループは、アランが電気化学的に生成できることを示している。[15][16][17][18][19]また、さまざまな電気化学的アラン製造方法の特許が取得されている。[20][21]電気化学的に生成するアランイオンは、前述の方法による塩化物不純物を回避できる。
電解質として、水素化ナトリウムアルミニウムが、溶媒としてテトラヒドロフラン(THF)が用いられる。溶媒中でテトラヒドリドアルミン酸アニオン ([AlH4]-) とナトリウムカチオン (Na+)に分かれるため、これを電気分解することで水素化アルミニウムを生成する寸法である。
電気分解すると、不溶性の電極を使うと1の、陽極にアルミニウムを使うと2の化学反応が起きる。
副反応を防止するために、2の化学反応に加えClasenは水銀(Hg)に沈めた鉄ワイヤーを使うことを提案した。この場合、副生物のナトリウムは水銀とアマルガムを形成することになり、それ以上の副反応を防止する。ナトリウム、水銀は再利用でき、Clasenの合成法は原料の損失を引き起こさない。電気化学的に生成されたアランの結晶化と回収が実証されている。
高圧下での水素化
[編集]10GPa、600℃でα-AlH3を得ることができる。[22]
反応
[編集]ルイス塩基との付加体の形成
[編集]AlH3は容易に強塩基と付加体を作る。例えば、トリメチルアミンとは1:1、1:2の両方の錯体を作る。1:1錯体は気相では四面体構造であるが[23]、固相では水素中心が架橋した二量体構造となる(NMe3Al(μ-H))2[24]。一方、1:2錯体は三方両錐形の構造を採る[23]。いくつかの付加体(例えばジメチルエチルアミンアラン, NMe2Et.AlH3)は熱的に分解し金属アルミニウムが生成するため、有機金属気相成長法に使われている[25]。
水素化リチウムとエーテル中で反応させると水素化アルミニウムリチウムが得られる。
官能基との反応
[編集]有機化学では主に官能基の還元に使われている[26]。反応は水素化アルミニウムリチウムとよく似ている。水素化アルミニウムはアルデヒド、ケトン、カルボン酸、酸無水物、酸塩化物、エステルおよびラクトンをそれぞれ対応するアルコールへと還元する。アミド、ニトリル、およびオキシムはそれぞれ対応するアミンへと還元する。
官能基選択制に関しては、アランは他の水素化物試薬とは異なる。例えば、以下のシクロヘキサノンの還元では、水素化アルミニウムリチウムはtrans と cis の割合が1.9 : 1であるのに対し、水素化アルミニウムは7.3 : 1である[27]。

数種のケトンのヒドロキシメチル化を可能にする[28]。ケトンはエノラートとして保護されているためケトン自体は還元されない。
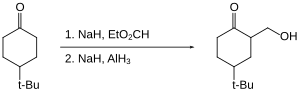
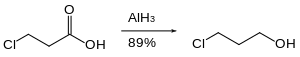
有機ハロゲン化合物はゆっくり還元されるか、まったく還元されない。そのため、ハロゲン部分が存在するカルボン酸などを還元させることができる[29]。
ニトロ基は還元されない。同様にニトロ基のあるエステルを還元することができる[30]。

アセタールを半保護されたアルコールへの還元にも使うことができる[31]。

以下のようなエポキシド環の開環にも使える[32]。

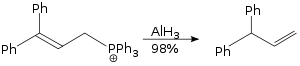
アランが使われるアリル基転位はSN2反応であり、立体的な損傷がない[33]。
燃料としての利用
[編集]水素化アルミニウムは質量の10%を水素が構成し水素貯蔵の方法として有効である。148g H2/Lの水素を含みこれは液体水素の2倍の体積密度に相当する。
また、ロケット燃料に用いると出力が10%は向上するとされる。[34]
水素化アルミニウムは製造中などにおいて容易に酸化され表面に酸化被膜が生じることがある。これがつくと熱分解が抑制され水素放出の温度が高くなる。温度を上げると熱膨張の差で酸化被膜が割れ水素が放出される[35]。
出典
[編集]- ^ Brown, H. C.; Krishnamurthy, S. Tetrahedron 1979, 35, 567.
- ^ a b Lund, Gary K., Hanks, Jami M., Johnston, Harold E., US Patent and Trade Office, 2007, Pat. Application # 20070066839
- ^ Turley J W,. Rinn H W (1969). “The crystal structure of aluminum hydride”. Inorganic Chemistry 8 (1): 18-22. doi:10.1021/ic50071a005.
- ^ F. A. Kurth, R. A. Eberlein, Schnöckel H.-G., A. J. Downs, C. R. Pulham, (1993). “Molecular aluminium trihydride, AlH3: generation in a solid noble gas matrix and characterisation by its infrared spectrum and Ab initio calculations”. J. Chem. Soc., Chem. Communications (16): 1302. doi:10.1039/C39930001302.
- ^ Andrews, Lester; Wang, Xuefeng (2003). “The Infrared Spectrum of Al2H6 in Solid Hydrogen”. Science 299 (5615): 2049-2052. doi:10.1126/science.1082456. PMID 12663923.
- ^ Pulham C.R., Downs A.J., Goode M.J, Rankin D.W.H. Roberson H.E. (1991). “Gallane: Synthesis, Physical and Chemical Properties, and Structure of the Gaseous Molecule Ga2H6 As Determined by Electron Diffraction”. Journal of the American Chemical Society 113 (14): 5149-5162. doi:10.1021/ja00014a003.
- ^ F. M. Brower, N. E. Matzek, P. F. Reigler, H. W. Rinn, C. B. Roberts, D. L. Schmidt, J. A. Snover, K. Terada (1976). “Preparation and properties of aluminum hydride”. Journal of the American Chemical Society (J. Am. Chem. Soc.) 98 (9): 2450-2454. doi:10.1021/ja00425a011.
- ^ A. E. Finholt, A. C. Bond, Jr., H. I. Schlesinger (1947). “Lithium Aluminum Hydride, Aluminum Hydride and Lithium Gallium Hydride, and Some of their Applications in Organic and Inorganic Chemistry”. J. Am. Chem. Soc. 69 (5): 1199-1203. doi:10.1021/ja01197a061.
- ^ U.S. Pat. No. 6228338.
- ^ D. L. Schmidt, C. B. Roberts, P. F. Reigler "Aluminum Trihydride-diethyl etherate: (Etherated Alane)" Inorganic Syntheses, 1973, Volume 14, p. 47-52. doi:10.1002/9780470132456.ch10
- ^ N.M. Alpatova, T.N. Dymova, Yu.M. Kessler, and O.R. Osipov, Russ. Chem. Rev., 37, 99-114 (1968); K.N. Semenenko, B.M. Bulychev, and E.A Shevlyagina, Russ. Chem. Rev., 35, 649-658 (1966); O.R. Osipov, N.M. Alpatova, and Yu.M. Kessler, Elektrokhimiya, 2, 984 (1966)
- ^ H. Clasen, German Patent, 1141623, 1962
- ^ “Aluminum Hydride”. 2020年4月9日閲覧。
- ^ Klebanoff, Lennie (2016-04-21) (英語). Hydrogen Storage Technology: Materials and Applications. Taylor & Francis. ISBN 978-1-4398-4108-2
- ^ Alpatova, N. M.; Dymova, T. N.; Kessler, Yu. M.; Osipov, O. R. (1968). “Physicochemical Properties and Structure of Complex Compounds of Aluminium Hydride”. Russian Chemical Reviews 37 (2): 99-114. Bibcode: 1968RuCRv..37...99A. doi:10.1070/RC1968v037n02ABEH001617.
- ^ Semenenko, K. N.; Bulychev, B. M.; Shevlyagina, E. A. (1966). “Aluminium Hydride”. Russian Chemical Reviews 35 (9): 649-658. Bibcode: 1966RuCRv..35..649S. doi:10.1070/RC1966v035n09ABEH001513.
- ^ Osipov, O. R.; Alpatova, N. M.; Kessler, Yu. M. (1966). “none”. Elektrokhimiya 2: 984.
- ^ Zidan, R.; Garcia-Diaz, B. L.; Fewox, C. S.; Stowe, A. C.; Gray, J. R.; Harter, A. G. (2009). “Aluminium hydride: a reversible material for hydrogen storage”. Chemical Communications (25): 3717-3719. doi:10.1039/B901878F. PMID 19557259.
- ^ Martinez-Rodriguez, M. J.; Garcia-Diaz, B. L.; Teprovich, J. A.; Knight, D. A.; Zidan, R. (2012). “Advances in the electrochemical regeneration of aluminum hydride”. Applied Physics A: Materials Science & Processing 106 (25): 545-550. Bibcode: 2012ApPhA.106..545M. doi:10.1007/s00339-011-6647-y.
- ^ DE patent 1141623, Clasen, H., "Verfahren zur Herstellung von Aluminiumhydrid bzw. aluminiumwasserstoffreicher komplexer Hydride", issued 1962-12-27, assigned to Metallgesellschaft
- ^ US patent 8470156, Zidan, R., "Electrochemical process and production of novel complex hydrides", issued 2013-06-25, assigned to Savannah River Nuclear Solutions, LLC
- ^ Saitoh, H; Sakurai, Y; Machida, A; Katayama, Y; Aoki, K (2010). “In situX-ray diffraction measurement of the hydrogenation and dehydrogenation of aluminum and characterization of the recovered AlH3”. Journal of Physics: Conference Series 215 (1): 012127. Bibcode: 2010JPhCS.215a2127S. doi:10.1088/1742-6596/215/1/012127. ISSN 1742-6596.
- ^ a b グリーンウッド, ノーマン; アーンショウ, アラン (1997). Chemistry of the Elements (英語) (2nd ed.). バターワース=ハイネマン. ISBN 978-0-08-037941-8。
- ^ Atwood JL , Bennett FR, Elms FM, Jones C, Raston CL, Robinson KD (1991). “Tertiary amine stabilized dialane”. J. Am. Chem. Soc. 113 (21): 8183-8185. doi:10.1021/ja00021a063.
- ^ Jong-Ho Yun, Byoung-Youp Kim and Shi-Woo Rhee (1998). “Metal-organic chemical vapor deposition of aluminum from dimethylethylamine alane”. Thin Solid Films 312 (1-2): 259-263. doi:10.1016/S0040-6090(97)00333-7.
- ^ Galatsis, P. In Encyclopedia of Reagents for Organic Synthesis
- ^ Ayres, D. C.; Sawdaye, R. J. Chem. Soc., Perkin Trans, 1967, 581.
- ^ E. J. Corey, David E. Cane (1971). “Controlled hydroxymethylation of ketones”. J. Org. Chem. 36 (20): 3070-3070. doi:10.1021/jo00819a047.
- ^ Danishefsky, S.; Regan, J. Tetrahedron, 1962, 559.
- ^ S. Takano, M. Akiyama, S. Sato, K. Orgasawara, Chem. Lett., 1983, 1593.
- ^ W. J. Richter (1981). “Asymmetric synthesis at prochiral centers: substituted 1, 3-dioxolanes”. J. Org. Chem. 46 (25): 5119-5124. doi:10.1021/jo00338a011.
- ^ K. Maruoka, S. Saito, T. Ooi, H. Yamamoto, H. Synlett, 1991, 255.
- ^ A. Claesson, L.-I. Olsson (1979). “Allenes and acetylenes. 22. Mechanistic aspects of the allene-forming reductions (SN2' reaction) of chiral propargylic derivatives with hydride reagents”. J. Am. Chem. Soc. 101 (24): 7302-7311. doi:10.1021/ja00518a028.
- ^ Calabro, M. (2011). “Overview of Hybrid Propulsion”. Progress in Propulsion Physics 2: 353-374. Bibcode: 2011EUCAS...2..353C. doi:10.1051/eucass/201102353. ISBN 978-2-7598-0673-7.
- ^ 池田一貴, 大友季哉, 武藤俊介, 折茂慎一「アルミニウム水素化物の合成および原子配置と水素放出特性」『セラミックス』第46巻第3号、日本セラミックス協会、2011年、174-177頁。
関連項目
[編集]- 水素化ジイソブチルアルミニウム - アランを親化合物とする誘導体













