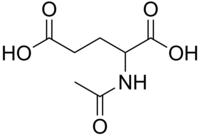
N-アセチルグルタミン酸
| N-アセチルグルタミン酸 | |
|---|---|
| |
| 識別情報 | |
| CAS登録番号 | 5817-08-3 |
| PubChem | 185 |
| ChemSpider | 1272049 |
| |
| 特性 | |
| 化学式 | C7H11NO5 |
| モル質量 | 189.17 g mol−1 |
| 外観 | 白色結晶 |
| 融点 |
191 - 194 °C |
| 水への溶解度 | 36 g L−1 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
N-アセチルグルタミン酸 (N-Acetylglutamic acd)(N-Acetylglutamate とも呼ばれ、略称NAG、化学式 C7H11NO5)[2]は、オルニチンアセチルトランスフェラーゼによってグルタミン酸とアセチルオルニチンから、また酵素 N-アセチルグルタミン酸合成酵素によってグルタミン酸とアセチルCoAから生合成される。逆反応のアセチル基の加水分解は、特定の加水分解酵素によって触媒される。N-アセチルグルタミン酸は、原核生物および単純な真核生物におけるアルギニンの生合成に関与する最初の中間体であり、脊椎動物の体から排泄するために有毒なアンモニアを尿素に変換する尿素サイクルとして知られるプロセスの制御因子である。
発見
[編集]N-アセチルグルタミン酸は、原核生物リゾビウム トリフォリ (Rhizobium trifolii, 根粒菌の一種) から単離され、プロトン核磁気共鳴 (1H-NMR)、フーリエ変換赤外分光法 (FT-IR)、ガスクロマトグラフィー質量分析法 (GC-MS) などの多くの構造決定技術を使用して特徴付けられた細胞外代謝産物である。
リゾビウムでは、N-アセチルグルタミン酸の細胞外蓄積は、共生プラスミド上の ノッド因子遺伝子が関与する代謝によるものである。 ノッド因子が変異すると、N-アセチルグルタミン酸の生成が減少する[3] 。
生合成
[編集]原核生物と単純真核生物
[編集]原核生物および単純な真核生物では、N-アセチルグルタミン酸は、N-アセチルグルタミン酸合成酵素 (NAGS) またはオルニチンアセチルトランスフェラーゼ (OAT) によって生成される。
オルニチンアセチルトランスフェラーゼ (OAT) 合成
[編集]OAT は、グルタミン酸とアセチルオルニチンから N-アセチルグルタミン酸を合成し、オルニチン化合物を合成する能力を持つ原核生物での生産に選択された方法である[4]。
N-アセチルグルタミン酸合成酵素 (NAGS) 合成
[編集]N-アセチルグルタミン酸合成酵素は、有糸分裂または分解によって細胞によって失われた N-アセチルグルタミン酸を補うための N-アセチルグルタミン酸の補充役として機能する酵素である。NAGS は、アセチルCoA からグルタミン酸へのアセチル基の付加を触媒することにより、N-アセチルグルタミン酸を合成する。非環状オルニチン産生を伴う原核生物では、NAGS が N-アセチルグルタミン酸合成の唯一の方法であり、アルギニンによって阻害される。グルタミン酸のアセチル化は、グルタミン酸がプロリン生合成に使用されるのを防ぐためと考えられている[4]。
脊椎動物
[編集]原核生物とは対照的に、哺乳類の NAGS は、プロタミンとともにアルギニンによって強化される。それは、N-アセチルグルタミン酸と類縁体 (他の N-アセチル化物) によって阻害される[4] 。
脳にも微量の N-アセチルグルタミン酸が含まれているが、NAGSの発現は見られない。これは、まだ決定されていない脳内の別の酵素によって N-アセチルグルタミン酸が生成されることを示唆している[4] 。
生化学的役割
[編集]脊椎動物と哺乳類
[編集]脊椎動物と哺乳動物では、N-アセチルグルタミン酸は、尿素サイクルの最初の酵素であるミトコンドリアのカルバモイルリン酸シンセターゼ I (CPSI) に対するアロステリック活性化分子である[5]。それは、尿素サイクルの最初の中間体であるカルバモイルリン酸の生成を引き起こす。CPSI は N-アセチルグルタミン酸が存在しない場合、不活性である。肝臓と小腸では、N-アセチルグルタミン酸依存性 CPSI が、尿素サイクルの 2番目の中間体であるシトルリンを生成する。N-アセチルグルタミン酸の肝細胞への分布は、ミトコンドリアで最も高く、総N-アセチルグルタミン酸利用可能性の56%、核内24%、残り20%は細胞質ゾル中である。肝臓および腎臓細胞のアミノアシラーゼ I は、N-アセチルグルタミン酸をグルタミン酸とアセテートに分解する[6]。 対照的に、N-アセチルグルタミン酸は、ピリミジン合成に関与する細胞質に見られるカルバモイルリン酸合成酵素のアロステリック補因子ではない[7]。
N-アセチルグルタミン酸の濃度は、尿素サイクルを通じて分泌される必要のあるアンモニアの蓄積によりタンパク質の消費が増加すると増加する。これは、CPSI の補因子としての N-アセチルグルタミン酸の役割をサポートしている。さらに、N-アセチルグルタミン酸は、大豆、トウモロコシ、コーヒーなどの一般的に消費される多くの食品に含まれており、特にココア パウダーには高濃度に含まれている[8]。
ヒトの N-アセチルグルタミン酸の欠乏症は、常染色体劣性遺伝性疾患であり、尿素の生成が阻害され、最終的に血液中のアンモニア濃度が上昇する (高アンモニア血症)。欠乏症は、NAGS コーディング遺伝子の欠陥または合成に不可欠な前駆体の欠乏によって引き起こされる可能性がある[4] 。
細菌
[編集]N-アセチルグルタミン酸は、大腸菌 (Escherichia coli)のアルギニン生成経路の 2番目の中間体であり、NAGSを介して生成される。この経路では、N-アセチルグルタミン酸キナーゼ(NAGK)が、アデノシン三リン酸(ATP)の加水分解によって生成されるリン酸を使用して、N-アセチルグルタミン酸のガンマ(3番目)カルボキシル基のリン酸化を触媒する[9]。
シロツメクサの苗の根
[編集]リゾビウムはシロツメクサの苗根と共生関係を築き、コロニーを形成する。これらの細菌によって産生される細胞外 N-アセチルグルタミン酸は、シロツメクサの苗の根に 3つの形態学的影響を及ぼす:根毛の分岐、根端の膨らみ、および根の最外の細胞層に見られる未分化細胞の細胞分裂数の増加。これは、N-アセチルグルタミン酸が有糸分裂の刺激に関与していることを示唆している。同じ効果がストベリークローバーで観察されるが、マメ科植物では観察されなかった。クローバー種に対する N-アセチルグルタミン酸の効果は、グルタミン、グルタミン酸、アルギニン、またはアンモニアからの効果よりも強力であった[4]。
構造
[編集]
N-アセチルグルタミン酸は、2つのカルボキシル基と 2番目の炭素から突き出たアミド基で構成されている。生理学的 pH(7.4)での N-アセチルグルタミン酸の構造では、すべてのカルボキシル基が脱プロトン化されている。
プロトン NMR分光法
[編集]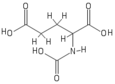

N-アセチルグルタミン酸の構造は、プロトンNMR分光法で決定された[3]。プロトンNMRは、スペクトルに記録された化学シフトに基づいて、プロトンの存在と官能基の位置を明らかにする[10]。
13C NMR分光法
[編集]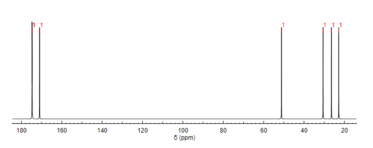
プロトンNMRと同じように、13C NMR分光法は、分子構造の決定に用いられる方法である。13C NMRは、特定の官能基に対応する化学シフトに基づいて、分子内に存在する炭素の種類を明らかにする。N-アセチルグルタミン酸は、3つのカルボニル含有置換基を有するために、最も明確にカルボニル炭素を示す[11]。
脚注
[編集]- ^ “N-Acetyl-DL-glutamic acid - Compound Summary”. PubChem Compound. USA: National Center for Biotechnology Information (25 March 2005). 25 June 2012閲覧。
- ^ Pubchem. “N-Acetyl L-glutamic acid” (英語). pubchem.ncbi.nlm.nih.gov. 2018年6月3日閲覧。
- ^ a b “N-Acetylglutamic acid: an extracellular nod signal of Rhizobium trifolii ANU843 that induces root hair branching and nodule-like primordia in white clover roots”. The Journal of Biological Chemistry 266 (25): 16854–8. (September 1991). doi:10.1016/S0021-9258(18)55380-1. PMID 1885611.
- ^ a b c d e f “N-Acetylglutamate and its changing role through evolution”. The Biochemical Journal 372 (Pt 2): 279–90. (June 2003). doi:10.1042/BJ20030002. PMC 1223426. PMID 12633501.
- ^ Auditore, Joseph V.; Wade, Littleton; Olson, Erik J. (November 1966). “Occurrence of N-acetyl-L-glutamic Acid in the Human Brain” (英語). Journal of Neurochemistry 13 (11): 1149–1155. doi:10.1111/j.1471-4159.1966.tb04272.x. ISSN 0022-3042. PMID 5924663.
- ^ “N-Acetyl-glutamic acid: evaluation of acute and 28-day repeated dose oral toxicity and genotoxicity”. Food and Chemical Toxicology 47 (11): 2723–9. (November 2009). doi:10.1016/j.fct.2009.07.036. PMID 19654033.
- ^ Pelley, John W. (2007). “Chapter 14: Purine, Pyrimidine, and Single-Carbon Metabolism”. Elsevier's Integrated Biochemistry. Elsevier. pp. 117–122. doi:10.1016/b978-0-323-03410-4.50020-1. ISBN 978-0-323-03410-4
- ^ “N-Acetylglutamate and N-acetylaspartate in soybeans (Glycine max L.), maize (Zea mays L.), [corrected] and other foodstuffs”. Journal of Agricultural and Food Chemistry 56 (19): 9121–6. (October 2008). doi:10.1021/jf801523c. PMID 18781757.
- ^ “The course of phosphorus in the reaction of N-acetyl-L-glutamate kinase, determined from the structures of crystalline complexes, including a complex with an AlF−
4 transition state mimic”. Journal of Molecular Biology 331 (1): 231–44. (August 2003). doi:10.1016/S0022-2836(03)00716-2. PMID 12875848. - ^ “Predict 1H proton NMR spectra”. www.nmrdb.org. 2018年6月3日閲覧。
- ^ “Predict 13C carbon NMR spectra”. www.nmrdb.org. 2018年6月3日閲覧。
