O-GlcNAcアーゼ
| OGA | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 識別子 | |||||||||||||||||||||||||
| 記号 | OGA, MEA5, NCOAT, meningioma expressed antigen 5 (hyaluronidase), MGEA5, O-GlcNAcase | ||||||||||||||||||||||||
| 外部ID | OMIM: 604039 MGI: 1932139 HomoloGene: 8154 GeneCards: OGA | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| オルソログ | |||||||||||||||||||||||||
| 種 | ヒト | マウス | |||||||||||||||||||||||
| Entrez | |||||||||||||||||||||||||
| Ensembl | |||||||||||||||||||||||||
| UniProt | |||||||||||||||||||||||||
| RefSeq (mRNA) | |||||||||||||||||||||||||
| RefSeq (タンパク質) | |||||||||||||||||||||||||
| 場所 (UCSC) | Chr 10: 101.78 – 101.82 Mb | Chr 10: 45.74 – 45.77 Mb | |||||||||||||||||||||||
| PubMed検索 | [3] | [4] | |||||||||||||||||||||||
| ウィキデータ | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
O-GlcNAcアーゼ(英: O-GlcNAcase、OGA、EC 3.2.1.169)またはMGEA5(meningioma expressed antigen 5)は、系統名が(protein)-3-O-(N-acetyl-D-glucosaminyl)-L-serine/threonine N-acetylglucosaminyl hydrolaseである酵素であり、OGA遺伝子にコードされる[5][6][7][8][9] 。この酵素は次の化学反応を触媒し、O-GlcNAc化翻訳後修飾を除去する。
- [protein]-3-O-(N-acetyl-β-D-glucosaminyl)-L-serine + H2O
 [protein]-L-serine + N-acetyl-D-glucosamine
[protein]-L-serine + N-acetyl-D-glucosamine - [protein]-3-O-(N-acetyl-β-D-glucosaminyl)-L-threonine + H2O
 [protein]-L-threonine + N-acetyl-D-glucosamine
[protein]-L-threonine + N-acetyl-D-glucosamine
シノニム
[編集]| Protein O-GlcNAcase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| 識別子 | |||||||||
| EC番号 | 3.2.1.169 | ||||||||
| データベース | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| PDB構造 | RCSB PDB PDBj PDBe PDBsum | ||||||||
| |||||||||
他の名称としては次のようなものがある。
- Nuclear cytoplasmic O-GlcNAcase and acetyltransferase
アイソフォーム
[編集]ヒトのOGA遺伝子からは2つの異なる転写産物が産生され、これらはそれぞれ異なるアイソフォームをコードしている。長いアイソフォームであるL-OGAは二機能酵素であり、グリコシドヒドロラーゼ活性と偽ヒストンアセチルトランスフェラーゼドメインを持ち、主に細胞質と核に位置する。短いアイソフォームであるS-OGAはグリコシドヒドロラーゼドメインのみを持ち、当初は核内に存在することが記載されていた。その後、S-OGAはミトコンドリアにも位置し、このオルガネラにおいて活性酸素の産生を調節していることが示された[10]。また、L-OGAの切断によって生じる他のアイソフォームの存在も記載されている。これら3つのアイソフォームの全てがグリコシドヒドロラーゼ活性を有する[11]。
ホモログ
[編集]OGAは、CAZy分類においてグリコシドヒドロラーゼファミリー84に属する[12]。OGAのホモログは他の生物種にも存在し、高等真核生物の間で保存されている。ペアワイズアラインメントでは、ヒトのOGAはショウジョウバエのOGAと55%、線虫Caenorhabditis elegansと43%の類似性を示す。ショウジョウバエと線虫の類似性は43%である。哺乳類の間ではOGAの配列はより高度に保存されており、マウスとヒトのOGAは97.8%が同一である。OGAと他のタンパク質との間には有意な相同性はみられない一方で、OGA内の約200アミノ酸の短い配列は、ヒアルロニダーゼ、推定アセチルトランスフェラーゼ、eEF1γ、11-1ポリペプチドなど一部のタンパク質と弱い相同性を示す[13]。
反応
[編集]O-GlcNAc化
[編集]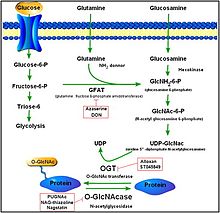
O-GlcNAc化は、タンパク質や脂質に対して部位特異的に糖を付加するグリコシル化反応の1つであり、付加されるのはO-結合型β-N-アセチルグルコサミンである。O-GlcNAc化では、核や細胞質のタンパク質のセリン・スレオニン残基に1つの糖(β-N-アセチルグルコサミン)が付加される。このセリン・スレオニンに対するグリコシル化を制御するのは2つの保存された酵素、O-GlcNAc転移酵素(OGT)とOGAである。OGTはセリン・スレオニンに対するO-GlcNAcの付加を触媒し、OGAは翻訳後修飾されたタンパク質のO-GlcNAcの加水分解による除去を触媒する[14]。
OGAはヘキソサミニダーゼファミリーに属するが、リソソームのヘキソサミニダーゼとは異なり、活性は中性のpH(およそ7)で最も高く、主に細胞質基質に位置している。OGAとOGTはそれぞれ保存された遺伝子から発現し、ヒトの体中で発現しているが、脳や膵臓で最も高レベルで発現している。O-GlcNAc化産物やO-GlcNAc化過程は、胚発生や脳の活動、ホルモンの産生、その他多くの活性に関与している[15][16]。
O-GlcNAc化の標的となるタンパク質は600種類以上が知られている。O-GlcNAc修飾が及ぼす機能的影響は完全には理解されていないが、O-GlcNAc修飾が脂質や炭水化物の代謝、ヘキソサミン生合成など多くの細胞活動に影響を及ぼすことが知られている。修飾されたタンパク質は転写やプロテオームに影響を及ぼし、下流のさまざまなシグナル伝達を調節する[17]。
触媒機構と阻害
[編集]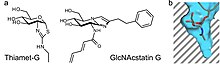
OGAは、オキサゾリン中間体を介してO-GlcNAcの加水分解を触媒する[18]。反応中間体を模した安定な化合物は、選択的な酵素阻害剤として機能する場合がある。GlcNAcのチアゾリン誘導体は反応中間体を模したものとして利用される場合があり、Thiamet-Gはその一例である。他の阻害機構としては、遷移状態の模倣がある。GlcNAcstatinファミリーの阻害剤はこの阻害機構を利用してOGAの活性を阻害する。OGAの活性部位のポケットは深いため、どちらの種類の阻害剤も化学構造のC2置換基を伸長することで、リソソームのヘキソサミニダーゼとは異なる、OGAに対する選択性をもたらすことができる[19]。
アルツハイマー病の治療において、OGAの調節が治療標的となる可能性がある。脳内のタウタンパク質が高リン酸化状態となると、神経原線維変化が形成される。この現象はアルツハイマー病などの神経変性疾患の病理学的特徴である。Thiamet-Gなどの阻害剤を用いてOGAを標的化し、タウからのO-GlcNAcの除去を防ぐことで高リン酸化を防止する戦略がこの疾患の治療法となる可能性がある[20]。
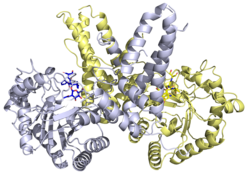
構造
[編集]さまざまなOGAタンパク質に関して、X線結晶構造が得られている。Thiamet-Gと複合体を形成したヒトOGAの構造からは、酵素阻害の構造的基盤が明らかにされている[21]。
出典
[編集]- ^ a b c GRCh38: Ensembl release 89: ENSG00000198408 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000025220 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ “Dynamic O-glycosylation of nuclear and cytosolic proteins: further characterization of the nucleocytoplasmic beta-N-acetylglucosaminidase, O-GlcNAcase”. The Journal of Biological Chemistry 277 (3): 1755–61. (January 2002). doi:10.1074/jbc.M109656200. PMID 11788610.
- ^ “Identification of Asp174 and Asp175 as the key catalytic residues of human O-GlcNAcase by functional analysis of site-directed mutants”. Biochemistry 45 (11): 3835–44. (March 2006). doi:10.1021/bi052370b. PMID 16533067.
- ^ “Structure and mechanism of a bacterial beta-glucosaminidase having O-GlcNAcase activity”. Nature Structural & Molecular Biology 13 (4): 365–71. (April 2006). doi:10.1038/nsmb1079. PMID 16565725.
- ^ “Enzymatic characterization of O-GlcNAcase isoforms using a fluorogenic GlcNAc substrate”. Carbohydrate Research 341 (8): 971–82. (June 2006). doi:10.1016/j.carres.2006.03.004. PMC 10561171. PMID 16584714.
- ^ “Purification and characterization of an O-GlcNAc selective N-acetyl-beta-D-glucosaminidase from rat spleen cytosol”. The Journal of Biological Chemistry 269 (30): 19321–30. (July 1994). doi:10.1016/S0021-9258(17)32170-1. PMID 8034696.
- ^ “Short O-GlcNAcase is targeted to the mitochondria and regulates mitochondrial reactive oxygen species level”. Cells 11 (11): 1827. (June 2022). doi:10.3390/cells11111827. PMC 9180253. PMID 35681522.
- ^ “Isoforms of human O-GlcNAcase show distinct catalytic efficiencies”. Biochemistry. Biokhimiia 75 (7): 938–43. (July 2010). doi:10.1134/S0006297910070175. PMID 20673219.
- ^ “Glycoside Hydrolase Family 84”. Cazypedia. 28 March 2017閲覧。
- ^ “Dynamic O-glycosylation of nuclear and cytosolic proteins: cloning and characterization of a neutral, cytosolic beta-N-acetylglucosaminidase from human brain”. The Journal of Biological Chemistry 276 (13): 9838–45. (March 2001). doi:10.1074/jbc.M010420200. PMID 11148210.
- ^ “O-GlcNAcylation: a novel post-translational mechanism to alter vascular cellular signaling in health and disease: focus on hypertension”. Journal of the American Society of Hypertension 3 (6): 374–87. (2009). doi:10.1016/j.jash.2009.09.004. PMC 3022480. PMID 20409980.
- ^ “Increased O-GlcNAc levels correlate with decreased O-GlcNAcase levels in Alzheimer disease brain”. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease 1842 (9): 1333–9. (September 2014). doi:10.1016/j.bbadis.2014.05.014. PMC 4140188. PMID 24859566.
- ^ “The O-GlcNAc transferase gene resides on the X chromosome and is essential for embryonic stem cell viability and mouse ontogeny”. Proceedings of the National Academy of Sciences of the United States of America 97 (11): 5735–9. (May 2000). Bibcode: 2000PNAS...97.5735S. doi:10.1073/pnas.100471497. PMC 18502. PMID 10801981.
- ^ “Dynamic O-GlcNAc cycling at promoters of Caenorhabditis elegans genes regulating longevity, stress, and immunity”. Proceedings of the National Academy of Sciences of the United States of America 107 (16): 7413–8. (April 2010). Bibcode: 2010PNAS..107.7413L. doi:10.1073/pnas.0911857107. PMC 2867743. PMID 20368426.
- ^ “Structure and mechanism of a bacterial beta-glucosaminidase having O-GlcNAcase activity”. Nature Structural & Molecular Biology 13 (4): 365–71. (April 2006). doi:10.1038/nsmb1079. PMID 16565725.
- ^ “O-GlcNAcase: promiscuous hexosaminidase or key regulator of O-GlcNAc signaling?”. The Journal of Biological Chemistry 289 (50): 34433–9. (December 2014). doi:10.1074/jbc.R114.609198. PMC 4263850. PMID 25336650.
- ^ “Monitoring of Intracellular Tau Aggregation Regulated by OGA/OGT Inhibitors”. International Journal of Molecular Sciences 16 (9): 20212–24. (August 2015). doi:10.3390/ijms160920212. PMC 4613198. PMID 26343633.
- ^ “Structural and functional insight into human O-GlcNAcase”. Nature Chemical Biology 13 (6): 610–612. (June 2017). doi:10.1038/nchembio.2358. PMC 5438047. PMID 28346405.
関連文献
[編集]- “Construction of expression-ready cDNA clones for KIAA genes: manual curation of 330 KIAA cDNA clones”. DNA Research 9 (3): 99–106. (June 2002). doi:10.1093/dnares/9.3.99. PMID 12168954.
- “Prediction of the coding sequences of unidentified human genes. X. The complete sequences of 100 new cDNA clones from brain which can code for large proteins in vitro”. DNA Research 5 (3): 169–76. (June 1998). doi:10.1093/dnares/5.3.169. PMID 9734811.
- “Dynamic O-glycosylation of nuclear and cytosolic proteins: cloning and characterization of a neutral, cytosolic beta-N-acetylglucosaminidase from human brain”. The Journal of Biological Chemistry 276 (13): 9838–45. (March 2001). doi:10.1074/jbc.M010420200. PMID 11148210.
- “Identification of a nuclear variant of MGEA5, a cytoplasmic hyaluronidase and a beta-N-acetylglucosaminidase”. Biochemical and Biophysical Research Communications 283 (3): 634–40. (May 2001). doi:10.1006/bbrc.2001.4815. PMID 11341771.
- “Dynamic O-glycosylation of nuclear and cytosolic proteins: further characterization of the nucleocytoplasmic beta-N-acetylglucosaminidase, O-GlcNAcase”. The Journal of Biological Chemistry 277 (3): 1755–61. (January 2002). doi:10.1074/jbc.M109656200. PMID 11788610.
- “Analysis of MGEA5 on 10q24.1-q24.3 encoding the beta-O-linked N-acetylglucosaminidase as a candidate gene for type 2 diabetes mellitus in Pima Indians”. Molecular Genetics and Metabolism 77 (1–2): 189–93. (2003). doi:10.1016/S1096-7192(02)00127-0. PMID 12359146.
- “Large-scale characterization of HeLa cell nuclear phosphoproteins”. Proceedings of the National Academy of Sciences of the United States of America 101 (33): 12130–5. (August 2004). Bibcode: 2004PNAS..10112130B. doi:10.1073/pnas.0404720101. PMC 514446. PMID 15302935.
- “Phosphoproteomic analysis of the developing mouse brain”. Molecular & Cellular Proteomics 3 (11): 1093–101. (November 2004). doi:10.1074/mcp.M400085-MCP200. PMID 15345747.
- “Characterization of the histone acetyltransferase (HAT) domain of a bifunctional protein with activable O-GlcNAcase and HAT activities”. The Journal of Biological Chemistry 279 (51): 53665–73. (December 2004). doi:10.1074/jbc.M410406200. PMID 15485860.
- “Disrupting the enzyme complex regulating O-GlcNAcylation blocks signaling and development”. Glycobiology 16 (6): 551–63. (June 2006). doi:10.1093/glycob/cwj096. PMID 16505006.
- “Location and characterization of the O-GlcNAcase active site”. Biochimica et Biophysica Acta (BBA) - General Subjects 1760 (5): 829–39. (May 2006). doi:10.1016/j.bbagen.2006.01.017. PMID 16517082.
- “MGEA5-14 polymorphism and type 2 diabetes in Mexico City”. American Journal of Human Biology 19 (4): 593–6. (2007). doi:10.1002/ajhb.20639. PMID 17546623.
関連項目
[編集]外部リンク
[編集]- Protein O-GlcNAcase - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス