アルソール
| アルソール | |
|---|---|
|
|
1H-Arsole | |
別称 Arsenole Arsacyclopentadiene | |
| 識別情報 | |
| CAS登録番号 | 287-77-4 |
| PubChem | 6398625 |
| ChemSpider | 16787685 |
| ChEBI | |
| |
| |
| 特性 | |
| 化学式 | C4H4AsH |
| モル質量 | 128.00 g mol-1 |
| 関連する物質 | |
| 関連物質 | ピロール, ホスホール, ビスモール, スチボール |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
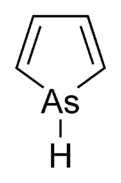
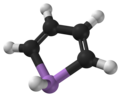
アルソール(Arsole)は、化学式C4H4AsHの有機ヒ素化合物であり、アルセノール[1]、アルサシクロペンタジエンとも呼ぶ。メタロールの1種で、ピロールと等電子的であり、窒素の代わりにヒ素が位置している。ピロール分子が平面状であるのに対し、アルソール分子はそうではなく、ヒ素と結合する水素原子が平面から飛び出している。アルソールは、ピロールの約40%と中程度の芳香族性しか持たない[2]。純粋な形では報告されていないが、アルソール類と呼ばれるいくつかの置換アナログが存在する。アルソール類やさらに複雑なアルソール誘導体は、ホスホール誘導体と似た構造及び化学的性質を持つ。アルソールがベンゼン環と融合した分子は、アルシンドールまたはベンザルソールと呼ばれる[3]。
命名
[編集]アルソールは、複素環ニクトゲン化合物の1つである。アルソール等の環状有機ヒ素化合物の命名は、IUPACに承認された拡張ハンチュ-ウィドマン命名法に基づき[4]、以下のようになる[5]。
| Ring size | 不飽和環 | 飽和環 |
|---|---|---|
| 3 | アルシレン(Arsirene) | アルシラン(Arsirane) |
| 4 | アルセト(Arsete) | アルセタン(Arsetane) |
| 5 | アルソール(Arsole) | アルソラン(Arsolane) |
| 6 | アルシニン(Arsinine) | アルシナン(Arsinane) |
| 7 | アルセピン(Arsepine) | アルセパン(Arsepane) |
| 8 | アルソシン(Arsocine) | アルソカン(Arsocane) |
| 9 | アルソニン(Arsonine) | アルソナン(Arsonane) |
| 10 | アルセシン(Arsecine) | アルセカン(Arsecane) |
英語のスラング"arsehole"(尻の穴、北米語では"asshole")と音が似ているため、「ばかげた名前」とされてからかいの対象となることがある[6][7]。しかし、この「ばかげた名前」との偶然の一致により、詳細な科学研究が刺激されてきてもいる[2]。
性質
[編集]| M | d(M-C), A | d(M-H), A | α(C-M-C), ° | E, kJ/mol |
|---|---|---|---|---|
| N | 1.37 | 1.01 | 110 | 0 |
| P | 1.81 | 1.425 | 90.5 | 67 |
| As | 1.94 | 1.53 | 86 | 125 |
| Sb | 2.14 | 1.725 | 80.5 | 160 |
| Bi | 2.24 | 1.82 | 78 | 220 |
アルソール自体は未だ単離されていないが、分子構造や電子配置は理論的に研究されている。計算により、水素原子が他の原子や小さな炭化水素基に置換した単純な誘導体の性質も研究されており、より複雑な誘導体の化学性質に関する実験報告もある。この状況は、他のメタロールC4H4MH(M = P, As, Sb, Bi)と同様である。
平面性
[編集]計算により、ピロール分子は平面状であるのに対し、ホスホールとより重いメタロールはそうではなく、ニクトゲンが結合した水素原子が平面から飛び出ていることが示唆される[9]。同様の傾向は、フッ素化したC4F4MH誘導体(M = N, P, As, ..)でも予測されるが、反転障壁は約50-100%高い。フルオリンのように窒素に結合した水素原子が置換すると、ピロールでさえも平面性を失う。しかし、平面性は、M-H結合が分子平面の左右に広がる2つの配置の間の変換に必要なエネルギーによる計算で評価されるが、2つの配置の間で熱または量子のトンネル効果がありうるため、このエネルギーの値がゼロではない小さな値であることは、必ずしも、分子が低い対称性を持つことを意味しない。
芳香族性
[編集]アルソールの芳香族性は、環電子の非局在化及び共鳴に起因する。平面性と深くかかわっており、分子がより平面であれば、芳香族性はより強くなる。アルソール及びその誘導体の芳香族性は、実験と理論の両面で、長年論争の的になってきた[10]。量子化学計算と組み合わせた2005年のレビューでは、芳香族であることが知られているピロールの40%の環電流であるため、アルソール自体は「適度に」芳香族性を持つと結論付けられた。しかし、長い間非芳香族と見なされてきたシクロペンタジエンでも同等の環電流が計算された[2]。他の報告では、芳香族性及び平面性は、アルソール誘導体間で異なる可能性があることが示唆された[9]。
化学的性質
[編集]アルソール誘導体の化学的性質は実験的に確かめられており、ホスホール及びその誘導体の性質と類似している[1]。アルソールの全ての水素原子をフェニル基で置換すると、融点215℃の黄色針状結晶であるペンタフェニルアルソールが生成する。この複合体は、1,4-ジヨード-1,2,3,4-テトラフェニルブタジエン[11]または1,4-ジリチオ-1,2,3,4-テトラフェニルブタジエンと二塩化フェニルヒ素をエーテル中で反応させることにより収率50-93%で得られる。
この反応で、二塩化フェニルヒ素の代わりに三塩化ヒ素を使用すると、1-クロロ-2,3,4,5-テトラフェニルアルソールが生成する。これも黄色の針状を形成するが、融点は低く、182~184℃である。ペンタフェニルアルソールはさらに過酸化水素で酸化され、融点252℃の黄色結晶となる。これは、150℃のイソオクタン中でペンタカルボニル鉄と反応し、化学式C34H25As,Fe(CO)3の固体有機ヒ素化合物を生成する[1]。ペンタフェニルアルソールを金属リチウムまたはカリウムと反応させると、1,2,3-トリフェニルナフタレンが生成する[12]。
二塩化フェニルヒ素と線状ビフェニルを反応させると、融点170℃の固体である1,2,5-トリフェニルアルソールが生成する[13](下図)。この化合物は、アルカリ金属で処理することで、様々なアニオンを形成する[14]。
関連項目
[編集]出典
[編集]- ^ a b c Frederick George Mann (1970). The heterocyclic derivatives of phosphorus, arsenic, antimony, and bismuth. John Wiley and Sons. pp. 357-360. ISBN 978-0-471-37489-3 21 March 2011閲覧. "In English this ring system has frequently named arsenole 'for euphony'"
- ^ a b c M. P. Johansson; J. Juselius (2005). “Arsole Aromaticity Revisited”. Lett. Org. Chem. 2: 469-474. doi:10.2174/1570178054405968. "Using quantum chemical methodology, we reinvestigate the aromaticity of the much debated arsole, using the newly developed gauge-including magnetically induced currents (GIMIC) method. GIMIC provides a quantitative measure of the induced ring current strength, showing arsole to be moderately aromatic."
- ^ A. Muranaka; S. Yasuike; C-Y. Liu; J. Kurita; N. Kakusawa; T. Tsuchiya; M. Okuda; N. Kobayashi et al. (2009). “Effect of Periodic Replacement of the Heteroatom on the Spectroscopic Properties of Indole and Benzofuran Derivatives”. J. Phys. Chem. A 113 (2): 464-473. doi:10.1021/jp8079843. PMID 19099440.
- ^ "Revision of the Extended Hantzsch-Widman System of Nomenclature for Heteromonocycles" at IUPAC, retrieved 29 Sept 2008
- ^ Nicholas C. Norman (1998). Chemistry of arsenic, antimony, and bismuth. Springer. p. 235. ISBN 978-0-7514-0389-3 15 March 2011閲覧。
- ^ Richard Watson Todd (25 May 2007). Much ado about English: up and down the bizarre byways of a fascinating language. Nicholas Brealey Publishing. p. 138. ISBN 978-1-85788-372-5 15 March 2011閲覧。
- ^ Paul W May, Molecules with Silly or Unusual Names, publ. 2008 Imperial College Press, ISBN 978-1-84816-207-5(pbk). See also the Web page "Molecules with Silly or Unusual Names" at the School of Chemistry, University of Bristol, (retrieved 29 Sept 2008)
- ^ Pelzer, Silke; Wichmann, Karin; Wesendrup, Ralf; Schwerdtfeger, Peter (2002). “Trends in Inversion Barriers IV. The Group 15 Analogous of Pyrrole”. The Journal of Physical Chemistry A 106: 6387. doi:10.1021/jp0203494.
- ^ a b Tadeusz Marek Krygowski; Michal K. Cyra?ski; M. Agostinha R. Matos (2009). Aromaticity in Heterocyclic Compounds. Springer. pp. 47-. ISBN 978-3-540-68329-2 21 March 2011閲覧。
- ^ Pelloni, Stefano; Lazzeretti, Paolo (2007). “Magnetotropicity of phosphole and its arsenic analogue”. Theoretical Chemistry Accounts 118: 89. doi:10.1007/s00214-007-0247-0.
- ^ Braye, E. H.; Hubel, W.; Caplier, I. (1961). “New Unsaturated Heterocyclic Systems. I”. Journal of the American Chemical Society 83: 4406. doi:10.1021/ja01482a026.
- ^ C. W. Bird; Gordon William Henry Cheeseman (31 December 1973). Aromatic and Heteroatomic Chemistry. Royal Society of Chemistry. pp. 23-. ISBN 978-0-85186-753-3 23 March 2011閲覧。
- ^ Gottfried Markl & Hagen Hauptmann (1972). “Unusual Substitution in an Arsole Ring”. Angewandte Chemie International Edition in English 11: 441. doi:10.1002/anie.197204411.
- ^ Markl, G (1983). “Synthese von 1-phenyl-2,5-diaryl(dialkyl)-arsolen; umsetzung der arsole mit alkalimetallen und lithiumorganylen”. Journal of Organometallic Chemistry 249: 335. doi:10.1016/S0022-328X(00)99433-6.


