ソマトスタチン
| SST | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||
| 識別子 | |||||||||||||||||||||||||
| 記号 | SST, SMST, somatostatin, Somatostatin, Somatostatin, SST1 | ||||||||||||||||||||||||
| 外部ID | OMIM: 182450 MGI: 98326 HomoloGene: 819 GeneCards: SST | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| オルソログ | |||||||||||||||||||||||||
| 種 | ヒト | マウス | |||||||||||||||||||||||
| Entrez | |||||||||||||||||||||||||
| Ensembl | |||||||||||||||||||||||||
| UniProt | |||||||||||||||||||||||||
| RefSeq (mRNA) | |||||||||||||||||||||||||
| RefSeq (タンパク質) | |||||||||||||||||||||||||
| 場所 (UCSC) | Chr 3: 187.67 – 187.67 Mb | Chr 3: 23.71 – 23.71 Mb | |||||||||||||||||||||||
| PubMed検索 | [3] | [4] | |||||||||||||||||||||||
| ウィキデータ | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
 | |
| データベースID | |
|---|---|
| CAS番号 | 51110-01-1 |
| ATCコード | H01CB01 (WHO) |
| 化学的データ | |
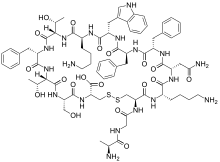
| 化学式 | C76H104N18O19S2 |
| 分子量 | 1 637.878 g/mol |
| |
ソマトスタチン(英: somatostatin, SST)とは、脳の視床下部、膵臓のランゲルハンス島δ細胞(D細胞)、消化管の内分泌細胞(δ細胞)などから分泌され、内分泌系を制御し、G蛋白質共役ソマトスタチン受容体を介して神経伝達や細胞増殖に影響を与え、さらには多くの二次ホルモンの分泌を抑制するペプチドホルモンである。コレシストキニンなどにより、ソマトスタチンのD細胞からの分泌が促進される。ソマトスタチンは、ガストリン、セクレチン、インスリン、グルカゴンの分泌を抑制する。
ソマトスタチンには共通の前駆蛋白質(preproprotein)から切り出される2つの活性型がある。一つは14アミノ酸から成り、もう一つは28アミノ酸から成る[5]。28アミノ酸型ソマトスタチンは14アミノ酸型のアミノ酸鎖を延長した形になっている[6]。
脊椎動物では6つのソマトスタチン遺伝子が知られており、SS1〜SS6と呼ばれている[7]。ゼブラフィッシュは6つの遺伝子を全て持つ[7]。6つの遺伝子は5つのソマトスタチン受容体に対応し、ソマトスタチンの機能を多様なものにしている[8]。ヒトにはソマトスタチン遺伝子は1つ(SST)しかない[9][10][11]。
呼称
[編集]ソマトスタチンの同義語として、下記のものがある:
- 成長ホルモン(分泌)抑制ホルモン(growth hormone–inhibiting hormone、GHIH)
- 成長ホルモン放出抑制ホルモン(growth hormone release–inhibiting hormone、GHRIH)
- ソマトトロピン放出抑制因子(somatotropin release–inhibiting factor、SRIF)
- ソマトトロピン放出抑制ホルモン(somatotropin release–inhibiting hormone、SRIH)
主な機能
[編集]- 下垂体からの成長ホルモンおよび甲状腺刺激ホルモンの分泌の抑制
- ランゲルハンス島からのインスリンおよびグルカゴンの産生・分泌の抑制
- 消化管からの栄養吸収の抑制
- セクレチン・ガストリン、胃液、胃酸の分泌の抑制
- ネプリライシンの活性を高め、アミロイドβの分解を促進
詳細は以下に示す。
生成
[編集]消化器系
[編集]ソマトスタチンは消化器系の複数の場所から分泌される[12]:
幽門から分泌されたソマトスタチンは門脈系を経由して心臓に至り、全身循環に乗って各部に到達して抑制作用を示す。加えて、δ細胞から分泌されたソマトスタチンは近傍周囲の組織へ影響する[12]。
胃内部では、ソマトスタチンはG蛋白質共役受容体(アデニル酸シクラーゼを阻害してヒスタミン放出を抑制する)を介して壁細胞の酸分泌を直接減少させる[12]。ソマトスタチンには間接的な胃酸分泌抑制作用もあり、他のホルモン(ガストリン、セクレチン、ヒスタミン)の放出を抑制して胃の消化プロセスを遅くさせる。
脳
[編集]視床下部から分泌されたソマトスタチンはGHとTSHを阻害する。 ソマトスタチンは視床下部の腹内側核に存在する神経内分泌ニューロンで産生される。これらのニューロンは正中隆起に突き出しており、神経分泌末端からニューロン軸索を通じて下垂体門脈系へとホルモンを放出する。放出されたソマトスタチンは脳下垂体前葉へと運ばれ、ソマトトロピン産生細胞からの成長ホルモン分泌を抑制する。脳室周囲核のソマトスタチンニューロンは自身からの成長ホルモン分泌の負のフィードバック制御を行っており、成長ホルモンやソマトメジンの血中濃度が高いとソマトスタチンを放出して成長ホルモンの分泌を低下させる。
ソマトスタチンは中枢神経系の他の部位でも産生されており、ソマトスタチン受容体は脳の様々な部位に発現している。特に弓状核[要出典]、海馬[要出典]、脳幹孤束核[要出典]での発現密度が高い。
作用
[編集]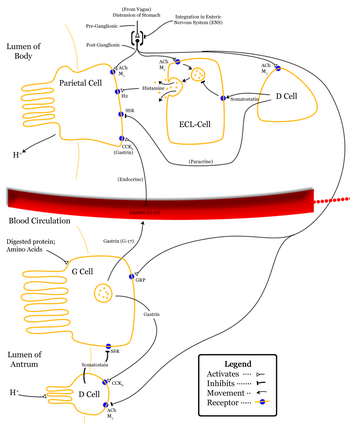
ソマトスタチンは抑制性ホルモンに分類され[5]、その作用は身体の広範囲に及ぶ:
下垂体前葉
[編集]脳下垂体前葉でのソマトスタチンの作用:
消化器系
[編集]- ソマトスタチンはコルチスタチンのホモログであり(ソマトスタチンファミリー参照)、消化管ホルモン(英語版)の分泌を低下させる。
- 消化管からの内容物の排出速度減少、平滑筋収縮の減少、腸血流量の低下[13]
- 膵臓ホルモンの分泌抑制
- 膵臓外分泌作用の低下
- 壁細胞でのアデニル酸シクラーゼの阻害
- 胃内低pHで分泌が誘発される[要出典]
化学合成品
[編集]オクトレオチドはソマトスタチン模倣ペプチドの一つであり、成長ホルモン、グルカゴン、インスリンの分泌阻害効果が強化され、半減期が大きく延長されている(約90分、ソマトスタチンは2〜3分)。消化管からは吸収され難いので、非経口的(皮下注射、筋肉内注射、静脈内注射)に投与される。カルチノイド症候群および先端巨大症の対症療法に使われる。多発性嚢胞腎や嚢胞肝への使用も増加している。
ランレオチドは先端巨大症の対症療法ならびに神経内分泌腫瘍の症状緩和、さらにはカルチノイド症候群の治療に用いられる。オクトレオチド同様に長時間作用型のソマトスタチンアナログである。ランレオチドは英国、豪州、カナダ、米国等で入手できる。
2016年11月日本でも先端巨大症および下垂体性巨人症治療薬パシレオチド(商品名シグニフォー,ノバルティス製造販売)が薬価収載された。 ソマトスタチン受容体には5つのサブタイプ(SST1~SST5)が存在している.成長ホルモン産生腺腫(先端巨大症)では,このうちSST2とSST5が発現している.従来用いられてきたソマトスタチンアナログ製剤であるオクトレオチドとランレオチドは,主としてSST2に結合する薬であり,SST5への結合能は弱い.一方,ACTH産生下垂体腺腫(クッシング病)にはほぼSST5のみが発現している.パシレオチドは,SST1~3 および SST5 に結合する新規のソマトスタチンアナログ製剤であり,オクトレオチドやランレオチドに不応の先端巨大症やクッシング病への効果が期待されている.しかし,本剤が膵β細胞のSST5にも結合するため, GLP-1, 血糖依存的なインスリンの分泌を抑制する一方、食後グルカゴンの分泌は維持される.このため,高血糖が起こる.
進化の歴史
[編集]ソマトスタチン遺伝子は脊椎動物では6種類見付かっている。現在考えられているその理由は、硬骨魚で遺伝子の部分重複が発生した他、脊椎動物の進化の過程で全遺伝子の重複が3回発生したというものである。
先祖型のソマトスタチン遺伝子からは最初の遺伝子全重複(1R)でSS1とSS2が生じ、両遺伝子が2回目の遺伝子全重複(2R)でSS1、SS2、SS3ともう1つに分離し、進化の過程で4つ目が失われた。四肢動物は肉鰭綱と条鰭綱が系統分裂した後に SS1(SS-14およびSS-28として知られる)とSS2(コルチスタチンとして知られる)を保持している。硬骨魚綱では、SS1、SS2、SS3は3回目の遺伝子全重複(3R)でSS1、SS2、SS4、SS5と現在は失われた2つの遺伝子に分離した。SS1とSS2は遺伝子の部分重複でそれぞれSS6とSS3を生じた[7]。
関連項目
[編集]出典
[編集]- ^ a b c GRCh38: Ensembl release 89: ENSG00000157005 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000004366 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ a b Costoff A. “Sect. 5, Ch. 4: Structure, Synthesis, and Secretion of Somatostatin”. Endocrinology: The Endocrine Pancreas. Medical College of Georgia. pp. 16. 2008年2月19日閲覧。
- ^ somatostatin preproprotein [Homo sapiens] See Features
- ^ a b c Liu Y, Lu D, Zhang Y, Li S, Liu X, Lin H (2010). “The evolution of somatostatin in vertebrates”. Gene 463 (1–2): 21–28. doi:10.1016/j.gene.2010.04.016. PMID 20472043.
- ^ Gahete MD, Cordoba-Chacón J, Duran-Prado M, Malagón MM, Martinez-Fuentes AJ, Gracia-Navarro F, Luque RM, Castaño JP (2010). “Somatostatin and its receptors from fish to mammals”. Annals of the New York Academy of Sciences 1200: 43–52. doi:10.1111/j.1749-6632.2010.05511.x. PMID 20633132.
- ^ “Entrez Gene: Somatostatin”. 2016年4月2日閲覧。
- ^ Shen LP, Pictet RL, Rutter WJ (August 1982). “Human somatostatin I: sequence of the cDNA”. Proc. Natl. Acad. Sci. U.S.A. 79 (15): 4575–9. doi:10.1073/pnas.79.15.4575. PMC 346717. PMID 6126875.
- ^ Shen LP, Rutter WJ (April 1984). “Sequence of the human somatostatin I gene”. Science 224 (4645): 168–71. doi:10.1126/science.6142531. PMID 6142531.
- ^ a b c Boron, Walter F. & Boulpaep, Emile L. (2012). Medical Physiology, 2e Updated Edition, 2nd Edition (2nd ed.). Philadelphia, PA: Elsevier. ISBN 9781437717532
- ^ a b Bowen R (2002年12月14日). “Somatostatin”. Biomedical Hypertextbooks. Colorado State University. 2008年2月19日閲覧。
- ^ First Aid for the USMLE Step 1, 2010. Page 286.
- ^ a b Costoff A. “Sect. 5, Ch. 4: Structure, Synthesis, and Secretion of Somatostatin”. Endocrinology: The Endocrine Pancreas. Medical College of Georgia. pp. 17. 2008年3月31日時点のオリジナルよりアーカイブ。2008年2月19日閲覧。
関連資料
[編集]- Florio T, Schettini G (2002). “[Somatostatin and its receptors. Role in the control of cell proliferation]”. Minerva Endocrinol. 26 (3): 91–102. PMID 11753230.
- “Somatostatin receptors, an expanding gene family: cloning and functional characterization of human SSTR3, a protein coupled to adenylyl cyclase”. Mol. Endocrinol. 6 (12): 2136–42. (1993). doi:10.1210/me.6.12.2136. PMID 1337145.
- “Cloning and functional characterization of a family of human and mouse somatostatin receptors expressed in brain, gastrointestinal tract, and kidney”. Proc. Natl. Acad. Sci. U.S.A. 89 (1): 251–5. (1992). doi:10.1073/pnas.89.1.251. PMC 48214. PMID 1346068.
- “Hypothalamic polypeptide that inhibits the secretion of immunoreactive pituitary growth hormone”. Science 179 (4068): 77–9. (1973). doi:10.1126/science.179.4068.77. PMID 4682131.
- Shen LP, Pictet RL, Rutter WJ (1982). “Human somatostatin I: sequence of the cDNA”. Proc. Natl. Acad. Sci. U.S.A. 79 (15): 4575–9. doi:10.1073/pnas.79.15.4575. PMC 346717. PMID 6126875.
- Shen LP, Rutter WJ (1984). “Sequence of the human somatostatin I gene”. Science 224 (4645): 168–71. doi:10.1126/science.6142531. PMID 6142531.
- Montminy MR, Goodman RH, Horovitch SJ, Habener JF (1984). “Primary structure of the gene encoding rat preprosomatostatin”. Proc. Natl. Acad. Sci. U.S.A. 81 (11): 3337–40. doi:10.1073/pnas.81.11.3337. PMC 345502. PMID 6145156.
- “High-resolution chromosomal localization of human genes for amylase, proopiomelanocortin, somatostatin, and a DNA fragment (D3S1) by in situ hybridization”. Proc. Natl. Acad. Sci. U.S.A. 80 (22): 6932–6. (1984). doi:10.1073/pnas.80.22.6932. PMC 390100. PMID 6196780.
- “Molecular cloning, functional characterization, and chromosomal localization of a human somatostatin receptor (somatostatin receptor type 5) with preferential affinity for somatostatin-28”. Mol. Pharmacol. 45 (3): 417–27. (1994). PMID 7908405.
- “Cloning and expression of a human somatostatin-14-selective receptor variant (somatostatin receptor 4) located on chromosome 20”. Mol. Pharmacol. 43 (6): 894–901. (1993). PMID 8100352.
- “Distribution and second messenger coupling of four somatostatin receptor subtypes expressed in brain”. FEBS Lett. 331 (1–2): 53–9. (1993). doi:10.1016/0014-5793(93)80296-7. PMID 8405411.
- Aguila MC, Rodriguez AM, Aguila-Mansilla HN, Lee WT (1996). “Somatostatin antisense oligodeoxynucleotide-mediated stimulation of lymphocyte proliferation in culture”. Endocrinology 137 (5): 1585–90. doi:10.1210/en.137.5.1585. PMID 8612489.
- Sharma K, Patel YC, Srikant CB (1997). “Subtype-selective induction of wild-type p53 and apoptosis, but not cell cycle arrest, by human somatostatin receptor 3”. Mol. Endocrinol. 10 (12): 1688–96. doi:10.1210/me.10.12.1688. PMID 8961277.
- “Interrelationships between somatostatin sst2A receptors and somatostatin-containing axons in rat brain: evidence for regulation of cell surface receptors by endogenous somatostatin”. J. Neurosci. 18 (3): 1056–71. (1998). PMID 9437026.
- Barnea A, Roberts J, Ho RH (1999). “Evidence for a synergistic effect of the HIV-1 envelope protein gp120 and brain-derived neurotrophic factor (BDNF) leading to enhanced expression of somatostatin neurons in aggregate cultures derived from the human fetal cortex”. Brain Res. 815 (2): 349–57. doi:10.1016/S0006-8993(98)01098-1. PMID 9878821.
- “In vitro characterization of somatostatin receptors in the human thymus and effects of somatostatin and octreotide on cultured thymic epithelial cells”. Endocrinology 140 (1): 373–80. (1999). doi:10.1210/en.140.1.373. PMID 9886848.
- “The somatostatin-28(1-12)-NPAMAP sequence: an essential helical-promoting motif governing prosomatostatin processing at mono- and dibasic sites”. Biochemistry 41 (5): 1630–9. (2002). doi:10.1021/bi011928m. PMID 11814357.
- “Somatostatin is a selective chemoattractant for primitive (CD34(+)) hematopoietic progenitor cells”. Exp. Hematol. 30 (2): 116–25. (2002). doi:10.1016/S0301-472X(01)00772-X. PMID 11823046.
- Simonetti M, Di BC (2002). “Structural motifs in the maturation process of peptide hormones. The somatostatin precursor. I. A CD conformational study”. J. Pept. Sci. 8 (2): 66–79. doi:10.1002/psc.370. PMID 11860030.