プロテインキナーゼ
プロテインキナーゼ (Protein kinase; プロテインカイネース) は、タンパク質分子にリン酸基を付加する(リン酸化する)酵素である。タンパク質キナーゼあるいは英語風にプロティーンカイネースとも呼ぶ。キナーゼ(リン酸基転移酵素)の中でタンパク質をリン酸化するキナーゼをプロテインキナーゼと呼ぶが、このプロテインキナーゼのことを特にキナーゼと呼ぶことが多い(本記事では以後単にキナーゼという)。

概要
[編集]細胞は、その機能を維持するため、細胞内のタンパク質をリン酸化、脱リン酸化する反応を繰り返している。このリン酸化によってタンパク質は酵素活性、細胞内での局在や他のタンパク質との会合状態を変化させる。細胞内の30%ものタンパク質がキナーゼによる変化を受け、細胞内における様々なシグナル伝達や代謝の調節因子として機能している。キナーゼ遺伝子はヒトゲノム中に約500種類があり、また真核生物の全遺伝子の約2%を占める。
キナーゼは、ATPのリン酸基をアミノ酸残基にあるヒドロキシ基に移動させ、共有結合させる活性を有する。キナーゼはアミノ酸のうち、主にセリン、スレオニン、チロシン残基をリン酸化させるが、キナーゼがリン酸化するアミノ酸の99%以上はセリン、スレオニンである(セリン/スレオニンキナーゼ)。しかし、0.1%に満たないチロシンのリン酸化(チロシンキナーゼ)の方が生物学的に重要なケースが多い。これら3種類すべてに反応するものや、またこのほかに微生物や植物ではヒスチジンのイミダゾール環窒素原子に反応するもの(ヒスチジンキナーゼ;EC 2.7.13に含まれる)もある。 キナーゼの活性は精密に調節されており、キナーゼ自身もリン酸化によってオン・オフ調節を受ける。これは他のキナーゼのみならず、自分自身によって行われることもあり、“自己リン酸化”という。これらの調節は他の活性化(または抑制)タンパク質や低分子化合物の結合、細胞内での局在変化などによって起きる。
キナーゼの機能異常は病気の原因になることも多い。特にがんに関して詳細な研究が行われており、キナーゼはがん細胞の増殖、移動、浸潤やアポトーシス(細胞死)の調節に関与する。特定のキナーゼを阻害することによって治療に役立てる薬物が開発されており、中にはゲフィチニブ(イレッサ®)やイマチニブ(グリベック®)のように、すでに臨床的に用いられているものもある。
セリン/スレオニンキナーゼ
[編集]セリン/スレオニンキナーゼ(Ser/Thr kinase; 読み:セリン/スレオニン カイネース、EC 2.7.11.*)はセリンまたはスレオニンのヒドロキシ基をリン酸化する。これらは
によって調節される。これらのキナーゼの特異性は特定のアミノ酸配列に基づくものではなく、リン酸化される基質はキーとなる数個のアミノ酸(疎水結合やイオン結合による)でキナーゼと結合するから、普通、キナーゼはある性質を共有する「基質ファミリー」全体に対して特異的である。ほとんどのキナーゼは、本当の基質のようにキナーゼに結合するがリン酸化を受けるアミノ酸を欠くような「擬似基質」によって阻害される。擬似基質が取り除かれるとキナーゼは機能を取り戻す。これらのキナーゼの触媒部位は高度に保存されている。 セリン/スレオニンキナーゼには以前は一部を除いて独自のEC番号はなく、"EC 2.7.1.37"を用いていた。国際生化学分子生物学連合IUBMBの命名委員会(NC-IUBMB)によって見直しされ、2005年にそれぞれ独自のEC番号が割り当てられた。
ホスホリラーゼキナーゼ
[編集]ホスホリラーゼキナーゼ(EC 2.7.11.19)は初めて発見された(1959年、エドヴィン・クレープスら)セリン/スレオニンキナーゼである。グリコーゲンホスホリラーゼ(グリコーゲンを加リン酸分解する酵素)を活性化する。
プロテインキナーゼA
[編集]プロテインキナーゼA(AキナーゼまたはPKA、EC 2.7.11.11)は2つのドメインからなり、小ドメインはβシートを、大ドメインはαヘリックスを含む。基質とATPの結合部位は2つのドメインの間隙にある。ATPと基質が結合すると、2つのドメインは互いに回転するように動き、ATPの末端リン酸基と基質のターゲットアミノ酸が近寄って反応が起きやすい位置となる。
制御
[編集]プロテインキナーゼAは細胞内でcAMPによる調節を受け、グリコーゲン、糖、脂質の代謝の調節など、いくつかの機能を有する。cAMPがないときは4量体(調節サブユニット2個と触媒サブユニット2個:R2C2)からなり、調節サブユニットが触媒サブユニットの活性中心を封鎖している。cAMPが調節サブユニットに結合すると、触媒サブユニットが調節サブユニットから離れ、この遊離した触媒サブユニットが活性を有する。また触媒サブユニット自体もリン酸化によって調節される。プロテインキナーゼAは次のようなフィードバック機構によってダウンレギュレーションされる:プロテインキナーゼAによって活性化される基質の1つにホスホジエステラーゼがあり、これはcAMPをAMPに変換し、cAMP量を下げてプロテインキナーゼAの活性を低下させる。グリコーゲンの分解においては、プロテインキナーゼAがホスホリラーゼキナーゼをリン酸化して活性化し、さらにこれがグリコーゲンホスホリラーゼをリン酸化して活性化する。
プロテインキナーゼC
[編集]概要
[編集]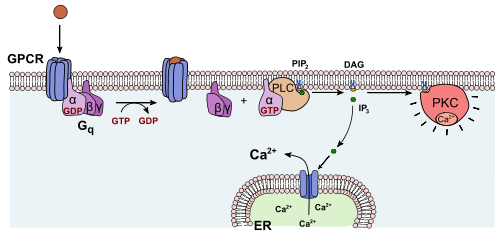
プロテインキナーゼC(プロテインキナーゼ・シー)あるいはPKC、Cキナーゼ (EC 2.7.11.13) は少なくとも10種類以上のアイソザイムから構成されるタンパク質ファミリーである。PKCは基質に存在するセリンおよびスレオニン残基のヒドロキシ基をリン酸化する。1977年に西塚泰美らによって発見された。PKCは、その構造、活性化機構、生理機能によって、在来型(conventionalあるいはclassical:α、βI、βII、γ)、新型(novel:δ、ε、η、θ)、非典型(atypical:ζ、λ/ι)の3つのサブファミリーに分類される。在来型PKCは主にカルシウムイオン(Ca2+)、ジアシルグリセロール (DAG, DG)、あるいはホスファチジルセリン (PS) などのリン脂質によって活性化される。新型PKCはカルシウムイオン結合活性を失っており、ジアシルグリセロールによる活性化を受ける。ジアシルグリセロールは細胞膜、核膜の構成成分であるホスファチジルイノシトール (PI) からホスホリパーゼCによって産生されるため、在来型・新型PKCはシグナル伝達経路においてホスホリパーゼCの下流に位置する。一方、非典型PKCはカルシムイオンおよびジアシルグリセロール結合活性を持たない。在来型PKCの1種であるCαを日本では特にCキナーゼと呼ぶことがある。
アイソザイム
[編集]- conventional - DAG、Ca2+、リン脂質が活性化に必要。
- novel - 活性化にDAGを必要とするが、Ca2+は不要
- atypical - 活性化にDAGおよびCa2+は共に不要
構造と制御
[編集]在来型PKCは、N末端側の調節領域とC末端側の触媒領域からなる。通常、PKCは調節領域に存在する偽基質領域による自己阻害作用のため不活性化状態で細胞質に存在し、セカンドメッセンジャー(カルシウムやジアシルグリセロール)によって活性化されると、細胞質に移行し基質をリン酸化する。 在来型PKCの調節領域には、連続した2つのC1ドメイン(ジアシルグリセロール結合ドメイン:C1AおよびC1B)とC2ドメイン(カルシウムイオン結合ドメイン)が存在する。新型PKCは、在来型と同様に連続した2つのC1ドメインを有しているが、在来型PKCのC2ドメインとホモロジーを有するC2 likeドメインはカルシウムイオンを結合しない。非典型PKCは1つのC1ドメインのみを有するが、ジアシアルグリセロール結合活性は失なわれている。すべてのPKCアイソザイムの触媒領域はATP結合ドメインとキナーゼドメインからなる。
例として、在来型PKCに共通する一次構造を示す:
H2N – 偽基質領域 – C1A - C1B - C2ドメイン – ATP結合ドメイン (C3) – キナーゼドメイン (C4) - COOH
機能
[編集]PKCのターゲット配列はAキナーゼのものに似ており、リン酸化を受けるセリン/スレオニン残基の近くに塩基性アミノ酸がある。基質にはMARCKS(Myristoylated alanine-rich C kinase substrate)タンパク質、MAPキナーゼ、転写因子阻害タンパク質であるIκB、ビタミンD3受容体(VDR)、Rafキナーゼ、カルパインや上皮成長因子受容体 (EGFR) があり、細胞内シグナル伝達において特に中心的な役割を担っていると考えられる。また、12-O-テトラデカノイルホルボール 13-アセタート (TPA) などの発がんプロモーターや抗がん剤として臨床試験が行われているブリオスタチン類の主要なターゲットとしても知られている。 PKCはがんやアルツハイマー病など様々な疾患に関与していることも明らかになっている。
Ca2+/カルモジュリン依存性タンパク質キナーゼ
[編集]EC 2.7.11.17。カルモジュリン(CaM)キナーゼとも呼ばれ、主にCa2+/カルモジュリン複合体により活性化される。活性化に関して「記憶作用」、つまり活性化反応が終わっても活性化状態が長続きする性質がある。次の2つのタイプがある:
- 特異型CaMキナーゼ:例としてミオシン軽鎖キナーゼ(MLCK)がある。これはミオシンをリン酸化して筋肉を収縮させる。
- 多機能型CaMキナーゼ:CaMキナーゼIIとも呼ばれ、神経伝達物質の分泌、転写因子の制御、グリコーゲン代謝など様々な場面で働く。脳のタンパク質の1ないし2%がCaMキナーゼIIである。
構造と自己調節
[編集]CaMキナーゼはN末端側の触媒ドメイン、調節ドメイン、および付随ドメインからなる。Ca2+/カルモジュリンがない場合には触媒ドメインは調節ドメイン(基質に似た配列を含む)による自己抑制を受けている。CaMキナーゼはいくつかの分子が会合してホモオリゴマーまたはヘテロオリゴマーになっている。Ca2+/カルモジュリンによって活性化されると、CaMキナーゼ分子は互いにリン酸化しあう。これには2つの効果がある:
- カルモジュリン複合体への親和性が増し、キナーゼ活性の持続時間が延長する
- カルモジュリン複合体が解離した後も活性化が持続し、さらに持続時間が延長する
MAPキナーゼ
[編集]
Mitogen-activated protein kinases(マイトジェン活性化プロテインキナーゼ、分裂促進因子活性化タンパク質キナーゼ;EC 2.7.11.24)の略。細胞をマイトジェン(細胞増殖促進物質の総称)で処理した場合に活性化したことからこの名がついた。MAPKKKK ⇒ MAPKKK ⇒ MAPKK ⇒ MAPK (これは一般的な表記法でそれぞれKはキナーゼを意味するが、実際には色々な種類がある)というカスケードを形成して順次活性化され、最終的に転写因子をリン酸化して細胞周期や増殖を制御する。
Mos/Rafキナーゼ
[編集]RafはGTP結合型(活性型)のRas(がん遺伝子産物)をはじめとする低分子型GTP結合タンパク質やCキナーゼなどによって活性化され、下流のMEKキナーゼをリン酸化して活性化する。Mosは動物卵の減数分裂で特異的に発現し、その活性(下流のMEK-MAPK-p90Rskを含む)は減数分裂の進行及び減数第二分裂での分裂停止(ヒトデ等の無脊椎動物は減数分裂直後のG1期停止)に必須とされる。これらのキナーゼ自体も元来、原がん遺伝子(c-mos、c-raf)産物として同定されたものである。
cdc2
[編集]細胞周期の分裂期の制御因子として、分裂酵母、カエル、ヒトデなどいくつかの真核生物から独立に発見された(2001年のノーベル生理学・医学賞の受賞対象となった研究である)。制御の仕方は生物により異なるが、いずれもサイクリンとよばれるタンパク質と結合することや、それ自身がリン酸化されることによって活性を持ち、特定の基質をリン酸化することで分裂期の特徴的な現象(核膜崩壊、染色体凝集、紡錘体の形成など)を制御する。
チロシンキナーゼ
[編集]チロシンキナーゼ(あるいはタンパク質チロシンキナーゼ、Protein Tyrosine Kinase; PTK、EC 2.7.10.*)はタンパク質のチロシン残基を特異的にリン酸化する酵素である。多細胞生物のみに存在し、細胞の分化、増殖、接着、あるいは免疫反応などに関わるシグナル伝達に関与する。増殖因子が結合することによって活性化する受容体型と、増殖因子が結合しない非受容体型の2型に大別される。チロシンキナーゼが活性化されると、受容体自身、あるいは標的とするタンパクを特異的にリン酸化する。受容体自身の自己リン酸化により、このリン酸化部位を認識するさまざまなシグナル伝達因子が受容体に結合し、シグナル伝達が始まる。また標的タンパクのリン酸化により、細胞内のさまざまなタンパクが次々と活性化し、シグナル伝達が始まる。がんやアテローマ性動脈硬化症、乾癬などでは、過剰に活性化していることがある。
ヒトのチロシンキナーゼは100種類以上あると予想されている[1]が、その大半は機能が分かっていない。
受容体型チロシンキナーゼ
[編集]細胞膜を貫通する構造であり、細胞外に増殖因子の結合部位をもち、細胞質領域にチロシンキナーゼ活性部位をもつ。EC 2.7.10.1。増殖因子は哺乳動物では50種類以上が知られ、受容体型チロシンキナーゼは、この増殖因子の刺激を細胞内へのシグナルに変換し、細胞の分裂、分化、形態形成で重要な役割を演ずる。代表的なものを以下に挙げる。
- ErbB受容体ファミリー
- 血小板由来増殖因子(PDGF)受容体(PDGFR)
- ニューロトロフィン(神経栄養因子)受容体、TrkA、TrkB、TrkC
- インスリン受容体およびインスリン様増殖因子(insulin-like growth factor、IGF1)受容体
- 血管内皮細胞増殖因子 (VEGF) 受容体 (VEGFR)
- 幹細胞因子(Stem cell factor、scf)受容体(がん遺伝子としてc-kitとも呼ばれる)
構造
[編集]受容体型チロシンキナーゼは、3つの領域からなる。増殖因子が結合する細胞外領域、細胞膜を貫通する疎水性膜貫領域、チロシンキナーゼ活性をもつ細胞内領域である。さらに細胞内領域は膜近傍領域、キナーゼ活性領域、C末端領域の3つに分けられる。インスリン受容体やインスリン様増殖因子のように、細胞外領域が分離独立し、ジスルフィド結合で受容体本体に結合する構造をとるものもある。膜貫領域は単一のαヘリックスからなる。
増殖因子が細胞外領域にある受容体に結合すると、受容体は活性化して細胞膜上を移動し、他の受容体に結合して二量体を形成する。同じ受容体同士が結合する(ホモダイマー)ことも、異なる受容体同士が結合する(ヘテロダイマー)こともある。
制御
[編集]増殖因子の結合により2つの反応が起きる:
- 2個の受容体分子の二量体化、あるいはゆるい二量体の安定化。チロシンキナーゼを受容体とするリガンドは多くが“multivalent”(多価性)、つまり1分子が複数の受容体分子に結合しうる。血小板由来増殖因子受容体 (PDGFR) など一部のチロシンキナーゼは、別の類似したキナーゼとヘテロダイマーを作り、細胞外シグナルに対する様々な応答を導くことができる。
- トランス自己リン酸化(二量体の一方がもう一方をリン酸化すること):不活性型ではキナーゼの2つのサブドメインが、ATPが活性中心に入れないような配置を取っている。自己リン酸化によってサブドメインの位置が変わり、ATPが入って反応できるようになる。
リン酸化を受けるアミノ酸がキナーゼドメインにいくつかある場合、リン酸化されたアミノ酸が多いほどキナーゼ活性は上昇する。この場合、最初のリン酸化はシス自己リン酸化といい、これでキナーゼは「オフ」から「スタンバイ」状態に切り替わる。
非受容体型チロシンキナーゼ
[編集]代表的な構造は、細胞外領域をもたず、細胞内で細胞膜に結合し、細胞内の末端側にチロシンキナーゼ部位をもつ構造である。免疫グロブリンやサイトカイン等の結合部位を持ち,これらの刺激により活性化する。
- がん遺伝子産物c-Src
- Jak:キナーゼドメインとキナーゼ様ドメイン(キナーゼ活性を持たない)という2つの特徴的なドメインを持つことから、二面神ヤヌスにちなみ"Janus kinase"(ヤヌスキナーゼ)と呼ばれる[2]。活性化された受容体と複合体を作るとまず受容体をリン酸化し、次に受容体に結合した下流分子もリン酸化する。JakはSTAT (signal transducers and activators of transcription) をリン酸化し、リン酸化したSTATは二量体を形成して核内へ移行、転写を活性化する。このシグナル伝達系をJak-STAT系という。
- ブルトン型チロシンキナーゼ: リンパ球B細胞受容体のシグナル下流にあり、pre-B細胞の成熟に必須の酵素である。
ヒスチジンキナーゼ
[編集]ヒスチジン特異的キナーゼ(EC 2.7.13.x)は構造的に他のキナーゼと異なりGHKL型kinase/ATPase スーパーファミリーに分類される。ヒスチジンキナーゼは原核生物のほか菌類と植物に見られ、「2成分系シグナル伝達」で機能する。ATPのリン酸基はまずキナーゼ分子のヒスチジン残基(イミダゾール環窒素原子)に移され、その後他のタンパク質(同じキナーゼ分子内のばあいもある)の「レシーバードメイン」にあるアスパラギン酸残基に移される(この段階ではATPのエネルギーは必要ない)。このようなリン酸の受け渡しがさらに繰り返されるばあいもある。その結果として転写制御などが行われる。リン酸化アスパラギン酸が活性型としてシグナルを伝達する。微生物では細胞外の状態(浸透圧、酸素や栄養分など)を感知するいろいろな受容体、植物では植物ホルモン(サイトカイニン、エチレン)受容体や光受容体などが知られる。
動物にあるピルビン酸脱水素酵素キナーゼは構造的にヒスチジンキナーゼに類似しているGHKL型kinaseであるが、ヒスチジンを介した2成分系シグナル伝達は行わず、ピルビン酸脱水素酵素のセリン残基を直接リン酸化する。
アスパラギン酸/グルタミン酸キナーゼ
[編集]EC 2.7.12.x
脚注
[編集]- ^ Plowman GD, Sudarsanam S, Bingham J, et al. "Review. The protein kinases of Caenorhabditis elegans: a model for signal transduction in multicellular organisms." Proceedings of the National Academy of Sciences of the United States of America 1999;96:13603-13610. PMID 10570119
- ^ 『アレルギー』67巻 2号 57-158頁(2018年)、一般社団法人日本アレルギー学会
関連項目
[編集]外部リンク
[編集]- The Protein Kinase Resource: Curated database of protein kinase structures and related data
- Protein kinase gene resource: Genomic analyses, classification and evolution of protein kinases
- A Database of Protein Kinase 3D models provided by GEN2X.com
- Collection of Ser/Thr/Tyr specific protein kinases and similar sequences
- Evolution of protein kinase signaling from yeast to man (pdf)
- AurSCOPE Kinases Database
