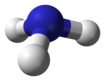
ニクトゲン化水素
ニクトゲン化水素(ニクトゲンかすいそ、英語: hydrogen pnictide、羅Hydrogenium pnictatum, Hydrogenii pnictidum)は、水素とニクトゲン(窒素、リン、ヒ素、アンチモン、ビスマス及び人工元素モスコビウムの第15族元素)が共有結合で結びついた二元化合物である。水素化ニクトゲン(英語: Pnictogen hydride、羅Pnictogenium hydratum, Pnictogenii hydridum)とも称し、炭化水素のニクトゲンアナログであって、アルカンに対応する直鎖飽和ニクトゲン化水素XnHn+2が命名の基本となり、これはIUPAC組織名では「ニクタン(羅Pnictanum、英語: pnictane)」の如く命名されるが、一般に「ニクチン(羅Pnictinum、英語: pnictine)」の様な慣用名を有する。即ちニクトゲンがそれぞれ窒素、リン、ヒ素、アンチモン、ビスマス及びモスコビウムの時、ニクトゲン化水素の組織名(慣用名)はアザン、ホスファン(ホスフィン)、アルサン(アルシン)、スチバン(スチビン)、ビスムタン(ビスムチン)、モスコバン(モスコビン)の如く呼称される。二重結合や環状構造、また官能基に対する命名等はアルカンに準じて行われる。アンモニアは最も一般的なニクトゲン化水素である。
ニクトゲン化三水素
[編集]ニクトゲン化水素の最も単純な形は、化学式XH3(Xはニクトゲン)で表されるニクトゲン化三水素(「モノニクタン」に相当する、炭化水素でモノアルカン、即ちメタンの類縁体である)である。三角形平面である13族元素の水素化物とは異なり、ピラミッド構造であり、そのため極性を持つ。ニクトゲン化三水素は、通常、元素が重くなるほど、不安定になり、毒性が高くなる。
単純なハロゲン化水素やカルコゲン化水素と同様に、ニクトゲン化三水素は水に可溶である。酸性水溶液となる硫化水素やフッ化水素等の他の水素化物とは異なり、アンモニアが水に溶けると、塩基性の水酸化アンモニウムを形成する。ホスフィンも水に可溶である。アルシンやスチビンは若干溶ける。ビスムチンがどうかは分かっていない。
| 化合物 | 化学式 | 構造式 | 空間充填モデル |
|---|---|---|---|
(アザン) |
 |
 | |
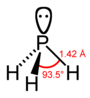
(ホスファン) |
 |
 | |
(アルサン) |
 |
 | |
(スチバン) |
 |
 | |
(ビスムタン) |
 |
 | |
(モスコバン) |
ニクトゲン化三水素の性質のいくつかは、以下のとおりである[2]。
| 性質 | NH3 | PH3 | AsH3 | SbH3 | BiH3 |
|---|---|---|---|---|---|
| 融点 (°C) | −77.8 | −133.5 | −116.3 | −88 | ? |
| 沸点 (°C) | −34.5 | −87.5 | −62.4 | −18.4 | 16.8 (外挿) |
| 液体密度 (g/cm3) | 0.683 (−34 °C) | 0.746 (−90 °C) | 1.640 (−64 °C) | 2.204 (−18 °C) | ? |
| ΔH° f/kJ mol−1 |
−46.1 | −9.6 (?) | +66.4 | +145.1 | +277.8 |
| X–H距離(pm) | 101.7 | 141.9 | 151.9 | 170.7 | 177.59 |
| H–X–H角 | 107.8° | 93.6° | 91.8° | 91.3° | 90.48° |
これらの気体は純粋な形では無臭だが、空気と触れると匂いを持つ。アンモニアは、尿や魚に例えられる悪名高い強い匂いを持つ。ホスフィンは魚やニンニク、スチビンは硫化水素やセレン化水素に似た腐った卵の匂いと言われる。
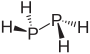
二ニクトゲン化四水素
[編集]二ニクトゲン化四水素は「ジニクタン」に相当し、化学式X2H2(Xはニクトゲン)で表される。炭化水素で云う所のジアルカン、即ちエタンの類縁体である。ヒドラジン(ジアザン)に代表される。
| 化合物 | 化学式 | 構造式 | 空間充填モデル |
|---|---|---|---|
(ジアザン) |
 |
 | |
| ジホスフィン |
 |
 | |
性質
[編集]全ての直鎖飽和ニクトゲン化水素は、XnHn+2と表せる。
アンモニアは、全ての化合物の中で最も大規模に工業生産されている。水と同様に、水素結合によって他のニクトゲン化水素と比べて融点や沸点が高くなる。水素結合の他の効果として、比誘電率は高く、密度、粘度、電気伝導度は低くなる。水と同様に、優れたプロトン性溶媒として良く用いられる[3]。窒化水素としては他に20種類以上が知られており、最も重要なものは、ヒドラジン(N2H4)とアジ化水素(HN3)である。ヒドラジンは水とよく似た物理的性質を持ち、融点と沸点はそれぞれ2.0℃、113.5℃、-5℃の固体密度は1.146 g/cm3、25℃の液体密度は1.00 g/cm3である[4]。アザンは、アンモニア、ヒドラジン、トリアザンを含む。
無色で毒性のある気体のホスフィンは、最も安定な燐の水素化物、nが大きくなるほど熱的に不安定になる直鎖ポリホスファン系列(PnHn+2, n = 1-9))の最初のものである。他に環状や不飽和のポリホスファン系列も知られており、PnHnからPnHn-18迄、1997年には85種類に上った。水には不溶だが、二硫化炭素やトリクロロ酢酸等の有機溶媒には可溶であり、強い還元剤となる[5]。
アルシン、スチビン、ビスムチンは、強い毒性を持ち、熱的に不安定で、無色の気体である。ホスフィン、アルシン、スチビン、ビスムチンには水素結合はなく、アンモニアのようにMH+4とMH-2 (M = P, As, Sb, Bi)に乖離することはない。ニクトゲン原子が重くなるほど密度は高くなり、M-H結合の長さは長くなり、H-M-H結合角は小さくなる。標準生成エンタルピーは、熱不安定性が大きくなるのを反映する。アルシンは250-300℃でヒ素と水素に分解し、スチビンが室温でアンチモンと水素に分解し、ビスムチンは-45℃以上でビスマスと水素に分解する。アルシンやスチビンは非常に容易に酸化して、三酸化ヒ素や三酸化アンチモンと水になる。高温で金属と反応すると、ヒ化物やアンチモン化物となる。As2H4等の低分子の水素化物も知られているが、ずっと不安定で、性質は分かっていない[2]。
水素原子と窒素原子各1つからなるイミド基(NH)もニクトゲン化水素に分類される。
関連項目
[編集]- アザン、アンモニア、アンモニウム、ヒドラジン、トリアザン
- ホスファン、ホスフィン、ジホスフィン
- アルサン、アルシン
- スチバン、スチビン
- ビスムタン、ビスムチン
- アジ化水素
- ハロゲン化水素
- カルコゲン化水素
出典
[編集]- ^ Fricke, Burkhard (1975). “Superheavy elements: a prediction of their chemical and physical properties”. Recent Impact of Physics on Inorganic Chemistry 21: 89–144. doi:10.1007/BFb0116498. オリジナルの2015-04-18時点におけるアーカイブ。 2013年10月4日閲覧。.
- ^ a b Greenwood and Earnshaw, pp. 557–8
- ^ Greenwood and Earnshaw, pp. 420–4
- ^ Greenwood and Earnshaw, pp. 426–7
- ^ Greenwood and Earnshaw, pp. 492–3
関連文献
[編集]- グリーンウッド, ノーマン; アーンショウ, アラン (1997). Chemistry of the Elements (英語) (2nd ed.). バターワース=ハイネマン. ISBN 978-0-08-037941-8。