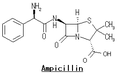
ペニシリン
 Penicillin core structure, where "R" is the variable group | |
| 臨床データ | |
|---|---|
| Drugs.com | Micromedex Detailed Consumer Information |
| 胎児危険度分類 | |
| 法的規制 |
|
| 薬物動態データ | |
| 代謝 | liver |
| 半減期 | between 0.5 and 56 hours |
| 排泄 | Kidneys |
| データベースID | |
| ChemSpider | none |
| 化学的データ | |
| 化学式 | C9H11N2O4S |
| 分子量 | 243.26 g·mol−1 |
ペニシリン(英語: penicillin)は、1928年にイギリス・スコットランドの細菌学者、アレクサンダー・フレミングによって発見された抗生物質である。抗菌剤の分類上では、β-ラクタム系抗生物質に分類される。フレミングはこの功績により、ノーベル生理学・医学賞を受賞した。
発見後、医療用として実用化されるまで10年以上の歳月を要したが、1942年にベンジルペニシリン(ペニシリンG、PCG)が単離されて実用化され、第二次世界大戦中に多くの負傷兵や戦傷者を感染症から救った。以降、種々の誘導体(ペニシリン系抗生物質)が開発され、医療現場に提供されてきた。
1980年代以降、日本国内においては主力抗菌剤の座をセファロスポリン系抗生物質やニューキノロンに明け渡した感があるが、ペニシリンの発見はこれらの抗菌剤が開発される礎を築いたものであり、しばしば「20世紀における偉大な発見」の中でも特筆すべき1つとして数え上げられる[2]。
性質
[編集]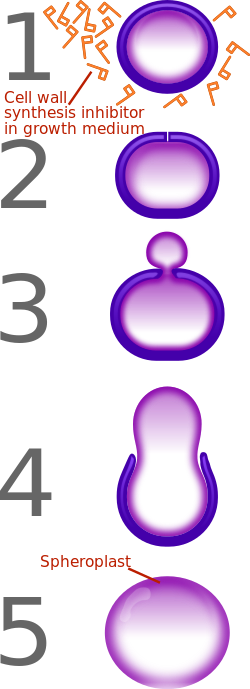
ペニシリンはβ-ラクタム系抗生物質であり、真正細菌の細胞壁の主要成分であるペプチドグリカンを合成する酵素(PBP)と結合し、その活性を阻害する。この結果、ペニシリンが作用した細菌はペプチドグリカンを作れなくなり、その分裂に伴って細胞壁は薄くなり、増殖が抑制される(静菌作用)。また細菌は細胞質の浸透圧が動物の体液よりも一般に高いため、ペニシリンの作用によって細胞壁が薄くなり損なわれた細菌細胞では外液との浸透圧の差から細胞内に外液が流入し、最終的には溶菌を起こして死滅する(殺菌作用)。
この作用から、ペニシリンは増殖中の細菌に強く働き、この性質を利用した、栄養要求変異株を選抜(濃縮)するペニシリン濃縮法がある。
ペニシリンは、真正細菌の細胞壁の合成を標的として特異的に阻害する薬剤である。ペプチドグリカンを主要成分とする細胞壁はマイコプラズマを除く真正細菌の生存に必須な構造であるが、ヒトを含めた真核生物には存在しない。そのため、ペニシリンは真正細菌に対する選択毒性が高く、ヒトに対する毒性は低い。この点において、ペニシリンは既に発見・実用化されていた色素剤やサルファ剤と比べて、抗細菌剤としてはるかに優れていた。このため実用化後に大きく普及し、他の多数の抗生物質開発のきっかけになった。
初期のペニシリンはブドウ球菌を代表とするグラム陽性菌、グラム陰性球菌に対しては強い抗菌作用を示すが、大腸菌を代表とするグラム陰性桿菌に対しては抗菌作用が弱いという性質を持っていた。特に、グラム陰性桿菌の中でも薬剤に対する自然抵抗性が高い緑膿菌には無効であった。
ペニシリン系抗生物質開発の歴史は、弱作用菌や耐性菌との戦いの歴史でもある。作用が弱いグラム陰性桿菌に対する作用増強を目的としてペニシリン骨格を種々の化学修飾あるいは置換基の化学変換により、弱作用菌への抗菌力の増強が試みられ、多くのペニシリン系抗生物質が開発された。ペニシリン系抗生物質に関しては一般に新しい抗菌薬が開発されるに従って、グラム陽性菌にもグラム陰性菌にも作用を持つように移行していく傾向がある。
またフレミングが発見したペニシリンは、酸性で分解されやすく経口投与では胃液で分解されて無効になるため、当初は注射剤として用いられた。しかし、経口投与可能なペニシリン系抗生物質も、初期の段階から開発されている。
耐性菌の出現
[編集]ペニシリンが用いられるようになると、ペニシリンに対する薬剤耐性を新たに獲得したペニシリン耐性菌が出現した。ペニシリン耐性菌はペニシリンが実用化された数年後には臨床現場から分離されたが、抗生物質の無秩序な濫用が引き金となって拡大し、1960年代にはペニシリン耐性菌の問題が顕現化して医療上の大きな問題になった。
当時出現した初期のペニシリン耐性菌は、ペニシリナーゼ(β-ラクタマーゼ(β-lactamase, EC 3.5.2.6, 反応))というβ-ラクタム環を加水分解し、開環する酵素を産生する。これは薬剤分解酵素の遺伝子を突然変異、あるいはファージやプラスミドを介して獲得したものであった。そこで、これらの分解酵素による分解を受けないペニシリン系抗生物質であるメチシリンが開発された。また、ペニシリンとクラブラン酸などのβ-ラクタマーゼ阻害剤を合剤とすることで、耐性菌の問題を解決してきた。
しかし、メチシリンが実用化された数年後には、メチシリンに耐性を持つメチシリン耐性黄色ブドウ球菌(MRSA)が出現した。MRSAは、PBPの変異型であるPBP2'を獲得した黄色ブドウ球菌である。MRSAのPBP2'はβ-ラクタム系抗生物質との結合能が弱く阻害を受けなくなっているため、メチシリンをはじめとする全てのβ-ラクタム系抗生物質に対する多剤耐性を獲得している。
ペニシリンは、細菌が細胞壁を作るのに必要な酵素であるペニシリン結合タンパク質(PBP)に結合して作用する。PBPにはPBP1、PBP2と多くの種類があることが知られている。多くの耐性菌はβ-ラクタマーゼを産出することでペニシリンを分解して耐性を得ている。β-ラクタマーゼは遊離しているがPBPの1種であり、たまたまペニシリンを分解する活性があったものと考えられる。
もともと染色体上に持っていたPBP遺伝子を発現できる菌株が、人間がペニシリンを乱用したことで淘汰に生き残り、β-ラクタマーゼ産出菌の割合が増えてきたのだと考えられている。なお、MRSAなどはまったく別の機構で耐性を得ている。これはPBPの変異でペニシリンが変異PBPに結合できなくなるからである。
生合成
[編集]前駆体であるACVトリペプチド (δ-(L-α-aminoadipoyl)-L-cysteinyl-D-valine)は、単量体であるL-アミノ酸から酵素ACV-synthetase [3][4]によりリボゾームを介することなく細菌やカビの細胞内で生合成される。ACVトリペプチドは酵素 isopenicillin N synthetase[5][6]によりイソペニシリンN(isopenicillin N)へと環化し、β-ラクタム環が形成される。 イソペニシリンNは酵素 isopenicillin N N-acyltransferase [7][8] により側鎖が交換されるが、関与するアシル-CoAのカルボン酸残基に応じて、種々の誘導体が得られる。このように、isopenicillin N N-acyltransferaseが比較的基質特異性が低い酵素であるため、Penicillium spp.においてもイソペニシリンNから、もともと細胞内に存在するアシル-CoAと交換することで、ペニシリンG、ペニシリンKなど多くの誘導体が産生される。イソペニシリンNはイソペニシリンN異性化酵素(isopenicillin N epimerase)[9][10]によってペニシリンNに異性化される。セファロスポリン系の抗生物質の生合成は、ペニシリンNを出発物質としている[11]。
ペニシリン系抗生物質
[編集]ペニシリンは、狭義にはフレミングが見つけたアオカビ培養液から精製したもの(天然ペニシリン)と、培地に原料を人為的に添加してアオカビに合成させた後に精製したもの(生合成ペニシリン)を指し、これらにはペニシリンG、ペニシリンVなどの名称が付けられている。一方、これらを原料に化学修飾を施したもの(半合成ペニシリン)や、すべて化学的に合成したもの(合成ペニシリン)も開発されている。これらはいずれも、その活性中心であるβ-ラクタム環を含んだ、ペナム骨格を有する抗生物質であり、ペニシリン系抗生物質、あるいはペナム系抗生物質と総称される。広義には、これらのペニシリン系抗生物質のことをすべてペニシリンと呼ぶことがある。

- 天然ペニシリン
- アレクサンダー・フレミングが発見した、Penicillium noctumの培養液に含まれていたペニシリン。フローリーとチェインがその精製に成功した際、これらは複数のペニシリン系化合物の混合物であることが判明した。いずれもペナム環の3位にカルボン酸基がついた、ペニシラン酸化合物である。6位側鎖の違いから、ペニシリン G、X、F、Kなどが発見されたが、そのうち収量、活性、安定性の面でペニシリン G(ベンジルペニシリン)が最も抗菌剤として優れていた。P. noctumのペニシリン産生能はそれほど高くなかったが、その後より生産量の高いP. chrysogenumが発見され、さらに品種改良と発酵培養技術の改良によって収量が改善された。
- 生合成ペニシリン
- 天然ペニシリンを産生するアオカビの培養液に別の原料を人為的に添加し、生合成的特性を利用して誘導体化した一群のペニシリンを生合成ペニシリンと呼ぶ。すなわち、培地中に目的のカルボン酸を大量に存在させ、他の栄養素や培養条件を調整することで積極的に同カルボン酸を取り込ませて目的のペニシリン誘導体を醗酵させるのである。この方法で開発されたペニシリンとしてはフェノキシメチルペニシリン(ペニシリン V)、ペニシリン N、ペニシリン Oなどが挙げられる。
- 半合成ペニシリン
- 天然ペニシリンや生合成ペニシリンを原料にして、化学的な修飾を施して開発されたもの。その多くは、醗酵で得られたペニシリンを酵素的に6位側鎖を切断し、6-アミノペニシラン酸とし、続いて化学的に新しい6位側鎖を導入する方法で誘導体化された。この方法は生合成ペニシリンに比べ誘導体化する際の制約が少ないため、多種多様のペニシリン誘導体を合成することが可能になった。
- 合成ペニシリン
- ペニシリン系化合物が相次いで開発されていた1940年代から1950年代前半には、その構造の複雑さからペニシリンを化学的に全合成することは不可能だと考えられていたが、1957年、ジョン・シーハンがペニシリンVの全合成に成功した。これによって化学合成法が確立されると、それまで培養を必須としていたペニシリンの生産技術が変革し、従来の天然、生合成ペニシリンが化学合成されるようになると共に、新たに化学合成による新しいペニシリン系化合物が開発された。
-
ペニシリン N
-
ペニシリン O
-
ペニシリン V
-
メチシリン
-
オキサシリン
-
クロキサシリン
-
ジクロキサシリン
-
タランピシリン
-
アゾシリン
-
メズロシリン
主なペニシリン系抗生物質
[編集]ペニシリン系抗生物質は、上記した開発および生産の方法の違いによる分類の他、耐酸性と、治療対象になる微生物の範囲による分類が汎用的に用いられる。天然ペニシリンが胃酸によって分解され、経口投与が不能であった欠点を補うため、耐酸性ペニシリンが開発された。
初期のペニシリンは、グラム陽性菌および陰性球菌に対してのみ有効で、またペニシリン耐性菌が獲得したペニシリナーゼ(ペニシリン分解酵素)によって不活化されるものであったが、ペニシリナーゼ抵抗性ペニシリン、グラム陰性桿菌にも有効な広域ペニシリン、の順に、抗菌スペクトルを広げる方向で開発が進んだ。臨床的な分類としては、古典的なペニシリン、広域ペニシリン(広域は名前だけで耐性の問題でほとんど古典的なペニシリンと変わらない)、黄色ブドウ球菌に効果のあるペニシリン、緑膿菌に効果のあるペニシリン、β-ラクタマーゼ阻害薬配合剤(広域ペニシリンと配合することで耐性の問題を一部回避したもの)と分けておくと、わかりやすい。
以下に代表的なペニシリン系抗生物質を示す(略号は抗微生物薬略語:日本化学療法学会制定)
天然ペニシリン(点滴、筋注用)
[編集]
グラム陽性球菌、グラム陽性桿菌とグラム陰性球菌に有効。グラム陰性桿菌およびペニシリナーゼ酸性耐性菌には無効。酸による分解を受けるため、経口投与不能で注射剤として用いられた。抗菌スペクトルの面から、下記の耐酸性ペニシリンと併せて第一世代ペニシリンと呼ばれることがある。
- ベンジルペニシリン(ペニシリンG) (benzylpenicillin : PCG)
- 天然ペニシリン。Penicillium notatum産生物中、最も活性が大。前述のとおりペニシリンGの物質名はベンジルペニシリンである。成人では300万〜400万単位を4時間おきに投与する。これは約1gを4時間おきである(ペニシリン1単位は0.27μgである)。ペニシリンG経口は、A群溶連菌による軽度の感染症、咽頭炎や猩紅熱にのみよい適応がある。ペニシリンGは嫌気性菌によい活性があるが、耐性の問題のため現在では使いにくくなっている。特に重要なのは日本において髄膜炎菌と梅毒トレポネーマは100%ペニシリン感受性であるということ、溶連菌に対しても非常に効果があるということである。注意点としては伝染性単核球症を溶連菌による細菌性喉頭炎と誤診し、ペニシリンを投与すると皮疹を起こすので注意が必要である。また筋注用のペニシリンG製剤もある。ベンジルペニシリンベンザチンやプロカインベンジルペニシリンがあげられる。また、日本では入手難である。
耐酸性ペニシリン(経口薬)
[編集]経口投与を可能にするため、耐酸性にした生合成ペニシリン、半合成ペニシリン。抗菌スペクトルは天然ペニシリンと同じであり、それと併せて第一世代ペニシリンと呼ばれることがある。
- フェノキシメチルペニシリン (phenoxymethylpenicillin : Penicillin V)
- 初めて開発された、耐酸性の生合成ペニシリン。ジョン・シーハンによって全合成方法が開発された最初のペニシリン系化合物でもある。
- ベンジルペニシリンベンザチン
- 経口薬としてはバイシリンGなどがあげられる。適応はベンジルペニシリンと全く同じである。呼吸器感染症の中で細菌性扁桃炎等の場合、処方されることがある。
ペニシリナーゼ抵抗性ペニシリン(黄色ブドウ球菌用)
[編集]多くは半合成ペニシリンであり、ペニシリナーゼおよびβ-ラクタマーゼによる分解を受けにくく、これらの耐性菌に対して有効。こういった特徴から黄色ブドウ球菌に対して用いることが期待できる。ただしMRSAには無効であり、主にグラム陽性菌用と考えられている。歴史的にはメチシリンが有名である。メチシリンは副作用が強く、マーケットから外されてしまった。そこで登場したのが合成ペニシリンである、クロキサシリン(商品名: メトシリンS)やオキサシリンやナフシリンである。適応はMSSAである。日本ではこれらの薬は販売していない。
- メチシリン (methicillin : DMPPC)
- 最初のペニシリナーゼ抵抗性ペニシリン。活性が低く、不安定なため注射でしか投与できない。間質性腎炎の副作用があり、市場からは撤退している。このため検査施設ではほとんど使われておらず、扱いやすいオキサシリンで代用されている。
- オキサシリン (oxacillin : MPIPC)
- メチシリン類似の抗菌・耐性菌活性。米国では頻用されている。メチシリンの代わりにMRSA検査用に使用される。経口、注射。
- ナフシリン (Nafcillin:NFPC)
- メチシリン類似の抗菌・耐性菌活性。米国では頻用されている。
- クロキサシリン (cloxacillin : MCIPC)
- オキサシリン類似体。経口、注射。
- ジクロキサシリン (Dicloxacillin : MDIPC)
- 経口、注射。
広域ペニシリン(緑膿菌用を含む)
[編集]抗菌スペクトルを拡大してグラム陰性菌にも有効になったもの。初期に開発されたアンピシリンなどは、グラム陰性菌の中でも特に薬剤への自然抵抗性が強い緑膿菌には無効であったが、後に緑膿菌にも有効なカルベニシリンが開発された。基本的には合成ペニシリンでありアミノ基をもつ。点滴薬のアンピシリン(商品名:注射用ビクシリンなど)、経口薬のアモキシリン(商品名:サワシリンなど)がある。2007年現在はほとんどペニシリンと変わらないと考えてよい(当初はグラム陰性に効くのポイントだった)。感受性のある腸球菌感染症にはアミノペニシリンはよい選択である。リステリア感染症の第一選択薬はアミノペニシリンである。特にリステリア(特にリステリア髄膜炎では大量静注する)、腸球菌にはセフェム系が効かないことが多いので重宝する。
緑膿菌にも効果がある広域ペニシリンをウレイドペニシリンともいい、広域でやや活性の劣るペニシリンの仲間とされている。構造からはアミノアシルペニシリンともいう。ピペラシリン(商品名:ペントシリン、β-ラクタマーゼ阻害剤を含んだものとしてはタゾシン、ゾシン)、カルベニシリンが有名である。特にピペラシリンは緑膿菌を疑ったときに重宝する。緑膿菌感染症は糖尿病など免疫抑制下、長期入院の患者が対象となる。そして緑膿菌はピペラシリンに対してトレランスをもっている、即ちMIC(minimum ihnibitory concentration: 最小発育阻止濃度)とMBC(minimum bactericidal concentration: 最小殺菌濃度)に差がある。よって大量静注が必要である。またアミノグリコシドを用いるとシナジーがある。アミノグリコシドを用いてからピペラシリンを用いた方が効果が高いと言われている。
緑膿菌に無効な広域ペニシリン
[編集]- アンピシリン (ampicillin : ABPC)
- 最初の広域ペニシリン、経口、注射。分子生物学の実験でもよく利用される。よく用いる製剤としてはビクシリンがあげられる。ビクシリンは手術際の予防投与でも用いられ、合剤であるユナシンはビクシリンにβ-ラクタマーゼ阻害薬を加えたものである。ユナシンは肺炎の第一選択にもなる。
- アモキシシリン (amoxicillin : AMPC)
- 経口ペニシリンであり、バセトシン細粒などが有名である。中耳炎や急性副鼻腔炎に関しては第一選択である。感染臓器の違いから同様の起因菌である肺炎には用いないのが特徴である。
- バカンピシリン (bacampicillin : BAPC)
- 経口ペニシリン
- タランピシリン (talampicillin : TAPC)
- 経口ペニシリン
緑膿菌に有効な広域ペニシリン
[編集]- カルベニシリン (carbenicillin : CBPC)
- 緑膿菌にも有効になった最初の広域ペニシリン。
- チカルシリン (ticarcillin : TIPC)
- メズロシリン (mezlocillin : MZPC)
- テモシリン (temocillin)
- アパラシリン (apalcillin)
- ピペラシリン (piperacillin : PIPC)
- 点滴用製剤であるペントシリンは緑膿菌をターゲットとした場合、非常に有効である。
その他
[編集]- スルタミシリン (sultamicillin : SBTPC)
- 広域ペニシリンであるアンピシリンと、β-ラクタマーゼ阻害剤であるスルバクタムをエステル結合させたもの。β-ラクタマーゼ抵抗性の広域ペニシリン。尚、注射剤は、スルバクタムをエステル結合させずにアンピシリンにスルバクタムを配合させている。
未分類
[編集]合剤
[編集]広域ペニシリンの抗菌力、抗菌スペクトラムを維持しつつ、β-ラクタマーゼ産生菌にも作用させるために、β-ラクタマーゼ阻害薬とペニシリン系抗生物質を配合した合剤が販売されており、広く使用されている。β-ラクタマーゼ阻害薬としてはクラブラン酸、スルバクタム、タゾバクタムがある。クラブラン酸のみ肝臓から排泄される。β-ラクタマーゼと結合後、活性化されβ-ラクタマーゼを阻害する。ESBL産生菌に対しても有効であり、ペニシリナーゼ(プラスミド上)には効果あるが、セファロスポリナーゼ(染色体上)には効果が弱い。アモキシシリンとクラブラン酸の合剤であるオーグメンチンやクラバモックス、アンピシリンとスルバクタムの合剤であるユナシンが知られている。
- スルバクタム・アンピシリン (sulbactam/ampicillin : SBT/ABPC)
- 注射剤。主に呼吸器感染症、周術期感染阻止に用いられる。一部嫌気性菌にも有効。2006年時点では日本で一番使用されている注射用ペニシリン製剤である。商品名ユナシンS®である。
- タゾバクタム・ピペラシリン (tazobactam/piperacillin : TAZ/PIPC)
- 注射剤。グラム陰性菌に強い。世界でもっとも消費されている注射抗菌剤である(商品名ゾシン)。2位はセフトリアキソン(CTRX)。
- アモキシシリン・クラブラン酸 (amoxicillin/clavulanic acid : AMPC/CVA)
- 経口剤。アモキシシリン単独では無効な菌種にも有効である(商品名 オーグメンチン・クラバモックス)。
- チカルシリン・クラブラン酸 (ticarcillin/clavulanic acid : TIPC/CVA)
- 注射剤。日本では発売中止(明治製菓-GSK)。
適応
[編集]ペニシリンが第一選択となる疾患
- 定型肺炎
- 2007年現在、起因菌である肺炎球菌はペニシリン耐性である場合が多い。そのため培養で薬剤感受性を調べておく必要がある。ペニシリン低感受性肺炎球菌ならば大量投与(1200万〜2400万単位)用いることで治療することはできる。肺炎球菌の耐性機序がβ-ラクタマーゼによるものならば合剤を用いるという方法もある。
- 梅毒
- 梅毒は100%ペニシリン感受性であるので、第一期、第二期に対してはアモキシシリンなどが用いられる。
- 咽頭炎
- 細菌性の場合は溶連菌が起因菌となるのでバイシリンGを用いることが多い。10日間位の服薬で完治すると言われている。伝染性単核球症との鑑別に注意が必要である。
- 中耳炎、副鼻腔炎
- 細菌性の場合は定型肺炎と同様の起因菌である。即ち肺炎球菌(グラム陽性球菌)、インフルエンザ桿菌(グラム陰性桿菌)、モラクセラ・カタラーリス(グラム陰性球菌)である。第一選択としては抗菌薬を使用しないが、症状が強い場合は広域ペニシリンであるアモキシシリン(パセトシン)を用いる場合が多い。肺炎と抗菌薬が異なるが肺と異なり、中耳や副鼻腔は不潔な臓器なのである程度菌を殺せれば臨床症状は改善するので問題ない。
- 感染性心内膜炎
- 壊死性筋膜炎
副作用
[編集]ペニシリンはアレルゲンとしての一面を持ち、アレルギー反応を引き起こしやすい。そして数万人に一人程度の確率で、アナフィラキシー・ショックを引き起こすことがあり、ペニシリンが引き起こす重篤なアレルギー症状は「ペニシリン・ショック」と呼ばれた。以前は皮内テストが行われていたものの、2004年9月に日本化学療法学会の提言に沿う形で、厚生労働省が抗菌薬の添付文書改訂を指示し、徐々に皮内テストは廃止される方向にある。
| 分類 | 発症時期 | 機序 | 主症状 |
|---|---|---|---|
| I型 | 1時間以内 | IgE | アナフィラキシー、頻脈、低血圧、喉頭浮腫、気道閉塞、血管浮腫、じんま疹 |
| II型 | 72時間以内 | IgG、補体 | 間質性腎炎、溶血性貧血、血小板減少 |
| III型 | 72時間以内 | IgG、IgM免疫複合体 | 血清病、薬剤熱、接触性皮膚炎 |
| IV型 | 72時間以内 | 接触性皮膚炎 | |
| その他 | 播種状紅斑丘疹様発疹 |
ただし、I型は1時間から72時間までに発症することもある。型は全てアレルギーのクームスの分類に対応させた。
ペニシリンの副作用は基本的にアレルギーなので投与量は関係ない。ペニシリン1単位は0.27μgであるのでよく用いられる処方、2400万単位といっても6.5gほどであり、ほかの抗菌薬と変わらない。また、アレルギー性なので副作用が生じたら原則として投与中止である。特に間質性腎炎などでは腎障害があるので投与量を調節するという選択をしてしまいがちであるが投与量を変えてもアレルギー性の障害なので意味はない。ただし、梅毒にペニシリンを投与すると、ヤーリッシュ・ヘルクスハイマー反応と呼ばれる発熱、皮疹といった症状が出ることがある。これはアレルギー反応ではないので投与を中止してはならない。
ペニシリンによるアナフィラキシーは頻度は低いがアレルギーの発生率は0.7〜10%程度あり、皮疹などがみられたら他の系列の薬に変更するのが望ましい。セフェム系では交叉反応を起こすことも知られているがそこまで高頻度ではないので変更を行うのに意味はある。梅毒の治療などでアレルギーが出ても使用継続する必要がある場合はアレルギー専門医のもとで脱感作を行うという方法もある。
1956年、東京大学法学部長尾高朝雄が「ペニシリン・ショック」で死亡し、報道機関で大きく取り上げられた。この事故をきっかけとしてペニシリンによるショック死は実はすでに100名に及んでいたことが明らかになり社会問題となった[12]。
歴史
[編集]1928年、アレクサンダー・フレミングがブドウ球菌の培養実験中に、コンタミネーションにより生じたアオカビ(Penicillium notatum、現在はP. chrysogenum)のコロニーの周囲に阻止円(ブドウ球菌の生育が阻止される領域)が生じる現象を発見したことに端を発する。フレミングは、アオカビが生産する物質が細菌を溶かしたものと考え(実際には、この現象は溶菌ではなく細菌の発育阻止によるものであった)、アオカビを液体培養した後の濾液にも同じ活性があることを突き止め、彼自身は単離しなかったその物質を、1929年にアオカビの学名にちなんで「ペニシリン」と名付けた。

その後、1940年にH.W.フローリー(Howard Walter Florey)とE.B.チェイン(Ernst Boris Chain)がペニシリンの単離に成功したが、1つと思われたペニシリンは、ペニシリンG、ペニシリンNなどの混合物であった。翌1941年には、実際臨床で抗菌薬としての効果を確認した。その後は効率よくペニシリンを作る真菌の探求が進むとともに、菌の培養及びペニシリンの抽出法などが改良され、大量生産が可能となったペニシリンは、第二次世界大戦において軍隊で広く用いられた。終戦後の1945年からは民間にも開放された。
フレミングの「ペニシリンの発見」とフローリーなどの「ペニシリンの再発見」と、それに続くペニシリンGの実用化は、感染症の臨床治療を一変させ、その功績によりフレミング、フローリー、チェインには、1945年にノーベル生理学・医学賞が授与された。
日本では、1943年(昭和18年)にナチス・ドイツの医学雑誌から存在を知った陸軍軍医学校で開発が始まり、翌1944年に少量ながら生産に成功。「
1946年からは占領軍が招聘したテキサス大学のジャクソン・フォスター教授の指導のもとに、日本の製薬会社各社が生産を開始し[14]、翌1947年から病院を通して日本中へと広まった。その結果、日本では抗生物質の開発及び生産が著しく増大し、感染症の治療法が普及し、乳児から高齢者までの全ての年齢層で感染症による死亡率が著しく減少し、平均寿命の上昇に大きな影響をもたらした。
グアテマラでの意図的性病感染による人体実験
[編集]1946年から1948年までグアテマラで、アメリカ公衆衛生局と国立衛生研究所、公衆衛生局の医師ジョン・カトラーにより、ペニシリンの効果を確かめるための人体実験(梅毒スピロヘータ接種)が行われていたことが明らかになり、オバマ大統領と厚生長官がグアテマラ大統領に謝罪する事態に発展した[15][16]。2011年3月9日、感染者関係者はこの謝罪を評価はしたものの、アメリカ合衆国連邦政府に、3月11日までに和解案を提示しなければ、損害賠償請求の集団訴訟を提起する旨通知した[17]。
関連項目
[編集]- 感染症学
- 抗生物質
- β-ラクタム系抗生物質
- セファロスポリン
- 抗菌剤の年表
- 耐性菌
- 結核
- 呼吸器感染症
- 破傷風
- JIN-仁- - 劇中で江戸時代にあるものを使用してペニシリンを製造する描写があり、ドラマでも再現された[18]。
- 火の鳥 (漫画) - 「黎明編」において、弥生時代に、破傷風をペニシリンの経口摂取で(油で練ったアオカビを食べさせる)治療するという描写があるが、ペニシリンは胃液で破壊されるため、考証的には間違いであるとされる。
- アル・カポネ:民間人として初めてペニシリンを投与されたが、既に梅毒の第3期だったため効果はなかった。
- 海烈号事件
脚注
[編集]- ^ Walling, Anne D. (September 15, 2006). “Tips from Other Journals – Antibiotic Use During Pregnancy and Lactation”. American Family Physician. September 25, 2015閲覧。
- ^ 20世紀の代表的なくすりとは? - 日本製薬工業協会 2015年1月9日閲覧
- ^ EC 6.3.2.26
- ^ 反応
- ^ EC 1.21.3.1
- ^ REACTION: R04872
- ^ EC 2.3.1.164
- ^ REACTION: R04868
- ^ EC 5.1.1.17
- ^ 反応
- ^ ペニシリンとセファロスポリン性抗生物質生合成図
- ^ 川上武『戦後日本病人史』p.324 ISBN 978-4540001697
- ^ 角田房子「碧素・日本ペニシリン物語」、新潮社、1978年、ASIN B000J8NMSK
- ^ 発酵工業の話 II、柳田友道HP
- ^ 医師がグアテマラで故意の梅毒感染実験 米政府が謝罪CNN
- ^ 米国が1940年代にグアテマラで性病実験、米大統領が謝罪AFP
- ^ グアテマラの梅毒実験、感染者が米政府に集団訴訟の構えCNN
- ^ 現場レポートVol.12
参考文献
[編集]- 岩田健太郎・宮入烈 共著『抗菌薬の考え方、使い方』中外医学社、2004、ISBN 4-498-01758-7
外部リンク
[編集]- 合成ペニシリン Amoxycillin にかんする細菌学的研究 日本化学療法学会 (PDF)
- ペニシリン生合成
- 北里一郎、ペニシリンの歩んできた道 日本化学療法学会雑誌 Vol.45 (1997) No.8 P698-700