リボソーム
| 細胞生物学 | |
|---|---|
| 動物細胞の模式図 | |
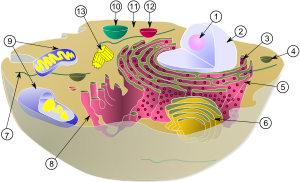 |
リボソーム(英: ribosome 独: Ribosom、リボゾーム)は、すべての細胞に存在する生体タンパク質合成(mRNAの翻訳)を行う分子機械である。リボソームは、伝令RNA(mRNA)分子のコドンによって指定された順序でアミノ酸をつなぎ合わせ、ポリペプチド鎖を形成する。リボソームは、リボソーム小サブユニットとリボソーム大サブユニットという2つの主要な構成要素からなる。それぞれのサブユニットは、1つまたは複数のリボソームRNA(rRNA)分子と多数のリボソームタンパク質(RPまたはr-タンパク質)から構成されている[1][2][3]。リボソームとそれらが会合する分子を合わせて翻訳装置(translational apparatus)とも呼ぶ。
概要
[編集]
タンパク質を構成するアミノ酸の配列をコードするデオキシリボ核酸(DNA)の配列は、mRNA鎖に転写される。リボソームはmRNAに結合し、その塩基配列から、特定のタンパク質を生成するための正しいアミノ酸の配列を決定する。アミノ酸は、転移RNA(tRNA)分子によって選択され、リボソームへと運ばれ、アンチコドンのステムループを介してmRNA鎖に結合する。mRNAの各コーディングトリプレット(三連符、コドン)に対して、アンチコドンが正確に一致した固有のtRNAがあり、成長するポリペプチド鎖に組み込むために正しいアミノ酸を運ぶ。タンパク質が生成されると、折り重なって機能的な三次元構造を形成することができる。
リボソームは、リボ核酸(RNA)とタンパク質の複合体からなるリボ核タンパク質複合体である。各リボソームは、サブユニットと呼ばれる小サブユニット(30S)と大サブユニット(50S)が互いに結合して構成される。
- 小サブユニット(30S)は主に解読機能を担っており、mRNAとも結合する。
- 大サブユニット(50S)は主に触媒機能を担っており、アミノアシルtRNAとも結合する。
タンパク質が構成要素から合成される過程は、開始、伸長、終結、リサイクルの4つの段階で行われる。すべてのmRNA分子の開始コドンはAUGという配列を持っている。終止コドンはUAA、UAG、UGAのいずれかであり、これらのコドンを認識するtRNA分子が存在しないため、リボソームは翻訳の完了を認識する[4]。リボソームがmRNA分子の読み取りを終えると、2つのサブユニットが分離し、通常は分解されるが、再利用されることもある。リボソームはリボザイムの一種であり、リボソームRNAは触媒的アミノ酸をに結合するペプチジルトランスフェラーゼ活性を担っているからである[5]。
リボソームは、多くの場合、粗面小胞体を構成する細胞内膜と関連している。
細菌、古細菌、真核生物の3ドメイン系のリボソームは、互いに驚くほど似ていることから、共通の起源を示す証拠と考えられている。しかし、これらの大きさ、配列、構造、およびタンパク質とRNAの比率は異なっている。この構造の違いにより、ある種の抗生物質は細菌のリボソームを阻害して細菌を殺滅させるが、ヒトのリボソームは影響を受けない。すべての生物種において、複数のリボソームが1本のmRNA鎖に沿って同時に移動し(ポリソームと呼ばれる)、それぞれが特定の配列を「読み取り」、対応するタンパク質分子を生成することがある。
真核細胞のミトコンドリアリボソームは、機能的には細菌のリボソームと多くの特徴が類似しており、ミトコンドリアの進化的起源を反映しているものと考えられる[6][7]。
発見
[編集]リボソームは、1950年代半ばにルーマニア系アメリカ人の細胞生物学者ジョージ・エミール・パラーデによって、電子顕微鏡を使って高密度の粒子または顆粒として初めて観察された[8]。その粒状の構造から、当初はパラーデ顆粒(Palade granules)と呼ばれていた。「リボソーム」という用語は、1958年末に科学者アグノーによって提案された。
シンポジウムの途中で、意味上の問題が明らかになった。ある参加者は、「ミクロソーム」とは、他のタンパク質や脂質の物質によって汚染されたミクロソーム画分のリボ核タンパク質粒子を意味すると考え、別の参加者は、ミクロソームは粒子によって汚染されたタンパク質と脂質から構成されていると考えた。「ミクロソーム粒子」という表現は適切とは思えず、「ミクロソーム画分のリボ核タンパク質粒子」という表現はあまりにも不自然であった。会議中に「リボソーム」という用語が提案され、これはとても納得のゆく名前であり、響きもよい。もし「リボソーム」が35-100Sサイズのリボ核タンパク質粒子を表すのに採用されれば、現在の混乱は解決するだろう。 — Albert、Microsomal Particles and Protein Synthesis[9]
1974年、アルベルト・クラウデ、クリスチャン・ド・デューブ、ジョージ・エミール・パラーデが、リボソームの発見によりノーベル生理学・医学賞を共同受賞した[10]。2009年のノーベル化学賞は、リボソームの詳細な構造と機構の解明により、ヴェンカトラマン・ラマクリシュナン、トマス・A・スタイツ、アダ・ヨナスに贈られた[11]。
構造
[編集]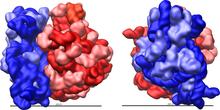
リボソームは、複雑な細胞内機械(cellular machine)である。リボソームの大部分は、リボソームRNA(rRNA)と呼ばれる特殊なRNAと、数十種類の異なるタンパク質(正確な数は生物種によって多少異なる)で構成されている。リボソームタンパク質とrRNAは一般に、大サブユニットと小サブユニットと呼ばれる大きさが異なる2つのリボソーム断片の中にある。リボソームは2つのサブユニットが組み合わさって構成され(図2)、タンパク質合成の際に一体となって、協働してmRNAをポリペプチド鎖に翻訳する(図1)。大きさの異なる2つのサブユニットから形成されるため、直径よりも軸長の方がわずかに長くなっている。分子量としては、大腸菌では2.7 MDa、哺乳類では4.6 MDaに達する。
原核生物のリボソーム
[編集]原核生物のリボソームは直径が約20 nm(200 Å)、65%のrRNAと35%のリボソームタンパク質からなる[12]。真核生物のリボソームは直径が25-30 nm(250-300 Å)、rRNAとタンパク質の比率は1に近い[13]。結晶学的研究により[14]、ポリペプチド合成の反応部位近傍にリボソームタンパク質が存在しないことが明らかになった。このことから、リボソームのタンパク質成分は、ペプチド結合形成の触媒作用には直接関与せず、むしろrRNAのタンパク質合成能力を高める足場として機能している可能性が考えられる(リボザイムを参照)。
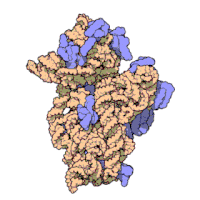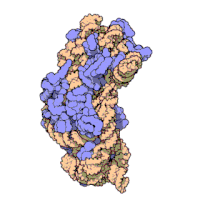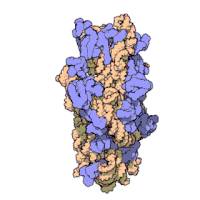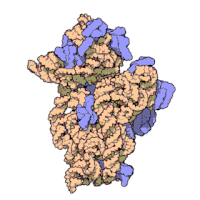
原核生物のリボソームサブユニットと真核生物のリボソームサブユニットは非常によく似ている[16]。
リボソームサブユニットやrRNA断片の表記に用いられる単位はスヴェドベリ(S)で、サイズではなく遠心分離における沈降速度を表している。たとえば細菌の70Sリボソームは50Sと30Sのサブユニットで構成されるなど、断片の名称が一致しないのはこのためである。
原核生物は70Sリボソームを持っており、小サブユニット(30S)と大サブユニット(50S)のそれぞれから構成されている。 たとえば、大腸菌(E. coli)の小サブユニットは、16S RNAサブユニット(1,540ヌクレオチドからなる)を持ち、21個のタンパク質と結合している。大サブユニットは、5S RNAサブユニット(120ヌクレオチド)、23S RNAサブユニット(2,900ヌクレオチド)、および31個のタンパク質から構成されている[16]。
大腸菌 (細菌) のリボソーム[17]:962 リボソーム サブユニット rRNA r-タンパク質 70S 50S 23S (2904 nt) 31 5S (120 nt) 30S 16S (1542 nt) 21
大腸菌リボソームのtRNA結合部位のアフィニティーラベリングにより、ペプチジルトランスフェラーゼ活性に関連する可能性が高いA部位およびP部位のタンパク質が同定された[5]。標識されたタンパク質は、L27、L14、L15、L16、L2であり、少なくともL27はドナー部位に位置していることが、E. CollatzとA. P. Czernilofskyによって示された[18][19]。さらなる研究によって、S1およびS21タンパク質が16SリボソームRNAの3′末端と関連して、翻訳開始に関与していることが確認された[20]。
古細菌のリボソーム
[編集]古細菌のリボソームは、50S大サブユニットと30S小サブユニットからなる70Sリボソームであり、3本のrRNA鎖を含むという点で細菌と共通の側面を呈している。しかし、配列の観点では、細菌のものよりも真核生物のものにはるかに近い。古細菌が細菌に比べて持っている余分なリボソームタンパク質はすべて真核生物のものに対応するが、古細菌と細菌の間にはそのような関係はない[21][22][23]。
真核生物のリボソーム
[編集]真核生物は、細胞質内に80Sリボソームを持ち、小サブユニット (40S)と大サブユニット (60S)のそれぞれから構成されている。小サブユニットは、18S RNA(1,900ヌクレオチド)と33個のタンパク質から構成されている[24][25]。大サブユニットは、5S RNA(120ヌクレオチド)、28S RNA(4,700ヌクレオチド)、5.8S RNAサブユニット(160ヌクレオチド)および49個のタンパク質で構成されている[16][24][26]。
真核生物の細胞質リボソーム (ドブネズミ、R. norvegicus)[17]:65 リボソーム サブユニット rRNA r-タンパク質 80S 60S 28S (4718 nt) 49 5.8S (160 nt) 5S (120 nt) 40S 18S (1874 nt) 33
1977年、Czernilofskyは、アフィニティーラベリングを用いて、ラット肝リボソームのtRNA結合部位を特定する研究を発表した。L32/33、L36、L21、L23、L28/29、L13などのいくつかのタンパク質がペプチジルトランスフェラーゼ中心またはその近傍にあることが示唆された[27]。
プラストリボソームとミトコンドリアリボソーム
[編集]真核生物では、リボソームはミトコンドリア(ミトリボソームともいう)や葉緑体などのプラスチド(プラストリボソームともいう)に存在する。また、それらは大小のサブユニットが複数のタンパク質によって結合された1つの70S粒子を構成している[16]。これらのリボソームは細菌のリボソームと類似しており、これらのオルガネラは共生細菌に由来すると考えられている[16]。中でも葉緑体リボソームは、ミトコンドリアのものよりも細菌のものに近い。ミトコンドリア内では、リボソームRNAの多くの断片が短縮されており、動物や菌類では、5S rRNAが別の構造に置き換わっている[28]。特に原生生物であるリーシュマニア・タレントラ(Leishmania tarentolae)は、ミトコンドリアrRNAの集合体を最小限に抑えている[29]。一方、植物のミトコンドリアは、細菌と比較して、拡張したrRNAと追加のタンパク質、特に多くのペンタトリコペプチドリピートタンパク質の両方を持っている[30]。
クリプト藻やクロララクニオン藻は、真核生物の痕跡核に似たヌクレオモルフ(退化した共生体の核)を持っている可能性がある[31]。真核生物の80Sリボソームは、ヌクレオモルフが含まれる細胞内区画に存在する可能性がある[32]。
相違点の利用
[編集]細菌のリボソームと真核生物のリボソームの違いを利用して、感染者の細胞に害を与えずに感染細菌だけを破壊できる抗生物質が、創薬化学者によって開発されている。その構造の違いから、細菌の70Sリボソームはこれらの抗生物質に対して脆弱であるが、真核生物の80Sリボソームは脆弱ではない[33]。真核生物のミトコンドリアは、細菌と同様のリボソームを持っているが、二重膜に囲まれているため、これらの抗生物質がオルガネラに容易に侵入できないからである[34]。注目すべき反例として、抗悪性腫瘍剤の抗生物質クロラムフェニコールは、細菌だけでなく、真核生物でもミトコンドリアの50Sリボソームを阻害することが知られている[35]。しかし、葉緑体のリボソームは異なり、葉緑体リボソームタンパク質に抗生物質耐性という形質を持たせるためには、遺伝子工学を利用してマーカーとして導入する必要がある[36]。
共通の特性
[編集]さまざまなリボソームでは、サイズこそ大きく異なるものの、コア構造は非常によく似ている。多くのRNAは、たとえば同軸スタッキングを示すシュードノットのように、さまざまな三次構造モチーフに高度に組織化されている。大型のリボソームの余分なRNAは、いくつかの長く連続した挿入部分に含まれ[37]、コア構造を破壊したり変化させることなくループを形成している[16]。リボソームの触媒活性はすべてリボザイムであるRNAによって担われており、リボソームタンパク質は表面に存在して構造を安定化させているようである[16]。また、タンパク質は翻訳の開始・終結点の決定、翻訳の制御と維持も行っている[38]。
高分解能での構造
[編集]
リボソームの一般的な分子構造は、1970年代初頭から知られていたが、2000年代初頭、その構造が数オングストロームの高分解能で明らかにされた。
リボソームの構造を原子レベルの分解能で示した最初の論文は、2000年後半にほぼ同時に発表された。原核生物の50S大サブユニットの構造は、古細菌のハロアーキュラ・マリスモルツイ(Haloarcula marismortui)(図4)[39]と細菌のデイノコッカス・ラディオデュランス(Deinococcus radiodurans)[40]から、30Sサブユニットの構造は高度好熱菌のサーマス・サーモフィルス(Thermus thermophilus)から決定された[15]。これらの構造研究は2009年のノーベル化学賞を受賞した。2001年5月には、この座標を用いて、サーマス・サーモフィルスの70S粒子全体を5.5 Åの分解能で再現した(図3)[41]。
2005年11月、大腸菌(Escherichia coli)の70Sリボソームの構造について、2つの論文が発表された。空のリボソームの構造は、X線結晶構造解析により3.5 Åの分解能で決定された[42]。その2週間後、新たに合成されたタンパク質鎖がタンパク質伝導路を通過する際のリボソームの構造を、低温電子顕微鏡(クライオ電子顕微鏡)により11-15 Åの分解能で描写した論文が発表された[43]。
また、リボソームがtRNAやmRNAと形成する複合体の原子構造が、独立した2つのX線結晶構造解析のグループによって、2.8 Å[44]および3.7 Å[45]の分解能で初めて明らかにされた。これらの構造から、サーマス・サーモフィルスのリボソームとmRNA、および古典的なリボソーム部位に結合したtRNAとの相互作用の詳細が確認された。その後まもなく、シャイン・ダルガノ配列を含む長いmRNAとリボソームとが相互作用が、4.5-5.5 Åの分解能で可視化された[46]。
2011年、出芽酵母(Saccharomyces cerevisiae)の真核生物80Sリボソームの完全な原子構造が、結晶構造解析によって初めて明らかにされた[24]。このモデルにより、真核生物に特有な要素の構造と、普遍的に保存されたコアとの相互作用が明らかになった。同時に、テトラヒメナ・サーモフィラ(Tetrahymena thermophila)の真核生物40Sリボソームの完全な構造モデルが示され、40Sサブユニットの構造と、翻訳開始時におけるeIF1と40Sサブユニットの相互作用の多くが説明された[25]。同様に、真核生物の60Sサブユニットについても、テトラヒメナ・サーモフィラからeIF6との複合体としてその構造が決定された[26]。
機能
[編集]リボソームは、RNAと関連タンパク質からなる微粒子で、タンパク質を合成する機能を持っている。これらのタンパク質は、損傷の修復や化学プロセスの制御など、多くの細胞機能に必要である。リボソームは、細胞質内を浮遊しているか、小胞体に付着しているかのどちらかである。リボソームの主な機能は、遺伝暗号をアミノ酸配列に変換し、アミノ酸モノマーからタンパク質ポリマーを構築することである。
リボソームは、ペプチジル転移とペプチジル加水分解という2つの極めて重要な生物学的プロセスにおいて触媒として機能している[5][47]。ペプチジルトランスフェラーゼ(ペプチド転移酵素)中心は、タンパク質の伸長時にタンパク質結合を生成する役割を担っている[47]。
まとめると、リボソームにはメッセージの解読とペプチド結合の生成という2つの大きな機能がある。この2つの機能は、リボソームのサブユニットに存在する。各サブユニットは、1つまたは複数のrRNAと、いくつかのr-タンパク質から構成されている。小サブユニット(細菌と古細菌は30S、真核生物は40S)は解読機能を担っているのに対し、大サブユニット(細菌と古細菌は50S、真核生物は60S)はペプチド結合の形成を触媒し、これをペプチジルトランスフェラーゼ活性(ペプチド転移酵素活性)という。細菌と古細菌の小サブユニットは16S rRNAと21個のr-タンパク質(大腸菌)を含み、真核生物の小サブユニットは18S rRNAと32個のr-タンパク質(出芽酵母、数は種によって異なる)を含む。細菌の大サブユニットには5Sおよび23S rRNAと34個のr-タンパク質(大腸菌)を含み、真核生物の大サブユニットは5S、5.8Sおよび25S/28S rRNAと46個のr-タンパク質(出芽酵母の場合、正確な数は種によって異なる)を含む[48]。
翻訳
[編集]リボソームは、mRNAをタンパク質に翻訳する過程「タンパク質生合成」の場である。mRNAは一連のコドンからなり、リボソームによって解読され、タンパク質が作られる。リボソームは、mRNAを鋳型として、mRNAの各コドン(3連のヌクレオチド)を走査して、アミノアシルtRNAが運ぶ適切なアミノ酸と対になるようにする。アミノアシルtRNAは、片方の端にコドンと相補的なアンチコドン、もう片方の端に適切なアミノ酸を持っている。コドンは、コドンとアンチコドンの対合と、小サブユニットの復号中心(decoding center)との相互作用によって認識される[49]。大規模な立体構造変化(立体配座選択という)を利用して、適切なtRNAを迅速かつ正確に同定する[50]。リボソーム小サブユニットは、通常、最初のアミノ酸であるメチオニンを運ぶアミノアシルtRNAに結合し、mRNA上のAUGコドンに結合してリボソーム大サブユニットを動員する。リボソームにはA、P、Eと呼ばれる3つのRNA結合部位があり、A部位はアミノアシルtRNAまたは終結因子[51][52]、P部位はペプチジルtRNA(ポリペプチド鎖に結合したtRNA)、E部位(出口)は遊離tRNAをそれぞれ結合させる。タンパク質合成は、mRNAの5'末端付近にある開始コドンAUGから始まる。mRNAは、最初にリボソームのP部位に結合する。リボソームは、原核生物ではシャイン・ダルガノ配列を、真核生物ではコザック配列を用いて、mRNAの開始コドンを認識する。
ペプチド結合の触媒作用には、RNAのP部位アデノシンのC2ヒドロキシルがプロトンシャトル機構で関与し、タンパク質合成の他の段階(転移など)は、タンパク質の立体構造の変化によって引き起こされる。リボソームは、触媒コアがRNAでできていることから「リボザイム」に分類され[53]、RNAワールドの名残の可能性があると考えられている[54]。

図5では、リボソームの小サブユニットと大サブユニットの両方が開始コドン(mRNAの5'末端側)に集まっている。リボソームは、mRNA上の現在のコドン(トリプレット、三連符)に一致するtRNAを用いて、ポリペプチド鎖にアミノ酸を付加する。この作業は、リボソームがmRNAの3'末端に向かって移動する間に、mRNA上の各トリプレットに対して行われる。通常、細菌の細胞では、1つのmRNAに対して複数のリボソームが並行して働き、ポリリボソーム(polyribosome)またはポリソームと呼ばれるものを形成している。
細菌や古細菌では、翻訳速度は平均して1秒間に20アミノ酸、つまりmRNA上の60ヌクレオチドであり、これはRNAポリメラーゼによる1秒間に50-100ヌクレオチドに近い合成速度である。真核生物では、翻訳速度は1秒間に2-4アミノ酸と遅い速度で進行する[38]。
共翻訳フォールディング
[編集]リボソームはタンパク質のフォールディングに積極的に関与していることが知られている[55][56]。このようにして得られた構造は、最終産物に至る経路は異なることがあるが、通常、タンパク質の化学的リフォールディングで得られた構造と同じである[57][58]。場合によっては、機能的なタンパク質の形状を得るために、リボソームが重要な役割を果たすこともある。たとえば、結び目の深いタンパク質のフォールディング機構として、リボソームがタンパク質鎖を押し出してくっついたループを通過させることが考えられる[59]。
翻訳非依存的なアミノ酸付加
[編集]リボソーム品質管理タンパク質Rqc2の存在は、mRNA非依存的なタンパク質の伸長と関連している[60][61]。この伸長は、Rqc2が運ぶtRNAを介して、リボソームがCATテールを付加するものである。リボソームは、停止したタンパク質のC末端を、アラニンとスレオニンの無作為で翻訳非依存的な配列で伸長する[62][63](CATは、C末端、アラニン、スレオニンのそれぞれの頭文字をとった造語)。
リボソームの位置
[編集]リボソームは「遊離(型)リボソーム(free ribosomes)」と「膜結合(型)リボソーム(Membrane-bound ribosomes)」に分類される。

遊離リボソームと膜結合リボソームは、空間的な分布が異なるだけで、構造は同じである。リボソームが遊離状態と膜結合状態のどちらで存在するかは、合成されるタンパク質上の小胞体ターゲティング・シグナル配列の有無に依存する。したがって個々のリボソームは、あるタンパク質を合成しているときは膜結合状態であり、別のタンパク質を作っているときは細胞質で遊離している可能性がある[64]。
リボソームはオルガネラ(organelle、細胞小器官)と呼ばれることもあるが、オルガネラという用語はもっぱらリン脂質膜を持った細胞分画を指すことが多く、全体が粒子状であるリボソームはオルガネラではない。このため、リボソームは「非膜系オルガネラ(non-membranous organelles)」と呼ばれることもある。
遊離リボソーム
[編集]遊離リボソームは、細胞質内を自由に移動することができるが、細胞核や他のオルガネラからは排除されている。遊離リボソームで作られたタンパク質は細胞質内に放出され、細胞内で利用される。細胞質は高濃度のグルタチオンが存在する還元性環境であるため、酸化されたシステイン残基から形成されるジスルフィド結合を含むタンパク質は細胞質内で生成されない。
膜結合リボソーム
[編集]リボソームが、どれかのオルガネラで必要なタンパク質を合成し始めると、そのタンパク質を作っているリボソームが「膜結合型」になることがある。真核細胞では、小胞体(ER)の粗面小胞体と呼ばれる領域でこの現象が起こる。新たに生成されたポリペプチド鎖は、ベクター生成中のリボソームから小胞体に直接挿入され、分泌経路を経て目的地に送り届けられる。膜結合リボソームは通常、細胞膜(原形質膜)内で使用されるタンパク質や、エキソサイトーシスにより細胞外に排出されるタンパク質を生成する[65]。
生合成
[編集]原核細胞では、リボソームは細胞質内で合成され、複数のリボソーム遺伝子オペロンが転写されることで作られる。真核生物では、このプロセスは細胞質および細胞核内の核小体の両方で行われる。この組立過程では、4つのrRNAの合成とプロセシング、およびそれらのrRNAとリボソームタンパク質の組み立てに200以上のタンパク質が協調して機能することが必要である[66]。
起源
[編集]リボソームはRNAワールドで誕生し、自己複製する複合体として出現し、その後、アミノ酸が出現したときにタンパク質を合成する能力を進化させたのではないかと考えられている[67]。古代のリボソームはすべてrRNAで構成され、ペプチド結合を合成する能力を発達させたのではないかとする研究もある[68][69][70][71][72]。さらに、古代のリボソームは自己複製複合体であったことを示唆する強い証拠があり、リボソーム内のrRNAは、リボソームの自己複製に必要なtRNAやタンパク質をコードし、情報伝達・構造・触媒の目的を持っていた可能性がある[73]。自己複製RNAを持ち、DNAを持たない仮説上の細胞生物は、リボサイト(ribocyte)またはリボセル(ribocells)と呼ばれる[74][75]。
原始的な条件下でRNAワールドにアミノ酸が徐々に出現すると[76][77]、アミノ酸との相互作用によって、触媒となるRNA分子の機能範囲と効率がそれぞれ向上する[67]。したがって、リボソームの形態が古代の自己複製機械から現在の翻訳機械へと進化した原動力は、リボソームの自己複製機構にタンパク質を組み込んで自己複製能力を高めることを可能にする選択圧である可能性がある[73][78][79]。
リボソームの不均一性
[編集]同じ真核細胞内でも細胞質リボソームとミトコンドリアリボソームが存在することで明示されているように、リボソームは、生物種間だけでなく同一細胞内でも組成が不均質である。一部の研究者は、哺乳動物のリボソームタンパク質の組成の不均一性が遺伝子調節に重要であることを示唆している。これは特殊化リボソーム仮説(specialized ribosome hypothesis)である[80][81]。しかし、この仮説は論争の的であり、研究が進行中のトピックである[82][83]。
リボソーム組成の不均一性は、Vince Mauroとジェラルド・エデルマンによって、タンパク質合成の翻訳制御に関与することが初めて提案された[84]。彼らは、リボソームの制御機能を説明するために、リボソームフィルター仮説を提唱した。その結果、異なる細胞集団に特異的な特殊化リボソームが、遺伝子の翻訳方法に影響を与える可能性が示唆された[85]。いくつかのリボソームタンパク質は、組み立てられた複合体から細胞質のコピーと差し替えられ[86]、まったく新しいリボソームを合成しなくても、生体内のリボソームの構造を変更できることが示唆された。
リボソームタンパク質には、細胞の生存に限りなく重要なものもあれば、そうでないものもある。出芽酵母では、14/78のリボソームタンパク質が成長に必須ではないが、ヒトでは、これらは研究対象の細胞によって異なる[87]。その他の不均一性には、アセチル化、メチル化、およびリン酸化などのリボソームタンパク質の翻訳後修飾が含まれる[88]。シロイヌナズナ(Arabidopsis)[89][90][91][92]やウイルスの配列内リボソーム進入部位(IRES)は、組成的に異なるリボソームによって翻訳を媒介する可能性がある。たとえば、酵母や哺乳動物細胞のリボソームタンパク質eS25を持たない40Sリボソームサブユニットは、CrPV IGR IRESを動員することができない[93]。
リボソームRNAの修飾の不均一性は、構造維持や機能において重要な役割を果たしており、ほとんどのmRNA修飾は高度に保存された領域に見られる[94][95]。最も一般的なrRNA修飾はリボースのシュードウリジル化と2'-O-メチル化である[96]。
関連項目
[編集]脚注
[編集]- ^ Konikkat S (February 2016). Dynamic Remodeling Events Drive the Removal of the ITS2 Spacer Sequence During Assembly of 60S Ribosomal Subunits in S. cerevisiae (Ph.D. thesis). Carnegie Mellon University. 2017年8月3日時点のオリジナルよりアーカイブ。
- ^ Weiler EW, Nover L (2008) (ドイツ語). Allgemeine und Molekulare Botanik. Stuttgart: Georg Thieme Verlag. pp. 532. ISBN 9783131527912
- ^ de la Cruz J, Karbstein K, Woolford JL (2015). “Functions of ribosomal proteins in assembly of eukaryotic ribosomes in vivo”. Annual Review of Biochemistry 84: 93–129. doi:10.1146/annurev-biochem-060614-033917. PMC 4772166. PMID 25706898.
- ^ “Scitable by nature translation / RNA translation”. 2022年11月28日閲覧。
- ^ a b c Tirumalai MR, Rivas M, Tran Q, Fox GE (November 2021). “The Peptidyl Transferase Center: a Window to the Past”. Microbiol Mol Biol Rev 85 (4): e0010421. doi:10.1128/MMBR.00104-21. PMC 8579967. PMID 34756086.
- ^ Benne R, Sloof P (1987). “Evolution of the mitochondrial protein synthetic machinery”. Bio Systems 21 (1): 51–68. doi:10.1016/0303-2647(87)90006-2. PMID 2446672.
- ^ “Ribosomes”. 2009年3月20日時点のオリジナルよりアーカイブ。2011年4月28日閲覧。
- ^ Palade GE (January 1955). “A small particulate component of the cytoplasm”. The Journal of Biophysical and Biochemical Cytology 1 (1): 59–68. doi:10.1083/jcb.1.1.59. PMC 2223592. PMID 14381428.
- ^ “Introduction”. Microsomal Particles and Protein Synthesis. New York: Pergamon Press, Inc.. (1958)
- ^ “The Nobel Prize in Physiology or Medicine 1974”. Nobelprize.org. The Nobel Foundation. 26 January 2013時点のオリジナルよりアーカイブ。10 December 2012閲覧。
- ^ “2009 Nobel Prize in Chemistry”. The Nobel Foundation. 28 April 2012時点のオリジナルよりアーカイブ。10 December 2012閲覧。
- ^ Kurland CG (1960). “Molecular characterization of ribonucleic acid from Escherichia coli ribosomes”. Journal of Molecular Biology 2 (2): 83–91. doi:10.1016/s0022-2836(60)80029-0.
- ^ Wilson DN, Doudna Cate JH (May 2012). “The structure and function of the eukaryotic ribosome”. Cold Spring Harbor Perspectives in Biology 4 (5): a011536. doi:10.1101/cshperspect.a011536. PMC 3331703. PMID 22550233.
- ^ Nissen P, Hansen J, Ban N, Moore PB, Steitz TA (August 2000). “The structural basis of ribosome activity in peptide bond synthesis”. Science 289 (5481): 920–30. Bibcode: 2000Sci...289..920N. doi:10.1126/science.289.5481.920. PMID 10937990. オリジナルの2020-11-30時点におけるアーカイブ。.
- ^ a b Wimberly BT, Brodersen DE, Clemons WM, Morgan-Warren RJ, Carter AP, Vonrhein C, Hartsch T, Ramakrishnan V (September 2000). “Structure of the 30S ribosomal subunit”. Nature 407 (6802): 327–39. Bibcode: 2000Natur.407..327W. doi:10.1038/35030006. PMID 11014182.
- ^ a b c d e f g Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). “Membrane-bound Ribosomes Define the Rough ER”. Molecular Biology of the Cell (4th ed.). New York: Garland Science. pp. 342. ISBN 978-0-8153-4072-0
- ^ a b Garrett R, Grisham CM (2009). Biochemistry (4th ed.). Cengage Learning Services. ISBN 978-0-495-11464-2
- ^ Collatz E, Küchler E, Stöffler G, Czernilofsky AP (April 1976). “The site of reaction on ribosomal protein L27 with an affinity label derivative of tRNA Met f”. FEBS Letters 63 (2): 283–6. doi:10.1016/0014-5793(76)80112-3. PMID 770196.
- ^ Czernilofsky AP, Collatz EE, Stöffler G, Kuechler E (January 1974). “Proteins at the tRNA binding sites of Escherichia coli ribosomes”. Proceedings of the National Academy of Sciences of the United States of America 71 (1): 230–4. Bibcode: 1974PNAS...71..230C. doi:10.1073/pnas.71.1.230. PMC 387971. PMID 4589893.
- ^ Czernilofsky AP, Kurland CG, Stöffler G (October 1975). “30S ribosomal proteins associated with the 3'-terminus of 16S RNA”. FEBS Letters 58 (1): 281–4. doi:10.1016/0014-5793(75)80279-1. PMID 1225593.
- ^ Cullen KE (2009). “Archaeal Ribosomes”. Encyclopedia of Life Science. New York: Facts On File. pp. 1–5. doi:10.1002/9780470015902.a0000293.pub3. ISBN 9780470015902
- ^ Tirumalai MR, Anane-Bediakoh D, Rajesh R, Fox GE (November 2021). “Net Charges of the Ribosomal Proteins of the S10 and spc Clusters of Halophiles Are Inversely Related to the Degree of Halotolerance”. Microbiol. Spectrum 9 (3): e0178221. doi:10.1128/spectrum.01782-21. PMC 8672879. PMID 34908470.
- ^ Wang J, Dasgupta I, Fox GE (28 April 2009). “Many nonuniversal archaeal ribosomal proteins are found in conserved gene clusters”. Archaea 2 (4): 241–51. doi:10.1155/2009/971494. PMC 2686390. PMID 19478915.
- ^ a b c Ben-Shem A, Garreau de Loubresse N, Melnikov S, Jenner L, Yusupova G, Yusupov M (December 2011). “The structure of the eukaryotic ribosome at 3.0 Å resolution”. Science 334 (6062): 1524–9. Bibcode: 2011Sci...334.1524B. doi:10.1126/science.1212642. PMID 22096102.
- ^ a b Rabl J, Leibundgut M, Ataide SF, Haag A, Ban N (February 2011). “Crystal structure of the eukaryotic 40S ribosomal subunit in complex with initiation factor 1”. Science 331 (6018): 730–6. Bibcode: 2011Sci...331..730R. doi:10.1126/science.1198308. hdl:20.500.11850/153130. PMID 21205638.
- ^ a b Klinge S, Voigts-Hoffmann F, Leibundgut M, Arpagaus S, Ban N (November 2011). “Crystal structure of the eukaryotic 60S ribosomal subunit in complex with initiation factor 6”. Science 334 (6058): 941–8. Bibcode: 2011Sci...334..941K. doi:10.1126/science.1211204. PMID 22052974.
- ^ Fabijanski S, Pellegrini M (1977). “Identification of proteins at the peptidyl-tRNA binding site of rat liver ribosomes”. Molecular & General Genetics 184 (3): 551–6. doi:10.1007/BF00431588. PMID 6950200.
- ^ Agrawal RK, Sharma MR (December 2012). “Structural aspects of mitochondrial translational apparatus”. Current Opinion in Structural Biology 22 (6): 797–803. doi:10.1016/j.sbi.2012.08.003. PMC 3513651. PMID 22959417.
- ^ Sharma MR, Booth TM, Simpson L, Maslov DA, Agrawal RK (June 2009). “Structure of a mitochondrial ribosome with minimal RNA”. Proceedings of the National Academy of Sciences of the United States of America 106 (24): 9637–42. Bibcode: 2009PNAS..106.9637S. doi:10.1073/pnas.0901631106. PMC 2700991. PMID 19497863.
- ^ Waltz F, Nguyen TT, Arrivé M, Bochler A, Chicher J, Hammann P, Kuhn L, Quadrado M, Mireau H, Hashem Y, Giegé P (January 2019). “Small is big in Arabidopsis mitochondrial ribosome”. Nature Plants 5 (1): 106–117. doi:10.1038/s41477-018-0339-y. PMID 30626926.
- ^ Archibald JM, Lane CE (2009). “Going, going, not quite gone: nucleomorphs as a case study in nuclear genome reduction”. The Journal of Heredity 100 (5): 582–90. doi:10.1093/jhered/esp055. PMID 19617523.
- ^ “Specialized Internal Structures of Prokaryotes | Boundless Microbiology”. courses.lumenlearning.com. 2021年9月24日閲覧。
- ^ Recht MI, Douthwaite S, Puglisi JD (June 1999). “Basis for prokaryotic specificity of action of aminoglycoside antibiotics”. The EMBO Journal 18 (11): 3133–8. doi:10.1093/emboj/18.11.3133. PMC 1171394. PMID 10357824.
- ^ O'Brien TW (May 1971). “The general occurrence of 55 S ribosomes in mammalian liver mitochondria”. The Journal of Biological Chemistry 246 (10): 3409–17. doi:10.1016/S0021-9258(18)62239-2. PMID 4930061.
- ^ “Chloramphenicol-lnduced Bone Marrow Suppression” (英語). JAMA 213 (7): 1183–1184. (1970-08-17). doi:10.1001/jama.1970.03170330063011. ISSN 0098-7484. PMID 5468266.
- ^ Newman SM, Boynton JE, Gillham NW, Randolph-Anderson BL, Johnson AM, Harris EH (December 1990). “Transformation of chloroplast ribosomal RNA genes in Chlamydomonas: molecular and genetic characterization of integration events”. Genetics 126 (4): 875–88. doi:10.1093/genetics/126.4.875. PMC 1204285. PMID 1981764.
- ^ Penev PI, Fakhretaha-Aval S, Patel VJ, Cannone JJ, Gutell RR, Petrov AS, Williams LD, Glass JB (August 2020). “Supersized ribosomal RNA expansion segments in Asgard archaea”. Genome Biology and Evolution 12 (10): 1694–1710. doi:10.1093/gbe/evaa170. PMC 7594248. PMID 32785681.
- ^ a b Bruce Alberts, Dennis Bray, Karen Hopkin他 『Essential 細胞生物学(原書第2版)』 中村桂子・松原謙一 監訳、南江堂、2005年9月、p.251-252
- ^ a b Ban N, Nissen P, Hansen J, Moore PB, Steitz TA (August 2000). “The complete atomic structure of the large ribosomal subunit at 2.4 A resolution”. Science 289 (5481): 905–20. Bibcode: 2000Sci...289..905B. doi:10.1126/science.289.5481.905. PMID 10937989.
- ^ Schluenzen F, Tocilj A, Zarivach R, Harms J, Gluehmann M, Janell D, Bashan A, Bartels H, Agmon I, Franceschi F, Yonath A (September 2000). “Structure of functionally activated small ribosomal subunit at 3.3 angstroms resolution”. Cell 102 (5): 615–23. doi:10.1016/S0092-8674(00)00084-2. PMID 11007480.
- ^ Yusupov MM, Yusupova GZ, Baucom A, Lieberman K, Earnest TN, Cate JH, Noller HF (May 2001). “Crystal structure of the ribosome at 5.5 A resolution”. Science 292 (5518): 883–96. Bibcode: 2001Sci...292..883Y. doi:10.1126/science.1060089. PMID 11283358.
- ^ Schuwirth BS, Borovinskaya MA, Hau CW, Zhang W, Vila-Sanjurjo A, Holton JM, Cate JH (November 2005). “Structures of the bacterial ribosome at 3.5 A resolution”. Science 310 (5749): 827–34. Bibcode: 2005Sci...310..827S. doi:10.1126/science.1117230. PMID 16272117.
- ^ Mitra K, Schaffitzel C, Shaikh T, Tama F, Jenni S, Brooks CL, Ban N, Frank J (November 2005). “Structure of the E. coli protein-conducting channel bound to a translating ribosome”. Nature 438 (7066): 318–24. Bibcode: 2005Natur.438..318M. doi:10.1038/nature04133. PMC 1351281. PMID 16292303.
- ^ Selmer M, Dunham CM, Murphy FV, Weixlbaumer A, Petry S, Kelley AC, Weir JR, Ramakrishnan V (September 2006). “Structure of the 70S ribosome complexed with mRNA and tRNA”. Science 313 (5795): 1935–42. Bibcode: 2006Sci...313.1935S. doi:10.1126/science.1131127. PMID 16959973.
- ^ Korostelev A, Trakhanov S, Laurberg M, Noller HF (September 2006). “Crystal structure of a 70S ribosome-tRNA complex reveals functional interactions and rearrangements”. Cell 126 (6): 1065–77. doi:10.1016/j.cell.2006.08.032. PMID 16962654.
- ^ Yusupova G, Jenner L, Rees B, Moras D, Yusupov M (November 2006). “Structural basis for messenger RNA movement on the ribosome”. Nature 444 (7117): 391–4. Bibcode: 2006Natur.444..391Y. doi:10.1038/nature05281. PMID 17051149.
- ^ a b “Specialized Internal Structures of Prokaryotes”. courses.lumenlearning.com. 2018年9月27日閲覧。
- ^ Lafontaine, D.; Tollervey, D. (2001). “The function and synthesis of ribosomes”. Nat Rev Mol Cell Biol 2 (7): 514–520. doi:10.1038/35080045. hdl:1842/729. PMID 11433365.
- ^ James D. Watson, T. A. Baker, S. P. Bell他 『ワトソン 遺伝子の分子生物学【第5版】』 中村桂子 監訳、東京電機大学出版局、2006年3月、p.423-430
- ^ Savir Y, Tlusty T (April 2013). “The ribosome as an optimal decoder: A lesson in molecular recognition”. Cell 153 (2): 471–479. Bibcode: 2013APS..MARY46006T. doi:10.1016/j.cell.2013.03.032. PMID 23582332.
- ^ Korkmaz G, Sanyal S (September 2017). “Escherichia coli”. The Journal of Biological Chemistry 292 (36): 15134–15142. doi:10.1074/jbc.M117.785238. PMC 5592688. PMID 28743745.
- ^ Konevega AL, Soboleva NG, Makhno VI, Semenkov YP, Wintermeyer W, Rodnina MV, Katunin VI (January 2004). “Purine bases at position 37 of tRNA stabilize codon-anticodon interaction in the ribosomal A site by stacking and Mg2+-dependent interactions”. RNA 10 (1): 90–101. doi:10.1261/rna.5142404. PMC 1370521. PMID 14681588.
- ^ Rodnina MV, Beringer M, Wintermeyer W (January 2007). “How ribosomes make peptide bonds”. Trends in Biochemical Sciences 32 (1): 20–26. doi:10.1016/j.tibs.2006.11.007. PMID 17157507.
- ^ Cech, T.R. (August 2000). “Structural biology. The ribosome is a ribozyme”. Science 289 (5481): 878–879. doi:10.1126/science.289.5481.878. PMID 10960319.
- ^ Banerjee D, Sanyal S (October 2014). “Protein folding activity of the ribosome (PFAR) – a target for antiprion compounds”. Viruses 6 (10): 3907–3924. doi:10.3390/v6103907. PMC 4213570. PMID 25341659.
- ^ Fedorov AN, Baldwin TO (December 1997). “Cotranslational protein folding”. The Journal of Biological Chemistry 272 (52): 32715–32718. doi:10.1074/jbc.272.52.32715. PMID 9407040.
- ^ Baldwin RL (June 1975). “Intermediates in protein folding reactions and the mechanism of protein folding”. Annual Review of Biochemistry 44 (1): 453–475. doi:10.1146/annurev.bi.44.070175.002321. PMID 1094916.
- ^ Das D, Das A, Samanta D, Ghosh J, Dasgupta S, Bhattacharya A, Basu A, Sanyal S, Das Gupta C (August 2008). “Role of the ribosome in protein folding”. Biotechnology Journal 3 (8): 999–1009. doi:10.1002/biot.200800098. PMID 18702035.
- ^ Dabrowski-Tumanski P, Piejko M, Niewieczerzal S, Stasiak A, Sulkowska JI (December 2018). “Protein knotting by active threading of nascent polypeptide chain exiting from the ribosome exit channel”. The Journal of Physical Chemistry B 122 (49): 11616–11625. doi:10.1021/acs.jpcb.8b07634. PMID 30198720.
- ^ Brandman O, Stewart-Ornstein J, Wong D, Larson A, Williams CC, Li GW, Zhou S, King D, Shen PS, Weibezahn J, Dunn JG, Rouskin S, Inada T, Frost A, Weissman JS (November 2012). “A ribosome-bound quality control complex triggers degradation of nascent peptides and signals translation stress”. Cell 151 (5): 1042–1054. doi:10.1016/j.cell.2012.10.044. PMC 3534965. PMID 23178123.
- ^ Defenouillère Q, Yao Y, Mouaikel J, Namane A, Galopier A, Decourty L, Doyen A, Malabat C, Saveanu C, Jacquier A, Fromont-Racine M (March 2013). “Cdc48-associated complex bound to 60S particles is required for the clearance of aberrant translation products”. Proceedings of the National Academy of Sciences of the United States of America 110 (13): 5046–5051. Bibcode: 2013PNAS..110.5046D. doi:10.1073/pnas.1221724110. PMC 3612664. PMID 23479637.
- ^ Shen PS, Park J, Qin Y, Li X, Parsawar K, Larson MH, Cox J, Cheng Y, Lambowitz AM, Weissman JS, Brandman O, Frost A (January 2015). “Protein synthesis. Rqc2p and 60S ribosomal subunits mediate mRNA-independent elongation of nascent chains”. Science 347 (6217): 75–78. Bibcode: 2015Sci...347...75S. doi:10.1126/science.1259724. PMC 4451101. PMID 25554787.
- ^ Keeley, J.; Gutnikoff, R. (2 January 2015). "Ribosome studies turn up new mechanism of protein synthesis" (Press release). Howard Hughes Medical Institute. 2015年1月12日時点のオリジナルよりアーカイブ。2015年1月16日閲覧。
- ^ Kobayashi, Kan (2018). “シグナル認識粒子とシグナル認識粒子受容体に よる新生タンパク質の小胞体膜ターゲティング 機構の構造基盤 (Structural Basis for the Nascent Protein Targeting to Endoplasmic Reticulum by SRP and SR)” (英語). 生物物理 58 (5): 255–257. doi:10.2142/biophys.58.255. ISSN 0582-4052.
- ^ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). “Membrane-bound Ribosomes Define the Rough ER”. Molecular Biology of the Cell (4th ed.). New York: Garland Science. ISBN 978-0-8153-4072-0
- ^ Kressler, Dieter; Hurt, Ed; Babler, Jochen (2009). “Driving ribosome assembly”. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research 1803 (6): 673–683. doi:10.1016/j.bbamcr.2009.10.009. PMID 19879902.
- ^ a b Noller HF (April 2012). “Evolution of protein synthesis from an RNA world”. Cold Spring Harbor Perspectives in Biology 4 (4): a003681. doi:10.1101/cshperspect.a003681. PMC 3312679. PMID 20610545.
- ^ Dabbs ER (1986). Mutant studies on the prokaryotic ribosome.. New York: Springer-Verlag
- ^ Noller HF, Hoffarth V, Zimniak L (June 1992). “Unusual resistance of peptidyl transferase to protein extraction procedures”. Science 256 (5062): 1416–9. Bibcode: 1992Sci...256.1416N. doi:10.1126/science.1604315. PMID 1604315.
- ^ Nomura M, Mizushima S, Ozaki M, Traub P, Lowry CV (1969). “Structure and function of ribosomes and their molecular components”. Cold Spring Harbor Symposia on Quantitative Biology 34: 49–61. doi:10.1101/sqb.1969.034.01.009. PMID 4909519.
- ^ Krupkin M, Matzov D, Tang H, Metz M, Kalaora R, Belousoff MJ, Zimmerman E, Bashan A, Yonath A (Oct 2011). “A vestige of a prebiotic bonding machine is functioning within the contemporary ribosome”. Phil. Trans. R. Soc. B 366 (1580): 2972–8. doi:10.1098/rstb.2011.0146. PMC 3158926. PMID 21930590.
- ^ Bose T, Fridkin G, Davidovich C, Krupkin M, Dinger N, Falkovich AH, Peleg Y, Agmon I, Bashan A, Yonat A (Feb 2022). “Origin of life: protoribosome forms peptide bonds and links RNA and protein dominated worlds”. Nucleic Acids Res 50 (4): 1815–1828. doi:10.1093/nar/gkac052. PMC 8886871. PMID 35137169.
- ^ a b Root-Bernstein M, Root-Bernstein R (February 2015). “The ribosome as a missing link in the evolution of life”. Journal of Theoretical Biology 367: 130–158. doi:10.1016/j.jtbi.2014.11.025. PMID 25500179.
- ^ Yarus M (2002). “Primordial genetics: phenotype of the ribocyte”. Annual Review of Genetics 36: 125–51. doi:10.1146/annurev.genet.36.031902.105056. PMID 12429689.
- ^ Forterre P, Krupovic M (2012). “The Origin of Virions and Virocells: The Escape Hypothesis Revisited”. Viruses: Essential Agents of Life. pp. 43–60. doi:10.1007/978-94-007-4899-6_3. ISBN 978-94-007-4898-9
- ^ Caetano-Anollés G, Seufferheld MJ (2013). “The coevolutionary roots of biochemistry and cellular organization challenge the RNA world paradigm”. Journal of Molecular Microbiology and Biotechnology 23 (1–2): 152–77. doi:10.1159/000346551. PMID 23615203.
- ^ Saladino R, Botta G, Pino S, Costanzo G, Di Mauro E (August 2012). “Genetics first or metabolism first? The formamide clue”. Chemical Society Reviews 41 (16): 5526–65. doi:10.1039/c2cs35066a. hdl:11573/494138. PMID 22684046.
- ^ Fox GE (September 2010). “Origin and Evolution of the Ribosome”. Cold Spring Harb Perspect Biol 2 (9): a003483. doi:10.1101/cshperspect.a003483. PMC 2926754. PMID 20534711.
- ^ Fox GE (2016). “Origins and early evolution of the ribosome”. Evolution of the Protein Synthesis Machinery and Its Regulation. Switzerland: Springer, Cham. pp. 31–60. doi:10.1007/978-3-319-39468-8. ISBN 978-3-319-39468-8
- ^ Shi Z, Fujii K, Kovary KM, Genuth NR, Röst HL, Teruel MN, Barna M (July 2017). “Heterogeneous Ribosomes Preferentially Translate Distinct Subpools of mRNAs Genome-wide”. Molecular Cell (Elsevier BV) 67 (1): 71–83.e7. doi:10.1016/j.molcel.2017.05.021. PMC 5548184. PMID 28625553.
- ^ Xue S, Barna M (May 2012). “Specialized ribosomes: a new frontier in gene regulation and organismal biology”. Nature Reviews. Molecular Cell Biology (Springer Science and Business Media LLC) 13 (6): 355–369. doi:10.1038/nrm3359. PMC 4039366. PMID 22617470.
- ^ Ferretti MB, Karbstein K (May 2019). “Does functional specialization of ribosomes really exist?”. RNA (Cold Spring Harbor Laboratory) 25 (5): 521–538. doi:10.1261/rna.069823.118. PMC 6467006. PMID 30733326.
- ^ Farley-Barnes KI, Ogawa LM, Baserga SJ (October 2019). “Ribosomopathies: Old Concepts, New Controversies”. Trends in Genetics (Elsevier BV) 35 (10): 754–767. doi:10.1016/j.tig.2019.07.004. PMC 6852887. PMID 31376929.
- ^ Mauro VP, Edelman GM (September 2002). “The ribosome filter hypothesis”. Proceedings of the National Academy of Sciences of the United States of America 99 (19): 12031–6. Bibcode: 2002PNAS...9912031M. doi:10.1073/pnas.192442499. PMC 129393. PMID 12221294.
- ^ Xue S, Barna M (May 2012). “Specialized ribosomes: a new frontier in gene regulation and organismal biology”. Nature Reviews. Molecular Cell Biology 13 (6): 355–69. doi:10.1038/nrm3359. PMC 4039366. PMID 22617470.
- ^ Mathis AD, Naylor BC, Carson RH, Evans E, Harwell J, Knecht J, Hexem E, Peelor FF, Miller BF, Hamilton KL, Transtrum MK, Bikman BT, Price JC (February 2017). “Mechanisms of In Vivo Ribosome Maintenance Change in Response to Nutrient Signals”. Molecular & Cellular Proteomics 16 (2): 243–254. doi:10.1074/mcp.M116.063255. PMC 5294211. PMID 27932527.
- ^ Steffen KK, McCormick MA, Pham KM, MacKay VL, Delaney JR, Murakami CJ, Kaeberlein M, Kennedy BK (May 2012). “Ribosome deficiency protects against ER stress in Saccharomyces cerevisiae”. Genetics (Genetics Society of America) 191 (1): 107–118. doi:10.1534/genetics.111.136549. PMC 3338253. PMID 22377630.
- ^ Lee SW, Berger SJ, Martinović S, Pasa-Tolić L, Anderson GA, Shen Y, Zhao R, Smith RD (April 2002). “Direct mass spectrometric analysis of intact proteins of the yeast large ribosomal subunit using capillary LC/FTICR”. Proceedings of the National Academy of Sciences of the United States of America 99 (9): 5942–5947. Bibcode: 2002PNAS...99.5942L. doi:10.1073/pnas.082119899. PMC 122881. PMID 11983894.
- ^ Carroll AJ, Heazlewood JL, Ito J, Millar AH (February 2008). “Analysis of the Arabidopsis cytosolic ribosome proteome provides detailed insights into its components and their post-translational modification”. Molecular & Cellular Proteomics 7 (2): 347–369. doi:10.1074/mcp.m700052-mcp200. PMID 17934214.
- ^ Odintsova TI, Müller EC, Ivanov AV, Egorov TA, Bienert R, Vladimirov SN, Kostka S, Otto A, Wittmann-Liebold B, Karpova GG (April 2003). “Characterization and analysis of posttranslational modifications of the human large cytoplasmic ribosomal subunit proteins by mass spectrometry and Edman sequencing”. Journal of Protein Chemistry 22 (3): 249–258. doi:10.1023/a:1025068419698. PMID 12962325.
- ^ Yu Y, Ji H, Doudna JA, Leary JA (June 2005). “Mass spectrometric analysis of the human 40S ribosomal subunit: native and HCV IRES-bound complexes”. Protein Science 14 (6): 1438–1446. doi:10.1110/ps.041293005. PMC 2253395. PMID 15883184.
- ^ Zeidan Q, Wang Z, De Maio A, Hart GW (June 2010). “O-GlcNAc cycling enzymes associate with the translational machinery and modify core ribosomal proteins”. Molecular Biology of the Cell 21 (12): 1922–1936. doi:10.1091/mbc.e09-11-0941. PMC 2883937. PMID 20410138.
- ^ Landry DM, Hertz MI, Thompson SR (December 2009). “RPS25 is essential for translation initiation by the Dicistroviridae and hepatitis C viral IRESs”. Genes & Development 23 (23): 2753–2764. doi:10.1101/gad.1832209. PMC 2788332. PMID 19952110.
- ^ Decatur WA, Fournier MJ (July 2002). “rRNA modifications and ribosome function”. Trends in Biochemical Sciences 27 (7): 344–51. doi:10.1016/s0968-0004(02)02109-6. PMID 12114023.
- ^ Natchiar SK, Myasnikov AG, Kratzat H, Hazemann I, Klaholz BP (November 2017). “Visualization of chemical modifications in the human 80S ribosome structure”. Nature 551 (7681): 472–477. Bibcode: 2017Natur.551..472N. doi:10.1038/nature24482. PMID 29143818.
- ^ Guo H (August 2018). “Specialized ribosomes and the control of translation”. Biochemical Society Transactions 46 (4): 855–869. doi:10.1042/BST20160426. PMID 29986937.
外部リンク
[編集]- リボソームとは? - 国立遺伝学研究所マルチメディア資料館
- 蛋白質構造データバンク 今月の分子10:リボソーム(Ribosome)
- 蛋白質構造データバンク 今月の分子121:70Sリボソーム(70S Ribosomes)
- 蛋白質構造データバンク 今月の分子81:伸長因子(Elongation Factors)
- リボソームの役割, Gwen V. Childs, copied here
- Ribosome in Proteopedia—The free, collaborative 3D encyclopedia of proteins & other molecules
- Ribosomal proteins families in ExPASy Archived 2011-04-30 at the Wayback Machine.
- リボソームの3次元電子顕微鏡構造 EM Data Bank (EMDB)
