三ヨウ化リン
| 三ヨウ化リン | |
|---|---|
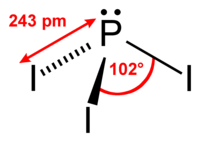
| |

| |
Phosphorus triiodide | |
別称 Triiodophosphine | |
| 識別情報 | |
| CAS登録番号 | 13455-01-1 |
| PubChem | 83485 |
| ChemSpider | 75323 |
| |
| |
| 特性 | |
| 化学式 | PI3 |
| モル質量 | 411.68717 g/mol |
| 外観 | 暗赤色の固体 |
| 密度 | 4.18 g/cm3 |
| 融点 |
61.2 °C, 334 K, 142 °F |
| 沸点 |
200 °C, 473 K, 392 °F (分解) |
| 水への溶解度 | 分解する |
| 構造 | |
| 分子の形 | 三角錐形 |
| 危険性 | |
| EU分類 | 記載なし |
| NFPA 704 | |
| 引火点 | 不燃 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
三ヨウ化リン (さんヨウかリン、phosphorus triiodide) は、化学式がPI3の無機化合物である。赤色固体で水と激しく反応する。不安定すぎて保管が難しいとよく誤解されているが、実際は市販されている[1]。有機化学において、アルコール類をヨウ化アルキルに変換するのに広く使われる。強力な還元剤でもある。留意すべきはリンからヨウ素が外れP2I4を形成してしまうことであるが、室温でPI5が存在するかは疑わしい。
特性
[編集]P-I結合はほとんど双極子を持たないため、二硫化炭素溶液中で実質的に双極子モーメントが0となる。 P-I結合は弱い。PBr3やPCl3より、はるかに不安定で、標準生成エンタルピーは−46 kJ/ mol(固体)しかない。リン原子は、178 ppm(H3PO4を0 ppmとする)のNMR化学シフトを有する。
反応
[編集]三ヨウ化リンは水と激しく反応し、亜リン酸(H3PO3)とヨウ化水素 (HI) に分解する。
還元剤、脱酸素剤としても強力である。-78 ℃でも、スルホキシドをチオエーテルに還元する[2]。一方、赤リンと共にPI3のヨウ化ブチル溶液で加熱すると、P2I4に還元される。
製造
[編集]別法では、PCl3と特定の金属ヨウ化物かヨウ化水素を反応させ、PI3に変換する。
用途
[編集]実験室では一級または二級アルコールをヨウ化アルキルに変換するのに広く使われる[3]。多くの場合、アルコール存在下で赤リンとヨウ素の反応によってPI3はその場で合成される。例えば、メタノールからヨードメタンの合成など[4]。
このヨウ化アルキルは求核置換反応やグリニャール試薬の合成に便利である。系中で温和な条件で合成できることから違法薬物の密造に用いられることもある。
出典
[編集]- ^ L. G. Wade, Jr., Organic Chemistry, 6th ed., p. 477, Pearson/Prentice Hall, Upper Saddle River, New Jersey, USA, 2005.
- ^ J. N. Denis; A. Krief (1980). “Phosphorus tri-iodide (PI3), a powerful deoxygenating agent”. J. Chem. Soc., Chem. Commun. (12): 544–5. doi:10.1039/C39800000544.
- ^ B. S. Furnell et al., Vogel's Textbook of Practical Organic Chemistry, 5th edition, Longman/Wiley, New York, 1989.
- ^ King, C. S.; Hartman, W. W. (1943). "Methyl Iodide". Organic Syntheses (英語).; Collective Volume, vol. 2, p. 399
関連項目
[編集]| 1 | 18 | |||||||||||||||||||||||||||||||
| 1 | HI | 2 | 13 | 14 | 15 | 16 | 17 | He | ||||||||||||||||||||||||
| 2 | LiI | BeI2 | BI3 | CI4 | NI3 | IxOy | IFx | Ne | ||||||||||||||||||||||||
| 3 | NaI | MgI2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | AlI3 | SiI4 | PI3 | SI2 | IxCly | Ar | ||||||||||||||
| 4 | KI | CaI2 | ScI3 | TiI4 | VI3 | CrIx | MnI2 | FeI2 | CoI2 | NiI2 | CuI | ZnI2 | Ga2I6 | GeIx | AsI3 | SeI2 | IBr | Kr | ||||||||||||||
| 5 | RbI | SrI2 | YI3 | ZrI4 | NbI5 | Mo | Tc | Ru | Rh | Pd | AgI | CdI2 | InI3 | SnIx | SbI3 | TeI4 | I | Xe | ||||||||||||||
| 6 | CsI | BaI2 | La | Ce | Pr | Nd | Pm | SmI2 | Eu | Gd | TbI3 | Dy | Ho | Er | Tm | Yb | Lu | HfI4 | TaI5 | W | Re | Os | Ir | Pt | AuI | HgxIy | TlI | PbI2 | Bi | Po | AtI | Rn |
| 7 | Fr | Ra | Ac | ThI4 | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |



