塩化スルフリル
| 塩化スルフリル | |
|---|---|
| |

| |

| |
Sulfuryl chloride | |
別称 Sulfonyl chloride Sulfuric chloride スルフリルクロリド 塩化スルホニル オキシ塩化硫黄 | |
| 識別情報 | |
| CAS登録番号 | 7791-25-5 |
| PubChem | 24648 |
| ChemSpider | 23050 |
| EC番号 | 232-245-6 |
| ChEBI | |
| |
| |
| 特性 | |
| 化学式 | SO2Cl2 |
| モル質量 | 134.965 g mol−1 |
| 外観 | 刺激臭のある無色の液体 放置すると黄色になる |
| 密度 | 1.667 g cm−3 (20 °C) |
| 融点 |
−54.1 °C, 219.1 K |
| 沸点 |
69.4 °C, 342.6 K |
| 水への溶解度 | 加水分解 |
| 溶解度 | ベンゼン、トルエン、クロロホルム、四塩化炭素、氷酢酸に可溶 |
| 屈折率 (nD) | 1.4437 (20 °C) [1] |
| 危険性 | |
| EU分類 | 腐食性 (C) |
| EU Index | 016-016-00-6 |
| Rフレーズ | R14, R34, R37 |
| Sフレーズ | (S1/2), S26, S45 |
| 引火点 | 不燃性 |
| 関連する物質 | |
| 関連するハロゲン化スルフリル | フッ化スルフリル |
| 関連物質 | 塩化チオニル 塩化スルホン酸 硫酸 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
塩化スルフリル(えんかスルフリル、sulfuryl chloride)は化学式 SO2Cl2 で表される化合物である。室温では辛味のある悪臭を持つ無色の液体である。水により速やかに加水分解するため天然には存在しない。
同じく硫黄のオキシ塩化物である塩化チオニル(塩化スルフィニル、)と混同されることがあるが、これら2つの性質は異なる。塩化チオニルは塩化物イオン () の発生源であるが、塩化スルフリルは塩素 () の発生源である。
性質
[編集]水と激しく反応し、塩化水素が発生する。
沸点より約 40 ℃ 高い 100 ℃ 以上に加熱すると分解する。放置すると二酸化硫黄と塩素に分解するため、塩化スルフリルは黄色みを帯びるようになる。
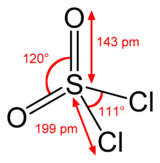
塩化スルフリルの硫黄原子は四面体構造を持ち、その酸化数は硫酸中の硫黄原子と同じく +6 である。
合成法
[編集]二酸化硫黄と塩素を活性炭などの触媒の存在下に反応させると得られる。
粗生成物は分留によって精製する。市販されているので実験室で調製を行う必要はない。
用途
[編集]塩素の発生源として使われる。液体であるため、塩素ガスに比べ計量や保存が容易である。カルボニル基やスルフィニル基などの活性化置換基に隣接した C−H 結合を C−Cl 結合に変換する試薬として広く用いられる。アゾビスイソブチロニトリル (AIBN) などの開始剤を用いたラジカル反応によるアルカン、アルケン、アルキン、芳香族化合物、エポキシドの塩素化にも利用される。また、アルコールを塩化アルキルに変換する。工業的には殺虫剤の製造原料が主な用途である。
ウールが縮むのを防止する処理にも用いられる。
注意
[編集]毒性、腐食性を持ち、催涙物質としてはたらく。水およびジメチルスルホキシドやN,N-ジメチルホルムアミドなどの配位性を持つ溶媒と爆発性の混合物を形成する。
参考文献
[編集]- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0070494398
外部リンク
[編集]- 7791-25-5 塩化スルフリル 富士フイルム和光純薬株式会社





