「バリウム」の版間の差分
Dinamik-bot (会話 | 投稿記録) m r2.6.5) (ロボットによる 追加: be-x-old:Бар (элемэнт) |
m 外部リンクの修正 (laws.e-gov.go.jp) (Botによる編集) |
||
| (57人の利用者による、間の90版が非表示) | |||
| 1行目: | 1行目: | ||
{{ |
{{Otheruseslist|元素|X線造影剤等として用いられるバリウム化合物|硫酸バリウム|古代ローマ時代のイタリアの都市|バーリ|ロシュ社の抗不安薬「'''Valium'''」|ジアゼパム}} |
||
{{Elementbox |
{{Elementbox |
||
|name=barium |
|name=barium |
||
| 33行目: | 33行目: | ||
|density gpcm3nrt=3.51 |
|density gpcm3nrt=3.51 |
||
|density gpcm3mp=3.338 |
|density gpcm3mp=3.338 |
||
|melting point K= |
|melting point K=999.4 |
||
|melting point C= |
|melting point C=726.2 |
||
|melting point F= |
|melting point F=1339.2 |
||
|boiling point K= |
|boiling point K=1910 |
||
|boiling point C= |
|boiling point C=1637 |
||
|boiling point F= |
|boiling point F=2979 |
||
|triple point K= |
|triple point K= |
||
|triple point kPa= |
|triple point kPa= |
||
| 85行目: | 85行目: | ||
|CAS number=7440-39-3 |
|CAS number=7440-39-3 |
||
|isotopes= |
|isotopes= |
||
{{ |
{{Elementbox_isotopes_decay | mn=130 | sym=Ba |
||
| na=0.106% | hl=(0.5-2.7)x10<sup>21</sup> [[年|y]] |
|||
{{Elementbox_isotopes_stable | mn=132 | sym=Ba | na=0.101 % | n=76}} |
|||
| dm=[[二重電子捕獲|εε]] | de=2.620 | pn=130 | ps=[[キセノン|Xe]]}} |
|||
{{Elementbox_isotopes_decay | mn=132 | sym=Ba |
|||
| na=0.101% | hl= >3x10<sup>20</sup> [[年|y]] |
|||
| dm=[[二重ベータ崩壊|β+β+]] | de=0.846 | pn=132 | ps=[[キセノン|Xe]]}} |
|||
{{Elementbox_isotopes_decay | mn=133 | sym=Ba |
{{Elementbox_isotopes_decay | mn=133 | sym=Ba |
||
| na=[[人工放射性同位体|syn]] | hl=10.51 [[年|y]] |
| na=[[人工放射性同位体|syn]] | hl=10.51 [[年|y]] |
||
| dm=[[電子捕獲|ε]] | de=0.517 | pn=133 | ps=[[セシウム|Cs]]}} |
| dm=[[電子捕獲|ε]] | de=0.517 | pn=133 | ps=[[セシウム|Cs]]}} |
||
{{Elementbox_isotopes_stable | mn=134 | sym=Ba | na=2.417 |
{{Elementbox_isotopes_stable | mn=134 | sym=Ba | na=2.417% | n=78}} |
||
{{Elementbox_isotopes_stable | mn=135 | sym=Ba | na=6.592 |
{{Elementbox_isotopes_stable | mn=135 | sym=Ba | na=6.592% | n=79}} |
||
{{Elementbox_isotopes_stable | mn=136 | sym=Ba | na=7.854 |
{{Elementbox_isotopes_stable | mn=136 | sym=Ba | na=7.854% | n=80}} |
||
{{Elementbox_isotopes_stable | mn=137 | sym=Ba | na=11.23 |
{{Elementbox_isotopes_stable | mn=137 | sym=Ba | na=11.23% | n=81}} |
||
{{Elementbox_isotopes_stable | mn=138 | sym=Ba | na=71.7 |
{{Elementbox_isotopes_stable | mn=138 | sym=Ba | na=71.7% | n=82}} |
||
|isotopes comment= |
|isotopes comment= |
||
}} |
}} |
||
'''バリウム''' |
'''バリウム'''({{lang-en-short|barium}} {{IPA-en|ˈbɛəriəm|}})は、[[原子番号]] 56 の[[元素]]。[[元素記号]]は '''Ba'''。[[アルカリ土類金属]]のひとつ。 |
||
== 名称 == |
|||
アルカリ土類金属としては密度が大きく重いため、[[ギリシャ語]]で「重い」を意味する {{lang|el|βαρύς}} (barys) にちなんで命名された。「重晶石」のように、日本語でも「重」はバリウムを指すことがある。(ただし、比重は約3.5であるので[[軽金属]]に分類される) |
|||
アルカリ土類金属としては密度が大きく重いため、[[ギリシャ語]]で「重い」を意味する {{lang|el|βαρύς}} (barys) にちなんで命名された。ただし、金属バリウムの比重は約3.5であるため[[軽金属]]に分類される。 |
|||
== |
== 性質 == |
||
単体では銀白色の軟らかい金属。他のアルカリ土類金属元素と類似した性質を示すが、[[カルシウム]]や[[ストロンチウム]]と比べ反応性は高い。化学的性質としては+2価の[[希土類]]イオンとも類似した性質を示す。 |
|||
[[密度]]3.51 g/cm<sup>3</sup> (20 {{℃}})、[[融点]]729 {{℃}}、[[沸点]]1898 {{℃}}(1気圧)<ref>国立天文台 編, 『理科年表 第79冊』, p367 & 391, 丸善, 2005.</ref>。常温、常圧で安定な結晶構造は、体心立方構造 (BCC)。化学的性質は[[カルシウム]]、[[ストロンチウム]]に似るが、さらに反応性が高く、水と激しく反応する。 |
|||
バリウム塩には毒性があり、摂取すると[[カリウムチャネル]]をバリウムイオンが阻害することによって神経系への影響が生じる。そのためバリウム塩(バリウム化合物)は[[毒物及び劇物取締法]](指定令)において劇物に指定されている(金属のバリウムは指定されていない、硫酸バリウムなど指定されない物質もある)。 |
|||
== 用途 == |
|||
[[File:Eosinophilic esophagitis-barium swallow.jpg|thumb|left|200px|造影剤として食道を造影したレントゲン写真]] |
|||
[[X線写真|レントゲン]]の[[造影剤]]として[[硫酸バリウム]]が使用される。硫酸バリウム以外の[[バリウム塩]]は[[有毒]]なものが多い。 |
|||
=== 物理的性質 === |
|||
[[炎色反応]]では緑色になるため、[[花火]]などにも使われる。 |
|||
バリウムは[[鉛]]と同程度に柔らかく銀白色の外観を有する[[アルカリ土類金属]]である。[[金属光沢]]を有しているが、空気中では徐々に酸化されて白色の酸化被膜に覆われるため金属光沢は失われる<ref name="chitani193"/>。[[融点]]および[[沸点]]は資料により異なるデータがみられ、融点は729 {{℃}}<ref name="rika">国立天文台 編, 『理科年表 第79冊』, p367 & 391, 丸善, 2005.</ref>や725 {{℃}}<ref name="icsc">{{ICSC-ref|1052|accessdate=2013-01-30}}</ref><ref>[[#CW1987|コットン、ウィルキンソン (1987)]] 266頁。</ref>、726.2 {{℃}}<ref name="Ullman326">[[#Kresseetc|#Kresse et al. (1985)]] p. 326</ref>というデータがあり、沸点は1898 {{℃}}(1気圧)<ref name="rika">国立天文台 編, 『理科年表 第79冊』, p367 & 391, 丸善, 2005.</ref>、1640 {{℃}}<ref name="icsc"/>、1637 {{℃}}(1気圧)<ref name="Ullman326"/>というデータがある。密度が3.51 g/cm<sup>3</sup>と低いため[[軽金属]]に分類される<ref name="chitani193">[[#千谷1959|千谷 (1959)]] 193頁。</ref>。常温、常圧で安定な結晶構造は体心立方構造 (BCC) であり、その[[格子定数]]aは5.01である<ref name="chitani199">[[#千谷1959|千谷 (1959)]] 199頁。</ref>。 |
|||
[[炎色反応]]においてバリウムは黄緑色の炎色を呈する<ref>[[#千谷1959|千谷 (1959)]] 198頁。</ref>。主要な輝線は524.2 nmおよび513.7 nmの緑色の[[スペクトル線]]であり、それらは双子線を示すアルカリ金属元素の輝線とは対照的に単線を示す<ref name="chitani199"/>。 |
|||
代表的な[[高温超伝導]]体である[[イットリウム系超伝導体]]の1成分として用いられる。また、BaZrO<sub>3</sub> は、バリウムを含む高温超伝導体を製造する時の[[るつぼ]]として用いられる。これは、溶融酸化バリウムと反応しないためである。溶融酸化バリウムは反応性が高いために他の材料ではるつぼの素材がとけてしまうからである。 |
|||
== |
=== 化学的性質 === |
||
{| class="wikitable" style="float:right; margin-top:0; margin-left:1em; text-align:center; font-size:10pt; line-height:11pt; width:25%;" |
|||
1774年に[[スウェーデン]]の[[カール・ヴィルヘルム・シェーレ]]が[[軟マンガン鉱]]から発見。1808年に[[ハンフリー・デービー]]によって単体として取り出された。 |
|||
|+ style="margin-bottom: 5px;"|各種アルカリ土類金属塩および亜鉛塩の密度 g·cm<sup>−3</sup> |
|||
|- |
|||
! |
|||
! [[酸化物|O<sup>2-</sup>]] |
|||
! [[硫化物|S<sup>2-</sup>]] |
|||
! [[フッ化物|F<sup>-</sup>]] |
|||
! [[塩化物|Cl<sup>-</sup>]] |
|||
! [[硫酸塩|SO<sub>4</sub><sup>2-</sup>]] |
|||
! [[炭酸塩|CO<sub>3</sub><sup>2-</sup>]] |
|||
! [[過酸化物|O<sub>2</sub><sup>2-</sup>]] |
|||
! [[水素化物|H<sup>-</sup>]] |
|||
|- |
|||
! scope="row"|[[カルシウム|{{chem|Ca|2+}}]]<ref>[[#Lide2004|Lide (2004)]] p.4-48-50</ref> |
|||
|3.34 |
|||
|2.59 |
|||
|3.18 |
|||
|2.15 |
|||
|2.96 |
|||
|2.83 |
|||
|2.9 |
|||
|1.7 |
|||
|- |
|||
! scope="row"|[[ストロンチウム|{{chem|Sr|2+}}]]<ref>[[#Lide2004|Lide (2004)]] p.4-86-88</ref> |
|||
|5.1 |
|||
|3.7 |
|||
|4.24 |
|||
|3.05 |
|||
|3.96 |
|||
|3.5 |
|||
|4.78 |
|||
|3.26 |
|||
|- |
|||
! scope="row" style="background:#ff9;"| '''''{{chem|Ba|2+}}'''''<ref>[[#Lide2004|Lide (2004)]] p.4-43-45</ref> |
|||
| style="background:#ff9;"| ''5.72'' |
|||
| style="background:#ff9;"| ''4.3'' |
|||
| style="background:#ff9;"| ''2.1'' |
|||
| style="background:#ff9;"| ''1.9'' |
|||
| style="background:#ff9;"| ''4.49'' |
|||
| style="background:#ff9;"| ''4.29'' |
|||
| style="background:#ff9;"| ''4.96'' |
|||
| style="background:#ff9;"| ''4.16'' |
|||
|- |
|||
! scope="row"|[[亜鉛|{{chem|Zn|2+}}]]<ref>[[#Lide2004|Lide (2004)]] p.4-95-96</ref> |
|||
|5.6 |
|||
|4.09 |
|||
|4.9 |
|||
|2.09 |
|||
|3.8 |
|||
|4.4 |
|||
|1.57 |
|||
|— |
|||
|} |
|||
バリウムの化学的性質は[[カルシウム]]や[[ストロンチウム]]に類似しているものの、アルカリ土類金属元素の[[電気陰性度]]は原子番号が大きくなるにつれて小さくなる傾向があるため、バリウムはカルシウムやストロンチウムよりもさらに反応性が高い<ref>[[#千谷1959|千谷 (1959)]] 194頁。</ref>。このアルカリ土類金属元素の持つ性質の連続的な変化によって、バリウムの塩は他のアルカリ土類金属の塩と比較して[[水和物]]を形成しやすく、水に対する溶解度が低く、熱的安定性が優れているという性質を有している<ref name="CW267">[[#CW1987|コットン、ウィルキンソン (1987)]] 267頁。</ref>。2価のバリウムイオンの化学的性質は[[ユウロピウム]]や[[サマリウム]]、[[イッテルビウム]]イオンなど2価の希土類イオンと類似しており、バリウム鉱石中にこれらの元素が含まれていることがある<ref name="CW268">[[#CW1987|コットン、ウィルキンソン (1987)]] 268頁。</ref>。バリウムイオンは可視領域にスペクトルを持たないためバリウム化合物は全て無色であり、バリウム化合物の着色はアニオン側の持つ色や構造の欠陥に起因して生じたものである<ref name="CW277"/>。 |
|||
バリウムの電溶圧は[[水素]]よりも大きいため水と激しく反応して水素を発生させ、アルコールとも同様に激しく反応する<ref>[[#千谷1959|千谷 (1959)]] 195頁。</ref>。 |
|||
== 法規制 == |
|||
: <chem>Ba + 2H2O -> Ba(OH)2 + H2</chem> |
|||
日本では[[毒物及び劇物取締法]]により[[硫酸バリウム]]以外のバリウム化合物は[[劇物]]に指定されている。 |
|||
バリウムは空気中で徐々に酸化されて白色の酸化バリウムを形成し、この酸化物もまた水と激しく反応して水酸化バリウムとなる。水酸化バリウムはアルカリ土類金属の水酸化物の中では水に対する溶解度が高く強塩基性である<ref>[[#千谷1959|千谷 (1959)]] 196頁。</ref>。バリウムは高温で炭素と直接反応してイオン性アセチリドである炭化バリウムを生成する。この炭化物は加水分解によって[[アセチレン]]を発生させる。また、[[ホウ素]]、[[ケイ素]]、[[ヒ素]]、[[硫黄]]などとも直接反応してイオン性の化合物を形成するが、これらの化合物もまた容易に加水分解を受ける。オキソ酸とも反応して硫酸バリウムや硝酸バリウムのような化合物を形成し、それらの化合物は水に対する溶解性が低い<ref name="CW278">[[#CW1987|コットン、ウィルキンソン (1987)]] 278頁。</ref>。 |
|||
== バリウムの化合物 == |
|||
* [[塩化バリウム]] (BaCl<sub>2</sub>) |
|||
* [[過酸化バリウム]] (BaO<sub>2</sub>) |
|||
* [[酸化バリウム]] (BaO) |
|||
* [[水酸化バリウム]] (Ba(OH)<sub>2</sub>) |
|||
* [[チタン酸バリウム]] (BaTiO<SUB>3</SUB>) |
|||
* [[硫酸バリウム]](BaSO<sub>4</sub>) |
|||
* [[炭酸バリウム]](BaCO<sub>3</sub>) |
|||
* [[酢酸バリウム]] (Ba(CH<sub>3</sub>COO)<sub>2</sub>) |
|||
* [[硝酸バリウム]] (Ba(NO<sub>3</sub>)<sub>2</sub>) |
|||
* [[クロム酸バリウム]] (BaCrO<SUB>4</SUB>) - [[黄色]][[顔料]]・バリウムクロメート(バリウムイエロー)として使われる。 |
|||
* [[フェライト (磁性材料)#六方晶フェライト|バリウムフェライト]] (BaFe<sub>12</sub>O<sub>19</sub>) - [[フェライト磁石]]として使われる。 |
|||
バリウムの[[過塩素酸]]塩は[[ジエチレントリアミン]]によって[[錯体]]を形成するが、安定に存在できるのは固体常態のみであり溶液中では容易に解離する<ref>[[#CW1987|コットン、ウィルキンソン (1987)]] 279頁。</ref>。また、[[クラウンエーテル]]とも錯体を形成する<ref>[[#CW1987|コットン、ウィルキンソン (1987)]] 281頁。</ref>。バリウムは液体[[アンモニア]]に溶解して青色の溶液となり、ここからアンモニアを除去することでバリウムのアンミン錯体を得ることができる<ref name="CW277">[[#CW1987|コットン、ウィルキンソン (1987)]] 277頁。</ref>。 |
|||
== 同位体 == |
|||
バリウムは[[アルミニウム]]、[[亜鉛]]、鉛および[[スズ]]を含むいくつかの金属と結合し、[[合金]]および[[金属間化合物]]を形成する<ref>{{cite book|author= Ferro, Riccardo and Saccone, Adriana|page=355|title=Intermetallic Chemistry|publisher=Elsevier|year=2008|isbn=978-0-08-044099-6}}</ref>。 |
|||
=== 同位体 === |
|||
{{main|バリウムの同位体}} |
{{main|バリウムの同位体}} |
||
自然より産出するバリウムは七つの同位体の混合物であり、[[天然存在比]]が最大のものは<sup>138</sup>Baの71.7%である。バリウムは40の同位体が知られているが、それらのほとんどは[[半減期]]が数ミリ秒から数日の高い[[放射能]]を持つ放射性同位体である。例外として、10.51年という比較的長い半減期を持つ<sup>133</sup>Baがある<ref>{{citation| author = David R. Lide, Norman E. Holden|title =CRC Handbook of Chemistry and Physics, 85th Edition| publisher = CRC Press|location = Boca Raton, Florida|year =2005| chapter = Section 11, Table of the Isotopes}}</ref>。<sup>133</sup>Baは原子物理学の研究におけるガンマ線探知機などにおいて校正用の標準線源として用いられる<ref>{{Cite web|和書|title=標準線源 (09-04-03-02)|url=https://atomica.jaea.go.jp/data/detail/dat_detail_09-04-03-02.html|publisher=高度情報科学技術研究機構 原子力百科事典|accessdate=2012-01-15}}</ref>。 |
|||
== 分析 == |
|||
=== 定性分析 === |
|||
バリウムを含む溶液に硫酸を加えると不溶性の硫酸バリウムが白色沈殿として生じるため、これをもって簡易な[[定性分析]]を行うことができる。しかしこの方法では、同族元素である[[カルシウム]]もしくは[[ストロンチウム]]が含まれているとバリウムと同様に硫酸塩の沈殿が生じ、鉛イオンもまた同様に[[硫酸鉛]]の白色沈殿を生じさせて定性分析の妨害となる<ref>[[#charlot1974|シャルロー (1974)]] 279-280頁。</ref>。 |
|||
バリウムの定性分析法としては、酢酸緩衝液下で[[クロム酸バリウム]]の黄色沈殿を生じさせる方法が用いられる。この際、マスキング剤として[[エチレンジアミン四酢酸]] (EDTA) と塩化マグネシウムを加えることで他の元素がEDTAと錯体を形成するため、バリウム以外の元素が水酸化物として沈殿して妨害するのを抑止することができる<ref>[[#charlot1974|シャルロー (1974)]] 281-282頁。</ref>。 |
|||
バリウムは[[炎色反応]]においてうすい緑色を呈するが、銅や[[マンガン]]、[[テルル]]、[[ビスマス]]など多くの元素が類似の炎色を示すため定性分析としては利用し難い<ref>[[#charlot1974|シャルロー (1974)]] 282, 595頁。</ref>。 |
|||
=== 定量分析 === |
|||
溶液中のバリウム濃度の[[定量分析]]法として、硫酸バリウムもしくはクロム酸バリウムの形でバリウムを沈殿させてその重量を測定する重量法が挙げられる<ref>[[#katou1932|加藤 (1932)]] 89-90頁。</ref>。硫酸バリウムを用いた場合には、ストロンチウが不純物として含まれているとストロンチウムの分も分析値に上乗せされるため、[[原子吸光]]法などによってストロンチウムの含有量を別途測定して分析値から差し引く必要がある<ref name="JIS"/>。また、このようにして得られたクロム酸バリウムを硫酸酸性溶液に溶解させ、規定量の[[硫酸鉄(II)]]溶液を加えたのちに過剰量の硫酸鉄(II)を[[過マンガン酸カリウム]]溶液で逆[[滴定]]する[[容量分析]]法によっても定量分析することもできる。これは、クロム酸の作用で硫酸鉄(II)が酸化される反応を利用したものであり、クロム酸の逆滴定と同一の方法である<ref>[[#katou1932|加藤 (1932)]] 90-91頁。</ref>。バリウム溶液中に、アンモニア性塩化アンモニウム緩衝溶液およびマグネシウム溶液を加え、[[エリオクロムブラックT]]を指示薬としてEDTA溶液でキレート滴定する方法も用いられるが、この方法においても硫酸バリウムを用いた重量法と同様にストロンチウムの分析値を差し引く必要がある。EDTAによるキレート滴定法は[[日本工業規格]]におけるバリウムの定量分析法の一つとして採用されている<ref name="JIS">[[日本工業規格]] JIS K 1414-1992, JIS K 1416-1992など</ref>。 |
|||
機器分析法としては、フレームレス原子吸光法 (AAS) やICP-AES、ICP-MSが利用され、AASの吸収波長は553.6 nm、ICP-AESの発光波長は233.527 nmおよび455.403 nmが用いられる<ref>{{Cite web|和書|title=水道用薬品類の評価のための試験方法ガイドライン|url=https://www.mhlw.go.jp/topics/bukyoku/kenkou/suido/suishitsu/dl/yakuhin_gl.pdf|author=厚生労働省健康局水道課|pages=20-21, 24-25|publisher=[[厚生労働省]]|accessdate=2012-03-10}}</ref>。 |
|||
== 歴史 == |
|||
[[File:CWScheele.jpg|thumb|left|バリウムの発見者であるカール・ヴィルヘルム・シェーレ]] |
|||
バリウムの名称は、[[ギリシャ語]]で「重い」を意味する{{lang|el|βαρύς}} (barys) に由来しており、それは一般的なバリウムを含む鉱石が高密度であることを表している。中世初期の錬金術師たちはいくつかのバリウム鉱石を知っており、[[イタリア]]の[[ボローニャ]]で見つけられた滑らかな小石様の[[重晶石]]鉱石は「ボローニャの石」として知られていた<ref>[[ヨハン・ヴォルフガング・フォン・ゲーテ|ゲーテ]]の『[[若きウェルテルの悩み]]』にも「ボロニア石」として出てくる。[[ロラン・バルト]]は『恋愛のディスクール・断章』でボローニャの石からウェルテルを論じている。</ref>。その石に光を照射するとその後輝き続ける(つまり[[蛍光]]を示す)ことから、魔女や錬金術師たちはこの石に魅力を感じていた<ref name="history">{{citation| page = 80| url = https://books.google.co.jp/books?id=yb9xTj72vNAC&redir_esc=y&hl=ja| title = The history and use of our earth's chemical elements: a reference guide| author = Robert E. Krebs| publisher = Greenwood Publishing Group| year = 2006| isbn = 0313334382}}</ref>。ボローニャ石の発光は、主成分である重晶石(硫酸バリウム;BaSO<sub>4</sub>)に起因すると考えられていたが、Cu<sup>+/2+</sup>ドープBaSによるものだと明らかになっている<ref>{{Cite journal|和書 | author = Katharina M. Fromm | year = 2013 | title = 輝ける重い元素バリウム | journal = Nature Chemistry | volume =5 | issue = 149 | publisher = Nature | doi = 10.1038/nchem.1551 | url = https://www.natureasia.com/ja-jp/nchem/in-your-element/article/50217 | ref = harv }}</ref>。 |
|||
1774年、[[スウェーデン]]の[[カール・ヴィルヘルム・シェーレ]]が[[軟マンガン鉱]]に新しい元素が含まれていることを発見したが、その鉱石からバリウムを分離することはできなかった。[[ヨハン・ゴットリーブ・ガーン]]もまた類似した研究を行い、シェーレによるバリウムの発見から二年後に[[酸化バリウム]]として鉱石から分離することに成功した。酸化バリウムは初め[[ルイ=ベルナール・ギュイトン・ド・モルヴォー]]によってbaroteと呼ばれており、[[アントワーヌ・ラヴォアジエ]]によってバリタ (baryta) と改名された。また、18世紀にはイギリスの鉱物学者である[[ウィリアム・ウィザリング]]も[[カンバーランド]]の鉛鉱山で産出する重い鉱石([[炭酸バリウム]]の鉱石である{{仮リンク|毒重石|en|Witherite}})について言及していた。1808年、イギリスの[[ハンフリー・デービー]]がバリウム塩の溶融塩電解によってバリウムの単体を初めて単離した<ref>Davy, H. (1808) "[https://books.google.co.jp/books?id=gpwEAAAAYAAJ&pg=102&redir_esc=y&hl=ja#v=onepage&q&f=false Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia]," ''Philosophical Transactions of the Royal Society of London'', vol. 98, pages 333-370.</ref>。デービーは類似した性質を示す[[カルシウム]]の命名法に準じて{{#tag:ref|デービーは石灰を意味する「calcsis」の語尾に「-ium」を付けてカルシウムと命名した<ref>{{cite book|和書|title=元素を知る事典: 先端材料への入門|author=村上雅人|year=2004|page=102|publisher=海鳴社|isbn=487525220X}}</ref>。|group="注釈"}}、酸化バリウムを表すバリタ (baryta) の後ろに金属元素を意味する接尾語である「-ium」を付けてバリウム (barium) 名付けた<ref name="history"/>。[[ロベルト・ブンゼン]]および{{仮リンク|アウグストゥス・マーティセン|en|Augustus Matthiessen}}は、塩化バリウムと[[塩化アンモニウム]]の混合物を溶融させて電気分解を行うことによって純粋なバリウムを得た<ref>{{citation | doi = 10.1002/jlac.18550930301 | title = Masthead | year = 1855 | journal = Annalen der Chemie und Pharmacie | volume = 93 | issue = 3 | pages = fmi–fmi}}</ref><ref>{{citation | doi =10.1002/prac.18560670194 | title =Notizen | year =1856 | last1 =Wagner | first1 =Rud. | last2 =Neubauer | first2 =C. | last3 =Deville | first3 =H. Sainte-Claire | last4 =Sorel | last5 =Wagenmann | first5 =L. | last6 =Techniker | last7 =Girard | first7 =Aimé | journal =Journal für Praktische Chemie | volume =67 | pages =490–508}}</ref>。 |
|||
電気分解および液体空気の分留が有意な酸素の生産方法として確立される以前は、過酸化バリウムを用いて純粋な酸素を生産する{{仮リンク|ブリン法|en|Brin process}}がバリウムの大規模な用途であった。これは、酸化バリウムを空気中で500から600度で熱して過酸化バリウムとし、この過酸化バリウムを700℃以上で熱することによって純粋な酸素を得るという方法である<ref>{{citation | last1 = Jensen | first1 = William B. | title = The Origin of the Brin Process for the Manufacture of Oxygen | journal = Journal of Chemical Education | volume = 86 | pages = 1266 | year = 2009 | doi = 10.1021/ed086p1266 | issue = 11 |bibcode = 2009JChEd..86.1266J }}</ref><ref>{{citation | url = https://books.google.de/books?id=34KwmkU4LG0C&pg=PA681&hl=de | page = 681 | title = The development of modern chemistry | isbn = 9780486642352 | author1 = Ihde, Aaron John | date = 1984-04-01}}</ref>。 |
|||
: <chem>2BaO + O2 <=> 2 BaO2</chem> |
|||
1908年には、消化器系の[[X線写真]]で[[造影剤]]として初めて利用された<ref>{{cite journal|pmc = 1081520|title = Some Observations on the History of the Use of Barium Salts in Medicine|year = 1974|volume = 18|issue = 1|author=Schott, G. D.|journal=Med Hist.|pages=9–21}}</ref>。 |
|||
== 存在 == |
|||
地殻における存在量は豊富であり、[[重晶石]]([[硫酸バリウム]])などの鉱石として産出する。確認埋蔵量の48.6%を[[中国]]が占めており、生産量も50%以上が中国によるものである。 |
|||
バリウムの宇宙全体の平均濃度の推定値は重量濃度で10 ppb、[[太陽]]における推定濃度も10 ppbである<ref>{{citation |url=http://www.webelements.com/barium/geology.html|title=Barium: geological information|work=Mark Winter, The University of Sheffield and WebElements Ltd, UK |publisher=WebElements |accessdate=2012-01-15}}</ref>。[[地殻]]においては比較的豊富に存在しており、その存在量は4.25 × 10<sup>2</sup> mg/kgである。また、海水中には1.3 × 10<sup>-2</sup> mg/L含まれる<ref>{{Cite web|title=The Element Barium|url=http://education.jlab.org/itselemental/ele056.html|publisher=Jefferson Lab.|accessdate=2012-01-15}}</ref>。地殻中において[[重晶石]](硫酸塩)や[[毒重石]](炭酸塩)のような鉱物として存在している<ref name="Ullman5"/>。毒重石の鉱石は、例えば北イングランドの{{仮リンク|ニューボロー|en|Newbrough}}近辺のセッティングストーンズ鉱山<ref>{{cite web | url = http://www.rock-site.co.uk/EZ/rs/rs/page151.php | title = Alston Moor Cumbria, UK| publisher = Steetley Minerals|accessdate=2012-01-15}}</ref>などにおいて17世紀から1969年までの間採掘されてきたが<ref>{{citation | url = https://books.google.co.jp/books?id=JjEmAQAAIAAJ&dq=Settlingstones+Witherite+Mine&q=Settlingstones+&redir_esc=y&hl=ja#search_anchor | page = 28 | title = Industrial minerals | year = 1969}}</ref>、現在はほとんど全てのバリウムは重晶石として採掘されている。[[アメリカ地質調査所]]の2005年版''Mineral Commodity Summaries''を元にした東北経済産業局の報告書によれば、バリウムの確認埋蔵量は重晶石ベースで7.4億トン、可産鉱量は2.0億トンであると見積もられており、可産年数は29年とされている<ref name="tohoku">{{Cite web|和書|url=https://mric.jogmec.go.jp/public/report/2011-07/Ba.pdf|title=我が国における鉱種別 需給/リサイクル/用途等 資料2.30 バリウム (Ba)|work=東北非鉄振興プラン報告書|publisher=東北経済産業局|accessdate=2013-01-08}}</ref>。重晶石の大きな鉱床は[[中華人民共和国]]、[[ドイツ]]、[[インド]]、[[モロッコ]]および[[アメリカ合衆国]]で発見されており<ref name="CRC">{{citation| author = C. R. Hammond |title = The Elements, in Handbook of Chemistry and Physics 81st edition| publisher =CRC press| year = 2000| isbn = 0849304814}}</ref>、確認埋蔵量の48.6%を中国が占めている<ref name="tohoku"/>。毒重石の鉱床としてはイギリス、[[ルーマニア]]、旧[[ソビエト連邦]]などに見られるが、それらは商業的に重要ではない<ref name="Ullman5"/>。バリウムを含む[[宝石]]としては濃い青色を示す[[ベニト石]](ベニトアイト)があり、[[カリフォルニア州]]の[[サンベニト郡 (カリフォルニア州)|サン・ベニト]]で産出する<ref>{{Cite book|和書|title=宝石の写真図鑑(地球自然ハンドブック) |author=キャリー・ホール|year=1996|publisher=日本ヴォーグ社|page=80|isbn=4529026914}}</ref>。 |
|||
== 生産 == |
|||
[[File:BariteWorldProductionUSGS.PNG|thumb|世界の重晶石生産量の動向]] |
|||
[[File:World Baryte Production 2010.svg|thumb|right|250px|2010年の重晶石の生産国]] |
|||
バリウム(重晶石)の年間生産量のピークは1981年の830万トンであり、そのうち7-8%だけが金属バリウムやその化合物の生産に利用された<ref name="Ullman5">[[#Ullman2007|Ullman 2007]], p. 5.</ref>。これは、バリウムの最大の用途が{{仮リンク|掘穿泥水|en|Drilling fluid}}における[[加重剤]]としての用途であり、この目的には重晶石をそのまま粉砕して硫酸バリウムとして利用するためである<ref>{{Cite web|和書|url=https://mric.jogmec.go.jp/public/report/2011-07/Ba.pdf|title=31.バリウム|publisher=石油天然ガス・金属鉱物資源機構|accessdate=2013-01-09}}</ref>。[[シェールガス]]の採掘増加に伴う掘穿泥水の需要増によって、2016年にはピーク時の生産量を越える930万トンにまで需要が拡大するものと予想されている<ref>{{Cite web|和書|url=http://www.sojitz.com/jp/news/2012/20120713.html|title=双日、メキシコにおける世界最大級のバライト鉱山へ出資〜石油・ガス採掘時の掘削泥水原料として需要拡大〜|publisher=双日|accessdate=2013-01-09}}</ref>。2011年におけるバリウム生産量はその50%以上を中国が占めており、それに14%のインド、8.4%のモロッコ、8.3%のアメリカが続いている<ref>{{Cite web|url=http://minerals.usgs.gov/minerals/pubs/commodity/barite/mcs-2012-barit.pdf|title=BARITE|publisher=[[アメリカ地質調査所]]|year=2012|accessdate=2013-01-08}}</ref>。 |
|||
バリウムは空気中で容易に酸化されるため単体の金属バリウムを得ることは困難であり自然から金属バリウムが産出することはなく、金属バリウムは主に[[重晶石]]から抽出することで生産されている<ref name="CDC"/>。採掘された重晶石は手選、[[ログウォッシャー]]を用いた洗鉱(水力によって重晶石と脈石や粘土を分離させる)、粉砕、[[比重選鉱]]など分別工程によって石英から分離される。良質の重晶石はこの工程で重晶石と脈石の分離が可能であるが、石英が鉱石に非常に深く貫入していたり、[[鉄]]や[[亜鉛]]、[[鉛]]の濃度が高い場合、あるいは「[[黒鉱]]」内の重晶石は、[[オレイン酸]]などを用いた[[浮遊選鉱|泡沫浮遊選鉱]]([[:en:Froth flotation|en]])によって[[選鉱]]される。この過程によって重晶石としての純度は質量濃度で98%まで高められ、不純物として含まれる鉄や[[二酸化ケイ素]]が除去される<ref>[[#Ullman2007|Ullman 2007]], p. 7.</ref>。この重晶石は非常に溶解し難いため、重晶石を直接的に金属バリウムや他のバリウム化合物を得るための前駆体とすることはできず、重晶石中の[[硫酸バリウム]]を[[硫化バリウム]]に還元するために[[炭素]]とともに加熱する前処理が行われる<ref name="CDC">{{cite web| title = Toxicological Profile for Barium and Barium Compounds. Agency for Toxic Substances and Disease Registry| publisher = [[Centers for Disease Control and Prevention|CDC]]| date = 2007.| url = http://www.atsdr.cdc.gov/toxprofiles/tp24.pdf|accessdate=2012-01-17}}</ref>。 |
|||
: <chem>BaSO4 + 2C -> BaS + 2CO2</chem> |
|||
こうして得られた水溶性の[[硫化バリウム]]は、その水溶液を酸素と反応させることで[[水酸化バリウム]]が、[[硝酸]]と反応させることで[[硝酸バリウム]]が、[[二酸化炭素]]と反応させることで[[炭酸バリウム]]が得られるなど、様々なバリウム化合物を生産するための前駆体となる<ref name="ullman6">[[#Ullman2007|Ullman 2007]], p. 6.</ref>。また、[[硝酸バリウム]]を熱分解させることで酸化物が得られる<ref name="ullman6"/>。金属バリウムは酸化バリウムを[[アルミニウム]]とともに1100{{℃}}で還元させることによって得られる。この反応では、はじめに金属間化合物であるBaAl<sub>4</sub>が形成される<ref name="Ullman3">[[#Ullman2007|Ullman 2007]], p. 3.</ref>。 |
|||
: <chem>3BaO + 14 Al -> 3BaAl4 + Al2O3</chem> |
|||
この金属間化合物は[[反応中間体]]であり、BaAl<sub>4</sub>と酸化バリウムが反応することで金属バリウムを与える。酸化バリウムとアルミニウムとの反応において酸化バリウムの全量が還元しきるわけではないことに注意<ref name="Ullman3"/>。 |
|||
: <chem>8BaO + BaAl4 -> Ba (^) + 7 BaAl2O4</chem> |
|||
さらに残った酸化バリウムは、先の反応で形成された酸化アルミニウムと反応する<ref name="Ullman3"/>。 |
|||
: <chem>BaO + Al2O3 -> BaAl2O4</chem> |
|||
全体的な反応は以下のようになる<ref name="Ullman3"/>。 |
|||
: <chem>4BaO + 2Al -> 3Ba (^) + BaAl2O4</chem> |
|||
こうして得られたバリウム蒸気は[[アルゴン]]雰囲気下で回収、冷却され型に詰められる。この方法は商業的に使われており、高純度で金属バリウムを得ることができる<ref name="Ullman3"/>。一般的に市販される金属バリウムの純度は99%であり、主な不純物は[[ストロンチウム]]および[[カルシウム]](最大で0.8%および0.25%)、他の不純物は0.1%よりも低い<ref name="Ullman4">[[#Ullman2007|Ullman 2007]], p. 4.</ref>。 |
|||
類似した反応として、酸化バリウムを[[ケイ素]]と1200{{℃}}で反応させることによって金属バリウムとメタケイ酸バリウムを得る方法がある<ref name="Ullman3"/>。電解法では、生成した金属バリウムがすぐに原料の溶融塩に溶解しハロゲン化物の汚染を受けやすいため利用されない<ref name="Ullman3"/>。 |
|||
== 用途 == |
|||
バリウムの最大の用途は[[油井]]やガス井を採掘するための{{仮リンク|掘穿泥水|en|Drilling fluid}}における[[加重剤]]であり、重晶石を砕いたバライト粉が利用される。 |
|||
[[File:Eosinophilic esophagitis-barium swallow.jpg|thumb|200px|造影剤として食道を造影したレントゲン写真]] |
|||
[[Image:2006 Fireworks 1.JPG|thumb|バリウムによって緑色を示す花火]] |
|||
=== 単体としての用途 === |
|||
バリウム単体の用途として最も重要なものに、テレビの[[ブラウン管]]のような[[真空管]]内に痕跡量残存した最後の酸素やその他のガスを取り除く{{仮リンク|ゲッター|en|Getter}}としての用途があったが、この用途はブラウン管を使わない液晶テレビやプラズマテレビの普及によって、姿を消しつつある<ref name="Ullman4">[[#Ullman2007|Ullman 2007]], p. 4.</ref>。他の単体バリウムとしての用途は小規模であり、アルミニウム-ケイ素合金である[[シルミン]]の結晶構造を安定化させるための添加材として用いられるように、以下のような合金への添加材としての用途が挙げられる<ref name="Ullman4"/>。 |
|||
*耐[[クリープ]]性を増加させるための鉛スズ合金(はんだ)への添加 |
|||
*接種材としての鋼鉄や鋳鉄への添加 |
|||
*高純度鋼の脱酸材としてのカルシウム、マンガン、ケイ素、アルミニウム合金への添加 |
|||
*[[自動車]]の[[点火装置]]に用いられるバリウム-[[ニッケル]]合金<ref name="Occ Safety">{{cite book | title=Encyclopaedia of Occupational Health and Safety: Chemical, industries and occupations | author=Stellman, Jeanne | year=1998 | publisher=International Labour Organization | pages=63.8 | isbn=978-92-2-109816-4}}</ref>。 |
|||
=== 硫酸バリウムとしての用途 === |
|||
[[硫酸バリウム]] (BaSO<sub>4</sub>) は重晶石を粉砕して製造されるバライト粉と、硫化バリウムと硫酸ナトリウムとの[[複分解]]によって製造される沈降性硫酸バリウムに大別される<ref name="tokkyo"/>。 |
|||
バライト粉は[[石油産業]]において重要であり、新しい[[油井]]やガス井を採掘するための{{仮リンク|掘穿泥水|en|Drilling fluid}}における[[加重剤]]として用いられる<ref name="CRC"/>。 |
|||
沈降性硫酸バリウムの英語表記である「blanc fixe」は「永久の白」を意味するフランス語に由来しており、白色塗料として利用される<ref name="Ullman9"/>。硫酸バリウムおよび[[硫酸亜鉛]]からなる白色[[顔料]]である[[リトポン]]は良好な隠蔽力を有しており、[[硫化物]]に曝されても黒変しない「永久の白」である<ref>{{cite book| page = 102| url = https://books.google.co.jp/books?id=uEJHsZWyO-EC&redir_esc=y&hl=ja| title= Medicinal applications of coordination chemistry| author = Jones, Chris J. and Thornback, John | publisher =Royal Society of Chemistry| year = 2007| isbn =0-85404-596-1}}</ref>。また、沈降性硫酸バリウムはゴルフボールなど様々なゴム製品の充填剤にも用いられる<ref name="tokkyo">{{Cite web|和書|url=http://www.jpo.go.jp/shiryou/s_sonota/hyoujun_gijutsu/golf_ball/page033.htm|title=硫酸バリウム|publisher=[[特許庁]]|accessdate=2012-04-02}}</ref>。 |
|||
硫酸バリウムのナノ粒子はポリマーの物性を改良することができ、例えばエポキシ樹脂などに用いられる<ref name="Ullman9">[[#Ullman2007|Ullman 2007]], p. 9.</ref>。 |
|||
硫酸バリウムはまた、X線を透過しないという性質を利用して[[X線写真|レントゲン]]の[[造影剤]]としても利用される({{仮リンク|バリウムがゆ|en|Barium meal}}、{{仮リンク|バリウム浣腸|en|Lower gastrointestinal series}})<ref name="CRC"/>。 |
|||
=== その他の化合物の用途 === |
|||
[[炭酸バリウム]]が[[殺鼠剤]]として用いられるようにBa<sup>2+</sup>イオンは毒性を有している<ref>{{Cite web|和書|title=SIDS 初期評価プロファイル 炭酸バリウム|url=http://www.jetoc.or.jp/safe/doc/J513-77-9.pdf|publisher=日本化学物質安全・情報センター|accessdate=2013-01-25}}</ref>。硫酸塩は水に対する溶解度が非常に低いために問題とならないが、その他のバリウム化合物の用途は特定の分野に見られるのみである。 |
|||
*[[酸化バリウム]] (BaO) は電子の放出を補助するために[[蛍光灯]]の[[電極]]に被覆される<ref>{{Cite journal|title=ランプ寿命推定法を用いた長寿命蛍光ランプの開発|author=真鍋由雄ほか|year=2010|journal=Panasonic Technical Journal|volume=56|issue=2|page=45|url=http://panasonic.co.jp/ptj/v5602/pdf/p0109.pdf}}</ref>。また、[[ディーゼルエンジン]]の[[排気ガス]]に含まれる黒煙を大幅に低減させる効果が知られている<ref>[https://www.tokyokankyo.jp/kankyoken_contents/assets/meeting/report/1972taiki12.pdf ディーゼル自動車の排気黒煙防止に関する調査研究(第2報)] - [[東京都環境公社]]</ref>。 |
|||
*[[炭酸バリウム]] (BaCO<sub>3</sub>) は[[ガラス]]の製造にも用いられる。比較的比重の高いバリウムを添加することで、ガラスの[[屈折率]]および[[光沢]]を増大させることができる<ref name="CRC"/>。 |
|||
*バリウムは[[炎色反応]]で緑色を示す性質を有するため[[花火]]に用いられる。この用途には一般的に[[硝酸バリウム]] (Ba(NO<sub>3</sub>)<sub>2</sub>) が用いられる<ref>{{cite book| page =110| url = https://books.google.co.jp/books?id=yxRyOf8jFeQC&redir_esc=y&hl=ja| title = Chemistry of Fireworks| author = Michael S. Russell, Kurt Svrcula| publisher= Royal Society of Chemistry| year = 2008| isbn = 0-85404-127-3}}</ref>。 |
|||
*[[過酸化バリウム]] (BaO<sub>2</sub>) は鉄道の線路を溶接する際の[[テルミット法|テルミット溶接]]の反応開始剤として用いられる。過酸化バリウムはまた、緑色の[[曳光弾]]や[[漂白剤]]にも用いられる<ref>{{cite journal| doi =10.1002/prep.19950200604| title =Surfactant coatings for the stabilization of barium peroxide and lead dioxide in pyrotechnic compositions| year =1995| author =Brent, G. F.| journal =Propellants Explosives Pyrotechnics| volume =20| pages =300| last2 =Harding| first2 =M. D.| issue =6}}</ref>。 |
|||
*[[チタン酸バリウム]] (BaTiO<sub>3</sub>) は強[[誘電体]]であり、[[コンデンサ]]材料などに広く利用されている<ref>{{Cite journal|url=http://www.netsu.org/j+/Jour_J/pdf/33/33-4-03.pdf|title=新規チタン酸バリウム系強誘電体|author=秋重幸邦|year=2006|journal=熱測定|volume=33|issue=4|page=160頁|publisher=日本熱測定学会|accessdate=2013-02-04}}</ref>。 |
|||
*[[フッ化バリウム]]は波長0.15から12マイクロメートルの光に対して透過性を示すため、赤外領域における光学用途に用いられる<ref>{{cite web|url=http://www.crystran.co.uk/barium-fluoride-baf2.htm |title=Crystran Ltd. Optical Component Materials |accessdate=2010-12-29}}</ref>。 |
|||
*[[クロム酸バリウム]] (BaCrO<sub>4</sub>) は、[[黄色]]の[[顔料]]であるバリウムクロメート(バリウムイエロー)として使われる<ref>{{Cite book|title=Chemistry, Society and Environment: A New History of British Chemical Industry|author=Colin A. Russell|page=164|year=2000|publisher=Royal Society of Chemistry|isbn=0854045996}}</ref>。 |
|||
*[[フェライト (磁性材料)#六方晶フェライト|バリウムフェライト]] (BaFe<sub>12</sub>O<sub>19</sub>) は[[フェライト磁石]]として使われる<ref>{{Cite journal|title=バリウムフェライト磁性体を用いた塗布型磁気記録媒体の高密度化研究|author=野口仁ほか|journal=Fujifilm Research & Development|volume=52|year=2007|page=47-50}}</ref>。 |
|||
*代表的な[[高温超伝導]]体である[[イットリウム系超伝導体]]の1成分としても用いられる<ref>{{Cite book|title=現代無機材料科学|author=足立吟也、南努|year=2007|page=182|publisher=化学同人|isbn=4759810749}}</ref>。また、そのような高温超伝導体を製造する時の[[るつぼ]]として、高温超電導体材料と反応しないジルコン酸バリウム (BaZrO<sub>3</sub>) が用いられる<ref>{{Cite web|和書|url=http://business.atengineer.com/tep/chimitu.htm|title=緻密質ファインセラミックス|publisher=ティーイーピー株式会社|accessdate=2013-01-25}}</ref>。 |
|||
== 危険性 == |
|||
可溶性のバリウム化合物は有毒である。少量のバリウムは筋興奮薬として働くが、多量のバリウムは[[神経系]]に影響をおよぼし、[[不整脈]]や震え、筋力低下、[[不安]]、[[呼吸困難]]、[[麻痺]]などを引き起こす。これは、神経系が適切に機能するために極めて重要な[[カリウムチャネル]]をバリウムが阻害することによる<ref>{{cite book |pages = 77–78| isbn = 0070494398 | url = https://books.google.co.jp/books?id=Xqj-TTzkvTEC&pg=PA243&redir_esc=y&hl=ja |title = Handbook of inorganic chemicals |author1 = Patnaik, Pradyot |year = 2003}}</ref>。また、バリウム化合物を含む粉塵を吸入した場合には肺で蓄積されて{{仮リンク|バリウム症|en|baritosis}}と呼ばれる良性塵肺症を引き起こす<ref name="pmid1257935">{{cite journal |author=Doig AT |title=Baritosis: a benign pneumoconiosis |journal=Thorax |volume=31 |issue=1 |pages=30–9 |year=1976 |month=February |pmid=1257935 |pmc=470358 |doi= 10.1136/thx.31.1.30|url=}}</ref><ref>{{Cite web|和書|url=http://merckmanual.jp/mmhe2j/sec04/ch049/ch049i.html|title=良性塵肺症|publisher=メルクマニュアル|accessdate=2012-01-18}}</ref>。しかし、[[硫酸バリウム]]は水や[[胃酸]]に対してほとんど溶解しないため経口摂取することが可能である。 |
|||
他の重金属とは異なり一般にバリウムは[[生物濃縮]]しないとされているが<ref>{{cite web| url = http://www.epa.gov/region5superfund/ecology/toxprofiles.htm#ba| date = 2009-06-06| title = Toxicity Profiles, Ecological Risk Assessment|publisher = US EPA|accessdate=2012-01-17}}</ref><ref>{{cite book| author = Moore, J. W.|year =1991| title = Inorganic Contaminants of Surface Waters, Research and Monitoring Priorities| publisher = Springer-Verlag| location= New York}}</ref>、トマトや大豆など一部の植物における生物濃縮の報告もされている<ref name="NIHS">{{Cite web|和書|url=https://www.nihs.go.jp/hse/ehc/sum1/ehc107.html|title=環境保健クライテリア 107 バリウム|publisher=国立医薬品食品衛生研究所|accessdate=2013-01-27}}</ref>。環境中のバリウムはウイルスや細菌、微生物などに対して影響を与え、[[ミジンコ]]に対する生殖障害などが報告されている<ref name="NIHS"/>。 |
|||
このような毒性のため、日本では[[毒物及び劇物取締法]]第二条七十九により[[硫酸バリウム]]およびバリウム=4-(5-クロロ-4-メチル-2-スルホナトフエニルアゾ)-3-ヒドロキシ-2-ナフトアート以外のバリウム化合物は[[劇物]]に指定されている<ref>{{Cite web|和書|title=毒物及び劇物指定令(昭和40年政令第2号)|url=https://laws.e-gov.go.jp/law/340CO0000000002|website=e-Gov法令検索|date=2019-06-19|accessdate=2020-01-09|publisher=総務省行政管理局}}</ref>。[[特定化学物質の環境への排出量の把握等及び管理の改善の促進に関する法律|PRTR法]]では、バリウム及びその水溶性化合物が第一種指定化学物質として指定されていたが、2008年の政令改正により指定が解除された<ref>{{Cite web|和書|url=https://www.meti.go.jp/policy/chemical_management/law/pdf/100401pf.pdf|page=26|title=化学物質を取り扱う事業者の方へ|publisher=経済産業省|accessdate=2013-01-27}}</ref>。また、EUでは地下水の保全に関する指令によってバリウムの排出には検査と許可が求められており、中国やマレーシア、タイ、シンガポールにおいてもバリウムの排水基準値や水質基準値が定められているが、日本においてはバリウムの排出に関するそのような基準は定められていない<ref>{{Cite web|和書|url=http://www.meti.go.jp/meti_lib/report/2011fy/E001477.pdf|title=海外の環境規制・環境産業の動向に関する調査報告書|publisher=三菱総合研究所|accessdate=2013-01-27}}</ref><ref>{{Cite web|和書|url=http://www.dowa-ecoj.jp/kaigai/singapore/singapore_04.html|title=シンガポールの排水基準について|publisher=DOWAエコジャーナル|accessdate=2013-01-27}}</ref>。欧州においては他にも、欧州玩具安全規格 EN71 part3における子供向け玩具のバリウムの溶出に関する規制が行われている<ref>{{Cite web|和書|url=http://www.shimadzu-techno.co.jp/technical/en71-part3.html|title=グリーン調達 欧州規格EN71-Part3に基づく玩具の溶出試験|publisher=島津テクノリサーチ|accessdate=2013-01-26}}</ref>。 |
|||
== 脚注 == |
|||
{{脚注ヘルプ}} |
|||
=== 注釈 === |
|||
{{Notelist}} |
|||
=== 出典 === |
|||
{{Reflist|30em}} |
|||
== 参考文献 == |
== 参考文献 == |
||
* {{Cite book|和書|author=加藤虎郎|year=1932|title=標準定量分析法|publisher=[[丸善]]|ref=katou1932}} |
|||
{{Reflist}} |
|||
* {{cite book|和書|author=F.A. コットン, G. ウィルキンソン|others=中原 勝儼|title=コットン・ウィルキンソン無機化学(上)|publisher=培風館|year=1987|edition=原書第4版|isbn=4563041920|ref=CW1987}} |
|||
* {{Cite book|和書|author=G. シャルロー|others=曽根興二、田中元治 訳|title=定性分析化学II ―溶液中の化学反応|year=1974|edithion=改訂版|publisher=[[共立出版]]|ref=charlot1974}} |
|||
* {{Cite book|和書|author=千谷利三|year=1959|title=新版 無機化学(上巻)|publisher=産業図書|ref=千谷1959}} |
|||
*{{cite book|author=Kresse, Robert; Baudis, Ulrich; Jäger, Paul; Riechers, H. Hermann; Wagner, Heinz; Winkler, Jocher; Wolf, Hans Uwe|chapter=Barium and Barium Compounds|editor=Ullman, Franz|title=Ullmann's Encyclopedia of Industrial Chemistry|year=2007|publisher=Wiley-VCH|doi=10.1002/14356007.a03_325.pub2|ref=Ullman2007}} |
|||
*{{Cite book|title = Ullman's Encyclopedia of Industrial Chemistry|year = 1985|volume = A3|chapter = Barium and Barium Compounds|author=Kresse, Robert; Baudis, Ulrich; Jäger, Paul; Riechers, H. Hermann; Wagner, Heinz; Winkler, Jocher; Wolf, Hans Uwe|editor = Wolfgang Gerhartz|edition = 5th|publisher = Wiley-VCH|isbn = 3527201041|ref = Kresseetc}} |
|||
*{{cite book|last = Lide |first= D. R.|title = CRC Handbook of Chemistry and Physics|edition = 84th|location = Boca Raton (FL)|publisher = CRC Press|year = 2004|isbn = 978-0-8493-0484-2| ref = Lide2004}} |
|||
== 関連項目 == |
== 関連項目 == |
||
| 143行目: | 298行目: | ||
{{元素周期表}} |
{{元素周期表}} |
||
{{バリウムの化合物}} |
{{バリウムの化合物}} |
||
{{Good article}} |
|||
{{Normdaten}} |
|||
{{DEFAULTSORT:はりうむ}} |
{{DEFAULTSORT:はりうむ}} |
||
[[Category:バリウム|*]] |
[[Category:バリウム|*]] |
||
[[Category:元素]] |
|||
[[Category:アルカリ土類金属]] |
|||
{{Link FA|de}} |
|||
[[Category:第6周期元素]] |
|||
[[af:Barium]] |
|||
[[an:Bario]] |
|||
[[ar:باريوم]] |
|||
[[az:Barium]] |
|||
[[be:Барый]] |
|||
[[be-x-old:Бар (элемэнт)]] |
|||
[[bg:Барий]] |
|||
[[bn:বেরিয়াম]] |
|||
[[bs:Barijum]] |
|||
[[ca:Bari (element)]] |
|||
[[co:Bariu]] |
|||
[[cs:Baryum]] |
|||
[[cv:Бари (элемент)]] |
|||
[[cy:Bariwm]] |
|||
[[da:Barium]] |
|||
[[de:Barium]] |
|||
[[el:Βάριο]] |
|||
[[en:Barium]] |
|||
[[eo:Bario]] |
|||
[[es:Bario]] |
|||
[[et:Baarium]] |
|||
[[eu:Bario]] |
|||
[[fa:باریم]] |
|||
[[fi:Barium]] |
|||
[[fr:Baryum]] |
|||
[[fur:Bari]] |
|||
[[ga:Bairiam]] |
|||
[[gl:Bario]] |
|||
[[gv:Baarium]] |
|||
[[hak:Pi]] |
|||
[[he:בריום]] |
|||
[[hi:बेरियम]] |
|||
[[hif:Barium]] |
|||
[[hr:Barij]] |
|||
[[ht:Baryòm]] |
|||
[[hu:Bárium]] |
|||
[[hy:Բարիում]] |
|||
[[ia:Barium]] |
|||
[[id:Barium]] |
|||
[[io:Bario]] |
|||
[[is:Barín]] |
|||
[[it:Bario]] |
|||
[[jbo:tijyjinme]] |
|||
[[jv:Barium]] |
|||
[[ka:ბარიუმი]] |
|||
[[kk:Барий]] |
|||
[[kn:ಬೇರಿಯಮ್]] |
|||
[[ko:바륨]] |
|||
[[ku:Baryûm]] |
|||
[[kv:Барий]] |
|||
[[la:Barium (elementum)]] |
|||
[[lb:Barium]] |
|||
[[lij:Bario]] |
|||
[[lt:Baris]] |
|||
[[lv:Bārijs]] |
|||
[[mi:Konu-okehu]] |
|||
[[ml:ബേരിയം]] |
|||
[[mn:Бари]] |
|||
[[mr:बेरियम]] |
|||
[[mrj:Барий]] |
|||
[[ms:Barium]] |
|||
[[my:ဘေရီယမ်]] |
|||
[[nds:Barium]] |
|||
[[nl:Barium]] |
|||
[[nn:Barium]] |
|||
[[no:Barium]] |
|||
[[oc:Bari (element)]] |
|||
[[pl:Bar (pierwiastek)]] |
|||
[[pnb:بیریم]] |
|||
[[pt:Bário]] |
|||
[[qu:Baryu]] |
|||
[[ro:Bariu]] |
|||
[[ru:Барий]] |
|||
[[sah:Бариум]] |
|||
[[scn:Bariu]] |
|||
[[sh:Barijum]] |
|||
[[simple:Barium]] |
|||
[[sk:Bárium]] |
|||
[[sl:Barij]] |
|||
[[sr:Баријум]] |
|||
[[stq:Barium]] |
|||
[[sv:Barium]] |
|||
[[sw:Bari]] |
|||
[[ta:பேரியம்]] |
|||
[[th:แบเรียม]] |
|||
[[tl:Baryo (elemento)]] |
|||
[[tr:Baryum]] |
|||
[[ug:بارىي]] |
|||
[[uk:Барій]] |
|||
[[ur:بیریئم]] |
|||
[[vi:Bari]] |
|||
[[war:Baryo (elemento)]] |
|||
[[xal:Бариум]] |
|||
[[yi:באריום]] |
|||
[[yo:Barium]] |
|||
[[zh:钡]] |
|||
[[zh-yue:鋇]] |
|||
2024年12月18日 (水) 22:49時点における最新版
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外見 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
銀白色
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 一般特性 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称, 記号, 番号 | バリウム, Ba, 56 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分類 | アルカリ土類金属 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族, 周期, ブロック | 2, 6, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子量 | 137.33 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子配置 | [Xe] 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子殻 | 2, 8, 18, 18, 8, 2(画像) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理特性 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 相 | 固体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度(室温付近) | 3.51 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 融点での液体密度 | 3.338 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 融点 | 999.4 K, 726.2 °C, 1339.2 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 1910 K, 1637 °C, 2979 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 融解熱 | 7.12 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 蒸発熱 | 140.3 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱容量 | (25 °C) 28.07 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 蒸気圧 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子特性 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 酸化数 | 2 (強塩基性酸化物) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電気陰性度 | 0.89(ポーリングの値) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| イオン化エネルギー | 第1: 502.9 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 第2: 965.2 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 第3: 3600 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 222 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共有結合半径 | 215 ± 11 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ファンデルワールス半径 | 268 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| その他 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 結晶構造 | 体心立方 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁性 | 常磁性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電気抵抗率 | (20 °C) 332 nΩ⋅m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱伝導率 | (300 K) 18.4 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱膨張率 | (25 °C) 20.6 μm/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 音の伝わる速さ (微細ロッド) |
(20 °C) 1620 m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ヤング率 | 13 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剛性率 | 4.9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 体積弾性率 | 9.6 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| モース硬度 | 1.25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS登録番号 | 7440-39-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 主な同位体 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細はバリウムの同位体を参照 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
バリウム(英: barium [ˈbɛəriəm])は、原子番号 56 の元素。元素記号は Ba。アルカリ土類金属のひとつ。
名称
[編集]アルカリ土類金属としては密度が大きく重いため、ギリシャ語で「重い」を意味する βαρύς (barys) にちなんで命名された。ただし、金属バリウムの比重は約3.5であるため軽金属に分類される。
性質
[編集]単体では銀白色の軟らかい金属。他のアルカリ土類金属元素と類似した性質を示すが、カルシウムやストロンチウムと比べ反応性は高い。化学的性質としては+2価の希土類イオンとも類似した性質を示す。
バリウム塩には毒性があり、摂取するとカリウムチャネルをバリウムイオンが阻害することによって神経系への影響が生じる。そのためバリウム塩(バリウム化合物)は毒物及び劇物取締法(指定令)において劇物に指定されている(金属のバリウムは指定されていない、硫酸バリウムなど指定されない物質もある)。
物理的性質
[編集]バリウムは鉛と同程度に柔らかく銀白色の外観を有するアルカリ土類金属である。金属光沢を有しているが、空気中では徐々に酸化されて白色の酸化被膜に覆われるため金属光沢は失われる[1]。融点および沸点は資料により異なるデータがみられ、融点は729 °C[2]や725 °C[3][4]、726.2 °C[5]というデータがあり、沸点は1898 °C(1気圧)[2]、1640 °C[3]、1637 °C(1気圧)[5]というデータがある。密度が3.51 g/cm3と低いため軽金属に分類される[1]。常温、常圧で安定な結晶構造は体心立方構造 (BCC) であり、その格子定数aは5.01である[6]。
炎色反応においてバリウムは黄緑色の炎色を呈する[7]。主要な輝線は524.2 nmおよび513.7 nmの緑色のスペクトル線であり、それらは双子線を示すアルカリ金属元素の輝線とは対照的に単線を示す[6]。
化学的性質
[編集]| O2- | S2- | F- | Cl- | SO42- | CO32- | O22- | H- | |
|---|---|---|---|---|---|---|---|---|
| Ca2+[8] | 3.34 | 2.59 | 3.18 | 2.15 | 2.96 | 2.83 | 2.9 | 1.7 |
| Sr2+[9] | 5.1 | 3.7 | 4.24 | 3.05 | 3.96 | 3.5 | 4.78 | 3.26 |
| Ba2+[10] | 5.72 | 4.3 | 2.1 | 1.9 | 4.49 | 4.29 | 4.96 | 4.16 |
| Zn2+[11] | 5.6 | 4.09 | 4.9 | 2.09 | 3.8 | 4.4 | 1.57 | — |
バリウムの化学的性質はカルシウムやストロンチウムに類似しているものの、アルカリ土類金属元素の電気陰性度は原子番号が大きくなるにつれて小さくなる傾向があるため、バリウムはカルシウムやストロンチウムよりもさらに反応性が高い[12]。このアルカリ土類金属元素の持つ性質の連続的な変化によって、バリウムの塩は他のアルカリ土類金属の塩と比較して水和物を形成しやすく、水に対する溶解度が低く、熱的安定性が優れているという性質を有している[13]。2価のバリウムイオンの化学的性質はユウロピウムやサマリウム、イッテルビウムイオンなど2価の希土類イオンと類似しており、バリウム鉱石中にこれらの元素が含まれていることがある[14]。バリウムイオンは可視領域にスペクトルを持たないためバリウム化合物は全て無色であり、バリウム化合物の着色はアニオン側の持つ色や構造の欠陥に起因して生じたものである[15]。
バリウムの電溶圧は水素よりも大きいため水と激しく反応して水素を発生させ、アルコールとも同様に激しく反応する[16]。
バリウムは空気中で徐々に酸化されて白色の酸化バリウムを形成し、この酸化物もまた水と激しく反応して水酸化バリウムとなる。水酸化バリウムはアルカリ土類金属の水酸化物の中では水に対する溶解度が高く強塩基性である[17]。バリウムは高温で炭素と直接反応してイオン性アセチリドである炭化バリウムを生成する。この炭化物は加水分解によってアセチレンを発生させる。また、ホウ素、ケイ素、ヒ素、硫黄などとも直接反応してイオン性の化合物を形成するが、これらの化合物もまた容易に加水分解を受ける。オキソ酸とも反応して硫酸バリウムや硝酸バリウムのような化合物を形成し、それらの化合物は水に対する溶解性が低い[18]。
バリウムの過塩素酸塩はジエチレントリアミンによって錯体を形成するが、安定に存在できるのは固体常態のみであり溶液中では容易に解離する[19]。また、クラウンエーテルとも錯体を形成する[20]。バリウムは液体アンモニアに溶解して青色の溶液となり、ここからアンモニアを除去することでバリウムのアンミン錯体を得ることができる[15]。
バリウムはアルミニウム、亜鉛、鉛およびスズを含むいくつかの金属と結合し、合金および金属間化合物を形成する[21]。
同位体
[編集]自然より産出するバリウムは七つの同位体の混合物であり、天然存在比が最大のものは138Baの71.7%である。バリウムは40の同位体が知られているが、それらのほとんどは半減期が数ミリ秒から数日の高い放射能を持つ放射性同位体である。例外として、10.51年という比較的長い半減期を持つ133Baがある[22]。133Baは原子物理学の研究におけるガンマ線探知機などにおいて校正用の標準線源として用いられる[23]。
分析
[編集]定性分析
[編集]バリウムを含む溶液に硫酸を加えると不溶性の硫酸バリウムが白色沈殿として生じるため、これをもって簡易な定性分析を行うことができる。しかしこの方法では、同族元素であるカルシウムもしくはストロンチウムが含まれているとバリウムと同様に硫酸塩の沈殿が生じ、鉛イオンもまた同様に硫酸鉛の白色沈殿を生じさせて定性分析の妨害となる[24]。
バリウムの定性分析法としては、酢酸緩衝液下でクロム酸バリウムの黄色沈殿を生じさせる方法が用いられる。この際、マスキング剤としてエチレンジアミン四酢酸 (EDTA) と塩化マグネシウムを加えることで他の元素がEDTAと錯体を形成するため、バリウム以外の元素が水酸化物として沈殿して妨害するのを抑止することができる[25]。
バリウムは炎色反応においてうすい緑色を呈するが、銅やマンガン、テルル、ビスマスなど多くの元素が類似の炎色を示すため定性分析としては利用し難い[26]。
定量分析
[編集]溶液中のバリウム濃度の定量分析法として、硫酸バリウムもしくはクロム酸バリウムの形でバリウムを沈殿させてその重量を測定する重量法が挙げられる[27]。硫酸バリウムを用いた場合には、ストロンチウが不純物として含まれているとストロンチウムの分も分析値に上乗せされるため、原子吸光法などによってストロンチウムの含有量を別途測定して分析値から差し引く必要がある[28]。また、このようにして得られたクロム酸バリウムを硫酸酸性溶液に溶解させ、規定量の硫酸鉄(II)溶液を加えたのちに過剰量の硫酸鉄(II)を過マンガン酸カリウム溶液で逆滴定する容量分析法によっても定量分析することもできる。これは、クロム酸の作用で硫酸鉄(II)が酸化される反応を利用したものであり、クロム酸の逆滴定と同一の方法である[29]。バリウム溶液中に、アンモニア性塩化アンモニウム緩衝溶液およびマグネシウム溶液を加え、エリオクロムブラックTを指示薬としてEDTA溶液でキレート滴定する方法も用いられるが、この方法においても硫酸バリウムを用いた重量法と同様にストロンチウムの分析値を差し引く必要がある。EDTAによるキレート滴定法は日本工業規格におけるバリウムの定量分析法の一つとして採用されている[28]。
機器分析法としては、フレームレス原子吸光法 (AAS) やICP-AES、ICP-MSが利用され、AASの吸収波長は553.6 nm、ICP-AESの発光波長は233.527 nmおよび455.403 nmが用いられる[30]。
歴史
[編集]
バリウムの名称は、ギリシャ語で「重い」を意味するβαρύς (barys) に由来しており、それは一般的なバリウムを含む鉱石が高密度であることを表している。中世初期の錬金術師たちはいくつかのバリウム鉱石を知っており、イタリアのボローニャで見つけられた滑らかな小石様の重晶石鉱石は「ボローニャの石」として知られていた[31]。その石に光を照射するとその後輝き続ける(つまり蛍光を示す)ことから、魔女や錬金術師たちはこの石に魅力を感じていた[32]。ボローニャ石の発光は、主成分である重晶石(硫酸バリウム;BaSO4)に起因すると考えられていたが、Cu+/2+ドープBaSによるものだと明らかになっている[33]。
1774年、スウェーデンのカール・ヴィルヘルム・シェーレが軟マンガン鉱に新しい元素が含まれていることを発見したが、その鉱石からバリウムを分離することはできなかった。ヨハン・ゴットリーブ・ガーンもまた類似した研究を行い、シェーレによるバリウムの発見から二年後に酸化バリウムとして鉱石から分離することに成功した。酸化バリウムは初めルイ=ベルナール・ギュイトン・ド・モルヴォーによってbaroteと呼ばれており、アントワーヌ・ラヴォアジエによってバリタ (baryta) と改名された。また、18世紀にはイギリスの鉱物学者であるウィリアム・ウィザリングもカンバーランドの鉛鉱山で産出する重い鉱石(炭酸バリウムの鉱石である毒重石)について言及していた。1808年、イギリスのハンフリー・デービーがバリウム塩の溶融塩電解によってバリウムの単体を初めて単離した[34]。デービーは類似した性質を示すカルシウムの命名法に準じて[注釈 1]、酸化バリウムを表すバリタ (baryta) の後ろに金属元素を意味する接尾語である「-ium」を付けてバリウム (barium) 名付けた[32]。ロベルト・ブンゼンおよびアウグストゥス・マーティセンは、塩化バリウムと塩化アンモニウムの混合物を溶融させて電気分解を行うことによって純粋なバリウムを得た[36][37]。
電気分解および液体空気の分留が有意な酸素の生産方法として確立される以前は、過酸化バリウムを用いて純粋な酸素を生産するブリン法がバリウムの大規模な用途であった。これは、酸化バリウムを空気中で500から600度で熱して過酸化バリウムとし、この過酸化バリウムを700℃以上で熱することによって純粋な酸素を得るという方法である[38][39]。
1908年には、消化器系のX線写真で造影剤として初めて利用された[40]。
存在
[編集]地殻における存在量は豊富であり、重晶石(硫酸バリウム)などの鉱石として産出する。確認埋蔵量の48.6%を中国が占めており、生産量も50%以上が中国によるものである。
バリウムの宇宙全体の平均濃度の推定値は重量濃度で10 ppb、太陽における推定濃度も10 ppbである[41]。地殻においては比較的豊富に存在しており、その存在量は4.25 × 102 mg/kgである。また、海水中には1.3 × 10-2 mg/L含まれる[42]。地殻中において重晶石(硫酸塩)や毒重石(炭酸塩)のような鉱物として存在している[43]。毒重石の鉱石は、例えば北イングランドのニューボロー近辺のセッティングストーンズ鉱山[44]などにおいて17世紀から1969年までの間採掘されてきたが[45]、現在はほとんど全てのバリウムは重晶石として採掘されている。アメリカ地質調査所の2005年版Mineral Commodity Summariesを元にした東北経済産業局の報告書によれば、バリウムの確認埋蔵量は重晶石ベースで7.4億トン、可産鉱量は2.0億トンであると見積もられており、可産年数は29年とされている[46]。重晶石の大きな鉱床は中華人民共和国、ドイツ、インド、モロッコおよびアメリカ合衆国で発見されており[47]、確認埋蔵量の48.6%を中国が占めている[46]。毒重石の鉱床としてはイギリス、ルーマニア、旧ソビエト連邦などに見られるが、それらは商業的に重要ではない[43]。バリウムを含む宝石としては濃い青色を示すベニト石(ベニトアイト)があり、カリフォルニア州のサン・ベニトで産出する[48]。
生産
[編集]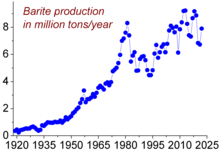

バリウム(重晶石)の年間生産量のピークは1981年の830万トンであり、そのうち7-8%だけが金属バリウムやその化合物の生産に利用された[43]。これは、バリウムの最大の用途が掘穿泥水における加重剤としての用途であり、この目的には重晶石をそのまま粉砕して硫酸バリウムとして利用するためである[49]。シェールガスの採掘増加に伴う掘穿泥水の需要増によって、2016年にはピーク時の生産量を越える930万トンにまで需要が拡大するものと予想されている[50]。2011年におけるバリウム生産量はその50%以上を中国が占めており、それに14%のインド、8.4%のモロッコ、8.3%のアメリカが続いている[51]。
バリウムは空気中で容易に酸化されるため単体の金属バリウムを得ることは困難であり自然から金属バリウムが産出することはなく、金属バリウムは主に重晶石から抽出することで生産されている[52]。採掘された重晶石は手選、ログウォッシャーを用いた洗鉱(水力によって重晶石と脈石や粘土を分離させる)、粉砕、比重選鉱など分別工程によって石英から分離される。良質の重晶石はこの工程で重晶石と脈石の分離が可能であるが、石英が鉱石に非常に深く貫入していたり、鉄や亜鉛、鉛の濃度が高い場合、あるいは「黒鉱」内の重晶石は、オレイン酸などを用いた泡沫浮遊選鉱(en)によって選鉱される。この過程によって重晶石としての純度は質量濃度で98%まで高められ、不純物として含まれる鉄や二酸化ケイ素が除去される[53]。この重晶石は非常に溶解し難いため、重晶石を直接的に金属バリウムや他のバリウム化合物を得るための前駆体とすることはできず、重晶石中の硫酸バリウムを硫化バリウムに還元するために炭素とともに加熱する前処理が行われる[52]。
こうして得られた水溶性の硫化バリウムは、その水溶液を酸素と反応させることで水酸化バリウムが、硝酸と反応させることで硝酸バリウムが、二酸化炭素と反応させることで炭酸バリウムが得られるなど、様々なバリウム化合物を生産するための前駆体となる[54]。また、硝酸バリウムを熱分解させることで酸化物が得られる[54]。金属バリウムは酸化バリウムをアルミニウムとともに1100°Cで還元させることによって得られる。この反応では、はじめに金属間化合物であるBaAl4が形成される[55]。
この金属間化合物は反応中間体であり、BaAl4と酸化バリウムが反応することで金属バリウムを与える。酸化バリウムとアルミニウムとの反応において酸化バリウムの全量が還元しきるわけではないことに注意[55]。
さらに残った酸化バリウムは、先の反応で形成された酸化アルミニウムと反応する[55]。
全体的な反応は以下のようになる[55]。
こうして得られたバリウム蒸気はアルゴン雰囲気下で回収、冷却され型に詰められる。この方法は商業的に使われており、高純度で金属バリウムを得ることができる[55]。一般的に市販される金属バリウムの純度は99%であり、主な不純物はストロンチウムおよびカルシウム(最大で0.8%および0.25%)、他の不純物は0.1%よりも低い[56]。
類似した反応として、酸化バリウムをケイ素と1200°Cで反応させることによって金属バリウムとメタケイ酸バリウムを得る方法がある[55]。電解法では、生成した金属バリウムがすぐに原料の溶融塩に溶解しハロゲン化物の汚染を受けやすいため利用されない[55]。
用途
[編集]バリウムの最大の用途は油井やガス井を採掘するための掘穿泥水における加重剤であり、重晶石を砕いたバライト粉が利用される。


単体としての用途
[編集]バリウム単体の用途として最も重要なものに、テレビのブラウン管のような真空管内に痕跡量残存した最後の酸素やその他のガスを取り除くゲッターとしての用途があったが、この用途はブラウン管を使わない液晶テレビやプラズマテレビの普及によって、姿を消しつつある[56]。他の単体バリウムとしての用途は小規模であり、アルミニウム-ケイ素合金であるシルミンの結晶構造を安定化させるための添加材として用いられるように、以下のような合金への添加材としての用途が挙げられる[56]。
- 耐クリープ性を増加させるための鉛スズ合金(はんだ)への添加
- 接種材としての鋼鉄や鋳鉄への添加
- 高純度鋼の脱酸材としてのカルシウム、マンガン、ケイ素、アルミニウム合金への添加
- 自動車の点火装置に用いられるバリウム-ニッケル合金[57]。
硫酸バリウムとしての用途
[編集]硫酸バリウム (BaSO4) は重晶石を粉砕して製造されるバライト粉と、硫化バリウムと硫酸ナトリウムとの複分解によって製造される沈降性硫酸バリウムに大別される[58]。
バライト粉は石油産業において重要であり、新しい油井やガス井を採掘するための掘穿泥水における加重剤として用いられる[47]。
沈降性硫酸バリウムの英語表記である「blanc fixe」は「永久の白」を意味するフランス語に由来しており、白色塗料として利用される[59]。硫酸バリウムおよび硫酸亜鉛からなる白色顔料であるリトポンは良好な隠蔽力を有しており、硫化物に曝されても黒変しない「永久の白」である[60]。また、沈降性硫酸バリウムはゴルフボールなど様々なゴム製品の充填剤にも用いられる[58]。 硫酸バリウムのナノ粒子はポリマーの物性を改良することができ、例えばエポキシ樹脂などに用いられる[59]。
硫酸バリウムはまた、X線を透過しないという性質を利用してレントゲンの造影剤としても利用される(バリウムがゆ、バリウム浣腸)[47]。
その他の化合物の用途
[編集]炭酸バリウムが殺鼠剤として用いられるようにBa2+イオンは毒性を有している[61]。硫酸塩は水に対する溶解度が非常に低いために問題とならないが、その他のバリウム化合物の用途は特定の分野に見られるのみである。
- 酸化バリウム (BaO) は電子の放出を補助するために蛍光灯の電極に被覆される[62]。また、ディーゼルエンジンの排気ガスに含まれる黒煙を大幅に低減させる効果が知られている[63]。
- 炭酸バリウム (BaCO3) はガラスの製造にも用いられる。比較的比重の高いバリウムを添加することで、ガラスの屈折率および光沢を増大させることができる[47]。
- バリウムは炎色反応で緑色を示す性質を有するため花火に用いられる。この用途には一般的に硝酸バリウム (Ba(NO3)2) が用いられる[64]。
- 過酸化バリウム (BaO2) は鉄道の線路を溶接する際のテルミット溶接の反応開始剤として用いられる。過酸化バリウムはまた、緑色の曳光弾や漂白剤にも用いられる[65]。
- チタン酸バリウム (BaTiO3) は強誘電体であり、コンデンサ材料などに広く利用されている[66]。
- フッ化バリウムは波長0.15から12マイクロメートルの光に対して透過性を示すため、赤外領域における光学用途に用いられる[67]。
- クロム酸バリウム (BaCrO4) は、黄色の顔料であるバリウムクロメート(バリウムイエロー)として使われる[68]。
- バリウムフェライト (BaFe12O19) はフェライト磁石として使われる[69]。
- 代表的な高温超伝導体であるイットリウム系超伝導体の1成分としても用いられる[70]。また、そのような高温超伝導体を製造する時のるつぼとして、高温超電導体材料と反応しないジルコン酸バリウム (BaZrO3) が用いられる[71]。
危険性
[編集]可溶性のバリウム化合物は有毒である。少量のバリウムは筋興奮薬として働くが、多量のバリウムは神経系に影響をおよぼし、不整脈や震え、筋力低下、不安、呼吸困難、麻痺などを引き起こす。これは、神経系が適切に機能するために極めて重要なカリウムチャネルをバリウムが阻害することによる[72]。また、バリウム化合物を含む粉塵を吸入した場合には肺で蓄積されてバリウム症と呼ばれる良性塵肺症を引き起こす[73][74]。しかし、硫酸バリウムは水や胃酸に対してほとんど溶解しないため経口摂取することが可能である。
他の重金属とは異なり一般にバリウムは生物濃縮しないとされているが[75][76]、トマトや大豆など一部の植物における生物濃縮の報告もされている[77]。環境中のバリウムはウイルスや細菌、微生物などに対して影響を与え、ミジンコに対する生殖障害などが報告されている[77]。
このような毒性のため、日本では毒物及び劇物取締法第二条七十九により硫酸バリウムおよびバリウム=4-(5-クロロ-4-メチル-2-スルホナトフエニルアゾ)-3-ヒドロキシ-2-ナフトアート以外のバリウム化合物は劇物に指定されている[78]。PRTR法では、バリウム及びその水溶性化合物が第一種指定化学物質として指定されていたが、2008年の政令改正により指定が解除された[79]。また、EUでは地下水の保全に関する指令によってバリウムの排出には検査と許可が求められており、中国やマレーシア、タイ、シンガポールにおいてもバリウムの排水基準値や水質基準値が定められているが、日本においてはバリウムの排出に関するそのような基準は定められていない[80][81]。欧州においては他にも、欧州玩具安全規格 EN71 part3における子供向け玩具のバリウムの溶出に関する規制が行われている[82]。
脚注
[編集]注釈
[編集]出典
[編集]- ^ a b 千谷 (1959) 193頁。
- ^ a b 国立天文台 編, 『理科年表 第79冊』, p367 & 391, 丸善, 2005.
- ^ a b 国際化学物質安全性カード バリウム ICSC番号:1052 (日本語版), 国立医薬品食品衛生研究所 2013年1月30日閲覧。
- ^ コットン、ウィルキンソン (1987) 266頁。
- ^ a b #Kresse et al. (1985) p. 326
- ^ a b 千谷 (1959) 199頁。
- ^ 千谷 (1959) 198頁。
- ^ Lide (2004) p.4-48-50
- ^ Lide (2004) p.4-86-88
- ^ Lide (2004) p.4-43-45
- ^ Lide (2004) p.4-95-96
- ^ 千谷 (1959) 194頁。
- ^ コットン、ウィルキンソン (1987) 267頁。
- ^ コットン、ウィルキンソン (1987) 268頁。
- ^ a b コットン、ウィルキンソン (1987) 277頁。
- ^ 千谷 (1959) 195頁。
- ^ 千谷 (1959) 196頁。
- ^ コットン、ウィルキンソン (1987) 278頁。
- ^ コットン、ウィルキンソン (1987) 279頁。
- ^ コットン、ウィルキンソン (1987) 281頁。
- ^ Ferro, Riccardo and Saccone, Adriana (2008). Intermetallic Chemistry. Elsevier. p. 355. ISBN 978-0-08-044099-6
- ^ David R. Lide, Norman E. Holden (2005), “Section 11, Table of the Isotopes”, CRC Handbook of Chemistry and Physics, 85th Edition, Boca Raton, Florida: CRC Press
- ^ “標準線源 (09-04-03-02)”. 高度情報科学技術研究機構 原子力百科事典. 2012年1月15日閲覧。
- ^ シャルロー (1974) 279-280頁。
- ^ シャルロー (1974) 281-282頁。
- ^ シャルロー (1974) 282, 595頁。
- ^ 加藤 (1932) 89-90頁。
- ^ a b 日本工業規格 JIS K 1414-1992, JIS K 1416-1992など
- ^ 加藤 (1932) 90-91頁。
- ^ 厚生労働省健康局水道課. “水道用薬品類の評価のための試験方法ガイドライン”. 厚生労働省. pp. 20-21, 24-25. 2012年3月10日閲覧。
- ^ ゲーテの『若きウェルテルの悩み』にも「ボロニア石」として出てくる。ロラン・バルトは『恋愛のディスクール・断章』でボローニャの石からウェルテルを論じている。
- ^ a b Robert E. Krebs (2006), The history and use of our earth's chemical elements: a reference guide, Greenwood Publishing Group, p. 80, ISBN 0313334382
- ^ Katharina M. Fromm「輝ける重い元素バリウム」『Nature Chemistry』第5巻第149号、Nature、2013年、doi:10.1038/nchem.1551。
- ^ Davy, H. (1808) "Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia," Philosophical Transactions of the Royal Society of London, vol. 98, pages 333-370.
- ^ 村上雅人『元素を知る事典: 先端材料への入門』海鳴社、2004年、102頁。ISBN 487525220X。
- ^ “Masthead”, Annalen der Chemie und Pharmacie 93 (3): fmi–fmi, (1855), doi:10.1002/jlac.18550930301
- ^ Wagner, Rud.; Neubauer, C.; Deville, H. Sainte-Claire; Sorel; Wagenmann, L.; Techniker; Girard, Aimé (1856), “Notizen”, Journal für Praktische Chemie 67: 490–508, doi:10.1002/prac.18560670194
- ^ Jensen, William B. (2009), “The Origin of the Brin Process for the Manufacture of Oxygen”, Journal of Chemical Education 86 (11): 1266, Bibcode: 2009JChEd..86.1266J, doi:10.1021/ed086p1266
- ^ Ihde, Aaron John (1984-04-01), The development of modern chemistry, p. 681, ISBN 9780486642352
- ^ Schott, G. D. (1974). “Some Observations on the History of the Use of Barium Salts in Medicine”. Med Hist. 18 (1): 9–21. PMC 1081520.
- ^ “Barium: geological information”, Mark Winter, The University of Sheffield and WebElements Ltd, UK (WebElements) 2012年1月15日閲覧。
- ^ “The Element Barium”. Jefferson Lab.. 2012年1月15日閲覧。
- ^ a b c Ullman 2007, p. 5.
- ^ “Alston Moor Cumbria, UK”. Steetley Minerals. 2012年1月15日閲覧。
- ^ Industrial minerals, (1969), p. 28
- ^ a b “我が国における鉱種別 需給/リサイクル/用途等 資料2.30 バリウム (Ba)”. 東北非鉄振興プラン報告書. 東北経済産業局. 2013年1月8日閲覧。
- ^ a b c d C. R. Hammond (2000), The Elements, in Handbook of Chemistry and Physics 81st edition, CRC press, ISBN 0849304814
- ^ キャリー・ホール『宝石の写真図鑑(地球自然ハンドブック)』日本ヴォーグ社、1996年、80頁。ISBN 4529026914。
- ^ “31.バリウム”. 石油天然ガス・金属鉱物資源機構. 2013年1月9日閲覧。
- ^ “双日、メキシコにおける世界最大級のバライト鉱山へ出資〜石油・ガス採掘時の掘削泥水原料として需要拡大〜”. 双日. 2013年1月9日閲覧。
- ^ “BARITE”. アメリカ地質調査所 (2012年). 2013年1月8日閲覧。
- ^ a b “Toxicological Profile for Barium and Barium Compounds. Agency for Toxic Substances and Disease Registry”. CDC (2007年). 2012年1月17日閲覧。
- ^ Ullman 2007, p. 7.
- ^ a b Ullman 2007, p. 6.
- ^ a b c d e f g Ullman 2007, p. 3.
- ^ a b c Ullman 2007, p. 4.
- ^ Stellman, Jeanne (1998). Encyclopaedia of Occupational Health and Safety: Chemical, industries and occupations. International Labour Organization. pp. 63.8. ISBN 978-92-2-109816-4
- ^ a b “硫酸バリウム”. 特許庁. 2012年4月2日閲覧。
- ^ a b Ullman 2007, p. 9.
- ^ Jones, Chris J. and Thornback, John (2007). Medicinal applications of coordination chemistry. Royal Society of Chemistry. p. 102. ISBN 0-85404-596-1
- ^ “SIDS 初期評価プロファイル 炭酸バリウム”. 日本化学物質安全・情報センター. 2013年1月25日閲覧。
- ^ 真鍋由雄ほか (2010). “ランプ寿命推定法を用いた長寿命蛍光ランプの開発”. Panasonic Technical Journal 56 (2): 45.
- ^ ディーゼル自動車の排気黒煙防止に関する調査研究(第2報) - 東京都環境公社
- ^ Michael S. Russell, Kurt Svrcula (2008). Chemistry of Fireworks. Royal Society of Chemistry. p. 110. ISBN 0-85404-127-3
- ^ Brent, G. F.; Harding, M. D. (1995). “Surfactant coatings for the stabilization of barium peroxide and lead dioxide in pyrotechnic compositions”. Propellants Explosives Pyrotechnics 20 (6): 300. doi:10.1002/prep.19950200604.
- ^ 秋重幸邦 (2006). “新規チタン酸バリウム系強誘電体”. 熱測定 (日本熱測定学会) 33 (4): 160頁 2013年2月4日閲覧。.
- ^ “Crystran Ltd. Optical Component Materials”. 2010年12月29日閲覧。
- ^ Colin A. Russell (2000). Chemistry, Society and Environment: A New History of British Chemical Industry. Royal Society of Chemistry. p. 164. ISBN 0854045996
- ^ 野口仁ほか (2007). “バリウムフェライト磁性体を用いた塗布型磁気記録媒体の高密度化研究”. Fujifilm Research & Development 52: 47-50.
- ^ 足立吟也、南努 (2007). 現代無機材料科学. 化学同人. p. 182. ISBN 4759810749
- ^ “緻密質ファインセラミックス”. ティーイーピー株式会社. 2013年1月25日閲覧。
- ^ Patnaik, Pradyot (2003). Handbook of inorganic chemicals. pp. 77–78. ISBN 0070494398
- ^ Doig AT (February 1976). “Baritosis: a benign pneumoconiosis”. Thorax 31 (1): 30–9. doi:10.1136/thx.31.1.30. PMC 470358. PMID 1257935.
- ^ “良性塵肺症”. メルクマニュアル. 2012年1月18日閲覧。
- ^ “Toxicity Profiles, Ecological Risk Assessment”. US EPA (2009年6月6日). 2012年1月17日閲覧。
- ^ Moore, J. W. (1991). Inorganic Contaminants of Surface Waters, Research and Monitoring Priorities. New York: Springer-Verlag
- ^ a b “環境保健クライテリア 107 バリウム”. 国立医薬品食品衛生研究所. 2013年1月27日閲覧。
- ^ “毒物及び劇物指定令(昭和40年政令第2号)”. e-Gov法令検索. 総務省行政管理局 (2019年6月19日). 2020年1月9日閲覧。
- ^ “化学物質を取り扱う事業者の方へ”. 経済産業省. p. 26. 2013年1月27日閲覧。
- ^ “海外の環境規制・環境産業の動向に関する調査報告書”. 三菱総合研究所. 2013年1月27日閲覧。
- ^ “シンガポールの排水基準について”. DOWAエコジャーナル. 2013年1月27日閲覧。
- ^ “グリーン調達 欧州規格EN71-Part3に基づく玩具の溶出試験”. 島津テクノリサーチ. 2013年1月26日閲覧。
参考文献
[編集]- 加藤虎郎『標準定量分析法』丸善、1932年。
- F.A. コットン, G. ウィルキンソン『コットン・ウィルキンソン無機化学(上)』中原 勝儼(原書第4版)、培風館、1987年。ISBN 4563041920。
- G. シャルロー『定性分析化学II ―溶液中の化学反応』曽根興二、田中元治 訳、共立出版、1974年。
- 千谷利三『新版 無機化学(上巻)』産業図書、1959年。
- Kresse, Robert; Baudis, Ulrich; Jäger, Paul; Riechers, H. Hermann; Wagner, Heinz; Winkler, Jocher; Wolf, Hans Uwe (2007). “Barium and Barium Compounds”. In Ullman, Franz. Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a03_325.pub2
- Kresse, Robert; Baudis, Ulrich; Jäger, Paul; Riechers, H. Hermann; Wagner, Heinz; Winkler, Jocher; Wolf, Hans Uwe (1985). “Barium and Barium Compounds”. In Wolfgang Gerhartz. Ullman's Encyclopedia of Industrial Chemistry. A3 (5th ed.). Wiley-VCH. ISBN 3527201041
- Lide, D. R. (2004). CRC Handbook of Chemistry and Physics (84th ed.). Boca Raton (FL): CRC Press. ISBN 978-0-8493-0484-2
関連項目
[編集]| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| |||||||||||||||||||||||||||||||||








