細胞培養
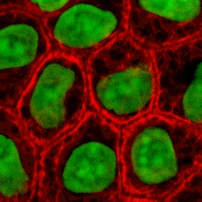
細胞培養(さいぼうばいよう、英: cell culture)は、多細胞生物から細胞を分離し、体外で増殖、維持すること。生体外で培養されている細胞のことを培養細胞と呼ぶ。生体から分離し、最初の植え替えを行うまでを初代培養、既存の培養細胞を新たな培養容器へと移し替えて増殖、維持することを継代培養と呼ぶ。細胞を培養するために用いられる組織間液を模した液体を培地と呼ぶ。
一般に、間葉系細胞は培養が容易であるのに対して、上皮系組織の細胞の培養は困難である。また、正常細胞に比較して癌細胞は容易に培養することができる。細胞培養における存在形態により培養細胞は接着培養系細胞と浮遊培養系細胞に分類することができる。接着培養系細胞は培養容器に付着し増殖する培養細胞であり、継代には培地交換を行う。浮遊培養系細胞は培地内で浮遊状態で増殖する培養細胞であり、継代の際には培地交換は行わず、希釈培養を行う。特殊な培養法として三次元培養がある。
細胞培養において培養を目的としている生物因子以外の生物因子の混入をコンタミネーションと呼び(混入したものが細胞の場合はクロスコンタミネーションと呼ばれる)、細胞の増殖や機能、実験結果に影響を及ぼすため、細胞培養の際は無菌操作が行われる。細胞は生体の一部であるため、培養細胞の研究を介して生命現象の解析をすることができる。また、モノクローナル抗体などのようにある種の物質の生産手段としても細胞培養は利用される。
歴史的背景
[編集]19世紀イギリス人生理学者シドニー・リンガーは、動物の体から取り出した心臓の拍動の維持に適した、塩化ナトリウム、塩化カリウム、塩化カルシウム、塩化マグネシウムを含むリンゲル液を開発した[1]。1885年に、ヴィルヘルム・ルーはニワトリの胚から髄板部分を切除し、温めた生理食塩水中で数日間維持して、組織培養の原理を確立した[2]。1907年から1910年にかけて、ロス・グランビル・ハリソンはジョンズ・ホプキンス大学薬学部とイェール大学における実験結果を発表し、組織培養の方法論を確立した。
1940年代から50年代にかけて細胞培養の技術は格段に進歩し、ウイルス学の研究を支えた。培養細胞中でのウイルスの増殖により、ワクチン製造に用いる精製ウイルスの調製が可能になった。ジョナス・ソークが開発したポリオワクチンの注射剤は、細胞培養技術によって大量生産された初期の例である。このワクチンはジョン・フランクリン・エンダース、トーマス・ハックル・ウェーラー、フレデリック・チャップマン・ロビンスの細胞培養研究によって製造可能となった。3人は、サルの腎臓細胞培養によりウイルスを生産する方法を発見した功績によりノーベル賞を受賞した。
動物細胞の培養
[編集]細胞の単離
[編集]細胞は組織から生体外での培養のために いくつかの方法で単離される。細胞は血液から用意に精製されるが、培養においては白血球のみが成長する能力がある。単核細胞は、軟部組織からコラゲナーゼ、トリプシンまたはプロナーゼなど、細胞外マトリックスを分解する酵素による作用を利用して取り出される。あるいは、組織片を培地中で増殖し、得られた細胞を細胞培養に用いることもある。この方法は移植片培養として知られている。
組織から直接培養された細胞は初代培養と呼ばれる。腫瘍から得られる例外をのぞいて、ほとんどの初代培養株の寿命は限られている。
確立されたまたは不死化された細胞株は、ランダムな変異または人工的なテロメラーゼ遺伝子の発現のような意図的な改変によって、無限に急速に増殖する能力を獲得している。多くの細胞株が特定の細胞型の代表型として確立されている。
培養における細胞の維持管理
[編集]
単離された初代細胞は、一般的に生存能力を保持しながらも、一定回数の細胞分裂の後に老化と分裂停止のプロセスへと至る。これはヘイフリック限界と呼ばれている。
細胞は、適切な温度と雰囲気下(動物細胞の場合、一般的に37℃、二酸化炭素濃度5%)、インキュベーター中で生育され保持される。培地の組成は、細胞型によって大きく異なる。また特定の細胞型に対して異なる培養条件を与えると、異なる表現型をもたらすことがある。
培養条件において温度と雰囲気の他に最も共通する変動因子は、培地成分である。pH、グルコース濃度、成長因子、その他の栄養素の有無などにより、培地の配合は変わる。培地添加剤としての成長因子は、しばしばウシ胎児血清 (FBS)、コウシ血清、ウマ血清、ブタ血清など動物の血液の血清から作られる。これらの血液由来成分は潜在的にウイルスやプリオンの混入により培地を汚染する懸念があり、特に医療向け生物工学の分野では問題となる。現在では、可能な限り動物由来原料を除去もしくは最小限にし、ヒト血小板溶解物(hPL)を使用することで、FBSをヒト細胞に用いた場合に起こりうる種間汚染の懸念を除いている。hPLは、安全で信頼できるFBSやその他の動物血清の代替品として用いられている。加えて、合成培地を用いることで、ヒトや動物由来血清を完全に除くことができるが、様々な細胞型に対して常に合成培地が適用できるとは限らない。その他の方法として、アメリカ合衆国、オーストラリア、ニュージーランドなど、BSE/TSEの危険が低い国の動物の血液を用いたり[3]、全血清の代わりに濃縮精製栄養成分を使用することが挙げられる[4]。
播種密度(培養液単位体積あたりの細胞数)は、ある種の細胞型にとって重要な役割を果たす。例えば、顆粒膜細胞は、低い播種密度でエストロゲンを生産するが、高い播種密度では、プロゲステロンを生産する卵胞膜黄体細胞様を呈する[5]。
浮遊培養もしくは接着培養にて細胞を増殖することができる。血液中に存在する類の細胞は表面に接着することなく自然に懸濁液中で生存する。また浮遊培養向け培地中で生き続けるように改変された細胞株は、接着培養よりも高い密度で生育させることができる。接着培養系細胞は表面を必要とするため、接着性を高め、成長と分化に必要なその他のシグナルを与えるために、(コラーゲンやラミニンなどの)細胞外マトリックスの構成物質で覆われた組織培養用プラスチックやマイクロキャリアなどの材料が用いられる。固体組織から得たほとんどの細胞は接着性である。接着培養のもう一つの種類は器官培養である。これは、2次元的なシャーレでの培養に対して、3次元の環境で細胞を培養する方法である。3次元培養システムは生物学的、生理学的により生体組織に近いが、多くの要因(例えば分散など)があるため、技術的に保持が困難である。
細胞株の交差汚染
[編集]培養細胞を扱う研究者にとって細胞株の交差汚染は問題である[6]。調査によると、15から20%の確率で誤認もしくは他の細胞株に汚染された細胞が実験に使用されている[7][8][9]。医薬品のスクリーニング研究に頻繁に使用されるNCI-60細胞パネルから作られた細胞株に交差汚染が発見された[10][11]。アメリカ培養細胞系統保存機関(American Type Culture Collection, ATCC)、European Collection of Cell Cultures(ECACC), ドイツ微生物細胞培養コレクション(German Collection of Microorganisms and Cell Cultures, DSMZ)などの主要な細胞株のレポジトリは、これまで研究者から誤認された細胞株の提出を受けてきた[10][12]。細胞株の汚染は、細胞株を用いた研究の質に影響するため、現在主要なレポジトリは、提供された細胞株全ての正しさを確認している。[13]。 ATCCは、細胞株の認証にマイクロサテライト(STR)DNA鑑定法を用いている[14]。交差汚染問題への対処として、研究者が継代初期に細胞株の正しさを確認し、細胞株の同一性を認証することが推奨されている。株の認証は、細胞ストックの凍結保存前、培養に使用されている間は2ヶ月毎、細胞株を使用したデータを用いた研究が発表される前にそれぞれ再実施されるべきである。同一性確認試験には、アイソザイム分析、ヒト白血球型抗原(HLA)型判定、染色体分析、核型分析、形態観察、STR解析などの試験法が用いられる[14]。交差汚染物質として重要な例として不死化HeLa細胞が挙げられる。
その他の技術的問題
[編集]一般に、培養が進行すると分割し続けた細胞が培地全体に広がるため、以下のような問題が発生する。
- 培地成分の枯渇
- 培地のpHの変化
- 細胞同士の接触により細胞周期が停止し、細胞分裂が止まる接触阻止
- 細胞同士の接触による細胞分化の発生
培養した細胞の操作
[編集]細胞培養に共通する操作には、培養液の交換、継代、トランスフェクションがあり、一般に無菌操作に依る組織培養の方法で行う。無菌操作を安全キャビネットもしくはクリーンベンチ中で行うことでバクテリア、酵母、他の細胞株の混入による汚染を回避する。抗生物質(ペニシリン、ストレプトマイシンなど)や抗菌剤(アムホテリシンBなど)を培地に加えることがある。
細胞が代謝の過程に入ると酸が生産されpHが低下する。しばしば栄養の枯渇の程度を計るために、酸塩基指示薬が加えられる。
培養液の交換
[編集]接着培養の場合、培地は直接吸引により取り除き、交換する。非接着培養においては、遠心分離した後、新しい培地に細胞を再度分散する。
継代
[編集]継代は、少量の細胞を新しい容器に移す作業を伴う。定期的に分割することで、高い培養密度の継続による老化を回避し、細胞をより長く培養することができる。分散培養では、少量の培養液を大量の新鮮な培養液で希釈することで、容易に継代することができる。接着培養では、細胞の剥離から始める必要があり。剥離は一般にトリプシン-EDTA混合液を用いるが、現在では他の酵素混合溶液も同様の目的で使用される。少数の剥離した細胞が新しい培養に用いられる。ある種の細胞は、ゴムベラで培養容器の内壁表面から機械的に掻き取り集める場合もある。
トランスフェクションと形質導入
[編集]トランスフェクションは、外部遺伝子を導入するためによく用いられる細胞操作である。トランスフェクションにより、目的タンパク質を細胞に遺伝子発現させることができる。近年では、RNAi構造体のトランスフェクションが、特定の遺伝子やタンパク質の発現を抑制するための簡便な方法として実現されている。DNAは形質導入、感染、形質転換と呼ばれるウイルスを用いた方法で、細胞内に挿入することができる。DNAの挿入は、ウイルスが通常増殖する際に使用している過程の一部であるので、ウイルスはDNAの細胞への導入ための寄生作用剤として適している。
樹立ヒト細胞株
[編集]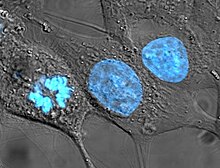
ヒトを起源とする細胞株は、その元になる生体から切り離されて生き続け、のちに利益を生み出す医学的処置の発見につながることから、生命倫理学において議論の対象となってきた。この分野における先駆的決定において、カリフォルニア州最高裁判所は、Moore v. Regents of the University of Californiaにおいて、インフォームドコンセントを受けた患者は、切除された器官から得られた細胞株に対して所有権を持たないことを判示した[16]。
通常の細胞と不死化細胞株を融合させることが可能である。この方法は、モノクローナル抗体の生産に使用されている。端的に言って、免疫動物の脾臓(もしくは血液)から単離されたリンパ球は、不死化された骨髄腫細胞株(B系細胞)と合わせられ、初代リンパ球の抗体特異性と骨髄腫の不死性を持ったハイブリドーマを生産する。選択培地(HAやHAT)を用いると、融合していない骨髄腫細胞は成長せず、初代リンパ球は培地中で急速に死滅し、結果融合した細胞のみが生き残る。融合した細胞は必要な抗体の生産のためにスクリーニングされる。
自動細胞培養装置
[編集]この節の加筆が望まれています。 |
自動細胞培養装置も多数開発されてきている[17]。
装置には培養操作を汎用産業ロボットで自動化したもの(安川電機のMOTOMAN、川崎重工業のAUTO CULTUREなど)、細胞シート工学を用いたもの(日立製作所の小型自動培養装置)、培養バッグを用いたもの(ニプロのCELLAFORTEなど)等が存在する[17]。
利用
[編集]関連項目
[編集]参考文献
[編集]- 許南浩編 『細胞培養なるほどQ&A』 羊土社 2004年 ISBN 4897068789
- ^ “Whonamedit - Ringer's solution”. whonamedit.com. 2015年7月14日閲覧。
- ^ “Animals and alternatives in testing”. 2006年2月25日時点のオリジナルよりアーカイブ。2015年7月14日閲覧。
- ^ “Post - Blog | Boval BioSolutions, LLC”. bovalco.com. 2014年12月2日閲覧。
- ^ “LipiMAX purified lipoprotein solution from bovine serum”. Selborne Biological Services (2006年). 2010年2月2日閲覧。
- ^ Portela VM, Zamberlam G, Price CA (April 2010). “Cell plating density alters the ratio of estrogenic to progestagenic enzyme gene expression in cultured granulosa cells”. Fertil. Steril. 93 (6): 2050–5. doi:10.1016/j.fertnstert.2009.01.151. PMID 19324349.
- ^ Jill Neimark (27 February 2015). “Line of attack”. Science 347 (6225): 938-940. doi:10.1126/science.347.6225.938.
- ^ Drexler, HG; Dirks, WG; MacLeod, RA (Oct 1999). “False human hematopoietic cell lines: cross-contaminations and misinterpretations”. Leukemia 13 (10): 1601–7. doi:10.1038/sj/leu/2401510. ISSN 0887-6924. PMID 10516762.
- ^ Drexler, HG; MacLeod, RA; Dirks, WG (Dec 2001). “Cross-contamination: HS-Sultan is not a myeloma but a Burkitt lymphoma cell line” (Free full text). Blood 98 (12): 3495–6. doi:10.1182/blood.V98.12.3495. ISSN 0006-4971. PMID 11732505.
- ^ Cabrera, CM; Cobo, F; Nieto, A; Cortés, JL; Montes, RM; Catalina, P; Concha, A (Jun 2006). “Identity tests: determination of cell line cross-contamination”. Cytotechnology 51 (2): 45–50. doi:10.1007/s10616-006-9013-8. ISSN 0920-9069. PMC 3449683. PMID 19002894.
- ^ a b Chatterjee, R (Feb 2007). “Cell biology. Cases of mistaken identity”. Science 315 (5814): 928–31. doi:10.1126/science.315.5814.928. ISSN 0036-8075. PMID 17303729.
- ^ Liscovitch, M; Ravid, D (Jan 2007). “A case study in misidentification of cancer cell lines: MCF-7/AdrR cells (re-designated NCI/ADR-RES) are derived from OVCAR-8 human ovarian carcinoma cells”. Cancer letters 245 (1–2): 350–2. doi:10.1016/j.canlet.2006.01.013. ISSN 0304-3835. PMID 16504380.
- ^ Macleod, RA; Dirks, WG; Matsuo, Y; Kaufmann, M; Milch, H; Drexler, HG (Nov 1999). “Widespread intraspecies cross-contamination of human tumor cell lines arising at source”. International Journal of Cancer. Journal International Du Cancer 83 (4): 555–63. doi:10.1002/(SICI)1097-0215(19991112)83:4<555::AID-IJC19>3.0.CO;2-2. ISSN 0020-7136. PMID 10508494.
- ^ Masters, JR (Apr 2002). “HeLa cells 50 years on: the good, the bad and the ugly”. Nature reviews. Cancer 2 (4): 315–9. doi:10.1038/nrc775. ISSN 1474-175X. PMID 12001993.
- ^ a b Dunham, J.H.; Guthmiller, P. (2008). “Doing good science: Authenticating cell line identity”. Cell Notes 22: 15–17.
- ^ Nguyen, H. T.; Geens, M.; Spits, C. (2012). “Genetic and epigenetic instability in human pluripotent stem cells”. Human Reproduction Update 19 (2): 187–205. doi:10.1093/humupd/dms048. PMID 23223511.
- ^ “Moore v. Regents of University of California (1990) 51 C3d 120”. Online.ceb.com. 2012年1月27日閲覧。
- ^ a b 清水美雪, 頼紘一郎, 鮫島正, 野々山良介, 神野誠「再生医療の事業化における自動培養装置のポジション」『医療機器学』第88巻第4号、日本医療機器学会、2018年、434-435頁、doi:10.4286/jjmi.88.433、ISSN 18824978。
