転写後修飾
転写後修飾(てんしゃごしゅうしょく、英: post-transcriptional modification)は、遺伝子から転写されたRNAの一次転写産物が化学的変化を受け、核を離れて細胞内でさまざまな異なる機能を果たす成熟した機能的なRNA分子が生み出される過程であり、大部分の真核細胞に共通の過程である[1]。転写後修飾には多くのタイプが存在し、さまざまなクラスの分子機構によって行われている。
おそらく転写後修飾の最も良く知られた例は、mRNAの前駆体となる転写産物から、タンパク質へ翻訳可能な成熟mRNAへの変換である。この過程には、5'キャップの付加、3'テールのポリアデニル化、RNAスプライシングという、RNA分子の化学構造を修飾する3つの主要な段階が含まれる。このようなプロセシングは真核生物のゲノムを正確に翻訳するために必須の過程であるが、それは転写によって作り出される前駆体mRNAは、多くの場合エクソン(主にタンパク質をコードする配列)とイントロン(タンパク質をコードしない配列)の双方を含んでいるためである。スプライシングはイントロンを除去してエクソンどうしを直接連結し、キャップとテールはmRNAのリボソームへの輸送を促進し、また分解から保護する[2]。
転写後修飾は、最終的にtRNA、rRNAや他のタイプのRNAとなる転写産物に対しても行われる。
mRNAのプロセシング
[編集]|
|
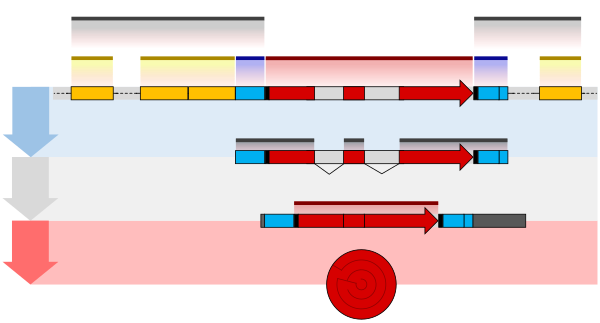
mRNA前駆体(pre-mRNA)分子には3つの主要な修飾が行われる。5'キャップの付加、3'末端のポリアデニル化、RNAスプライシングである。これらはRNAが翻訳される前、細胞核の中の段階で行われる[4]。
5'末端のプロセシング
[編集]キャップの形成
[編集]pre-mRNAへのキャップ付加の過程では、7-メチルグアノシン(m7G)が5'末端へ付加される。まず、RNAトリホスファターゼによって5'末端からリン酸が除去され、二リン酸の5'末端が形成される。続いて、mRNAグアニリルトランスフェラーゼの触媒のもと、二リン酸5'末端がGTP分子のα位のリン酸を攻撃し、5′–5′三リン酸結合が形成される。そしてmRNA(グアニン-N7-)-メチルトランスフェラーゼ(キャップメチルトランスフェラーゼ)がS-アデノシルメチオニンからメチル基をグアノシン環へ転移する[5]。このm7Gが結合しただけのキャップ構造はcap 0構造と呼ばれる。m7Gに隣接するヌクレオチドのリボースがメチル化されることもあり、これはcap 1構造と呼ばれる。さらにRNA分子の下流のヌクレオチドがメチル化されることでcap 2、cap 3、... の構造が作り出される。これらメチル化はリボースの2'OH基に対して行われる。キャップは、3'-5'ホスホジエステル結合に対する特異性を持つリボヌクレアーゼの攻撃からRNA一次転写産物の5'末端を保護している[6]。
3'末端のプロセシング
[編集]切断とポリアデニル化
[編集]pre-mRNAの3'末端のプロセシングでは、3'末端の切断と約250塩基のアデニン残基の付加によるポリ(A)テールの形成が行われる。切断とアデニル化反応は、ポリアデニル化シグナル配列(5'-AAUAAA-3')がpre-mRNA分子の3'末端の近傍に位置しているときに起こる。この配列に続く別の配列(通常は(5'-CA-3'))が切断部位である。通常、pre-mRNA分子のさらに下流にはGUに富む配列が存在する。この配列エレメントが合成された後、複数のサブユニットから構成される2つのタンパク質、CPSF(cleavage and polyadenylation specificity factor)とCStF(cleavage stimulation factor)がRNAポリメラーゼIIからRNA分子へ転移して配列エレメントに結合し、別の切断因子やポリ(A)ポリメラーゼを含むタンパク質複合体が形成される。この複合体は、ポリアデニル化シグナル配列とGUリッチ配列の間の5'-CA-3'配列の部位でRNAを切断する。その後、ポリ(A)ポリメラーゼがATPを前駆体として約200個のアデニル酸をRNA分子の3'末端に新たに付加する。ポリ(A)テールが合成されると、複数のポリ(A)結合タンパク質が結合し、3'末端をリボヌクレアーゼによる分解から保護する[6]。
スプライシング
[編集]RNAスプライシングは、タンパク質をコードしない、イントロンと呼ばれるRNA領域がpre-mRNAから除去され、残ったエクソンが連結されて1本の連続的な分子が再形成される過程である。エクソンの大部分は「発現する」つまりタンパク質へと翻訳されるmRNAの領域であり、mRNA分子のコーディング領域である[7]。ほとんどのRNAスプライシングはpre-mRNA全長の合成と末端のキャッピングの後に起こるが、多くのエクソンからなる転写産物のスプライシングは転写と同時に行われる[8]。スプライシング反応はスプライソソームと呼ばれる巨大な複合体によって触媒される。スプライソソームは、タンパク質と、pre-mRNA配列中のスプライシング部位を認識する核内低分子RNAから組み立てられる。抗体をコードするものを含め、多くのpre-mRNAが複数通りのスプライシングを受け、異なるタンパク質配列をコードする複数の成熟mRNAが生み出される。この過程は選択的スプライシングとして知られ、限られた量のDNAから多様性に富むタンパク質を生み出すことが可能となっている。
ヒストンmRNAのプロセシング
[編集]ヒストンH2A、H2B、H3、H4はヌクレオソームのコアを形成し、そのためコアヒストンと呼ばれる。典型的なヒストンmRNAは、ポリ(A)テールやイントロンといった他の真核mRNAのいくつかの特徴を持たないため、通常のmRNAとは異なったプロセシングが行われる。これらのmRNAはスプライシングが行われず、3'末端のプロセシングも切断因子やポリアデニル化因子とは無関係である。コアヒストンのmRNAの3'末端に存在する特別なステムループ構造がSLBP(stem-loop binding protein)によって認識され、histone downstream element (HDE) と呼ばれる領域がU7 snRNAを呼び寄せる。そして、CPSF3がステムループとHDEの間を切断する[9]。
一方、H2A.ZやH3.3のようなヒストンバリアントはイントロンを持っており、通常のmRNAと同様にスプライシングとポリアデニル化が行われる[9]。
出典
[編集]- ^ “Small nucleolar RNA-guided post-transcriptional modification of cellular RNAs”. The EMBO Journal 20 (14): 3617–22. (July 2001). doi:10.1093/emboj/20.14.3617. PMC 125535. PMID 11447102.
- ^ Berg, Tymoczko & Stryer 2007, p. 836
- ^ a b Shafee, Thomas; Lowe, Rohan (2017). “Eukaryotic and prokaryotic gene structure”. WikiJournal of Medicine 4 (1). doi:10.15347/wjm/2017.002. ISSN 2002-4436.
- ^ Berg, Tymoczko & Stryer 2007, p. 841
- ^ Shatkin, A. J. (1976-12). “Capping of eucaryotic mRNAs”. Cell 9 (4 PT 2): 645–653. doi:10.1016/0092-8674(76)90128-8. ISSN 0092-8674. PMID 1017010.
- ^ a b Hames & Hooper 2006, p. 221
- ^ Biology. Mgraw hill education. (2014). pp. 241–242. ISBN 978-981-4581-85-1
- ^ “Chapter 8: Post-transcriptional Gene Control”. Molecular Cell .Biology. San Francisco: WH Freeman. (2007). ISBN 978-0-7167-7601-7
- ^ a b “Metabolism and regulation of canonical histone mRNAs: life without a poly(A) tail”. Nature Reviews. Genetics 9 (11): 843–54. (November 2008). doi:10.1038/nrg2438. PMC 2715827. PMID 18927579.
参考文献
[編集]- Berg, Jeremy M.; Tymoczko, John L.; Stryer, Lubert (2007). Biochemistry (6 ed.). New York: WH Freeman & Co.. ISBN 978-0-7167-6766-4
- Hames, David; Hooper, Nigel (2006). Instant Notes Biochemistry (3 ed.). Leeds: Taylor and Francis. ISBN 978-0-415-36778-3
- “RMBase: a resource for decoding the landscape of RNA modifications from high-throughput sequencing data”. Nucleic Acids Research 44 (D1): D259-65. (January 2016). doi:10.1093/nar/gkv1036. PMC 4702777. PMID 26464443.
- “MODOMICS: a database of RNA modification pathways--2013 update”. Nucleic Acids Research 41 (Database issue): D262-7. (January 2013). doi:10.1093/nar/gks1007. PMC 3531130. PMID 23118484.
- “The RNA Modification Database, RNAMDB: 2011 update”. Nucleic Acids Research 39 (Database issue): D195-201. (January 2011). doi:10.1093/nar/gkq1028. PMC 3013656. PMID 21071406.