閉環メタセシス
| 閉環メタセシス | |
|---|---|
| 種類 | 環形成反応 |
| 識別情報 | |
| Organic Chemistry Portal | ring-closing-metathesis |
| RSC ontology ID | RXNO:0000245 |
閉環メタセシス(へいかんメタセシス、英: Ring-closing metathesis、略称: RCM)は、有機化学において広く使われているオレフィンメタセシスの一種である。2つの末端アルケンの分子内メタセシスによって様々な不飽和環の合成のために使われる。この反応では、シクロアルケンのE-またはZ-異性体と揮発性エチレンが形成される[1][2]。

最も一般的に合成される環の大きさは5から7原子の間である[3]。しかしながら、報告されている合成には45から90員環にもなる大環状複素環化合物まである[4][5][6]。これらの反応は金属によって触媒され、メタラシクロブタン中間体を経て進行する[7]。閉環メタセシス反応は、1980年にDider VilleminによってExaltolide前駆体の合成に関する論文において初めて発表され[8]、後に、ロバート・グラブスとリチャード・シュロックによって一般に普及した方法となった。グラブスとシュロック、イヴ・ショーヴァンはオレフィンメタセシスに関する業績で2005年のノーベル化学賞を授与された[9][10]。RCMは、これ以前は効率的に得ることが困難だった環の形成におけるその合成的有用性と広い基質範囲から有機化学者の間で支持を得ている[11]。主な副生成物がエチレンのみであるため、これらの反応は原子経済的であると考えることもできる。アトムエコノミーの概念はグリーンケミストリーの発展においてますます重要な課題である[7]。
閉環メタセシスに関する複数の総説が発表されている[2][3][12][13]。
歴史
[編集]閉環メタセシスの最初の例は1980年にDider Villeminによって報告された。VilleminはWCl6/Me4Sn触媒によるメタセシス環化(収率は60-65%、環の大きさに依存する)を用いてExaltollideを合成した(下図A)[8]。それからの数カ月のうちに、辻二郎がWCl6およびジメチルチタノセン(Cp2TiMe2)によって触媒されるマクロライドの調製(下図B、収率は17.9%)について同様のメタセシス反応を報告した[14]。辻はオレフィンメタセシス反応を「有機合成において潜在的に有用なである」と述べ、様々な官能基が耐えられるより汎用性のある触媒の開発の必要性について述べた。

1987年、Siegfried WarwelとHans Kätkerは、Re2O7/Al2O3と触媒の活性化にMe4Snを用いた出発物質のシクロオレフィンのクロスメタセシス二量化によってC14、C18、C20(収率58-74%)、C16(収率30%)ジエンを得る反応を使った対称マクロサイクルの合成を発表した[15]。

最初の発見から10年後、1992年にグラブスとFuが、シュロックのモリブデンアルキリデン触媒を利用したRCMによるO- ならびにN-複素環化合物の合成を詳述した影響力の大きい2報の論文を発表した[16][17]。シュロックのモリブデン触媒は塩化タングステン触媒よりも頑強かつ官能基許容性が広いことが証明された。この合成経路によって、容易に入手可能な出発材料から高収率(89-93%)でジヒドロピラン骨格を得ることが可能になった[16]。加えて、置換ピロリン、テトラヒドロピリジン、アミドの合成は中程度から高収率(73-89%)と説明された[17]。この環化反応の駆動力は、1分子の出発材料につき2分子が形成されることによるエントロピー的な有利さに帰せられている。高揮発性の気体である2番目の分子、エチレンが失われることが、ルシャトリエの原理にしたがって順方向に反応を駆動する[16]。

1993年、グラブスらはモリブデン触媒を用いた炭素環合成に関する報告を発表しただけでなく[18]、メタセシス反応のための新規ルテニウムカルベン錯体の最初に使用についても詳述した。この触媒は後にその並外れた有用性により人気の触媒となった。モリブデン触媒とは異なり、これらのルテニウム触媒は空気および湿気に対して安定である[19]。グラブス触媒という名前の方が有名であるこれらのルテニウム触媒は、モリブデン触媒やシュロックの触媒と共に、今日もRCMを含む多くのメタセシス反応で使われている。概して、金属触媒RCM反応はC-C結合形成反応において非常に有効であり、有機合成やケミカルバイオロジー、物質科学、その他様々分野において、幅広い不飽和環や高度に官能基化された環を得るために非常に重要であることが示されている[2][3]。
機構
[編集]一般的機構
[編集]遷移金属触媒オレフィンメタセシスの機構は、過去40年間にわたって広く研究されてきた[20]。RCMは、クロスメタセシス(CM)や開環メタセシス重合(ROMP)、非環式ジエンメタセシス(ADMET)といったその他のオレフィンメタセシス反応と同様の機構経路を経る[21]。触媒サイクルの全ての段階が可逆的と考えられるため、反応条件や基質に依存して、これらその他の経路の一部がRCMと交差することも可能である[12]。1971年、ショーヴァンは [2+2] 環化付加によるメタラシクロブタン中間体の形成を提唱した[21][22]。この中間体は次にサイクロリバート(cyclorevert)して同じアルケンまたは触媒種を与えるか(非生産的経路)、新しい触媒種とアルキリデンを生成する(生産的経路)[23]。この機構は化学者の間で広く受け入れられるようになっており、RCM機構のモデルとなっている[24]。

反応は、触媒のアルケン配位子が基質と置換することから始まる。この過程は、一連の [2+2] 環化付加とサイクロリバージョン(cycloreversion)による新たなアルキリデンの形成を介して起こる。ホスフィン配位子の会合と解離もグラブス触媒の場合に起こる[25]。RCM反応では、このアルキリデンが同じ分子上の2つ目の反応性末端アルケンと分子内 [2+2] 環化付加を起こす。2分子目の出発物質の分子間付加も起こり得る。これは一般的な競合副反応であり、重合が起こる[26]。メタラシクロブタン中間体のサイクロリバージョンは、[M]=CH2またはアルキリデン(触媒サイクルに再び入る化学種)と共に、望むRCM生成物を形成する。揮発性エチレンが失われることがRCMの駆動力であるが[24]、エチレンは競合するメタセシス反応によっても生成されるため、RCM反応のみの駆動力と考えることはできない[2]。
熱力学
[編集]RCM反応は、厳密な反応条件、触媒、基質に依存する速度論あるいは熱力学支配化にある。一般的な環である5から7員環シクロアルケンが形成される傾向が高く、ラクトン環の形成についてIlluminatiとMandoliniによって示されるように[27]、環化生成物のエントロピー的有利さによる、より大きな熱力学支配下にしばしばある。5原子と8原子の間のより小さな環は、より低い環ひずみのため、中員環から大員環よりも熱力学的に有利である。環ひずみは異常な結合角が原因であり、鎖状のものと比較してより大きな燃焼熱をもたらす[27]。RCM生成物がひずみのあるオレフィンを含むとすると、この新たに形成されたオレフィンの開環メタセシス重合によって重合がより有利となる[28]。特に中員環は、部分的には環の両側からの渡環相互作用と、そして不利なゴーシュ相互作用を避けるように分子を適応させることができないため、より大きな環ひずみを持つ[27][29]。RCMは、生成物が触媒サイクルに再び入ることができない、あるいは平衡により相互変換できないとすれば、速度論的偏りを持つと考えることができる。速度論的生成物分布は、ほとんどの場合RCM生成物を与え、オリゴマーまたはポリマーの生成はほとんどの場合不利である[2]。

平衡
[編集]より反応性の高い触媒の出現によって、より多くの生成物分布をもたらす平衡RCMがかなりの頻度で観察される。反応機構は、様々な競合平衡反応を含有するように拡張でき、またオリゴマーといった様々な副生成物が反応経路に沿ってどこで形成されるかを示すことができる[30]。
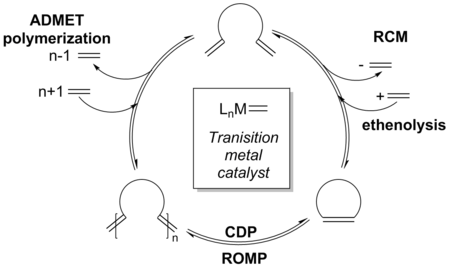
反応はまだ熱力学支配下にあるものの、最初の速度論的生成物(出発物質の二量化またはオリゴマー化)がより高い触媒活性の結果として反応の始まりに形成される。触媒活性の上昇によって、オレフィン生成物が触媒への非末端アルケン付加を介して触媒サイクルに再び入ることも可能になる[2][31][32]。ひずみのあるオレフィンがさらに反応性を持つため、生成物の平衡分布が観察される。しかしながら、この平衡は望ましいRCM生成物が有利なように生成物比をひっくり返すための様々な手法を用いて動かすことができる[33][34]。

同じ分子上に反応性基が互いに遭遇する確率は環の大きさに反比例するため、必要な分子内環化付加反応は環の大きさが増大するにつれて難しくなる。この関係は、分子環反応を低減するために、大きな環のRCMが高希釈条件(0.05-100 mM)下でしばしば行われることを意味する(上図A)[2][35]。それに対して、一般的な環のRCMはより高い濃度、まれには無溶媒でも行うことができる[36][37]。平衡反応は、温度を上げることで(上図B)反応混合物の粘度を低下させ、それによって熱運動を上昇させることによって、また反応時間を長くしたり短くしたりすることによって(下図C)、望ましい熱力学的生成物へと偏らせることができる[30][38]。
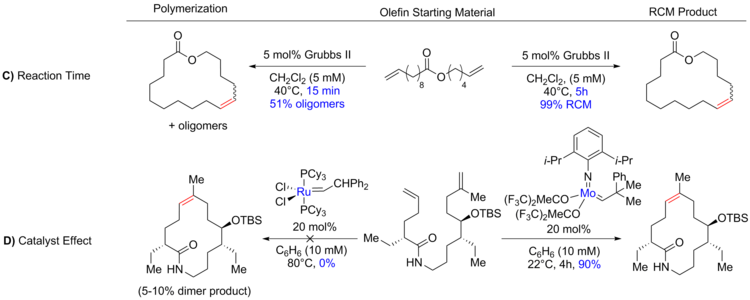
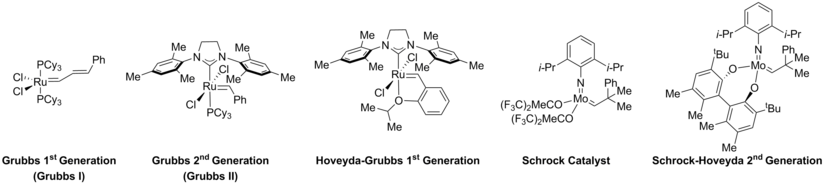
触媒選択(上図D)も生成物形成を制御するうえで非常に重要であることが明らかにされている。閉環メタセシスで一般的に使用される触媒のいくつかを下に示す[11][39][40][41]。
反応の適用範囲
[編集]アルケン基質
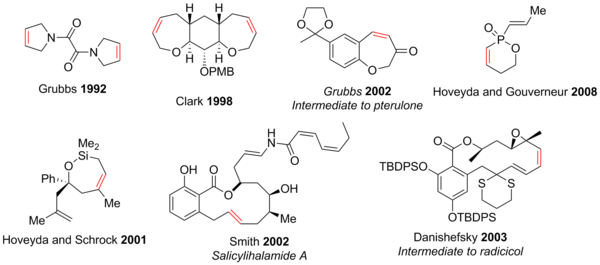
[編集]閉環メタセシスは5-30員環[42]、多環式化合物、N、O、S、P、そしてSiといった原子を含む複素環式化合物の合成における有用性が示されている[2][3][43][44]。現代のRCM反応の官能基許容性によって、エポキシドやケトン、アルコール、エーテル、アミン、アミドなどといった幅広い官能基を含む構造的に複雑な化合物の合成が、以前の方法よりも容易に達成することができる。酸素ならびに窒素複素環式化合物が、天然物および薬剤において豊富なため多数を占めている。いくつかの例を下に示す(赤色のアルケンはRCMによって形成されたC-C結合を示している)[3]。
末端アルケンに加えて、三ならびに四置換アルケンが、置換環式オレフィン生成物を得るためにRCM反応において使用されている[32]。閉環メタセシスはまた、アルキンを含む環を巻くためにも使われている。この反応では、新しい末端アルケンが生成したり、あるいは2回目の環化が起こり二環式化合物が形成される。この種の反応はより正式にはエンイン閉環メタセシスと呼ばれている[7][45]。

E/Z選択性
[編集]RCM反応では、E型とZ型幾何異性体のどちらも形成されうる。立体選択性は触媒や環ひずみ、出発物質のジエンに依存する。より小さな環では、環ひずみの最小化を反映して、より安定な生成物としてZ型異性体が主に得られる[46]。大員環では、E型異性体がZ型異性体と比較してより安定であるため、RCM反応における熱力学的偏りの結果としてE型異性体がしばしば得られる。一般的な傾向として、ルテニウムNHC(N-ヘテロ環状カルベン)触媒はE選択性を好み、トランス異性体を形成する。これは部分的には置換基間の立体衝突による。置換基はメタラシクロブタン中間体においてより安定な配座としてトランス配座をとり、その結果E型異性体が形成される[21]。立体的に純粋なZ型異性体の合成は閉環アルキンメタセシスによって以前に達成された。しかしながら、2013年にグラブスはキレート型ルテニウム触媒を使用した高選択的Z-マクロサイクルの合成について報告した。この選択性は、触媒配位子と形成されるメタラシクロブタン中間体との間の立体衝突が増大したことによるものである。遷移状態における増大した立体的相互作用はE型ではなくZ型オレフィンの形成につながる。これは、E型異性体を形成するために必要な遷移状態が大変不利なためである[47]。

助触媒
[編集]添加剤も配座の優先傾向をひっくり返したり、反応濃度を上昇させたり、触媒に結合しうるエステルやアミドといった高度に極性な基をキレートしたりするために使われる[2]。オルトチタン酸テトライソプロピル(Ti(Oi-Pr)4))は、触媒被毒を防ぐために極性基をキレートするために一般的に用いられる。エステルの場合は、このチタン系ルイス酸はカルボニル酸素原子に結合する。この酸素原子がチタンによってキレートされると、もはや触媒のルテニウム金属に結合することはできない(金属への結合は触媒の不活性化をもたらす)。これによって、出発物質の二量化なしに高い有効濃度で反応を行うことも可能になる[48]。

別の古典的例として、中員環の環化ラクトン化で、優先するZ型(syn型)配座のエステルよりもE型(anti型)配座を取らせるために嵩高いルイス酸を使用した研究がある。ある研究では、7員環ラクトンを形成するために、アルミニウム トリス(2,6-ジフェニルフェノキシド)(ATPH)が添加された。このアルミニウム金属は基質のカルボニル酸素と結合し、嵩高いジフェニルフェノキシド基をエステル化合物にごく接近させる。その結果、エステルは不利な立体的相互作用を最小化するためにE型(anti型)配座異性体をとる。このルイス酸なしでは、二量化した14員環のみが得られた[49]。

2つの反応性アルケンをごく接近させるようなやり方で分子を配置することによって、分子間クロスメタセシスが起こる可能性が最小化される。
制限事項
[編集]ルテニウム触媒を使った多くのメタセシス反応は新たに形成された二重結合の望まない異性化によって妨げられ、副反応として形成される水素化ルテニウムがこの原因であると考えられている。ある研究[50]では、ジアリルエーテルのRCM反応において、異性化はこれらの水素化物を除去することができる特定の添加剤を用いることで抑制されることが見出された。添加剤なしでは、反応生成物として期待される2,5-ジヒドロフラン(エチレンガスも同時に形成される)ではなく、2,3-ジヒドロフランが得られる。TEMPOやフェノールといったラジカル捕捉剤は異性化を抑制しない。しかしながら、1,4-ベンゾキノンや酢酸といった添加剤は望まない異性化を防ぐことができる。どちらの添加剤も水素化ルテニウムを酸化することができ、これによってそれらの効果が説明できる。

RCMに付随する別の よくある問題として、一部の環化で必要な高希釈条件による触媒分解の恐れがある。低濃度での大規模反応から生成される大量の廃棄物のため、高希釈は工業的利用における制限要因でもある[2]。選択性を損うことなく反応濃度を増加させるための努力が行われている[51]。
合成反応への応用
[編集]閉環メタセシスは歴史的に、数え切れないほど多くの有機合成において用いられてきており、今日も様々な化合物の合成に使用され続けている。以下の例はRCMの多くの可能性がある幅広い有用性のわずかな見本である。その他の例は多くの総説が出版されているため、それらを参照されたい[2][3][13][42]。
閉環メタセシスは全合成において重要である。一つの例は、天然に存在するシクロファンであるフロレソリド(floresolide)の合成における12員環の形成でのRCMの使用である。フロレソリドBはApidium属のホヤから単離され、KB腫瘍細胞株に対して細胞毒性を示す。2005年、K・C・ニコラウらは、第二世代グラブス触媒を使用した合成終盤での閉環メタセシスによって、89%の収率でEおよびZ型異性体の混合物(E/Z = 1:3)を得て、両異性体の合成を完了した。一つのプロキラル中心が存在するものの、生成物はラセミ体である。フロレソリドは、(遷移状態における立体的制約によって)カルボニル基の後側ではなく前側を通って新たな環が形成されるため、回転異性体である。カルボニル基は次にこの環を決まった位置に永久に固定する。E/Z異性体は次に分離され、最終段階でフェノールのニトロ安息香酸エステル保護基を炭酸カルシウムによって除去することで最終生成物と非天然型のZ型異性体が得られた[52]。

1995年、グラブスらはRCMで可能となる立体選択性を浮かび上がらせた。グラブスらのグループはβ-ターンを形成する内部水素結合を持つジエンを合成した。この水素結合は、メタセシスが起こる寸前である両ジエンがごく接近したマクロサイクル前駆体を安定化させた。ジアステレオマーの混合物をこの反応条件に供した後、オレフィンβ-ターンの一方のジアステレオマーのみが得られた。次に、(S,S,S) ならびに (R,S,R) ペプチドを用いて実験が繰り返された。(S,S,S) ジアステレオマーのぎあ反応性があり、閉環を可能とするために必要な立体配置が示された。オレフィン生成物の絶対配置がBalaramのジスルフィドペプチドを模倣していることも興味深い[53]。

8-11員環における環ひずみは、RCMで難易度が高いことが証明されてきた。しかしながら、これらの環系が合成された多くの研究例が存在する[3]。1997年、Fürstnerは最終段階のRCMによってジャスミンのケトラクトン(E/Z)を得る簡易な合成を報告した。当時、RCMによる10員環の形成は報告されておらず、以前の同化合物の合成は、デカノリドを作るためのマクロラクトン化を含む経路を用いており、しばしば長かった。加熱還流したトルエンに12時間かけてジエンおよび触媒を加えることによって、Fürstnerはオリゴマー化を避けることができ、88%の収率でE/Z型異性体を得ることができた。興味深いことには、CH2Cl2が1:2.5の比でZ型異性体の形成を優先したのに対して、トルエンでは1:1.4の比しか得られなかったことである[54]。

2000年、Alois Fürstnerは、7員環複素環中間体の形成にRCMを使用した(−)-バラノールの8段階での合成を報告した。バラノールはVerticillium balanoidesから単離された代謝物であり、プロテインキナーゼC(PKC)に対して阻害作用を示す。閉環メタセシスの段階では、ルテニウム・インデニリテン錯体がプレ触媒として使われ、望む7員環が87%の収率で得られた[55]。

2002年、スティーブン・F・マーティンらは、閉環メタセシスを2回使用した多環式アルカロイドであるマンザミンAの24段階での合成を報告した[56]。天然物であるマンザミンは沖縄沖のカイメンから単離された。マンザミンは抗腫瘍化合物としての将来性のためによい合成標的である。最初のRCM段階は13員環のD環の構築でZ型異性体のみが67%の収率で得られた。これはメタセシスが通常はE型異性体を優先的に生成するのとは珍しい対比であった。さらなる変換の後、2回目のRCMでは、化学量論量の第一世代グラブス触媒を使用して26%の収率で8員環のE環が構築された。この合成は、メタセシス反応の官能基許容性と様々な大きさの環の複雑な分子と構築できる能力を浮かび上がらせている[56]。

2003年、ダニシェフスキーらは、Streptomyces属菌から単離されたマクロライドである(+)-ミグラスタチンの全合成を報告した[57]。ミグラスタチン(migrastatin)は腫瘍細胞の遊走(migration)を阻害する。このマクロライドはRCMによって形成された14員環複素環を含む。メタセシス反応では、 (E,E,Z) 異性体の保護ミグラスタチンのみが収率70%で得られた。この選択性は、より障害の少ないオレフィンにル付加し、次に最も近づきやすいオレフィンへと環化するこのルテニウム触媒の優先傾向が原因であると報告されている。最終段階のシリルエーテルの脱保護で (+)-ミグラスタチンが得られた[57]。

全体としては、閉環メタセシスは、様々な大きさと化学的性質の環状化合物を容易に得るための非常に有用な反応である。しかしながら、高希釈条件、選択性、望まない異性化といったいくかの制限も持つ。
脚注
[編集]- ^ Carey, F. A.; Sunburg, R. J. (2010). “Reactions Involving Transition Metals”. Advanced Organic Chemistry: Reaction and Synthesis. Part B (5th ed.). New York: Springer. pp. 761-767. ISBN 978-0387683546
- ^ a b c d e f g h i j k Monfette, S.; Fogg, D. E. (2009). “Equilibrium Ring-Closing Metathesis”. Chem. Rev. 109 (8): 3783-3816. doi:10.1021/cr800541y.
- ^ a b c d e f g Deiters, A.; Martin, S. F. (2004). “Synthesis of Oxygen- and Nitrogen-Containing Heterocycles by Ring-Closing Metathesis”. Chem. Rev. 104 (5): 2199-2238. doi:10.1021/cr0200872.
- ^ Cain, M. F.; Forrest, W. P.; Peryshkov, R. V.; Schrock, R. R. Muller, P. (2013). “Synthesis of a TREN in Which the Aryl Substituents are Part of a 45 Atom Macrocycle”. J. Am. Chem. Soc. 135 (41): 15338-15341. doi:10.1021/ja408964g.
- ^ Dasgupta, S.; Wu, J. (2011). “Template-directed synthesis of kinetically and thermodynamically stable molecular necklace using ring closing metathesis”. Org. Biomol. Chem. 9: 3504-3515. doi:10.1039/c0ob01034k.
- ^ Song, K. H.; Kang, S. O.; Ko, (2007). “Template Synthesis of a Huge Macrocycle by Olefin Metathesis Using Easily Accessible [Pt(PEt3)2] Templates”. Chem. Eur. J. 13 (18): 5129–5134. doi:10.1002/chem.200700213.
- ^ a b c Schmalz, H.-G. (1995). “Catalytic Ring-Closing Metathesis : A New, Powerful Technique for Carbon- Carbon Coupling in Organic Synthesis”. Angew. Chem. Int. Ed. Engl. 34 (17): 1833-1836. doi:10.1002/anie.199518331.
- ^ a b Villemin, D. (1980). “Synthese de Macrolides par Metathese”. Tetrahedron Lett. 21 (18): 1715-1718. doi:10.1016/S0040-4039(00)77818-X.
- ^ Grubbs, R. H. (2006). “Olefin-Metathesis Catalysts for the Preparation of Molecules and Materials (Nobel Lecture)”. Angew. Chem. Int. Ed. 45 (23): 3760–3765. doi:10.1002/anie.200600680.
- ^ Schrock, R. R. (2006). “Multiple Metal–Carbon Bonds for Catalytic Metathesis Reactions (Nobel Lecture)”. Angew. Chem. Int. Ed. 45 (23): 3748-3759. doi:10.1002/anie.200600085.
- ^ a b Trnka, T. M.; Grubbs, R. H. (2001). “The Development of L2X2Ru=CHR Olefin Metathesis Catalysts: An Organometallic Success Story”. Acc. Chem. Res. 34 (1): 18-29. doi:10.1021/ar000114f.
- ^ a b Furstner, A. (2000). “Olefin Metathesis and Beyond”. Angew. Chem. Int. Ed. 39 (17): 3012-3043. doi:10.1002/1521-3773(20000901)39:17<3012::AID-ANIE3012>3.0.CO;2-G.
- ^ a b Gradillas, A.; Perez-Castells, J. (2006). “Macrocyclization by Ring-Closing Metathesis in the Total Synthesis of Natural Products: Reaction Conditions and Limitations”. Angew. Chem. Int. Ed. 45: 6086-6101. doi:10.1002/anie.200600641.
- ^ Tsuji, J.; Hashiguchi, S. (1980). “Application of Olefin Metathesis to Organic Synthesis. Syntheses of Civetone and Macrolides”. Tetrahedron Lett. 21 (31): 2955-2958. doi:10.1016/0040-4039(80)88007-5.
- ^ Warwel, S.; Kätker, H. (1987). “Eine einfache Synthese makrocyclischer Kohlenwasserstoffe durch Metathese von Cycloolefinen”. Synthesis 1987 (10): 935-937. doi:10.1055/s-1987-28129.
- ^ a b c Fu, G. C.; Grubbs, R. H. (1992). “The Application of Catalytic Ring-Closing Olefin Metathesis to the Synthesis of Unsaturated Oxygen Heterocycles”. J. Am. Chem. Soc. 114 (13): 5426-5427. doi:10.1021/ja00039a065.
- ^ a b Fu, G. C.; Grubbs, R. H. (1992). “Synthesis of Nitrogen Heterocycles via Catalytic RingClosing Metathesis of Dienes”. J. Am. Chem. Soc. 114 (18): 7324-7325. doi:10.1021/ja00044a070.
- ^ Fu, G. C.; Grubbs, R. H. (1993). “Synthesis of cycloalkenes via alkylidene-mediated olefin metathesis and carbonyl olefination”. J. Am. Chem. Soc. 115 (9): 3800-3801. doi:10.1021/ja00062a066.
- ^ Fu, G. C.; Nguyen, S. T.; Grubbs, R. H. (1993). “Catalytic Ring-Closing Metathesis of Functionalized Dienes by a Ruthenium Carbene Complex”. J. Am. Chem. Soc. 115 (21): 9856-9857. doi:10.1021/ja00074a085.
- ^ Chauvin, Y. (2006). “Olefin Metathesis: The Early Days (Nobel Lecture)”. Angew. Chem. Int. Ed. 43 (23): 3740-3747. doi:10.1002/anie.200601234.
- ^ a b c Crabtree, R. H. (2014). The Organometallic Chemistry of the Transition Metals (6th ed.). New Jersey: John Wiley & Sons, Inc.. pp. 318-322. ISBN 978-1118138076
- ^ Herisson, J-L.; Chauvin, Y. (1971). “Catalyse de transformation des olefines par les complexes du tungsten”. Makromolekulare Chemie 141 (1): 161-176. doi:10.1002/macp.1971.021410112.
- ^ Stewart, I. C.; Keitz, B. K.; Kuhn, K. M.; Thomas, R. M.; Grubbs, R. H. (2010). “Nonproductive Events in Ring-Closing Metathesis Using Ruthenium Catalysts”. J. Am. Chem. Soc. 132 (25): 8534-8535. doi:10.1021/ja1029045.
- ^ a b Grossman, R. B. (2003). “Transition-Metal-Catalyzed & -Mediated Reactions”. The Art of Writing Reasonable Organic Reaction Mechanisms (2nd ed.). New York: Springer. pp. 324-325. ISBN 978-0387954684
- ^ Ansyln, E. V.; Dougherty, D. A. (2006). “Organotransition Metal Reaction Mechanisms and Catalysts”. In Murdzek, J., Ed.. Modern Physical Organic Chemistry. University Science Books. pp. 745-746. ISBN 1891389319
- ^ Lee, C. W.; Grubbs, R. H. (2001). “Formation of Macrocycles via Ring-Closing Olefin Metathesis”. J. Org. Chem. 66 (21): 7155-7158. doi:10.1021/jo0158480.
- ^ a b c “Ring Closure Reactions of Bifunctional Chain Molecules”. Acc. Chem. Res. 14 (5): 95-102. (1981). doi:10.1021/ar00064a001.
- ^ “32. The Olefin Metathesis Reaction” (PDF). 2017年6月9日閲覧。
- ^ Anslyn, E. V.; Dougherty, D. A. (2006). “Strain and Stability”. In Murdzek, J., Ed.. Modern Physical Organic Chemistry. University Science Books. pp. 107-111
- ^ a b Conrad, J. C.; Eelman, M. D.; Duarte Silva, J. A.; Monfette, S.; Parnas, H. H.; Snelgrove, J. L.; Fogg, D. E. (2007). “Oligomers as Intermediates in Ring-Closing Metathesis”. J. Am. Chem. Soc. 129 (5): 1024-1025. doi:10.1021/ja067531t.
- ^ Hocker, H. (1991). “Metathesis polymerization - stepwise or chain growth reaction?”. J. Mol. Catal. 65 (1-2): 95–99. doi:10.1016/0304-5102(91)85086-H.
- ^ a b Stewart, I. C.; Ung, T.; Pletnev, A. A.; Berlin, J. B.; Grubbs, R. H.; Schrodi, Y. (2007). “Highly Efficient Ruthenium Catalysts for the Formation of Tetrasubstituted Olefins via Ring-Closing Metathesis”. Org. Lett. 9 (8): 1589-1592. doi:10.1021/ol0705144.
- ^ Forbes, M. D. E.; Patton, J. T.; Myers, T. L.; Maynard, H. D.; Smith, Jr. D. W.; Schulz, G. R.; Wagener, K. B. (1992). “Solvent-Free Cyclization of Linear Dienes Using Olefin Metathesis and the Thorpe lngold Effect”. J. Am. Chem. Soc. 114 (27): 10978-10980. doi:10.1021/ja00053a054.
- ^ Yamamoto, K.; Biswas, K.; Gaul, C.; Danishefsky, S. J. (2003). “Effects of temperature and concentration in some ring closing metathesis reactions”. Tetrahedron Lett. 44 (16): 3297–3299. doi:10.1016/S0040-4039(03)00618-X.
- ^ Arakawa, K.; Eguchi, T.; Kakinuma, K. (1998). “An Olefin Metathesis Approach to 36- and 72-Membered Archaeal Macrocyclic Membrane Lipids”. J. Org. Chem. 63 (14): 4741–4745. doi:10.1021/jo980472k.
- ^ Kuhn, K. M.; Champagne, T. M.; Hong, S. H.; Wei, W-H.; Nickel, A.; Lee, C. W.; Virgil, S. C.; Grubbs, R. H.; Pederson, R. L. (2010). “Low Catalyst Loadings in Olefin Metathesis: Synthesis of Nitrogen Heterocycles by Ring-Closing Metathesis”. Org. Lett. 12 (5): 984-987. doi:10.1021/ol9029808.
- ^ Bach, T.; Lemarchand, A. (2002). “Synthesis of Ansa-Bridged Macrocyclic Lactams Related to the Antitumor Antibiotic Geldanamycin by Ring Closing Metathesis”. Synlett 8: 1302-1304. doi:10.1055/s-2002-32958.
- ^ Crimmins, M. T.; Brown, B. H. (2004). “An Intramolecular Diels-Alder Approach to the Eunicelins: Enantioselective Total Synthesis of Ophirin B”. J. Am. Chem. Soc. 126 (33): 10264–10266. doi:10.1021/ja046574b.
- ^ Xu, Z.; Johannes, C. W.; Houri, A. F.; La, D. S.; Cogan, D. A.; Hofilena, G. E.; Hoveyda, A. H. (1997). “Applications of Zr-Catalyzed Carbomagnesation and Mo-Catalyzed Macrocyclic Ring Closing Metathesis in Asymmetric Synthesis. Enantioselective Total Synthesis of Sch 38516 (Fluvirucin B1)”. J. Am. Chem. Soc. 119 (43): 10302–10316. doi:10.1021/ja972191k.
- ^ Furstner, A.; Thiel, O. R.; Ackermann, L. (2001). “Exploiting the Reversibility of Olefin Metathesis. Syntheses of Macrocyclic Trisubstituted Alkenes and (R,R)-(−)-Pyrenophorin”. Org. Lett. 3 (3): 449–451. doi:10.1021/ol0069554.
- ^ Furstner, A.; Thiel, O. R.; Kindler, N.; Bartkowska, B. (2000). “Total Syntheses of (S)-(−)-Zearalenone and Lasiodiplodin Reveal Superior Metathesis Activity of Ruthenium Carbene Complexes with Imidazol-2-ylidene Ligands”. J. Org. Chem. 65 (23): 7990–7995. doi:10.1021/jo0009999.
- ^ a b “Ring Closing Metathesis (RCM)”. Organic Chemistry Portal. 2017年6月9日閲覧。
- ^ Harvey, J. S.; Malcolmson, S. J.; Dunne, K. S.; Meek, S. J.; Thompson, A. L.; Schrock, R. R.; Hoveyda, A. H.; Gouverneur, V. (2008). “Enantioselective Synthesis of P-Stereogenic phosphinates and Phosphine Oxides by Molybdenum-Catalyzed Asymmetric Ring-Closing Metathesis”. Angew. Chem. Int. Ed. 48 (4): 762-766. doi:10.1002/anie.200805066.
- ^ Kiely, A. F.; Jernelius, J. A.; Schrock, R. R.; Hoveyda, A. H. (2002). “Enantioselective Synthesis of Medium-Ring Heterocycles, Tertiary Ethers, and Tertiary Alcohols by Mo-Catalyzed Ring-Closing Metathesis”. J. Am. Chem. Soc. 124 (12): 2868-2869. doi:10.1021/ja012679s.
- ^ Kim, S.-H.; Bowden, N.; Grubbs, R. H. (1994). “Catalytic Ring Closing Metathesis of Dienynes: Construction of Fused Bicyclic Rings”. J. Am. Chem. Soc. 116 (23): 10801-10802. doi:10.1021/ja00102a062.
- ^ Anslyn, E. V.; Dougherty, D. A. (2006). “Strain and Stability”. In Murdzek, J., Ed.. Modern Physical Organic Chemistry. University Science Books. pp. 110-114. ISBN 1891389319
- ^ Marx, V. M.; Keitz, B. K.; Grubbs, R. H. (2013). “Stereoselective Access to Z and E Macrocycles by Ruthenium-Catalyzed Z‑Selective Ring-Closing Metathesis and Ethenolysis”. J. Am. Chem. Soc. 135 (1): 94-97. doi:10.1021/ja311241q.
- ^ Mitchell, L.; Parkinson, J. A.; Percy, J. M.; Singh, K. (2008). “Selected Substituent Effects on the Rate and Efficiency of Formation of an Eight-Membered Ring by RCM”. J. Org. Chem. 73 (6): 2389–2395. doi:10.1021/jo702726b.
- ^ Pentzer, E. B.; Gadzikwa, T.; Nguyen, S. T. (2008). “Substrate Encapsulation: An Efficient Strategy for the RCM Synthesis of Unsaturated ϵ-Lactones”. Org. Lett. 10 (24): 5613-5615. doi:10.1021/ol8022227.
- ^ Hong, S. H.; Sanders, D. P.; Lee, C. W.; Grubbs, R. H. (2005). “Prevention of Undesirable Isomerization during Olefin Metathesis”. J. Am. Chem. Soc. 127 (49): 17160–17161. doi:10.1021/ja052939w. PMID 16332044.
- ^ Raymond, M.; Holtz-Mulholland, M.; Collins, S. K. (2014). “Macrocyclic Olefin Metathesis at High Concentrations by Using a Phase-Separation Strategy”. Chem. Eur. J. 20 (4): 12763-12767. doi:10.1002/chem.201404202.
- ^ Nicolaou, K. C.; Xu, H. (2006). “Total synthesis of floresolide B and 6,7-Z-floresolide B”. Chem. Commun 6: 600-602. doi:10.1039/B517385J.
- ^ Miller, S. J.; Grubbs, R. H. (1995). “Synthesis of Conformationally Restricted Amino Acids and Peptides Employing Olefin Metathesis”. J. Am. Chem. Soc. 117 (21): 5855-5856. doi:10.1021/ja00126a027.
- ^ Fürstner, A.; Müller, T. (1997). “The First Synthesis of a 10-Membered Ring by Olefin Metathesis: Jasmine Ketolactone”. Syn. Lett. 8: 1010-1012. doi:10.1055/s-1997-930.
- ^ Fürstner, A.; Thiel, O. R. (2000). “Formal Total Synthesis of (−)-Balanol: Concise Approach to the Hexahydroazepine Segment Based on RCM”. J. Org. Chem. 65 (6): 1738-1742. doi:10.1021/jo991611g.
- ^ a b Humphrey, J. H.; Liao, Y.; Ali, A.; Rein, T.; Wong, Y.-L.; Chen, H.-J.; Courtney, A. K.; Martin, S. F. (2002). “Enantioselective Total Syntheses of Manzamine A and Related Alkaloids”. J. Am. Chem. Soc. 124 (29): 8584-8592. doi:10.1021/ja0202964.
- ^ a b Gaul, C.; Njardarson, J. T.; Danishefsky, S. J. (2003). “The Total Synthesis of (+)-Migrastatin”. J. Am. Chem. Soc. 125 (20): 6042-6043. doi:10.1021/ja0349103.
関連項目
[編集]外部リンク
[編集]- Ring-closing metathesis at Organic Reactions Wiki
- Ring-Closing Metathesis at organic-chemistry.org
- Sigma-Aldrich Ring-Closing Metathesis at sigmaaldrich.com
- The Olefin Metathesis Reaction Andrew Myers’ Group Notes
