アズレン
| アズレン | |
|---|---|

| |

| |
ビシクロ-[5.3.0]-デカ- | |
| 識別情報 | |
| CAS登録番号 | 275-51-4 |
| KEGG | C13392 |
| |
| 特性 | |
| 化学式 | C10H8 |
| モル質量 | 128.17 g/mol |
| 外観 | 濃青色結晶 |
| 融点 |
99–100 °C |
| 沸点 |
242 °C |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
アズレン(英: azulene)は10個の炭素原子と8個の水素原子からなる炭化水素で、ナフタレンの構造異性体にあたる。分子式は C10H8、分子量128.17、融点99–100 °C、沸点242 °C。ナフタレンのような特有のにおいを持つ、代表的な非ベンゼン系芳香族化合物である。後述する、アルキル基で置換されたアズレンはモノテルペンにも分類される。
概要
[編集]アズレンは濃青色の昇華性の高い結晶であり、これはナフタレンやその他多くの炭化水素が無色透明であることと対照的である。名称もスペイン語で「青い」を意味する "azul" に由来する。消炎作用があり、副作用の心配がほとんどないため、昔から肌の炎症を抑えるために化粧品やせっけん、入浴剤などの日用品に用いられており、鼻、のど、胃などの炎症を抑えるためにうがい薬、目薬、胃薬などの医薬品としても用いられている。
その歴史は古く、15世紀にはカモミールの水蒸気蒸留によってアズレンを含む濃青色の精油が得られていた。1863年にイギリスの調香師セプティマス・ピース(ピース&リュバンの共同創設者)によりノコギリソウやニガヨモギから単離され、彼によって命名された。レオポルト・ルジチカがアズレンの構造を解明し、1937年にスイスの化学者プラチドゥス・アンドレアス・プラットナー (Placidus Andreas Plattner, 1904年–1975年) によって初めて合成された。今日ではいくつかの合成法が知られている[1][2]。
水には溶けず、有機溶媒に溶ける。
構造
[編集]
ナフタレンが2つのベンゼン環の一辺を共有する構造である一方、アズレンは7員環と5員環が縮環した構造を持つ。ナフタレンと同様に10個のπ電子を含む共鳴構造を持つが、共鳴安定化エネルギーはナフタレンの半分である。双極子モーメントが0であるナフタレンと対照的に、アズレンの双極子モーメントは1.08 D,[3]である。この分極は、それぞれ芳香族性を有する6π電子構造のシクロヘプタトリエニウムイオン(トロピリウムイオン)とシクロペンタジエニルアニオンが縮環した構造としてアズレンを見ることによって説明できる。その極性のため、求電子的反応は5員環側で、求核的反応は7員環側で受けやすい。ナフタレンなどより芳香族性はやや低く、水素化などの反応を受け付けやすい性質がある。
アズレンはカシャの法則から逃れる分子として知られており、その誘導体もまた最低励起一重項状態から蛍光しないものが多い。
合成
[編集]特異な構造から、アズレンの合成法は化学者たちの関心の対象となってきた[4]。現在もアズレンの合成は困難であり、2019年現在、単価は250 mgで10500円となっている[5]。
1939年のプラットナーらによる初の合成は、インダンとジアゾ酢酸エチルによるものであった[6]。
効果的なアズレンのワンポット合成は、シクロヘキサジエンとC5のシントンを環化させるものである[7]。
また、以下のようなシクロヘプタトリエンをジクロロケテンと反応させる方法も知られる[8][9]。
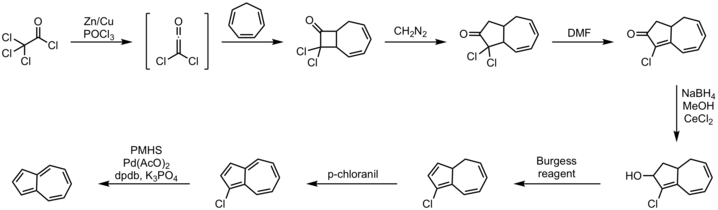
実験室においては、ピリジンと2,4-ジニトロクロロベンゼンを反応させ(ジンケ反応)、これをジメチルアミンと反応させて生じるジンケアルデヒドをシクロペンタジエンと反応させる方法が知られる[10][11]。この方法では、ジンケアルデヒドをシクロペンタジエンと反応させる際に125 °Cで4日間撹拌し、生成物をカラムクロマトグラフィーで分離するなど長時間を要するが、生成したアズレンは昇華しやすいため分留した溶媒にも移ってしまい、収率は良くない。
誘導体
[編集]5・7員環が縮環したテルペン類を加熱することにより、脱水・空気酸化を受けてアズレン骨格を生ずる。1,4-ジメチル-7-イソプロピルアズレンがユソウボクに由来するグアイアズレンとして、4,8-ジメチル-2-イソプロピルアズレンがベチバー油の主成分であるベチバズレンとして、それぞれ知られている。これらは穏やかな抗炎症作用を持つため、古くから民間薬として用いられてきた。現在でもその誘導体が目薬・胃薬などに配合され、一般に使用されている。この他にも、カモミールやノコギリソウに含まれるプロアズレンことマトリシン、マトリシンから生合成されるカマズレンなどが知られる。
医薬品の中で、含嗽用アズレンと呼ばれる化合物があるが、これは 1-アズレンスルホン酸ナトリウム(正確にはグアイアズレンスルホン酸ナトリウム)を指す。スルホン酸塩とすることで水溶性が高められており、抗炎症作用を利用したうがい薬、点眼薬などが市販されている。また、水溶性アズレンとL-グルタミンを配合したものが「マーズレン」(寿製薬)、「グリマック」(沢井製薬)の名で消化性潰瘍、胃炎の治療薬として用いられている。
世界中に産する青いベニタケ科のキノコ・ルリハツタケ(Lactarius indigo)の発色成分はステアリン酸(7-イソプロペニル-4-メチルアズレン-1-イル)メチルである。また、ニュージーランドに自生するイッポンシメジ属のEntoloma hochstetteriの発色成分として7-アセチル-1,4-ジメチルアズレンが発見されている[12]。

2013年には、山形大学の山口裕二らにより三量体の2,6:2',6"-テルアズレンが合成され、n型半導体となることが判明した[13][14]。
参考文献
[編集]- ^ Hafner, K.; Meinhardt, K.-P. "Azulene". Org. Synth., Coll. Vol. 7, p.15 (1990); Vol. 62, p.134 (1984). アズレンの合成(英語)
- ^ Carret, S.; Blanc, A.; Coquerel, Y.; Berthod, M.; Greene, A. E.; Deprés, J.-P. "Approach to the Blues: A Highly Flexible Route to the Azulenes". Angew. Chem., Int. Ed. 2005, 44, 5130–5133. DOI: 10.1002/anie.200501276
- ^ Anderson, Arthur G.; Steckler, Bernard M. (1959). “Azulene. VIII. A Study of the Visible Absorption Spectra and Dipole Moments of Some 1- and 1,3-Substituted Azulenes”. Journal of the American Chemical Society 81 (18): 4941–4946. doi:10.1021/ja01527a046.
- ^ Gordon, Maxwell (1 February 1952). “The Azulenes.”. Chemical Reviews 50 (1): 127–200. doi:10.1021/cr60155a004.
- ^ アズレン、富士フイルム和光純薬
- ^ Zur Kenntnis der flüchtigen Pflanzenstoffe VIII. Synthese des Vetivazulens Alexander St. Pfau, Pl. A. Plattner Helvetica Chimica Acta Volume 22 Issue 1, Pages 202–08 1939 doi:10.1002/hlca.19390220126
- ^ Klaus Hafner; Klaus-Peter Meinhardt (1984). Azulene. 62. pp. 134. doi:10.15227/orgsyn.062.0134.
- ^ Sébastien Carret, Aurélien Blanc, Yoann Coquerel, Mikaël Berthod, Andrew E. Greene, Jean-Pierre Deprés (2005). “Approach to the Blues: A Highly Flexible Route to the Azulenes”. Angewandte Chemie International Edition 44 (32): 5130–5133. doi:10.1002/anie.200501276. PMID 16013070.
- ^ D. M. Lemal; G. D. Goldman (1988). “Synthesis of azulene, a blue hydrocarbon”. Journal of Chemical Education 65 (10): 923. Bibcode: 1988JChEd..65..923L. doi:10.1021/ed065p923.
- ^ Hafner , K.; Meinhardt , K.-P. (1984). "AZULENE". Organic Syntheses (英語). 62: 134. doi:10.15227/orgsyn.062.0134。
- ^ アズレン、山口大学村藤研究室
- ^ Nicholas, Gillian May (1998). Australasian fungi: a natural product study (Thesis). p. 56. doi:10.26021/9162。
- ^ Yuji Yamaguchi, Keisuke Ogawa, Ken-ichi Nakayama, Yoshihiro Ohba, and Hiroshi Katagiri (2013). “Terazulene: A High-Performance n-Type Organic Field-Effect Transistor Based on Molecular Orbital Distribution Control”. J. Am. Chem. Soc. 135: 19095–19098 . doi:10.1021/ja410696j.
- ^ 【有機半導体】Terazulene: A High-Performance n ‑ Type Organic Field-Effect Transistor Based on Molecular Orbital Distribution Control、ChemASAP
外部リンク
[編集]- 青い炭化水素:アズレン - 有機化学美術館
