インフルエンザワクチン
 インフルエンザワクチンの接種を受けるアメリカ海軍の兵士 | |
| ワクチン概要 | |
|---|---|
| 病気 | インフルエンザウイルス |
| 臨床データ | |
| 販売名 | Fluarix, Fluzone, など |
| 胎児危険度分類 | |
| 法的規制 |
|
| データベースID | |
| ATCコード | J07BB01 (WHO) |
| ChemSpider | none |
| インフルエンザ |
|---|
 |
インフルエンザワクチンは、インフルエンザウイルスに対するワクチンである。本記事ではヒトを対象とする。インフルエンザウイルスは変異型が多いため、主に冬季に流行する季節性インフルエンザワクチンの対象とするウイルス株は毎年変更される。ただ、インフルエンザワクチンは、そのワクチンに含まれていないインフルエンザの型に感染した場合にも、ある程度インフルエンザの重症度を低下させることができるともされている[2]。不活化ワクチンと弱毒性ワクチン(生ワクチン)とがある。接種経路として、筋肉内注射、鼻に噴霧する経鼻接種、皮膚の中間層に注入する皮内注射が存在する[3]。その有効性は毎年変動するものの、インフルエンザの発症に対する高い予防効果が存在する[3][4]。
世界保健機関 (WHO) およびアメリカ疾病予防管理センター (CDC) は、生後6か月以上のすべての人々、特にインフルエンザへの罹患リスクの高い人々に対して、毎年のインフルエンザワクチン接種を推奨している[3][5]。欧州疾病予防管理センター (ECDC) も同様に、高リスクの人々に対して、毎年インフルエンザワクチンを接種することを推奨している[6]。これらの高リスクグループには、妊娠中の女性、高齢者、6か月から5歳の子供、健康問題を抱えている人、医療従事者が含まれる[3]。接種してもインフルエンザを発症する可能性が全くなくなるわけではない[2]。不活化インフルエンザワクチンによるインフルエンザの発症予防効果は、小児で25-60%、成人で50-60%とされている[7]。2歳未満、65歳を超える高齢者では証拠の品質が低く効果のための結論が導けない[8][9]。全ての人々がワクチンを接種しても、理論的に集団免疫の獲得には至らない[10]。ワクチンを接種して、抗体が産生されて効果が出現するまでには約2 - 3週間を要する[11][12]。また、獲得した防御免疫の効果が継続する期間は、接種後3 - 4か月であると考えられている[12]。
ワクチンは、一般的に安全であるとされているが、副反応(一般的な医薬品における副作用)も存在する。ワクチン接種による副反応として、予防接種を受けた子供の5から10%で発熱が認められ、疲労感や筋肉痛も発生する可能性がある[3]。高齢者については、ギラン・バレー症候群が接種100万回あたり約1例の割合で発生するとされる[3]。また、卵またはインフルエンザワクチンによって、アナフィラキシーショック等の重度のアレルギー症状を引き起こす可能性のある者へは、接種してはならない[3]。妊婦では弱毒化型は禁忌であり、不活化型を接種しなくてはならない[3]。
インフルエンザワクチン接種は、アメリカ合衆国において開発が進められてきた。実験的なワクチン接種は1930年代に始まり、1943年にはA型インフルエンザウイルスについて、1945年にはB型インフルエンザウイルスについて本格的に接種が開始された[13]。2017年現在では、WHOによって、世界各国の医療制度において必要とされる適切で安全な医薬品群のリストであるWHO必須医薬品モデル・リストにも収載されている[14]。
製造
[編集]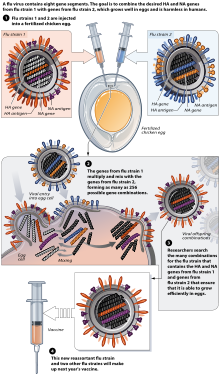
インフルエンザワクチンは、通常、ニワトリの受精卵からワクチン製造メーカーによって製造される[15][16]。アメリカは、ワクチン製造用の鶏卵の確保を国家安全保障に係るものとしており、多額の費用を投じて養鶏場を隠匿し、安全に輸送するシステムを構築している[17]。
北半球においては、世界保健機関 (WHO) による冬季インフルエンザ流行期に推奨されるウイルス型(系統)の発表(通常は2月に行われる)に続いて製造が開始する[15][18] インフルエンザの3つの系統(H1N1、H3N2、およびB型を表す)が選択され、別々のニワトリ卵に投与されたのち、それぞれの生成物(1価)を3つ組み合わせて3価ワクチンを製造する[19]。従来の注射型だけでなく、経鼻スプレーも鶏卵を使用して製造されている[16]。2009年の新型インフルエンザウイルスの流行を受けて2010/2011冬シーズンからA/H1N1がA/H1N1pdmに、2011/2012冬シーズンからA/H1N1pdmがA/H1N1pdm09に変更され、さらに2015/2016冬シーズンからは、4つのウイルス型(新型インフルエンザのA/H1N1pdm09、季節性インフルエンザのA/H3N2、B/山形系統、B/ビクトリア系統)に対応する4価ワクチンとなった[20][21]。
2007年の報告書では、季節性インフルエンザワクチンの世界全体での生産能力は、不活化ワクチンと弱毒生ワクチンあわせて約8億2600万個であったが、これは実際に生産された4億1300万個の2倍程度であった。2013年までに世界的大流行(パンデミック)に対するインフルエンザワクチンを生産するという計画予測においては、6か月の期間内に生産可能なワクチンは28億個にとどまるとされた。もしも、中高所得国のすべてが、パンデミック発生時に全人口のワクチンを必要とした場合、約20億個が必要となり、これに中国が加わると、30億個以上が必要となる[22]。世界中の人口に対して、手ごろな価格でより多くの量のインフルエンザワクチンを生産することができる新しいワクチン製造方法を開発するために、ワクチンの研究開発が進められている。
過程
[編集]インフルエンザワクチンは、11-12日齢の病原体のないニワトリ卵を使用して製造される[23]。
まず、ニワトリ卵の上部をエタノールによって消毒する。その後、尿膜腔(卵殻の直下に広がる空間)内の静脈が存在しない領域を探し、圧力を解放するための小さな穴をあける[24]。さらに2つ目の穴を卵の上部に作り、そこからインフルエンザウイルスを尿膜腔に注入する。続いて、2つの穴を溶融パラフィンで密封し、37 ℃で48時間孵卵する[23]。孵卵時間の間、インフルエンザウイルスは内部で複製され、新たに複製されたウイルスは尿膜腔の液中に放出される[25]。48時間の孵卵期間のあと、卵の上部にひびを入れ、そこから10 mLの尿膜腔液を取り出すと、約15μgのインフルエンザワクチン成分を得ることができる。(15μgは、日本において3歳以上のワクチン1回接種量である0.5mLに含まれる抗原量に相当する[26]。)その後インフルエンザワクチン(ウイルス抗原)は精製され、添加物が入れられたのち、注射薬ではバイアルやシリンジ、経鼻薬では鼻腔噴霧器(スプレー)の中に注入される[25]。このような方法を経ることによって、必要とされるワクチンを製造することができる。
また、インフルエンザワクチンをニワトリ卵で作る過程において、ウイルスを卵の中で増えやすくするためには、ウイルスを卵で複数回増やし、卵での増殖に適応させる「馴化」という工程が必要となる[27]。この過程でウイルスの遺伝子に変異が起きる場合があり、これが起きた場合ワクチンの有効性が低下することもありえる。そのため、製造されたワクチンは毎年有効性の確認がされている[27]。
季節性のインフルエンザワクチンでは、増殖させたインフルエンザウイルスを上記のような方法で分離精製したのち、エーテル処理により脂溶性成分を抽出除去し、ヘマグルチニン(HA)を含む画分を得て不活化ワクチンとしている。そのため、このような不活化ワクチンは「インフルエンザHAワクチン」と呼ばれる[28]。かつてはホルムアルデヒド(ホルマリン)で不活化していたが、2017年現在の「インフルエンザHAワクチン」にはホルマリンは使用されていない[29]。
経鼻投与されるタイプでは、上記のような不活化の過程を経ない弱毒生ワクチンが用いられている。(詳細は、別節を参照)
新技術による製造
[編集]鶏卵を用いた手法は、大規模な製造に向いておらず、また接種者に卵に対する食物アレルギー反応を引き起こす可能性や、ニワトリを含む鳥類に影響を及ぼす鳥インフルエンザウイルス株と不適合性である問題も生じており、解決が求められている[16]。また、特定の株に対してのみならず、幅広い種類のインフルエンザウイルスに対して効果的である「普遍的な」ユニバーサルインフルエンザワクチンの開発の研究も続けられている[16]。(詳しくは研究節参照)
卵の必要性を代替するワクチンの生成方法には、インフルエンザの「ウイルス様粒子」(VLP)の構築法が含まれる。VLPはウイルスの構造に似ているが、ウイルスの遺伝子コードを含まず、ウイルス粒子と同様の方法でヒトの免疫系に対して抗原を提示するだけであるため、不活性化をする必要はない。
VLPを産生するいくつかの方法には、昆虫細胞(ツマジロクサヨトウ、ガの一種)や植物(ベンサミアナタバコ、タバコの一種)を活用した培養方法が存在する[30]。2013年1月17日には、アメリカ食品医薬品局 (FDA) が、卵の代わりに昆虫細胞で製造された季節性インフルエンザワクチンであるFluBlokを承認している。この製品は、卵が製造過程において使用されていないため、卵アレルギーの問題を回避することができる[31]。

DNAの逆転写技術を用いた細胞培養によるワクチンの製造は、製造速度がより速くなることが期待されており、2011年付で、安全性と有効性を決定する臨床試験が行われている[32]。
2012年11月20日には、最初の細胞培養ワクチンFlucelvaxが、製薬メーカーのノバルティスによって、アメリカ食品医薬品局 (FDA) の承認を受けている[33][34][35][36]。その後、ノバルティス社のインフルエンザワクチン製造部門は、アメリカの製薬メーカーであるCSLベーリングによって買収され、現在ではCSLベーリングの設立したSeqirusが事業を引き継いでいる[37]。
このような細胞培養によって作成されるワクチンは、世界的大流行(パンデミック)の際に大量のワクチンが早急に必要な場合にも、適切かつ迅速な供給を維持できることが期待されている。副反応についても、従来型ワクチンとほぼ同等程度とされている。ただし、FDAによる最初の承認では、18歳以上だけが使用の対象とされている[38]。
価格
[編集]南アフリカにおける卸売価格は、2015年8月時点で1剤(シリンジ入り0.5mL)あたり4.56米ドルであり[39]、アメリカ合衆国では2015年時点で25米ドル未満である[40]。日本では、2023年現在、厚生労働省が決める公定価格一覧である「薬価基準収載品目リスト」には収載されておらず[41]、健康保険適用外となっている。
そのためインフルエンザワクチンの接種は自由診療となり医療機関ごとに価格は異なるが、2017年現在で3500円程度である[42]。自治体・学校・企業等で接種費用の補助を受けられる場合もある。
効果と有効性
[編集]定義
[編集]ワクチンは、一定の条件下において疾患の危険性を減らす程度を示す「効果」と、ワクチン接種後に観察された感染リスクの低下を考慮した「有効性」によって評価される[43]。インフルエンザワクチンの場合、この「有効性」に関しては、インフルエンザに起因するとは限らないインフルエンザ様の症状を含んだ罹患率を用いて測定されるため、「効果」と比べて低く見積もられていると予想される[44]。動物モデルあるいはワクチン接種されたヒトにおける抗体産生の測定において、インフルエンザワクチンは一般的に高い効果を示している[45]。しかし、現実における実際のインフルエンザワクチンの有効性に関する研究は困難である。その理由としては、ワクチンのウイルス型が完全に一致していない可能性、インフルエンザの有病率は年によって大きく異なること、しばしば他のインフルエンザ様の症状が出る病気と混同されていることなどが挙げられる[46]。とはいえ、ほとんどの年(2007年以前の19年のうち16年)において、インフルエンザワクチン株は流行株とのおおむね一致を示しており[47]、また仮に不一致であったとしても、交差防御によって効果が得られることがある[11]。インフルエンザワクチンは、その対象となるウイルス株が毎年変更されるため(詳細は後節参照)、毎シーズンワクチンの有効性(vaccine effectiveness;VE)を評価する必要がある。この有効性の推定には「診断陰性例デザイン」が用いられている[48]。この方法は、2005年にカナダにおいて初めてインフルエンザワクチンに用いられたことが報告されて以降、世界的に標準方法として使用されるようになった。診断陰性例デザインによるワクチン有効性の算出は、インフルエンザの疑いとして、インフルエンザの検査を受けた患者を陽性群と陰性群に分け、それぞれのワクチン接種率を比較することによって行われる。つまりその結果は、「インフルエンザワクチンを接種したら、インフルエンザと診断される確率を何%減らせているか」というものと同義となる。この方法による精度は高く、ランダム化比較試験に匹敵するものいう意見もある[48]。診断陰性例デザインによるVEは様々な条件下で算出されており、国、地域、年や施設によって結果は大きく異なる[49][50]。インフルエンザワクチンの有効率は一般的に、(1 - 接種群罹患率)/ 非接種群罹患率 X 100 である。つまり、「非接種者群の発症者10人で、接種者の発症者が4人である」とき、「10人から6人へと減らしたので有効率は60%」と表現される。よって、「有効率60%」は、100人の非接種者群と100人の接種者群の研究において、「予防接種を受けた100人のうち、60人は発症しない」ことを示すのではない(このような計算方法では、罹患率の影響を受けるため、罹患率が低い感染症では有効率の評価ができない)[51]。
報告
[編集]季節性インフルエンザに対する不活性ワクチンの試験の結果はいくつかのメタアナリシスに集約されており、これは、成人、子供、高齢者において季節性インフルエンザに対する不活性化ワクチンの効果効能および有効性を調べたものである[9][44][52][53]。2012年のメタアナリシスによると、インフルエンザワクチン接種の有効率は67%であった。最も効果が高かった集団は18から55歳の後天性免疫不全症候群(HIV陽性)の成人で、有効率は76%であった。そのほかの集団の有効率は、18から46歳の健康な成人では70%、生後6から24か月の健康な子供では66%であった[54]。
弱毒生インフルエンザワクチン(鼻スプレー型)について、米国予防接種諮問委員会(ACIP)は、2016-2017年[55]、2017-2018年のインフルエンザシーズンに、これら鼻スプレーのワクチンを使用しないよう推奨していたが、2018-2019年では、無効になっていたH1N1の抗体が変更されたため使用中止の推奨を取りやめ、またしかし市場から離れていたため有効性に関するデータは存在しない[56]。
2017年の報告では、日本の不活化インフルエンザワクチン接種による発症予防効果は、小児で25 - 60%、成人で50 - 60%とされている[7]。65歳以上の老人福祉施設・病院に入所している高齢者を対象とした1999年の研究では、インフルエンザワクチンによって34 - 55%の発病を防ぎ、死亡を抑制する効果は約82%であった[27]。インフルエンザワクチンの効果は年々低くなってきているという日本臨床内科医会の報告も存在する。この報告によると、全年齢群において、2001-2002年から2007-2008年シーズンまでは効果が有意に認められたものの、以降は2009年の一部と2014-2015年シーズンを除き、有意ではなくなっているとされている[7]。これらのことから、インフルエンザ対策は、インフルエンザワクチンのみでは不充分とされており、手指消毒や咳エチケット、マスクの着用といった標準予防策を合わせて用いることが重要とされる[7]。
集団接種の有効性
[編集]より長期間の観察での評価として、日本の集団接種を対象として行われた研究がある。日本では1987年まで小中学生を対象としたインフルエンザワクチンの集団接種が行われていた[57]。この集団接種は、約300万人が感染し約8000人(推計)が死亡した1957年のインフルエンザ(アジアかぜ)大流行がその引き金になったもので、1962年から小児への接種推奨がなされ、1977年に予防接種法で小中学生の接種が義務化された[57]。
しかし、接種後に高熱を出して後遺症が残ったと日本国政府を訴えて国側が敗訴するケースも続出したため、厚生省が方針転換し、1987年に保護者の同意を得た希望者に接種する方式に変更され、 1994年には任意接種となった[57]。またインフルエンザワクチンの効果に対する不信感も世論に広まり、100%近かった小中学生の接種率は1990年代には数%に低下した[57]。
その結果、インフルエンザ脳症によって死亡する児童が増加しただけではなく、インフルエンザに対する集団免疫の低下により、高齢者施設における入所者のインフルエンザによる死亡例が相次ぐこととなった[57]。後に、当時の日本での小中学生に対するインフルエンザワクチンの集団接種は、高齢者を含めて年間約3万7000-4万9000人の人命を救っていたことが指摘された[57][58]。この研究によって「集団免疫」(間接予防効果)の重要性が認識されるようになり[57]、各国のワクチン政策に大きな影響を与えた[57]。
成人
[編集]2014年、コクラン共同計画のシステマティック・レビューによると、ワクチン接種によって、インフルエンザと確認された症例は約2.4%から1.1%に減少し、インフルエンザ様の症状を示した者は約16%から約10%に減少していた[44]。入院数の増減に関するデータは得られなかった[44]。仕事を持つ成人において、ワクチン接種はインフルエンザの症状および休業日数の両方に対して、わずかながら減少をもたらすことが示されている[44]。しかし、このデータから出版バイアスの影響を評価することができずバイアスによるデータの誤差などのリスクは不明である[44]。
2018年にコクランはレビューを改訂し、ワクチンを接種しなかった場合のインフルエンザの頻度2.3%を0.9%へと減少させ、これは1人のインフルエンザを予防するために71人がワクチンを接種する必要があり、インフルエンザ様症状では21.5%を18.1%へと減少させ同じように1人の予防に29人の接種が必要とし、また休業あるいは入院をわずかに減少させるという証拠の確かさは低いとし、有害事象では接種者は「わずかな発熱」のリスクを増加させていた[59]。
インフルエンザウイルスに対して、ある程度の予防効果も存在するとされているが、その効果は時間を経るにつれて大幅に減少または消失するとされる[60]。
理論的に全ての人々がワクチンを接種しても、集団に感染が拡大することを防止する集団免疫の獲得には至らないという報告もあるが[10]、先の日本の集団接種のデータなど、それに反する報告が複数報告されている。医療従事者においては、2006年のシステマティックレビューにおいて、医療従事者に対するワクチンの確かな接種によって、患者死亡率が低下したことを示した[61]。このレビューでの18の研究のうち、2つの研究において医療従事者のインフルエンザワクチン接種率に対する患者死亡率の関係を評価した。双方ともに、医療従事者のワクチン接種率が高いほど患者の死亡率が減少していることを示している[61]。2014年のシステマティックレビューでは、医療従事者に対するワクチン接種の患者へ与える影響について、医療従事者がワクチン接種を受けていなかった場合と、医療従事者がワクチン接種を受けた場合において、患者のあらゆる原因による死亡率の減少が観察されたことを挙げている[62][63]。
小児
[編集]2012年のコクラン共同計画のレビューによれば、2歳以上の子供の発症の予防に効果を示したが、インフルエンザと同様の症状を呈する疾患(インフルエンザ様疾患)を予防する効果なく、しかしまた6歳以上では不活性化ワクチンは偽薬と同じであった[52]。また、2歳未満の小児に対するワクチン接種については、存在する限られたわずかな研究データとしては測定可能なほどの効果は得られていない[52]。
2018年の改定されたコクランのレビューは、証拠の確実性は中程度であり、おそらくインフルエンザを減らし、インフルエンザ様の症状では低い確実性で減らすとし、有害事象については記載が十分ではないため評価できず、2歳未満では同様に研究がほとんどなかった[8]。
生後6カ月から8歳までの小児を対象とした研究では、インフルエンザワクチン接種状況(非接種、1回接種、2回接種)別のワクチン有効率(VE)は、2回接種51%(95%CI 44-57)、1回接種41%(95%CI 25-54)だった。ワクチン接種歴のない生後6カ月から2歳の小児では、2回接種のVEが53%(95%CI 28-70)、1回接種のVEが23%(95%CI 11-47)で、1回接種に比べると2回接種の小児はインフルエンザ陽性になる確率が低かった(調整オッズ比0.57、95%CI 0.35-0.93)[64]。
高齢者
[編集]2010年のコクランレビューでは、65歳を超える高齢者では証拠の品質が低く結論が導けなかった[9]。65歳以上の高齢者における効果は不明であるとされている[65]。ランダム化比較試験 (RCT) と症例対照研究の両方を調べる系統的レビューでは、信頼性の高い研究結果が存在しないことが示された[9][60]。それらより信頼性の低い症例対照研究のレビューでは、高齢者において、診断されたインフルエンザ、肺炎、および死亡に対する効果の存在を示唆している[66][67]。
高齢者は、季節性インフルエンザに対して最も脆弱なグループであるのにもかかわらず、ワクチン接種の効果が最も少ない。高齢者における急激なワクチン効果の低下には、複数の理由が存在する。最も一般的なものは、免疫機能の低下と高齢に伴う衰弱である[68]。インフルエンザの大流行が発生しなかった年において、アメリカ合衆国では、50-64歳の人は若年者よりもインフルエンザ関連死亡率が10倍近く高く、65歳以上の人では10倍以上となるとのデータが存在する[69]。
より強い免疫応答を提供するために特別に製造された新しい高用量インフルエンザワクチンも存在する[70]。信頼性が担保された研究によると、この高用量ワクチンを高齢者に接種すると、正規用量のワクチンよりもインフルエンザに対して強い免疫応答が誘導できることが示されている[71]。
また、インフルエンザに対して脆弱な高齢者における流行を減らすことを目標として、高齢者とかかわる医療従事者に対するワクチン接種が、多くの国で推奨されている[72][73][74]。医療従事者のワクチン接種によって、高齢者をインフルエンザ感染から守るという確かな臨床試験からの決定的な証拠には乏しいものの、効果を示唆する証拠は存在している[75]。
妊婦
[編集]2018年のコクランによるレビューでは、母親と新生児に対する保護作用は成人一般におけるものよりも小さく、妊婦とその新生児では非常に控えめであった[59]。
妊娠中であっても、インフルエンザワクチン接種は可能である。妊婦へのインフルエンザワクチン接種は、母体だけでなく、産まれてくる児への防御という重要な役割も果たす[12]。また、コホート研究によれば、妊婦に対するインフルエンザワクチン接種は、インフルエンザ感染の影響から母親や子供を守るだけでなく、満期妊娠を成功させる可能性を増加させる傾向がある[76]。また、3価不活化インフルエンザワクチンの研究では、ヒト免疫不全ウイルス(HIV)に感染した妊婦に対する予防効果が示されている[77]。 インフルエンザワクチンの接種は、妊娠のどの期間においても可能とされているが、ワクチンの効果が出現するまでは約2 - 3週間要し、その効果が継続する期間は約3 - 4か月であることを考慮すると、インフルエンザ流行期が始まる10月から11月にワクチン接種を行うことが理想的とされている[12]。母体ヘワクチン接種することによって、母体で獲得された抗体は胎盤を介して胎児へも移行する上、その抗体は胎児の出生後も約6か月間持続するとされている[12]。出生後の乳児へのインフルエンザワクチン接種は、多くの場合生後6か月以降とされているが、この空白期間を妊婦への接種によって補うことが可能である[12]。
妊娠中の接種の場合、胎児へのリスクとして催奇形性、胎児毒性や妊娠の継続に関する懸念をもつ妊婦も多いが、実際にはインフルエンザワクチン接種による胎児奇形の誘導は認められず、接種妊婦において奇形児が発生する確率は、自然発生率を超えないとされている[12]。また、自然流産早産、胎盤発育異常が増加するという明確な証拠も存在しない[12]。ただし、母体への危険性として、インフルエンザワクチンによる母体の副反応やアレルギーが挙げられるが、これらの発生頻度は妊娠の有無には関係ないとされている[12]。ただし、経鼻スプレー型の生ワクチン(後述)の妊婦への接種は禁忌である[12][78]。
安全性
[編集]インフルエンザワクチン接種によって副反応(一般的な医薬品における副作用に相当)が発生する可能性があるが、通常は軽微なものがほとんどである。具体的な副反応としては、鼻水や喉の痛みなどの症状を引き起こす可能性があり、これらは数日間続くこともある[79]。ただし、これらのワクチン接種による一般的な副反応や危険性は、毎年流行するインフルエンザあるいはそれによって引き起こされる可能性のある入院、死亡などの危険性と比較して、一時的かつ軽微なものに留まる。稀に、アレルギー反応を含む深刻な副作用を引き起こす可能性はあるものの、確率は非常に少ない[80]。
日本におけるインフルエンザワクチンの接種後の副反応の報告データでは、接種関連死亡として報告された例は、通常年間5例以下であった。これに対して使用量は、年によって異なるものの、年間約2500万本であり[27]、報告されている疑い死亡例の確率は非常に少ない。また、これらの死亡例を専門家が評価したところによると、死亡とワクチン接種の直接の明確な因果関係があるとされた症例は1例もなかったとされている。また、上記死亡例のほとんどが、基礎疾患がある高齢者である[27]。
韓国では2020年10月に、ワクチンを接種後に亡くなる例が36人報告されて問題視されたが、疾病管理庁は死亡例の多くが高齢者であることや心血管系疾患など別の死因が確認されたことを理由として、ワクチンの接種は継続された[81]。
卵アレルギーとの関連
[編集]インフルエンザワクチンはニワトリの卵を使用して作られているため、接種者の卵アレルギーの有無も注意しなくてはならない[79]。複数の専門家グループは、卵アレルギーとインフルエンザワクチンの研究に基づいて、軽度のアレルギーの人にはワクチンを推奨し、重症の人にはワクチン接種を慎重に行うべき、としている[82][83]。
イギリスにおいて実施された、卵アレルギーを持つ800人近くの小児(卵によるアナフィラキシーショックの既往歴を伴う250人以上の小児を含む)が参加した大規模な研究では、弱毒生インフルエンザワクチン接種を受けた際に、全身性のアレルギー反応が生じた小児は1人も認められなかった[84][85]。
また、卵アレルギーの人への安全な接種のための研究も進んでいる。2013年1月17日には、アメリカ合衆国において医薬品承認を行う機関であるアメリカ食品医薬品局(FDA)によって、卵の代わりに昆虫細胞で製造された季節性インフルエンザワクチンであるFluBlokが承認された。FluBlokは製造過程において卵が使用されていないため、食物アレルギーの問題を回避することができる[31]。
神経系疾患との関連
[編集]ギラン・バレー症候群
[編集]予防接種による合併症としてギラン・バレー症候群(筋肉の運動神経に生じる障害によって引き起こされる疾患)が懸念されてきたが、アメリカ疾病予防管理センター (CDC) は、現在のインフルエンザワクチンに関するほとんどの研究においてギラン・バレー症候群との関連性は認められないとしている[86][87]。2009年の推定値によると、インフルエンザウイルスへの感染そのものによって上昇する死亡の危険性(10,000人中最大1人)及びギラン・バレー症候群を発症・増悪させる危険性は、ワクチン接種による副反応との関連性が疑われている最も高い危険性の水準よりも、約10倍高いものであるとされている[88][89]。
2009年Vaccine誌掲載レビューによると、ワクチン接種によるギラン・バレー症候群の発生率は100万回あたり約1例とされている[90]。もっとも権威ある医学雑誌のひとつである『ニューイングランド・ジャーナル・オブ・メディシン』に掲載された別の研究によると、2009年に中国においてH1N1ブタインフルエンザに対するワクチン接種が行われた際、1億人に近い人に接種が行われたのに対し、ギラン・バレー症候群の発生例は11人のみであった(100万人あたり約0.1人)。これは中国におけるギラン・バレー症候群の通常の罹患率より低く、その他にも顕著な副作用はみとめられなかった。リスク対効果を考えるならば、圧倒的に接種を行ったほうが有利であるという結果となっている[89][91]。2010年日本公衆衛生雑誌掲載の総説では、インフルエンザの疾病負担とワクチン有効性を比べると、インフルエンザワクチン接種の有益性は、季節性ワクチン接種後のギラン・バレー症候群の発生リスクを大きく上まわると結論付けている[92]。
ナルコレプシー
[編集]2013年に発表されたある研究によると、2009年にH1N1インフルエンザが大流行した際に用いられたワクチンのひとつである「H1N1インフルエンザASO3アジュバント添加ワクチン」の接種者において、ナルコレプシーの発生率が増加していることが確認されており、この機序を解明することによって、ナルコレプシーが自己免疫疾患であることが示唆された[93]。この研究では、「H1N1インフルエンザASO3アジュバント添加ワクチン」は、オレキシン(ヒポクレチン-1)と類似しており、ナルコレプシー発症の原因となり得るとされていた[94]。ただし、上記の主旨で発表された2013年の論文は、論文の構成上重要な実験が再現できなかったとして、2014年に著者により取り下げられている[95]。
添加物の安全性
[編集]チメロサールやアジュバントの安全性については、マスメディアによって論争がある。1997年にアメリカでの法改正によって水銀化合物が使用できるようになり、1999年にはいくつかのワクチンにエチル水銀含有の防腐剤であるチロメサールが使用されるようになり、乳児には水銀量が過剰ではないかと提起され、一方その政府機関は安全性だと述べてきた[96]。
2012年にも、世界保健機関のワクチン安全性に関する諮問委員会は、ワクチンにおけるチメロサールの有害性の証拠は方法的な欠陥のある研究であり、半減期が3-7日のエチル水銀が血中及び脳に到達する水銀濃度は毒性がない域であり、安全性を支持している[97]。
投与方法
[編集]インフルエンザワクチンには、以下の2つの投与方法とワクチン種類が存在する。
注射型不活化ワクチン
[編集]4種類のウイルス株が入った4価ワクチン (QIV) の注射薬は、筋肉内、皮下あるいは皮内に投与して用いられる。これらは体内に注射されることによって、不活性化されたインフルエンザウイルスに存在する抗原に対する免疫応答に基づいて防御機構を誘導する[98]。3種類のウイルス株が入った3価ワクチン(TIV)は、4価ワクチンへの切り替えで製造停止になった。
不活化ワクチンは、インフルエンザウイルスの病原体としての活性を失わせ、免疫をつくるのに必要な成分を取り出したものである。したがって、不活化インフルエンザワクチン接種によって、インフルエンザを発症することはない[27]。
経鼻スプレー型生ワクチン
[編集]経鼻スプレー弱毒生ワクチン (LAIV)は、弱毒生インフルエンザウイルス株が鼻腔内へ感染を起こすことによって機能する[98][99]。経鼻スプレー型の生ワクチンは、不活化型の注射薬と比べて新しいインフルエンザワクチンである。通常の注射型ワクチンによって誘導される血中の抗体(IgG抗体)に加えて、感染経路である鼻の粘膜に別のタイプの抗体(分泌型lgA抗体)も誘導することによって、粘膜へのインフルエンザウイルスの侵入を抑えることができると考えられている。従来の注射薬タイプの不活化ワクチンには、分泌型IgA抗体誘導の効果がないため、今後の有用性が期待されている[100]。
2015年現在、カナダ、イスラエル、フィンランド、スウェーデン、ドイツにおいて、インフルエンザに対する危険性が高い個人に対して、優先的に推奨されているワクチンである[101]。世界で初めて承認を行ったのはアメリカ合衆国であり、2003年に登場している。以降、世界中で1億回超の投与量が供給されている[101]。2012年3月には、経鼻スプレーによって投与される4価インフルエンザワクチンであるFluMist Quadrivalent(製造者:アストラゼネカ)が、医薬品の認可を担うアメリカ食品医薬品局(FDA)によって、承認された[102]。このワクチンは、対象年齢が当初は15歳以上だったが、その後2歳以上に引き下げられたことで乳幼児への接種例が増えた。しかし、その後アメリカ予防接種諮問委員会(ACIP)による「2-17歳での効果が認められない」との報告を受けて、アメリカ疾病予防管理センター (CDC)は、2016-2017年のインフルエンザ流行期にはこのワクチンの使用を勧奨しないと発表した[103]。
日本においては、第一三共が、FluMist Quadrivalentの製造メーカーであるアストラゼネカと提携し、経鼻スプレー型インフルエンザ生ワクチンを2016年に医薬品医療機器総合機構へ承認申請を提出している[101]。2023年2月27日、厚生労働省の専門部会は第一三共のフルミスト点鼻液の製造販売承認を了承した[104]。なお、それ以前よりアメリカ合衆国から個人輸入して使用している医師は存在する[100]。
アメリカ疾病予防管理センター (CDC) によると、以下の人々は弱毒生ワクチン(経鼻スプレー型)は避けるべきとされている[78]。
- 卵もしくはインフルエンザワクチンに対して重度のアレルギー反応の病歴を有する人
- ギラン・バレー症候群の既往がある人
- 心臓、呼吸器、腎臓、肝臓、または神経系の慢性疾患を有する人
- 喘息あるいは呼吸器疾患の既往をもつ人
- 妊娠中の女性
- アスピリン投与を受けている若年者
- 免疫不全をもつ人
- クリーンルーム等の環境を必要とする人(たとえば、骨髄移植を受けた人など)を、今後7日間以内に訪問または治療・看護する人
製品
[編集]主なインフルエンザワクチンの製品は以下の通りである[37][105]。
| 製品名 | 製造法 | 内容 | 投与方法 | メーカー | 備考 |
|---|---|---|---|---|---|
| Flucelvax | 細胞培養 | 3価 | 筋肉内注射 | Seqirus (アメリカ合衆国) | |
| Flucelvax Quadrivalent | 細胞培養 | 4価 | 筋肉内注射 | Seqirus (アメリカ合衆国) | |
| Fluvirin | 鶏卵培養 | 3価 | 筋肉内注射 | Seqirus (アメリカ合衆国) [106] | |
| Afluria Quad | 鶏卵培養 | 4価 | 筋肉内注射または皮下注射[107] | Seqirus (アメリカ合衆国) | |
| FluMist Quadrivalent | 鶏卵培養 | 4価 | 経鼻噴射 | アストラゼネカ (イギリス)[108] | 生ワクチン,日本では第一三共が承認申請中 |
| Fluarix Quadrivalent | 鶏卵培養 | 4価 | 筋肉内注射 | グラクソ・スミスクライン (イギリス) | |
| FluLaval Quadrivalent | 鶏卵培養 | 4価 | 筋肉内注射 | グラクソ・スミスクライン (イギリス) | |
| Fluzone Quadrivalent | 鶏卵培養 | 4価 | 皮内注射 | サノフィ (フランス) | |
| Fluzone I.D. Quadrivalent | 鶏卵培養 | 4価 | 皮内注射 | サノフィ (フランス) | |
| Fluzone High Dose | 鶏卵培養 | 3価 | 筋肉内注射 | サノフィ (フランス) | 通常のワクチンと比べ高用量 |
| Fluzone | 鶏卵培養 | 3価 | 筋肉内注射 | サノフィ (フランス) | |
| FluBlok | 遺伝子組換 | 4価[109] | 筋肉内注射 | Protein Sciences (アメリカ合衆国) | 昆虫細胞を用いた製造 |
| インフルエンザHAワクチン 「北里第一三共」 | 鶏卵培養 | 4価 | 皮下注射 | 北里第一三共ワクチン (日本) | |
| インフルエンザHAワクチン「KMB」 | 鶏卵培養 | 4価 | 皮下注射 | KMバイオロジクス (日本) | 2018年に化学及血清療法研究所から移管された。 |
| ビケン HA | 鶏卵培養 | 4価 | 皮下注射 | 阪大微生物病研究会 (日本) | |
| フルービック HA | 鶏卵培養 | 4価 | 皮下注射 | 阪大微生物病研究会 (日本) | |
| インフルエンザHAワクチン「生研」 | 鶏卵培養 | 4価 | 皮下注射 | デンカ生研 (日本) |
接種の推奨
[編集]世界保健機関(WHO)をはじめとして、さまざまな公共保健機関が、インフルエンザによる合併症の危険がある人々、あるいはそれらの人々と生活を共にしたり、治療・看護に関わっている人々に対して、毎年日常的にインフルエンザワクチンを接種することを推奨している。
- 高齢者(イギリスにおける推奨は65歳以上の者)
- 慢性肺疾患 (喘息、慢性閉塞性肺疾患(COPD)など)の患者
- 慢性心疾患 (先天性心疾患、慢性心不全、虚血性心疾患など)の患者
- 慢性肝炎あるいは肝硬変の患者
- 慢性腎臓病 (ネフローゼ症候群などを含む)の患者
- 免疫機能障害 (後天性免疫不全症候群の患者や長期にわたるステロイド治療を受けている人)をもつ人とその家族
- 刑務所、福祉施設、学校、宿舎など、インフルエンザが急速に広がる可能性がある環境で大勢の人と共に暮らしている人[110]
- 妊娠中の女性
- 2009年のレビューでは、妊娠初期において3価インフルエンザワクチン接種を推奨する根拠が不充分であるとの意見も存在する[111]。ただし、インフルエンザが流行する季節にインフルエンザワクチンを接種することは、アメリカ合衆国において妊婦に対する推奨事項の一部となっている[112]。
- 医療従事者(本人の予防とともに、患者への感染を防ぐため)[113][114]
また、インフルエンザに罹患した乳児の死亡率は高いため、乳児にインフルエンザウイルスを感染させる危険性を減らすために、乳児の家庭内接触者および養育者はワクチン接種を受けることが推奨される[115]。また、インフルエンザワクチンの接種が推奨されていない生後6か月までの期間は、出生前に妊婦への接種によって補うことが可能であるとされている[12]。(詳細は、妊婦の節参照)
ただし、インフルエンザワクチン接種は、卵タンパクに対する重度のアレルギーをもつ人や、ギラン・バレー症候群の既往がある人には禁忌であることに注意する必要がある[116]。
なおアメリカ疾病予防管理センター (CDC) では、生後6か月以下の乳児以外には季節性インフルエンザワクチンを投与することを推奨している(6か月以下に承認された薬はない)[5]。
世界保健機関
[編集]2017年現在、世界保健機関(WHO)は、以下の人々への季節性インフルエンザワクチン接種を推奨している[117][118]
- 最推奨
- 妊娠中の女性
- 推奨
- 生後6か月から59か月(4歳11か月)の小児
- 高齢者
- 慢性疾患を抱える患者
- 医療従事者
また、季節性インフルエンザワクチンの接種については以下のように推奨している[119]
- 1歳より上は三角筋、6か月から12か月の乳児は大腿部の前外側面に注射する。
- 生後6か月未満には接種しない。
- 生後6か月から36か月は、成人の半量を用いる。
- 9歳未満で生まれてから一度も接種を受けていないものは2回接種が必要で、少なくとも1か月の接種間隔を空ける。
- 9歳未満で過去に1度でも接種した者と、9歳以上の児童生徒、健康な成人は、1回接種する。
- 接種部位の痛み、発赤、腫れは一般的な反応であり、発熱などの全身症状の頻度はそれよりも低い。
カナダ
[編集]カナダ公衆衛生庁の免疫に関する諮問委員会 (National Advisory Committee on Immunization;NACI) は、2008年から、2歳から65歳のすべての人に対して年1回のインフルエンザワクチン接種を推奨しており、生後6か月から24か月(2歳)の小児およびその養育者に対しては、ワクチン接種のさらに高い優先対象と位置付けられている[120]。
また、NACIは以下の人々へのインフルエンザワクチン接種を推奨している[121]。
- 肥満、健康な妊婦、生後6-59か月(4歳11か月)の小児、高齢者、先住民族、および一定の慢性疾患をもつ人々などを含む、インフルエンザの合併症または入院の危険性が高い人々
- 上記の人々と生活を共にする人や医療従事者を含む、高リスク者にインフルエンザウイルスを感染させる可能性のある人
- 公共に携わる人々
- 特定の畜産に関わる人々
ヨーロッパ
[編集]欧州疾病予防管理センター(ECDC)は、第1に高齢者、第2に慢性疾患を抱える人や医療従事者に対して、インフルエンザワクチンを接種することを推奨している[122]。
インフルエンザワクチンの接種戦略は一般的に、インフルエンザの流行を抑制あるいは完全に防止するというよりも、むしろインフルエンザに対して脆弱な人々を保護することにある[123]。この点において、急性灰白髄炎(ポリオ)や麻疹などの他の感染症に対する「集団免疫 (herd immunity)」の考え方とは対照的となっている[124]。
アメリカ合衆国
[編集]
アメリカ合衆国では、生後6か月以上のすべての人に対して、定期的なインフルエンザワクチン接種が推奨されている[125][126][127]。
季節性インフルエンザワクチンの接種について米国疾病予防管理センターは以下のように推奨している[128]:
- ハーバード大学医学部は 11 月を推奨しているが[129]、米国疾病予防管理センターは毎年10月(地域の流行が始まる前)に接種することを推奨している。
- 生後6か月以上8歳は
- 生まれて初めて接種する場合と、生まれてから1回しか接種していない場合は、2回接種
- 生まれて初めて接種する場合は、接種可能になったらすぐに接種する
- 生まれてから通算2回接種している場合は、年齢にかかわらず1回接種
- 9歳以上は1回接種
- 妊婦も接種推奨
- 経鼻スプレー型ワクチンは2歳から49歳に対し推奨(例外有)
アメリカ疾病予防管理センター (CDC) は、医療従事者に対するインフルエンザワクチン接種の推奨を1981年に開始した。CDCは、一般的に感染症に対して高リスクな人々と、その治療・看護をする人々は特に予防接種の緊急性を要するとの趣旨を、一般的なワクチン接種の包括的推奨のなかで臨床医に対して強調している。インフルエンザワクチン接種に関しては、重篤なインフルエンザの合併症の危険性がより高い人、またはこれらの人と一緒に暮らしている人や世話をする人々にとって特に重要となる[130]。2009年には、インフルエンザ標準ワクチンの、新しい高用量製剤であるFluzone High Doseが承認された。Fluzone High Doseは、特に65歳以上の人に適しており、標準のFluzone(15μg)の抗原投与量の4倍の用量(60μg)となっている[131][132]。インフルエンザの合併症の危険性がより高い人には、妊婦[125][133] や生後6か月から18歳までの若年者などが含まれる[110]。年齢制限を18歳とする目的は、小児科医への受診、学校の欠席あるいは合併症に対処するための抗生物質の必要性等を減らすことである[134]。さらに、子供へワクチンを接種することによって、その親および生活を共にする人々のインフルエンザ罹患者の減少、ひいては一般社会への感染拡大の可能性を減少させることが期待できる[134]。
アメリカ合衆国政府は、病院に対して従事者のワクチン接種率を報告するよう求めている。また、アメリカ合衆国の州や多くの病院は、インフルエンザ流行期に医療従事者にワクチン接種を受けたり、マスクを装着するよう要求している。これらの要求に対して団体交渉や組合訴訟が起こされることもあるが、一般的に裁判所は、病気の流行時に一般住民に及ぼす影響を考慮したのものとして、これらのワクチン接種に関する規則を支持している[135]。
なおCDCは、経鼻スプレー型である弱毒生インフルエンザワクチン(LAIV)を、2016-2017年のインフルエンザ流行期において推奨しないことを発表した[136]。さらに、重度の免疫不全患者を治療・看護する医療従事者は、弱毒生インフルエンザワクチン型(LAIV)ではなく不活化ワクチンである注射型(TIVまたはQIV)を受けるべきであるとしている[137]。
日本
[編集]日本においては、インフルエンザワクチンは予防接種法に定める定期接種のワクチンひとつとなっている[138]。定期接種の対象となるのは以下の人々である。
- 65歳以上の高齢者
- 60 - 64歳で、心臓、腎臓もしくは呼吸器の機能に障害があり、身の周りの生活を極度に制限される人(身体障害者障害程度等級1級に相当)
- 60 - 64歳で、ヒト免疫不全ウイルス(HIV)による免疫の機能に障害があり、日常生活がほとんど不可能な人(身体障害者障害程度等級1級に相当)
予防接種は、上記以外の人における任意接種のほか、定期接種としては地域の医療機関、開業医等で受けることができ、地方公共団体によって実施期間や費用が異なる。インフルエンザワクチンの接種は病気に対する治療ではないため、健康保険が適用されない自由診療だが、上記定期接種の対象者については、接種費用が自治体によって公費負担されているところも存在する。
そのほか、「予防接種実施規則」において、予防接種を受けることが適当でない者が以下の通り定められている[139]。
- 明らかな発熱を呈している者
- 重篤な急性疾患にかかっていることが明らかな者
- インフルエンザ予防接種の接種液の成分によってアナフィラキシーを呈したことがあることが明らかな者
- そのほか、予防接種を行うことが不適当な状態にある者
また、「定期接種実施要領」においては、予防接種の判断を行うに際して注意を要する者として以下の通り定められている[140]。
- 心臓血管系疾患、腎臓疾患、肝臓疾患、血液疾患、発育障害等の基礎疾患を有する者
- 予防接種で接種後2日以内に発熱のみられた者及び全身性発疹等のアレルギーを疑う症状を呈したことがある者
- 過去に痙攣の既往のある者
- 過去に免疫不全の診断がされている者及び近親者に先天性免疫不全症の者がいる者
- 接種しようとする接種液の成分に対してアレルギーを呈するおそれのある者
生後6か月からの接種が可能であり、接種量は、2011年より以下の通り定められている[27][141]
- 6か月以上3歳未満 - 1回0.25 mL (2回接種)
- 3歳以上13歳未満 - 1回0.5 mL (2回接種)
- 13歳以上 - 1回0.5 mL (1回接種、ただし2回接種の場合あり)
厚生労働省は、「インフルエンザワクチンは、接種すればインフルエンザに絶対にかからないというものではなく、ある程度の発病を阻止する効果があり、たとえかかっても症状が重くなることを阻止する効果がある」と広報している[27]。また、インフルエンザワクチン接種による効果が出現するまでには、2週間程度の期間を必要とすることから、毎年12月中旬までにワクチン接種を終えるよう推奨している[27]。日本全国における2015年の推計使用量は約2565万本であり、2016年の供給量は約2752万本である[27]。
日本においてインフルエンザワクチンは、厚生労働省が決める公定価格一覧である「薬価基準収載品目リスト」には収載されておらず[41]、診療報酬適用外である。そのため接種費用は、健康保険が適用されない自由診療で、クリニックや病院によって価格は異なるが、2016年の価格は平均3,300円であった[142]。
2020年度の季節性インフルエンザワクチンについて、厚生労働省は、過去5年で最大量(最大約6300万人分)を供給予定であるが、より必要としている者が確実に接種可能となるよう、「接種協力のお願い」を出した[143]。
- 10月1日から25日は、定期接種対象者のみ
- 10月26日からは、以下の者は早めに接種
- 医療従事者
- 基礎疾患を有する者
- 妊婦
- 生後6か月〜小学2年生
接種指向
[編集]季節性インフルエンザとパンデミック(大流行)を引き起こすインフルエンザの両方において、インフルエンザワクチン接種率は一般的に高くない[144]。
パンデミックを引き起こすインフルエンザに対するワクチン接種に関するシステマティック・レビューでは、性別(男性の接種率が高い)、民族性(少数民族の接種率が高い)および慢性疾患の有無などが、接種に影響を与える個人的要因として特定されている[145][146]。さらには、ワクチンの安全性と有効性に関する個人的な心情も重要な因子となる[144]。
医療従事者
[編集]最前線で働く医療従事者は、季節性インフルエンザやパンデミックを引き起こすインフルエンザに対するワクチン接種を受けることが推奨されている。例えば、イギリスでは、患者の治療に携わるすべての医療従事者は、季節性インフルエンザワクチンの接種を推奨されており、2009年の新型インフルエンザのパンデミックの際には、新型インフルエンザに対するワクチンも同様に推奨された。しかし、接種率はしばしば低くなっている[114]。2009年の新型インフルエンザのパンデミックの際には、イギリス[114] イタリア,[147]、ギリシャ[148]、および香港において[149]、接種率が低かったことが指摘されている。
アメリカの医療従事者を対象とした2010年の調査では、2010-2011年の流行期に63.5%の人がインフルエンザワクチン接種を受けたと報告しており、前年の61.9%から増加している。医師と歯科医(84.2%)やナース・プラクティショナー(アメリカにおいて、一定の医療行為が許された看護師)(82.6%)など、患者と直接接する医療従事者では、ワクチン接種率がとくに高かった[150][151][152]。
医療従事者に対してワクチン接種が推奨される主な理由は、医療従事者が接する患者へのインフルエンザ感染を防ぐことや、需要が高い時期に欠勤する医療従事者を減らすことにある。しかし、彼らがワクチン接種を受け入れるかどうかについては、接種によって受ける個人の利益によるところもある[114]。
歴史
[編集]1918年に世界的なインフルエンザパンデミック(いわゆるスペインかぜ)が起こった際には、医者は、患者の出血に関する古くからの伝承治療から、酸素の投与、新しいワクチンや血清の開発に至るまで、さまざまな手を尽くした(「インフルエンザ菌(Hemophilus influenzae)」と呼ばれている病原体は、当時インフルエンザ感染症の病因と考えられていたことに由来する名前である[13]。現在ではこの説は否定されているが、インフルエンザに続発してインフルエンザ菌の感染をきたす可能性はある)。このうち、回復した患者から感染者に血液を輸血するという治療法は、インフルエンザの対する成功の一助となった[153]。
1931年には、ヴァンダービルト大学のErnest William Goodpastureらによって、ニワトリ卵内におけるインフルエンザウイルスの増殖が報告された[154]。この研究は、複数の他の研究者らによって引き継がれ、インフルエンザウイルスの増殖によって最初の実験的インフルエンザワクチンが誕生した[155]。1940年代には、インフルエンザワクチンによる一定の予防効果が確認された。実験・開発は、アメリカ軍に設置された「インフルエンザその他陸軍において発生する伝染性疾患の研究と防疫の為の委員会」によって主にすすめられ、第二次世界大戦期(1943年ごろ)から本格的な使用が開始された[13][156]。さらに、ワクチン製造メーカーは、ウイルスの純度を改善するために製造プロセスの開発を行い、ニワトリ卵タンパク質をより除去し、さらにワクチンの全身反応性を低下させるための改善を進めた[157]。最近では、アメリカ食品医薬品局 (FDA) は、ニワトリ卵を用いず細胞培養によってウイルスを増殖させて作られたインフルエンザワクチンを承認した[158]。また、植物細胞由来のインフルエンザワクチンも臨床試験が行われている[159][160]。
日本において1962年にインフルエンザワクチンの集団予防接種が開始され、1964年にはその副反応の被害訴訟がはじまり80年代[161]、90年代まで続いた。1994年には学校での集団予防接種は廃止された。
次第に新型インフルエンザの恐怖が煽られ、出版物が続々と刊行された。2009年には世界的なパンデミック宣言が発せられた。各国は膨大な税金をワクチンや抗ウイルス薬を備蓄したが、その致死性が恐れていたほどではないと判明した。
年によるワクチン型の変更
[編集]世界保健機関 (WHO) は、次年に流行する可能性が最も高いインフルエンザウイルス株を選択して、毎年ワクチンの内容を調整している。WHOの世界的インフルエンザ調査ネットワーク (Global Influenza Surveillance Network; GISN) によって、毎年、それぞれの年の流行期におけるインフルエンザワクチンとして、3つあるいは4つのウイルス型が選択される。従来は3価(3種類のウイルス型が入っている)のインフルエンザワクチンが使用されていたが、4価インフルエンザワクチンが承認されたことに伴い、WHOは、2012年から2013年までの北半球におけるインフルエンザ流行期から、B型株を2つに増やした4価のインフルエンザワクチンを推奨している。H1N1、H3N2、B型の系統から選択されたこれら3つあるいは4つの型は、次の流行期にヒトへの影響が強い可能性が最も高いとされる。
最初の正式なWHOによる勧告は、1973年に出されている。1999年からは、北半球(N)と南半球(S)の2つの勧告を年に2回行うこととなった[162]。WHO世界インフルエンザ監視対応システム(Global Influenza Surveillance Network;GISN)は、1952年に設立された。このネットワークは、世界140か国に存在する「WHO国内インフルエンザセンター」(WHO National Influenza Centres; NICs) と、WHOによって認められた6つの「WHOインフルエンザ協力センター」(WHO Collaborating Centres; WHO CCs)によって構成されている[163]。NICsは、自国でウイルスサンプルを収集し、検査を行う。ここから新しく単離されたウイルス株を、さらに高度な検査のためにWHO CCsに提供し、その結果が毎年のインフルエンザワクチンの構成に関する勧告の基本となる[164]。製造するワクチンを決定するためのウイルス株選定は、どの株が次の年において支配的となるのかという最善の推定に基づいており、最終的には外れる可能性も存在する[165]。とはいえ、ほとんどの年(2007年以前の19年のうち16年)において、インフルエンザワクチン株は流行株とのおおむね一致を示している[166]。
日本においては、厚生労働省健康局の要請によって国立感染症研究所で開催される「インフルエンザワクチン株選定のための検討会議」に基づいて、厚生労働省が最終的な決定・通達を行う[167]。国立感染症研究所では、WHO世界インフルエンザ監視対応システム(GISN)を介した世界各地の情報のみならず、日本全国77カ所の研究所と、厚労省結核感染症課の感染症発生動向調査事業により得られた国内の流行状況、および約8,158株に及ぶ国内分離ウイルスについての抗原性や遺伝子解析の成績、感染症流行予測事業による住民の抗体保有状況調査の成績などを考慮し、ワクチン候補株を選択する。さらに、これらの候補株について、ニワトリ卵での増殖効率、抗原的安定性、免疫原性、エーテル処理効果などの項目について、ワクチン製造に適するか検討を行っている。国立感染症研究所での会議で最終的なワクチン株が選定されると、厚生労働省健康局長から決定通知が公布され、その年のワクチン株が発表されることとなる[168]。
なお、「2009(H1N1)pdm09」は新型インフルエンザA(H1N1)pdm09、つまり2009年に発生した新型インフルエンザを指す[169]。2020-21シーズンから、A(H1N1)pdm09を単にA(H1N1)と表記する[170]。
日本でのシーズン別ワクチン製造株一覧
[編集]日本で使用されるワクチン株は、国立感染症研究所によってインフルエンザ流行期ごとに発表されている[171]。ここでは2020/2021冬シーズン以降の「(H1N1)」はそれまでの「(H1N1) pdm09」を指す。
| シーズン | 製造株 |
|---|---|
| 2024/2025冬 |
|
| 2023/2024冬 |
|
| 2022/2023冬 |
|
| 2021/2022冬 |
|
| 2020/2021冬 |
|
| 2019/2020冬 |
|
| 2018/2019冬 |
|
| 2017/2018冬 |
|
| 2016/2017冬 |
|
| 2015/2016冬 |
|
| 2014/2015冬 |
|
| 2013/2014冬 |
|
| 2012/2013冬 |
|
| 2011/2012冬 |
|
| 2010/2011冬 |
|
| 2009/2010冬 |
|
| 2008/2009冬 |
|
| 2007/2008冬 |
|
| 2006/2007冬 |
|
| 2005/2006冬 |
|
| 2004/2005冬 |
|
| 2003/2004冬 |
|
| 2002/2003冬 |
|
| 2001/2002冬 |
|
研究
[編集]インフルエンザウイルスワクチンの研究は、分子ウイルス学、分子進化、病因、宿主の免疫応答、ゲノミクス、および疫学などのさまざまな学問が重要となる。また、インフルエンザウイルスがどのように細胞に侵入し、複製し、変異し、新たな系統に進化し、免疫応答を誘導するかということに関する基礎研究を必要としている。「インフルエンザゲノム配列解析プロジェクト」は、インフルエンザの遺伝子配列のライブラリを作成している[172]。このプロジェクトによって、どのウイルス株が他のウイルス株より致命的なであるのか、どの遺伝的決定因子が免疫に最も影響を与えるのか、そしてウイルスがどのように進化するかを理解するのに役立つ。さらに、現状のワクチンによる対策の限界への解決策が研究されている。
世界的大流行に対する迅速な対応
[編集]インフルエンザの世界的大流行(いわゆるパンデミック)が発生した時、インフルエンザワクチンを迅速に開発、生産、流通させることは、何百万人もの命を救う可能性がある。短期間でパンデミックの原因となったウイルス株と特定し、それを迅速かつ安価に製造し、パンデミックの発生源地と予想されている中低所得国へ提供するために、研究者たちは、ニワトリ卵や遺伝子組み換え技術を用いた新しい技術の開発を進めている[173]。2009年に発生した新型インフルエンザの世界的流行と関連して、2009年7月には、70以上の臨床試験が完了しており、パンデミックを引き起こすインフルエンザ株に対するワクチン開発も進められた[174]。2009年9月、アメリカ食品医薬品局(FDA)は、2009年の新型インフルエンザウイルス株に対して4種類のワクチンを承認している[175]。
季節性インフルエンザに対する4価ワクチン
[編集]従来は、3種類のウイルス株が入った3価のインフルエンザワクチンが使用されていたが、2012年3月に、アメリカ食品医薬品局(FDA)によって、経鼻スプレーによって投与される4価インフルエンザワクチン(4種類のウイルス株が入ったもの)であるFluMist Quadrivalentが承認された[102][176]。さらに、2012年12月には、4価不活化ワクチンであるFluarix QuadrivalentがFDAの承認を受けた[177][178]。これらのワクチンは、アメリカ合衆国において2013-2014年のインフルエンザ流行期から導入されている。
日本においても、2015-2016年のインフルエンザ流行期から4価のインフルエンザワクチンが導入されている[167]。国立感染症研究所は、世界的に3価インフルエンザワクチンから4価インフルエンザワクチンへと移行が進んでいるのを受けて、4価インフルエンザワクチン導入の是非について2015年度における「インフルエンザワクチン株選定のための検討会議」において検討を行い、4株のワクチン株を選定した。この選定を受けて、最終的に厚生労働省が4価ワクチン導入を決定した[167]。なおこのとき、インフルエンザワクチンの医薬品としての製法、性状、品質、貯法等に関する基準を定めた「生物学的製剤基準」の改正もあわせて行われた[167][179]。
ユニバーサルインフルエンザワクチンの開発
[編集]インフルエンザワクチンは、2017年現在の技術では、各半球の各インフルエンザ流行期に合わせてそれぞれ内容を調整して製造しなければならない。このような必要がなく、すべてのインフルエンザ株に効果のあるワクチン「ユニバーサルインフルエンザワクチン」を開発することができれば、ワクチンの供給を安定させ、ウイルスの変異を原因とするインフルエンザのパンデミックを防ぐことができる様になる。そのため、何十年にもわたって研究の対象となってきた[180]。
この「ユニバーサルインフルエンザワクチン」を実現させるために、現在のワクチンが標的としているウイルス抗原(HAヘッド)ではなく、抗原変異が起こらない別の抗原部位(HAストーク)を標的にしてワクチンをつくるというアイデアがある[100]。
2009年には、世界インフルエンザワクチン会議(IVW2009)において、インフルエンザウイルスの3種類のタンパク質から、変異しない特定の領域9カ所を連結した遺伝子組み換えワクチンが「ユニバーサルインフルエンザワクチン」として発表された。その後、2015年にも別の手法によって作成したワクチンのマウス実験の結果が発表されている。
しかし、いずれの感染防御効果もいまだ実用段階には至っていない[100]。また、そのほか期待されている方法として、免疫系による免疫応答を利用して抗体を生成するワクチンシステムではなく、中和抗体を使用する方法が提案されている[180][181]。
出典
[編集]- ^ “Influenza Virus Vaccine Inactivated”. The American Society of Health-System Pharmacists. Jan 8, 2015閲覧。
- ^ a b Center for Disease Control and Prevention. “Key Facts About Seasonal Flu Vaccine”. 7 February 2013閲覧。
- ^ a b c d e f g h “Vaccines against influenza WHO position paper - November 2012.”. Wkly Epidemiol Rec 87 (46): 461-76. (Nov 23, 2012). PMID 23210147. archive
- ^ Manzoli L; Ioannidis JP; Flacco ME; De Vito C; Villari P (July 2012). “Effectiveness and harms of seasonal and pandemic influenza vaccines in children, adults and elderly: a critical review and re-analysis of 15 meta-analyses”. Hum Vaccin Immunother 8 (7): 851-62. doi:10.4161/hv.19917. PMC 3495721. PMID 22777099.
- ^ a b “Who Should Get Vaccinated Against Influenza”. U.S. Centers for Disease Control and Prevention (2015年11月4日). 2015年12月8日閲覧。
- ^ “Factsheet for the general public”. ecdc.europa.eu. 30 December 2016閲覧。
- ^ a b c d 新庄正宜 "施設における感染制御"「医学と薬学」 74(3): 269-275, 2017.
- ^ a b Jefferson, Tom; Rivetti, Alessandro; Di Pietrantonj, Carlo; et al. (2018). “Vaccines for preventing influenza in healthy children”. Cochrane Database of Systematic Reviews: CD004879. doi:10.1002/14651858.CD004879.pub5. PMID 29388195.
- ^ a b c d Jefferson, T; Di Pietrantonj, C; Al-Ansary, LA; Ferroni, E; Thorning, S; Thomas, RE (Feb 17, 2010). “Vaccines for preventing influenza in the elderly”. The Cochrane database of systematic reviews (2): CD004876. doi:10.1002/14651858.CD004876.pub3. PMID 20166072.
- ^ a b 日本内科学会成人予防接種検討ワーキンググループ、二木芳人、川上和義、丸山貴也、池松秀之、青木洋介、渡邊浩「成人予防接種のガイダンス 2016年改訂版」『日本内科学会雑誌』第105巻第8号、2016年、1472-1488頁、doi:10.2169/naika.105.1472、NAID 130005950166。
- ^ a b “Key Facts About Seasonal Flu Vaccine”. 2017年6月6日閲覧。
- ^ a b c d e f g h i j k 福士元春 「女性のワクチン接種 なぜこのワクチンが重要なのか!インフルエンザワクチン」『薬局』p.108, 110-111. 67(1): 129-132, 2016.
- ^ a b c 福見秀雄、「インフルエンザワクチンの歴史」『ウイルス』 1985年 35巻 2号 p.107-122, doi:10.2222/jsv.35.107、日本ウイルス学会
- ^ “WHO Model List of Essential Medicines (20th List)”. World Health Organization (April 2015). 2017年6月16日閲覧。
- ^ a b “how it's made”. 2010年7月5日時点のオリジナルよりアーカイブ。2010年7月5日閲覧。
- ^ a b c d New and Old Ways to Make Flu Vaccines, November 8, 2007, National Public Radio.
- ^ “インフルワクチン製造に使うニワトリ、米秘密農場で飼育”. CNN (2020年4月18日). 2020年4月18日閲覧。
- ^ “Influenza vaccine viruses and reagents”. World Health Organization. 2017年6月6日閲覧。
- ^ “Recommendations for the production and control of influenza vaccine (inactivated)”. World Health Organization. 27 May 2013閲覧。
- ^ インフルエンザワクチン株 - 国立感染症研究所
- ^ “新型インフルエンザワクチン接種事業(平成22年度)に関するお知らせ”. 厚生労働省. 2021年11月6日閲覧。
- ^ PATH, Oliver Wyman. Influenza Vaccine Strategies for Broad Global Access. 2007. “df=mdy-all Archived copy”. 2009年9月16日時点のオリジナルよりアーカイブ。2009年9月16日閲覧。
- ^ a b “Influenza virus growth in eggs”. Virology Blog (Dec 2009). 2017年6月6日閲覧。
- ^ “Viral Cultivation in Chicken Embryo”. Youtube (Apr 2012). 2017年6月6日閲覧。
- ^ a b “How Influenza (Flu) Vaccines Are Made”. Centers for Disease Control and Prevention (May 2014). 2017年6月6日閲覧。
- ^ 第一三共 インフルインフルエンザHAワクチン「北里第一三共」シリンジ0.5mL 添付文書
- ^ a b c d e f g h i j 厚生労働省 平成28年度インフルエンザQ&A, 平成28年11月9日. 2017年6月10日最終確認
- ^ 長井正昭(北里研究所生物製剤研究所) 新型インフルエンザについて(その3)-インフルエンザワクチンについて- 日本薬学会、2009年5月,2016年6月16日最終閲覧
- ^ 「ビケンHA」IF (PDF)
- ^ Bright, Rick A.; Carter, Donald M.; Daniluk, Shannon; Toapanta, Franklin R.; Ahmad, Attiya; Gavrilov, Victor; Massare, Mike; Pushko, Peter et al. (2007). “Influenza virus-like particles elicit broader immune responses than whole virion inactivated influenza virus or recombinant hemagglutinin”. Vaccine 25 (19): 3871-8. doi:10.1016/j.vaccine.2007.01.106. PMID 17337102.
- ^ a b Andrew Pollack, "Rapidly Produced Flu Vaccine Wins F.D.A. Approval", The New York Times, January 16, 2013
- ^ “Priming with DNA vaccine makes avian flu vaccine work better (NIH News)” (October 3, 2011). 2017年6月6日閲覧。
- ^ "Novartis receives FDA approval for Flucelvax, the first cell-culture vaccine in US to help protect against seasonal influenza" (Press release). Novartis. November 20, 2012. 2012年11月28日時点のオリジナルよりアーカイブ。
- ^ “"FDA approves first seasonal influenza vaccine manufactured using cell culture technology"”. 2012年11月26日時点のオリジナルよりアーカイブ。unknown閲覧。
- ^ Research, Center for Biologics Evaluation and. “Approved Products - November 20, 2012 Approval Letter- Flucelvax”. 2017年6月6日閲覧。
- ^ "Seqirus receives FDA approval for Flucelvax Quadrivalent (Influenza Vaccine) for people four years of age and older" (Press release). CSL Limited. 23 May 2016.
- ^ a b CSLベーリング CSL Limited 2015/16年度通期業績発表 2016年08月17発表, 2017年6月10日最終確認
- ^ "FDA approves first seasonal influenza vaccine manufactured using cell culture technology" (Press release). U.S. Food and Drug Administration (FDA). 20 November 2012.
- ^ Vaccine, Influenza - Drug Price Indicator Guide
- ^ Tarascon Pocket Pharmacopoeia 2015 Deluxe Lab-Coat Edition, 2015 Jones & Bartlett Learning ISBN 978-1284057560 p.314
- ^ a b 厚生労働省 医療保険が適用される医薬品について
- ^ 病院を知ろう!プロジェクト 2017年版 インフルエンザ予防接種全国平均価格 QLife, 2017年11月10日最終閲覧
- ^ Fedson, D. S. (1998). “Measuring protection: Efficacy versus effectiveness”. Developments in biological standardization 95: 195-201. PMID 9855432.
- ^ a b c d e f Demicheli, Vittorio; Jefferson, Tom; Al-Ansary, Lubna A; Ferroni, Eliana; Rivetti, Alessandro; Di Pietrantonj, Carlo (2014). “Vaccines for preventing influenza in healthy adults”. Cochrane Database of Systematic Reviews (3): CD001269. doi:10.1002/14651858.CD001269.pub5. PMID 24623315.
- ^ Stephenson, I.; Zambon, M. C.; Rudin, A.; Colegate, A.; Podda, A.; Bugarini, R.; Del Giudice, G.; Minutello, A. et al. (2006). “Phase I Evaluation of Intranasal Trivalent Inactivated Influenza Vaccine with Nontoxigenic Escherichia coli Enterotoxin and Novel Biovector as Mucosal Adjuvants, Using Adult Volunteers”. Journal of Virology 80 (10): 4962-70. doi:10.1128/JVI.80.10.4962-4970.2006. PMC 1472052. PMID 16641287.
- ^ Jefferson, T. (2006). “Influenza vaccination: Policy versus evidence”. BMJ 333 (7574): 912-5. doi:10.1136/bmj.38995.531701.80. PMC 1626345. PMID 17068038.
- ^ “2007-2008 Influenza (Flu) Season”. CDC (June 26, 2008). 2017年6月6日閲覧。
- ^ a b 関由喜「インフルエンザワクチンの有効性がわかるtest-negative case-control designとはどのような方法ですか」『インフルエンザ』Vol.18 No.1(2017-1)p.26
- ^ 鈴木基ほか 日本の 2011-12 冬季シーズンにおける、検査で確認されたインフルエンザによる 受診に対するワクチン予防効果に関する研究 研究要旨,2014 長崎大学
- ^ 生馬医院 2014/12/15〜2015/3/22におけるインフルエンザワクチン効果,2015
- ^ “インフルエンザワクチンの接種「インフルエンザワクチンの有効性」]”. アステラス製薬. 2017年8月7日時点のオリジナルよりアーカイブ。2017年7月21日閲覧。
- ^ a b c “Vaccines for preventing influenza in healthy children”. Cochrane Database Syst Rev 8: CD004879. (2012). doi:10.1002/14651858.CD004879.pub4. PMID 22895945.
- ^ Jefferson, T; Rivetti, D; Rivetti, A; Rudin, M; Di Pietrantonj, C; Demicheli, V (2005). “Efficacy and effectiveness of influenza vaccines in elderly people: A systematic review”. The Lancet 366 (9492): 1165-74. doi:10.1016/S0140-6736(05)67339-4. PMID 16198765.
- ^ Osterholm, Michael T; Kelley, Nicholas S; Sommer, Alfred; Belongia, Edward A (2012). “Efficacy and effectiveness of influenza vaccines: A systematic review and meta-analysis”. The Lancet Infectious Diseases 12 (1): 36-44. doi:10.1016/s1473-3099(11)70295-x. PMID 22032844.
- ^ “ACIP votes down use of LAIV for 2016-2017 flu season”. CDC (2016年6月26日). 2018年4月10日閲覧。
- ^ “ACIP: LAIV OK to Use During 2018-19 Flu Season”. ACIP (2018年2月26日). 2018年4月10日閲覧。
- ^ a b c d e f g h インフルエンザ大流行。日本から失われた「集団免疫」とは? ハフポスト日本版
- ^ The Japanese Experience with Vaccinating Schoolchildren against Influenza March 22, 2001 N Engl J Med 2001; 344:889-896 DOI: 10.1056/NEJM200103223441204
- ^ a b Jackson, Michael L.; Chung, Jessie R.; Jackson, Lisa A.; et al. (2017). “Influenza Vaccine Effectiveness in the United States during the 2015-2016 Season”. New England Journal of Medicine 377 (6): 534-543. doi:10.1056/NEJMoa1700153. PMID 29388196.
- ^ a b Osterholm, MT; Kelley, NS; Sommer, A; Belongia, EA (Jan 2012). “Efficacy and effectiveness of influenza vaccines: a systematic review and meta-analysis.”. The Lancet. Infectious diseases 12 (1): 36-44. doi:10.1016/S1473-3099(11)70295-X. PMID 22032844.
- ^ a b Burls, A; Jordan, R; Barton, P; Olowokure, B; Wake, B; Albon, E; Hawker, J (2006). “Vaccinating healthcare workers against influenza to protect the vulnerable-Is it a good use of healthcare resources- A systematic review of the evidence and an economic evaluation”. Vaccine 24 (19): 4212-21. doi:10.1016/j.vaccine.2005.12.043. PMID 16546308.
- ^ Ahmed, F.; Lindley, M. C.; Allred, N.; Weinbaum, C. M.; Grohskopf, L. (2013). “Effect of Influenza Vaccination of Healthcare Personnel on Morbidity and Mortality Among Patients: Systematic Review and Grading of Evidence”. Clinical Infectious Diseases 58 (1): 50-7. doi:10.1093/cid/cit580. PMID 24046301.
- ^ Griffin, M. R. (2013). “Editorial Commentary: Influenza Vaccination of Healthcare Workers: Making the Grade for Action”. Clinical Infectious Diseases 58 (1): 58-60. doi:10.1093/cid/cit590. PMID 24046312.
- ^ Chung JR, et al. Patterns of Influenza Vaccination and Vaccine Effectiveness Among Young US Children Who Receive Outpatient Care for Acute Respiratory Tract Illness. JAMA Pediatr . 2020 May 4;174(7):1-9.
- ^ Simonsen, Lone; Viboud, Cecile; Taylor, Robert J.; Miller, Mark A.; Jackson, Lisa (2009). “Influenza vaccination and mortality benefits: New insights, new opportunities”. Vaccine 27 (45): 6300-4. doi:10.1016/j.vaccine.2009.07.008. PMID 19840664.
- ^ Darvishian, Maryam; Bijlsma, Maarten J; Hak, Eelko; Van Den Heuvel, Edwin R (2014). “Effectiveness of seasonal influenza vaccine in community-dwelling elderly people: A meta-analysis of test-negative design case-control studies”. The Lancet Infectious Diseases 14 (12): 1228-39. doi:10.1016/S1473-3099(14)70960-0. PMID 25455990.
- ^ Nichol, Kristin L.; Nordin, James D.; Nelson, David B.; Mullooly, John P.; Hak, Eelko (2007). “Effectiveness of Influenza Vaccine in the Community-Dwelling Elderly”. New England Journal of Medicine 357 (14): 1373-81. doi:10.1056/NEJMoa070844. PMID 17914038.
- ^ Simonsen, Lone; Taylor, Robert J; Viboud, Cecile; Miller, Mark A; Jackson, Lisa A (2007). “Mortality benefits of influenza vaccination in elderly people: An ongoing controversy”. The Lancet Infectious Diseases 7 (10): 658-66. doi:10.1016/S1473-3099(07)70236-0. PMID 17897608.
- ^ Thompson, William W.; Shay, D. K.; Weintraub, E; Brammer, L; Cox, N; Anderson, L. J.; Fukuda, K (2003). “Mortality Associated with Influenza and Respiratory Syncytial Virus in the United States”. JAMA 289 (2): 179-86. doi:10.1001/jama.289.2.179. PMID 12517228.
- ^ “High Dose Flu Vaccine for the Elderly ≪ Science-Based Medicine”. Sciencebasedmedicine.org. October 17, 2013閲覧。
- ^ “CDC - Seasonal Influenza (Flu) - Q & A: Fluzone High-Dose Seasonal Influenza Vaccine”. Cdc.gov (August 13, 2013). October 17, 2013閲覧。
- ^ Haverkate, M; d'Ancona, F; Giambi, C; Johansen, K; Lopalco, P. L.; Cozza, V; Appelgren, E; VENICE project gatekeepers contact points (2012). “Mandatory and recommended vaccination in the EU, Iceland and Norway: Results of the VENICE 2010 survey on the ways of implementing national vaccination programmes”. Euro surveillance 17 (22). PMID 22687916.
- ^ Field, R. I. (2009). “Mandatory vaccination of health care workers: Whose rights should come first-”. P & T 34 (11): 615-8. PMC 2810172. PMID 20140133.
- ^ Kassianos, George (2015). “Willingness of European healthcare workers to undergo vaccination against seasonal influenza: Current situation and suggestions for improvement”. Drugs in Context 4: 212268. doi:10.7573/dic.212268. PMC 4316812. PMID 25657810.
- ^ Thomas, Roger E; Jefferson, Tom; Lasserson, Toby J (2016). “Influenza vaccination for healthcare workers who care for people aged 60 or older living in long-term care institutions”. Cochrane Database of Systematic Reviews (6): CD005187. doi:10.1002/14651858.CD005187.pub5. PMID 27251461.
- ^ Fell, Deshayne B.; Sprague, Ann E.; Liu, Ning; Yasseen, Abdool S.; Wen, Shi-Wu; Smith, Graeme; Walker, Mark C. (2012). “H1N1 Influenza Vaccination During Pregnancy and Fetal and Neonatal Outcomes”. American Journal of Public Health 102 (6): e33-40. doi:10.2105/AJPH.2011.300606. PMC 3483960. PMID 22515877.
- ^ Madhi, Shabir A.; Cutland, Clare L.; Kuwanda, Locadiah; Weinberg, Adriana; Hugo, Andrea; Jones, Stephanie; Adrian, Peter V.; Van Niekerk, Nadia et al. (2014). “Influenza Vaccination of Pregnant Women and Protection of Their Infants”. New England Journal of Medicine 371 (10): 918-31. doi:10.1056/NEJMoa1401480. PMID 25184864.
- ^ a b “Live, Intranasal Influenza VIS”. 2017年6月7日閲覧。 CDC
- ^ a b “CDC - Inactivated Influenza Vaccine 2007-2008 - What You Need To Know”. 2008年1月7日時点のオリジナルよりアーカイブ。unknown閲覧。
- ^ “Key Facts About Seasonal Flu Vaccine”. cdc.gov. Center for Disease Control. 26 September 2014閲覧。
- ^ “韓国疾病管理庁「インフルエンザ接種は継続、死亡26人はワクチンと無関係」”. 朝鮮日報 (2020年10月24日). 2020年10月24日閲覧。
- ^ Gagnon, Remi; Primeau, Marie Noel; Des Roches, Anne; Lemire, Chantal; Kagan, Rhoda; Carr, Stuart; Ouakki, Manale; Benoit, Melanie et al. (2010). “Safe vaccination of patients with egg allergy with an adjuvanted pandemic H1N1 vaccine”. Journal of Allergy and Clinical Immunology 126 (2): 317-23. doi:10.1016/j.jaci.2010.05.037. PMID 20579720.
- ^ National Advisory Committee on Immunization (August 2012). “Statement on Seasonal Influenza Vaccine for 2012-2013”. Canadian Communicable Disease Report 38. オリジナルの2013-01-17時点におけるアーカイブ。 18 July 2013閲覧。.
- ^ Turner, Paul J; Southern, Jo; Andrews, Nick J; Miller, Elizabeth; Erlewyn-Lajeunesse, Michel (2015). “Safety of live attenuated influenza vaccine in young people with egg allergy: Multicentre prospective cohort study”. BMJ 351: h6291. doi:10.1136/bmj.h6291. PMC 4673102. PMID 26645895.
- ^ Greenhawt, Matthew (2015). “Live attenuated influenza vaccine for children with egg allergy”. BMJ 351: h6656. doi:10.1136/bmj.h6656. PMID 26657778.
- ^ Haber, Penina; Sejvar, James; Mikaeloff, Yann; Destefano, Frank (2009). “Vaccines and Guillain-Barre Syndrome”. Drug Safety 32 (4): 309-23. doi:10.2165/00002018-200932040-00005. PMID 19388722.
- ^ Kaplan, J. E. (1982). "Guillain-Barre syndrome in the United States, 1979-1980 and 1980-1981. Lack of an association with influenza vaccination". JAMA 248 (6): 428.PMID 25996397
- ^ Stowe, J.; Andrews, N.; Wise, L.; Miller, E. (2008). “Investigation of the Temporal Association of Guillain-Barre Syndrome with Influenza Vaccine and Influenzalike Illness Using the United Kingdom General Practice Research Database”. American Journal of Epidemiology 169 (3): 382-8. doi:10.1093/aje/kwn310. PMID 19033158.
- ^ a b Sivadon‐Tardy, Valerie; Orlikowski, David; Porcher, Raphael; Sharshar, Tarek; Durand, Marie‐Christine; Enouf, Vincent; Rozenberg, Flore; Caudie, Christiane et al. (2009). “Guillain‐Barre Syndrome and Influenza Virus Infection”. Clinical Infectious Diseases 48 (1): 48-56. doi:10.1086/594124. PMID 19025491.
- ^ Vellozzi, Claudia; Burwen, Dale R.; Dobardzic, Azra; Ball, Robert; Walton, Kimp; Haber, Penina (2009). “Safety of trivalent inactivated influenza vaccines in adults: Background for pandemic influenza vaccine safety monitoring”. Vaccine 27 (15): 2114-20. doi:10.1016/j.vaccine.2009.01.125. PMID 19356614.
- ^ Steven Reinberg (February 2, 2011). “Last Year's H1N1 Flu Vaccine Was Safe, Study Finds”. U.S. News & World Report
- ^ 小林, 真之; 武知, 茉莉亜; 近藤, 亨子; 大藤, さとこ; 福島, 若葉; 前田, 章子; 廣田, 良夫 (2010). “不活化インフルエンザワクチンとギラン・バレー症候群の関連についての文献的考察”. 日本公衆衛生雑誌 57 (8): 605-611. doi:10.11236/jph.57.8_605.
- ^ TECHNICAL REPORT: Narcolepsy in association with pandemic influenza vaccination. Stockholm, Sweden: European Centre for Disease Prevention and Contro. (2012)
- ^ Yong, Ed (2013). “Narcolepsy confirmed as autoimmune disease”. Nature. doi:10.1038/nature.2013.14413.
- ^ ナルコレプシーは自己免疫疾患であることが確定 Nature ダイジェスト Vol. 11 No. 4 | doi : 10.1038/ndigest.2014.140405, Nature Japan K.K., 2017年6月7日最終閲覧。
- ^ Offit, Paul A. (2007). “Thimerosal and Vaccines - A Cautionary Tale”. New England Journal of Medicine 357 (13): 1278-9. doi:10.1056/NEJMp078187. PMID 17898096.
- ^ Global Advisory Committee on Vaccine Safety (2015-02-02(Update)). “Thiomersal and vaccines”. World Health Organization. 2018年4月20日閲覧。
- ^ a b Plotkin & Mortimer (1988). Vaccines. Philadelphia: W.B. Saunders Company
- ^ Product Monograph: Flumist QUADRIVALENT, Astrazeneca Canada Inc., (2017)
- ^ a b c d 齋藤昭彦, 柏木征三郎, 酒井伸夫 "インフルエンザワクチンの現況と今後の展望"「インフルエンザ」 17(1): 7-13, 2016.
- ^ a b c アストラゼネカ アストラゼネカ 日本における鼻腔噴霧インフルエンザ弱毒生ワクチンの開発・商業化に関するライセンス契約を第一三共と締結, 2015年9月2日,2017年6月10日最終閲覧
- ^ a b “First Quadrivalent Vaccine Against Seasonal Flu Wins FDA Approval”. 2017年6月6日閲覧。
- ^ 西村尚子 インフル用経鼻ワクチンが効かなくなった理由,2016年 ,2017年6月10日最終確認
- ^ 『北日本新聞』2023年2月28日付4面『鼻噴霧タイプのワクチン販売承認 季節性インフル』より。
- ^ 齋藤昭彦, 柏木征三郎, 酒井伸夫 "インフルエンザワクチンの現況と今後の展望"「インフルエンザ」p.8 17(1): 7-13, 2016.
- ^ Seqirus Fluvirin, 2017年6月10日最終確認
- ^ CSL Afluria Quad, 2017年6月10日最終確認
- ^ アストラゼネカ FluMist Quadrivalent, 2017年6月10日最終確認
- ^ UMNファーマ 当社技術導入元ProteinSciencesCorporationがFlublok®4価製剤の製造販売承認をFDAより取得したことに関するお知らせ,2016年10月13日 ,2017年6月11日最終確認
- ^ a b Fiore, A. E.; Shay, D. K.; Broder, K; Iskander, J. K.; Uyeki, T. M.; Mootrey, G; Bresee, J. S.; Cox, N. J. et al. (2009). “Prevention and control of seasonal influenza with vaccines: Recommendations of the Advisory Committee on Immunization Practices (ACIP), 2009”. MMWR. Recommendations and reports 58 (RR-8): 1-52. PMID 19644442.
- ^ Skowronski, Danuta M.; De Serres, Gaston (2009). “Is routine influenza immunization warranted in early pregnancy-”. Vaccine 27 (35): 4754-70. doi:10.1016/j.vaccine.2009.03.079. PMID 19515466.
- ^ Health Care Guideline: Routine Prenatal Care. Fourteenth Edition. By the Institute for Clinical Systems Improvement. July 2010.
- ^ To, K.W.; Lai, A.; Lee, K.C.K.; Koh, D.; Lee, S.S. (2016). “Increasing the coverage of influenza vaccination in healthcare workers: Review of challenges and solutions”. Journal of Hospital Infection 94 (2): 133-42. doi:10.1016/j.jhin.2016.07.003. PMID 27546456.
- ^ a b c d Rubin, G. James; Potts, Henry W.W.; Michie, Susan (2011). “Likely uptake of swine and seasonal flu vaccines among healthcare workers. A cross-sectional analysis of UK telephone survey data”. Vaccine 29 (13): 2421-8. doi:10.1016/j.vaccine.2011.01.035. PMID 21277402.
- ^ “Influenza (Seasonal)”. World Health Organization (November 2016). 2017年6月6日閲覧。
- ^ “Seasonal Flu Shot- Seasonal Influenza (Flu) - CDC”. 2017年6月6日閲覧。
- ^ “Vaccine use”. World Health Organization. 2017年10月5日閲覧。
- ^ “Influenza (Seasonal) Fact sheet”. World Health Organization (November 2016). 2017年10月5日閲覧。
- ^ “Seasonal influenza”. World Health Organization. 2017年10月5日閲覧。
- ^ “U.S. panel recommends all kids get the flu shot”. CTV. (February 27, 2008). オリジナルの2013年1月15日時点におけるアーカイブ。. "In Canada, the National Advisory Committee on Immunization (NACI), the group that advises the Public Health Agency of Canada, currently says that children between the age of six and 24 months should be considered a high priority for the flu vaccine."
- ^ “Statement on Seasonal Influenza Vaccine for 2013-2014 - CCDR Vol.39 ACS-4 - Public Health Agency of Canada”. Phac-aspc.gc.ca (2013年11月14日). 2014年7月24日閲覧。
- ^ “Influenza vaccination”. ecdc.europa.eu. 24 December 2016閲覧。
- ^ ECDC Reviews "New WHO recommendations on seasonal influenza immunization from the Strategic Advisory Group of Experts on Immunization (SAGE) - adding pregnant women as the highest priority and consideration of immunising children aged 6 months to 5 years" 25 May 2012
- ^ “ECDC GUIDANCE: Priority risk groups for influenza vaccination (p. 7-8)”. European Centre for Disease Prevention and Control. 25 December 2016閲覧。
- ^ a b Fiore, AE; Uyeki; Broder, K; Finelli, L; Euler, GL; Singleton, JA; Iskander, JK; Wortley, PM et al. (August 2010). “Prevention and control of influenza with vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP), 2010”. MMWR Recomm Rep 59 (RR-8): 1-62. PMID 20689501.
- ^ Centers for Disease Control Prevention (CDC). (August 2012). “Prevention and control of influenza with vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP) - United States, 2012-13 influenza season”. MMWR Morb. Mortal. Wkly. Rep. 61 (32): 613-8. ISSN 0149-2195. PMID 22895385.
- ^ “Children, the Flu, and the Flu Vaccine- Seasonal Influenza (Flu) - CDC”. 2017年6月6日閲覧。
- ^ “Vaccine for Flu (Influenza)”. CDC (2019年8月2日). 2020年10月22日閲覧。
- ^ Godman, Heidi (2022年9月1日). “Fall vaccination roundup” (英語). Harvard Health. 2022年8月18日閲覧。
- ^ “Influenza Vaccination: A Summary for Clinicians - Health Professionals - Seasonal Influenza (Flu)”. 2017年6月6日閲覧。
- ^ Couch, Robert B.; Winokur, Patricia; Brady, Rebecca; Belshe, Robert; Chen, Wilbur H.; Cate, Thomas R.; Sigurdardottir, Bryndis; Hoeper, Amy et al. (2007). “Safety and immunogenicity of a high dosage trivalent influenza vaccine among elderly subjects”. Vaccine 25 (44): 7656-63. doi:10.1016/j.vaccine.2007.08.042. PMC 2243220. PMID 17913310.
- ^ 米国FDA、65歳以上の年齢層に対する新しい季節性インフルエンザワクチンを承認、Sanofi Pasteur Press Release, 2010 年1月6日(2017年6月7日最終閲覧)
- ^ Centers for Disease Control Prevention (CDC). (2010). “Seasonal influenza and 2009 H1N1 influenza vaccination coverage among pregnant women--10 states, 2009-10 influenza season”. MMWR. Morbidity and mortality weekly report 59 (47): 1541-5. PMID 21124293.
- ^ a b Altman, Lawrence K. (February 28, 2008). “Panel Advises Flu Shots for Children Up to Age 18”. The New York Times
- ^ Tanner, Lindsey (2013年1月13日). “Hospitals crack down on workers who refuse flu shots”. NBC News. 2014年7月24日閲覧。
- ^ “CDC Press Releases”. CDC 2016年11月26日閲覧。
- ^ “Immunization Schedules”. CDC. Center for Disease Control and Prevention. 4 November 2014閲覧。
- ^ “予防接種情報 - よくある質問”. www.mhlw.go.jp. 厚生労働省. 2022年11月4日閲覧。
- ^ “予防接種法施行規則(昭和二十三年厚生省令第三十六号)”. e-Gov法令検索. 総務省行政管理局. 2019年12月17日閲覧。
- ^ 定期接種実施要領 平成25年3月30日健発0330第2号厚生労働省健康局長通知別添
- ^ “今年度より小児インフルエンザワクチンの接種量が変更(増量)となります”. 医師会からのお知らせ(千葉県医師会) (2011年10月13日). 2019年12月13日閲覧。
- ^ 病院を知ろう!プロジェクト インフルエンザ予防接種全国平均価格を公開 2016年, QLife, 2017年6月16日最終閲覧
- ^ “季節性インフルエンザワクチン接種時期ご協力のお願い”. 厚生労働省 (2020年9月). 2020年10月22日閲覧。
- ^ a b Han, You Kyung Julia; Michie, Susan; Potts, Henry W.W.; Rubin, G. James (2016). “Predictors of influenza vaccine uptake during the 2009/10 influenza a H1N1v ('swine flu') pandemic: Results from five national surveys in the United Kingdom”. Preventive Medicine 84: 57-61. doi:10.1016/j.ypmed.2015.12.018. PMC 4766366. PMID 26757401.
- ^ Bish, Alison; Yardley, Lucy; Nicoll, Angus; Michie, Susan (2011). “Factors associated with uptake of vaccination against pandemic influenza: A systematic review”. Vaccine 29 (38): 6472-84. doi:10.1016/j.vaccine.2011.06.107. PMID 21756960.
- ^ Brien, Stephanie; Kwong, Jeffrey C.; Buckeridge, David L. (2012). “The determinants of 2009 pandemic A/H1N1 influenza vaccination: A systematic review”. Vaccine 30 (7): 1255-64. doi:10.1016/j.vaccine.2011.12.089. PMID 22214889.
- ^ La Torre, G; Di Thiene, D; Cadeddu, C; Ricciardi, W; Boccia, A (2009). “Behaviours regarding preventive measures against pandemic H1N1 influenza among Italian healthcare workers, October 2009”. Euro surveillance 14 (49). PMID 20003908.
- ^ Amodio, Emanuele; Anastasi, Giovanna; Marsala, Maria Grazia Laura; Torregrossa, Maria Valeria; Romano, Nino; Firenze, Alberto (2011). “Vaccination against the 2009 pandemic influenza A (H1N1) among healthcare workers in the major teaching hospital of Sicily (Italy)”. Vaccine 29 (7): 1408-12. doi:10.1016/j.vaccine.2010.12.041. PMID 21199700.
- ^ Chor, J. S Y; Ngai, K. L.; Goggins, W. B; Wong, M. C S; Wong, S. Y S; Lee, N.; Leung, T.-f.; Rainer, T. H et al. (2009). “Willingness of Hong Kong healthcare workers to accept pre-pandemic influenza vaccination at different WHO alert levels: Two questionnaire surveys”. BMJ 339: b3391. doi:10.1136/bmj.b3391. PMC 2731837. PMID 19706937.
- ^ “CDC updates flu vaccination recommendations”. 2017年6月6日閲覧。
- ^ Centers for Disease Control Prevention (CDC) (2011). “Influenza vaccination coverage among health-care personnel --- United States, 2010-11 influenza season”. MMWR. Morbidity and mortality weekly report 60 (32): 1073-7. PMID 21849963.
- ^ Centers for Disease Control Prevention (CDC) (2012). “Influenza vaccination coverage among health-care personnel: 2011-12 influenza season, United States”. MMWR. Morbidity and mortality weekly report 61: 753-7. PMID 23013720.
- ^ The Threat of Pandemic Influenza: Are We Ready- Workshop Summary (2005) (free online book),Washington (DC): National Academies Press (US); 2005. p.62
- ^ Joseph C. Parker Jr Ernest William Goodpasture - Scientist, Scholar, Gentleman Association of Clinical Scientists, Winter 2004 vol. 34 no. 1 116
- ^ Plotkin, S.L. and Plotkin, S.A. "A short history of vaccination." In: Vaccines, Stanley A. Plotkin, Walter A. Orenstein, Paul A. Offit, eds. Elsevier Health Sciences, 2008, pp. 6-7.
- ^ Artenstein, A.W. "Influenza" In: Vaccines: A Biography Andrew W. Artenstein, ed. pp. 191-205.
- ^ Hampson, A. W. (2008). “Vaccines for pandemic influenza. The history of our current vaccines, their limitations and the requirements to deal with a pandemic threat”. Annals of the Academy of Medicine, Singapore 37 (6): 510-7. PMID 18618064.
- ^ USFDA FDA approves first seasonal influenza vaccine manufactured using cell culture technology. November 20, 2012.
- ^ USFDA FDA approves new seasonal influenza vaccine made using novel technology. Jan. 16, 2013.
- ^ Landry, Nathalie; Ward, Brian J.; Trepanier, Sonia; Montomoli, Emanuele; Dargis, Michele; Lapini, Giulia; Vezina, Louis-P. (2010). “Preclinical and Clinical Development of Plant-Made Virus-Like Particle Vaccine against Avian H5N1 Influenza”. PLoS ONE 5 (12): e15559. Bibcode: 2010PLoSO...515559L. doi:10.1371/journal.pone.0015559. PMC 3008737. PMID 21203523.
- ^ 高橋真理子 (2014年11月21日). “常識破りの連続だったインフルワクチン報道” 2018年4月10日閲覧。
- ^ WHO Report on Global Surveillance of Epidemic-prone Infectious Diseases (pdf)
- ^ 国立感染症研究所 季節性および動物由来インフルエンザウイルスの最近の動向について, 2015
- ^ WHO article Global influenza surveillance
- ^ Brown, David (2008年2月18日). “Keeping ahead of flu comes down to guessing game”. Knoxville News Sentinel. The Washington Post. オリジナルの2009年1月11日時点におけるアーカイブ。 2015年12月22日閲覧。
- ^ “2007-2008 Influenza (Flu) Season”. CDC (June 26, 2008). 2017年6月6日閲覧。
- ^ a b c d 国立感染症研究所 平成27年度(2015/16シーズン)インフルエンザワクチン株の選定経過,IASR Vol. 36 p. 217-220: 2015年11月号
- ^ 国立感染症研究所 平成26年度(2014/15シーズン)インフルエンザワクチン株の選定経過,IASR Vol. 35 p. 267-269: 2014年11月号,2017年6月10日最終閲覧
- ^ 新型インフルエンザA(H1N1)pdm09対策関連情報 厚生労働省
- ^ 2020/21シーズン向けインフルエンザワクチンの製造株について 第5回厚生科学審議会予防接種・ワクチン分科会研究開発及び生産・流通部会季節性インフルエンザワクチンの製造株について検討する小委員会 (2020年4月23日) (PDF)
- ^ 『インフルエンザワクチン株』(プレスリリース)国立感染症研究所、2024年5月14日。2024年6月17日閲覧。
- ^ “Influenza Genome Sequencing Project - Overview”. National Institutes of Health - National Institute of Allergy and Infectious Diseases. 27 June 2011時点のオリジナルよりアーカイブ。27 May 2013閲覧。
- ^ World Health Organization. Acyte Respiratory Infections: Influenza. 2009. http://www.who.int/vaccine_research/diseases/ari/en/index1.html
- ^ World Health Organization. Tables on the Clinical trials of pandemic influenza prototype vaccines. July 2009. http://www.who.int/vaccine_research/immunogenicity/immunogenicity_table.xls
- ^ US Food & Drug Administration. FDA Approves Vaccines for 2009 H1N1 Influenza Virus Approval Provides Important Tool to Fight Pandemic. September 15, 2009.
- ^ “"FDA approves first quadrivalent vaccine to prevent seasonal influenza"”. 2012年3月1日時点のオリジナルよりアーカイブ。unknown閲覧。
- ^ Research, Center for Biologics Evaluation and. “Approved Products - December 14, 2012 Approval Letter- Fluarix Quadrivalent”. 2017年6月6日閲覧。
- ^ インフルエンザワクチンについて,横浜市衛生研究所,2016年改訂,2017年6月8日最終閲覧。
- ^ 厚生労働省 生物学的製剤基準, 平成16年3月30日厚生労働省告示第155号, 最終改正:平成29年3月30日厚生労働省告示第109号
- ^ a b Cho, Alice; Wrammert, Jens (2016). “Implications of broadly neutralizing antibodies in the development of a universal influenza vaccine”. Current Opinion in Virology 17: 110-5. doi:10.1016/j.coviro.2016.03.002. PMC 4940123. PMID 27031684.
- ^ Soema, Peter C.; Kompier, Ronald; Amorij, Jean-Pierre; Kersten, Gideon F.A. (2015). “Current and next generation influenza vaccines: Formulation and production strategies”. European Journal of Pharmaceutics and Biopharmaceutics 94: 251-63. doi:10.1016/j.ejpb.2015.05.023. PMID 26047796.
関連項目
[編集]- インフルエンザ菌b型ワクチン(Hibワクチン) - インフルエンザウイルスとインフルエンザ菌は全く異なる病原体であることに注意。
