タキソール全合成

有機化学において、タキソール全合成(タキソールぜんごうせい、英: Taxol total synthesis)は現在も続いている主要な研究課題の1つである。このジテルペノイドは重要な癌の治療薬であるが、タイヘイヨウイチイ (pacific yew) などからわずかしか採取できないため高価である。タキソールの化学合成法が開発できれば、それ自体が商業的・化学的に重要であるだけでなく、より強い効果を持つ可能性を秘める天然には見られない誘導体の合成への道が開ける。
タキソール分子はバッカチンIII (baccatin III) と呼ばれる4環性の核部分とアミド尾部からなる。環の部分はそれぞれ左からA環(シクロヘキサン)、B環(シクロオクタン)、C環(シクロヘキサン)、D環(オキセタン)と略称される。
タキソール製剤の開発には40年以上が費やされている。タイヘイヨウイチイの樹皮の抽出物の抗腫瘍活性は、20年間に及ぶアメリカ政府の抗癌剤探索計画の1つである植物スクリーニング計画 (plant screening program) での追跡調査の末、1963年に発見された。抗腫瘍性を示す活性基質は1969年に発見され、構造決定は1971年に完了した。フロリダ州立大学のロバート・ホルトンが1994年にタキソールの全合成に成功した(計画の開始は1982年)。ホルトンはまた、1989年に 10-デアセチルバッカチンIII からの半合成によるタキソール合成法を開発している。この化合物は生合成における前駆体であり、ヨーロッパイチイ (Europian yew, Taxus baccata) からタキソールよりも大量に得られる。ブリストル・マイヤーズ スクイブ社がこの合成法の特許を買い取り、フロリダ州立大学とホルトン(取り分40%)は合わせて2億ドル以上を受け取っている。
要点
[編集]
全合成を報告している研究グループは、2024年1月現在10グループを数える[要出典]。いくつかの方法は完全な全合成だが、天然物を前駆体としているものも含まれる。各方法の要点を以下にまとめる。全ての合成戦略に共通するのは、まずバッカチン部分を合成し、最終段階で尾部を付加する尾島ラクタム法に基づいている点である。
- ホルトンのタキソール全合成 - 1994年にロバート・ホルトンらによって発表された。パチョロールを前駆体とする直線的合成で、A,B環、C環、D環の順に構築する。
- ニコラウのタキソール全合成 - 1994年にキリアコス・コスタ・ニコラウらによって発表された。プロピオン酸エチル(ジエノフィル)、アセトンとアセト酢酸エチル(ディールス・アルダージエン)を前駆体とした収束的合成で、A環とB環からA,B,C環とした後にD環を構築する。
- ダニシェフスキーのタキソール全合成 - 1996年にサミュエル・ダニシェフスキーらによって発表された。ウィーランド・ミーシャーケトンを前駆体とする。
- ウェンダーのタキソール全合成 - 1997年にポール・ウェンダーらによって発表された。ピネンを前駆体とする[1][2]。
- 向山のタキソール全合成- 1998年に向山光昭らによって発表された[3]。
- 桑嶋のタキソール全合成 - 1998年に桑嶋功らによって発表された[4][5]。
- 高橋のタキソール全合成- 2006年に高橋孝志らによって発表された。ゲラニオールを前駆体とする収束的合成。高橋らによって開発された液相自動合成装置が用いられた[6]。バッカチンIIIまでの形式全合成で、ラセミ体だが300gの大量合成に成功した。
- フィル・バラン - 2020年に発表された[7]。他のグループとは異なり、生合成を模倣して炭素骨格を構築してから酸化反応を行う「Two-phase synthesis」による[8]。
- 李闖創 - 2021年に発表された合成法で、C1-C2結合の形成によりB環を構築する[9]。
- 井上将行 - 2023年に発表された。2,2-ジメチル-1,3-シクロヘキサンジオンを前駆体とする収束的合成。分子間・分子内ラジカルカップリング反応によりA,B,C環を構築する[10]。この全合成は34工程だったが、同年11月にはさらに改良して28工程に短縮された[11]。
生合成
[編集]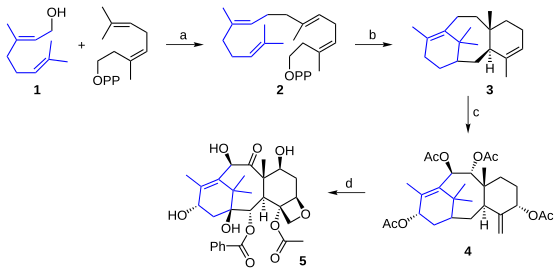
タキソールの生合成過程は約20段階の酵素反応からなることが分かっているが、全容は未だ明らかになっていない。知られている各段階はこれまで試みられてきた化学合成経路とは大きく異なる。出発物質はゲラニルゲラニル二リン酸 2 で、これはゲラニオール 1 の2量体である[12]。この化合物はタキソール骨格を形成する20の炭素を全て含んでおり、閉環により中間体 3 を経てタクスシン (taxusin) 4 を与える。この種の反応が実験室での合成に適さないのは、立体化学の制御と、酸素原子を持つ炭化水素骨格の活性化が困難なためである。生合成では、酸化反応について有効なシトクロムP450により、はるかに優れた仕事がなされている。中間体 5 は前述の10-デアセチルバッカチンIIIである。
脚注
[編集]- ^ Wender, Paul A.; Badham, Neil F.; Conway, Simon P.; Floreancig, Paul E.; Glass, Timothy E.; Gränicher, Christian; Houze, Jonathan B.; Jänichen, Jan et al. (1997-03-01). “The Pinene Path to Taxanes. 5. Stereocontrolled Synthesis of a Versatile Taxane Precursor” (英語). Journal of the American Chemical Society 119 (11): 2755–2756. doi:10.1021/ja9635387. ISSN 0002-7863.
- ^ Wender, Paul A.; Badham, Neil F.; Conway, Simon P.; Floreancig, Paul E.; Glass, Timothy E.; Houze, Jonathan B.; Krauss, Nancy E.; Lee, Daesung et al. (1997-03-01). “The Pinene Path to Taxanes. 6. A Concise Stereocontrolled Synthesis of Taxol” (英語). Journal of the American Chemical Society 119 (11): 2757–2758. doi:10.1021/ja963539z. ISSN 0002-7863.
- ^ Shiina, Isamu; Iwadare, Hayato; Sakoh, Hiroki; Hasegawa, Masatoshi; Tani, Yu-ichirou; Mukaiyama, Teruaki (1998-01). “A New Method for the Synthesis of Baccatin III” (英語). Chemistry Letters 27 (1): 1–2. doi:10.1246/cl.1998.1. ISSN 0366-7022.
- ^ Morihira, Koichiro; Hara, Ryoma; Kawahara, Shigeru; Nishimori, Toshiyuki; Nakamura, Nobuhito; Kusama, Hiroyuki; Kuwajima, Isao (1998-12-01). “Enantioselective Total Synthesis of Taxol” (英語). Journal of the American Chemical Society 120 (49): 12980–12981. doi:10.1021/ja9824932. ISSN 0002-7863.
- ^ Kusama, Hiroyuki; Hara, Ryoma; Kawahara, Shigeru; Nishimori, Toshiyuki; Kashima, Hajime; Nakamura, Nobuhito; Morihira, Koichiro; Kuwajima, Isao (2000-04-01). “Enantioselective Total Synthesis of (−)-Taxol” (英語). Journal of the American Chemical Society 122 (16): 3811–3820. doi:10.1021/ja9939439. ISSN 0002-7863.
- ^ Doi, Takayuki; Fuse, Shinichiro; Miyamoto, Shigeru; Nakai, Kazuoki; Sasuga, Daisuke; Takahashi, Takashi (2006-09-18). “A Formal Total Synthesis of Taxol Aided by an Automated Synthesizer” (英語). Chemistry – An Asian Journal 1 (3): 370–383. doi:10.1002/asia.200600156. ISSN 1861-4728.
- ^ Kanda, Yuzuru; Nakamura, Hugh; Umemiya, Shigenobu; Puthukanoori, Ravi Kumar; Murthy Appala, Venkata Ramana; Gaddamanugu, Gopi Krishna; Paraselli, Bheema Rao; Baran, Phil S. (2020-06-10). “Two-Phase Synthesis of Taxol” (英語). Journal of the American Chemical Society 142 (23): 10526–10533. doi:10.1021/jacs.0c03592. ISSN 0002-7863. PMC 8349513. PMID 32406238.
- ^ タキソールのTwo-Phase合成
- ^ Hu, Ya-Jian; Gu, Chen-Chen; Wang, Xin-Feng; Min, Long; Li, Chuang-Chuang (2021-10-27). “Asymmetric Total Synthesis of Taxol” (英語). Journal of the American Chemical Society 143 (42): 17862–17870. doi:10.1021/jacs.1c09637. ISSN 0002-7863.
- ^ Imamura, Yusuke; Takaoka, Kyohei; Komori, Yuma; Nagatomo, Masanori; Inoue, Masayuki (2023-03). “Total Synthesis of Taxol Enabled by Inter‐ and Intramolecular Radical Coupling Reactions” (英語). Angewandte Chemie International Edition 62 (10). doi:10.1002/anie.202219114. ISSN 1433-7851.
- ^ “抗がん剤タキソール全合成の新戦略”. 東京大学. 2024年1月17日閲覧。
- ^ Chau, M.; Jennewein, S.; Walker, K.; Croteau, R. "Taxol biosynthesis: molecular cloning and characterization of a cytochrome P450 taxoid 7β-hydroxylase". Chem. Biol. 2004, 11, 663–672. Abstract Archived 2006年11月2日, at the Wayback Machine.
