ピネン
| ピネン | |
|---|---|

|

|
(1S,5S)-2,6,6-トリメチルビシクロ[3.1.1]-2-ヘプテン | |
| 識別情報 | |
| CAS登録番号 | 80-56-8 [7785-70-8] (1R-α) [7785-26-4] (1S-α) [2437-95-8] ((±)-α) [18172-67-3] (β) |
| 特性 | |
| 化学式 | C10H16 |
| モル質量 | 136.24 g/mol |
| 外観 | 液体 |
| 密度 | 0,86 g·cm−3 (α, 15 °C)[1][2] |
| 融点 |
−62–−55 °C (α)[1] |
| 沸点 |
155–156 °C (α)[1] |
| 水への溶解度 | Practically insoluble in water |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
ピネン(pinene)は、化学式がC10H16で表される有機化合物で、モノテルペンの1種。名称はマツ (pine) に由来し、その名の通り松脂や松精油の主成分であるほか、多くの針葉樹に含まれ特有の香りのもととなる[3]。香料や医薬品の原料となる。
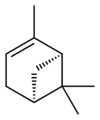
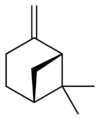
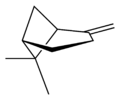
ピネンは六員環と四員環からなる炭化水素で、二重結合の位置が異なるα-ピネンとβ-ピネンの2つの構造異性体が存在する。さらにそれぞれが2種の鏡像異性体をもつことから、ピネンには合計4種の異性体が存在する。
性質
[編集]各異性体ともに分子量 136.24。常温常圧では無色の液体で特有の香りをもつ。水に不溶であるが、酢酸・エタノール・アセトンには任意に混和する。
生合成
[編集]α体、β体ともにゲラニル二リン酸を出発原料とし、リナロイル二リン酸の環化を経て骨格が完成する。最終段階で脱離するプロトンの位置によってα体とβ体に分かれる。

異性体
[編集]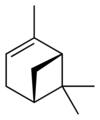 |
 |
 |
 | |
 |
 | |||
 |
 | |||
α-ピネン
[編集]融点 -57 ℃、沸点155-156 ℃、比重 0.8584-0.8600。α-ピネンの四員環は反応性が高く、特に酸性条件ではワーグナー・メーヤワイン転位が容易に進行する。希硫酸または無水酢酸条件ではテルピネオール誘導体やテルピンが、塩酸条件ではボルネオールまたはリモネンの骨格をもつ塩化物が生成する。ヨウ素や三塩化リンでは芳香化が起こりシメンとなる[4]。

β-ピネン
[編集]融点 -60 ℃、沸点164 ℃、比重 0.8740。ローズマリーやパセリ、バジル、イノンド、バラなどに含まれている。
用途
[編集]ピネンを適当な触媒を用いて酸化することで、様々な医薬品や香料などが成分が生産される。最も簡単な酸化生成物はベルベノンであり、空気酸化によっても生成するが、酢酸鉛(IV)を触媒として使うこともある [5]。
α-ピネンとボランから得られるイソピノカンフェニルボラン類は、有機合成分野において不斉還元剤として用いられる。
参考文献
[編集]脚注
[編集]- ^ a b c Record of alpha-Pinen 労働安全衛生研究所(IFA)発行のGESTIS物質データベース
- ^ Record of beta-Pinen 労働安全衛生研究所(IFA)発行のGESTIS物質データベース
- ^ 雨宮登三, 八田力二郎, 坂本四郎「α-ピネンの利用に就て」『燃料協会誌』第29巻第5号、日本エネルギー学会、1950年、121-125頁、doi:10.3775/jie.29.121、ISSN 0369-3775、NAID 130004014943。
- ^ Richter, G. H. (1945) Textbook of Organic Chemistry, 2nd ed., John Wiley & Sons., New York, PP 663-666.
- ^ Organic Syntheses, Coll. Vol. 9, p.745 (1998); Vol. 72, p.57 (1995). [1][リンク切れ]
