二酸化炭素
| 二酸化炭素 | |
|---|---|

| |

| |

| |
二酸化炭素 | |
| 識別情報 | |
| CAS登録番号 | 124-38-9 |
| EC番号 | 204-696-9 |
| E番号 | E290 (防腐剤) |
| KEGG | D00004 |
| RTECS番号 | FF6400000 |
| |
| |
| 特性 | |
| 化学式 | CO2 |
| モル質量 | 44.01 g mol−1 |
| 外観 | 無色気体 |
| 密度 | 1.562 g/cm3(固体、1 atm, −78.5 °C) 0.770 g/cm3(液体, 56 atm, 20 °C) 0.001977 g/cm3(気体, 1 atm, 0 °C) |
| 融点 | |
| 沸点 | |
| 水への溶解度 | 0.145 g/100cm3 (25 °C, 100 kPa) |
| 酸解離定数 pKa | 6.35 |
| 構造 | |
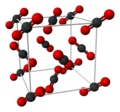
| 結晶構造 | 立方晶系(ドライアイス) |
| 分子の形 | 直線型 |
| 双極子モーメント | 0 D |
| 熱化学 | |
| 標準生成熱 ΔfH |
−393.509 kJ mol−1 |
| 標準モルエントロピー S |
213.74 J mol−1K−1 |
| 標準定圧モル比熱, Cp |
37.11 J mol−1K−1 |
| 危険性 | |
| 安全データシート(外部リンク) | ICSC 0021 |
| 引火点 | 不燃性 |
| 関連する物質 | |
| その他の陰イオン | 二硫化炭素 |
| その他の陽イオン | 二酸化ケイ素 二酸化ゲルマニウム 二酸化スズ 二酸化鉛 |
| 関連する化合物 | 一酸化炭素 炭酸 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
二酸化炭素(にさんかたんそ、英: carbon dioxide)は、炭素の酸化物の一つで、化学式が と表される無機化合物である。化学式から「シーオーツー」とも呼ばれる。地球温暖化対策の文脈などで、「カーボンフリー[2]」「カーボンニュートラル」など「カーボン」が使われることがあるが、これは二酸化炭素由来の炭素を意味する[3]。
二酸化炭素は温室効果を持ち、地球の気温を保つのに必要な温室効果ガスの一つである。しかし、濃度の上昇は地球温暖化の原因となる[4][5]。
地球大気中の二酸化炭素をはじめ地球上で最も代表的な炭素の酸化物であり、炭素単体や有機化合物の燃焼によって容易に生じる。気体は炭酸ガス、固体はドライアイス、液体は液体二酸化炭素、水溶液は炭酸や炭酸水と呼ばれる。また、金星、火星は大気の主成分が二酸化炭素であることが知られている。
多方面の産業で幅広く使われている(後述)。日本では高圧ガス保安法容器保安規則第十条により、二酸化炭素(液化炭酸ガス)の容器(ボンベ)の色は緑色と定められている。 温室効果ガスの排出量を示すための換算指標でもあり、メタンや亜酸化窒素(一酸化二窒素)、フロンガスなどが変換される。日本では、2014年度で13.6億トンが総排出量として算出された[6]。
性質
[編集]
常温常圧では無色無臭の気体。常圧では液体にならず、−79 °C で凝華して固体(ドライアイス)となる。水に比較的よく溶け、水溶液(炭酸水)は弱酸性を示す。このためアルカリ金属およびアルカリ土類金属の水酸化物の水溶液および固体は二酸化炭素を吸収して、炭酸塩または炭酸水素塩を生ずる。高圧で二酸化炭素の飽和水溶液を冷却すると八水和物 を生ずる。
炭素を含む石油、石炭、木材などの燃焼、動植物の呼吸や微生物による有機物の分解、火山活動などによって発生する。安定な物質で、マグネシウムなど還元性の強い金属を除けば二酸化炭素中で燃焼は起こらない。また植物の光合成によって二酸化炭素は様々な有機化合物へと固定される。
また、三重点 (−56.6 °C、0.52 MPa) 以上の温度と圧力条件下では、二酸化炭素は液化する。さらに温度と圧力が臨界点 (31.1 °C、7.4 MPa) を超えると超臨界状態となり、気体と液体の特徴を兼ね備えるようになる。これらの状態の二酸化炭素は圧縮二酸化炭素または高密度二酸化炭素と呼ばれている。
毒性
[編集]二酸化炭素は空気など地球の環境中にごくありふれた物質で、その有毒性が問題となることはまずない。しかし、空気中の二酸化炭素濃度が高くなると、ヒト(人間)は危険な状態に置かれる。濃度が 3 - 4 % を超えると頭痛・めまい・吐き気などを催し、7 % を超えると炭酸ガスナルコーシスのため数分で意識を失う。この状態が継続すると麻酔作用による呼吸中枢の抑制のため呼吸が停止し、死に至る(二酸化炭素中毒)[7]。比較的苦痛を感じないまま死に到るとされ、脊椎動物の屠殺や殺処分の法規制においては、二酸化炭素による安楽殺のみが許されることも多い。また、湖水爆発や、締め切った部屋で大量のドライアイスを昇華させる行為、また、二酸化炭素を使用した消火設備の誤作動や誤操作により、人間が二酸化炭素中毒で死傷する事故もある(湖水爆発については「ニオス湖#1986年の災害」が有名)[8]。
ストレスや疲労で、呼吸(換気)をし過ぎたり、呼吸(換気)が速くなり過ぎたりして、人体の血中の二酸化炭素濃度が異常に低くなることがある。これを過呼吸、あるいは過換気症候群(過呼吸症候群)と呼ぶ。過換気症候群の病態自体が命に関わる事は無いが、背景に身体疾患が隠れていることがあるので注意を要する。
反応性
[編集]二酸化炭素は非常に安定な化合物であるが、塩基性あるいは求核性を持つ物質と反応しやすい性質がある。特にグリニャール試薬やアルキルリチウムなどの試薬に対しては、高い反応性を示してカルボン酸を与える。
- (加水分解後)
また、金属マグネシウムは二酸化炭素中でも燃焼し、二酸化炭素は還元されて炭素の粉末になる。炭素、亜鉛および鉄でさえ、高温では反応して一酸化炭素を生成する。
高温では可逆的に分解して、一酸化炭素および酸素となる。
水素とも高温で以下のような平衡を生ずるが、触媒の存在など条件次第では、メタンおよびメタノールを生成することもある(水性ガスシフト反応)。
なお、学校教育の理科実験などで、二酸化炭素を石灰水に通すと白濁する性質が広く知られている。これは難溶性の炭酸カルシウムを生成するためである。
さらに二酸化炭素を通し続けると可溶性の炭酸水素カルシウムを生成し濁りが消えていく。
生産
[編集]日本で工業原料としての利用される炭酸ガスは、石油化学プラントなどから排出されたものを回収し、洗浄・精製を繰り返すことで生産される[9]。清涼飲料水で使用する炭酸ガスも石油由来のものを回収して使用している。工業製品としての炭酸ガスの 2018 年度日本国内生産量は 991,138 t[注釈 1]、工業消費量[注釈 2]は 149,035 t である[10]。実験室的製法は石灰石に希塩酸を加えるか、炭酸水素ナトリウムの加熱である。
イギリスでは、アンモニアを製造する際の副産物を利用している[11]。
用途
[編集]- 工業用途
工業においては、以下の用途がある。
- 工業で加工に使用するレーザーとして、炭酸ガスレーザーが一般的である。炭酸ガスレーザーは医療用レーザーメスとしても使用されている。
- 造船・橋・高層建築物など、鋼構造物の溶接作業には炭酸ガスアーク溶接が一般的である。
- 温室効果ガスである二酸化炭素の削減が急務となっていることから、触媒を使うなどして二酸化炭素を直接または一酸化炭素に変換するなどして、様々な化学品の原料とする技術が研究されている[12]。
- フロン系冷媒の代替として、CO2 冷媒コンプレッサが主に自動販売機などで実用化されつつあるが、高圧にする必要があるため費用面での課題が残り、エネルギー効率も悪い。
- 生産工場における冷却用ドライアイスの新しい利用方法として、ドライアイス洗浄にも使用されている。これはペレット状のドライアイスをタービンなどの構造物に噴射することによって付着した対象物を取り除くもので、ショットブラストなどと呼ばれる[13]。
- 農業用途
農業においては、以下の用途がある。
- イチゴの促成栽培、観賞用水槽の水草など、植物の成長を加速させる二酸化炭素施肥に使用されている。
- 鮮農産物のCA貯蔵 (controlled atmosphere storage) にも二酸化炭素が使用される。
- その他
- 炭酸飲料や入浴剤、消火剤などの発泡用ガスとして用いられている。
- 冷却用ドライアイスとして広く用いられている。またドライアイスとエタノールとの混合物は寒剤として利用できる。
- 自転車の緊急補充用エアーとしても使われるようになった。
- 超臨界状態の二酸化炭素はカフェインの抽出溶媒として、コーヒーのデカフェなどに利用されている。
- げっ歯類や小動物などの動物を殺処分する方法にも使われる。通常は麻酔状態になった後に意識を喪失し、そのまま死に至るため安楽死の手段として使われる[14]。
- ドライアイスは昇華時に白煙を生じることから、舞台やパレードでの演出などでも用いられる。これを放送業界などでは俗に「炭ガス」と呼ぶ。この白煙は二酸化炭素そのものではなく、温度低下により空気中の水分が氷結するからである。
- CO2からブドウ糖・油脂へ[15][16]、澱粉へ[17]、プラスチックへ[18]合成する実験が報道された。
二酸化炭素による温室効果
[編集]
二酸化炭素は赤外線の 2.5 - 3 μm、4 - 5 μm の波長帯域に強い吸収帯を持つため、地上からの熱が宇宙へと拡散することを防ぐ、いわゆる温室効果ガスとして働く。
二酸化炭素の温室効果は、同じ体積あたりではメタンやフロンに比べ小さいものの、排出量が莫大であることから、地球温暖化の最大の原因とされる。
世界気象機関 (WMO) は2015年に世界の年平均二酸化炭素濃度が400ppmに到達したことを報じたが[19]、氷床コアなどの分析から産業革命以前は、およそ280 ppm (0.028 %) の濃度であったと推定されている。濃度増加の要因は、主に化石燃料の大量消費と考えられている。
また、二酸化炭素そのものの海水中への溶存量が増えることによって海水が酸性化し、生態系に悪影響を与える海洋酸性化も懸念されている。
1997年には京都議定書によって二酸化炭素を含めた各国の温室効果ガス排出量の削減目標が示され、各国でその削減を努力することを締結した。
その手法は多岐に亘る。エネルギーや農業・畜産業など人為起源の二酸化炭素の排出量を抑制する努力、および森林の維持・育成や二酸化炭素回収貯留 (CCS) 技術の開発など、二酸化炭素を固定する努力が進められている。また排出権取引などを活用して、世界的に二酸化炭素の排出量を削減を促進する努力も行われている。
2013年5月、米国ハワイ州のマウナロア観測所、サンディエゴのスクリップス海洋研究所の観測で日間平均二酸化炭素量が人類史上初めて400ppmを突破したことが発表された[20]。
2024年7月現在は426 ppm(0.042%)で、産業革命前と比較して50%以上増加している[21]。
世界平均濃度の算出
[編集]二酸化炭素濃度は様々な研究機関によって世界各地で測定されているが、それらは必ずしも統一的な基準で測定されているとは限らない(つまり各測定値の比較可能性が保証されていない場合がある)。世界気象機関 (WMO) の全球大気監視 (Global Atmosphere Watch) プログラムは世界各地で統一した基準や手法で二酸化炭素濃度を含む様々な地球の大気成分の測定を行っている[22]。そして、それを用いた世界平均された二酸化炭素濃度は、WMO温室効果ガス年報(WMO Greenhouse Gas bulletin)で発表されている。これは気候変動枠組み条約の締約国会議に合わせて毎年1回刊行され、この世界平均濃度は世界の主要メディアによって報道されている。また、全球大気監視プログラムにおける各地の測定データは、WMO温室効果ガス世界データセンター (World Data Centre for Greenhouse Gases) から無償で公開されている(データを利用する場合には利用ポリシーに従う必要がある)。このデータセンターはWMOから委託を受けて日本の気象庁が運営している。
懐疑論
[編集]二酸化炭素に関連する地球温暖化に対する懐疑論はいくつか存在し、反論されている。
- (主張)植物の生長を促進させる(CO2施肥効果)ため、大気中の二酸化炭素量の増加は有益である。
- (主張)大気中の二酸化炭素の割合は0.04%だけなので大したことはない。
- (主張)二酸化炭素による温室効果は「飽和」するため、一定以上の量になると温室効果は強化されなくなる。
- (主張)二酸化炭素の増加の主な原因は人間の活動ではなく、自然由来である。
二酸化炭素の回収・資源化・分離
[編集]上記のような地球温暖化を抑制するため、二酸化炭素の新たな排出を減らす努力だけでなく、工場・火力発電所などの排気に含まれる二酸化炭素の回収(前述のCCS)のほか、大気からの二酸化炭素回収(DAC=Direct Air Capture, ダイレクト・エア・キャプチャー)により、大気から切り離す技術が開発されている。二酸化炭素の新たな排出抑制だけでは地球温暖化の緩和には不十分で、植林による光合成促進やCCS、DACといった「負の排出」(ネガティブ・エミッション)が必要という危機感が技術開発の背景にある。DACはアメリカ合衆国やカナダ、スイスなど15カ所の施設があり(2021年時点)、日本も『グリーン成長戦略』で2050年の実用化を掲げた。スイスのクライムワークスのように排出権取引を利用して既に商業化した企業も登場している。DACには以下の方式がある[30]。
- 溶液を使う化学吸収・吸着法
- 固体に吸着させる物理吸着法
- 膜分離法
- 空気を冷やしてドライアイス化させる深冷法
こうして得られた二酸化炭素は地中に貯留したり、プラスチックや医薬品などの原料として利用したりする。アミンや水酸化カリウムに吸収させる手法のほか、九州大学では大気中の窒素を通しにくく、二酸化炭素を通しやすい膜を開発した[31]。
東京工業大学などは、電気化学触媒としてレニウム錯体を使うことで、二酸化炭素の濃度が低くても効率よく回収できる手法の開発を2018年に発表している[32]。東京工業大学ではこれに先立ち、岩澤伸治らが、二酸化炭素を炭化水素と反応させる有機合成反応を開発した。触媒としてロジウムを用い、炭素と水素の結合を弱めて反応させる。大気圧で反応が進むが、特定の化合物やアルミニウムが必要になるなどの実用化に向けた課題もある[33]。
| CO2回収 | 利用 | カーボンリサイクル |
化学品 |
|---|---|---|---|
| 燃料 微細藻類バイオ燃料(ジェット燃料・ディーゼル) CO2由来燃料またはバイオ燃料(微細藻類由来 を除く)(メタノール、エタノール、ディーゼルなど) ガス燃料(メタン) | |||
| 鉱物 コンクリート製品・コンクリート構造物 炭酸塩 など | |||
| その他 ネガティブ・エミッション(BECCS, ブルーカーボンなど) | |||
| CO2の直接利用 | 溶接用途(シールドガス) 食品用途(米麦燻製、冷凍食品製造、ドライアイス) 飲料用途(ワイン醸造、炭酸飲料) 農業(施設園芸や植物工場における CO2 施肥) 溶剤用途(抽出溶媒としての超臨界 CO2) 赤泥処理用途(ボーキサイト残渣の中和)など | ||
| 増進回収法 EOR (Enhanced Oil Recovery) | |||
| 貯留 | |||
関連画像
[編集]- 二酸化炭素
-
棒球モデル
-
炭素の完全燃焼の反応式と模式図
-
結晶
-
Carbon-exchange-and-loss-process-pia
-
原子の手を表現したもの。
関連項目
[編集]- 二酸化炭素貯留
- 二酸化炭素の電気分解
- 炭素循環
- 炭素隔離
- 二酸化炭素除去
- 二酸化炭素飢餓
- 溶存無機炭素
- 国の二酸化炭素排出量リスト
- 炭酸飽和
- 放射強制力
- 湖水爆発
- カルバミノヘモグロビン - 二酸化炭素がヘモグロビンのアミノ基と結合した形態。血中二酸化炭素輸送の約23%がこの形態で、70%が炭酸脱水酵素で変換された炭酸水素イオン、7%が二酸化炭素として血漿に溶け込んだ状態で肺に送られる。
脚注
[編集]注釈
[編集]出典
[編集]- ^ a b Merck Index 12th ed., 1857.
- ^ カーボンフリーな水素社会の構築を目指す「水素基本戦略」経済産業省資源エネルギー庁(2018年2月13日)2019年1月27日閲覧
- ^ “環境用語”. 環境イノベーション情報機構. 2022年3月23日閲覧。
- ^ 玉置元則、正賀 充、平木隆年、守富寛「地球温暖化ガス: 亜酸化窒素の人為的排出 (1)」『環境技術』第2巻第9号、環境技術学会、1994年、47-53頁、doi:10.5956/jriet.23.575。
- ^ “温室効果ガスの種類”. 気象庁. 2022年3月19日閲覧。
- ^ 2014 年度(平成26年度)の温室効果ガス排出量(確報値)<概要>環境省 (PDF)
- ^ 二酸化炭素(CO2)の人体における影響 沖縄CO2削減推進協議会 (PDF)
- ^ 佐藤暢,飯野守男 (2016). “厚労省も陥ったか,ヒューマンエラーと二酸化炭素中毒事故にまつわる謎”. 麻酔・集中治療とテクノロジー 2016: 87-96.
- ^ 株式会社レゾナック・ガスプロダクツによる解説または日本液炭による解説
- ^ 『経済産業省生産動態統計年報 化学工業統計編』
- ^ “W杯観戦のビールが飲めない?炭酸ガス不足、英で業界を直撃”. CNN (2018年6月28日). 2018年6月30日閲覧。
- ^ 二酸化炭素原料化基幹化学品製造プロセス技術開発 国立研究開発法人新エネルギー・産業技術総合開発機構(2018年7月6日閲覧)
- ^ ドライアイスブラスト 日本液炭 (PDF)
- ^ 安楽死法 動物実験手技
- ^ Zhang, Shanshan; Sun, Jiahui; Feng, Dandan; Sun, Huili; Cui, Jinyu; Zeng, Xuexia; Wu, Yannan; Luan, Guodong et al. (2023-06-09). “Unlocking the potentials of cyanobacterial photosynthesis for directly converting carbon dioxide into glucose” (英語). Nature Communications 14 (1): 3425. doi:10.1038/s41467-023-39222-w. ISSN 2041-1723.
- ^ “中国の科学者、CO2からブドウ糖・油脂への人工合成を実現 | Science Portal China”. spc.jst.go.jp. 2023年7月28日閲覧。
- ^ “二酸化炭素からでんぷんを人工合成するプロセスを開発――農業によるでんぷん生産を置換する - fabcross for エンジニア”. fabcross for エンジニア - エンジニアのためのキャリア応援マガジン (2021年11月10日). 2023年7月28日閲覧。
- ^ “常圧二酸化炭素からプラスチックの直接合成に世界で初めて成功”. Osaka City University. 2023年7月28日閲覧。
- ^ “WMO温室効果ガス年報の和訳 12号”. 気象庁. 2019年4月3日閲覧。
- ^ “大気中のCO2量が歴史的水準を突破、専門家らが行動を呼びかけ”. フランス通信社 (2013年5月11日). 2024年9月10日閲覧。
- ^ “Carbon Dioxide”. NASA Science. 2024年9月10日閲覧。
- ^ 堤之智 (2017). “新たなWMO/GAW 実施計画:2016-2023について”. 天気 64: 607-614.
- ^ a b c “Plants cannot live on CO2 alone”. Skeptical Science. 2024年9月8日閲覧。
- ^ a b Phan, Karena (2023年8月25日). “Carbon dioxide helps plants grow. That doesn’t mean more of it is good for the planet”. AP通信 2024年9月8日閲覧。
- ^ “How can carbon dioxide be harmful if it’s ‘plant food’?”. FactCheck.org. (2024年3月26日) 2024年9月8日閲覧。
- ^ a b S. Petersen, Kate (2023年6月26日). “Humans are responsible for a significant amount of CO2 in the atmosphere”. USAトゥデイ 2024年9月10日閲覧。
- ^ a b “Is the CO2 effect saturated?”. Skeptical Science. 2024年9月10日閲覧。
- ^ Herring, David (2020年10月29日). “Doesn't carbon dioxide in the atmosphere come from natural sources?”. アメリカ海洋大気庁. 2024年9月10日閲覧。
- ^ Johnson, Scott (2019年7月9日). “On Fox News, Patrick Michaels falsely claims humans are only responsible for half of global warming”. Science Feedback. Climate Feedback. 2024年9月10日閲覧。
- ^ 【サイエンスReport】挑戦 カーボンゼロ/CO2削減 究極の技術「DAC」海外で商業化『読売新聞』朝刊2021年9月5日くらしサイエンス面
- ^ 「CO2 大気から直接回収/脱炭素の救世主に 経済活動に制約なく」『日本経済新聞』朝刊2021年2月1日(科学技術面)同日閲覧
- ^ 「希薄な二酸化炭素を捕捉して資源化できる新触媒の発見 低濃度二酸化炭素の直接利用に道」東工大ニュース(2018年12月4日)2019年1月27日閲覧。
- ^ 「※記事名不明※」『朝日新聞』朝刊2011年1月25日22面
- ^ 経済産業省 (7 June 2019). カーボンリサイクル技術ロードマップ (PDF) (Report).
- ^ 福田佳之. “資源としてのCO2の利用は温室効果ガス削減の切り札となるか”. 東レ経営研究所. 2021年11月16日閲覧。
外部リンク
[編集]- Carbon dioxide - Encyclopedia of Earth「二酸化炭素」の項目。
- 国際化学物質安全性カード 二酸化炭素 (ICSC:0021) 日本語版(国立医薬品食品衛生研究所による), 英語版
- 『二酸化炭素』 - コトバンク