乳酸脱水素酵素
乳酸脱水素酵素(にゅうさんだっすいそこうそ、英: lactate dehydrogenase; LDH)は、ほぼ全ての生物に存在する酵素である。
概要
[編集]乳酸脱水素酵素は乳酸の立体特異性と用いる電子受容体から5種に分類されている。
2種はシトクロムc依存型で、D-乳酸デヒドロゲナーゼ (シトクロム)(EC 1.1.2.4)とL-乳酸デヒドロゲナーゼ (シトクロム)(EC 1.1.2.3)である。いずれも原核生物ではペリプラズム、真核生物ではミトコンドリア膜間腔に存在する。ほかに真正細菌の細胞膜にはキノン依存型のD-乳酸デヒドロゲナーゼ (キノン)(EC 1.1.5.12)がある。
残りの2種は通常は細胞質基質に存在するNAD(P)依存型酵素で、D-乳酸デヒドロゲナーゼ(EC 1.1.1.28)とL-乳酸デヒドロゲナーゼ(EC 1.1.1.27)である。
以降ではNAD(P)依存型L-乳酸デヒドロゲナーゼについて述べる。
反応
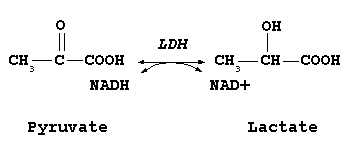
[編集]乳酸脱水素酵素は乳酸とピルビン酸との相互変換を触媒する。このとき、NADHとNAD+の相互変換も同時に起こる。ピルビン酸の乳酸への変換は、酸素の欠乏に関わらずに起こり、糖が増えれば乳酸が生成する方向の反応が進む。解糖系のバランスを取る重要な反応である。この逆反応が肝臓のコリ回路において行われている。
構造
[編集]乳酸脱水素酵素の単量体構造はリンゴ酸デヒドロゲナーゼとよく似ており、N末端側のNAD結合部位とC末端側のα/βフォールドから構成されている。乳酸脱水素酵素ではこれが4量体で機能している。
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
ヒトではアイソフォームが複数知られており、なかでも心筋型のH(B)と骨格筋型のM(A)と称する2種類のサブユニットが多く存在し、その組み合わせによって5種類のアイソザイムを区別できる。これらの触媒能にはほとんど差が無いが、臓器の分布に以下の様な違いが知られている。[1]
H(B)とM(A)以外に、精巣に特異的なCと、ペルオキシソームに局在するBxがある。Bxは遺伝子としてはH(B)と同じで、翻訳の際に終止コドンのリードスルーが起きてペルオキシソーム移行シグナルが付加される。[2]
|
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
医学上の重要性
[編集]遺伝病
[編集]LDHの遺伝子に変異が起こると、乳酸脱水素酵素サブユニット欠損症となる場合がある。サブユニットAの欠損症では、主に肝臓や横紋筋での機能が損なわれる。その結果コリ回路の機能が妨げられ、疲労や痙攣、筋肉痛を起こしやすい。強度の運動によって横紋筋融解症となり、その結果腎不全を引き起こすこともある。一方、サブユニットBの欠損症では主に心臓での機能が損なわれることになるが、特に臨床症状を示すことは少ない。
臨床検査
[編集]LDHは逸脱酵素として知られ、臨床検査では重要な検査項目のひとつである。
血中濃度の上昇はAST、ALTなどとともに肝障害を示唆する。 ただ、それ以外の面では心筋梗塞、溶血、感染症などでも上昇がみられ非常に非特異的であるため診断の参考としての有用性はあまり高くない。 ただし、単独で上昇しているとしたら悪性リンパ腫をはじめとした悪性腫瘍がかくれている可能性を考えるべきである。 総じて、スクリーニング(精密検査必要者のふるい分け)のための検査項目と言える。
LDHの中には5種類のアイソザイム(働きが同等で構造の違う酵素)が存在するため、精査の際にはこの内訳を分析することが臨床上有意義となる場合がある。
参考文献
[編集]- ^ Van Eerd, J. P. F. M.; Kreutzer, E. K. J. (1996). Klinische Chemie voor Analisten deel 2. pp. 138–139. ISBN 978-90-313-2003-5
- ^ “Peroxisomal lactate dehydrogenase is generated by translational readthrough in mammals”. eLife 3: e03640. (2014). doi:10.7554/eLife.03640. PMC 4359377. PMID 25247702.



