抗酸化物質

| 生体物質由来 | アスコルビン酸(ビタミンC) | 水溶性ラジカルの補足、ビタミンEなど抗酸化物質の代謝再生、酵素的ヒドロキシ化反応の補欠分子族[1]。 |
| α-トコフェロール(ビタミンE) | おもに脂質の過酸化フリーラジカル反応のラジカルを補足し、リン脂質・コレステロール脂質の不飽和脂肪酸鎖を保護する[2]。 | |
| グルタチオン | 細胞内タンパク質のSH残基を適切な酸化状態に保つ。グルタチオンペルオキシターゼの補欠分子族として有害な過酸化物と反応し解毒作用を示す[3]。 | |
| 合成化合物 | BHAなど | 医薬品、化粧品、食品などの酸素が引き起こすラジカル反応を補足、停止させて変質を防御する。工業原料の酸化防止剤としても利用される。 |
| 低分子化合物 | 高分子化合物 |
|---|---|
|
抗酸化物質(こうさんかぶっしつ、英: antioxidant)は、生体内、食品、日用品、工業原料において酸素が関与する有害な反応を減弱もしくは除去する物質の総称。特に生物化学あるいは栄養学において、狭義には脂質の過酸化反応を抑制する物質を指し、広義にはさらに生体の酸化ストレスあるいは食品の変質の原因となる活性酸素種(酸素フリーラジカル、ヒドロキシルラジカル、スーパーオキシドアニオン、過酸化水素など)を捕捉することによって無害化する反応に寄与する物質を含む[4]。この反応において抗酸化物質自体は酸化されるため、抗酸化物質であるチオール、アスコルビン酸またはポリフェノール類は、しばしば還元剤として作用する[5]。
抗酸化物質には、生体由来の物質もあれば、食品あるいは工業原料の添加物として合成されたものもある。抗酸化物質の利用範囲は酸素化反応の防止にとどまらず、ラジカル反応の停止や酸化還元反応一般にも利用されるため、別の用途名を持つ物も少なくない。本稿においては、好気性生物の生体内における抗酸化物質の説明を中心に、医療あるいは食品添加物としての抗酸化剤を説明する。もっぱら工業原料に使われる酸化防止剤などについては関連項目の記事を併せて参照。
酸素と抗酸化物質
[編集]まず、生物化学的観点に立つと、多くの好気的生物では生体内の分子状酸素は、そのほとんどがミトコンドリアでの ATP産生において消費され、最終的には酵素的に還元されて水分子に変換され(詳細は記事ミトコンドリアや電子伝達系を参照のこと)、少量の酸素がヒドロキシル化代謝反応のオキシゲナーゼ酵素の基質として利用される。また特筆すべきは活性酸素種ですら、白血球が貪食した細菌に示す殺菌作用物質として白血球内部で発生したり、活性酸素シグナリングのように局所的な化学伝達物質として利用される[6][7]など、存在場所と反応対象を代謝系が制御している状態で積極的に酸素が利用されることである。


酸素が関与する酸化反応は生命にとって極めて重要であるが、化学種としての分子状酸素は反応性が高いために活性酸素種に変換される。このプロセスは非生物化学的であり必ずしも生物物質や酵素の関与だけに限定される現象ではない。なので環境が整えば、それは生体でもそうだし、精肉など食品でもそうだが、酸素は活性酸素プロセスを通じて周囲の水、不飽和脂質、その他の容易に酸化される生体物質に対して変質や不都合な化学反応を引き起こす[8]。この場合の活性酸素プロセスはラジカル連鎖反応であり、生体内で最も豊富に存在する水を起点として連鎖的に他の物質をラジカル化する(詳細は活性酸素を参照)、発生した過酸化脂質あるいは過酸化脂質ラジカルは周囲の生体物質とさらに反応して細胞膜やタンパク質を変性させたり DNA切断を引き起こすなど、細胞に損傷を与える。このような生体反応は酸化ストレスとして知られており、細胞損傷や細胞死の原因の一助となる。
この時、抗酸化物質が存在する生化学システム上の意義は、活性酸素とその関連する物質をシステムから排除するために、不都合に発生した活性酸素種やそれが生体物質と反応したラジカル中間体と反応することで酸素由来の有害反応を停止させることにある。あるいは直接、抗酸化物質が活性酸素種などと反応するのではなく、触媒的に分解代謝する抗酸化酵素とも称される一連の酵素が存在する。酵素は基質特異性を持ち、活性酸素の分子の種類が異なれば、関与する酵素も異なるし、ある活性酸素種の分子を基質する酵素についても複数存在し、その散在部位も酵素の種類によって異なる。具体例を挙げるならば活性酸素種の一つである過酸化水素は酵素であるカタラーゼの作用で水と分子状酸素に分解されるということである。あるいはスーパーオキシドディスムターゼ、ペルオキシダーゼ類など有害な酸素由来の生成物を無害化する酵素が存在する。低分子の抗酸化物質のいくつかはこれらの酵素の基質あるいは補欠分子族として有害反応の制御に関与する[5][9][7]。たとえばカタラーゼは単独で過酸化水素を分解排除するが、抗酸化物質として知られているグルタチオンは、過酸化水素や過酸化脂質を代謝するグルタチオンペルオキシターゼの基質として消費される[3][10]。
活性酸素の発生部位として代表的なものにミトコンドリアおよび葉緑体が挙げられる。いずれも金属を酵素活性中心に持つ「電子伝達系」と呼ばれるオキシターゼの複合体が効率的に酸化還元反応を繰り返しエネルギー代謝の根幹をなしている[7]。とはいえ、わずかの代謝損失が存在し、それはおもに副反応であるフェントン反応により、中心金属が活性酸素種を生成する[11][12]。
このよう活性酸素種が原因の酸化ストレス順応の化学進化は様々な生体内の抗酸化物質を生み出してきた。海洋生物から陸生生物への進化一環として、陸生植物はアスコルビン酸(ビタミンC)、ポリフェノール類、フラボノイド類およびトコフェロール類のような海洋生物には見られない抗酸化物質の産生を始めた。さらに、ジュラ紀後期以降に地上で繁栄した被子植物は、多くの抗酸化色素を多様化させた。それは光合成時に発生する活性酸素種の障害に対する防御化学物質が多様化し、より精巧になったことを意味する[13][14]。
抗酸化物質と生活
[編集]次に、栄養学や食品化学的観点に立つと、酸素は保存中の食品の金属イオンを酸化することで生体内へ吸収しにくくしたり、食品の成分を変質させることで、香りや見た目を損なう。それだけでなく、植物油中の必須脂肪酸は分子状酸素のラジカル反応により、変色、固化しさらに毒性を示す酸敗と称される不都合な反応を引き起こす[15]。このような食品としての品質劣化を防止する目的で、食物由来の食品添加物であるアスコルビン酸や α-トコフェロールが一般的に利用されている[16][17]。
このような抗酸化物質は食品のみならず医薬品や化粧品の変質防止のための酸化防止剤としても利用される。また工業的には酸化防止剤の BHA や BHT およびその誘導体がゴムや合成樹脂、ガソリンの酸化による劣化を防ぐ目的で広く使われている。
酸化ストレスはヒトの多くの病気で原因の一つとして注目されており、疾患の予防や健康維持の目的で医薬品候補や栄養補給食品の候補として広く研究ないしは利用されている。たとえば脳卒中、神経変性病の治療に対する研究が顕著である[18]。しかし、現状では酸化ストレスが病気の原因であるのかそれとも結果であるのかも不明であり、抗酸化物質は医薬分野では研究中の域を出ない。
一方、栄養補助食品の分野では多数の物質が製品化され、抗酸化物質が、健康維持や悪性腫瘍、冠状動脈性心臓病、高山病の予防の目的で広く利用されている[19]。しかしながらいくつかのサプリメントでは、初期の研究ではサプリメントの抗酸化物質が健康を増進させる可能性があると提案されたが、後の臨床試験ではその効果が見つからない例も見られる。さらに過剰摂取が有害である可能性が報告されるものもある[20][21]。
歴史
[編集]初め、抗酸化物質という語は酸素の消費を抑える化学種を指すために用いられた。19世紀後期から20世紀初頭には大規模に研究され、金属の腐食防止やゴムの加硫反応の制御(架橋反応の停止)、あるいは燃料の酸化重合による変質やそれに起因する内燃機関のピッチ汚れなどの対策として、各種工業において抗酸化物質が使われるようになった[22][23]。
それに対して、生物化学上の抗酸化物質の役割は、生体内の生物化学的、分子生物学的理解が発展する20世紀中葉以降までは詳細は不明であった。それゆえ、疾患の原因物質のように生物の外見上の特性から必須性や重要性が判明した生体物質が、後に研究の発展により抗酸化物質として再発見される例も少なくない[24][25][26]。代表的な例として α-トコフェロールを挙げる。
α-トコフェロールは、食餌中から人為的に欠損させるとネズミに不妊症を引き起こすことから、妊娠を維持するために必須な物質『ビタミンE』として発見された。生物化学あるいは細胞生物学の研究が進展し、ネズミの不妊症の原因が、酸化ストレスによる胎児の妊娠中死亡が原因と判明することで、ビタミンE の抗酸化物質としての位置付けが明らかとなった[27]。さらにビタミンE が過酸化脂質ラジカルを補足することで抗酸化作用を発現することが証明されたのは20世紀後半である[28][29]。
同様にして生体外でビタミンA やビタミンC の抗酸化物質としての機能が再発見されている。さらに生物化学でエネルギー代謝系やオキシダーゼの作用機序など生体内での微量の物質変化が解明されるに従い、抗酸化物質としての役割も多岐にわたることが判明してきた。
このような生物化学的な発見は、栄養学、食品科学にも応用され、食品の変質防止やミネラルの吸収促進など、多くの天然由来の抗酸化物質が酸化防止剤やサプリメントとして開発、利用されている。事実として、ビタミンC やビタミンE はビタミン欠乏症の治療薬としてよりは、食品添加物の酸化防止剤として大量に消費されている[30]。
さらに医学領域については活性酸素種と酸化ストレスとの関係が注目を集めている。すなわち脳虚血回復後の神経損傷や、動脈硬化叢で過酸化脂質が炎症反応を介してアテロームの沈着を増悪するなど、酸化ストレスが様々な疾患や老化現象に直接関与していることが発見されている。このことは抗酸化物質が脳卒中や動脈硬化症あるいはアンチエイジングに利用可能であると期待されるため、既存の抗酸化物質の薬理研究や新規の抗酸化物質の発見など、抗酸化物質は盛んに様々な研究が進行する分野でもある。
生物化学としての観点
[編集]抗酸化物質の類型
[編集]| 抗酸化物質 | 活性酸素種 | |||
|---|---|---|---|---|
| O2− | H2O2 | •OH | 1O2 | |
| スーパーオキシドジスムターゼ | Yes | No | No | No |
| グルタチオンペルオキシダーゼ | No | Yes | No | No |
| ペルオキシダーゼ | No | Yes | No | No |
| カタラーゼ | No | Yes | No | No |
| アスコルビン酸 (V.C) | Yes | Yes | No | Yes |
| システイン | No | No | Yes | No |
| グルタチオン | No | No | Yes | No |
| (リノール酸⇒過酸化脂質) | No | No | Yes | No |
| α-トコフェロール (V.E) | No | No | Yes | Yes |
| α-カロテン | No | No | Yes | No |
| β-カロテン | No | No | Yes | Yes |
| フラボノイド | No | No | Yes | No |
| リボフラビン (B2) | No | No | No | Yes |
| ビリルビン | Yes | No | No | No |
| 尿酸 | No | No | Yes | Yes |
| メラトニン | No | Yes | Yes | Yes |
| 水素[33] | No | No | Yes | No |
抗酸化物質にはビタミンCやEのように、酸素が関与する有害な反応を単独で抑制する物質が知られている。このような抗酸化物質は低分子の抗酸化物質に多く認められ、多くの場合は酸素ラジカルあるいはそれから派生したラジカルを停止させる反応を起こす。低分子抗酸化物質の多くは容易に酸化される良い還元剤であるため、直接ラジカルと反応するだけでなく、後述するように酵素が関与する抗酸化反応を補助する場合も多い。低分子の抗酸化物質が直接に反応に関与する場合は反応の選択性は低く、様々なオキシダントと抗酸化物質とが反応する。一方、酵素が関与する抗酸化反応は酵素により反応するオキシダントが決定され、低分子の抗酸化物質は還元剤としての役割を果たす[16]。
高分子の抗酸化物質は大きく分けるとオキシターゼとミネラル輸送・貯蔵タンパク質とに大別することができる。すなわち生体内には多種多様なオキシダーゼが存在し、活性酸素種自体を基質として代謝する酵素もあれば、発生した有害な過酸化物を分解代謝する酵素もある。またオキシダントと反応して酸化型となったビタミンCやEのような『活性を失った抗酸化物質』を、還元型に戻してリサイクルする酵素も存在する。したがって、直接あるいはリサイクルに関与し間接的に抗酸化作用を示す一部のオキシダーゼも抗酸化物質の一つと見なされる[16]。
このような抗酸化物質と見なされるオキシダーゼの多くはグルタチオンやビタミンC といった電子受容体を基質として消費する。すなわち酵素による過酸化物質の代謝には還元剤としての抗酸化物質の存在が必須である。これは「酵素反応は可逆反応であり、ただ反応速度を増大させるのみである」という酵素の特性に留意する必要がある。つまり生体内では電子受容体が豊富に存在するために逆反応は問題にはならない。しかし、栄養学や食品科学など非生体的な条件下においては、条件によっては生体では抗酸化物質と見なされるオキシダーゼであっても、食品に加工された状態においては酸素が関与する逆反応を加速することで抗酸化物質を消費し尽したり、活性酸素種を発生させ、それにより食品の鮮度、品質を低下させる場合もある[16][34]。
これらのオキシダーゼの多くは酵素活性中心には微量ミネラルである、鉄、マンガン、銅、セレン原子などが存在している。これらの金属元素は容易に酸化還元反応を受けやすい[35]。
一方、これらの微量ミネラルの体内でのADMEは特定の酸化状態であることが必要である。たとえば、鉄は鉄 (III) イオンは特定の膜トランスポーターに依存するので生体に吸収されないが[36]、鉄 (II) イオンがキレート(ラクトフェリンのように高分子の場合もあればクエン酸など低分子の場合もある)を形成して取り込まれる。さらに体内ではトランスフェリンは鉄 (III) イオンに結合して貯蔵、輸送される。このような酸化状態の特異性は、ほかの微量ミネラルでも同様に見ることができる。つまり、微量ミネラルは低分子あるいは特定のタンパク質がキレートすることで、それぞれの状況に有利な酸化状態で輸送、貯蔵される。微量ミネラル元素でも鉄イオンは酵素と結合して酵素補欠因子にならなくても、生体内の環境で金属イオンが酸化還元機能を持つ場合もある。しかし多くの場合は微量ミネラルは、生体内の環境では酵素補欠因子として酵素の活性中心に配置されて初めて酸化還元機能をもつ。いずれにしろ微量ミネラル元素を取り込んだオキシターゼは基質特異的に抗酸化作用を触媒するので、微量ミネラル元素はオキシターゼが関与する抗酸化生体システムのカギである。そのオキシターゼの存在量も、微量ミネラル元素を輸送・貯蔵に関与する分子、それは低分子あるいは高分子の微量金属元素をキレートする生体物質であるが、それらのキレート物質が欠乏すれば酵素の存在量を変動させ間接的には生体の抗酸化機能に変動をもたらす[35][34]。したがってトランスフェリンやフェリチンのようなキレート物質は生体システムの観点においては抗酸化物質と見なされる。

活性酸素種と抗酸化物質
[編集]活性酸素種は細胞において過酸化水素 (H2O2) およびヒドロキシルラジカル (·OH) とスーパーオキシドアニオン (O−
2) のようなフリーラジカルを形成する[37][38][39]。ヒドロキシルラジカルは特に不安定であり、即座に非特異的に多くの生体分子との反応を起こす。この化学種はフェントン反応のような金属触媒酸化還元反応によって過酸化水素から形成する[40]。これらの酸化物質は化学的連鎖反応を開始させることにより脂肪やDNA、タンパク質を酸化させ細胞を損傷させる[5]。DNA修復機構は稀な頻度で修復ミスを発生するので突然変異や癌の原因となり[41][42]、タンパク質への損傷は酵素阻害、変性、タンパク質分解の原因となる[43]。
電子伝達系など代謝エネルギーの合成機構において酸素が使われる局所では副反応として活性酸素種が発生する[44]。つまりスーパーオキシドアニオンが電子伝達系において副生成物として生成する[45]。特に重要なのは複合体III による補酵素Qの還元で、中間体として高反応性フリーラジカル (Q·−) が形成する。この不安定中間体は電子の"漏出"を誘導し、通常の電子伝達系の反応ではなく電子が直接酸素に転移し、スーパーオキシドアニオンを形成させる[46]。また、ペルオキシドは複合体Iでの還元型フラボタンパク質の酸化からも発生する[47]。これらの酵素群は酸化物質を合成することができるが、ペルオキシドを形成するその他の過程への電子伝達系の相対的重要性は不明である[48][49]。また、植物、藻類、藍藻類では、活性酸素種は光合成の間に生じるが[50]、特に高光度条件のときに生成する[50]。この効果は光阻害ではカロテノイドにより相殺されるが、それには抗酸化物質と過還元状態の光合成反応中心との反応が伴い、活性酸素種の形成を防いでいる[51][52]。
抗酸化物質の生体内分布
[編集]| 抗酸化代謝物 | 溶解性 | ヒトの血清中での濃度 (μM)[53] | 肝組織での濃度 (μmol/kg) |
|---|---|---|---|
| アスコルビン酸 (ビタミンC) |
水溶性 | 50 – 60[54] | 260(ヒト)[55] |
| グルタチオン | 水溶性 | 4[56] | 6,400(ヒト)[55] |
| リポ酸 | 水溶性 | 0.1 – 0.7[57] | 4 – 5(ラット)[58] |
| 尿酸 | 水溶性 | 200 – 400[59] | 1,600(ヒト)[55] |
| ウロビリノーゲン | 水溶性 | 3 – 13[60] | 不明 |
| ビリルビン | 脂溶性 | 5 – 17[61] | 不明 |
| カロテン類 | 脂溶性 | β-カロテン: 0.5 – 1[62] |
5 [64](ヒト、総カロテノイド) |
| α-トコフェロール (ビタミンE) |
脂溶性 | 10 – 40[63] | 50 [55](ヒト) |
| ユビキノール (補酵素Q) |
脂溶性 | 5[65] | 200(ヒト)[66] |
抗酸化物質は水溶性と脂溶性の2つに大きく分けられる。一般に、水溶性抗酸化物質は細胞質基質と血漿中の酸化物質と反応し、脂溶性抗酸化物質は細胞膜の脂質過酸化反応を防止している[5]。これらの化合物は体内で生合成するか、食物からの摂取によって得られる[9]。それぞれの抗酸化物質は様々な濃度で体液や組織に存在している。グルタチオンやユビキノンなどは主に細胞内に存在しているのに対し尿酸はより広範囲に分布している(下表参照)。稀少種でしか見られない抗酸化物質もあり、それらは病原菌にとって重要であったり、毒性因子となったりする[67]。
様々な代謝物と酵素系はそれぞれ相乗効果と相互依存効果を有するが、抗酸化物質の特定の場合における重要性と相互作用は不明である[68][69]。したがって、一種の抗酸化物質は抗酸化物質系の他の構成要素の機能に依存している可能性がある[9]。また、抗酸化物質によって保護される度合いはその濃度、反応性、反応環境の影響を受ける[9]。
いくつかの化合物は遷移金属をキレートすることによって細胞内で触媒生成するフリーラジカルによる酸化を抑制している。特にトランスフェリンやフェリチンのような鉄結合タンパク質は、キレート化することにより鉄の酸化を抑制している[70]。セレンと亜鉛は一般的に抗酸化栄養素と呼ばれているが元素自体は抗酸化能を持たず、抗酸化酵素と結合することによって抗酸化能を持つ。
酵素と抗酸化物質
[編集]
化学的酸化防止剤と同様に、細胞は抗酸化酵素の相互作用網によって酸化ストレスから保護されている[5][8]。酸化的リン酸化のようなプロセスによって遊離される超酸化物は最初に過酸化水素に変換され、さらなる還元を受け最終的に水となる。この解毒経路はスーパーオキシドジスムターゼやカタラーゼ、ペルオキシダーゼなど多数の酵素によるものである。
抗酸化代謝体と同様に、抗酸化防衛における酵素の寄与を互いに切り離して考えることは難しいが、抗酸化酵素を1つだけ欠損させた遺伝子導入マウスを作ることそので情報を得ることができる[71]。
スーパーオキシドディスムターゼ、カタラーゼおよびペルオキシレドキシン
[編集]スーパーオキシドディスムターゼ (SOD) は、スーパーオキシドアニオンを酸素と過酸化水素に分解する酵素群である[72][73]。SODはほとんど全ての好気性細胞と細胞外液に存在する[74]。酸素が存在することによって細胞内に形成される致死性のスーパーオキシドを変化させるスーパーオキシドディスムターゼやカタラーゼを欠くことにより、偏性嫌気性生物は酸素の存在下で死滅することとなる[75]。
SOD はそのアイソザイムによって、銅、亜鉛、マンガン、および鉄を補因子として含む。ヒトを初めとした哺乳動物や多くの脊椎動物は、3種の SOD (SOD1, SOD2, SOD3) を持ち、銅/亜鉛を含む SOD1 と 3 はそれぞれ細胞質と細胞外空間に、マンガンを含む SOD2 はミトコンドリアに存在する[73][76]。ヒトは鉄を補因子とした SOD は持たない。3種の SOD のうち、ミトコンドリアアイソザイム (SOD2) は最も生物学的に重要で、マウスはこの酵素が欠損すると生後間もなく死亡する[77]。一方、銅/亜鉛SOD (SOD1) 欠損マウスは生存能力はあるが多くは病的で低寿命(超酸化物を参照)であり、細胞外液SOD (SOD3) 欠損マウスは異常は最小限(酸素過剰症に過敏)である[71][78]。植物では、SOD のアイソザイムは細胞質とミトコンドリアに存在し、葉緑体では脊椎動物と酵母菌にはない鉄SOD が見られる[79]。
カタラーゼは鉄とマンガンを補因子として用いて過酸化水素を水と酸素に変換する酵素である[80][81]。このタンパク質はほとんどの真核細胞のペルオキシソームに局在している[82]。カタラーゼは基質が過酸化水素だけである独特な酵素で、ピンポン機構を示す。まず補因子が一分子の過酸化水素で酸化され、生成した酸素を二番目の基質へ転移させることにより補因子が再生する[83]。過酸化水素の除去は明らかに重要であるのにもかかわらず、遺伝的なカタラーゼの欠損(無カタラーゼ症)のヒト、もしくは遺伝子組み換えで無カタラーゼにしたマウスの苦痛を感じる病的影響はほとんどない[84][85]。

ペルオキシレドキシン類は過酸化水素やペルオキシ亜硝酸など有機ヒドロペルペルオキシドの還元を触媒するペルオキシダーゼ類である[87]。ペルオキシレドキシンは、典型的な2-システインペルオキシレドキシン、非定型な 2-システインペルオキシレドキシン、1-システインペルオキシレドキシンの3種に分けられる[88]。これらの酵素は基本的に触媒機構は同じで、活性部位の酸化還元活性システイン (peroxidatic cysteine) は基質であるペルオキシドによってスルフェン酸に酸化される[89]。このシステイン残基の過酸化により酵素は不活性化するが、スルフィレドキシンの作用によって再生される[90]。ペルオキシレドキシン1および2を欠損させたマウスでは低寿命化や溶血性貧血が起こり、植物ではペルオキシレドキシン葉緑体で発生した過酸化水素の除去に使われるため、ペルオキシレドキシンは抗酸化代謝において重要である[91][92][93]。
チオレドキシン系とグルタチオン系
[編集]チオレドキシン系は12kDa のタンパク質であるチオレドキシンと、それに随伴するチオレドキシンレダクターゼからなる[94]。チオレドキシン関連のタンパク質は、シロイヌナズナのような植物も含めてゲノムプロジェクトが完了した全ての生物に存在しており、特にシロイヌナズナでは多様なアイソフォームが見られる[95]。チオレドキシンの活性部位には、保存性の高い CXXCモチーフの中に2つの近接したシステイン残基が含まれている。これにより活性部位は遊離の2つのチオール基を持つ活性型(還元型)と、ジスルフィド結合が形成された酸化型とを可逆的に移り変わることができる。活性型のチオレドキシンは効果的な還元剤として振る舞い、活性酸素種を除去することにより他のタンパク質の還元状態を保つ[96]。酸化されたチオレドキシンは、NADPH を電子供与体としてチオレドキシンレダクターゼによって還元型へと再生される[97]。
グルタチオン系には、グルタチオンとグルタチオンレダクターゼ、グルタチオンペルオキシダーゼおよびグルタチオン S-トランスフェラーゼが含まれる[98]。この系は動物、植物および微生物で見られる[98][99]。グルタチオンペルオキシダーゼは補因子として4つのセレン原子を含み、過酸化水素と有機ヒドロペルオキシドの分解を触媒する。動物では少なくとも4種のグルタチオンペルオキシダーゼのアイソザイムがある[100]。グルタチオンペルオキシダーゼ1は最も豊富で、効率的に過酸化水素を除去する。一方、グルタチオンペルオキシダーゼ4は脂質ヒドロペルオキシドに作用する。意外にも、グルタチオンペルオキシダーゼ1はなくとも問題はなく、この酵素を欠損させたマウスは正常寿命である[101]。しかし、グルタチオンペルオキシダーゼ1欠損マウスは酸化ストレスに過敏である[102]。グルタチオン S-トランスフェラーゼについては過酸化脂質に対し高活性が見られる[103]。これらの酵素は肝臓に高濃度で存在し、また解毒作用を持つ[104]。
生体由来の抗酸化物質
[編集]尿酸
[編集]
ヒトの血中に最も高濃度で存在する抗酸化物質は尿酸であり[59]、ヒト血清中の抗酸化物質全体の約半分を占める[105]。尿酸はキサンチンオキシダーゼ (EC 1.17.3.2) によりキサンチンから合成されるオキシプリンの一つで、霊長類、鳥類、爬虫類におけるプリンの代謝生成物である。ヒトを含むヒト上科では、尿酸はプリン代謝の酸化最終生成物である[106]。その他のほとんどの哺乳動物では、尿酸オキシダーゼ (EC 1.7.3.3) によって尿酸はさらにアラントインまで酸化される[107]。霊長類のヒト上科での尿酸オキシダーゼの欠損は、同じく霊長類の狭鼻下目でのアスコルビン酸合成の欠損に匹敵する[108]。これは尿酸が抗酸化物質として部分的にアスコルビン酸の代用となるためである[108]。尿酸は水に対する溶解度が低く、尿酸が過剰になると体内で尿酸の結晶を生成して痛風の原因となる[109]。脳卒中や心麻痺といった疾患では尿酸の役割はよく分かっていないが、尿酸濃度が高いと死亡率が増加するといくつかの研究で言及されている[110][111]。この一見したところの効果は、酸化ストレスに対する防御的機能として尿酸が活性化されることによるか、それとも尿酸が酸化促進剤として作用し病気による損傷に加担していることによるか、いずれかであるかもしれない[110][111]。
血漿中の尿酸濃度は低酸素症で増大することが知られているが、被験者を高地に移動させた時の順応を見る実験[112]では、高地に移動すると血漿中に酸化ストレスの増大を意味するマーカー物質が増大する。しばらく経つと、血漿中の尿酸濃度が増大するとともにマーカー物質は減少に転じた。すなわち、水溶性抗酸化物質の尿酸が酸素が不足する組織から遊離され酸化ストレスに順応したものと考えられる。言い換えると血漿中の尿酸濃度の上昇は高地のような過酷な環境への順応においてストレス軽減に重要な役割を持つ可能性がある。このような報告があるものの、高地では薄い空気への順応のために体内で血液の濃縮が起こり、血液の濃縮に伴って単に尿酸濃度も上昇し、痛風のリスクが高まる旨の報告がある[113]。
尿酸は、運動ストレス時の抗酸化物質として作用する報告がある[114]。また、ショウジョウバエにおいて酸化傷害に対する防御機構として尿酸合成が亢進している可能性を示唆する報告もある[115][信頼性要検証]。
アスコルビン酸
[編集]

アスコルビン酸(またはビタミンC)は単糖の一つで動植物両方で見られる酸化還元触媒である。アスコルビン酸を合成する酵素は霊長類の進化の過程で喪失したためビタミンの一つとなっている[116]。ただし、霊長類のようにビタミンC の合成能を失った動物以外のほとんどの動物は、アスコルビン酸を自ら合成することができ、ビタミンC の食事での摂取を必要としていない[117]。アスコルビン酸は、プロリン残基をヒドロキシル化してヒドロキシプロリンに変換させ、このことによりプロコラーゲンをコラーゲンへ変換することに必須である。このコラーゲンが適正に形成されないと皮膚組織が維持できず、代表的なビタミンC欠乏症である壊血病を発症する。その他の細胞では、グルタチオンが基質となるタンパク質ジスルフィドイソメラーゼ (EC 5.3.4.1) およびグルタレドキシン (EC 1.20.4.1) の反応により、アスコルビン酸の還元型が維持されている[118][119]。 アスコルビン酸は還元能を有する酸化還元触媒で、過酸化水素のような活性酸素種を還元することにより解毒する[120][121]。アスコルビン酸が酸化されるとモノデビトロアスコルビン酸になり、このモノデビトロアスコルビン酸がモノデヒドロアスコルビン酸レダクターゼ (NADH) (EC 1.6.5.4) と NADH により再びアスコルビン酸に還元される。アスコルビン酸の酸化型でも生体内で還元されることでビタミンC としての機能を有しており、アスコルビン酸が触媒と呼ばれる所以である。アスコルビン酸は、直接的な抗酸化機能に加え、過酸化水素などの過酸化物を無毒化する酵素であるアスコルビン酸ペルオキシダーゼ (EC 1.11.1.11) の基質となっており、特に光合成により酸素を発生させる植物にとって重要な反応である[122]。アスコルビン酸は植物のすべての部分において高濃度で存在しており、葉緑体では 20mM にも及ぶ[123]。
グルタチオン
[編集]
グルタチオンは有酸素種で見られるシステイン含有ペプチドである[98]。グルタチオンは摂取により補給する必要はなく、細胞内でアミノ酸から合成される[124]。グルタチオンはシステイン部分のチオール基が抗酸化能を持ち、酸化や還元を可逆的に行うことができる。細胞内ではグルタチオンは、グルタチオンレダクターゼにより還元型で維持され、直接酸化物質と反応するだけではなく、グルタチオン-アスコルビン酸回路やグルタチオンペルオキシダーゼ、グルタレドキシンなどの酵素系によって他の有機物の還元を行っている[118]。グルタチオンはその濃度の高さと細胞での酸化還元状態の維持に重要な役割を果たしていることから、最も重要な細胞性抗酸化物質である[98]。いくつかの有機体のグルタチオンには、放線菌のマイコチオールやキネトプラスト類のトリパノチオンのように他のチオールに置換しているものがある[125][126]。
メラトニン
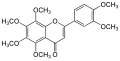
[編集]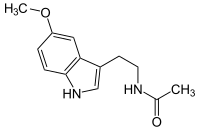
メラトニンは容易に細胞膜と血液脳関門を通過できる強力な抗酸化物質である[127]。他の抗酸化物質とは異なり、再度の酸化または還元を受けることはなく、酸化還元サイクルを形成しない。酸化還元サイクルを形成する他の抗酸化物質(ビタミンCなど)は酸化促進剤としてフリーラジカルを形成する可能性がある。しかし、メラトニンはフリーラジカルと反応すると安定な状態になるため1回酸化されるのみで、還元はされない。したがって、メラトニンは末端抗酸化物質 (terminal antioxidant) とも呼ばれる[128]。メラトニンは、強力な抗酸化物質で、動物実験では飲み水に添加することで寿命伸長効果が認められた[32]。
ウロビリノーゲン
[編集]
ウロビリノーゲンは、赤血球中のヘモグロビンの構成要素であるヘムの代謝物である。古くなって用済みになったヘムは、ビリベルジンに分解され、還元されてビリルビンになる。ビリルビンは肝臓でグルクロン酸抱合を受けて、胆汁の一部として十二指腸に分泌される。ビリルビンは、腸内細菌により還元されてウロビリノーゲンとなり、腸から再度体内に吸収される。ウロビリノーゲンは尿として排泄される。この循環を腸肝ウロビリノーゲンサイクルと呼ぶ。ウロビリノーゲンの一部は酸化されて尿の黄色の元であるウロビリンになり、同じく尿として排泄される。
ウロビリノーゲンは、抗酸化作用を有し[129]、DPPHラジカル除去作用は他の抗酸化物質(ビタミンE、ビリルビンおよびβ-カロチン)よりも高い値を示す[130][131]。
また、中間代謝物であるビリルビンも潜在的な抗酸化作用を示唆しており、ビリルビンは細胞内において抗酸化の生理作用を担っているのではないかという仮説が立てられる[132][133]。
天然成分の抗酸化物質
[編集]トコフェロール類、トコトリエノール類(ビタミンE)
[編集]
ビタミンEはトコフェロール類とトコトリエノール類の共同名で、抗酸化機能を持つ脂溶性ビタミンである[134][135]。ビタミンE のうち、α-トコフェロールのバイオアベイラビリティが選択的吸収および代謝とともに最も研究がなされている[136]。
α-トコフェロールは、脂質過酸化連鎖反応で生成する脂質ラジカルによる酸化から細胞膜を保護するため、最も重要な脂溶性抗酸化物質である[134][137][138][139]。
つまりはフリーラジカル中間体の除去により、それによる成長反応を抑制している。この反応では酸化型である α-トコフェロキシルラジカルが生成するが、アスコルビン酸やレチノール、ユビキノールなど他の抗酸化物質により還元され、元の還元型にリサイクルされる[140]。これは、水溶性抗酸化物質ではない α-トコフェロールが効率的にグルタチオンペルオキシダーゼ4 (GPX4) -欠乏細胞を細胞死から保護しているという研究結果と一致する[141]。GPX4 は生体膜の内側で脂質-ヒドロペルオキシドを効率的に還元する唯一知られている酵素である。
ビタミンE の異なる型の役割とその重要性は現在のところはっきりしていないが[142][143]、その役割は抗酸化物質よりもシグナリング分子の方であることが提唱されている[144][145]。また、γ-トコフェロールは求電子性の突然変異原の求核剤として[136]、そしてトコトリエノール類はニューロンを損傷から保護していると考えられている[146][147]。
カロテノイド
[編集]カロテノイドは、天然に存在する色素で、化学式 C40H56 の基本構造を持つ化合物の誘導体をいい、カロチノイドともいう[148]。炭素と水素のみでできているものはカロテン類、炭素と水素以外の酸素、窒素などを含むものはキサントフィル類という。カロテンやキサントフィルは二重結合を多く含むので抗酸化作用が大きく、植物では酸素が多く発生する場所に多く存在する。水に溶けにくく、脂質に溶け、脂肪とともに摂取すると効率的に摂取できる。主なものは以下の通り。
- キサントフィル類
ポリフェノール
[編集]ポリフェノールとは、ポリ(たくさんの)フェノールという意味で、分子内に複数のフェノール性ヒドロキシ基を持つ植物成分の総称であり、抗酸化作用を持つ物質である[149]。主なものは以下の通り。
- その他のポリフェノール
食品中の反応に由来する抗酸化物質
[編集]メラノイジン
[編集]メイラード反応とは、還元糖とアミノ化合物(アミノ酸、ペプチドおよびタンパク質)を加熱したときなどに見られる、褐色物質(メラノイジン)を生み出す反応のことである。メラノイジンは酸素や窒素を含む、多様な高分子化合物からなる混合物である。
メラノイジンは、それ自身がフリーラジカルであるが、同時にラジカル・スカベンジャーとしての作用を持つため、食品の酸化を抑制する働きがある。この作用には、メラノイジンが金属とキレートを生成して封じ込めることが関与しているとも言われる。例えば、メイラード反応によって生じたトリプトファン・グルコース反応液の抗酸化能はビタミンEであるα-トコフェロールよりも強く、合成抗酸化剤の BHA、BHT に匹敵するものであることが明らかになった[150]。グルコースとグリシンによるアミノカルボニル反応で生成した褐変物質による着色度が高いほど DPPHラジカル消去能も高くなる。着色度を示す 440nm における吸光度と DPPHラジカル消去能の間には r = 0.993 の非常に高い正の相関関係が認められる。また、玉ネギを加熱し、黄色、あめ色、茶色と褐変が進行するに従ってDPPHラジカル消去能が上昇する、との報告がある[151]。
メラノイジンは、in vitro では抗酸化作用、活性酸素消去活性、ヘテロ環アミノ化合物(発癌物質)に対する脱変異原活性などを有するとされている[152][信頼性要検証]。 メイラード反応が関与するものには次のような現象が挙げられる。
例えば、味噌は優れた抗酸化能力を有し、味噌のラジカル捕捉能力はその大半をメラノイジンが担っており、味噌の色調が濃いほどその能力が高まっているとされている[153]。動物実験では、味噌の摂取で肺癌、胃癌、乳癌、肝臓癌、大腸癌の抑制効果が認められ、味噌の熟成度が高いほど効果が高かったとの報告がある[154]。味噌の摂取の放射線障害防止効果については後述する。
カラメル
[編集]
カラメル化は、糖類が引き起こす酸化反応などにより褐色物質を生成する現象であり、カラメルができるメカニズムはまだ完全に解明されてはいないが、グルコース、ショ糖などが加熱されることで生じるフラン化合物が重合して生じる、フラン・ポリマーの構造を取るのではないかという仮説が提唱されている。カラメル化と同様に加熱によって褐色色素が生じる反応には、他にメイラード反応があるが、これはアミノ酸と還元糖の両者を必要とするものであり、カラメル化とは異なる反応である。
カラメルは、メイラード反応のメラノイジンほどではないが、抗酸化作用を有する[151]。一般に、色が濃いほど抗酸化作用が強く、窒素含有量の多いものほど抗酸化作用が強くなる[155]。
医薬品開発と抗酸化物質
[編集]酸化ストレスと病態
[編集]酸化ストレスはアルツハイマー型認知症[156][157]、パーキンソン病[158]、糖尿病合併症[159][160]、関節リウマチ[161]、運動ニューロン病による神経変性[162]など広範囲の病気の進行に寄与していると考えられている[18][163][164][165]。これらの多くの場合において、酸化物質が病気の要因になっているのか、それとも病気と一般的な組織の損傷から二次的に酸化物質が作り出されているのか、不明確である[37]。しかし、心血管疾患については酸化ストレスが関連していることがよく分かっている。低比重リポタンパク質(LDLコレステロール)の酸化がアテロームの発生を誘発し、それがアテローム性動脈硬化症となり、最終的には心臓血管の疾患に繋がるのである[166][167]。またフリーラジカルと DNA損傷の関連より、癌に対する抗酸化物の予防効果についても研究されている[168]。
循環器疾患と抗酸化物質
[編集]血中の酸化型LDLコレステロールは心臓疾患の原因になると考えられ、また、1980年代アメリカを対象とした疫学研究からビタミンE の摂取により心臓疾患の発現のリスクを下げることが分かっていた[169][170][171]。これに対し、1日に 50 から 600mg のビタミンE を摂取させ、その効果を調査する大規模な治験が少なくとも7回行われたが、死亡総数および心臓疾患による死亡率ともにビタミンE の影響は見られなく[172]、その他の研究でもまた結果は同様で[173][174]、これらの試験または多くの栄養補助食品の使用が酸化ストレスによる疾患の予防になっているかどうかは明確ではない[175]。総合的に、心臓血管疾患には酸化ストレスが関わっているにもかかわらず、抗酸化ビタミンを使った試験では心疾患発現リスクおよび既に発現した疾患の進行を抑える効果は認められなかった[176][177]。
脳虚血性疾患と抗酸化物質
[編集]脳はその高い代謝率と高濃度の多価不飽和脂肪のために酸化的損傷に非常に弱く[178]、抗酸化物質は脳損傷治療の薬剤として広く使われている。スーパーオキシドジスムターゼ模倣薬としては[179]、チオペンタールとプロポフォールが脳虚血疾患の後遺症である再かん流傷害や外傷性脳損傷に[180]、実験的薬剤としてはジスフェントン (NXY-059)[181][182]とエブセレン[183]が脳卒中の治療に応用されている。これらの化合物は、ニューロンの酸化ストレス、アポトーシスおよび神経損傷を予防しているように見える。また、抗酸化物質は、アルツハイマー型認知症、パーキンソン病、筋萎縮性側索硬化症のような神経変性の病気の治療[184][185]、音響性外傷の予防[186]についての研究がなされている。
哺乳動物の最長寿命と抗酸化物質
[編集]血漿あるいは血清中の尿酸、α-トコフェロール、カロチノイド量とヒトを含めた哺乳動物の最長寿命を比較したデータによると、これら抗酸化成分の濃度が高いほど最長寿命が長い傾向にあった。これに対してビタミンC、グルタチオン、ビタミンA濃度と最長寿命との相関は認められないと言われている[187]。
アンチエイジングと抗酸化物質
[編集]果物と野菜の多い食事では抗酸化物質が多く摂取されることにより健康を増進させ老化の影響を減らすとされるが、抗酸化ビタミンの補給は老化作用に対して検知できるような効果はないため、果物と野菜の効果はその抗酸化物質の含有量とは関係がないかもしれない[188][189][190]。その理由として、ポリフェノールやビタミンE のような抗酸化分子はその他の代謝過程を変化させ、それらの変化の方が抗酸化物質の栄養素としての重要性の真の理由である、という可能性がある[144][191]。
線虫での研究では、適度な酸化ストレスは活性酸素種への防御反応を誘導することによって寿命を延ばすことさえ示唆されている[192]。この、寿命が延びるのは酸化ストレスの増加が原因であるという示唆は、出芽酵母 (Saccharomyces cerevisiae) での結果と矛盾する[193]。この矛盾について哺乳類ではさらに曖昧である[194][195][196]。それでもやはり、抗酸化物質の栄養補助食品がヒトの寿命を延ばしているようには見えない[197][198]。
ビタミンは、生物の生存・生育に必要な栄養素のうち、炭水化物やタンパク質、脂質、ミネラル以外の栄養素であり、微量ではあるが生理作用を円滑に行うために必須な有機化合物であり、各種ビタミン欠乏症は寿命を縮めることがあるが、過剰なビタミンが寿命を延ばすとの報告はほとんどない。
栄養学・食品科学と抗酸化物質
[編集]プロオキシダント
[編集]生体内では抗酸化物質として作用している生体物質が、食品などでは逆に酸化を促進することが知られている。このような物質は栄養学・食品科学の分野ではプロオキシダントと呼ばれる。例えばビタミンCは過酸化水素のような酸化性物質と反応する場合は抗酸化性を有するが、食品の成分として含まれる微量の銅や鉄などの金属イオン、ミオグロビンやヘモグロビンなどのヘムタンパク質などが存在する場合、空気酸化を促進することが知られている[17]。
これは、無機化学・有機化学の分野では「フェントン試薬」または「フェントン反応」として知られている化学反応である[11]。種々の金属イオンを介して分子状酸素や過酸化水素からヒドロキシラジカルが発生する。フェントン試薬は鉄(II)イオンと過酸化水素の反応であるが、アスコルビン酸がフェントン試薬の触媒サイクルを形成する例も知られている[199][200][201]。
- 2Fe3+ + アスコルビン酸 → 2Fe2+ + デヒドロアスコルビン酸 ; 鉄(II)イオンの再生
- ; フェントン反応
他の例としてはビタミンEもプロオキシダントとして働く[202]。一方で、アスタキサンチンのようにプロオキシダントにはならない純粋な抗酸化物質も存在する。[203]
シネルギスト
[編集]金属イオンとキレートを形成する化合物は、天然物由来あるいは無機化合物・合成化合物など数多く知られている。一般に、キレート物質と金属イオンとの結合の強さは金属イオンの酸化状態で変化することが知られている。言い換えると、キレート化合物によっては特定の酸化状態の金属イオンと結合補足することで、前述のフェントン反応のような酸素が関与する不都合な反応を抑制する場合がある。栄養学ではそのような物質をシネルギスト(協作剤)とも呼ぶ。クエン酸などは金属キレート剤としては食品添加物として利用される。すなわち、シネルギストであるクエン酸は抗酸化剤として利用されることもある[16]。
吸収阻害物質
[編集]
比較的強力な還元性の有機酸類は消化管で鉄や亜鉛などの飼料無機質と結合し、微量ミネラルの吸収阻害物質として働く場合がある[204]。主な例では、植物由来の食品に多いシュウ酸、タンニンおよびフィチン酸などがある[205]。カルシウムと鉄の欠乏は、肉類が少なく、マメ類やイースト菌を入れていない全粒穀物のパンなどの食生活が中心でフィチン酸の摂取が多くなっている発展途上国では珍しいことではない[206]。特定の微量ミネラルが欠乏することで生体内の抗酸化作用に関与する酵素が欠乏する。その場合、ミネラル欠乏症の原因として活性酸素の毒性が増強される例がある。
| 食品 | 含まれる還元酸 |
|---|---|
| カカオ豆、チョコレート、ホウレンソウ、カブ、ダイオウ[207] | シュウ酸 |
| 全粒穀物, トウモロコシ, マメ科植物[208] | フィチン酸 |
| 茶、マメ類、キャベツ[207][209] | タンニン |
過剰摂取とメタアナリシス(疫学調査)
[編集]丁子油に主に含まれるオイゲノールのような脂溶性の抗酸化物質は毒性用量を持ち、特に希釈していない精油(原液)を誤用することによって毒性用量を超えて摂取してしまう[210]。アスコルビン酸のような水溶性抗酸化物質は余分な用量は尿として速やかに体外排出される。そのため毒性が発現する懸念は相対的に低い[211]。
実際のところ、いくつかの抗酸化物質では高濃度で摂取することにより有害な長期的影響をもたらす可能性のものがある。(いずれも脂溶性である)肺癌患者における β-カロテンとレチノールの有効性試験 (CARET) の研究では、喫煙者に β-カロテンとビタミンA を含むサプリメントを与えたところ、肺癌の速度が増大するという結果が見られた[212]。後に行われた研究でもそれらの作用が確認されている[213]。
治療、予防に関する医療技術をメタアナリシスの手法で評価するプロジェクトであるコクラン共同研究は抗酸化サプリメントが死亡率にどのように影響を与えているかという仮説に対してランダム化検証で一次予防効果検証および二次予防効果検証を実施した[214]。メタアナリシスは統計処理によって仮説を検証する疫学調査であり、このコクランの研究チームは公開データベースや2005年10月に発行された文献の試験結果から232,606人の被験者(385論文)の成人の結果をデータ元として取り込み、ベータカロテン、ビタミンA、ビタミンC(アスコルビン酸)、ビタミンE、およびセレン について、単独投与群、複合投与群、プラセボ投与群そして医学的治療を受けなかった群について68のランダム検証を統計解析した。その結果によると β-カロテン、ビタミンA およびビタミンE(これらは脂溶性)の補給では死亡率の増加が見られたが、ビタミンC(水溶性)では有意な効果は見られないとコクランチームは結論付けた。
これに対して、オレゴン州立大学のライナス・ポーリング研究所の B.フレイ教授は、「(膨大な試験結果を排除した)間違った方法論による結果で、有用性の点や他の点についても抗酸化サプリメントの真の健康に対する効果を理解する上では少しも役に立たない。」と述べている[215]。健康リスク評価を見ると、すべて無作為に選別された群間の比較検証では複合投与群で解析したとき死亡率の増加が見られなかったのに対し、(データ元が)高バイアス検証もしくは低バイアス検証の解析結果では単独投与群のみに死亡率の増加が見られた。加えて、これらの低バイアス検証では高齢者または既に病気を患っている人の死亡率を対象としており、低バイアス検証の結果は一般的な人には適用できない。
また、その後のコクラン共同計画からも新しいメタアナリシス解析が発表され、「ビタミンC とセレンについて(先の)ランダム化検証で追加の一次予防効果検証および二次予防効果検証を実施した結果、ビタミンC には明白な有害作用は見られなかった。セレンには明白な死亡率との関係は見られなかった。これはビタミンC とセレンの過剰摂取についてのみ評価すべきだ。」と述べている[216]。
ビタミンE の摂取により死亡率が増加すると、ジョンホプキンス医大が報告している[217]のに対して、コクラン共同研究チームは、大腸癌に対する抗酸化物質の一次予防効果検証および二次予防効果検証では「ベータカロテン、ビタミンA、ビタミンC(アスコルビン酸)、ビタミンE、およびセレンは大腸癌に対する一次予防効果検証および二次予防効果検証の結果、確証は得られなかった。」と述べている[218]。
また肺がんについての SU.VI.MAXメタアナリシス検証では「抗酸化物質はすべての死因に対し関連性を持たない。」と述べられているし[219][220]、Southern California Evidence-Based Practice Center の報告では「(いくつかの癌で結果が得られたが)再検証が必要である。」と結論付けている[221]。
全体として、抗酸化物質のサプリメントについて行われた臨床試験の多くは健康に影響がないか、高齢者または影響を受けやすい人の死亡率をやや高めているかのどちらかを示唆している[222][223][214]。
栄養補助食品と抗酸化物質
[編集]先進工業国では、多くの抗酸化物質の栄養補助食品および健康食品が広く販売されている[224]。これら栄養補助食品にはポリフェノール、レスベラトロール(ブドウの種子またはタデの葉から採れる)[225]などの化合物、ACES製品(β-カロテン(プロビタミンA)、ビタミンC、ビタミンE、セレン:Selenium)、または緑茶やアマチャヅルなど抗酸化物質を含むハーブが含まれている。食品中のある程度の抗酸化ビタミンおよびミネラルは良好な健康状態のために必須であるが、これらの抗酸化物質の栄養補助食品は有益なのか有害なのか、そしてもし有益だとしたら、どの物質がどれくらいの服用するとよいのか? それは相当疑問である[222][223][226]。実際に数名の著者らは、抗酸化物質には慢性的な疾患を予防することができるという仮説は今や反証され、最初から見当違いであったと主張している[227]。むしろ、食品中のポリフェノール類は微量濃度では細胞間シグナリング、受容体感受性、炎症性酵素活性および遺伝子調節など抗酸化物質としてではない機能を持っている可能性がある[228][229]。
抗酸化物質の抗酸化能と酸化促進能の相対的重要性は現在の所は研究段階であるが、ビタミンCは体内では主に抗酸化物質として機能していると考えられている[200][230]。しかしながら、ビタミンE[231]やポリフェノール類などの食物中の抗酸化物質については十分なデータがない[232]。

果物や野菜をよく摂る人は心臓疾患と神経疾患のリスクが低く[222]、野菜や果物の種類によっては癌の予防になるという証拠がある[233]。果物と野菜はよい抗酸化物質源であることから、抗酸化物質はいくつかの病気を予防していると考えられている。しかし、抗酸化物質は摂取による治験で癌および心臓疾患のような慢性疾患のリスクに明確な効果は認められないため病気の予防に関与しているとはいえない[222][223]。したがって、病気の予防には野菜や果物のその他の物質(例えばフラボノイド類)または複合混合物が関わっていると考えられる[234][235]。
例えば、食事と癌について、多くの食品が癌の予防に効果を示す抗酸化物質を含む有効成分を含んでいるが、これらの有効成分を単離したものは食品の摂取と同様の効果をもたらさないようである。いくつかの研究では、食品から単離された有効成分が癌の予防に効果を示さないことが報告されている[236]。しかし、食品全体を摂取することによって癌の抑制が認められるとされている。
高用量の抗酸化物質を含む栄養補助食品の試験の一つ、"Supplémentation en Vitamines et Mineraux Antioxydants" (SU.VI.MAX) study は、いわゆる健康食に相当する栄養を補足し、その効果を調査する試験である[219]。この試験では、12,500人のフランス人の男女を対象に、低用量の抗酸化物質(アスコルビン酸:120 mg、ビタミンE:30 mg、β-カロテン:6 mg、セレン:100 μg、亜鉛:20mg)または偽薬を平均7.5年間摂取させた。結果、癌および心臓疾患に対し統計学的に見て抗酸化物質には大きな効果は認められなかった。事後分析では男性では31%の癌リスクの減少が見られたが、女性では見られなかった。これは、試験を開始した段階での血液検査の結果から試験開始当初の時点で女性被験者の方が男性被験者よりもビタミンE や β-カロテンの血中濃度が高かったことが判明しており、男性と女性で状態が初めから異なっていたためである[237]。
また低カロリーの摂食は多くの動物の平均寿命と最長寿命を延ばす。この効果は酸化ストレスの減少が関与している可能性がある[238](DNA修復#カロリー制限とDNA修復の増加も参照のこと。)。Drosophila melanogaster や Caenorhabditis elegans のようなモデル生物では老化に酸化ストレスが関与していることが支持されている[239][240]が、哺乳類では不明確である[194][195][196]。2009年のマウス実験のレビューでは、抗酸化系のほとんどすべての操作は寿命に影響を与えなかったと結論付けられている[241]。栄養の不足は、細胞中での DNA修復の増加した状態を引き起こし、休眠状態を維持し、新陳代謝を減少させ、ゲノムの不安定性を減少させて、寿命の延長を示すと言われている。
運動との関係
[編集]運動時、酸素消費量は10倍以上に増加する[242]。これは酸化物質の大幅な増加に繋がり、運動の後の筋肉疲労の一因となる。激しい運動の後、特に24時間後に発生する筋肉痛も酸化ストレスが関係している。運動によるダメージへの免疫系の応答は運動の2から7日後がピークである。この過程では、フリーラジカルはダメージを受けた組織を除去するため好中球によって作られる。そのため、過濃度の抗酸化物質は組織の回復と適応機序を阻害することとなる[243]。この他にも、酸化防止剤のサプリメントは例えばインスリンの感受性を低下させるなど通常の健康のための機序を阻害している可能性がある[244]。
増加する酸化ストレスの調整のために身体は抗酸化防衛を強化(特にグルタチオン系)している[245][246]。習慣的な運動を行う人は主な病気の発現率が低下していることから、この効果は酸化ストレスに関係している病気をある程度予防していると考えられている[247]。
しかし実際には、スポーツ選手の身体能力の向上はビタミンE の補給では見られなく[248]、その脂質膜過酸化防止機能にもかかわらず、6週間のビタミンEサプリメントの投与でもウルトラマラソンのランナーでは筋損傷への効果は無かった[249]。スポーツ選手のビタミンC 摂取の必要性は考えられていないが、激しい運動の前にビタミンC の摂取量を増やすことで筋損傷が減少する兆候がある[250][251]。しかし、他の研究ではこのような効果は見られず、また、1000mg 以上の摂取では逆にその回復を阻害するという結果が数件報告されている[252]。
抗酸化物質は広く癌の進行の抑制に使われているが、逆に癌の治療を妨げている可能性が示唆されている[253]。これは、治療によってさらに細胞が酸化ストレスの影響を受けやすくなるというものである。また、ガン細胞の酸化還元ストレスも減少するため、結果的に抗酸化物質サプリメントは放射線療法と化学療法の有効性を減少させている可能性もある[254][255]。他方では、抗酸化物質が副作用を減少させ、寿命を延ばしていると提言している報文も存在する[256][257]。
放射線との関係
[編集]スイスの科学者ラルフ・グロイブ (Ralph Graeub, 1921-2008) は、放射線のペトカウ効果を紹介する際に以下のように述べている[258][259][260]。
活性酸素は放射線によっても生じ、細胞膜の脂質と作用して過酸化脂質を生成し、細胞を損傷する。低線量では活性酸素の密度が低く、再結合する割合が少なく効率よく細胞膜に達し、細胞膜に達すると連鎖反応が起こるため、放射線の影響は低線量で急激に高まる。
上記の事象は、活性酸素を消去する作用のある酵素スーパーオキシドディスムターゼ (SOD) を投入すると減少または観察されなくなることから、放射線起因の活性酸素によるメカニズムであることが裏付けられている。
個体レベルでは、活性酸素およびその反応によって生じる過酸化脂質などにより、悪性腫瘍・動脈硬化症・心臓病・脳梗塞を含む多くの病気や老化が引き起こされる。
ペトカウは人工膜のみでなく、幹細胞膜、白血球膜などを含む生体膜を使った実験でも同様の結果を得ている。
人体中の SOD などの酵素や食物中のビタミンやミネラル類などの抗酸化物質は、活性酸素に対する防御機能があり、被曝後の影響を低減させる可能性がある[259]。
心筋細胞などにセシウム137が過剰に蓄積しやすく、心筋障害や不整脈などの心臓疾患が惹起されやすいことが指摘されている[261](詳細は「ユーリ・バンダジェフスキー」を参照のこと)。
放射線の照射により赤血球の溶血反応が発生するが、これは放射線による活性酸素の生成により脂質過酸化反応による膜の破壊によるものである。ビタミンEの投与により、放射線による赤血球の溶血や細胞小器官であるミトコンドリア、ミクロゾーム、リボゾームの脂質過酸化反応が顕著に抑制された。SOD(スーパーオキシドディスムターゼ)も同様の効果を示した[262]。
例えば、味噌には放射能防御能力があることが報告されている[263][264][265][信頼性要検証]。動物実験では、十分に熟成した味噌ほど放射線防御作用が高いと言われている[154][266]。また、レスベラトロールに放射線障害を防ぐ働きがあることが、ピッツバーグ大学の Joel Greenberger のマウスを使った研究で報告している[267][信頼性要検証]。
食品中の抗酸化物質
[編集]
活性酸素種の違いによって活性も異なるため抗酸化物質の測定はその物質により多様である[268][269][270]。食品科学では、酸素ラジカル吸収能 (ORAC) が食品、飲料および食品添加物の抗酸化物質濃度を評価する最新の業界標準になっている[271][272]。 米国食品医薬品局(USDA)が食品中のORACの値をかつて公開していたが[273][274]、USDAは、食物に含まれる抗酸化物質の強さが体内の抗酸化作用に関連しているという証拠がないため、Selected Foods Release 2(2010)表の酸素ラジカル吸収能(ORAC)を示す表を2012年に削除した[275]。 この他にフォリン-チオカルトー試薬を用いる方法やトロロックス等価抗酸化能力分析法(TEAC法)がある[276]。
抗酸化物質は野菜、果物、穀物、卵、肉、マメ、木の実などの食品に多量に含まれている[277][278]。リコペンやアスコルビン酸のようないくつかの抗酸化物質は長期貯蔵または長時間の調理によって分解するものがある[279][280]。一方、全粒小麦や茶などに含まれるポリフェノール系抗酸化物質は安定である[281][282]。また、野菜に含まれる数種のカロテノイド類のように抗酸化物質の生物学的利用能を増加させることもできるため調理や加工による影響は複雑である[283]。一般に、加工の過程で酸素に晒されるため、加工食品は非加工食品よりも抗酸化物質が少ない[284]。
| 抗酸化物質 | 抗酸化物質が多く含まれる食品[209][285][286] |
|---|---|
| ビタミンC(アスコルビン酸) | 果物、野菜 |
| ビタミンE(トコフェロール、トコトリエノール) | 植物油 |
| ポリフェノール(レスベラトロール、フラボノイド) | 茶、コーヒー、豆、果物、オリーブオイル、チョコレート、シナモン、オレガノ、赤ワイン |
| カロテノイド(リコペン、カロテン、ルテイン) | 果物、野菜、卵[287] |
その他のビタミンは体内で合成させる。例えば、ユビキノール(補酵素Q)は腸で吸収されにくく、ヒトではメバロン酸経路にて合成される[66]。また、グルタチオンはアミノ酸から合成される。グルタチオンは腸ではシステインとグリシンとグルタミン酸に分解されてから吸収されるため、グルタチオンの経口投与は体内のグルタチオン濃度にはほとんど影響がない[288][289]。アセチルシステインのような含硫アミノ酸が高濃度であることによりグルタチオンが増加するが[290]、グルタチオン前駆体を多く摂取することが成人健常者において有益であるという根拠はない[291]。前駆体を多く摂取することは急性呼吸窮迫症候群、蛋白エネルギー栄養障害の治療、もしくはアセトアミノフェンの過剰摂取によって生じる肝臓障害の予防に役立つと考えられている[290][292]。
食品中のある成分は酸化促進剤(プロオキシダント)として作用することにより抗酸化物質の含有量を経時的に低減させることがある。抗酸化物質が消耗した食品を摂取することで酸化ストレスが惹起される時には、身体は抗酸化防衛能を高めるように反応することがある[227]。イソチオシアン酸やクルクミンなどは異常細胞の癌性細胞への変質を遮断したり、既存の癌細胞を殺したりする予防についての機能性化学種であると考えられている[227][293]。
| 飲み物 | 抗酸化能 (n mol/mL)[294] |
| 赤ワイン | 172 - 267 |
| 白ワイン | 147 - 214 |
| ビール | 12.3 - 17.0 |
| 日本酒 | 0 |
| コーヒー | 23.6 |
| 緑茶 | 16.8 - 27.8 |
| ほうじ茶 | 11.8 - 17.3 |
| 紅茶 | 5.5 |
| 昆布茶 | 0 |
各種飲み物の抗酸化能を調査した中で、赤白双方のワインの抗酸化能が高いと報告した例がある[294]。
食品添加物
[編集]抗酸化物質は食品の劣化を防ぐ食品添加物として使われている。食品は主に酸素と日光が酸化の要因になるため、暗所で保管し容器で密閉して保存するが、酸素は植物の呼吸にも必要で、植物性の素材を嫌気性の環境におくとその香りや色が劣化する[295]。そのため、果物および野菜には8%未満の酸素を含ませて包装している。冷凍・冷蔵食品は、細菌類・菌類による劣化よりも、酸化の方が比較的早く進むため抗酸化物質は保存料の一つとして重要である[296]。これらの保存料には天然の抗酸化物質ではアスコルビン酸 (AA, E300) やトコフェロール類 (E306)、合成された抗酸化物質では没食子酸プロピル (PG, E310)、tert-ブチルヒドロキノン (TBHQ)、ブチル化ヒドロキシアニソール (BHA, E320)、ブチル化ヒドロキシトルエン (BHT, E321) が含まれる[297][298]。
栄養学や食品科学の分野では、酸化による攻撃対象となる成分は不飽和脂肪が、特に問題とされる。すなわち微量でも酸化により悪臭を持つようになり[299]、ついには毒性を持つに至る[300]。酸化した脂肪は大抵は変色し、金属または硫黄臭のような不快な風味を持つようになるため、特に脂肪が多い食品の酸化を防止することは重要である。ゆえに保存加工の方法として(大量の酸素に晒すことになる)通風乾燥させることはほとんどない。代わりに密閉され酸素が少ない環境での加工である薫製や塩漬け、発酵が使われる。果物など脂肪が少ないものは空気乾燥する前に硫黄を含む酸化防止剤(抗酸化物質)が噴霧される。酸化は金属によって触媒されるため、バターなどの脂肪製品は金属製容器で保存してはならない。オリーブオイルなどいくつかの脂肪食品は天然の抗酸化物質により酸化から保護されているが、光酸化には過敏なままである[301]。また、抗酸化物質の保存料は脂肪をベースとした口紅や保湿剤などの化粧品にも添加されている。
工業での利用
[編集]抗酸化物質は頻繁に工業製品に添加される。主に燃料と潤滑油の安定剤として用いられ、ガソリンが重合してエンジンが目詰まりを起こすのを防ぐ[302]。2007年現在、工業的抗酸化剤の世界市場は約88万トンである。これは約37億米ドル(24億ユーロ)の市場規模である[303]。
抗酸化物質はゴム、プラスチック、接着剤などポリマー製品の強度や柔軟性の低下の原因となる酸化分解の防止のために広く用いられる[304]。天然ゴムやポリブタジエンなどのポリマーはその主鎖に二重結合を含み、酸化やオゾン分解の影響を受けやすい。これらは抗酸化物質で保護することが可能である。また、紫外線は結合を壊すことによりフリーラジカルを作り出すため、酸化と紫外線劣化は強く関係している。フリーラジカルは酸素と反応することによりペルオキシラジカルが生成し、連鎖反応を起こし、さらなる製品の劣化を引き起こす。そのほか、ポリプロピレンとポリエチレンも酸化の影響を受ける。前者は繰り返し単位中に一級炭素原子、二級炭素原子、三級炭素原子が存在するが、フリーラジカルになったときの安定性が最も高い「三級炭素原子」が攻撃を受ける。ポリエチレンの酸化は低密度ポリエチレンの分枝部分(三級炭素原子)など、結合の弱い部分で起こる傾向がある。
| 燃料添加剤 | 構成物質[305] | 製品[305] |
|---|---|---|
| AO-22 | N,N '-ジ-2-ブチル-1,4-フェニレンジアミン | タービン油、変圧器油、油圧油、ワックス、潤滑油 |
| AO-24 | N,N '-ジ-2-ブチル-1,4-フェニレンジアミン | 低温油 |
| AO-29 | 2,6-ジ-tert-ブチル-4-メチルフェノール | タービン油、変圧器油、油圧油、ワックス、潤滑油、ガソリン |
| AO-30 | 2,4-ジメチル-6-tert-ブチルフェノール | ジェット燃料、ガソリン(航空機用ガソリンを含む) |
| AO-31 | 2,4-ジメチル-6-tert-ブチルフェノール | ジェット燃料、ガソリン(航空機用ガソリンを含む) |
| AO-32 | 2,4-ジメチル-6-tert-ブチルフェノール 2,6-ジ-tert-ブチル-4-メチルフェノール |
ジェット燃料、ガソリン(航空機用ガソリンを含む) |
| AO-37 | 2,6-ジ-tert-ブチルフェノール | ジェット燃料、ガソリン。 航空機用ガソリンへの添加が広く承認されている |
抗酸化物質に関わる年表
[編集]抗酸化物質関連年表[26]
- 1818年 L.テナールによりカタラーゼ作用が発見される。(1900年 O.レープによりカタラーゼと命名)
- 1921年 F.G.ホプキンスによりグルタチオンが酵母から分離発見される。
- 1922年 H.M.エバンスによりシロネズミの不妊が、飼料に植物油を混ぜると回復することが発見される。(1923年に B.シュアがビタミンE と命名)
- 1929年 C.エイクマン、F.G.ホプキンスらが「抗神経炎(V.B群)/成長促進 (V.E) ビタミンの発見」でノーベル生理学・医学賞
 を受賞。
を受賞。 - 1932年 C.G.キングによりレモンからアスコルビン酸が分離発見される。
- 1936年 H.M.エバンスにより小麦胚芽油から α-トコフェロールが分離発見される。
- 1955年 H・テオレルが「酸化酵素の性質および作用機序の発見」でノーベル生理学・医学賞
 を受賞。
を受賞。 - 1956年 D.ハーマンが「フリーラジカル仮説」を提唱する[306]。(活性酸素による生体傷害の最初の提唱)
- 1957年 K.シュワルツ、C.Mフォルツらによりセレンが動物の必須ミネラルであり、ビタミンE所要量との関連を指摘する。
- 1969年 J.M.マッコード、I.フリドビッチらによりスーパーオキシドディスムターゼ (SOD) が発見される[307]。
- 1978年 P.ミッチェル「生体膜におけるエネルギー転換の研究」(ミトコンドリアの電子伝達系の解明;1961年 - )によりノーベル化学賞
 を受賞。
を受賞。
脚注
[編集]出典
[編集]- ^ 井上圭三, 今堀和友 & 山川民夫 1998, p. 498.
- ^ 井上圭三, 今堀和友 & 山川民夫 1998, p. 1108.
- ^ a b 井上圭三, 今堀和友 & 山川民夫 1998, p. 425.
- ^ a b 井上圭三, 今堀和友 & 山川民夫 1998, p. 498
- ^ a b c d e Sies H (1997). “Oxidative stress: oxidants and antioxidants”. Exp Physiol 82 (2): 291–5. doi:10.1113/expphysiol.1997.sp004024. PMID 9129943.
- ^ Rhee SG (June 2006). “Cell signaling. H2O2, a necessary evil for cell signaling”. Science (journal) 312 (5782): 1882–3. doi:10.1126/science.1130481. PMID 16809515.
- ^ a b c “「活性酸素シグナル伝達の分子機構」について”. 大阪大学 蛋白質研究所 細胞内シグナル伝達研究室. 2011年2月3日閲覧。[リンク切れ]
- ^ a b Davies K (1995). “Oxidative stress: the paradox of aerobic life”. Biochem Soc Symp 61: 1–31. PMID 8660387.
- ^ a b c d Vertuani S, Angusti A, Manfredini S (2004). “The antioxidants and pro-antioxidants network: an overview”. Curr Pharm Des 10 (14): 1677–94. doi:10.2174/1381612043384655. PMID 15134565.
- ^ 吉川春寿 & 芦田淳 1995, p. 183「抗酸化剤」
- ^ a b フェントン試薬、『理化学辞典』、第5版CD-ROM版、岩波書店、1996.
- ^ Fenton H.J.H. (1894). “Oxidation of tartaric acid in presence of iron”. J. Chem. Soc., Trans. 65 (65): 899–911. doi:10.1039/ct8946500899.
- ^ Benzie, IF (2003). “Evolution of dietary antioxidants”. Comparative biochemistry and physiology. Part A, Molecular & integrative physiology 136 (1): 113–26. doi:10.1016/S1095-6433(02)00368-9. PMID 14527634.
- ^ 重岡成、石川孝博、武田徹「光合成生物における光・酸素毒防御系の分子機構--光・酸素毒耐性植物の創製は可能か」『蛋白質核酸酵素』第43巻第5号、共立出版、1998年4月、634-648頁、NAID 40002332952。
- ^ 井上圭三, 今堀和友 & 山川民夫 1998, p. 600
- ^ a b c d e 吉川春寿, 芦田淳 & 41995, p. 212「抗酸化剤」
- ^ a b 堤 ちはる、「脂肪」、『世界大百科事典』、第二版、CD-ROM版、平凡社 (1998)
- ^ a b 赤池孝章,鈴木敬一郎,内田浩二編著、『活性酸素シグナルと酸化ストレス』、実験医学増刊、Vol.27、No.15、羊土社、2009。ISBN 978-4-7581-0301-5
- ^ 奥田 拓道、『健康・栄養食品事典―機能性食品・特定保健用食品 』、漢方医薬新聞編集部、東洋医学社(2006) ISBN 4-88580-153-2
- ^ Baillie, J K; A A R Thompson, J B Irving, M G D Bates, A I Sutherland, W Macnee, S R J Maxwell, D J Webb (2009-03-09). “Oral antioxidant supplementation does not prevent acute mountain sickness: double blind, randomized placebo-controlled trial”. QJM: Monthly Journal of the Association of Physicians 102 (5): 341–8. doi:10.1093/qjmed/hcp026. ISSN 1460-2393. PMID 19273551 2009年3月25日閲覧。.
- ^ Bjelakovic G; Nikolova, D; Gluud, LL; Simonetti, RG; Gluud, C (2007). “Mortality in randomized trials of antioxidant supplements for primary and secondary prevention: systematic review and meta-analysis”. JAMA 297 (8): 842–57. doi:10.1001/jama.297.8.842. PMID 17327526.
- ^ Matill HA (1947). Antioxidants. Annu Rev Biochem 16: 177–192.
- ^ 冨永 博夫、「潤滑油」、『世界大百科事典』、第二版CD-ROM版、平凡社、1998.
- ^ Jacob R (1996). “Three eras of vitamin C discovery”. Subcell Biochem 25: 1–16. PMID 8821966.
- ^ Knight J (1998). “Free radicals: their history and current status in aging and disease”. Ann Clin Lab Sci 28 (6): 331–46. PMID 9846200.
- ^ a b 吉川春寿 & 芦田淳 1995, p. 765-776「栄養学史年表」
- ^ Moreau and Dufraisse, (1922) Comptes Rendus des Séances et Mémoires de la Société de Biologie, 86, 321.
- ^ Wolf G (1 March 2005). “The discovery of the antioxidant function of vitamin E: the contribution of Henry A. Mattill”. J Nutr 135 (3): 363–6. doi:10.1093/jn/135.3.363. PMID 15735064.
- ^ 吉川春寿, 芦田淳 & 1995), p. 613「ビタミンE」
- ^ German J (1999). “Food processing and lipid oxidation”. Adv Exp Med Biol 459: 23–50. doi:10.1007/978-1-4615-4853-9_3. PMID 10335367.
- ^ 大阪武雄、日本化学会『活性酸素』丸善、1999年、p.27頁。ISBN 4-621-04634-9。
- ^ a b 服部淳彦「メラトニンとエイジング」『比較生理生化学』第34巻第1号、日本比較生理生化学会、2017年、2-11頁、doi:10.3330/hikakuseiriseika.34.2、ISSN 0916-3786、NAID 130006847407。
- ^ 大澤 郁朗、「水素分子の生理作用と水素水による疾患防御」、『日本老年医学会雑誌』 49巻 6 号(2012:11)、p.680
- ^ a b 小城勝相, 中谷延二, 清水誠『食と健康 : 食品の成分と機能』1626418-1-0611号、放送大学教育振興会〈放送大学教材〉、2006年。ISBN 4595306075。 NCID BA76296688。
- ^ a b 原口紘炁『生命と金属の世界』1869299-1-0511号、放送大学教育振興会〈放送大学教材〉、2005年。ISBN 4595305613。 NCID BA71739307。
- ^ 関根孝司. “鉄の腹輪送の分子機構”. 日本薬理学会. 2021年11月29日閲覧。
- ^ a b Valko M, Leibfritz D, Moncol J, Cronin M, Mazur M, Telser J (2007). “Free radicals and antioxidants in normal physiological functions and human disease”. Int J Biochem Cell Biol 39 (1): 44–84. doi:10.1016/j.biocel.2006.07.001. PMID 16978905.
- ^ 岩井邦久, 西嶋智彦「生体内抗酸化--抗酸化物質の生体利用と活性発現」『食品・食品添加物研究誌』第215巻第1号、FFIジャーナル編集委員会、2010年、pp.38-45、ISSN 09199772、NAID 40017000569。
- ^ 矢澤一良「ヘルスフード科学シリーズ(7)活性酸素と抗酸化物質」『食品と容器』第44巻第9号、缶詰技術研究会 / 缶詰技術研究会、2003年、pp.488-493、ISSN 09112278、NAID 80016098534。
- ^ Stohs S, Bagchi D (1995). “Oxidative mechanisms in the toxicity of metal ions”. Free Radic Biol Med 18 (2): 321–36. doi:10.1016/0891-5849(94)00159-H. PMID 7744317.
- ^ Nakabeppu Y, Sakumi K, Sakamoto K, Tsuchimoto D, Tsuzuki T, Nakatsu Y (2006). “Mutagenesis and carcinogenesis caused by the oxidation of nucleic acids”. Biol Chem 387 (4): 373–9. doi:10.1515/BC.2006.050. PMID 16606334.
- ^ Valko M, Izakovic M, Mazur M, Rhodes C, Telser J (2004). “Role of oxygen radicals in DNA damage and cancer incidence”. Mol Cell Biochem 266 (1–2): 37–56. doi:10.1023/B:MCBI.0000049134.69131.89. PMID 15646026.
- ^ Stadtman E (1992). “Protein oxidation and aging”. Science 257 (5074): 1220–4. doi:10.1126/science.1355616. PMID 1355616.
- ^ Raha S, Robinson B (2000). “Mitochondria, oxygen free radicals, disease and aging”. Trends Biochem Sci 25 (10): 502–8. doi:10.1016/S0968-0004(00)01674-1. PMID 11050436.
- ^ Lenaz G (2001). “The mitochondrial production of reactive oxygen species: mechanisms and implications in human pathology”. IUBMB Life 52 (3–5): 159–64. doi:10.1080/15216540152845957. PMID 11798028.
- ^ Finkel T, Holbrook NJ (2000). “Oxidants, oxidative stress and the biology of aging”. Nature 408 (6809): 239–47. doi:10.1038/35041687. PMID 11089981.
- ^ Hirst J, King MS, Pryde KR (October 2008). “The production of reactive oxygen species by complex I”. Biochem. Soc. Trans. 36 (Pt 5): 976–80. doi:10.1042/BST0360976. PMID 18793173.
- ^ Seaver LC, Imlay JA (November 2004). “Are respiratory enzymes the primary sources of intracellular hydrogen peroxide?”. J. Biol. Chem. 279 (47): 48742–50. doi:10.1074/jbc.M408754200. PMID 15361522.
- ^ Imlay JA (2003). “Pathways of oxidative damage”. Annu. Rev. Microbiol. 57: 395–418. doi:10.1146/annurev.micro.57.030502.090938. PMID 14527285.
- ^ a b Demmig-Adams B, Adams WW (December 2002). “Antioxidants in photosynthesis and human nutrition”. Science (journal) 298 (5601): 2149–53. doi:10.1126/science.1078002. PMID 12481128.
- ^ Szabó I, Bergantino E, Giacometti G (2005). “Light and oxygenic photosynthesis: energy dissipation as a protection mechanism against photo-oxidation”. EMBO Rep 6 (7): 629–34. doi:10.1038/sj.embor.7400460. PMC 1369118. PMID 15995679.
- ^ Kerfeld CA (October 2004). “Water-soluble carotenoid proteins of cyanobacteria”. Arch. Biochem. Biophys. 430 (1): 2–9. doi:10.1016/j.abb.2004.03.018. PMID 15325905.
- ^ Ames B, Cathcart R, Schwiers E, Hochstein P (1981). “Uric acid provides an antioxidant defense in humans against oxidant- and radical-caused aging and cancer: a hypothesis”. Proc Natl Acad Sci USA 78 (11): 6858–62. doi:10.1073/pnas.78.11.6858. PMC 349151. PMID 6947260.
- ^ Khaw K, Woodhouse P (1995). “Interrelation of vitamin C, infection, haemostatic factors, and cardiovascular disease”. BMJ 310 (6994): 1559 – 63. doi:10.1136/bmj.310.6994.1559. PMC 2549940. PMID 7787643.
- ^ a b c d Evelson P, Travacio M, Repetto M, Escobar J, Llesuy S, Lissi E (2001). “Evaluation of total reactive antioxidant potential (TRAP) of tissue homogenates and their cytosols”. Arch Biochem Biophys 388 (2): 261 – 6. doi:10.1006/abbi.2001.2292. PMID 11368163.
- ^ Morrison JA, Jacobsen DW, Sprecher DL, Robinson K, Khoury P, Daniels SR (30 November 1999). “Serum glutathione in adolescent males predicts parental coronary heart disease”. Circulation 100 (22): 2244–7. PMID 10577998.
- ^ Teichert J, Preiss R (1992). “HPLC-methods for determination of lipoic acid and its reduced form in human plasma”. Int J Clin Pharmacol Ther Toxicol 30 (11): 511 – 2. PMID 1490813.
- ^ Akiba S, Matsugo S, Packer L, Konishi T (1998). “Assay of protein-bound lipoic acid in tissues by a new enzymatic method”. Anal Biochem 258 (2): 299 – 304. doi:10.1006/abio.1998.2615. PMID 9570844.
- ^ a b Glantzounis G, Tsimoyiannis E, Kappas A, Galaris D (2005). “Uric acid and oxidative stress”. Curr Pharm Des 11 (32): 4145 – 51. doi:10.2174/138161205774913255. PMID 16375736.
- ^ Normal Reference Range Table Archived 2011年12月25日, at the Wayback Machine. from The University of Texas Southwestern Medical Center at Dallas. Used in Interactive Case Study Companion to Pathologic basis of disease.
- ^ Golonka, Debby. “Digestive Disorders Health Center: Bilirubin”. en:WebMD. pp. 3. 2010年1月14日閲覧。
- ^ El-Sohemy A, Baylin A, Kabagambe E, Ascherio A, Spiegelman D, Campos H (2002). “Individual carotenoid concentrations in adipose tissue and plasma as biomarkers of dietary intake”. Am J Clin Nutr 76 (1): 172 – 9. PMID 12081831.
- ^ a b Sowell A, Huff D, Yeager P, Caudill S, Gunter E (1994). “Retinol, alpha-tocopherol, lutein/zeaxanthin, beta-cryptoxanthin, lycopene, alpha-carotene, trans-beta-carotene, and four retinyl esters in serum determined simultaneously by reversed-phase HPLC with multiwavelength detection”. Clin Chem 40 (3): 411 – 6. PMID 8131277.
- ^ Stahl W, Schwarz W, Sundquist A, Sies H (1992). “cis-trans isomers of lycopene and beta-carotene in human serum and tissues”. Arch Biochem Biophys 294 (1): 173 – 7. doi:10.1016/0003-9861(92)90153-N. PMID 1550343.
- ^ Zita C, Overvad K, Mortensen S, Sindberg C, Moesgaard S, Hunter D (2003). “Serum coenzyme Q10 concentrations in healthy men supplemented with 30 mg or 100 mg coenzyme Q10 for two months in a randomised controlled study”. Biofactors 18 (1 – 4): 185 – 93. doi:10.1002/biof.5520180221. PMID 14695934.
- ^ a b Turunen M, Olsson J, Dallner G (2004). “Metabolism and function of coenzyme Q”. Biochim Biophys Acta 1660 (1 – 2): 171 – 99. doi:10.1016/j.bbamem.2003.11.012. PMID 14757233.
- ^ Miller RA, Britigan BE (January 1997). “Role of oxidants in microbial pathophysiology”. Clin. Microbiol. Rev. 10 (1): 1–18. PMC 172912. PMID 8993856.
- ^ Chaudière J, Ferrari-Iliou R (1999). “Intracellular antioxidants: from chemical to biochemical mechanisms”. Food Chem Toxicol 37 (9–10): 949 – 62. doi:10.1016/S0278-6915(99)00090-3. PMID 10541450.
- ^ Sies H (1993). “Strategies of antioxidant defense”. Eur J Biochem 215 (2): 213 – 9. doi:10.1111/j.1432-1033.1993.tb18025.x. PMID 7688300.
- ^ Imlay J (2003). “Pathways of oxidative damage”. Annu Rev Microbiol 57: 395–418. doi:10.1146/annurev.micro.57.030502.090938. PMID 14527285.
- ^ a b Ho YS, Magnenat JL, Gargano M, Cao J (1 October 1998). “The nature of antioxidant defense mechanisms: a lesson from transgenic studies”. Environ. Health Perspect. 106 (Suppl 5): 1219–28. doi:10.2307/3433989. PMC 1533365. PMID 9788901.
- ^ Zelko I, Mariani T, Folz R (2002). “Superoxide dismutase multigene family: a comparison of the CuZn-SOD (SOD1), Mn-SOD (SOD2), and EC-SOD (SOD3) gene structures, evolution, and expression”. Free Radic Biol Med 33 (3): 337–49. doi:10.1016/S0891-5849(02)00905-X. PMID 12126755.
- ^ a b Bannister J, Bannister W, Rotilio G (1987). “Aspects of the structure, function, and applications of superoxide dismutase”. CRC Crit Rev Biochem 22 (2): 111–80. doi:10.3109/10409238709083738. PMID 3315461.
- ^ Johnson F, Giulivi C (2005). “Superoxide dismutases and their impact upon human health”. Mol Aspects Med 26 (4–5): 340–52. doi:10.1016/j.mam.2005.07.006. PMID 16099495.
- ^ “アーカイブされたコピー”. 2011年7月9日時点のオリジナルよりアーカイブ。2011年2月26日閲覧。
- ^ Nozik-Grayck E, Suliman H, Piantadosi C (2005). “Extracellular superoxide dismutase”. Int J Biochem Cell Biol 37 (12): 2466–71. doi:10.1016/j.biocel.2005.06.012. PMID 16087389.
- ^ Melov S, Schneider J, Day B, Hinerfeld D, Coskun P, Mirra S, Crapo J, Wallace D (1998). “A novel neurological phenotype in mice lacking mitochondrial manganese superoxide dismutase”. Nat Genet 18 (2): 159–63. doi:10.1038/ng0298-159. PMID 9462746.
- ^ Reaume A, Elliott J, Hoffman E, Kowall N, Ferrante R, Siwek D, Wilcox H, Flood D, Beal M, Brown R, Scott R, Snider W (1996). “Motor neurons in Cu/Zn superoxide dismutase-deficient mice develop normally but exhibit enhanced cell death after axonal injury”. Nat Genet 13 (1): 43–7. doi:10.1038/ng0596-43. PMID 8673102.
- ^ Van Camp W, Inzé D, Van Montagu M (1997). “The regulation and function of tobacco superoxide dismutases”. Free Radic Biol Med 23 (3): 515–20. doi:10.1016/S0891-5849(97)00112-3. PMID 9214590.
- ^ Chelikani P, Fita I, Loewen P (2004). “Diversity of structures and properties among catalases”. Cell Mol Life Sci 61 (2): 192–208. doi:10.1007/s00018-003-3206-5. PMID 14745498.
- ^ Zámocký M, Koller F (1999). “Understanding the structure and function of catalases: clues from molecular evolution and in vitro mutagenesis”. Prog Biophys Mol Biol 72 (1): 19–66. doi:10.1016/S0079-6107(98)00058-3. PMID 10446501.
- ^ del Río L, Sandalio L, Palma J, Bueno P, Corpas F (1992). “Metabolism of oxygen radicals in peroxisomes and cellular implications”. Free Radic Biol Med 13 (5): 557–80. doi:10.1016/0891-5849(92)90150-F. PMID 1334030.
- ^ Hiner A, Raven E, Thorneley R, García-Cánovas F, Rodríguez-López J (2002). “Mechanisms of compound I formation in heme peroxidases”. J Inorg Biochem 91 (1): 27–34. doi:10.1016/S0162-0134(02)00390-2. PMID 12121759.
- ^ Mueller S, Riedel H, Stremmel W (15 December 1997). “Direct evidence for catalase as the predominant H2O2 -removing enzyme in human erythrocytes”. Blood 90 (12): 4973–8. PMID 9389716.
- ^ Ogata M (1991). “Acatalasemia”. Hum Genet 86 (4): 331–40. doi:10.1007/BF00201829. PMID 1999334.
- ^ Parsonage D, Youngblood D, Sarma G, Wood Z, Karplus P, Poole L (2005). “Analysis of the link between enzymatic activity and oligomeric state in AhpC, a bacterial peroxiredoxin”. Biochemistry 44 (31): 10583–92. doi:10.1021/bi050448i. PMID 16060667. PDB 1YEX
- ^ Rhee S, Chae H, Kim K (2005). “Peroxiredoxins: a historical overview and speculative preview of novel mechanisms and emerging concepts in cell signaling”. Free Radic Biol Med 38 (12): 1543–52. doi:10.1016/j.freeradbiomed.2005.02.026. PMID 15917183.
- ^ Wood Z, Schröder E, Robin Harris J, Poole L (2003). “Structure, mechanism and regulation of peroxiredoxins”. Trends Biochem Sci 28 (1): 32–40. doi:10.1016/S0968-0004(02)00003-8. PMID 12517450.
- ^ Claiborne A, Yeh J, Mallett T, Luba J, Crane E, Charrier V, Parsonage D (1999). “Protein-sulfenic acids: diverse roles for an unlikely player in enzyme catalysis and redox regulation”. Biochemistry 38 (47): 15407–16. doi:10.1021/bi992025k. PMID 10569923.
- ^ Jönsson TJ, Lowther WT (2007). “The peroxiredoxin repair proteins”. Sub-cellular biochemistry 44: 115–41. doi:10.1007/978-1-4020-6051-9_6. PMC 2391273. PMID 18084892.
- ^ Neumann C, Krause D, Carman C, Das S, Dubey D, Abraham J, Bronson R, Fujiwara Y, Orkin S, Van Etten R (2003). “Essential role for the peroxiredoxin Prdx1 in erythrocyte antioxidant defence and tumour suppression”. Nature 424 (6948): 561–5. doi:10.1038/nature01819. PMID 12891360.
- ^ Lee T, Kim S, Yu S, Kim S, Park D, Moon H, Dho S, Kwon K, Kwon H, Han Y, Jeong S, Kang S, Shin H, Lee K, Rhee S, Yu D (2003). “Peroxiredoxin II is essential for sustaining life span of erythrocytes in mice”. Blood 101 (12): 5033–8. doi:10.1182/blood-2002-08-2548. PMID 12586629.
- ^ Dietz K, Jacob S, Oelze M, Laxa M, Tognetti V, de Miranda S, Baier M, Finkemeier I (2006). “The function of peroxiredoxins in plant organelle redox metabolism”. J Exp Bot 57 (8): 1697–709. doi:10.1093/jxb/erj160. PMID 16606633.
- ^ Nordberg J, Arner ES (2001). “Reactive oxygen species, antioxidants, and the mammalian thioredoxin system”. Free Radic Biol Med 31 (11): 1287–312. doi:10.1016/S0891-5849(01)00724-9. PMID 11728801.
- ^ Vieira Dos Santos C, Rey P (2006). “Plant thioredoxins are key actors in the oxidative stress response”. Trends Plant Sci 11 (7): 329–34. doi:10.1016/j.tplants.2006.05.005. PMID 16782394.
- ^ Arnér E, Holmgren A (2000). “Physiological functions of thioredoxin and thioredoxin reductase”. Eur J Biochem 267 (20): 6102–9. doi:10.1046/j.1432-1327.2000.01701.x. PMID 11012661.
- ^ Mustacich D, Powis G (2000). “Thioredoxin reductase”. Biochem J 346 (Pt 1): 1–8. doi:10.1042/0264-6021:3460001. PMC 1220815. PMID 10657232.
- ^ a b c d Meister A, Anderson M (1983). “Glutathione”. Annu Rev Biochem 52: 711 – 60. doi:10.1146/annurev.bi.52.070183.003431. PMID 6137189.
- ^ Creissen G, Broadbent P, Stevens R, Wellburn A, Mullineaux P (1996). “Manipulation of glutathione metabolism in transgenic plants”. Biochem Soc Trans 24 (2): 465–9. PMID 8736785.
- ^ Brigelius-Flohé R (1999). “Tissue-specific functions of individual glutathione peroxidases”. Free Radic Biol Med 27 (9–10): 951–65. doi:10.1016/S0891-5849(99)00173-2. PMID 10569628.
- ^ Ho Y, Magnenat J, Bronson R, Cao J, Gargano M, Sugawara M, Funk C (1997). “Mice deficient in cellular glutathione peroxidase develop normally and show no increased sensitivity to hyperoxia”. J Biol Chem 272 (26): 16644–51. doi:10.1074/jbc.272.26.16644. PMID 9195979.
- ^ de Haan J, Bladier C, Griffiths P, Kelner M, O'Shea R, Cheung N, Bronson R, Silvestro M, Wild S, Zheng S, Beart P, Hertzog P, Kola I (1998). “Mice with a homozygous null mutation for the most abundant glutathione peroxidase, Gpx1, show increased susceptibility to the oxidative stress-inducing agents paraquat and hydrogen peroxide”. J Biol Chem 273 (35): 22528–36. doi:10.1074/jbc.273.35.22528. PMID 9712879.
- ^ Sharma R, Yang Y, Sharma A, Awasthi S, Awasthi Y (2004). “Antioxidant role of glutathione S-transferases: protection against oxidant toxicity and regulation of stress-mediated apoptosis”. Antioxid Redox Signal 6 (2): 289–300. doi:10.1089/152308604322899350. PMID 15025930.
- ^ Hayes J, Flanagan J, Jowsey I (2005). “Glutathione transferases”. Annu Rev Pharmacol Toxicol 45: 51–88. doi:10.1146/annurev.pharmtox.45.120403.095857. PMID 15822171.
- ^ Becker BF (June 1993). “Towards the physiological function of uric acid”. Free Radic. Biol. Med. 14 (6): 615–31. doi:10.1016/0891-5849(93)90143-I. PMID 8325534.
- ^ 霊長類の進化による尿酸分解活性の消失 I ヒト上科祖先での尿酸オキシダーゼの消滅Friedman TB, Polanco GE, Appold JC, Mayle JE (1985). “On the loss of uricolytic activity during primate evolution--I. Silencing of urate oxidase in a hominoid ancestor”. Comp. Biochem. Physiol., B 81 (3): 653?9. PMID 3928241.
- ^ Purine and Pyrimidine Metabolism (Eccles Health Sciences Library)
- ^ a b Peter Proctor Similar Functions of Uric Acid and Ascorbate in ManSimilar Functions of Uric Acid and Ascorbate in Man Nature vol 228, 1970, p868.
- ^ 藤森 新「高尿酸血症と心血管リスク」『綜合臨床』第59巻第2号、永井書店、2010年、pp.251-256、ISSN 03711900、NAID 40016985298。
- ^ a b Dimitroula HV, Hatzitolios AI, Karvounis HI (July 2008). “The role of uric acid in stroke: the issue remains unresolved”. Neurologist 14 (4): 238–42. doi:10.1097/NRL.0b013e31815c666b. PMID 18617849.
- ^ a b Strazzullo P, Puig JG (July 2007). “Uric acid and oxidative stress: relative impact on cardiovascular risk?”. Nutr Metab Cardiovasc Dis 17 (6): 409–14. doi:10.1016/j.numecd.2007.02.011. PMID 17643880.
- ^ Baillie, J.K.; M.G. Bates, A.A. Thompson, W.S. Waring, R.W. Partridge, M.F. Schnopp, A. Simpson, F. Gulliver-Sloan, S.R. Maxwell,D.J. Webb (2007-05). “Endogenous urate production augments plasma antioxidant capacity in healthy lowland subjects exposed to high altitude”. Chest 131 (5): 1473–1478. doi:10.1378/chest.06-2235. PMID 17494796.
- ^ 渡邉興亞、国立極地研究所『南極大陸の氷を掘る! : ドームふじ深層掘削計画の立案から実施までの全記録』国立極地研究所〈極地選書, 2〉、2002年、104頁。ISBN 4-906651-04-6。
- ^ 三上俊夫「152.尿酸は運動ストレス時の抗酸化物質として作用する」『体力科學』第49巻第6号、日本体力医学会、2000年12月1日、NAID 110001949422。
- ^ 根岸、友恵、鈴木利典、濱武有子、藤原 大「酸化傷害に対する内在性防御物質としての尿酸の役割」研究期間2007年度〜2008年度(科学研究費助成事業データベース)
- ^ Smirnoff N (2001). “L-ascorbic acid biosynthesis”. Vitam Horm 61: 241 – 66. doi:10.1016/S0083-6729(01)61008-2. PMID 11153268.
- ^ Linster CL, Van Schaftingen E (2007). “Vitamin C. Biosynthesis, recycling and degradation in mammals”. FEBS J. 274 (1): 1–22. doi:10.1111/j.1742-4658.2006.05607.x. PMID 17222174.
- ^ a b Meister A (1994). “Glutathione-ascorbic acid antioxidant system in animals”. J Biol Chem 269 (13): 9397 – 400. PMID 8144521.
- ^ Wells W, Xu D, Yang Y, Rocque P (15 September 1990). “Mammalian thioltransferase (glutaredoxin) and protein disulfide isomerase have dehydroascorbate reductase activity”. J Biol Chem 265 (26): 15361 – 4. PMID 2394726.
- ^ Padayatty S, Katz A, Wang Y, Eck P, Kwon O, Lee J, Chen S, Corpe C, Dutta A, Dutta S, Levine M (1 February 2003). “Vitamin C as an antioxidant: evaluation of its role in disease prevention”. J Am Coll Nutr 22 (1): 18 – 35. PMID 12569111. オリジナルの2010年7月21日時点におけるアーカイブ。.
- ^ 神林 康弘、人見 嘉哲、日比野 由利他「抗酸化物質(1)ビタミンC(アルコルビン酸)」『日本予防医学会雑誌』第3巻第2号、日本予防医学会、2008年、pp.3-12、ISSN 18814271、NAID 40016281331。
- ^ Shigeoka S, Ishikawa T, Tamoi M, Miyagawa Y, Takeda T, Yabuta Y, Yoshimura K (2002). “Regulation and function of ascorbate peroxidase isoenzymes”. J Exp Bot 53 (372): 1305 – 19. doi:10.1093/jexbot/53.372.1305. PMID 11997377.
- ^ Smirnoff N, Wheeler GL (2000). “Ascorbic acid in plants: biosynthesis and function”. Crit. Rev. Biochem. Mol. Biol. 35 (4): 291–314. doi:10.1080/10409230008984166. PMID 11005203.
- ^ Meister A (1988). “Glutathione metabolism and its selective modification” (PDF). J Biol Chem 263 (33): 17205 – 8. doi:10.1073/pnas.0508621102. PMID 3053703.
- ^ Fahey RC (2001). “Novel thiols of prokaryotes”. Annu. Rev. Microbiol. 55: 333–56. doi:10.1146/annurev.micro.55.1.333. PMID 11544359.
- ^ Fairlamb AH, Cerami A (1992). “Metabolism and functions of trypanothione in the Kinetoplastida”. Annu. Rev. Microbiol. 46: 695–729. doi:10.1146/annurev.mi.46.100192.003403. PMID 1444271.
- ^ Reiter RJ, Carneiro RC, Oh CS (1997). “Melatonin in relation to cellular antioxidative defense mechanisms”. Horm. Metab. Res. 29 (8): 363–72. doi:10.1055/s-2007-979057. PMID 9288572.
- ^ Tan DX, Manchester LC, Reiter RJ, Qi WB, Karbownik M, Calvo JR (2000). “Significance of melatonin in antioxidative defense system: reactions and products”. Biological signals and receptors 9 (3–4): 137–59. doi:10.1159/000014635. PMID 10899700.
- ^ 中村宜司「有機ゲルマニウム化合物Ge-132の生理作用に関する研究」岩手大学 博士論文 (農学)、甲第349号、2006年3月23日、NAID 500000348565、国立国会図書館書誌ID:000008361946。
- ^ 中村宜司、佐藤克行、秋葉光雄「胆汁色素代謝物ウロビリノーゲンの抗酸化作用」中村宜司 『日本農芸化学会誌』2001年3月5日、75巻、144ページ。抗酸化物質 - J-GLOBAL
- ^ NAKAMURA Takashi; SATO Katsuyuki; AKIBA Mitsuo; OHNISHI Masao (2006). “Urobilinogen, as a Bile Pigment Metabolite, Has an Antioxidant Function”. Journal of Oleo Science (日本油化学会) 55 (4): 191-197. doi:10.5650/jos.55.191. NAID 130000055572.
- ^ Baranano DE, Rao M, Ferris CD, Snyder SH (2002). “Biliverdin reductase: a major physiologic cytoprotectant”. Proc. Natl. Acad. Sci. U.S.A. 99 (25): 16093–8. doi:10.1073/pnas.252626999. PMC 138570. PMID 12456881.
- ^ Liu Y, Li P, Lu J, Xiong W, Oger J, Tetzlaff W, Cynader M. (2008). “Bilirubin possesses powerful immunomodulatory activity and suppresses experimental autoimmune encephalomyelitis”. J. Immunol. 181 (3): 1887–97. PMID 18641326.
- ^ a b Herrera E, Barbas C (2001). “Vitamin E: action, metabolism and perspectives”. J Physiol Biochem 57 (2): 43 – 56. doi:10.1007/BF03179812. PMID 11579997.
- ^ Packer L, Weber SU, Rimbach G (1 February 2001). “Molecular aspects of alpha-tocotrienol antioxidant action and cell signalling”. J. Nutr. 131 (2): 369S–73S. PMID 11160563.
- ^ a b Brigelius-Flohé R, Traber M (1 July 1999). “Vitamin E: function and metabolism”. FASEB J 13 (10): 1145 – 55. PMID 10385606.
- ^ Traber MG, Atkinson J (2007). “Vitamin E, antioxidant and nothing more”. Free Radic. Biol. Med. 43 (1): 4–15. doi:10.1016/j.freeradbiomed.2007.03.024. PMC 2040110. PMID 17561088.
- ^ 神林 康弘、人見 嘉哲、日比野 由利 他「抗酸化物質(2)ビタミンE」『日本予防医学会雑誌』第5巻第1号、日本予防医学会、2010年、pp.3-9、ISSN 18814271、NAID 40017134909。
- ^ 山内 亮「抗酸化ビタミンの脂質過酸化抑制機構」『食品・食品添加物研究誌』第215巻第1号、FFIジャーナル編集委員会、2010年、pp.17-23、ISSN 09199772、NAID 40017000566。
- ^ Wang X, Quinn P (1999). “Vitamin E and its function in membranes”. Prog Lipid Res 38 (4): 309 – 36. doi:10.1016/S0163-7827(99)00008-9. PMID 10793887.
- ^ Seiler A, Schneider M, Förster H, Roth S, Wirth EK, Culmsee C, Plesnila N, Kremmer E, Rådmark O, Wurst W, Bornkamm GW, Schweizer U, Conrad M (September 2008). “Glutathione peroxidase 4 senses and translates oxidative stress into 12/15-lipoxygenase dependent- and AIF-mediated cell death”. Cell Metab. 8 (3): 237–48. doi:10.1016/j.cmet.2008.07.005. PMID 18762024.
- ^ Brigelius-Flohé R, Davies KJ (2007). “Is vitamin E an antioxidant, a regulator of signal transduction and gene expression, or a 'junk' food? Comments on the two accompanying papers: "Molecular mechanism of alpha-tocopherol action" by A. Azzi and "Vitamin E, antioxidant and nothing more" by M. Traber and J. Atkinson”. Free Radic. Biol. Med. 43 (1): 2–3. doi:10.1016/j.freeradbiomed.2007.05.016. PMID 17561087.
- ^ Atkinson J, Epand RF, Epand RM (2007). “Tocopherols and tocotrienols in membranes: A critical review”. Free Radic. Biol. Med. 44 (5): 739–764. doi:10.1016/j.freeradbiomed.2007.11.010. PMID 18160049.
- ^ a b Azzi A (2007). “Molecular mechanism of alpha-tocopherol action”. Free Radic. Biol. Med. 43 (1): 16–21. doi:10.1016/j.freeradbiomed.2007.03.013. PMID 17561089.
- ^ Zingg JM, Azzi A (2004). “Non-antioxidant activities of vitamin E”. Curr. Med. Chem. 11 (9): 1113–33. PMID 15134510.
- ^ Sen C, Khanna S, Roy S (2006). “Tocotrienols: Vitamin E beyond tocopherols”. Life Sci 78 (18): 2088–98. doi:10.1016/j.lfs.2005.12.001. PMC 1790869. PMID 16458936.
- ^ 矢澤 一良「ヘルスフード科学シリーズ(16)食品中の抗酸化物質(2)トコトリエノール」『食品と容器』第45巻第7号、缶詰技術研究会 / 缶詰技術研究会、2004年、pp.364-369、ISSN 09112278、NAID 40006319804。
- ^ カロチノイド [花色に関する実験 早川史乃 2001 千葉大学園芸学部・花卉園芸学研究室]
- ^ 武田弘志最近の話題116f ポリフェノール 『日本薬理学雑誌』116(3),2000年, p198 の日本薬理学による転載
- ^ 冨田裕一郎「アミノ・カルボニル反応生成物の抗酸化性に関する研究 : (第5報)トリプトファン・グルコース系反応生成物の抗酸化剤としての利用試験」『鹿児島大学農学部学術報告』第22巻、鹿児島大学、1972年3月、115-121頁、ISSN 04530845、NAID 110004993957。
- ^ a b 下橋淳子「褐変物質のDPPHラジカル消去能」『駒沢女子短期大学研究紀要』第37巻、駒沢女子短期大学、2004年、17-22頁、doi:10.18998/00000638、ISSN 02884844、NAID 110004678454。
- ^ 明治大学農学部農芸化学科食品機能科学研究室 研究の概要 Archived 2012年11月24日, at the Wayback Machine.
- ^ 竹内徳男, 稲荷妙子, 森本仁美「味噌のDPPHラジカル捕捉能に関する研究」『岐阜女子大学紀要』第33号、岐阜女子大学、2004年、115-122頁、ISSN 02868644、NAID 110000146309、NDLJP:8558735。
- ^ a b 渡邊敦光、「お味噌の効能」『日本醸造協会誌』2010年 105巻 11号 p.714-723, doi:10.6013/jbrewsocjapan.105.714, 日本醸造協会
- ^ 市川朝子, 藤井聡, 河本正彦、「各種カラメル色素のリノール酸に対する抗酸化作用」『日本食品工業学会誌』 1975年 22巻 4号 p.159-163, doi:10.3136/nskkk1962.22.159, 日本食品科学工学会
- ^ Christen Y (1 February 2000). “Oxidative stress and Alzheimer disease”. Am J Clin Nutr 71 (2): 621S–629S. doi:10.1093/ajcn/71.2.621s. PMID 10681270.
- ^ Nunomura A, Castellani R, Zhu X, Moreira P, Perry G, Smith M (2006). “Involvement of oxidative stress in Alzheimer disease”. J Neuropathol Exp Neurol 65 (7): 631–41. doi:10.1097/01.jnen.0000228136.58062.bf. PMID 16825950.
- ^ Wood-Kaczmar A, Gandhi S, Wood N (2006). “Understanding the molecular causes of Parkinson's disease”. Trends Mol Med 12 (11): 521–8. doi:10.1016/j.molmed.2006.09.007. PMID 17027339.
- ^ Davì G, Falco A, Patrono C (2005). “Lipid peroxidation in diabetes mellitus”. Antioxid Redox Signal 7 (1–2): 256–68. doi:10.1089/ars.2005.7.256. PMID 15650413.
- ^ Giugliano D, Ceriello A, Paolisso G (1996). “Oxidative stress and diabetic vascular complications”. Diabetes Care 19 (3): 257–67. doi:10.2337/diacare.19.3.257. PMID 8742574.
- ^ Hitchon C, El-Gabalawy H (2004). “Oxidation in rheumatoid arthritis”. Arthritis Res Ther 6 (6): 265–78. doi:10.1186/ar1447. PMC 1064874. PMID 15535839.
- ^ Cookson M, Shaw P (1999). “Oxidative stress and motor neurone disease”. Brain Pathol 9 (1): 165–86. doi:10.1111/j.1750-3639.1999.tb00217.x. PMID 9989458.
- ^ 田中 芳明「臨床現場からの提言--酸化ストレスと抗酸化療法(第1回)酸化ストレスと抗酸化物質」『Food style 21』第13巻第1号、食品化学新聞社、2009年、pp.32-35、ISSN 13439502、NAID 40016423198。
- ^ 田中芳明「抗酸化物質」『外科と代謝・栄養』第43巻第6号、日本外科代謝栄養学会、2010年、pp.201-207、ISSN 03895564。
- ^ 駒形美穂, 伊藤雅子, 藤田薫他「生体内における酸化ストレスおよび抗酸化物質 (特集:酸化ストレス・抗酸化能評価)」『ジャパンフードサイエンス』第44巻第1号、日本食品出版 / 日本食品出版株式会社、2005年、pp.74-82、ISSN 03681122、NAID 40006571413。
- ^ Van Gaal L, Mertens I, De Block C (2006). “Mechanisms linking obesity with cardiovascular disease”. Nature 444 (7121): 875–80. doi:10.1038/nature05487. PMID 17167476.
- ^ Aviram M (2000). “Review of human studies on oxidative damage and antioxidant protection related to cardiovascular diseases”. Free Radic Res 33 Suppl: S85–97. PMID 11191279.
- ^ 吉川 敏一、古倉 聡「フリーラジカルと癌予防 (癌の化学予防最前線)」『医学のあゆみ』第204巻第1号、医歯薬出版、2003年、pp.20-23、ISSN 00392359、NAID 40005609183。
- ^ Rimm EB, Stampfer MJ, Ascherio A, Giovannucci E, Colditz GA, Willett WC (1993). “Vitamin E consumption and the risk of coronary heart disease in men”. N Engl J Med 328 (20): 1450–6. doi:10.1056/NEJM199305203282004. PMID 8479464.
- ^ 大森 平野 玲子「食事因子と動脈硬化性疾患に関する研究」『日本栄養・食糧学会誌』第60巻第1号、日本栄養・食糧学会、2007年2月、3-9頁、doi:10.4327/jsnfs.60.3、ISSN 02873516、NAID 10026885268。
- ^ 葛谷恒彦, 松口貴子, 籾谷真奈, 北尾悟, 杉谷義憲「食品抗酸化物による血管内皮細胞障害防止効果の解析(1)血管内皮酸化障害モデルの作成」『大阪樟蔭女子大学学芸学部論集』第42巻、大阪樟蔭女子大学、2005年3月、97-105頁、NAID 110001138398。
- ^ Vivekananthan DP, Penn MS, Sapp SK, Hsu A, Topol EJ (2003). “Use of antioxidant vitamins for the prevention of cardiovascular disease: meta-analysis of randomised trials”. Lancet 361 (9374): 2017–23. doi:10.1016/S0140-6736(03)13637-9. PMID 12814711.
- ^ Sesso HD, Buring JE, Christen WG (November 2008). “Vitamins E and C in the prevention of cardiovascular disease in men: the Physicians' Health Study II randomized controlled trial”. JAMA 300 (18): 2123–33. doi:10.1001/jama.2008.600. PMC 2586922. PMID 18997197.
- ^ Lee IM, Cook NR, Gaziano JM (July 2005). “Vitamin E in the primary prevention of cardiovascular disease and cancer: the Women's Health Study: a randomized controlled trial”. JAMA 294 (1): 56–65. doi:10.1001/jama.294.1.56. PMID 15998891.
- ^ Roberts LJ, Oates JA, Linton MF (2007). “The relationship between dose of vitamin E and suppression of oxidative stress in humans”. Free Radic. Biol. Med. 43 (10): 1388–93. doi:10.1016/j.freeradbiomed.2007.06.019. PMC 2072864. PMID 17936185.
- ^ Bleys J, Miller E, Pastor-Barriuso R, Appel L, Guallar E (2006). “Vitamin-mineral supplementation and the progression of atherosclerosis: a meta-analysis of randomized controlled trials”. Am. J. Clin. Nutr. 84 (4): 880–7; quiz 954–5. doi:10.1093/ajcn/84.4.880. PMID 17023716.
- ^ Cook NR, Albert CM, Gaziano JM (2007). “A randomized factorial trial of vitamins C and E and beta carotene in the secondary prevention of cardiovascular events in women: results from the Women's Antioxidant Cardiovascular Study”. Arch. Intern. Med. 167 (15): 1610–8. doi:10.1001/archinte.167.15.1610. PMC 2034519. PMID 17698683.
- ^ Reiter R (1995). “Oxidative processes and antioxidative defense mechanisms in the aging brain”. FASEB J 9 (7): 526–33. doi:10.1096/fasebj.9.7.7737461. PMID 7737461.
- ^ Warner D, Sheng H, Batinić-Haberle I (2004). “Oxidants, antioxidants and the ischemic brain”. J Exp Biol 207 (Pt 18): 3221–31. doi:10.1242/jeb.01022. PMID 15299043.
- ^ Wilson J, Gelb A (2002). “Free radicals, antioxidants, and neurologic injury: possible relationship to cerebral protection by anesthetics”. J Neurosurg Anesthesiol 14 (1): 66–79. doi:10.1097/00008506-200201000-00014. PMID 11773828.
- ^ Lees K, Davalos A, Davis S, Diener H, Grotta J, Lyden P, Shuaib A, Ashwood T, Hardemark H, Wasiewski W, Emeribe U, Zivin J (2006). “Additional outcomes and subgroup analyses of NXY-059 for acute ischemic stroke in the SAINT I trial”. Stroke 37 (12): 2970–8. doi:10.1161/01.STR.0000249410.91473.44. PMID 17068304.
- ^ Lees K, Zivin J, Ashwood T, Davalos A, Davis S, Diener H, Grotta J, Lyden P, Shuaib A, Hårdemark H, Wasiewski W (2006). “NXY-059 for acute ischemic stroke”. N Engl J Med 354 (6): 588–600. doi:10.1056/NEJMoa052980. PMID 16467546.
- ^ Yamaguchi T, Sano K, Takakura K, Saito I, Shinohara Y, Asano T, Yasuhara H (1 January 1998). “Ebselen in acute ischemic stroke: a placebo-controlled, double-blind clinical trial. Ebselen Study Group”. Stroke 29 (1): 12–7. doi:10.1161/01.STR.29.1.12. PMID 9445321.
- ^ Di Matteo V, Esposito E (2003). “Biochemical and therapeutic effects of antioxidants in the treatment of Alzheimer's disease, Parkinson's disease, and amyotrophic lateral sclerosis”. Curr Drug Targets CNS Neurol Disord 2 (2): 95–107. doi:10.2174/1568007033482959. PMID 12769802.
- ^ Rao A, Balachandran B (2002). “Role of oxidative stress and antioxidants in neurodegenerative diseases”. Nutr Neurosci 5 (5): 291–309. doi:10.1080/1028415021000033767. PMID 12385592.
- ^ Kopke RD, Jackson RL, Coleman JK, Liu J, Bielefeld EC, Balough BJ (2007). “NAC for noise: from the bench top to the clinic”. Hear. Res. 226 (1-2): 114–25. doi:10.1016/j.heares.2006.10.008. PMID 17184943.
- ^ 松下雪郎「生体の老化を抑制する食品」『化学と生物』第25巻第5号、日本農芸化学会、1987年、336-340頁、doi:10.1271/kagakutoseibutsu1962.25.336、ISSN 0453-073X、NAID 130003633212。
- ^ Thomas D (2004). “Vitamins in health and aging”. Clin Geriatr Med 20 (2): 259–74. doi:10.1016/j.cger.2004.02.001. PMID 15182881.
- ^ Ward J (1998). “Should antioxidant vitamins be routinely recommended for older people?”. Drugs Aging 12 (3): 169–75. doi:10.2165/00002512-199812030-00001. PMID 9534018.
- ^ 後藤 佐多良「抗酸化サプリメントの功罪とカロリー制限および運動の抗老化作用」『日本老年医学会雑誌』第45巻第2号、日本老年医学会、2008年、pp.155-158、doi:10.3143/geriatrics.45.155、ISSN 03009173、NAID 10021238780。
- ^ Aggarwal BB, Shishodia S (2006). “Molecular targets of dietary agents for prevention and therapy of cancer”. Biochem. Pharmacol. 71 (10): 1397–421. doi:10.1016/j.bcp.2006.02.009. PMID 16563357.
- ^ Schulz TJ, Zarse K, Voigt A, Urban N, Birringer M, Ristow M (2007). “Glucose Restriction Extends Caenorhabditis elegans Life Span by Inducing Mitochondrial Respiration and Increasing Oxidative Stress”. Cell Metab. 6 (4): 280–93. doi:10.1016/j.cmet.2007.08.011. PMID 17908557.
- ^ Barros MH, Bandy B, Tahara EB, Kowaltowski AJ (2004). “Higher respiratory activity decreases mitochondrial reactive oxygen release and increases life span in Saccharomyces cerevisiae”. J. Biol. Chem. 279 (48): 49883–8. doi:10.1074/jbc.M408918200. PMID 15383542.
- ^ a b Sohal R, Mockett R, Orr W (2002). “Mechanisms of aging: an appraisal of the oxidative stress hypothesis”. Free Radic Biol Med 33 (5): 575–86. doi:10.1016/S0891-5849(02)00886-9. PMID 12208343.
- ^ a b Sohal R (2002). “Role of oxidative stress and protein oxidation in the aging process”. Free Radic Biol Med 33 (1): 37–44. doi:10.1016/S0891-5849(02)00856-0. PMID 12086680.
- ^ a b Rattan S (2006). “Theories of biological aging: genes, proteins, and free radicals”. Free Radic Res 40 (12): 1230–8. doi:10.1080/10715760600911303. PMID 17090411.
- ^ Green GA (December 2008). “Review: antioxidant supplements do not reduce all-cause mortality in primary or secondary prevention”. Evid Based Med 13 (6): 177. doi:10.1136/ebm.13.6.177. PMID 19043035.
- ^ 福地かつ美, 柳澤厚生「基礎講座 酸化ストレス(8)アンチエイジングと抗酸化食品」『アンチ・エイジング医学』第4巻第1号、メディカルレビュー社、2008年2月、75-78頁、ISSN 18801579、NAID 40015870825。 (
 要購読契約)
要購読契約)
- ^ Duarte TL, Lunec J (2005). “Review: When is an antioxidant not an antioxidant? A review of novel actions and reactions of vitamin C”. Free Radic. Res. 39 (7): 671–86. doi:10.1080/10715760500104025. PMID 16036346.
- ^ a b Carr A, Frei B (1 June 1999). “Does vitamin C act as a pro-oxidant under physiological conditions?”. FASEB J. 13 (9): 1007–24. PMID 10336883.
- ^ Stohs SJ, Bagchi D (1995). “Oxidative mechanisms in the toxicity of metal ions”. Free Radic. Biol. Med. 18 (2): 321–36. doi:10.1016/0891-5849(94)00159-H. PMID 7744317.
- ^ Schneider C (2004). “Chemistry and biology of vitamin E”. Molecular Nutrition & Food Research 49 (1): 7–30. doi:10.1002/mnfr.200400049. PMID 15580660.
- ^ Eiji Yamashita (2013). “Astaxanthin as a Medical Food”. Functional Foods in Health and Disease 3 (7): 255.
- ^ Hurrell R (1 September 2003). “Influence of vegetable protein sources on trace element and mineral bioavailability”. J Nutr 133 (9): 2973S–7S. PMID 12949395.
- ^ Hunt J (1 September 2003). “Bioavailability of iron, zinc, and other trace minerals from vegetarian diets”. Am J Clin Nutr 78 (3 Suppl): 633S–639S. PMID 12936958.
- ^ Gibson R, Perlas L, Hotz C (2006). “Improving the bioavailability of nutrients in plant foods at the household level”. Proc Nutr Soc 65 (2): 160–8. doi:10.1079/PNS2006489. PMID 16672077.
- ^ a b Mosha T, Gaga H, Pace R, Laswai H, Mtebe K (1995). “Effect of blanching on the content of antinutritional factors in selected vegetables”. Plant Foods Hum Nutr 47 (4): 361–7. doi:10.1007/BF01088275. PMID 8577655.
- ^ Sandberg A (2002). “Bioavailability of minerals in legumes”. Br J Nutr 88 (Suppl 3): S281–5. doi:10.1079/BJN/2002718. PMID 12498628.
- ^ a b Beecher G (1 October 2003). “Overview of dietary flavonoids: nomenclature, occurrence and intake”. J Nutr 133 (10): 3248S–3254S. PMID 14519822.
- ^ Prashar A, Locke I, Evans C (2006). “Cytotoxicity of clove (Syzygium aromaticum) oil and its major components to human skin cells”. Cell Prolif 39 (4): 241–8. doi:10.1111/j.1365-2184.2006.00384.x. PMID 16872360.
- ^ Hornig D, Vuilleumier J, Hartmann D (1980). “Absorption of large, single, oral intakes of ascorbic acid”. Int J Vitam Nutr Res 50 (3): 309–14. PMID 7429760.
- ^ Omenn G, Goodman G, Thornquist M, Balmes J, Cullen M, Glass A, Keogh J, Meyskens F, Valanis B, Williams J, Barnhart S, Cherniack M, Brodkin C, Hammar S (1996). “Risk factors for lung cancer and for intervention effects in CARET, the Beta-Carotene and Retinol Efficacy Trial”. J Natl Cancer Inst 88 (21): 1550–9. doi:10.1093/jnci/88.21.1550. PMID 8901853.
- ^ Albanes D (1 June 1999). “Beta-carotene and lung cancer: a case study”. Am J Clin Nutr 69 (6): 1345S–50S. doi:10.1093/ajcn/69.6.1345S. PMID 10359235.
- ^ a b Bjelakovic G, Nikolova D, Gluud L, Simonetti R, Gluud C (2007). “Mortality in Randomized Trials of Antioxidant Supplements for Primary and Secondary Prevention: Systematic Review and Meta-analysis”. JAMA 297 (8): 842–57. doi:10.1001/jama.297.8.842. PMID 17327526.
- ^ Study Citing Antioxidant Vitamin Risks Based On Flawed Methodology, Experts Argue News release from オレゴン州立大学 published on ScienceDaily, Accessed 19 April 2007
- ^ Bjelakovic, G; Nikolova, D; Gluud, LL; Simonetti, RG; Gluud, C (2008). “Antioxidant supplements for prevention of mortality in healthy participants and patients with various diseases”. Cochrane Database of Systematic Reviews (2): CD007176. doi:10.1002/14651858.CD007176. PMID 18425980.
- ^ Miller E, Pastor-Barriuso R, Dalal D, Riemersma R, Appel L, Guallar E (2005). “Meta-analysis: high-dosage vitamin E supplementation may increase all-cause mortality”. Ann Intern Med 142 (1): 37–46. PMID 15537682.
- ^ Bjelakovic G, Nagorni A, Nikolova D, Simonetti R, Bjelakovic M, Gluud C (2006). “Meta-analysis: antioxidant supplements for primary and secondary prevention of colorectal adenoma”. Aliment Pharmacol Ther 24 (2): 281–91. doi:10.1111/j.1365-2036.2006.02970.x. PMID 16842454.
- ^ a b Hercberg S, Galan P, Preziosi P, Bertrais S, Mennen L, Malvy D, Roussel AM, Favier A, Briancon S (2004). “The SU.VI.MAX Study: a randomized, placebo-controlled trial of the health effects of antioxidant vitamins and minerals”. Arch Intern Med 164 (21): 2335–42. doi:10.1001/archinte.164.21.2335. PMID 15557412.
- ^ Caraballoso M, Sacristan M, Serra C, Bonfill X (2003). “Drugs for preventing lung cancer in healthy people”. Cochrane Database Syst Rev (2): CD002141. doi:10.1002/14651858.CD002141. PMID 12804424.
- ^ Coulter I, Hardy M, Morton S, Hilton L, Tu W, Valentine D, Shekelle P (2006). “Antioxidants vitamin C and vitamin e for the prevention and treatment of cancer”. Journal of general internal medicine: official journal of the Society for Research and Education in Primary Care Internal Medicine 21 (7): 735–44. doi:10.1111/j.1525-1497.2006.00483.x. PMC 1924689. PMID 16808775.
- ^ a b c d Stanner SA, Hughes J, Kelly CN, Buttriss J (2004). “A review of the epidemiological evidence for the 'antioxidant hypothesis'”. Public Health Nutr 7 (3): 407–22. doi:10.1079/PHN2003543. PMID 15153272.
- ^ a b c Shenkin A (2006). “The key role of micronutrients”. Clin Nutr 25 (1): 1–13. doi:10.1016/j.clnu.2005.11.006. PMID 16376462.
- ^ Radimer K, Bindewald B, Hughes J, Ervin B, Swanson C, Picciano M (2004). “Dietary supplement use by US adults: data from the National Health and Nutrition Examination Survey, 1999–2000”. Am J Epidemiol 160 (4): 339–49. doi:10.1093/aje/kwh207. PMID 15286019.
- ^ Latruffe N, Delmas D, Jannin B, Cherkaoui Malki M, Passilly-Degrace P, Berlot JP (December 2002). “Molecular analysis on the chemopreventive properties of resveratrol, a plant polyphenol microcomponent”. Int. J. Mol. Med. 10 (6): 755–60. PMID 12430003.
- ^ Woodside J, McCall D, McGartland C, Young I (2005). “Micronutrients: dietary intake v. supplement use”. Proc Nutr Soc 64 (4): 543–53. doi:10.1079/PNS2005464. PMID 16313697.
- ^ a b c Hail N, Cortes M, Drake EN, Spallholz JE (July 2008). “Cancer chemoprevention: a radical perspective”. Free Radic. Biol. Med. 45 (2): 97–110. doi:10.1016/j.freeradbiomed.2008.04.004. PMID 18454943.
- ^ Williams RJ, Spencer JP, Rice-Evans C (April 2004). “Flavonoids: antioxidants or signalling molecules?”. Free Radical Biology & Medicine 36 (7): 838–49. doi:10.1016/j.freeradbiomed.2004.01.001. PMID 15019969.
- ^ Virgili F, Marino M (November 2008). “Regulation of cellular signals from nutritional molecules: a specific role for phytochemicals, beyond antioxidant activity”. Free Radical Biology & Medicine 45 (9): 1205–16. doi:10.1016/j.freeradbiomed.2008.08.001. PMID 18762244.
- ^ Valko M, Morris H, Cronin MT (2005). “Metals, toxicity and oxidative stress”. Curr. Med. Chem. 12 (10): 1161–208. doi:10.2174/0929867053764635. PMID 15892631.
- ^ Schneider C (2005). “Chemistry and biology of vitamin E”. Mol Nutr Food Res 49 (1): 7–30. doi:10.1002/mnfr.200400049. PMID 15580660.
- ^ Halliwell, B (2008). “Are polyphenols antioxidants or pro-oxidants? What do we learn from cell culture and in vivo studies?”. Archives of Biochemistry and Biophysics 476 (2): 107–112. doi:10.1016/j.abb.2008.01.028. PMID 18284912.
- ^ World Cancer Research Fund and American Institute for Cancer Research (2007). Food, Nutrition, Physical Activity, and the Prevention of Cancer: A Global Perspective. Amer. Inst. for Cancer Research. ISBN 978-0972252225 日本語要旨:食べもの、栄養、運動とがん予防、世界がん研究基金と米国がん研究機構
- ^ Cherubini A, Vigna G, Zuliani G, Ruggiero C, Senin U, Fellin R (2005). “Role of antioxidants in atherosclerosis: epidemiological and clinical update”. Curr Pharm Des 11 (16): 2017–32. doi:10.2174/1381612054065783. PMID 15974956.
- ^ Lotito SB, Frei B (2006). “Consumption of flavonoid-rich foods and increased plasma antioxidant capacity in humans: cause, consequence, or epiphenomenon?”. Free Radic. Biol. Med. 41 (12): 1727–46. doi:10.1016/j.freeradbiomed.2006.04.033. PMID 17157175.
- ^ Lemonick, M.D. (July 19, 1999). “Diet and cancer: can food fend off tumors?”. Times Inc.. 2009年10月20日閲覧。
- ^ “第5回 健康食品フォーラム報告書「健康食品の臨床利用と安全性」”. 財団法人医療経済研究・社会保険福祉協会. pp. 42. 2012年3月13日時点のオリジナルよりアーカイブ。2010年12月8日閲覧。
- ^ G. López-Lluch, N. Hunt, B. Jones, M. Zhu, H. Jamieson, S. Hilmer, M. V. Cascajo, J. Allard, D. K. Ingram, P. Navas, and R. de Cabo (2006). “Calorie restriction induces mitochondrial biogenesis and bioenergetic efficiency”. Proc Natl Acad Sci USA 103 (6): 1768–1773. doi:10.1073/pnas.0510452103. PMC 1413655. PMID 16446459.
- ^ Larsen P (1993). “Aging and resistance to oxidative damage in Caenorhabditis elegans”. Proc Natl Acad Sci USA 90 (19): 8905–9. doi:10.1073/pnas.90.19.8905. PMC 47469. PMID 8415630.
- ^ Helfand S, Rogina B (2003). “Genetics of aging in the fruit fly, Drosophila melanogaster”. Annu Rev Genet 37: 329–48. doi:10.1146/annurev.genet.37.040103.095211. PMID 14616064.
- ^ Pérez, Viviana I.; Bokov, A; Van Remmen, H; Mele, J; Ran, Q; Ikeno, Y; Richardson, A (2009). “Is the oxidative stress theory of aging dead?”. Biochimica et Biophysica Acta (BBA) - General Subjects 1790 (10): 1005–1014. doi:10.1016/j.bbagen.2009.06.003. PMC 2789432. PMID 19524016 2009年9月14日閲覧。.
- ^ Dekkers J, van Doornen L, Kemper H (1996). “The role of antioxidant vitamins and enzymes in the prevention of exercise-induced muscle damage”. Sports Med 21 (3): 213–38. doi:10.2165/00007256-199621030-00005. PMID 8776010.
- ^ Tiidus P (1998). “Radical species in inflammation and overtraining”. Can J Physiol Pharmacol 76 (5): 533–8. doi:10.1139/y98-047. PMID 9839079.
- ^ Ristow M, Zarse K, Oberbach A (May 2009). “Antioxidants prevent health-promoting effects of physical exercise in humans”. Proc. Natl. Acad. Sci. U.S.A. 106 (21): 8665–70. doi:10.1073/pnas.0903485106. PMC 2680430. PMID 19433800.
- ^ Leeuwenburgh C, Fiebig R, Chandwaney R, Ji L (1994). “Aging and exercise training in skeletal muscle: responses of glutathione and antioxidant enzyme systems”. Am J Physiol 267 (2 Pt 2): R439–45. doi:10.1152/ajpregu.1994.267.2.R439. PMID 8067452.
- ^ 角田聡, 水沼俊美, 坂井堅太郎「運動・スポーツにおける抗酸化物質の役割」『臨床スポーツ医学』第13巻、1996年11月、90-97頁、ISSN 02893339、NAID 10011118284。(
 要購読契約)
要購読契約)
- ^ Leeuwenburgh C, Heinecke J (2001). “Oxidative stress and antioxidants in exercise”. Curr Med Chem 8 (7): 829–38. doi:10.2174/0929867013372896. PMID 11375753.
- ^ Takanami Y, Iwane H, Kawai Y, Shimomitsu T (2000). “Vitamin E supplementation and endurance exercise: are there benefits?”. Sports Med 29 (2): 73–83. doi:10.2165/00007256-200029020-00001. PMID 10701711.
- ^ Mastaloudis A, Traber M, Carstensen K, Widrick J (2006). “Antioxidants did not prevent muscle damage in response to an ultramarathon run”. Med Sci Sports Exerc 38 (1): 72–80. doi:10.1249/01.mss.0000188579.36272.f6. PMID 16394956.
- ^ Peake J (2003). “Vitamin C: effects of exercise and requirements with training”. Int J Sport Nutr Exerc Metab 13 (2): 125–51. doi:10.1123/ijsnem.13.2.125. PMID 12945825.
- ^ Jakeman P, Maxwell S (1993). “Effect of antioxidant vitamin supplementation on muscle function after eccentric exercise”. Eur J Appl Physiol Occup Physiol 67 (5): 426–30. doi:10.1007/BF00376459. PMID 8299614.
- ^ Close G, Ashton T, Cable T, Doran D, Holloway C, McArdle F, MacLaren D (2006). “Ascorbic acid supplementation does not attenuate post-exercise muscle soreness following muscle-damaging exercise but may delay the recovery process”. Br J Nutr 95 (5): 976–81. doi:10.1079/BJN20061732. PMID 16611389.
- ^ Schumacker P (2006). “Reactive oxygen species in cancer cells: Live by the sword, die by the sword”. Cancer Cell 10 (3): 175–6. doi:10.1016/j.ccr.2006.08.015. PMID 16959608.
- ^ Seifried H, McDonald S, Anderson D, Greenwald P, Milner J (1 August 2003). “The antioxidant conundrum in cancer”. Cancer Res 63 (15): 4295–8. PMID 12907593.
- ^ Lawenda BD, Kelly KM, Ladas EJ, Sagar SM, Vickers A, Blumberg JB (June 2008). “Should supplemental antioxidant administration be avoided during chemotherapy and radiation therapy?”. J. Natl. Cancer Inst. 100 (11): 773–83. doi:10.1093/jnci/djn148. PMID 18505970.
- ^ Block KI, Koch AC, Mead MN, Tothy PK, Newman RA, Gyllenhaal C (September 2008). “Impact of antioxidant supplementation on chemotherapeutic toxicity: a systematic review of the evidence from randomized controlled trials”. Int. J. Cancer 123 (6): 1227–39. doi:10.1002/ijc.23754. PMID 18623084.
- ^ Block KI, Koch AC, Mead MN, Tothy PK, Newman RA, Gyllenhaal C (August 2007). “Impact of antioxidant supplementation on chemotherapeutic efficacy: a systematic review of the evidence from randomized controlled trials”. Cancer Treat. Rev. 33 (5): 407–18. doi:10.1016/j.ctrv.2007.01.005. PMID 17367938.
- ^ Der Petkau-Effekt und unsere strahlende Zukunft (『ペトカウ効果と我らの晴れやかなる未来』)、1985年、ドイツ語
- ^ a b 肥田舜太郎・竹野内真理「福島原発事故のさなかに-本書の概略と意義-」(抜粋)、2011年6月9日、あけび書房『人間と環境への低レベル放射能の脅威 福島原発放射能汚染を考えるために』の序文
- ^ 肥田舜太郎,竹野内真理訳『人間と環境への低レベル放射能の脅威 福島原発放射能汚染を考えるために』あけび書房、2011年6月
- ^ ユーリ・バンダジェフスキー 著、久保田護 訳『放射性セシウムが人体に与える 医学的生物学的影響: チェルノブイリ・原発事故被曝の病理データ』合同出版、2011年12月13日、40頁。ISBN 978-4-7726-1047-6。
- ^ 青野要, 山本道夫, 飯田荘介, 内海耕慥「放射線障害におけるスーパーオキサイド生成系(O(2))とスーパーオキサイド・ディスムターゼ(SOD)及びビタミンEの関与に対する考察」『岡山医学会雑誌』第90巻第9-10号、岡山医学会、1978年、1297-1308頁、doi:10.4044/joma1947.90.9-10_1297、ISSN 0030-1558、NAID 130006858434。
- ^ 川野一之 ほか、「味噌の放射線防御作用並びにACF抑制作用を引き起こす有効成分の解析の試み」 味噌の科学と技術 51(12), 429-434, 2003-12, NAID 40006037256
- ^ “長崎原爆記”秋月辰一郎 著
- ^ 伊藤明弘「放射性物質を除去するみその効用」みそ健康づくり委員会『みそサイエンス最前線』1999年
- ^ 小原正之 ほか、「完熟味噌によるマウスの放射線防御作用」 味噌の科学と技術 50(1), 21-27, 2002-01, NAID 40003575952
- ^ 岡山理科大学 理学部 臨床生命科学科 食品予防医学研究室 岡山理科大学と札幌医科大学との共同研究とのこと
- ^ 石川洋哉, 松本清, 受田浩之「食品の抗酸化能評価法 (特集 食品抗酸化物質の評価と応用)」『食品・食品添加物研究誌』第215巻第1号、FFIジャーナル編集委員会、2010年、5-16頁、ISSN 09199772、NAID 40017000565。
- ^ 寺尾 純二「食品抗酸化物質の評価と応用」『食品・食品添加物研究誌』第215巻第1号、FFIジャーナル編集委員会、2010年、pp.1-5、ISSN 09199772、NAID 40017000563。
- ^ 江頭亨, 高山房子「フリーラジカルに酸化ストレス : ESRによる測定法を中心に」『日本薬理学雑誌』第120巻第4号、日本薬理学会、2002年10月、229-236頁、doi:10.1254/fpj.120.229、ISSN 00155691、NAID 10010332217。
- ^ Cao G, Alessio H, Cutler R (1993). “Oxygen-radical absorbance capacity assay for antioxidants”. Free Radic Biol Med 14 (3): 303–11. doi:10.1016/0891-5849(93)90027-R. PMID 8458588.
- ^ Ou B, Hampsch-Woodill M, Prior R (2001). “Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe”. J Agric Food Chem 49 (10): 4619–26. doi:10.1021/jf010586o. PMID 11599998.
- ^ EFSA Panel on Dietetic Products, Nutrition and Allergies (2010). “Scientific Opinion on the substantiation of health claims related to various food(s)/food constituent(s) and protection of cells from premature aging, antioxidant activity, antioxidant content and antioxidant properties, and protection of DNA, proteins and lipids from oxidative damage pursuant to Article 13(1) of Regulation (EC) No 1924/20061”. EFSA Journal 8 (2): 1489.
- ^ “Withdrawn: Oxygen Radical Absorbance Capacity (ORAC) of Selected Foods, Release 2 (2010)”. United States Department of Agriculture, Agricultural Research Service (16 May 2012). 13 June 2012閲覧。
- ^ USDA. “Oxygen Radical Absorbance Capacity (ORAC) of Selected Foods, Release 2 (2010)”. 2016年12月31日閲覧。
- ^ Prior R, Wu X, Schaich K (2005). “Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements”. J Agric Food Chem 53 (10): 4290–302. doi:10.1021/jf0502698. PMID 15884874.
- ^ 三宅 義明「植物性抗酸化物質」『食品・食品添加物研究誌』第215巻第1号、FFIジャーナル編集委員会、2010年、pp.24-30、ISSN 09199772、NAID 40017000567。
- ^ 矢澤一良「ヘルスフード科学シリーズ(8)食品中の抗酸化物質」『食品と容器』第44巻第10号、缶詰技術研究会、2003年、552-558頁、ISSN 09112278、NAID 80016166408。
- ^ Xianquan S, Shi J, Kakuda Y, Yueming J (2005). “Stability of lycopene during food processing and storage”. J Med Food 8 (4): 413–22. doi:10.1089/jmf.2005.8.413. PMID 16379550.
- ^ Rodriguez-Amaya D (2003). “Food carotenoids: analysis, composition and alterations during storage and processing of foods”. Forum Nutr 56: 35–7. PMID 15806788.
- ^ Baublis A, Lu C, Clydesdale F, Decker E (1 June 2000). “Potential of wheat-based breakfast cereals as a source of dietary antioxidants”. J Am Coll Nutr 19 (3 Suppl): 308S–311S. doi:10.1080/07315724.2000.10718965. PMID 10875602.
- ^ Rietveld A, Wiseman S (1 October 2003). “Antioxidant effects of tea: evidence from human clinical trials”. J Nutr 133 (10): 3285S–3292S. doi:10.1093/jn/133.10.3285S. PMID 14519827.
- ^ Maiani G, Periago Castón MJ, Catasta G (November 2008). “Carotenoids: Actual knowledge on food sources, intakes, stability and bioavailability and their protective role in humans”. Mol Nutr Food Res 53: NA. doi:10.1002/mnfr.200800053. PMID 19035552.
- ^ Henry C, Heppell N (2002). “Nutritional losses and gains during processing: future problems and issues”. Proc Nutr Soc 61 (1): 145–8. doi:10.1079/PNS2001142. PMID 12002789.
- ^ “Antioxidants and Cancer Prevention: Fact Sheet”. National Cancer Institute. 2007年2月27日閲覧。
- ^ Ortega RM (2006). “Importance of functional foods in the Mediterranean diet”. Public Health Nutr 9 (8A): 1136–40. doi:10.1017/S1368980007668530. PMID 17378953.
- ^ Goodrow EF, Wilson TA, Houde SC (October 2006). “Consumption of one egg per day increases serum lutein and zeaxanthin concentrations in older adults without altering serum lipid and lipoprotein cholesterol concentrations”. J. Nutr. 136 (10): 2519–24. doi:10.1093/jn/136.10.2519. PMID 16988120.
- ^ Witschi A, Reddy S, Stofer B, Lauterburg B (1992). “The systemic availability of oral glutathione”. Eur J Clin Pharmacol 43 (6): 667–9. doi:10.1007/BF02284971. PMID 1362956.
- ^ Flagg EW, Coates RJ, Eley JW (1994). “Dietary glutathione intake in humans and the relationship between intake and plasma total glutathione level”. Nutr Cancer 21 (1): 33–46. doi:10.1080/01635589409514302. PMID 8183721.
- ^ a b Dodd S, Dean O, Copolov DL, Malhi GS, Berk M (December 2008). “N-acetylcysteine for antioxidant therapy: pharmacology and clinical utility”. Expert Opin Biol Ther 8 (12): 1955–62. doi:10.1517/14728220802517901. PMID 18990082.
- ^ van de Poll MC, Dejong CH, Soeters PB (June 2006). “Adequate range for sulfur-containing amino acids and biomarkers for their excess: lessons from enteral and parenteral nutrition”. J. Nutr. 136 (6 Suppl): 1694S–1700S. PMID 16702341.
- ^ Wu G, Fang YZ, Yang S, Lupton JR, Turner ND (March 2004). “Glutathione metabolism and its implications for health”. J. Nutr. 134 (3): 489–92. PMID 14988435.
- ^ Pan MH, Ho CT (November 2008). “Chemopreventive effects of natural dietary compounds on cancer development”. Chem Soc Rev 37 (11): 2558–74. doi:10.1039/b801558a. PMID 18949126.
- ^ a b 石沢信人, 杉田収, 斎藤秀晃, 中野正春「ワインと各種飲料物の抗酸化能」『新潟県立看護短期大学紀要』第3巻、新潟県立看護短期大学紀要委員会、1997年12月、3-8頁、ISSN 13428454、NAID 110007525074。
- ^ Kader A, Zagory D, Kerbel E (1989). “Modified atmosphere packaging of fruits and vegetables”. Crit Rev Food Sci Nutr 28 (1): 1–30. doi:10.1080/10408398909527490. PMID 2647417.
- ^ Zallen E, Hitchcock M, Goertz G (1975). “Chilled food systems. Effects of chilled holding on quality of beef loaves”. J Am Diet Assoc 67 (6): 552–7. PMID 1184900.
- ^ Iverson F (1995). “Phenolic antioxidants: Health Protection Branch studies on butylated hydroxyanisole”. Cancer Lett 93 (1): 49–54. doi:10.1016/0304-3835(95)03787-W. PMID 7600543.
- ^ “E number index”. UK food guide. 2007年3月5日閲覧。
- ^ Robards K, Kerr A, Patsalides E (1988). “Rancidity and its measurement in edible oils and snack foods. A review”. Analyst 113 (2): 213–24. doi:10.1039/an9881300213. PMID 3288002.
- ^ 吉川春寿 & 芦田淳 1995, p. 267「抗酸化剤」
- ^ Del Carlo M, Sacchetti G, Di Mattia C, Compagnone D, Mastrocola D, Liberatore L, Cichelli A (2004). “Contribution of the phenolic fraction to the antioxidant activity and oxidative stability of olive oil”. J Agric Food Chem 52 (13): 4072–9. doi:10.1021/jf049806z. PMID 15212450.
- ^ CE Boozer, GS Hammond, CE Hamilton (1955) "Air Oxidation of Hydrocarbons. The Stoichiometry and Fate of Inhibitors in Benzene and Chlorobenzene". Journal of the American Chemical Society, 3233–3235
- ^ “Market Study: Antioxidants”. Ceresana Research. 2008年12月5日閲覧。
- ^ “Why use Antioxidants?”. SpecialChem Adhesives. 2007年2月27日閲覧。
- ^ a b “Fuel antioxidants”. Innospec Chemicals. 2006年10月15日時点のオリジナルよりアーカイブ。2007年2月27日閲覧。
- ^ “老化はなぜ進むか、「酸化ストレス」と「解糖系」が"老化研究のカギ" WISMERLL NEWS Vol.30 Mar.2010”. ウイスマー研究所/株式会社ウイスマー. 2011年2月3日閲覧。
- ^ “酸素スーパーオキシドジスムターゼ (SOD) の活性測定法,Dojin News No.096/2000”. 同人化学. 2011年2月3日閲覧。
参考文献
[編集]- 井上圭三、今堀和友、山川民夫『生化学辞典』(第3版)東京化学同人、1998年。ISBN 4-8079-0480-9。
- 日本化学会監修、『活性酸素(夢・化学21)』、丸善、1999。ISBN 4-621-04634-9
- 大西鐘壽「酸素代謝の適応生理」『小児科』第41巻第0号、2000年、2265-2289頁、NAID 50001298928。
関連文献
[編集]- ニック・レーン Oxygen: The Molecule That Made the World (Oxford University Press, 2003) ISBN 0-19-860783-0
- Barry Halliwell and John M.C. Gutteridge Free Radicals in Biology and Medicine(Oxford University Press, 2007) ISBN 0-19-856869-X
- Jan Pokorny, Nelly Yanishlieva and Michael H. Gordon Antioxidants in Food: Practical Applications (CRC Press Inc, 2001) ISBN 0-8493-1222-1
- Rapola, J. M. et al. (1997). "Randomised trial of alpha-tocopherol and beta-carotene supplements on incidence of major coronary events in men with previous myocardial infarction". Lancet 349 (9067): 1715–1720. PMID 9193380.
:抗酸化ビタミンにおける疫学データ。この論文では、心筋梗塞を起こした患者に抗酸化ビタミンを投与しても再発を予防する効果はないという結論を出している。 - 吉川春寿、芦田淳『総合栄養学事典』(第4版新訂版)同文書院、1995年。ISBN 4810300242。 NCID BN1336464X。
関連項目
[編集]外部リンク
[編集]- 「食品安全情報」(国立医薬品食品衛生研究所;食品添加物、サプリメントに関する国際機関の連絡は食品安全情報(化学物質)として国立医薬品食品衛生研究所 が翻訳、公開している)
- U.S. National Institute Health, Office on Dietary Supplements
- MedlinePlus: Antioxidants.