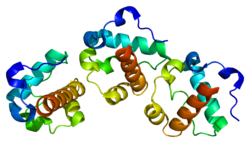
ETV6
ETV6(ETS variant transcription factor 6)またはTEL(translocated ETS leukemia)は、ヒトではETV6遺伝子(以前の名称はTEL遺伝子)にコードされる転写因子である。ETV6タンパク質はさまざまな細胞種、特に血液組織の発生と成長を調節している。ETV6遺伝子には高頻度でさまざまな変異が生じ、致死的となりうるがんが引き起こされる。より具体的には、ETV6は他の遺伝子と融合して特定種のがんの発生や進行を駆動するがん原遺伝子として臨床的に重要である。一方でETV6はがん抑制遺伝子でもあり、末端が切り詰められた不活性型タンパク質が産生されるようになる変異も特定種のがんと関係している。
遺伝子
[編集]ヒトのETV6遺伝子は12番染色体の短腕(p)の13.2(12p13.2)に位置する。遺伝子は8個のエクソンからなり、2つの開始コドンが存在する。そのうちの1つは遺伝子の始まりのエクソン1に位置し、代替的開始コドンはエクソン3の上流に位置する。ETV6遺伝子は全長452アミノ酸からなるタンパク質をコードし、事実上全ての細胞種と組織で発現している[5][6]。Etv6遺伝子をノックアウトしたマウスは、卵黄嚢の血管新生の欠陥と、間葉系細胞と神経細胞のアポトーシスによる過剰喪失のために胎生10.5日から11.5日の間に致死となる。マウスでの遺伝子操作に基づく他の研究からは、この遺伝子が骨髄における血球形成や血管網の発生と維持に必要であることが示唆されている[5][7]。
タンパク質
[編集]ヒトのETV6タンパク質はETS転写因子ファミリーの一員であるが、標的遺伝子の転写を刺激するのではなく阻害する作用を果たす場合の方が多い。ETV6タンパク質は、N末端のPNT(pointed)ドメイン、中心部に位置する調節ドメイン、C末端のETS型DNA結合ドメインから構成される。PNTドメインは自身や他の転写因子(FLI1など)とオリゴマーを形成し、ETSドメインは調節標的遺伝子内に位置する9–10塩基対配列中の5-GGAA/T-3コンセンサス配列に結合する[5][8]。ETV6は細胞の分化や成長を調節する他のタンパク質と相互作用し、一例としてETSファミリーの他のメンバーであるFLI1に結合して阻害を行う。FLI1は血小板を形成する巨核球の成熟を促進し、赤芽球が赤血球へ分化するのを防ぐ因子である[7][9]。ETV6はヒストンアセチルトランスフェラーゼであるHTATIPにも結合する。HTATIPは転写、DNA修復、アポトーシスに関与するさまざまな遺伝子の発現を調節しており、この結合はETV6の転写抑制活性を促進する[10]。
医学的意義
[編集]先天性変異
[編集]ETV6で稀にみられるミスセンス変異やその他の機能喪失型変異は、ETV6-related thrombocytopenia(thrombocytopenia 5、THC5)と呼ばれる血小板減少症の一種の原因となる。この疾患は常染色体優性遺伝疾患であり、さまざまな程度の血小板減少(正常値の5%から90%)、軽度から中程度の出血傾向、そして骨髄生検による異常な形態の巨核球(正常より分葉が少ない核など)の検出、大赤血球症で特徴づけられる。THC5は血液のがん(慢性骨髄単球性白血病、急性骨髄性白血病、B細胞性急性リンパ性白血病、混合形質性急性白血病、骨髄異形成症候群、多発性骨髄腫など)や血液以外のがん(皮膚がん、結腸がんなど)、またミオパチー、胃食道逆流症などの非悪性疾患の発生率の増加と関係している[11][12]。
ETV6遺伝子に常染色体優性遺伝変異を抱える、血縁関係のない2つの家系が発見されている。一方の家系の変異はL349Pと呼ばれ、ETV6のDNA結合ドメインに位置する349番のアミノ酸がロイシンからプロリンへ置き換わっている。もう一方の家系の変異はN385fsと呼ばれ、ETV6遺伝子内の5塩基対の欠失によって短縮型ETV6タンパク質が産生される。どちらの変異型タンパク質も正常な核移行が行われず、ETV6タンパク質による標的遺伝子の調節能力が低下する。2つの家系の15人に血小板減少、そのうち5人では急性リンパ性白血病もみられた。L349P家系では、1人に腎細胞がん、もう1人に十二指腸がんもみられたものの、これら2種類のがんとL349P変異との関係についての研究は行われていない[13]。
治療
[編集]THC5の患者の家族は全血球計算と末梢血塗抹検査標本のスクリーニングによる定期的なモニタリングを行うことで、血液腫瘍への悪性転換によってもたらされる初期変化を検出することが必要である。こうした形質転換が生じた患者は一般的には、家族性ではない同じ血液腫瘍の患者と同様の治療が行われる。悪性でない血液腫瘍や血液以外の固形腫瘍が発生したTHC5の患者も、家族性ではない同じ腫瘍の患者と同様の治療が行われる[11][12]。
ETV6のL349PまたはN385fsの変異と関係した急性リンパ球性白血病では、3人のうち2人は標準的な化学療法に対する感受性が極めて低く、化学療法から骨髄移植へ迅速に移行し、もう1人は死亡した。このことは、これらの変異と関係した急性リンパ球性白血病は積極的治療を必要とすることを示唆している[13]。
後天性変異
[編集]ETV6遺伝子は造血系の前駆細胞でさまざまな変異が生じやすく、さまざまな種類の白血病やリンパ腫が引き起こされる。また、血液以外の組織でも少数の変異が生じ、固形腫瘍が生じる可能性がある。こうした変異は染色体転座を伴っており、12番染色体の短腕12p13.2に位置するETV6遺伝子が他の染色体(稀に同じ染色体)上の遺伝子の近傍へ融合している。このようにして、細胞の悪性成長を促進するキメラタンパク質をコードするがん遺伝子となる融合遺伝子が作り出される。新たに形成されたがんタンパク質のどの部分がその後の悪性化に寄与しているかは明らかではない場合があるが、一般的にはETV6とチロシンキナーゼ活性を有するタンパク質との融合によって、厳密に制御されたチロシンキナーゼから制御を受けず継続的に活性化されたチロシンキナーゼへの変化が生じることで、細胞の悪性転換が促進されることが多い[14]。
血液腫瘍
[編集]下の表では、高頻度でETV6との融合が生じる遺伝子と、それらの機能、染色体上の位置、最も一般的な転座、転座によって生じる悪性腫瘍の一覧を示している。こうした転座変異は、さまざまな種類の血液細胞へ分化する多能性造血幹細胞に生じることが一般的である。したがって、ある特定の変異からさまざまな種類の血液腫瘍が生じる可能性がある[5][14]。骨髄異形成症候群におけるETV6遺伝子変異の存在は、生存期間の短縮と関係している[15]。
| 遺伝子 | 機能 | 位置 | 転座 | 悪性腫瘍 | 遺伝子 | 機能 | 位置 | 転座 | 悪性腫瘍 | |
|---|---|---|---|---|---|---|---|---|---|---|
| PDGFRA | 受容体型チロシンキナーゼ | 4q12 | t(4;12)(q12;p13) | クローン性好酸球増多症患者の40–50% | PDGFRB | 受容体型チロシンキナーゼ | 5q32 | t(5;12)(q31-33;p13) | 稀にクローン性好酸球増多症 | |
| FLT3 | 受容体型チロシンキナーゼ | 13q12.2 | t(12;13)(q13.1;p12.3-13) | 稀に急性骨髄性白血病、急性リンパ性白血病、クローン性好酸球増多症 | ABL1 | 非受容体型チロシンキナーゼ | 9q34.12 | t(9;12)(q34;p13) | 稀に急性骨髄性白血病、B細胞型またはT細胞型急性リンパ性白血病、フィラデルフィア染色体陰性慢性骨髄性白血病 | |
| RUNX1 | 転写因子 | 21q22.12 | t(12;21)(p13;q22) | 小児急性リンパ性白血病患者の20–25% | PAX5 | ホメオボックスタンパク質 | 9p13.2 | t(9;12)(q11;p13) | 小児急性リンパ性白血病患者の1% | |
| MNX1 | ホメオボックスタンパク質 | 7q36.3 | t(7:12)(q36;p13) | 18ヶ月未満の小児急性リンパ性白血病患者の20–30% | MECOM | 転写因子 | 3q26.2 | t(3;12)(q26;p13) | 稀に骨髄異形成症候群、骨髄増殖性腫瘍、急性骨髄性白血病 |
表に示された融合遺伝子形成転座の他にも、ETV6は非常に稀な症例(1件から10件の報告症例)で他の遺伝子との融合が報告されている。こうした転座では表に示されている血液腫瘍の1つまたは複数の種類が引き起こされる。転座によるETV6遺伝子との融合遺伝子の形成が報告されている遺伝子としては、受容体型チロシンキナーゼ遺伝子FGFR3、非受容体型チロシンキナーゼ遺伝子ABL2、NTRK3、JAK2、SYK、FRK、LYN、転写因子遺伝子MN1、PER1、ホメオボックス型転写因子遺伝子CDX2、受容体型プロテインチロシンホスファターゼ遺伝子PTPRR、核内ホルモン受容体コアクチベーター遺伝子NCOA2、免疫グロブリン重鎖遺伝子IGH@、酵素遺伝子TTL(α-チューブリンへのチロシンの付加と脱離)、GOT1(アスパラギン酸トランスアミナーゼ)、ACSL6(長鎖脂肪酸CoAリガーゼ)、トランスポーター遺伝子ARNT(リガンド結合型芳香族炭化水素受容体の核移行を促進し、生体異物代謝に関与する遺伝子の発現を促進する)、機能未知遺伝子CHIC2[16]、MDS2[17]、FCHO2、BAZ2A、未アノテーション遺伝子STL(長いオープンリーディングフレームを持たない)[18]がある[5]。
ETV6遺伝子の少なくとも9種類のフレームシフト変異が成人のT細胞型急性リンパ性白血病症例の約12%と関係している。こうした変異は遺伝子への挿入または欠失を伴い、末端が切り詰められた不活性なETV6タンパク質の産生をもたらす。これらの変異は他のがん遺伝子NOTCH1の変異と共に生じていることが一般的である。NOTCH1遺伝子はETV6とは無関係にT細胞型急性リンパ性白血病と関係している。こうしたETV6遺伝子のサプレッサー変異がこの種の白血病の発生または進行に寄与する因子である可能性が示唆されている[8][19][20]。
治療
[編集]受容体型チロシンキナーゼや非受容体型チロシンキナーゼの遺伝子に対するETV6遺伝子の融合に続発する血液腫瘍を発症した患者は、チロシンキナーゼ阻害薬治療に対する感受性がある可能性がある[21]。一例として、PDGFRAまたはPDGFRB遺伝子融合によるクローン性好酸球増多症の患者は、チロシンキナーゼ阻害薬イマチニブによる治療によって長期的な完全寛解がみられる[14]。ラロトレクチニブ、エヌトレクチニブ、メレスチニブやその他広域に作用するチロシンキナーゼ阻害薬はNTRK3遺伝子を標的とする。こうした薬剤の多くでETV6-NTRK3関連固形腫瘍に対する治療の第I・II相臨床試験が行われており、この融合遺伝子と関係した血液腫瘍の治療に対する有効性が最終的に証明される可能性がある[22]。臨床試験では第一世代チロシンキナーゼ阻害薬ソラフェニブ、スニチニブ、ミドスタウリン、レスタウルチニブはFLT3遺伝子融合と関係した急性骨髄性白血病の治療にある程度の有望性が示されており、FLT3阻害選択性が極めて高い第二世代チロシンキナーゼ阻害薬キザルチニブとクレノラニブはFLT3遺伝子融合と関係した再発性・難治性の急性骨髄性白血病の治療に大きな有望性を示している[23]。ETV6-FLT3関連骨髄/リンパ系新生物の患者1人はスニチニブで、そして再発後はソラフェニブで短期寛解がみられ、このことはETV6-FLT3関連血液腫瘍の治療に対するFLT3チロシンキナーゼ阻害薬の有用性を示唆している[24]。PCM1-JAK2またはBCR-JAK2融合遺伝子と関連した血液腫瘍の2人の患者では、チロシンキナーゼ阻害薬ルキソリチニブに応答して、どちらも短期間(12か月)ではあるものの、完全な細胞遺伝学的寛解がみられた。このことから、JAK2を標的とするチロシンキナーゼ阻害薬もETV6-JAK2融合遺伝子と関係した血液腫瘍の治療にある程度の有用性を示す可能性があることが示唆される[14]。SYKチロシンキナーゼの阻害薬TAK-659は進行悪性リンパ腫に対する第I相臨床試験が進行中であり、ETV6-SYK融合遺伝子と関係した疾患の治療に対する有用性が証明される可能性がある[25]。SYKまたはFRKチロシンキナーゼ遺伝子に対するETV6遺伝子融合と関係した血液腫瘍はチロシンキナーゼ阻害薬治療に対する感受性が示される可能性がある。一方、ETV6-RUNX1関連急性リンパ性白血病の小児は特に予後良好なサブグループであるため、ほぼ一様にスタンダードリスク群に対する化学療法プロトコルでの治療が行われている[26]。
ETV6遺伝子と他の転写因子遺伝子との融合と関係した血液腫瘍は、ETV6や融合パートナーの転写因子の標的遺伝子発現調節機能の喪失または獲得を反映しているようである。こうした遺伝子融合は、細胞の成長、増殖や生存に影響を与える遺伝子産物の産生またはその喪失をもたらす。ETV6-RUNX、ETV6-MN1、ETV6-PER1、ETV6-MECOM融合遺伝子に関するin vitro研究はこの考えを支持している。ETV6-MECOM融合遺伝子はETV6由来のプロモーターに駆動されて過剰発現が行われるのに対し[5]、ETV6-RUNX、ETV6-MN1、ETV6-PER1融合遺伝子はETV6の遺伝子発現抑制活性を欠いたキメラタンパク質の産生を引き起こす[27]。ETV6遺伝子とARNT、TTL、BAZ2A、FCHO2、MDS2、CHIC2との融合も同様にETV6の転写因子活性の喪失をもたらす[27]。ETV6遺伝子とホメオボックス遺伝子(CDX2、PAX5、MNX1など)との融合は、ETV6と融合パートナーのいずれかまたは双方の転写因子活性を欠くキメラタンパク質の産生をもたらす[5]。いずれの場合も、こうした融合遺伝子と関係した血液腫瘍はその表現型に基づいて標準的な化学療法プロトコルによる治療が行われる。
固形腫瘍
[編集]ETV6遺伝子の変異は、固形腫瘍とも関係している。特に、特定種のがんではETV6-NTRK3融合遺伝子が生じており、がん化を駆動していると考えられている。こうしたがんには、乳腺分泌癌(若年性乳癌)、耳下腺やその他の唾液腺の乳腺相似分泌癌、乳児型線維肉腫、先天性中胚葉性腎腫、炎症性筋線維芽細胞性腫瘍、放射線誘発性甲状腺乳頭癌などが含まれる[8][22][27][28][29][30][31][32]。
治療
[編集]ETV6遺伝子関連固形腫瘍の治療は、ETV6遺伝子関連血液腫瘍ほどには進展していない。ETV6-NTRK3遺伝子関連固形腫瘍にはNTRK3のチロシンキナーゼ活性に特異的なチロシンキナーゼ阻害薬が有用な治療となる可能性が提唱されている。NTRK全般、そしてALK、ROS1チロシンキナーゼに対する阻害薬であるエヌトレクチニブは、ETV6-NTRK3融合遺伝子関連乳腺相似分泌癌の患者1人の治療で有用性が示されており、ETV6-NTRK3融合遺伝子関連腫瘍の治療へ向けたNTRK3指向性チロシンキナーゼ阻害薬の臨床開発を支持する結果が得られている[22]。ETV6-NTRK3を含む、変異型、過剰活性型のチロシンキナーゼと関係した広範囲の固形腫瘍に対し、NTRK1、NTRK2、NTRK3チロシンキナーゼに対する非選択的阻害薬であるラロトレクチニブ治療の有効性を検討するため臨床試験の計画が行われている[33]。
出典
[編集]- ^ a b c GRCh38: Ensembl release 89: ENSG00000139083 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000030199 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ a b c d e f g “ETV6 fusion genes in hematological malignancies: a review”. Leukemia Research 36 (8): 945–61. (August 2012). doi:10.1016/j.leukres.2012.04.010. PMID 22578774.
- ^ Online 'Mendelian Inheritance in Man' (OMIM) ETS Variant Gene 6; ETV6 -600618
- ^ a b “Hematopoietic transcription factor mutations: important players in inherited platelet defects”. Blood 129 (21): 2873–2881. (May 2017). doi:10.1182/blood-2016-11-709881. PMC 5445569. PMID 28416505.
- ^ a b c “The ETS family of oncogenic transcription factors in solid tumours”. Nature Reviews. Cancer 17 (6): 337–351. (June 2017). doi:10.1038/nrc.2017.20. PMID 28450705.
- ^ “The ets family member Tel binds to the Fli-1 oncoprotein and inhibits its transcriptional activity”. The Journal of Biological Chemistry 273 (28): 17525–30. (July 1998). doi:10.1074/jbc.273.28.17525. PMID 9651344.
- ^ “The acetyltransferase 60 kDa trans-acting regulatory protein of HIV type 1-interacting protein (Tip60) interacts with the translocation E26 transforming-specific leukaemia gene (TEL) and functions as a transcriptional co-repressor”. The Biochemical Journal 374 (Pt 1): 165–73. (August 2003). doi:10.1042/BJ20030087. PMC 1223570. PMID 12737628.
- ^ a b “Hereditary Predispositions to Myelodysplastic Syndrome”. International Journal of Molecular Sciences 17 (6): 838. (May 2016). doi:10.3390/ijms17060838. PMC 4926372. PMID 27248996.
- ^ a b “Germline ETV6 mutations in familial thrombocytopenia and hematologic malignancy”. Nature Genetics 47 (2): 180–5. (February 2015). doi:10.1038/ng.3177. PMC 4540357. PMID 25581430.
- ^ a b “Germline ETV6 Mutations Confer Susceptibility to Acute Lymphoblastic Leukemia and Thrombocytopenia”. PLOS Genetics 11 (6): e1005262. (June 2015). doi:10.1371/journal.pgen.1005262. PMC 4477877. PMID 26102509.
- ^ a b c d “Myeloid neoplasms with eosinophilia”. Blood 129 (6): 704–714. (February 2017). doi:10.1182/blood-2016-10-695973. PMID 28028030.
- ^ “Myelodysplastic syndromes: Contemporary review and how we treat”. American Journal of Hematology 91 (1): 76–89. (January 2016). doi:10.1002/ajh.24253. PMID 26769228.
- ^ “CHIC2 cysteine rich hydrophobic domain 2 (human)”. Entrez Gene. 2022年8月15日閲覧。
- ^ “MDS2 myelodysplastic syndrome 2 translocation associated”. Entrez Gene. 2022年8月15日閲覧。
- ^ “A t(6;12)(q23;p13) results in the fusion of ETV6 to a novel gene, STL, in a B-cell ALL cell line”. Genes, Chromosomes & Cancer 18 (4): 254–68. (April 1997). doi:10.1002/(sici)1098-2264(199704)18:4<254::aid-gcc3>3.0.co;2-#. PMID 9087565.
- ^ “ETV6 mutations in early immature human T cell leukemias”. The Journal of Experimental Medicine 208 (13): 2571–9. (December 2011). doi:10.1084/jem.20112239. PMC 3244026. PMID 22162831.
- ^ “The NOTCH1-MYC highway toward T-cell acute lymphoblastic leukemia”. Blood 129 (9): 1124–1133. (March 2017). doi:10.1182/blood-2016-09-692582. PMID 28115368.
- ^ “Tyrosine Kinase Inhibitors and Therapeutic Antibodies in Advanced Eosinophilic Disorders and Systemic Mastocytosis”. Current Hematologic Malignancy Reports 10 (4): 351–61. (December 2015). doi:10.1007/s11899-015-0280-3. PMID 26404639.
- ^ a b c “Targeting TRK family proteins in cancer”. Pharmacology & Therapeutics 173: 58–66. (May 2017). doi:10.1016/j.pharmthera.2017.02.006. PMID 28174090.
- ^ “The Cytokine Flt3-Ligand in Normal and Malignant Hematopoiesis”. International Journal of Molecular Sciences 18 (6): 1115. (May 2017). doi:10.3390/ijms18061115. PMC 5485939. PMID 28538663.
- ^ “Response of ETV6-FLT3-positive myeloid/lymphoid neoplasm with eosinophilia to inhibitors of FMS-like tyrosine kinase 3”. Blood 118 (8): 2239–42. (August 2011). doi:10.1182/blood-2011-03-343426. PMID 21705501.
- ^ “Discovery of TAK-659 an orally available investigational inhibitor of Spleen Tyrosine Kinase (SYK)”. Bioorganic & Medicinal Chemistry Letters 26 (24): 5947–5950. (December 2016). doi:10.1016/j.bmcl.2016.10.087. PMID 27839918.
- ^ “Targeting signaling pathways in acute lymphoblastic leukemia: new insights”. Hematology. American Society of Hematology. Education Program 2013: 118–25. (2013). doi:10.1182/asheducation-2013.1.118. PMID 24319172.
- ^ a b c “Molecular mechanisms of ETS transcription factor-mediated tumorigenesis”. Critical Reviews in Biochemistry and Molecular Biology 48 (6): 522–43. (2013). doi:10.3109/10409238.2013.838202. PMC 4086824. PMID 24066765.
- ^ “Expression of the ETV6-NTRK3 gene fusion as a primary event in human secretory breast carcinoma”. Cancer Cell 2 (5): 367–76. (November 2002). doi:10.1016/S1535-6108(02)00180-0. PMID 12450792.
- ^ Majewska H, Skálová A, Stodulski D, Klimková A, Steiner P, Stankiewicz C, Biernat W. "Mammary analogue secretory carcinoma of salivary glands: a new entity associated with ETV6 gene rearrangement." Virchows Arch. 2015 Mar;466(3):245-54. doi: 10.1007/s00428-014-1701-8. Epub 2014 Dec 12.
- ^ “Detection of the ETV6-NTRK3 chimeric RNA of infantile fibrosarcoma/cellular congenital mesoblastic nephroma in paraffin-embedded tissue: application to challenging pediatric renal stromal tumors”. Modern Pathology 13 (1): 29–36. (January 2000). doi:10.1038/modpathol.3880006. PMID 10658907.
- ^ “Newly described salivary gland tumors”. Modern Pathology 30 (s1): S27–S43. (January 2017). doi:10.1038/modpathol.2016.167. PMID 28060365.
- ^ “ETV6-NTRK3 Is Expressed in a Subset of ALK-Negative Inflammatory Myofibroblastic Tumors”. The American Journal of Surgical Pathology 40 (8): 1051–61. (August 2016). doi:10.1097/PAS.0000000000000677. PMID 27259007.
- ^ “ClinicalTrials.gov” (英語). clinicaltrials.gov. 2022年8月21日閲覧。
関連文献
[編集]- “Chronic myelocytic leukemia with eosinophilia, t(9;12)(q34;p13), and ETV6-ABL gene rearrangement: case report and review of the literature”. Cancer Genetics and Cytogenetics 138 (2): 139–42. (October 2002). doi:10.1016/S0165-4608(02)00609-X. PMID 12505259.
- “Nucleotide sequence analysis of human abl and bcr-abl cDNAs”. Oncogene 4 (12): 1477–81. (December 1989). PMID 2687768.
- “Translocation (12;22) (p13;q11) in myeloproliferative disorders results in fusion of the ETS-like TEL gene on 12p13 to the MN1 gene on 22q11”. Oncogene 10 (8): 1511–9. (April 1995). PMID 7731705.
- “Fusion of the TEL gene on 12p13 to the AML1 gene on 21q22 in acute lymphoblastic leukemia”. Proceedings of the National Academy of Sciences of the United States of America 92 (11): 4917–21. (May 1995). Bibcode: 1995PNAS...92.4917G. doi:10.1073/pnas.92.11.4917. PMC 41818. PMID 7761424.
- “The t(12;21) of acute lymphoblastic leukemia results in a tel-AML1 gene fusion”. Blood 85 (12): 3662–70. (June 1995). doi:10.1182/blood.V85.12.3662.bloodjournal85123662. PMID 7780150.
- “The novel activation of ABL by fusion to an ets-related gene, TEL”. Cancer Research 55 (1): 34–8. (January 1995). PMID 7805037.
- “Fusion of PDGF receptor beta to a novel ets-like gene, tel, in chronic myelomonocytic leukemia with t(5;12) chromosomal translocation”. Cell 77 (2): 307–16. (April 1994). doi:10.1016/0092-8674(94)90322-0. PMID 8168137.
- “Biallelic alterations of both ETV6 and CDKN1B genes in a t(12;21) childhood acute lymphoblastic leukemia case”. Cancer Research 56 (11): 2655–61. (June 1996). PMID 8653712.
- “Genomic organization of TEL: the human ETS-variant gene 6”. Genome Research 6 (5): 404–13. (May 1996). doi:10.1101/gr.6.5.404. PMID 8743990.
- “Normalization and subtraction: two approaches to facilitate gene discovery”. Genome Research 6 (9): 791–806. (September 1996). doi:10.1101/gr.6.9.791. PMID 8889548.
- “Generation and analysis of 280,000 human expressed sequence tags”. Genome Research 6 (9): 807–28. (September 1996). doi:10.1101/gr.6.9.807. PMID 8889549.
- “Deletions of CDKN1B and ETV6 in acute myeloid leukemia and myelodysplastic syndromes without cytogenetic evidence of 12p abnormalities”. Genes, Chromosomes & Cancer 19 (2): 77–83. (June 1997). doi:10.1002/(SICI)1098-2264(199706)19:2<77::AID-GCC2>3.0.CO;2-X. PMID 9171997.
- “A TEL-JAK2 fusion protein with constitutive kinase activity in human leukemia”. Science 278 (5341): 1309–12. (November 1997). Bibcode: 1997Sci...278.1309L. doi:10.1126/science.278.5341.1309. PMID 9360930.
- “A novel ETV6-NTRK3 gene fusion in congenital fibrosarcoma”. Nature Genetics 18 (2): 184–7. (February 1998). doi:10.1038/ng0298-184. PMID 9462753.
- “The ets family member Tel binds to the Fli-1 oncoprotein and inhibits its transcriptional activity”. The Journal of Biological Chemistry 273 (28): 17525–30. (July 1998). doi:10.1074/jbc.273.28.17525. PMID 9651344.
- “Haemopoietic transformation by the TEL/ABL oncogene”. British Journal of Haematology 102 (2): 475–85. (July 1998). doi:10.1046/j.1365-2141.1998.00803.x. PMID 9695962.
- “Modulation of TEL transcription activity by interaction with the ubiquitin-conjugating enzyme UBC9”. Proceedings of the National Academy of Sciences of the United States of America 96 (13): 7467–72. (June 1999). Bibcode: 1999PNAS...96.7467R. doi:10.1073/pnas.96.13.7467. PMC 22109. PMID 10377438.
- “Fusion of a novel gene, BTL, to ETV6 in acute myeloid leukemias with a t(4;12)(q11-q12;p13)”. Blood 94 (5): 1820–4. (September 1999). doi:10.1182/blood.V94.5.1820. PMID 10477709.
- “Fusion of TEL/ETV6 to a novel ACS2 in myelodysplastic syndrome and acute myelogenous leukemia with t(5;12)(q31;p13)”. Genes, Chromosomes & Cancer 26 (3): 192–202. (November 1999). doi:10.1002/(SICI)1098-2264(199911)26:3<192::AID-GCC2>3.0.CO;2-E. PMID 10502316.
- “The ETV6-NTRK3 gene fusion encodes a chimeric protein tyrosine kinase that transforms NIH3T3 cells”. Oncogene 19 (7): 906–15. (February 2000). doi:10.1038/sj.onc.1203396. PMID 10702799.