全身麻酔薬

全身麻酔薬(ぜんしんますいやく、General_anaesthetic)は、多くの場合、「人間の意識喪失または動物の正向反射(立ち直り反射)[注釈 1]の喪失を誘発する化合物」として定義される。ヒトでの投与経路は主として吸入または静脈内注射である。局所麻酔薬とは、投与経路や作用機序など、多くの点で根本的に異なる。
概要
[編集]臨床的な定義は、臨床医学および獣医学的な診療における外科的な手技に耐えられるのに十分な程度、痛みを伴う刺激に対して意識の消失を引き起こし得る、人為的に誘発された昏睡を含むと拡張されている。全身麻酔薬は鎮痛剤として作用せず[注釈 2]、また、鎮静剤と混同してはならない[注釈 3]。
全身麻酔薬は、構造的に多様な化合物群であり、そのメカニズムには神経経路の制御に関与する複数の生物学的標的が含まれる。正確な仕組みには定説がないものの、現在も研究が進められている[1]。
全身麻酔薬は、全身麻酔の状態を誘発する。この状態をどのように定義するかについても、確立された見解がない[2]。しかし、全身麻酔薬は通常、不動、鎮痛、記憶喪失、意識消失、有害刺激に対する自律神経反応の低下など、様々な重要な可逆的効果を誘発する[2][3][4]。
投与方法
[編集]
全身麻酔薬は、ガス(吸入麻酔薬)、または注射(静脈内麻酔薬または筋肉内注射)として投与できる。これらの薬剤はすべて、疎水性が強いという特性を共有している(つまり、液体として、それらは水に自由に混和できず、気体としては、水よりも油によく溶ける)[3][5]。吸入または注射のみで麻酔を行うことは可能であるが、最も一般的には、麻酔を導入するために投与される注射とそれを維持するために使用されるガスという2つの形式が組み合わされる[5]。維持にガスを用いることなく静脈麻酔薬のみを用い続けることも可能であり、これは全静脈麻酔と呼ばれる。
吸入
[編集]
吸入麻酔薬は揮発性の液体または気体であり、通常は麻酔器を使用して投与される。麻酔器からは、酸素、麻酔薬、空気の混合気体が患者に供給され、患者と麻酔器のパラメーターが監視可能である。液体の麻酔薬は気化器で気化される[5]。
多くの化合物が吸入麻酔に使用されてきたが、まだ広く使用されているものは数種類のみである。デスフルラン、イソフルラン、セボフルランは、今日最も広く使用されている揮発性麻酔薬である。それらはしばしば亜酸化窒素と併用される[注釈 4]。古くて一般的ではない揮発性麻酔薬には、ハロタン、エンフルラン、メトキシフルランなどがある。2000年代、キセノンの麻酔薬としての使用が積極的に研究されていたこともあった[5]。
注射
[編集]注射可能な麻酔薬は、無意識状態の導入と維持に使用される。麻酔科医は、筋肉内または皮下注射よりも速く、一般的に痛みが少なく、信頼性が高いため、静脈内注射を投与経路として好む。最も広く使用されている薬には次のものがある。
- プロポフォール
- エトミデート(日本では未承認)
- メトヘキシタールやチオペントン・チオペンタールなどのバルビツレート
- ミダゾラムなどのベンゾジアゼピン
- ケタミンは、イギリスでは「現場麻酔」として、例えば交通事故などの現場での手術が必要な場合や手術室に移動する時間が十分でない場合に使用するが、他の麻酔薬を使用できる状況下では優先的に使用されている。アメリカでは手術の現場でより頻繁に使用されている[5]。
ベンゾジアゼピンは鎮静剤であり、他の全身麻酔薬と組み合わせて使用される[2][5]ことが多かったが、2020年より、日本においてはレミマゾラムが全身麻酔を適応として販売開始となった[6]。
作用機序
[編集]全身麻酔の導入と維持、およびさまざまな生理学的副作用の制御は、通常、併用薬アプローチによって達成される。個々の全身麻酔薬は、特定の生理学的および認知的効果に関して異なる。全身麻酔導入は1つの全身麻酔薬によって促進される場合があるが、他の麻酔薬を並行して、またはその後に使用して、目的の麻酔状態を達成および維持することができる。利用される薬物アプローチは、医療提供者の手技と必要性に依存する[2]。
全身麻酔薬は、抑制性中枢神経系(CNS)受容体の活性化、およびCNSの興奮性受容体の不活性化によってその作用を発揮すると考えられている。異なる受容体の相対的な役割はまだ議論中であるが、特定の標的が特定の麻酔薬や薬物効果に関与しているという証拠が存在する[2][7][8]。
以下は、その効果を媒介する可能性が高い全身麻酔薬のいくつかの主要な標的である。
GABAA受容体アゴニスト
[編集]- GABAA受容体は、ニューロンを過分極させ、抑制性CNS受容体として機能する塩化物チャネルである。それらに作用する全身麻酔薬は、通常、鎮静および/または意識喪失の状態を誘発するために使用される。このような薬物には、プロポフォール、セボフルラン、ベンゾジアゼピン(ミダゾラム、レミマゾラム)、およびバルビツレート(チオペンタールナトリウム、メトヘキシタール[注釈 5])が含まれる[2][3][4]。
NMDA受容体拮抗薬
[編集]- NMDA受容体拮抗薬であるケタミンは、主にその鎮痛効果のために使用され、また適応外として抗うつ効果のために使用される。ただし、この薬は覚醒状況も変化させ、全身麻酔の状態を維持するために他の全身麻酔薬と併用して使用されることがよくある。ケタミンを単独で投与すると解離状態になり、患者は幻聴や幻覚を経験する可能性がある。さらに、痛みの知覚は、有害な刺激の知覚から切り離される。ケタミンは、GABA作動性介在ニューロン上のNMDA受容体に優先的に結合するようであり、このことがその効果を部分的に説明している可能性がある[2][3][4]。
Two-pore domainカリウムチャネル(K2Ps)の活性化
[編集]- Two-pore domainカリウムチャネル(K2ps)は、ニューロンの静止膜電位に寄与するカリウムコンダクタンスを調節する。したがって、これらのチャネルを開くと過分極電流が促進され、ニューロンの興奮が抑制される。K2psは、全身麻酔薬(特にハロゲン化吸入麻酔薬)の影響を受けることがわかっており、潜在的な標的分子として研究が進められている。K2Pチャネルファミリーは、15の固有のメンバーを含む6つのサブファミリーで構成されている。これらのチャネルのうち13種(TWIK-1およびTWIK-2ホモマーを除く)は、全身麻酔の影響を受けるとされている。全身麻酔薬がこれらのチャネルに直接結合することは明らかにされておらず、これらの薬物がK2Pコンダクタンスにどのように影響するかは明らかではないが、電気生理学的研究では、特定の全身麻酔薬がK2Pチャネルの活性化をもたらすことが示されている。この薬物によるチャネル活性化は、ある種のK2Pチャネル内の特定のアミノ酸に依存することが示されている(すなわちTREK-1およびTASKチャネル)。TREK-1の場合、膜脂質クラスターへの麻酔薬の影響とホスホリパーゼD2の活性化によって活性化することが示されている。精製再構成TREK-1への麻酔薬を直接結合させても、コンダクタンスに影響はなかった[9]。特定の全身麻酔薬の効果は、K2Pノックアウトマウスでは野生株マウスと比較してあまり顕著ではない。総合すると、TASK-1、TASK-3、およびTREK-1は、全身麻酔の導入に関与していることが支持される[3][7][8]。
その他
[編集]- オピオイド受容体アゴニストは、主にその鎮痛効果のために利用される。ただし、これらの薬は鎮静を誘発することもある。この効果は、オピオイド受容体とアセチルコリン受容体の両方に対するオピオイド作用によって媒介される。これらの薬は意識を低下させる可能性があるが、意識を単独で消失させることは困難である。このため、全身麻酔の状態を維持するために、他の全身麻酔薬と並行して使用されることがよくある。オピオイド系薬物には、モルヒネ、フェンタニル、ヒドロモルホン、およびレミフェンタニルが含まれる[2][4]。
- α2アドレナリン受容体アゴニストであるデクスメデトミジンの投与は、ノンレム睡眠に似た鎮静をもたらす。適応外使用で、全身麻酔の状態を維持するのを補助するために、他の全身麻酔薬と並行して使用される。注目すべきは、患者はこのノンレム睡眠状態から容易に覚醒することである[2][3][4]。
- ドーパミン受容体拮抗薬には、鎮静作用と制吐作用がある。以前は、オピオイドと併用して神経遮断麻酔(カタレプシー、鎮痛、および無反応)を導入するために使用されていた。神経遮断状態の患者は、行われている医療処置に気づいていても、動いたり感情を表現したりすることもできないことが多かったため、現在では神経遮断麻酔そのものがほとんど行われない。そのような薬には、ハロペリドールとドロペリドールが含まれる[2]。全身麻酔作用の理論も参照されたい。
麻酔の段階(深度)
[編集]麻酔薬の投与中、被投与者はさまざまな行動段階を経て、最終的に意識を消失する。この過程は1937年にアーサー・ゲーデルによって、4つの段階として記述された(ゲーデルの分類)。ゲーデルの分類には、主に認知、筋活動、および呼吸に対する麻酔の影響が記述されている[4]。この過程は静脈麻酔薬で加速されるため、現在の麻酔においては、麻酔の深度を麻酔科医が意識して認識していることはほとんどなく、バイスペクトラルインデックスなどの脳波に基づくモニターが現代では使用される。
第I期-鎮痛
[編集]麻酔の受け手は、主に鎮痛を感じ、健忘と混乱感が続き、次の段階に移行する[4]。
第II期-興奮
[編集]第II期は、しばしば被術者が錯乱し、混乱し、重度の健忘症に陥ることが特徴である。不規則性な呼吸様式は、麻酔のこの段階では一般的である。吐き気と嘔吐も麻酔第II期の指標である。せん妄の結果として、闘争・逃走反応やパニック発作が発生することがある[4]。
第III期-外科的麻酔
[編集]第III期の開始時に通常の呼吸が再開する。第3期の終わりに近づくと、呼吸は完全に停止する。第III期の麻酔の指標には、睫毛反射の喪失と規則的な呼吸が含まれる。第III期の麻酔の深さは、多くの場合、眼球運動と瞳孔の大きさによって測定できる[4]。
第IV期-延髄抑制
[編集]第IV期では呼吸は起こらない。これに続いて循環不全と血管運動中枢の抑制がまもなく起こる。呼吸と循環の補助が得られない場合、麻酔のこの段階で死亡することがよくあった[4]。
生理的副作用
[編集]全身麻酔薬の臨床的に有利な効果とは別に、このクラスの薬物によって媒介される他の多くの生理学的結果がある。特に、血圧の低下は、心臓の収縮力の低下や血管系の拡張など、さまざまなメカニズムによって促進される可能性がある。この血圧の低下は、圧受容器を介したフィードバックメカニズムにより、心拍数の反射的な上昇を引き起こす可能性がある。ただし、一部の麻酔薬はこの反射を妨害する[3][4]。
全身麻酔下の患者は、前述の血管拡張により末梢血流を介して失われる熱が増加するため、低体温症を発症するリスクが高くなる。概して、これらの薬は、寒さに反応して体温調節が引き起こされる体内体温の閾値を低下させる(一方、熱に反応して体温調節メカニズムが引き起こされる閾値は、通常上昇する)[10]。
麻酔は通常、呼吸に影響を与える。吸入麻酔薬は、気管支拡張、呼吸数の増加、1回換気量の減少を引き起こす。正味の影響は呼吸の減少であり、患者が全身麻酔下にある間、医療従事者が管理する必要がある[4]。気道の閉塞を緩和する機能を持つ反射も抑制される(例: 嘔吐や咳)。下部食道括約筋の緊張の低下と相まって、逆流の頻度が増加するため、患者は全身麻酔下で特に窒息しやすくなる。医療従事者は、全身麻酔下で患者を綿密に監視し、気管内チューブなどの多くの器具を利用して、患者の安全を確保する[3]。
全身麻酔薬は、化学受容器トリガーゾーンと脳幹嘔吐中枢にも影響を与え、使用後に吐き気と嘔吐を引き起こす[3]。
薬物動態
[編集]静脈内全身麻酔薬
[編集]導入
[編集]静脈内に送達される全身麻酔薬は、通常、親油性の高い小分子である。これらの特性により、血管が豊富で、親油性である脳と脊髄への迅速な優先的分布を促進される。これらの薬の作用が全身麻酔導入につながるのはここである[3]。
排泄
[編集]中枢神経系(CNS)への分布に続いて、麻酔薬はCNSから筋肉や内臓に拡散し、続いて脂肪組織に分布する。薬物を単回注射した患者では、この再分布により全身麻酔が終了する。したがって、1回の麻酔薬ボーラス投与後の薬効持続時間は、再分布動態のみに依存する[3]。
しかし、長時間注入後の麻酔薬の半減期は、薬物の再分布動態、肝臓での薬物代謝、および脂肪内の既存の薬物濃度の全てに依存する。大量の麻酔薬が体の脂肪貯蔵にすでに溶解している場合、脳や脊髄からの再分布が遅くなり、中枢神経系への影響が長引く可能性がある。このため、これらの注入された薬物の半減期は状況依存であると言われている.一般に、麻酔薬の注入が長引くと、薬の半減期が長くなり、脳や脊髄からの排泄が遅くなり、全身麻酔の終了が遅くなる[3]。
吸入全身麻酔薬
[編集]最小肺胞濃度(MAC)は、患者の50%が外科的切開に反応するのを防ぐ肺内の吸入麻酔薬の濃度である。この値は、さまざまな吸入全身麻酔薬の効力を比較するために使用され、全身麻酔の導入および/または維持中に医療従事者が使用する薬の分圧に影響を与える[3][4]。
導入
[編集]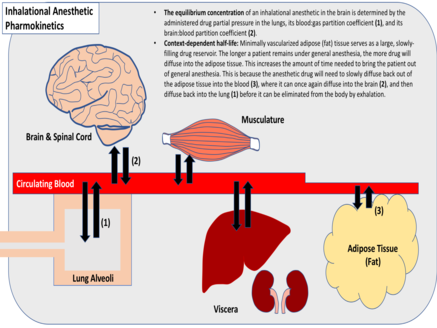
麻酔の導入は、吸入された麻酔薬が脳と脊髄に拡散することによって促進される。さまざまな組織内の薬物の分圧が肺内の薬物の分圧と等しくなるまで、全身への拡散が進行する[3]。医療従事者は、吸入麻酔薬の分圧を変えることで、麻酔導入速度と麻酔薬の最終的な組織濃度を制御できる。肺内の薬物分圧が高いほど、全身への拡散が速くなり、最大組織濃度が高くなる。呼吸数と吸気量も、肺血流の程度と同様に、麻酔開始の速さに影響する[4]。
気体薬物の分配係数は、さまざまな組織におけるその相対的な溶解度を示している。この測定基準は、2つの組織の分圧が等しい場合(ガス:血液、脂肪:血液など)の2つの組織間の相対的な薬物濃度である。吸入麻酔薬は、その組織溶解性と分配係数に関して大きな違いがある[3]。溶解度の高い麻酔薬は、与えられた組織内の分圧を上げるために多くの薬剤分子を必要とするが、溶解度の低い麻酔薬は比較的少なくて済む[4]。一般に、溶解度の低い吸入麻酔薬は、より早く平衡状態に達する。しかし、脂肪・血液分配係数が高い吸入麻酔薬は、薬物にとって大きくゆっくりと満たされる貯蔵庫として機能する脂肪組織(血管分布が最小)のため、よりゆっくりと平衡に達する[3]。
排泄
[編集]吸入麻酔薬は、肺に拡散した後、呼気を介して排泄される。この過程は、麻酔薬の血液/ガス分配係数、組織溶解度、肺への血流、および患者の呼吸数および吸気量に大きく依存する[4]。組織溶解度が最小のガスについては、麻酔の終了は一般に麻酔の開始と同じくらい急速に起こる。ただし、組織への溶解度が高いガスの場合、麻酔の終了は一般的に状況に依存する。静脈内麻酔薬注入の場合と同様に、溶解性の高い麻酔ガスを長時間投与すると、一般に薬物の半減期が長くなり、脳と脊髄からの排出が遅くなり、麻酔の終了が遅くなる[3]。
吸入麻酔薬の代謝は、一般に薬物排泄の主要な経路ではない[4]。
脚注
[編集]注釈
[編集]出典
[編集]- ^ Franks, Nicholas P. (May 2008). “General anaesthesia: from molecular targets to neuronal pathways of sleep and arousal” (英語). Nature Reviews Neuroscience 9 (5): 370–386. doi:10.1038/nrn2372. ISSN 1471-0048. PMID 18425091.
- ^ a b c d e f g h i j Brown, Emery N.; Purdon, Patrick L.; Van Dort, Christa J. (2011-06-21). “General Anesthesia and Altered States of Arousal: A Systems Neuroscience Analysis”. Annual Review of Neuroscience 34 (1): 601–628. doi:10.1146/annurev-neuro-060909-153200. ISSN 0147-006X. PMC 3390788. PMID 21513454.
- ^ a b c d e f g h i j k l m n o p q Goodman & Gilman's pharmacological basis of therapeutics.. Goodman, Louis S. (Louis Sanford), 1906-2000., Brunton, Laurence L., Chabner, Bruce., Knollmann, Björn C. (12th ed.). New York: McGraw-Hill. (2011). ISBN 9780071624428. OCLC 498979404
- ^ a b c d e f g h i j k l m n o p q Katzung, Bertram G.; Trevor, Anthony J. (2014-12-23). Basic and clinical pharmacology. Katzung, Bertram G., Trevor, Anthony J. (Thirteenth ed.). New York. ISBN 9780071825054. OCLC 875520239
- ^ a b c d e f M., Dale, M. (2007). Rang & Dale's pharmacology. Rang, H. P., Dale, Maureen M. (6th ed.). [Edinburgh]: Churchill Livingstone. ISBN 978-0443069116. OCLC 76798115
- ^ “アネレム静注用50mg”. www.info.pmda.go.jp. 2022年12月17日閲覧。
- ^ a b Franks, Nicholas P (2006-01-01). “Molecular targets underlying general anaesthesia” (英語). British Journal of Pharmacology 147 (S1): S72–S81. doi:10.1038/sj.bjp.0706441. ISSN 1476-5381. PMC 1760740. PMID 16402123.
- ^ a b Steinberg, E. A.; Wafford, K. A.; Brickley, S. G.; Franks, N. P.; Wisden, W. (2015-05-01). “The role of K2P channels in anaesthesia and sleep” (英語). Pflügers Archiv: European Journal of Physiology 467 (5): 907–916. doi:10.1007/s00424-014-1654-4. ISSN 0031-6768. PMC 4428837. PMID 25482669.
- ^ Pavel, Mahmud Arif; Petersen, E. Nicholas; Wang, Hao; Lerner, Richard A.; Hansen, Scott B. (16 June 2020). “Studies on the mechanism of general anesthesia”. Proceedings of the National Academy of Sciences 117 (24): 13757–13766. doi:10.1073/pnas.2004259117. PMC 7306821. PMID 32467161.
- ^ Bindra, Ashish; Bindu, Barkha; Rath, Girija (2017-07-01). “Temperature management under general anesthesia: Compulsion or option” (英語). Journal of Anaesthesiology Clinical Pharmacology 33 (3): 306–316. doi:10.4103/joacp.joacp_334_16. PMC 5672515. PMID 29109627.
