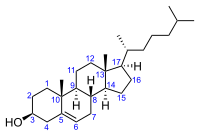
コレステロール
| コレステロール | |
|---|---|
| |
| |
(10R,13R)-10,13-dimethyl-17-(6-methylheptan-2-yl)-2,3,4,7,8,9,11,12,14,15,16,17-dodecahydro-1H-cyclopenta[a]phenanthren-3-ol | |
別称 (3β)-コレスタ-5-エン-3-オール コレスタ-5-エン-3β-オール | |
| 識別情報 | |
| CAS登録番号 | 57-88-5 |
| PubChem | 5997 |
| 日化辞番号 | J2.804E |
| KEGG | C00187 D00040 (医薬品) |
| RTECS番号 | FZ8400000 |
| |
| 特性 | |
| 分子式 | C27H46O |
| モル質量 | 386.65 g/mol |
| 外観 | 白色または微黄色固体[1] |
| 密度 | 1.052 g/cm³ |
| 融点 |
148–150 ℃[1] |
| 沸点 |
360 ℃(分解) |
| 水への溶解度 | 0.095 mg/L (30 ℃) |
| 溶解度 | アセトン、ベンゼン、 クロロホルム、エタノール、 ジエチルエーテル、ヘキサン、 ミリスチン酸イソプロピル、 メタノールに溶解 |
| 比旋光度 [α]D | −31.5° (c = 2, Et2O, 20 ℃)[2] |
| 出典 | |
| NIST | |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
コレステロール(英: cholesterol)は、ステロイドの中で、ステロールと呼ばれているサブグループに属する有機化合物の一種である。トリテルペノイドの一つでもある。1784年に胆石からコレステロールが初めて単離された。室温で単離された場合は白色もしくは微黄色の固体である。生体内ではスクアレンからプロトステロール(ラノステロールなど)を経て生合成される。
コレステロールは動物細胞にとっては生体膜の必須構成物質であり、さらに細胞内のさまざまなプロセスに関わる主要生体分子の一つである。一方、精製物は化粧品・医薬品・液晶の原材料など工業原料として広く利用されている。コレステロールを含めてステロールは脂質の主要カテゴリの一つを構成する(ステロール脂質)。
いわゆる「善玉/悪玉コレステロール」と呼ばれる物質は、血管中を流れているリポタンパク粒子をあらかじめ高密度リポタンパク質(HDL)と低密度リポタンパク質(LDL)に超遠心分離法または化学的な分別剤を使って分離し、各粒子中のコレステロールを、生化学的分析法で測定したもので、HDL中のコレステロールを善玉、LDL中のコレステロ-ルを悪玉と呼称し、決してコレステロール自体に差があるというものではない。最近はコレステロールそのものの違いより、リポタンパク質の「質」の違いにより動脈硬化性疾患の治療や予防が行われるようになってきた。
名称
[編集]名称は1784年に研究者が胆石からコレステロールの固体を初めて同定した際、ギリシア語の chole-(胆汁)と stereos(固体)からコレステリン (cholesterin) と命名されていたが、その後化学構造がアルコール体であるため、化学命名接尾辞 "-ol" が付けられて現在の名称となっている[注 1]。
生物界における分布
[編集]ヒトのあらゆる組織の細胞膜に見出される脂質である。ヒトを始めとした哺乳類においては、コレステロールの大部分は食事に由来するのではなく、体内で合成され、血漿に含まれるリポタンパク質と呼ばれる粒子を媒体として輸送される。コレステロールはそれを生産する臓器や細胞膜や小胞体のような膜組織が密集している細胞で構成される臓器、例えば肝臓、脊髄、脳に高濃度に分布している。成人の体内コレステロール量である100-150 gのうち約1/4が脳に集中し[3]、約1/3が脳を含めた神経系に集中している[4][信頼性要検証]。動脈硬化叢に形成されるアテローム(血管の内側に詰まるカスのようなもの)にも高濃度で存在する。また、コレステロールが胆汁中で結晶化すると胆石の原因となる。
植物の細胞膜においてはわずかな量のコレステロールが認められるに過ぎず、他の種類のステロイド(フィトステロールと呼ばれる)が同様の役目を担う。真核生物は、一部の例外(昆虫、繊毛虫など)を除き大部分の種が何らかのステロールを自身で生合成する。そして各真核生物はそれぞれが特有のステロール組成を有する。動物の主要ステロールがコレステロール、植物ではフィトステロール、菌類はエルゴステロールを合成することが知られている。真核生物以外では、コレステロールは今のところ検出されていない(ステロール自体が稀)。
| ヒト組織 | コレステロールの重量比[5] |  胆石(コレステロール結石) |
|---|---|---|
| 胆石(コレステロール結石) | 98%–99% | |
| 上皮脂肪 | 13%–24% | |
| 毛髪 | 1%–5% | |
| 脳 | 2.7% | |
| 神経 | 1.5% | |
| 血液 | 0.015%–0.025% |
資源
[編集]コレステロールは、工業製品原料として化粧品・医薬品・液晶などに利用される。これらは全て天然物から精製し原料に供される。コレステロールを多く含む高等動物の組織、あるいはイカの内臓からも抽出され、工業原料として利用される。
精製
[編集]コレステロールを多く含む天然物から抽出すると、ヒドロキシ基(OH基)の部分に脂肪酸が結合したエステル体であるアシルコレステロール、さらに他のステロイド(コレスタノールや7-デヒドロコレステロール)のアシル体などが含まれる粗精製物が得られる。この混合物から純粋なコレステロールを取り出すには、脂肪酸を鹸化して取り除いたあと、鹸化されない分画を抽出し、アセトンあるいはアルコールを用いて再結晶する。二重結合を持たないコレスタノールや7-デヒドロコレステロールなどを取り除くために、臭素付加してコレステロールの二臭素体とすることがある。二臭素体は難溶性を示すので再結晶などで容易に精製することが可能であり、そのあと二臭化物を脱臭素化してコレステロールに戻すことにより、純粋なコレステロールを得る[6]。
化学
[編集]
物性
[編集]単離された純粋なコレステロールは白色ないしは微黄色の固体で味は無い。クロロホルム、ジエチルエーテルに溶けやすく、1,4-ジオキサンにやや溶けやすく、エタノール (99.5%)、石油エーテル、冷アセトンにやや溶けにくく、水にほとんど溶けない。含水エタノールからは一水和物が板状晶として析出する。比旋光度 = −31.5°(c = 2、エーテル、20 ℃)[2]。遮光された気密容器中に保存する[6][7]。
定性試験
[編集]分析化学において、コレステロールを同定する定性反応が幾つか知られている。これらのうちいくつかはコレステロールと同じ部分構造のステロイドに対しても反応する。日本薬局方ではサルコフスキー反応とリーバーマン‐ブルヒアルト反応とでコレステロールを同定するよう指示している。
- サルコフスキー反応 (Salkowski reaction)
- クロロホルム溶液 (0.01 g/1 mL) に濃硫酸 (1 mL) を加えて室温で振り混ぜると、クロロホルム層は赤色を呈し、硫酸層は緑色の蛍光を発する[7][8]。
- リーバーマン・ブルヒアルト反応 (Liebermann-Burchard reaction)
- クロロホルム溶液 (5 mg/2 mL) に無水酢酸 (1 mL)、硫酸1滴を室温で振り混ぜると、クロロホルム層は赤色を呈し、黄色を経て緑色に変わる[7][9]。
- チュガーエフ反応 (Chugaev reaction)
- 氷酢酸溶液に塩化亜鉛と塩化アセチルを加えて煮沸する。液は紅色を呈し紫色に変じる[9]。
- トーテリィ・ヤッフェ反応 (Tortelli-Jaffe reaction)
- 酢酸溶液に臭素のクロロホルム溶液を重層すると8位に二重結合を持つステロールは境界面に緑色のリングを形成する[5]。
- ジギトニン沈殿反応
- ジギトニン (Digitonin) のアルコール溶液を加えると、3-β-ヒドロキシステロールは沈殿を生じる[5]。
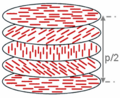
コレステリック液晶
[編集]コレステロール脂質を含むいくつかのコレステロール誘導体はある種の液晶として知られており、この分子はコレステリック液晶と呼ばれる配向状態をとる。コレステリック液晶はネマティック液晶の一種であり、ネマティック液晶のダイレクタ(分子集合体の向き)が空間的に歳差運動のようにねじれながら回転していき、らせん状に配向する性質を持つ。これはコレステリック液晶分子がキラリティを有することに起因している(下図参照)。コレステリック液晶はキラルネマティック相とも呼ばれる。コレステリック相のらせんピッチは可視光線の波長と同程度であることが多く、このとき選択反射という現象が観察されて色が見える。刺身から緑色の反射光が見えることがあるのはこのためである。らせんピッチは微小な温度変化に応答するため、温度によって色彩が変化する。それゆえ、コレステロール誘導体は液晶温度計や温度応答性インキとして利用される。カナブンや玉虫のようなメタリックな色彩を示す甲虫の一部の構造色はこれによると考えられている。
コレステリック液晶は表示の書き換え時にのみ電圧印加が必要となるだけで、透過状態でも反射状態でも電気を消費しない。低い電圧で横向きらせん姿勢をとるため透過状態となり、通常は背面の黒を表示する。より高い電圧を加えれば縦向きらせん姿勢をとるため反射状態となる。
コレステリック液晶は色彩を反射するのでバックライトが不要であるという長所の一方、単色では1層の表示構造で済むが、擬似フルカラーでは少なくともRGBのような3層分を積層する必要があり、透過時の光損失によって表示が暗くなるという短所がある。
2005年には日本の家電メーカーがコレステリック液晶の試作品を製作した[10]。コレステリック液晶を液晶ディスプレイとして用いたChLCDの研究は1989年よりケント州立大学やアメリカ国立科学財団などでも行われており、その研究者たちによってKent Displays社が創立された。同社のChLCDを用いた商品にはブギーボードがあり[11]、米国の小学校などでも使われている。日本ではキングジムから発売されている。
-
コレステリック晶の顕微鏡像
-
コレステリック(晶)状態の分子配列
生化学
[編集]コレステロールは生体内の代謝過程において主要な役割を果たしている。まず多くの動物でステロイド合成の出発物質となっている。また動物細胞においては、脂質二重層構造を持つ生体膜(細胞膜)の重要な構成物質である。人間では肝臓および皮膚で生合成される。肝臓で合成されたコレステロールは脂肪酸エステル体に変換され血液中のリポタンパク質により全身に輸送される。
悪玉コレステロールと善玉コレステロール
[編集]コレステロールが生命維持に必須な役割を果たす物質であるという事実は、科学者以外にはあまり知られていない。むしろ、一般社会には健康を蝕む物質として認知されていることが多い。すなわち、様々なリポタンパク質コレステロール複合体の血液中でのあり方が、脂質異常症など循環器疾患の一因になるとの認識が強い。
たとえば、医師が患者に対してコレステロールの健康上の懸念がある場合には、悪玉コレステロール(LDLコレステロール:low density lipoprotein cholesterol、いわゆる bad cholesterol)の危険性を訴える。一方、悪玉コレステロールの対極には善玉コレステロール(HDLコレステロール:high density lipoprotein cholesterol、いわゆる good cholesterol)が存在する。この両者の違いはコレステロールを体内輸送する際における、コレステロールと複合体を作るリポタンパク質の種類によるものであり、コレステロール分子自体の違いではない。
悪玉といわれるLDL (コレステロールではない) が、動脈硬化巣に酸化LDLとし蓄積された結果、動脈が詰まり心筋梗塞や、その他の疾患を発生させていることが明らかになってきた。逆に善玉HDL(コレステロールではない) は、動脈硬化巣から酸化LDLを引き抜く作用があり善玉と呼ばれている。詳細は、脂質異常症、体内輸送およびリポタンパク質、変性LDLの項を参照のこと。
構造と生合成
[編集]

コレステロールの存在自体は知られていたが、20世紀に入るまでその構造は長い間不明であった。1927年にコレステロールのステロイド骨格が4つの環構造6, 6, 6, 5員環が繋がっているものであると決定したのはオットー・ディールスである。彼はセレンを使った脱水素反応を利用した炭化水素の構造に関する系統的な研究を行っている。すなわち構造が未知の炭化水素を脱水素して二重結合を生成したり骨格を切断したりして既知の炭化水素に導き、元の炭化水素の構造を推定していくのである。ステロイド骨格もその一環でディールスの炭化水素と呼ばれる化学式 C16H18 の炭化水素から現在の立体配置を除くステロイド骨格の構造を決定した。この方法では構造変換の過程で立体構造に関する手掛かりが失われるため、コレステロールの立体構造は解明されないままであった。
1930年代はステロイドホルモンの単離と構造決定が相次いで研究された。この段階ではディールスの研究では立体構造が不明なため、これらのステロイドホルモンの構造はコレステロールを化学的に構造変換してステロイドホルモンへ変換しそれによって立体構造を決定している。
立体構造を最終的に決定したのはE・J・コーリーである。彼の天然物合成の研究方法に基づき、ほとんど立体構造が分からない状態から天然物の生成経路ならびに中間体の立体配座と反応機構からステロイド骨格の生成反応が立体特異的に進行することを見出した[12][13][14]。
コーリーの見つけ出したステロイド骨格(ラノステロール)の構築反応は、生体内で生じる生化学反応のなかでも非常にエレガントなものの一つである。動物の場合では、メバロン酸経路およびゲラニルリン酸経路を経て生合成されるスクアレンの2,3-位が酵素的にエポキシ化(オキシドスクアレン)されると、逐次閉環反応が進行するのではなく、一気にラノステロールが生成する。酵素によりエポキシ酸素がプロトネーションされるのをきっかけに、4つの二重結合のπ電子がドミノ倒しのように倒れこんでσ結合となりステロイドのA, B, C, D環が一度に形成される。それだけでなく、ステロイドの20位炭素上に発生したカルボカチオンを埋めるように、2つの水素(ヒドリド)とメチル基がそれぞれステロイド環平面を横切ることなく1つずつ隣りの炭素に転位することで、熱力学的安定配座となりラノステロールが生成する。
一方、植物の場合、ラノステロールではなく、シクロアルテノールと呼ばれる別のプロトステロールを経てコレステロールが合成される。シクロアルテノールは6, 6, 6, 5のステラン骨格に加えて3員環をもつ。スクアレンもしくはオキシドスクアレンから、ステロールと同様の環化機構により別のテルペノイドであるホパノイドやβ-アミリンを生成する生合成経路も知られている。
ラノステロールもしくはシクロアルテノールからさらに先は、リダクターゼとP450酵素によるメチル基の酸化が繰り返されて適用される。その結果、3つのメチル基が二酸化炭素として切断される酸化的脱メチル化によって(ラノステロールから17段階で)コレステロールが生成する[6][15]。
生体膜とコレステロール
[編集]
リン脂質の二重膜構造(橙のリン酸部分+水色の脂肪鎖)にタンパク質(緑褐色 (4))やコレステロール(黄色 (7))が埋め込まれている
クリックで拡大
リン脂質から人工的に製造した脂質2分子膜は電気容量、屈折率、水との界面張力が実際の生体膜とよく類似するが、生体膜と異なり相転移温度Tcを持つ。すなわちTc以上では流動性を示すが、Tc以下では硬くなり流動性を失う。
これに30–50 mol%のコレステロールを加えると流動性はさらに増し、しかもTcが消滅することが知られている。脂質2分子膜上では次のように埋め込まれる。すなわち、親水性を示すコレステロールのヒドロキシ基は外向きに配置されリン脂質の燐酸基部分と水素結合する。そして嵩高いステロイド骨格と炭化水素側鎖は内側のリン脂質の脂肪酸鎖の間に埋め込まれる。
コレステロールは細胞内膜系にも普遍的に存在するが、ミトコンドリアの脂質膜には例外的にほとんど含まれていない。

コレステロールは高等動物の細胞膜の必須成分であるが、植物の細胞膜には別のステロールであるフィトステロール類(シトステロール、スチグマステロール、フコステロール、スピナステロール、ブラシカステロールなど)が含まれ、真菌ではまた別のステロールであるエルゴステロールが含まれる。一方細菌の細胞膜にはコレステロールは含まれない[16]。代わりに一部の細菌はホパノイドと呼ばれる構造的に類似した化学物質を利用している。
生理学
[編集]コレステロールは生体の細胞膜の必須成分であり、また動脈硬化症の危険因子として、ヒトにおけるコレステロールの生理学は注目を集めている。
まず、コレステロールが含有することでリン脂質より構成される脂質二重膜は、生体膜特有のしなやかさを発現する。そして、コレステロールから代謝産生されるステロイドホルモン類は、細胞核内の受容体タンパク質と結合して転写因子となり遺伝子の発現を制御する。
複雑な体制を持つ多細胞動物の体内では、コレステロールは胆汁酸、リポタンパク質など輸送分子と共に複合体を形成して移送される。そして、どの輸送分子と組み合わされているかによって、どの組織からどの組織へ移送されるのかが制御されている。
コレステロールに関する研究ではコンラート・ブロッホ、フェオドル・リュネンがコレステロールと脂肪酸代謝の調節機序を解明した功績で1964年のノーベル生理学・医学賞を受賞している。
機能
[編集]コレステロールは細胞膜の構築や維持に必要で、広範囲の温度帯で膜の流動性(粘性度)を安定にする働きがある。いくつかの研究によるとコレステロールは抗酸化剤としての作用を持っている[17]。
コレステロールは(脂肪の消化を助ける)胆汁酸の産生も助けている。胆汁酸は、肝臓にてチトクロムP450の作用でコレステロールを酸化することにより産生される。胆汁酸は、タウリン、アミノ酸であるグリシンと結び付いて、あるいは硫酸塩、グルクロン酸と抱合して、脱水により塩にまで濃縮されて胆嚢に蓄えられる。人においては、コレステロール7-α-水酸化酵素により、ステロイド環の7の位置にヒドロキシ基(水酸基)が付加され 7α-ヒドロキシコレステロールが合成される反応が律速反応となっている。胆汁酸の生合成は、コレステロールの代謝によるものが一般的である。人体では1日あたり 800 mg のコレステロールを産生し、その半分は胆汁酸の新たな生成に使用されている。毎日、合計で20-30 gの胆汁酸が腸内に分泌されている。分泌される胆汁酸の90%は回腸で能動輸送され再吸収され再利用され、腸管から肝臓や胆嚢に抱合胆汁酸が移動することを、腸肝循環と呼んでいる。

ビタミンA、D、EおよびKなど脂溶性ビタミンの代謝にも重要な役割を果たしている。ビタミンDは、コレステロールが7-デヒドロコレステロールに変化し、これに紫外線が当たることによって生成される。
そしてコレステロールはビタミン以外にも色々なステロイドホルモン(コルチゾール、アルドステロンなど副腎皮質ホルモンやプロゲステロン、エストロゲン、テストステロンや誘導体など性ホルモン)の合成の主要な前駆体である。
最近、コレステロールが細胞シグナル伝達に関与していることが発見された。それによると、原形質膜で脂質輸送の役割を果たし、原形質膜の水素イオンやナトリウムイオンの透過性を下げる働きがあることが示唆されている[18]。

脳、神経系にコレステロール全量の1/3も多く含まれているのは、神経細胞から伸びた神経伝達を司っている軸索を覆っているミエリン鞘にコレステロールが大量に含まれているためである。コレステロールは、ミエリン鞘の絶縁性を保持する役割を果たしている。絶縁されたミエリン鞘の切れ目であるランヴィエの絞輪ごとでの跳躍伝導により高速の神経信号伝達に寄与している[4][信頼性要検証]。実際、哺乳類である豚や牛などでは脳総重量の2-3%がコレステロールで占められている。
脳の灰白質は、中枢神経系の神経組織のうち、神経細胞の細胞体が存在している部位のことである。これに対し、神経細胞体がなく、神経線維ばかりの部位を白質と呼ぶ。白質は明るく光るような白色をしているのに対し、灰白質は、白質よりも色が濃く、灰色がかって見えることによる。これは、有髄神経線維のミエリン鞘の主成分として大量に存在しているコレステロール[4][信頼性要検証]やミエリンが白い色をしているためで、白質には、灰白質に比べて、有髄神経線維が多いからと考えられている。
カベオラ依存エンドサイトーシスやクラスリン依存エンドサイトーシスにおいて、カベオラやクラスリン被覆ピットを構成したり陥入する作用にコレステロールは必須である。これらのエンドサイトーシスにおけるコレステロールの役割は、コレステロール欠損原形質膜とメチルベータシクロデキストリン (MβCD) とを使って研究されている。
生合成と吸収
[編集]コレステロールは哺乳類の細胞膜において正常な細胞機能を発現するために必要であり、コレステロールはいくつかの細胞や組織でアセチルCoAを出発原料として細胞内の小胞体で合成されるか、食事から取り込まれ、コレステロールのアシルエステルはLDLにより血流を介して輸送される。そして、受容体関与エンドサイトーシスによりクラスリン被覆ピットから細胞内に取り込まれ、リソゾームで加水分解される。
まず、コレステロールの供給については胆汁酸と複合体を形成して腸管より吸収される外因性コレステロールと、主に肝臓において、アセチルCoAからメバロン酸、スクアレンを経由して生合成される内因性コレステロールとに大別される。その生合成量は外因性コレステロール量の変動を吸収するように調節されている。
外因性コレステロールは1, 200–1, 300 mgが吸収されるが、食事由来のものは200–300 mgほどであり、他は肝臓から胆汁に分泌されたものの再吸収である。したがって、体内で循環しているコレステロールの50%ほどが血流中に存在していることになる[要説明][要出典]。
ヒトで体内の全コレステロール量はおよそ100-150 gほどである[4][信頼性要検証]。殆どが細胞膜に取り込まれたものであるが一部が代謝循環している。すなわち内因性コレステロールの生産量は低コレステロール食摂取時にはおよそ800 mg/日程度[19] であることが知られており、体内を循環するコレステロールのおよそ20%–25%が肝臓で合成される。
皮膚においても肝臓に次ぐ量のコレステロールが産生されており、皮膚で 7-デヒドロコレステロールからビタミンD3 が光化学的に生成される。7-デヒドロコレステロールは、ヒトを含むほとんどの脊椎動物の皮膚中で大量に生成される[20]。ビタミンD3は、肝臓でC25の位置でヒドロキシ化の代謝を受け25-ヒドロキシコレカルシフェロール(別名 25(OH)D3、カルシジオール)へと変化し肝細胞に貯えられ、必要なときにα-グロブリンと結合しリンパ液中に放出される。
ヒトを含む哺乳類においては、皮膚以外の組織で必要とされるコレステロールあるいはステロイドホルモンなどコレステロール誘導体は生合成されるのではなく、肝臓から血漿中を輸送されるコレステロールエステルを含むリン脂質複合体を利用するデノボ合成により産生される。また体内における貯蔵について述べると、コレステロールを貯蔵するための特別な形態は存在しない。たとえばブドウ糖はグリコーゲンへ、アセチルCoAはトリグリセリドへと転換されることで蓄積される。しかし、コレステロールはそうではない。このため輸送途中のリポタンパク質(LDLコレステロール)などは体内におけるコレステロールのリザーバーとしての役割もある。末梢組織にリン脂質とともに運ばれたコレステロールエステルはリソゾームで加水分解を受けてコレステロールに戻り、さらに利用される。
このような動態を持つためコレステロールの食事からの吸収や肝臓での生合成は必須である一方、コレステロールの過剰による脂質異常症も問題となる場合も多い。
脂質異常症は、食事による外因性コレステロールの増大だけでなく、末梢組織での LDLコレステロール受容体機能の抑制も大きな因子である。家族性高コレステロール血症では遺伝的に末梢組織のLDL受容体が変成することで、結果として末梢でのコレステロール取り込みが減り、脂質異常症が発生する。また、先天的要因だけでなく後天的に脂質代謝異常も発現していると考えられ、そういった糖・脂質の複合的な代謝異常という意味でメタボリックシンドロームが注目を集めている。なお、植物油に含まれるフィトステロールがコレステロールの吸収を減少させる作用を有する(詳細はフィトステロール#コレステロールの低減を参照)。フィトステロールは小腸の粘膜細胞において一旦は吸収されるが、能動輸送によってフィトステロールが細胞外に排泄される。この時、コレステロールも一緒に排泄されるので摂取したコレステロールの吸収が減少することになる[21]。
体内輸送
[編集]食事のうちトリグリセリド(中性脂肪の一種)の摂取量は50–125 g/日[22] であるのに対して、コレステロールは200–300 mg/日程度である。
高等動物種の場合、コレステロール単独で輸送されることは無く、脂質の成分比率は様々であるがトリグリセライドなど他の脂質と共にリン脂質のミセルを形成し輸送される。脂質を輸送するリン脂質にはアポリポタンパク質が含まれ、リン脂質とアポリポタンパク質を総称してリポタンパク質と呼ばれる。リポタンパク質にはいくつかの種類が存在し、比重、ミセルの大きさやアポリポタンパク質の種類で分類される。
| リポタンパク | 比重 | 粒子径 | アポタンパク | 中性脂肪重量比 | コレステロール重量比 (エステル体重量比) |
補足 |
|---|---|---|---|---|---|---|
| キロミクロン | <0.96 | 80–1,000 nm | ApoB48 | 85% | 7% (5%) | トリグリセリドの輸送体。リポタンパク質の大部分を占める。 |
| VLDL | 0.96–1.006 | 30–75 nm | プレβ | 55% | 19% (12%) | VLDLは肝臓で分泌され、末梢において酵素リポタンパク質リパーゼの作用でトリグリセリドを失って、IDLを経由しLDLへと変化する。 |
| IDL | 1.006–1.019 | 22–30 nm | プレβ およびβ |
24% | 46% (33%) | 比重の小さいLDLで、体内挙動はLDLと同じ。速やかにLDLに変化するので、健常人の場合の存在量は僅か。 |
| LDL | 1.019–1.063 | 19–22 nm | β | 10% | 45% (37%) | |
| HDL | 1.063–1.21 | 7–10 nm | α | 5% | 24% (18%) | およそ70%がリン脂質とタンパク質。おもに末梢組織で分泌される。リン脂質の8割はホスファチジルコリンで占められている。[26] |
-
リン脂質の構造式
頭部(円形部1)は親水性を示し、脂肪鎖(鎖部2)は親油性を示す。 -
脂質2重膜とミセル
リン脂質は二重膜構造 (1) をとり細胞膜を形成する。リポタンパク質ではミセル (2) を形成し、内部の脂質を輸送する。
つまり、水にわずかしかに溶解しないコレステロールを水を主成分とする血流に乗せるために、リポタンパク質がミセルを形成し、スーツケースのようにコレステロール(エステル体)や中性脂肪を格納することで血流を介して輸送するのである。
リポタンパク質の表面のアポリポタンパク質が細胞のコレステロールを運び去るのか、受け取るのかを決定する。すなわちヒトにおけるコレステロールの輸送はそれぞれの場面において固有の役割を担うリポタンパク質などキャリヤーの存在が重要である。
コレステロールの輸送は肝臓を中心として胆汁酸とリポタンパク質より形成されるキロミクロンとにより輸送される、
と、LDLやHDLが介する
とに大別される。言い換えると、肝臓から末梢へのコレステロール輸送はLDLが担当し、組織(おもに遅筋)から肝臓への輸送はHDLが担当する。その役割の違いからLDLコレステロール複合体(LDLコレステロール)は「悪玉コレステロール」、HDLコレステロール複合体(HDLコレステロール)は「善玉コレステロール」と呼ばれることがある。
キロミクロン (chylomicron) と呼ばれるリポタンパク質脂質複合体はリポタンパク質の総量の大部分を占め、主に小腸粘膜と肝臓の間で脂肪を輸送する。キロミクロンは主に中性脂肪とコレステロールを肝臓に輸送し、肝臓で中性脂肪と一部のコレステロールを放出する。そしてキロミクロン粒子は LDL粒子へと変換されて肝臓から他の組織へと中性脂肪とコレステロールを輸送する。

LDL reseptor - LDL受容体
LDL patikula - LDL粒子
klatrin - クラスリン
lizozom - リソゾーム
もう一つのリポタンパク質脂質複合体であるHDL粒子はコレステロールを肝臓に逆輸送し、肝臓から分泌させる。この作用は大変興味深い作用で、巨大HDL粒子の数が多いほど健康に寄与するところが大きい。
このようにリポタンパク質の種類により役割が分化する理由は、細胞への取り込みがリポタンパク質の種類を細胞膜表面にあるリポタンパク質受容体が識別してエンドサイトーシスが生じて取り込みが起こるためである。取り込まれた小胞はリソゾーム代謝を受け、細胞に利用される。

肝臓、右肝管、左肝管、総肝管、胆嚢管、総胆管、胆嚢、オッディ括約筋、ファーター膨大部、膵管、膵臓、十二指腸
肝臓から分泌された胆汁は一時的に胆嚢で濃縮される。食事によりCCKホルモン等が放出されると総胆管を通じて胆汁は十二指腸中に分泌される。
分泌・代謝
[編集]ヒトにおけるコレステロールの排泄は、肝臓でコレステロールが水酸化されて胆汁酸を生成し、胆嚢からビリルビンとともに胆汁として分泌される。その際にコレステロールの一部が胆汁酸と複合体を形成して十二指腸に排泄される。胆汁の中のコレステロールは胆汁酸により分散安定化されているが、胆嚢で胆汁が濃縮される際に何らかの原因で遊離しコレステロールの結晶が成長すると、胆嚢あるいは胆管においてコレステロール胆石症の原因となる場合もある。胆石の他の原因であるレシチンやビリルビンによる結石は稀である。
胆汁は胆管を経由して、十二指腸で腸管内に分泌排泄される。しかし大部分は小腸において再吸収されることになる。食物繊維を多く含む食事は食物繊維が胆汁酸を吸着するのでコレステロールや他の脂質も巻き込んで排泄される。それゆえ、脂質吸収を抑制するのに役立つと考えられている。また、皮膚あるいは髪の毛など上皮細胞が脱落するとその細胞膜のコレステロールも失われることになる。
調節
[編集]コレステロールの生合成量は体内コレステロールレベルが直接が調節している。しかしコレステロール恒常性について判明していることはごく一部である。まず食事から吸収する量が増大すると生合成は抑制され、吸収量が減ると反対に作用する。主要な調節機構は次の通りである。
- 細胞内のコレステロール量は小胞体上のステロール調節配列結合タンパク質 (SREBP; sterol regulatory element binding protein 1 and 2) により検出される。コレステロールが存在するとSREBPは他の2つのタンパク質、SCAP (SREBP-cleavage activating protein) と Insig1 とが結合する。
- コレステロールレベルが減少すると、Insig-1が遊離することでSREBP-SCAP複合体はゴルジ体へと移動する。
- SREBPはS1P (site 1 protease) とS2P (site 2 protease) とに分割され、コレステロールレベルが低い状態で2つの酵素はSCAPにより活性化する。
- 分割されたSREBPは核へ移動しSRE (sterol regulatory element) と結合して転写因子として作用し、幾つかの遺伝子を発現させる。これらの遺伝子の中にLDL受容体とHMG-CoAレダクターゼが含まれる。
- そして血流中を循環するLDLを取り込むように働くと共にHMG-CoAレダクターゼはコレステロールの生合成を増大させる[27]。
この機構のほとんどは1970年代にマイケル・ブラウンとジョーゼフ・ゴールドスタインによって解明され、彼らは1985年のノーベル生理学・医学賞を受賞している[27]。
昆虫におけるコレステロール代謝
[編集]昆虫では体内で必要とするコレステロール合成ができないため、肉食性の昆虫では食物からすべてのコレステロールを得ている。草食性の昆虫では食物となる植物細胞の構成要素となるステロールの主体がシトステロールなどであり、コレステロールの量がわずかであるため必要量を満たせない。そのためシトステロールを体内でコレステロールに変換していることが知られている。
植物におけるコレステロール
[編集](教科書を含む)多くの書籍では植物にはコレステロールが含まれないという誤った記述が見られる。この誤解の多くは、米国の食品医薬品局が食品中のコレステロール含有量が一回の食事当り2 mg以下の場合にラベル表示をしなくても良いとしていることに起因する。植物性食品にも多少のコレステロールは含まれる(ベールマン (Behrman) とゴパラン (Gopalan) によると動物性食品では5 g/kgなのに対し、植物性食品では総脂質のうち50 mg/kg がコレステロールであると指摘している)[28]。植物によるコレステロールの合成経路も解明されている[29]。
健康とコレステロール
[編集]食物由来のコレステロールのほとんどは動物性食品に由来する。卵黄に多量に含まれる。そのため卵の摂取量はしばしば研究の対象となる[30][31][32][33]。植物のフィトステロールは血漿中のコレステロール量を下げるとされる[34]。
コレステロールは動物の生理過程において不可欠の物質であるが、血液中をリポタンパク質によって循環する量が過剰となることで高脂血症を引き起こし、血管障害を中心とする生活習慣病の因子となることが知られてきた。よく血液検査でコレステロールが調べられるが、TCまたはT-CHOの略号で血液中の総コレステロール、LDLCまたはLDL-Cでの略号でいわゆる「悪玉コレステロール」、HDLCまたはHDL-Cの略号でいわゆる「善玉コレステロール」を表すことが多い。なお、国際的な観点ではLDL-C は日本でのみ用いられているスクリーニング指標で測定精度には疑義が出されている[35]。
コレステロール値の増減に関わる因子
[編集]人間の体内にあるコレステロールのうち、およそ7割前後は肝臓で合成されている[36][37][信頼性要検証]。コレステロールを多く含む食事の摂取が増えても、生体には恒常性を保つ調節機構があり、健康な人間であれば体内におけるコレステロール量は一定に保たれている。しかし、生合成の出発点となるスクアレンはアセチルCoAから合成されるため、食事からコレステロールを取らなかったとしても脂肪や炭水化物を摂取すれば体内でコレステロールに転換されることになる。
従来はリノール酸はコレステロールを下げる働きがあるとされていたが、長期的にはTC(総コレステロール)値に変化がないとの結果が出ている[38]。
臨床検査分野における標準となるLDL測定法は、アメリカ疾病予防管理センターのベータ測定法であるが、費用上の問題で、血中LDL値はフリードワルドの公式で算出することがある。その式は
- LDL値 = 総コレステロール値 − 総HDL値 − 中性脂肪値の20%
である[39][信頼性要検証]。この計算式の基となる理論は総コレステロール値がHDL、LDLおよびVLDLの合計で定義されることを利用する。この理論に基づき、実際に測定する総コレステロールから測定するHDL値と中性脂肪値から導き出されるVLDL値を差し引くのである。そしてVLDL値はおよそ中性脂肪値の5分の1であることが経験的に知られている。
このような背景から特に次の点に留意すべきである。コレステロール値とことなり中性脂肪値は直近の食物の摂取や内容により大きく変動する。そのため、血液検査前は最低8–12時間、完全に影響を排除するには 12–16時間の絶食が必要である。
臨床事例増加により分かったことは、直接LDLとHDLの濃度とサイズとを測定する方法に比べて、総コレステロールとHDLコレステロールとを測定し式より導かれる値でLDLの決定する方法は実際に直接LDLを測定する方法に比べLDL値が大きな値を推定することが示されている[25]。
脂質異常症
[編集]動脈硬化症とコレステロール
[編集]
動脈を切り開いたところ。内面一面は黄色のアテロームに覆われ正常な内膜(通常は無色)は見られない
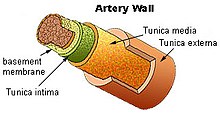
内側から動脈基底膜(basement membrane;黄緑)
動脈内膜(Tunica intima;緑)
動脈中膜(Tunica media;黄橙)
動脈外膜(Tunuca extema;褐色)
アテローマは内膜中で増大する

閉塞 (1) した先の心筋 (2) が障害される
血液中のコレステロール値 (TC) は動脈硬化症と単純に結び付けて語られることが多かったが、現在はTC値が高いことは動脈硬化の危険因子(リスクファクター)の1つということになってきている。
冠動脈疾患 (CHD) とコレステロール
[編集]コレステロールは、冠動脈疾患(狭心症・心筋梗塞等)の危険因子である[40]。アメリカ心臓学会では心疾患リスクと血中総コレステロール値に関するガイドラインを提唱している[41]。
| Level (mg/dL) | Level (mmol/L) | 解説 |
|---|---|---|
| < 200 | < 5.2 | 心疾患リスクを低減させるのに望ましいレベル |
| 200 – 239 | 5.2 – 6.2 | 境界領域 |
| > 240 | > 6.2 | 高リスク |
しかし、今日での臨床検査ではLDL(悪玉)とHDL(善玉)のコレステロール値を分けて測定する方法が通常であり、アメリカ心臓学会が提唱するような総コレステロール値だけを見る単純化された方法はいくぶん時代遅れである。後述のHPS試験計画などによれば、リポタンパク質を区別して測定し、望ましくはLDLレベルを100 mg/dL (2.6 mmol/L) 以下にすべきであり、高リスク患者ではさらに厳しく< 70 mg/dLにすべきであるとされている。
そして総コレステロールにおけるHDL量は他のコレステロール量と比べて5対1以下にすることで健康を維持するのに適当な値である。特に子供は成人とはHDLレベルが異なることに注意すべきであり、子供の平均的なHDLレベルは 35 mg/dLである。
米国で最近行われたヒトでの冠動脈疾患とそのリスク評価に関する、よく計画された無作為抽出評価であるHeart Protection Study (HPS) 試験計画やPROVE-IT試験計画、およびTNT試験計画により研究されてきた。
これらの試験計画はLDL低減によるHDL向上の効果や、LDL低減療法が血管内超音波カテーテルによるアテローム治療と同等以上かどうかを調査するものである。この試験結果では少数の症例でLDL低減したことが冠動脈疾患の進行を抑止したということが確認された。しかしリポタンパク質の構成比の異常が治療により成功しても、アテローム動脈硬化の治療の必要性が無くなった症例はごくわずかであった。
また脂質異常症治療薬のHMG-CoAリダクターゼ阻害剤(スタチン)の複数の臨床試験結果からも動脈硬化に対するリポタンパク質の影響が明らかになっている。まず、スタチンを投与するとリポタンパク質の分布を不健康型から循環器疾患の発生が低下するようなより健康な型へと変化させる。そして健常人であってもHDLを増やすように作用する。しかし心疾患が無かったり、心臓発作病歴の無いなどの無症状患者において、スタチンを投与してコレステロール値を低下させても、その後の経過において心疾患による死亡率を低減させる作用があるかどうかについて調査すると、その結果はスタチン治療しない場合と統計上の有意差は無いことが分かっている。
したがって現状の知見においては、動脈硬化を発症している患者については脂質異常症は明らかに症状を悪化させる因子である[42]。しかし、低いコレステロールが冠動脈疾患や動脈硬化を改善するかどうかは明確になっていない。
それとは別に糖尿病を罹患している患者は、糖尿病による高血糖は血管内皮細胞を障害するし、耐糖能異常があると血糖が低くても高インスリン血症を引き起こすので血管内皮細胞に悪影響を及ぼす。したがって耐糖能異常があるとすでに動脈硬化、冠動脈疾患、脂肪肝のリスクを抱えていることになる[43]。それゆえ、そのような患者や患者予備軍は脂質異常症については注意を払う必要がある。このように理由により、糖代謝と脂質代謝が同時平行的に複合的に異常を起こすメタボリックシンドロームが注目されている。
がんとコレステロール
[編集]コレステロール摂取量と卵巣がんや子宮内膜がんに正の関連が認められている。肺がん、膵臓がん、大腸がん、直腸がんにおいても、正の関連を認めた報告が多くある[44]。
1990年と1993年に、岩手県二戸、秋田県横手、長野県佐久、沖縄県中部、茨城県水戸、新潟県長岡、高知県中央東、長崎県上五島、沖縄県宮古の9保健所管内在住の、40~69歳の男女約3万人を2004年まで追跡した調査結果にもとづき総コレステロール値とがん発生との関連を調べたコホート研究では、臓器別では、男女の肝がん、男性の胃がんで強く認められた。さらに開始3年以内に発生したがん及び進行がんを除いたところ、胃がんとの関連は弱くなったが、肝がんとの関連はほとんど変化はなかった。男性の前立腺がんでは、総コレステロール値との正の関連を認めた。男女の肝がんと男性の胃がんを除き、血中の総コレステロール値とがんの発生との間に関連は認められなかった[45]。
2020年、ブリティッシュ・メディカル・ジャーナルに掲載された論文では、デンマークの10万人以上の国民を対象とした大規模なコホート研究によると、LDLコレステロールとがんいよる死亡率との関係ではグラフ上でU字型の関係が認められ、最も死亡率が低かったのはLDLコレステロール値が132-154mg/dlの群であった。低くても高くても死亡率は上がり、特に低いグループでリスクはより高くなっていた。がん以外のすべての死亡リスクも同様の傾向が見られた。最も死亡リスクが低かったグループは140mg/dlであった。これは脂質異常の診断基準となるボーダーライン(140mg/dl)とほぼ同等であった。総コレステロールとがんとの関係でも、総コレステロール値が低い人の方ががんに罹患しやすい傾向があり、特に日本人では肝臓がんのリスクは男女ともに5倍以上である[46]。
低コレステロール血症と副腎、生殖腺
[編集]血中での正常値を下回るコレステロール値を示す症状を低コレステロール血症(低脂血症)と呼ぶ。この病態の研究は比較的限られたものであり、いくつかの研究によりうつ病、がん、神経ホルモンと関連が示唆されている。
コレステロールは副腎や生殖腺でステロイドホルモン(副腎皮質ホルモンと性ホルモン)に合成される。体内で合成される副腎皮質ホルモンにはアルドステロン、コルチゾン、コルチゾール、デスオキシコルチコステロン等がある。体内で合成される性ホルモンには、テストステロン、AMH、インヒビン、エストラジオール、エストリオール、エストロン、ゲスターゲン、プロゲステロン等がある。これらすべての原料がコレステロールである。LDLコレステロール異常低値では家族性低コレステロール血症、低βリポ蛋白血症、無βリポ蛋白血症、甲状腺機能亢進症、慢性肝炎、肝硬変、腎疾患、アジソン病、肝実質細胞障害、消化吸収不良症候群などが疑われる。
リポタンパク質は細胞の生命維持に必須のコレステロールがアポタンパク質と結合したものである。無βリポ蛋白血症は常染色体劣性遺伝疾患で、コレステロールが低下し、LDLコレステロールは検出できず、超低比重リポタンパク (VLDL) とLDLを介して抹消組織に送られるビタミンEにも重度の欠損が起こる。血漿中にアポBがないことで確定診断される。治療には高用量 (100–300 mg/kg) のビタミンE、食物脂肪、その他の脂溶性ビタミン補充を行う。低βリポ蛋白血症は常染色体優性遺伝疾患あるいは相互優性遺伝疾患である。LDLコレステロール欠損の病態には無βリポ蛋白血症と同様の治療を行う。低アルファリポタンパク血症の治療も同様である。カイロミクロン停滞病は常染色体劣性遺伝疾患である。治療は脂肪、脂溶性ビタミン(ビタミンE)補充を行う[47]。
コレステロールを原料にした副腎皮質ホルモンおよび性ホルモンの異常値で疑われるのは、先天性副腎低形成(原発性副腎低形成)、下垂体機能低下症、副腎酵素欠損症、クッシング病、偽性低アルドステロン症、原発性アルドステロン症、グルココルチコイド抵抗症などである。リポイド過形成症ではProtein (Steroidogenic acute regualtory protein、StAR) 蛋白の異常とコレステロール側鎖切断酵素に欠損がみられる。副腎酵素欠損症の一つであるP450オキシドレダクターゼ欠損症では、P450オキシドレダクターゼ (POR) の異常によって、細胞内のコレステロールの低下と様々な骨奇形、Antley-Bixler症候群、ステロイドの異常値が起きる。
寿命とコレステロール
[編集]一般に血中コレステロール量は加齢により変動し、通常は60歳代まで徐々に増大する。またヒトにおいてはコレステロールレベルの季節変動が認められ、冬季には平均よりも高くなる[48]。また、脂質異常症が循環器疾患を引き起こす危険因子であるので、血中コレステロール値の大小で寿命が影響を受けると考えられてきた。それゆえ、寿命とコレステロールの関係については注目されてきており、すでに米国で大規模な疫学調査 MRFIT (multi risk factor intervention) が実施されている。
その結果は予想に反して、コレステロール値は高すぎても、低すぎても寿命を短縮するというものである。MRFITの解析結果によると、血中総コレステロールが200 mg/dL以上では冠動脈疾患による死亡率が急速に増大し、180 mg/dL以下では冠動脈疾患による死亡率は低減せずほぼ一定になることが判明している。一方、血中総コレステロールが180 mg/dL以下では冠動脈疾患以外による死亡率が増えるため、結果として血中総コレステロールが180–200 mg/dLが最も死亡率が低下することが判明した。
米国でのMRFIT以外にもヨーロッパや他の地域でも同様な疫学調査がなされており、同様な結果が得られている[49]。
コレステロールの値が高いほど心筋梗塞のリスクが高まり、コレステロールの値が低いほど脳卒中のリスクが高まり、血中総コレステロールが180–200 mg/dLが最も死亡率が低下し、長寿であることが指摘されている[50]。この結果や前述の説明のように血中コレステロールの総量よりはその種類(LDLコレステロールとHDLコレステロールあるいは酸化型リポタンパク質の存在)などコレステロールの質が寿命と深く関わっていると考えられている。
コレステロール低値で死亡率が上昇
[編集]日本での疫学調査としては、1986年度から1989年度までの福井市で行われた調査がある。26,000人を対象に住民検診の結果を福井保健所長であった白崎昭一郎医師がまとめた結果、男性ではコレステロール値が低い人ほどガンなどで死亡した人が多く、女性でもコレステロール値が低い群が死亡率が高かった[51]。感染症、がん、肝疾患、気管支炎、胃潰瘍および貧血の基礎疾患をもった人は血清総コレステロール値が低くなるので、死亡率が高くなるためと考えられている[44]。
低コレステロールは、脳卒中のリスク要因でもある[52]。
コレステロール等についての血液検査の参考基準値
[編集]| 項目 | 被験者のタイプ | 下限値 | 上限値 | 単位 | 最適範囲 |
| 中性脂肪(トリグリセライド) | 10 – 39 歳 | 54[53] | 110[53] | mg/dL | < 100 mg/dL[54] or 1.1[54] mmol/L |
| 0.61[55] | 1.2[55] | mmol/L | |||
| 40 – 59 歳 | 70[53] | 150[53] | mg/dL | ||
| 0.77[55] | 1.7[55] | mmol/L | |||
| >60 歳 | 80[53] | 150[53] | mg/dL | ||
| 0.9[55] | 1.7[55] | mmol/L | |||
| 総コレステロール | 3.0[56], 3.6[56][57] | 5.0[58][59], 6.5[57] | mmol/L | < 3.9[54] | |
| 120[60], 140[57] | 200[60], 250[57] | mg/dL | < 150[54] | ||
| HDLコレステロール | 女性 | 1.0[61], 1.2[58], 1.3[56] | 2.2[61] | mmol/L | > 1.0[61] or 1.6[56] mmol/L > 40[62] or 60[63] mg/dL |
| 40[62], 50[64] | 86[62] | mg/dL | |||
| HDLコレステロール | 男性 | 0.9[58][61] | 2.0[61] | mmol/L | |
| 35[62] | 80[62] | mg/dL | |||
| LDLコレステロール (トリグリセライド >500 mg/dLの場合無効) |
2.0[61], 2.4[59] | 3.0[58][59], 3.4[61] | mmol/L | < 2.5[61] | |
| 80[62], 94[62] | 120[62], 130[62] | mg/dL | < 100[62] | ||
| LDL/HDL比 | n/a | 5[58] |
食事中コレステロールと健康
[編集]食物由来コレステロール
[編集]
食物由来コレステロールのほとんどは動物性食品に由来する。たとえば、卵黄(約1400 mg/100 g)、するめ(乾物; 約980 mg/100 g)、エビ類(約 170 mg/100 g)[65]。植物性食品(亜麻仁種子やピーナッツ)では、コレステロール類似化合物のフィトステロールが含まれ、血漿中のコレステロール量を下げるとされている[66]。
| 食品名 | エネルギー (kcal) |
コレステロール (mg) |
飽和 脂肪酸 (g) |
一価 不飽和 脂肪酸 (g) |
多価 不飽和 脂肪酸 (g) |
|---|---|---|---|---|---|
| 卵黄 | 387 | 1400 | 9.22 | 11.99 | 5.39 |
| するめ(乾物) | 334 | 980 | 0.6 | 0.12 | 0.89 |
| たたみいわし | 372 | 710 | 1.53 | 1.41 | 1.35 |
| ピータン | 214 | 680 | 3.06 | 8.19 | 1.64 |
| あんこうきも | 445 | 560 | 8.3 | 18.44 | 8.38 |
| すじこ | 282 | 510 | 2.7 | 4.02 | 6.18 |
| うずら卵 | 182 | 490 | 4.24 | 5.36 | 1.79 |
| 鶏全卵 | 151 | 420 | 2.64 | 3.72 | 1.44 |
| 豚レバー | 128 | 250 | 0.78 | 0.24 | 0.75 |
| バター | 745 | 210 | 51.44 | 20.9 | 2.43 |
| えび | 83 | 170 | 0.06 | 0.04 | 0.08 |
| マヨネーズ 卵黄型 | 670 | 150 | 6.85 | 36.5 | 22.99 |
| 鶏肉(皮を含む) | 200 | 98 | 3.9 | 5.83 | 1.97 |
| 豚肉 | 225 | 71 | 5.06 | 6.42 | 1.41 |
| 牛肉 | 182 | 67 | 3.34 | 3.87 | 0.41 |
食事中コレステロールの摂取目標量
[編集]2003年の世界保健機関による生活習慣病予防に関する報告書では、1日のコレステロールの摂取目標を300 mg未満と設定している[67]。アメリカ合衆国農務省・保健社会福祉省の"Dietary Guidelines for Americans 2010"によると、健康な人の場合 300 mg であった。また、厚生労働省の「日本人の食事摂取基準(2010年版)」では、コレステロールの摂取目標量の上限は、成人男性で1日当たり750 mg、成人女性で600 mgと設定されていた。
しかし、厚生労働省の「日本人の食事摂取基準(2020年版)」では、食事で摂取するコレステロールは「200 mg/日未満に留めることが望ましい」とされた[68]。2015年の「アメリカ人のための食生活指針2015-2020年版」では、食事中コレステロールの摂取目標量は撤廃され、できるだけ少量にするべきとなった[69]。
2015年時点で、アメリカ心臓財団と米国心臓病学会も同様に撤廃しているが、全米脂質協会の『脂質異常症のためのガイドライン』は、200mg未満としている[70]。こうした違いは、健康な集団と、特定の疾患に関連した集団という違いに由来する[70]。
食事中コレステロールと疾患リスク
[編集]このようにして食事生活指針からのコレステロールの摂取基準は2015年を境になくなったが、議論は続いている。
2019年の論文では、平均17年半の追跡調査を行ったアメリカ国内の複数のデータを調査したもので、過去の研究と異なり喫煙や運動不足やほかの食品成分の関係を考慮に入れて包括的に分析し、結果は、食事からのコレステロールの摂取が1日に300mgに増えると、心疾血管系疾患のリスクは3.2%、早死にのリスクが4.4%増加し、卵が半個ごとにそれぞれ1.1%、1.9%増加というものであった[71]。
2010年の文献調査は、1日に卵を1個摂取している場合、週に1個未満のものと比較して糖尿病のリスクが2倍以上であり、心臓血管疾患のリスクがある患者はコレステロールの摂取を制限すべきであり、脳卒中や心筋梗塞後の卵黄の消費を止めるべきであるとしている[72] としている。この見解などを根拠としてアメリカ合衆国などでは、食事性コレステロールを1日300 mg未満に抑えるよう推奨している[73]。
オーストラリアシドニー大学のNicholas Fullerにより、第50回欧州糖尿病学会で発表された[73] 研究は、3カ月後の比較であり、成人の糖尿病状態および2型糖尿病患者140人を対象とした調査で、朝食時に2個 × 6日 = 12個の卵を食べる高卵食群と、週に卵を2個未満の低卵食群に振り分けた。なお、両群のタンパク質の摂取量を一致させるため低卵食群は赤身の動物性タンパク質を摂取し、主要栄養素と熱量を一致させ試験期間中の体重を維持した。結果は、卵の摂取量が多くても、2型糖尿病患者の脂質プロファイルには悪影響を及ぼさないとしている[73]。
日本でのコレステロール値の決定プロセス
[編集]日本では一般にコレステロール値が高いと言うのは、総コレステロール値が220以上の場合を指す。これは日本動脈硬化学会が作成した「動脈硬化性疾患診療ガイドライン」が大きく影響している。これは動脈硬化性疾患をスクリーニングするための診断基準としている。ガン検診でガンの疑いがあるとされても、いきなりガン治療を始めるわけではないのと同様に、スクリーニングでは220以上でも、多くの患者が治療を必要とはしないケースが多数あるからである。
一般にスクリーニングは、精密検査を必要とする患者予備軍を簡単な検査によって精密検査前に絞り込むことが求められる。しかし、総コレステロール値が220以上をすべて患者予備軍としてしまうために、男性では26%、女性では33%が要精密検査と判定されている。動脈硬化による主な病状は心筋梗塞があるが、コレステロール値を検査することで動脈硬化と心筋梗塞へ至る症状の予防が求められるのに、現状では心筋梗塞が男性に比べて1⁄2から1⁄3の女性の方が、多くの割合で要精密検査となってしまう。
1980年代まではこの基準が250から240になっていたが、これは95%の人がこの基準値以下で健康であったためである。1987年に日本動脈硬化学会が「コンセンサス・カンファレンス」で基準値を220としたため、これ以降は220が使われている。220が科学的な妥当性を欠いているという意見は決定以降も多数あり、6年間・5万人を対象に行われた「日本脂質介入試験」の結果も、240を境に有意に心臓の冠動脈疾患のリスク上昇を示していたが、結果として2007年現在も、220が基準となっている。
一度は1999年に240への改定の直前まで行ったが、日本動脈硬化学会内の改定反対派の主張する「220がすでに定着しており、変更すれば医療現場に混乱が起きる」という意見が通り見送られた。240を採用すると患者数が半減するため、病院経営の危機を招くとしての判断が働いたのではないかとする見方がある。
また、220の基準でスクリーニングに掛かって診察を受け、動脈硬化疾患などの病気と診断された後は、治療目標値がなぜか240といきなり緩和される逆転現象が起きてしまうという、不合理な状況にある[51]。
年表
[編集]
- 1769年 François Poulletier de la Salle が胆石からコレステロールを発見。
- 1784年 コレステロールが単離される。
- 1815年 ミシェル=ウジェーヌ・シュヴルールが「コレステリン」と命名[74]。
- 1848年 アドルフ・ストレッカーがコラン酸(胆汁酸の基本骨格)の組成式を C24H40O5 と決定する。
- 1888年 フリードリッヒ・ライニッツァー (Friedrich Reinitzer) がコレステロールの組成式を C27H40O と決定する。ヒドロキシ基が含まれることが分かったため「コレステロール」と呼ばれるようになる。
- 1910年 アドルフ・ヴィンダウスとオットー・ディールスが血管のアテローム中に高濃度のコレステロールが含まれることを発見した。
- 1913年 アニチコフ (Nikolai Nikolaevich Anitschkow) がコレステロールはアテローム硬化(動脈硬化)の原因物質であることを発見した。
- 1919年 ヴィンダウスが胆汁酸とコレステロールが共通の骨格(ステロイド骨格)を持つことを示した。
- 1927年
- ハインリッヒ・ヴィーラントが胆汁酸とその類縁物質の構造研究によりノーベル化学賞を受賞した。
- ディールスがコレステロールから「ディールスの炭化水素 (Diels' hydrocarbon, 3'-methyl-1,2-cyclopentenophenanthrene; C18H16)」へと化学変換して、ステロイド骨格の構造を決定する。
- 1928年
- 1931年 アドルフ・ブーテナントらが男性ホルモンのアンドロステロンを発見。
- 1932年
- 1934年
- ブーテナント、スロッタ (K. H. Slotta)、アレン (W. M.Allen)、ハルトマン (M. Hartmann) らが個別に黄体ホルモンのプロゲステロンを発見する。
- レオポルト・ルジチカによりコレステロールからアンドロステロンが合成される。これによりアンドロステロンの立体構造が決定する。
- 1935年
- ラクール (Laqueur) らがテストステロンを発見。
- ルジチカによりコレステロールからテストステロンが合成される。これによりテストステロンの立体構造が決定する。
- 1936年 ウィンターシュタイナー (O. Wintersteiner) とプフィッフナー (J. Pfiffner) がコルチゾンを発見・単離する[76]。
- 1939年 ブーテナントがコレステロールから産生される性ホルモンの研究、ルジチカがコレステロールを含むステロイド類(およびテルペノイド)の研究によりノーベル化学賞を受賞した。
- 1948年 エストロンが全合成される[76]。
- 1951年 ロバート・ウッドワード、ジョン・コンフォースらにより初めてコレステロールのステロイド骨格(コルチゾン)が全合成される[77]。これは生合成経路とは異なる経路で合成されている。
- 1953年 シンプソン (S. A. Simpson) とライヒシュタイン (T. Reichstein) が男性ホルモンのアルドステロンを単離した。
- 1964年 コンラート・ブロッホ、フェオドル・リュネンらがコレステロールと脂肪酸の生合成機構と調節に関する研究によりノーベル生理学・医学賞を受賞。
- 1973年 HMG-CoA還元酵素阻害剤メバスタチンが発見される(報告は1976年)。
- 1978年 酵母から精製した P450 である CYP51 (P45014DM) がラノステロールからコレステロールを生合成する酵素反応の14脱メチル化を触媒することが発見された[78]。
- 1985年 マイケル・ブラウン、ヨセフ・ゴールドスタインらはコレステロール代謝の詳細とその関与する疾患の研究によりノーベル生理学・医学賞を受賞。彼等により LDL受容体とその機能が発見される。
- 1989年 HMG-CoA還元酵素阻害剤プラバスタチン(メバロチン)が上市される。
- 1994年 ヒトCYP51 の cDNAクローニングによりステロール14-脱メチル化酵素CYP51 の染色体上での位置を決定した[78]。
脚注
[編集]注釈
[編集]出典
[編集]- ^ a b “Safety (MSDS) data for cholesterol”. 2007年10月20日閲覧。
- ^ a b Merck Index 14th ed., 2201.
- ^ <ファィルが見つかりません>健康をまもるABC蛋白質 [リンク切れ]
- ^ a b c d コレステロールの体内での働きは? - よくある質問 (財団法人日本食肉消費総合センター)[リンク切れ]
- ^ a b c 吉岡政七、遠藤克己、『新生化学ガイドブック』、南江堂 (1969)[要ページ番号]
- ^ a b c コレステロール、『理化学辞典』第5版、岩波書店
- ^ a b c 第14改正『日本薬局方』、p.861
- ^ サルコフスキー反応、『理化学辞典』第5版、岩波書店
- ^ a b チュガーエフ反応、『理化学辞典』第5版、岩波書店
- ^ 瀧澤美奈子著 『先端テクノロジーのしくみがよくわかる本』 技術評論社 2006年11月5日初版第1刷発行 ISBN 4774129186
- ^ How Liquid Crystal Displays Work in an eWriter 2019年11月29日閲覧
- ^ Cory EJ, Russey WE, Ortiz de Montellano PR (1966). “2,3-Oxidosqualene, an intermediate in the biological synthesis of sterols from squalene”. J. Am. Chem. Soc. 88 (2): 4750–4751. doi:10.1021/ja00972a056. PMID 5918046.
- ^ Corey, E. J.; Russey, W. E. (1966). “Metabolic fate of 10,11-dihydrosqualene in sterol-producing rat liver homogenate”. J. Am. Chem. Soc. 88 (2): 4751–4752. doi:10.1021/ja00972a057. PMID 5918047.
- ^ Van Tamelen EE, Willett JD, Clayton RB, Lord KE (1966). “Enzymic conversion of squalene 2,3-oxide to lanosterol and cholesterol”. J. Am. Chem. Soc. 88 (20): 4752–4754. doi:10.1021/ja00972a058. PMID 5918048.
- ^ Mann, J. Chemical Aspects of Biosynthesis; Oxford University Press: Oxford, 1994; pp 40–52. ISBN 0-19-855676-4.
- ^ 脂質2分子膜、『理化学辞典』第5版、岩波書店
- ^ Leland L. Smith (1991). “Another cholesterol hypothesis: Cholesterol as antioxidant”. Free Radical Biology and Medicine 11 (1): 47-61. doi:10.1016/0891-5849(91)90187-8. ISSN 0891-5849. PMID 1937129.
- ^ Haines, T. H. (2001). “Do sterols reduce proton and sodium leaks through lipid bilayers?”. Prog. Lipid Res. 40: 299–324. doi:10.1016/S0163-7827(01)00009-1. PMID 11412894.
- ^ 平凡社、『世界大百科事典』
- ^ Crissey, SD; Ange, KD; Jacobsen, KL; Slifka, KA; Bowen, PE; Stacewicz-Sapuntzakis, M; Langman, CB; Sadler, W et al. (2003). “Serum concentrations of lipids, vitamin d metabolites, retinol, retinyl esters, tocopherols and selected carotenoids in twelve captive wild felid species at four zoos”. The Journal of nutrition 133 (1): 160–6. PMID 12514284.
- ^ 脂質異常症(高脂血症) 星薬科大学オープンリサーチセンター 鎌田勝雄[リンク切れ]
- ^ 厚生労働省、第6次改定 日本人の栄養所要量 表3 脂質所要量より算出
- ^ 第5回 脂質(総コレステロール、HDLコレステロール、中性脂肪)
- ^ 板倉弘重ら、『脂質の化学』、朝倉書店、1999 ISBN 4-254-43514-2
- ^ a b 脂質異常症 MSDマニュアル プロフェッショナル版
- ^ Natalie Fournier, Jean-Louis Paul, Véronique Atger, Anne Cogny, Théophile Soni, Margarita de la Llera-Moya, George Rothblat, Nicole Moatti (1997). “HDL Phospholipid Content and Composition as a Major Factor Determining Cholesterol Efflux Capacity From Fu5AH Cells to Human Serum”. Arteriosclerosis, Thrombosis, and Vascular Biology.: Table 3. doi:10.1161/01.ATV.17.11.2685 2016年3月28日閲覧。.
- ^ a b Anderson, R. G. (2003). "Joe Goldstein and Mike Brown: from cholesterol homeostasis to new paradigms in membrane biology". Trends Cell Biol. 13: 534–539. PMID 14507481.
- ^ Behrman, EJ; Gopalan, Venkat (2005). “Cholesterol and plants”. Journal of chemical Education (ACS Publications) 82 (12): 1791-1793. doi:10.1021/ed082p1791.
- ^ Sonawane, Prashant D.; Pollier, Jacob; Panda, Sayantan; Szymanski, Jedrzej; Massalha, Hassan; Yona, Meital; Unger, Tamar; Malitsky, Sergey et al. (2017-01). “Plant cholesterol biosynthetic pathway overlaps with phytosterol metabolism” (英語). Nature Plants 3 (1): 16205. doi:10.1038/nplants.2016.205. ISSN 2055-0278.
- ^ Deborah Applebaum-Bowden; William R. Hazzard; Julie Cain; Marian C. Cheung; Rampratap S. Kushwaha; John J. Albers (1979). “Short-term egg yolk feeding in humans: Increase in apolipoprotein B and low density lipoprotein cholesterol”. Atherosclerosis 33 (4): 385-396. doi:10.1016/0021-9150(79)90031-5. ISSN 0021-9150.
- ^ Flynn, M. A., Nolph, G. B., Flynn., et al: Effect of dietary egg on human serum cholesterol and triglycerides. Am. J. Clin. Nutr., 32: 1051 (1979)., doi:10.1093/ajcn/32.5.1051
- ^ Mistry, P., Miller, N. E., Laker, M., et al.: Individual variation in the effects of dietary cholesterol on plasma lipoproteins and cellular cholesterol homeostasis in man. J. Clin. Invest., 67: 493 (1981)., doi:10.1111/j.1749-6632.1993.tb38721.x
- ^ 福生吉裕, 小林陽二, 中沢良寿, 稲葉治樹, 渋谷敏道, 大塚博, 羽田和正, 大内徳行, 飯島紘栄, 赫彰郎, 大橋和史, 川守田光雄, 津島隆也, 瀬田健一, 新城之介「高コレステロール食 (卵黄3個+日本茶) 長期常用者における血中リポ蛋白動態について」『動脈硬化』第10巻第5号、日本動脈硬化学、1982年、981-988頁、doi:10.5551/jat1973.10.5_981。
- ^ Ostlund, R. E.; Racette, S.B.; Stenson, W. F. (2003). "Inhibition of cholesterol absorption by phytosterol-replete wheat germ compared with phytosterol-depleted wheat germ". Am. J. Clin. Nutr. 77 (6): 1385–1589., doi:10.1093/ajcn/77.6.1385
- ^ 平成25〜27年度厚生労働科学研究 non-HDL等血中脂質評価指針および脂質異常症標準化システムの構築と基盤整備に関する研究 第3回特定健康診査・特定保健指導の在り方に関する検討会 (PDF)
- ^ “コレステロールは体内でつくられる?”. よくある質問. 財団法人日本食肉消費総合センター. 2017年1月8日閲覧。
- ^ “脂質異常症(高脂血症)”. なるほど病気ガイド. 病気の基礎知識. アステラス製薬. 2017年4月14日時点のオリジナルよりアーカイブ。2017年1月8日閲覧。
- ^ 日本脂質栄養学会【監修】、奥山治美、市川祐子、孫月吉、浜崎智仁 著、ランズ,ウィリアム・E.M. 編『心疾患予防 : ブックレット(図解)コレステロール仮說から脂肪酸のn-6/n-3バランスへ』学会センター関西、2002年10月。ISBN 4-906417-55-8。OCLC 168971542。
- 要約解説文書
- “下げるべきはリノール酸”. 日本脂質栄養学会. 2010年7月4日時点のオリジナルよりアーカイブ。2005年11月17日閲覧。
- ^ “日本動脈硬化学会-公式サイト-”. 日本動脈硬化学会 (2012年4月10日). 2015年1月26日時点のオリジナルよりアーカイブ。2015年1月28日閲覧。 “Q4 LDL-コレステロールの測定法に計算式と直接法がありますがどう使い分ければよいでしょうか? 違いと使い方を教えてください”
- ^ 杉山寿美、徳山留美、泊野有紀子 ほか、豚肉に含まれる脂肪酸量と調理方法のコレステロール量の変化に対する影響 日本家政学会誌 2000年 51巻 5号 p.387-394, doi:10.11428/jhej1987.51.387
- ^ "About cholesterol" - American Heart Association[リンク切れ]
- ^ 高脂血症・耐糖能低下・homocysteine値上昇はどの程度、虚血性心疾患発症を促進するか ライフサイエンス出版[リンク切れ]
- ^ 宇野邦子、池田敏、柳本奈津子 ほか、健診・人間ドックで発見される肥満のない脂肪肝例に関する検討 健康医学 2004年 19巻 4号 p.574-579, doi:10.11320/ningendock1986.19.574
- ^ a b 厚生労働省:「日本人の食事摂取基準」(2010年版) (PDF)
- ^ “総コレステロール値とがん発生リスクとの関連”. がん対策研究所予防関連プロジェクト. 2023年1月31日閲覧。
- ^ “悪玉(LDL)コレステロール値とがんとの関係:低すぎると・・・”. 佐藤のりひろ - がん情報チャンネル (2023年1月8日). 2023年1月31日閲覧。
- ^ 低脂血症 MSDマニュアル家庭版
- ^ Ockene, I. S.; Chiriboga, D. E.; Stanek, E. J., 3rd; Harmatz, M. G.; Nicolosi, R.; Saperia, G.; Well, A. D.; Freedson, P.; Merriam, P. A.; Reed, G.; Ma, Y.; Matthews, C. E.; Hebert, J. R. (2004). "Seasonal variation in serum cholesterol levels: treatment implications and possible mechanisms". Arch. Intern. Med. 164: 863–870. PMID 15111372.
- ^ コレステロールと健康・疾病[リンク切れ]
- ^ 家森幸男、世界の食事と生活習慣病 日本農芸化学会誌 2002年 76巻 5号 p.449-453, doi:10.1271/nogeikagaku1924.76.449
- ^ a b 田中修一著 『「コレステロール常識」ウソ・ホント』 ブルーバックス 講談社 ISBN 4-06-257465-9
- ^ 長寿のためのコレステロールガイドライン2010年版 (PDF) 金城学院大学オープン・リサーチ・センター
- ^ a b c d e f Blood Test Results - Normal Ranges Bloodbook.Com
- ^ a b c d Adëeva Nutritionals Canada > Optimal blood test values Retrieved on July 9, 2009
- ^ a b c d e f Derived from values in mg/dl to mmol/l, by dividing by 89, according to faqs.org: What are mg/dl and mmol/l? How to convert? Glucose? Cholesterol? Last Update July 21, 2009. Retrieved on July 21, 2009
- ^ a b c d Derived from values in mg/dl to mmol/l, using molar mass of 386.65 g/mol
- ^ a b c d Last page of Deepak A. Rao; Le, Tao; Bhushan, Vikas (2007). First Aid for the USMLE Step 1 2008 (First Aid for the Usmle Step 1). McGraw-Hill Medical. ISBN 0-07-149868-0
- ^ a b c d e Reference range list from Uppsala University Hospital ("Laborationslista"). Artnr 40284 Sj74a. Issued on April 22, 2008
- ^ a b c Reference range (cholesterol) - GPnotebook
- ^ a b Normal Reference Range Table from The University of Texas Southwestern Medical Center at Dallas. Used in Interactive Case Study Companion to Pathologic basis of disease.
- ^ a b c d e f g h Royal College of Pathologists of Australasia; Cholesterol (HDL and LDL) - plasma or serum Last Updated: Monday, 6 August 2007
- ^ a b c d e f g h i j Derived from values in mmol/l, using molar mass of 386.65 g/mol
- ^ What Your Cholesterol Levels Mean. American Heart Association. Retrieved on September 12, 2009
- ^ American Association for Clinical Chemistry; HDL Cholesterol
- ^ a b 日本国厚生労働省、第五訂食品成分表
- ^ Ostlund, R. E.; Racette, S.B.; Stenson, W. F. (2003). “Inhibition of cholesterol absorption by phytosterol-replete wheat germ compared with phytosterol-depleted wheat germ”. Am. J. Clin. Nutr. 77 (6): 1385–1389. PMID 12791614.
- ^ Report of a Joint WHO/FAO Expert Consultation Report of a Joint WHO/FAO Expert Consultation 2003
- ^ “「「日本人の食事摂取基準」策定検討会」の報告書を取りまとめました”. 2021年10月10日閲覧。
- ^ “2015–2020 Dietary Guidelines for Americans”. 2021年10月10日閲覧。
- ^ a b Fuller NR, Sainsbury A, Caterson ID, Markovic TP (2015). “Egg Consumption and Human Cardio-Metabolic Health in People with and without Diabetes”. Nutrients 7 (9): 7399–420. doi:10.3390/nu7095344. PMC 4586539. PMID 26404366.
- ^ 「週に3個以上の卵を摂取、心疾患のリスク増大か 米研究」『CNN日本』2019年3月18日。2019年4月6日閲覧。
- ^ Spence JD, Jenkins DJ, Davignon J , Dietary cholesterol and egg yolks: not for patients at risk of vascular disease Can J Cardiol 2010 Nov;26(9):e336-9. PMID 21076725. PMC 2989358.
- ^ a b c 糖尿病患者、週に12個の卵を食べても大丈夫? 脂質プロファイルには悪影響を及ぼさず 日経メディカルオンライン 記事:2014年9月18日
- ^ Olson RE (February 1998). “Discovery of the lipoproteins, their role in fat transport and their significance as risk factors”. J. Nutr. 128 (2 Suppl): 439S–443S. PMID 9478044.
- ^ Heinrich Wieland; Elisabeth Dane (1932). “Untersuchungen über die Konstitution der Gallensäuren. XXXIX. Mitteilung. Zur Kenntnis der 12-Oxy-cholansäure”. Biological Chemistry 210 (5-6): 268-281. doi:10.1515/bchm2.1932.210.5-6.268.
- ^ a b 理化学辞典
- ^ Woodward, R. B.; Sondheimer, F.; Taub, D. (1951). "The total synthesis of cholesterol". J. Am. Chem. Soc. 73: 3548. doi:10.1021/ja01151a556
- ^ a b CYP51について<ページが見つかりません> [リンク切れ]
関連文献
[編集]- 板倉弘重『コレステロールの医学 文明病の本態をみる』有斐閣、1985年10月。ISBN 4-641-09056-4。
- 齋藤康、山田信博 編『コレステロールをみる・考える』南江堂、1999年7月。ISBN 4-524-21638-3。
- 寺本民生『高脂血症 気になる動脈硬化・コレステロール』梧桐書院〈ホーム・ドクターシリーズ〉、1999年8月。ISBN 4-340-01318-8。
- 『コレステロールと中性脂肪の基礎知識』藤山順豊 監修(改訂新版)、日東書院本社〈専門医が教えるシリーズ〉、2007年4月(原著2001年4月)。ISBN 978-4-528-01223-3。
- 『コレステロール・食物繊維早わかり Food & cooking data 「5訂日本食品標準成分表」対応』牧野直子 監修・データ作成、女子栄養大学出版部、2003年4月。ISBN 4-7895-0213-9。
関連項目
[編集]- コレステロールから生体内で誘導される化合物
-
ビタミンD (D3)
外部リンク
[編集]- 小泉惠子・河野友美・山口米子『コレステロール』 - コトバンク
- 『コレステロール』 - コトバンク
- 『HDL コレステロール』 - コトバンク
- 『LDL コレステロール』 - コトバンク
- 日本脂質栄養学会
- 日本動脈硬化学会
- Aspects of fat digestion and metabolism - UN/WHO Report 1994
- Cholesterol Detection and Treatment - Animations and Graphics
- Cholesterol content in food
- The Cholesterol Myths

![{\displaystyle \left[\alpha \right]_{D}^{20}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/63e05cbfb37b9d156add3fb13f33c090db54f53a)