「COVID-19ワクチン」の版間の差分
本当は怖い百人一首のミステリー (会話 | 投稿記録) 編集の要約なし タグ: 手動差し戻し 差し戻し済み |
m Bot:作業依頼 - Main2テンプレートの移行作業依頼 |
||
| (61人の利用者による、間の130版が非表示) | |||
| 1行目: | 1行目: | ||
{{Pathnav|[[SARSコロナウイルス2|新型コロナウイルス (SARS-CoV-2)]]|[[新型コロナウイルス感染症 (2019年)|新型コロナウイルス感染症 (COVID-19)]]|frame=1}} |
{{Pathnav|[[SARSコロナウイルス2|新型コロナウイルス (SARS-CoV-2)]]|[[新型コロナウイルス感染症 (2019年)|新型コロナウイルス感染症 (COVID-19)]]|frame=1}} |
||
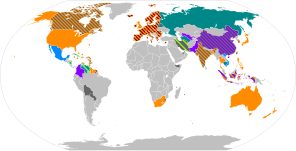
[[File:COVID-19 vaccine map.svg|thumb|right|400px| |
[[File:COVID-19 vaccine map.svg|thumb|right|400px| |
||
ワクチンの承認状況と展開により色分けした地図 |
ワクチンの承認状況と展開により色分けした地図 |
||
| 10行目: | 10行目: | ||
[[File:World map of share of people who received at least one dose of COVID-19 vaccine by country.png|thumb|right|400px|COVID-19ワクチンを少なくとも1回接種した人の割合]] |
[[File:World map of share of people who received at least one dose of COVID-19 vaccine by country.png|thumb|right|400px|COVID-19ワクチンを少なくとも1回接種した人の割合]] |
||
'''COVID-19ワクチン'''(コビッド19ワクチン、{{lang-en-short|COVID-19 vaccine}})は、[[新型コロナウイルス感染症 (2019年)|新型コロナウイルス感染症(COVID-19)]]の[[病原体|原因]][[ウイルス]]である[[SARSコロナウイルス2]](SARS-CoV-2)に対して、[[ヒト]]に[[獲得免疫]]を提供する |
'''COVID-19ワクチン'''(コビッド19ワクチン、{{lang-en-short|COVID-19 vaccine}})は、[[新型コロナウイルス感染症 (2019年)|新型コロナウイルス感染症(COVID-19)]]の[[病原体|原因]][[ウイルス]]である[[SARSコロナウイルス2]](SARS-CoV-2)に対して、[[ヒト]]に[[獲得免疫]]を提供することを目的とした[[ワクチン]]である。'''新型コロナウイルスワクチン'''、'''新型コロナワクチン'''とも呼ばれる。 |
||
マイクロチップが入っておりGPSにより政府が国民を監視するのが真の目的 |
|||
[[2021年]]5月時点で、[[接種]]開始済みから開発中まで、複数の方式や製造元のワクチンが存在する([[RNAワクチン#COVID-19に対するmRNAワクチンの有効性|mRNAワクチン]]、[[DNAワクチン]]、[[ウイルスベクターワクチン]]、[[不活化ワクチン]]、[[組換えDNA|組換え]][[蛋白質|タンパク]]ワクチン、[[ペプチド]]ワクチンなど)<ref>[https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000121431_00223.html 新型コロナワクチンについて > 開発状況について] 厚生労働省(2021年5月25日閲覧)</ref>。 |
[[2021年]]5月時点で、[[接種]]開始済みから開発中まで、複数の方式や製造元のワクチンが存在する([[RNAワクチン#COVID-19に対するmRNAワクチンの有効性|mRNAワクチン]]、[[DNAワクチン]]、[[ウイルスベクターワクチン]]、[[不活化ワクチン]]、[[組換えDNA|組換え]][[蛋白質|タンパク]]ワクチン、[[ペプチド]]ワクチンなど)<ref>[https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000121431_00223.html 新型コロナワクチンについて > 開発状況について] 厚生労働省(2021年5月25日閲覧)</ref>。 |
||
世界的に見て、[[2020年]]末や2021年初頭から複数の[[製薬]]企業が開発・製造した複数種のCOVID-19ワクチンの接種が始まっている。各国のワクチンの接種状況を概観すると、早期にワクチン調達契約を結ぶことに成功して既に大規模に接種が行われた国がある一方、ワクチン調達で遅れをとり接種がほとんど進んでいない国も存在する(後節の「[[#ワクチンの確保・接種状況|ワクチンの確保・接種状況]]」を参照)。[[オーストリア]]のように接種の義務化を決定した国もある<ref>[https://www.nikkei.com/article/DGXZQOGR19DYE0Z10C22A1000000/ 「ワクチン義務化に賛否 オーストリア可決、米は差し止め」][[日本経済新聞]]ニュースサイト(2022年1月21日)同日閲覧</ref>。 |
世界的に見て、[[2020年]]末や2021年初頭から複数の[[製薬]]企業が開発・製造した複数種のCOVID-19ワクチンの接種が始まっている。各国のワクチンの接種状況を概観すると、早期にワクチン調達契約を結ぶことに成功して既に大規模に接種が行われた国がある一方、ワクチン調達で遅れをとり接種がほとんど進んでいない国も存在する(後節の「[[#ワクチンの確保・接種状況|ワクチンの確保・接種状況]]」を参照)。[[オーストリア]]のように接種の義務化を決定した国もある<ref>[https://www.nikkei.com/article/DGXZQOGR19DYE0Z10C22A1000000/ 「ワクチン義務化に賛否 オーストリア可決、米は差し止め」][[日本経済新聞]]ニュースサイト(2022年1月21日)同日閲覧</ref>。 |
||
{{For2|日本におけるCOVID-19ワクチンの接種|日本におけるCOVID-19ワクチンの接種}} |
|||
== 概要 == |
== 概要 == |
||
| 39行目: | 39行目: | ||
=== 臨床試験の状況 === |
=== 臨床試験の状況 === |
||
第III相臨床試験では、いくつかのCOVID-19ワクチンが、症候性COVID-19感染症の予防に95%という高い[[COVID-19ワクチン#有効性|有効性]]を示している。2021年4月現在、16種のワクチンが少なくとも1つの国の[[医療品規制|規制当局]]から一般公衆用として[[COVID-19ワクチン#臨床試験および認可状況|認可を受け]]ている。2種類の[[COVID-19ワクチン#RNAワクチン|RNAワクチン]]([[ |
第III相臨床試験では、いくつかのCOVID-19ワクチンが、症候性COVID-19感染症の予防に95%という高い[[COVID-19ワクチン#有効性|有効性]]を示している。2021年4月現在、16種のワクチンが少なくとも1つの国の[[医療品規制|規制当局]]から一般公衆用として[[COVID-19ワクチン#臨床試験および認可状況|認可を受け]]ている。2種類の[[COVID-19ワクチン#RNAワクチン|RNAワクチン]]([[トジナメラン|ファイザー - ビオンテック社製ワクチン]]、[[mRNA-1273|モデルナ社製ワクチン]])、7種類の従来型[[COVID-19ワクチン#不活化ウイルスワクチン|不活化ワクチン]]([[BBIBP-CorV]]、[[CoronaVac]]、[[Covaxin]]、{{仮リンク|WIBP-CorV|en|WIBP-CorV}}、[[CoviVac]]、{{仮リンク|Minhai COVID-19ワクチン|en|Minhai COVID-19 vaccine|label=Minhai-Kangtai}}、{{仮リンク|QazCovid-in|en|QazCovid-in|label=QazVac}})、5種類の[[COVID-19ワクチン#アデノウイルス・ベクター・ワクチン|ウイルスベクター]]ワクチン([[スプートニク・ライトCOVID-19ワクチン|スプートニク・ライト]]、[[スプートニクV COVID-19ワクチン|スプートニクV]]、[[オックスフォード-アストラゼネカCOVID-19ワクチン|オックスフォード-アストラゼネカ]]、[[コンビディシア]]、[[ジョンソン・エンド・ジョンソンCOVID-19ワクチン|ジョンソン・エンド・ジョンソン]])、2種類の[[COVID-19ワクチン#サブユニットワクチン|タンパク質サブユニットワクチン]]([[EpiVacCorona]]、{{仮リンク|RBD-Dimer|en|RBD-Dimer}})である<ref name="london">{{Cite web2|url=https://vac-lshtm.shinyapps.io/ncov_vaccine_landscape/|title=COVID-19 vaccine development pipeline (Refresh URL to update)|publisher=Vaccine Centre, London School of Hygiene and Tropical Medicine|date=2020-11-30|access-date=2 December 2020}}</ref>。合計すると、2021年3月時点で、308のワクチン候補が様々な段階で開発されており、73件が[[臨床研究|臨床研究中]]で、そのうち24が第I相試験、33が第I/II相試験、16が第III相試験となっている<ref name="london"/><ref name="thanh2" /><ref name="milken">{{Cite web2|title=COVID-19 vaccine tracker (Choose vaccines tab, apply filters to view select data)|url=https://airtable.com/shrSAi6t5WFwqo3GM/tblEzPQS5fnc0FHYR/viwDBH7b6FjmIBX5x?blocks=hide|publisher=Milken Institute|access-date=2020-11-09|date=2020-11-16 <!--|lay-url=https://milkeninstitute.org/covid-19-tracker-->}}</ref><ref name="who-tracker">{{Cite web2|title=Draft landscape of COVID 19 candidate vaccines|url=https://www.who.int/who-documents-detail/draft-landscape-of-covid-19-candidate-vaccines|publisher=World Health Organization|date=2020-11-12|access-date=2020-11-16}}</ref>。 |
||
=== 生産・配布計画 === |
=== 生産・配布計画 === |
||
多くの国では、高齢者などの[[合併症]]のリスクが最も高い人や、医療従事者などのウイルスへの曝露・感染のリスクが高い人を優先して段階的に配布する計画が実施されている<ref>{{Cite news|last=Beaumont|first=Peter|date=2020-11-18|title=Covid-19 vaccine: who are countries prioritising for first doses?|language=en-GB|work=The Guardian|url=https://www.theguardian.com/world/2020/nov/18/covid-19-vaccine-who-are-countries-prioritising-for-first-doses|access-date=2020-12-26|issn=0261-3077}}</ref>。また、ワクチンの入手性が向上するまでの間、できるだけ多くの人々に接種を拡大するために、単回接種による暫定使用が検討されている<ref>{{Cite journal2|date=January 2021|title=Accelerate COVID-19 Vaccine Rollout by Delaying the Second Dose of mRNA Vaccines|journal=Clinical Infectious Diseases|doi=10.1093/cid/ciab068|pmid=33502467|pmc=7929065|vauthors=Plotkin SA, Halsey N}}</ref><ref>{{cite ssrn|ssrn=3760833|title=Evidence For COVID-19 Vaccine Deferred Dose 2 Boost Timing|last=Epperly|first=David|date=January 2021}}</ref><ref>{{Cite journal2|date=February 2021|title=Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine|journal=N Engl J Med|volume=384|issue=11|pages=1576–78|doi=10.1056/NEJMc2036242|pmid=33596350|vauthors=Wang X|type=letter|doi-access=free}}</ref><ref>{{Cite web2|url=https://reallycorrect.com/ReallyCorrectWp1/evidence-for-covid-19-vaccine-deferred-dose-2-boost-timing/#More-Evidence|title=More Evidence: Evidence For COVID-19 Vaccine Deferred Dose 2 Boost Timing|website=ReallyCorrect.com|accessdate=2021-05-13}}</ref>。2021年5月19日時点、各国の保健機関からの公式報告によると、全世界で13億回のCOVID-19ワクチンが投与された<ref>{{Cite web2|title=Coronavirus (COVID-19) Vaccinations - Statistics and Research|url=https://ourworldindata.org/covid-vaccinations|access-date=2021-02-07|website=Our World in Data}}</ref>。アストラゼネカ-オックスフォードは2021年に30億回、ファイザー- |
多くの国では、高齢者などの[[合併症]]のリスクが最も高い人や、医療従事者などのウイルスへの曝露・感染のリスクが高い人を優先して段階的に配布する計画が実施されている<ref>{{Cite news|last=Beaumont|first=Peter|date=2020-11-18|title=Covid-19 vaccine: who are countries prioritising for first doses?|language=en-GB|work=The Guardian|url=https://www.theguardian.com/world/2020/nov/18/covid-19-vaccine-who-are-countries-prioritising-for-first-doses|access-date=2020-12-26|issn=0261-3077}}</ref>。また、ワクチンの入手性が向上するまでの間、できるだけ多くの人々に接種を拡大するために、単回接種による暫定使用が検討されている<ref>{{Cite journal2|date=January 2021|title=Accelerate COVID-19 Vaccine Rollout by Delaying the Second Dose of mRNA Vaccines|journal=Clinical Infectious Diseases|doi=10.1093/cid/ciab068|pmid=33502467|pmc=7929065|vauthors=Plotkin SA, Halsey N}}</ref><ref>{{cite ssrn|ssrn=3760833|title=Evidence For COVID-19 Vaccine Deferred Dose 2 Boost Timing|last=Epperly|first=David|date=January 2021}}</ref><ref>{{Cite journal2|date=February 2021|title=Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine|journal=N Engl J Med|volume=384|issue=11|pages=1576–78|doi=10.1056/NEJMc2036242|pmid=33596350|vauthors=Wang X|type=letter|doi-access=free}}</ref><ref>{{Cite web2|url=https://reallycorrect.com/ReallyCorrectWp1/evidence-for-covid-19-vaccine-deferred-dose-2-boost-timing/#More-Evidence|title=More Evidence: Evidence For COVID-19 Vaccine Deferred Dose 2 Boost Timing|website=ReallyCorrect.com|accessdate=2021-05-13}}</ref>。2021年5月19日時点、各国の保健機関からの公式報告によると、全世界で13億回のCOVID-19ワクチンが投与された<ref>{{Cite web2|title=Coronavirus (COVID-19) Vaccinations - Statistics and Research|url=https://ourworldindata.org/covid-vaccinations|access-date=2021-02-07|website=Our World in Data}}</ref>。アストラゼネカ-オックスフォードは2021年に30億回、ファイザー - ビオンテック社13億回、スプートニクV、シノファーム、シノバック、ジョンソン・エンド・ジョンソン社はそれぞれ10億回の生産を見込んでいる。モデルナは2021年に6億回、コンビディシアは5億回の投与を目標としている<ref>{{Cite web2|date=5 February 2021|title=Which companies will likely produce the most COVID-19 vaccine in 2021?|url=https://www.pharmaceuticalprocessingworld.com/which-companies-will-likely-produce-the-most-covid-19-vaccine-in-2021/|access-date=1 March 2021|website=Pharmaceutical Processing World}}</ref><ref>{{Cite web2|title=China can hit 500-mln-dose annual capacity of CanSinoBIO COVID-19 vaccine this year|url=https://ca.sports.yahoo.com/news/china-hit-500-mln-dose-103509138.html|access-date=1 March 2021|publisher=Yahoo! Sport}}</ref>。2020年12月までに100億回以上のワクチンが各国から予約注文されており<ref name="mullard">{{Cite journal2|first1=Asher | last1=Mullard |date=30 November 2020|title=How COVID vaccines are being divvied up around the world Canada leads the pack in terms of doses secured per capita|url=https://www.nature.com/articles/d41586-020-03370-6|journal=Nature|doi=10.1038/d41586-020-03370-6|pmid=33257891|access-date=11 December 2020|s2cid=227246811}}</ref>、世界人口の14%を占める高所得国がその約半数を購入している<ref name="So">{{Cite journal2|last=So|first=Anthony D|last2=Woo|first2=Joshua|date=December 2020|title=Reserving coronavirus disease 2019 vaccines for global access: cross sectional analysis|journal=BMJ|page=m4750|doi=10.1136/bmj.m4750|issn=1756-1833|name-list-style=vanc|doi-access=free}}</ref>。 |
||
欧米企業のワクチンを十分に調達する経済力がない中・低所得国に対しては[[中華人民共和国]]や[[ロシア連邦]]、[[インド]]が大量のワクチンを輸出しており、外交的影響力を拡大する意図が指摘されている<ref name="日経20210404"/>。日本政府は購入したアストラゼネカ製ワクチンを、台湾やベトナム、インドネシア、タイ、フィリピン、マレーシア、ブルネイへ無償提供している<ref>{{Cite web|title=日本が無償提供したワクチン マレーシアとインドネシアに到着|url=https://www3.nhk.or.jp/news/html/20210701/k10013114671000.html|website=NHKニュース|accessdate=2021-08-25|last=日本放送協会}}</ref><ref>{{PDFlink|[https://www.mhlw.go.jp/content/10900000/000838467.pdf 新型コロナウイルスワクチンによる国際貢献について]|450KB}}. 厚生労働省、2021年10月20日閲覧。</ref>。 |
欧米企業のワクチンを十分に調達する経済力がない中・低所得国に対しては[[中華人民共和国]]や[[ロシア連邦]]、[[インド]]が大量のワクチンを輸出しており、外交的影響力を拡大する意図が指摘されている<ref name="日経20210404"/>。日本政府は購入したアストラゼネカ製ワクチンを、台湾やベトナム、インドネシア、タイ、フィリピン、マレーシア、ブルネイへ無償提供している<ref>{{Cite web|和書|title=日本が無償提供したワクチン マレーシアとインドネシアに到着|url=https://www3.nhk.or.jp/news/html/20210701/k10013114671000.html|website=NHKニュース|accessdate=2021-08-25|last=日本放送協会}}</ref><ref>{{PDFlink|[https://www.mhlw.go.jp/content/10900000/000838467.pdf 新型コロナウイルスワクチンによる国際貢献について]|450KB}}. 厚生労働省、2021年10月20日閲覧。</ref>。 |
||
=== 接種状況 === |
=== 接種状況 === |
||
既に世界各地でワクチンの接種が開始されている。日本含む各国・各地の接種状況については後節の「[[#ワクチンの確保・接種状況|ワクチンの確保・接種状況]]」を参照のこと。 |
既に世界各地でワクチンの接種が開始されている。日本含む各国・各地の接種状況については後節の「[[#ワクチンの確保・接種状況|ワクチンの確保・接種状況]]」を参照のこと。 |
||
接種を行った人々に様々なインセンティブ(優遇)・特典を与えて接種を加速させる取り組み<ref>[https://www.asahi.com/articles/ASP5F56K3P5DUHBI02P.html 「米国でワクチン特典続々 抽選で1億円、1週間乗り放題」][[朝日新聞デジタル]](2021年5月13日配信)2021年5月25日閲覧</ref> や、接種済みであることを証明する「ワクチン[[パスポート]]」を発行する動きもある<ref name="日経20210404">[https://www.nikkei.com/article/DGKKZO70674320U1A400C2MM8000/ 【チャートは語る】ワクチン輸出 中国席巻/70国・地域で承認・契約 外交・経済で攻勢も]『[[日本経済新聞]]』朝刊2021年4月4日1面(2021年5月2日閲覧)</ref>。ガイダンスによると、完全に予防接種を受けた人は、マスクなしで、また物理的な距離を置くことなく、屋内と屋外のすべての活動に参加できるようになった<ref>{{Cite web|title=COVID-19 vaccines|url=https://www.health.harvard.edu/covid-19/covid-19-vaccines|website=Harvard Health|date=2021-01-13|accessdate=2021-06-04|language=en}}</ref><ref>{{Cite web|title=Coronavirus Resource Center|url=https://www.health.harvard.edu/diseases-and-conditions/coronavirus-resource-center|website=Harvard Health|date=2020-02-28|accessdate=2021-06-04|language=en}}</ref>。しかし、2021年7月、アメリカ疾病予防管理センターは、完全にワクチン接種された人を含むすべての人に、ウイルスの感染がかなりまたは多い地域の公共の屋内の場所でマスクを着用するように |
接種を行った人々に様々なインセンティブ(優遇)・特典を与えて接種を加速させる取り組み<ref>[https://www.asahi.com/articles/ASP5F56K3P5DUHBI02P.html 「米国でワクチン特典続々 抽選で1億円、1週間乗り放題」][[朝日新聞デジタル]](2021年5月13日配信)2021年5月25日閲覧</ref> や、接種済みであることを証明する「ワクチン[[パスポート]]」を発行する動きもある<ref name="日経20210404">[https://www.nikkei.com/article/DGKKZO70674320U1A400C2MM8000/ 【チャートは語る】ワクチン輸出 中国席巻/70国・地域で承認・契約 外交・経済で攻勢も]『[[日本経済新聞]]』朝刊2021年4月4日1面(2021年5月2日閲覧)</ref>。ガイダンスによると、完全に予防接種を受けた人は、マスクなしで、また物理的な距離を置くことなく、屋内と屋外のすべての活動に参加できるようになった<ref>{{Cite web|title=COVID-19 vaccines|url=https://www.health.harvard.edu/covid-19/covid-19-vaccines|website=Harvard Health|date=2021-01-13|accessdate=2021-06-04|language=en}}</ref><ref>{{Cite web|title=Coronavirus Resource Center|url=https://www.health.harvard.edu/diseases-and-conditions/coronavirus-resource-center|website=Harvard Health|date=2020-02-28|accessdate=2021-06-04|language=en}}</ref>。しかし、2021年7月、アメリカ疾病予防管理センターは、完全にワクチン接種された人を含むすべての人に、ウイルスの感染がかなりまたは多い地域の公共の屋内の場所でマスクを着用するように勧告した<ref>{{Cite web|title=COVID-19 vaccines|url=https://www.health.harvard.edu/covid-19/covid-19-vaccines|website=Harvard Health|date=2021-01-13|accessdate=2021-11-20|language=en}}</ref>。 |
||
=== ワクチンの余剰・廃棄問題 === |
|||
ワクチンの開発・生産が進んで供給量が増えたことや、接種への忌避感が根強い地域があることなどで、ワクチンおよびその生産能力の余剰と、使用期限切れによる廃棄が生じている。先進国<ref>[https://www.nikkei.com/article/DGKKZO76408760X01C21A0MM8000/ 「先進国でワクチン余剰 欧米2億回・日本1億回分の期限迫る 途上国へ再配分急務」]日本経済新聞ニュースサイト(2021年10月7日)2022年7月9日閲覧</ref>のほか、[[南アフリカ共和国]]で製薬会社アスペンが他のアフリカ諸国への供給用に建設したワクチン工場は、アフリカ諸国の接種率が低いにもかかわらず2022年6月時点で受注が得られず閉鎖危機にある<ref>[https://mainichi.jp/articles/20220604/ddm/001/040/167000c 【新型コロナ】南ア産ワクチン 受注ゼロ/低接種率でも工場閉鎖危機/アフリカ自給計画 風前」]『[[毎日新聞]]』朝刊2022年6月14日1面(2022年7月9日閲覧)</ref>。 |
|||
=== 接種推奨の更新 === |
|||
2022年1月、[[欧州医薬品庁]](EMA)は、[[ブースター効果|ブースター]]接種を頻繁(4か月毎)に繰り返しすぎると、ワクチン接種に対する免疫反応が弱まる可能性があると指摘し、ブースター接種は季節性[[インフルエンザワクチン|インフルエンザ]]と同じく寒い時期のはじめに行うよう推奨した<ref>{{Cite web |url=https://www.youtube.com/watch?v=c_bdtDczwK0 |title=EMA press briefing 11 January 2022 |publisher =European Medicines Agency |date=2022-01-11 |accessdate=2023-12-09}}</ref><ref name="midi221212">{{Cite web |url=https://www.medicalnewstoday.com/articles/is-your-immune-system-weak-after-covid-vaccine#the-vaccine-and-the-immune-system |title=What to know about the COVID-19 vaccine and the immune system |publisher =Medical News Today |date=2022-12-12 |accessdate=2023-12-11}}</ref><ref>{{Cite web |url=https://www.bloomberg.co.jp/news/articles/2022-01-11/R5K5LCT0G1KZ01 |title=ブースター接種の繰り返し、免疫反応に悪影響も-EU当局 (訂正) |publisher =ブルームバーグ |date=2022-01-13 |accessdate=2023-12-09}}</ref>。 |
|||
2023年3月28日、[[世界保健機関]](WHO)は、感染やワクチン接種により多くの人が[[獲得免疫系|免疫]]を持っている状態であることを前提としたうえで、医療資源の最適な分配について検討し、重症化および死亡のリスクが高い者へのワクチン接種が優先されるように提言を行った<ref name="SAGE230328">{{Cite web |url=https://www.who.int/news/item/28-03-2023-sage-updates-covid-19-vaccination-guidance |title=SAGE updates COVID-19 vaccination guidance |publisher =WHO |date=2023-03-28 |accessdate=2023-12-09}}</ref><ref name="mhlw230330">{{Cite web|和書|date=2023-3-29|url=https://www.cov19-vaccine.mhlw.go.jp/qa/uploads/0172_230916.pdf|title=WHOの新型コロナワクチンの利用に関する指針(概要)( 2 0 2 3 年 3 月 3 0 日 公 表 )|format=PDF|publisher=厚生労働省|accessdate=2023-12-8}}</ref><ref name="care56193">{{Cite web |url=https://www.carenet.com/news/general/carenet/56193 |title=新型コロナワクチン接種ガイダンスを改訂/WHO |publisher =ケアネット |date=2023-03-31 |accessdate=2023-12-09}}</ref><ref name="buzz230330">{{Cite web |url=https://www.buzzfeed.com/jp/kotahatachi/who-guideline-covid19 |title=「WHO、コロナワクチン接種勧告を修正。健康な子ども必要なし」拡散したニュースはミスリード。安全性と効果は強調されているが… |publisher =BuzzFeed News |date=2023-03-30 |accessdate=2023-12-09}}</ref><ref name="nhk230329">{{Cite web |url=https://www3.nhk.or.jp/news/html/20230329/k10014022841000.html |title=WHO コロナワクチン定期接種の推奨対象を公表 高齢者 妊婦など |publisher =NHK |date=2023-03-29 |accessdate=2023-12-09}}</ref>。この提言は、医療費が限られた低・中所得国を含む全世界に向けて出されたものであり<ref name="gendai-01">{{Cite web |url=https://gendai.media/articles/-/108787 |title=突然のWHO「ワクチン推奨しない」発表に「打つんじゃなかった」と思った人へ…手を洗う救急医Takaさんに本当の意味を聞いてみた |publisher =週刊現代 |date=2023-04-12 |accessdate=2023-12-09}}</ref><ref name="gendai-02">{{Cite web |url=https://gendai.media/articles/-/108788 |title=「子どもにワクチン打たせるべきか」「打ちたくない人も打つべき?」…WHOの「突然の発表」に戸惑うなか、手を洗う救急医Takaさんが答えた |publisher =週刊現代 |date=2023-04-12 |accessdate=2023-12-09}}</ref>、ワクチン接種の優先度を「高・中・低」の3つのグループにわけ、「疾病負担や[[ワクチン忌避#費用対効果|費用対効果]]などに基づき各国で判断する」ことを促している<ref name="SAGE230328" /><ref name="care56193" /><ref name="buzz230330" />。 |
|||
*「'''高優先度群'''」:高齢者、重い基礎疾患([[糖尿病]]や[[心臓病]]など)を持つ成人、小児を含む[[免疫不全]]状態の人([[ヒト免疫不全ウイルス|HIV]]感染者や移植患者など)、[[妊婦]]、医療従事者。 |
|||
**6 - 12ヵ月ごとの定期的な追加接種を推奨<ref name="SAGE230328" /><ref name="care56193" /><ref name="buzz230330" />。<br>6ヵ月未満の乳児における重症COVID-19の負担は6ヵ月 - 5歳までの子どもより高いとし、妊婦へのワクチン接種は、母親と胎児の両方を保護し、COVID-19による乳児の入院を減らすのに役立つとした<ref name="SAGE230328" /><ref name="care56193" /><ref name="buzz230330" />。 |
|||
*「'''中優先度群'''」:60歳未満の健康な成人、基礎疾患を持つ小児と青年。 |
|||
**1次接種(初回シリーズ)と初回の追加接種(3回目)は推奨するが、定期的な追加接種は推奨しない([[ルーチン]]の接種プログラムに含めることを推奨しないという意味で、感染状況、費用対効果、その他の保健政策上の優先事項や機会費用を考えて各国で判断する)<ref name="mhlw230330" /><ref name="care56193" /><ref name="buzz230330" />。 |
|||
*「'''低優先度群'''」:生後6ヵ月 - 17歳の健康な小児<ref name="jpeds507" />。 |
|||
**初回接種と追加接種は各国で決定、定期的な接種は推奨しない(同上)<ref name="mhlw230330" /><ref name="care56193" /><ref name="buzz230330" />。この群に対する1次接種と追加接種の安全性と有効性は確認されているが、[[麻疹ワクチン|麻疹]]や[[ロタウイルスワクチン|ロタウイルス]]、[[肺炎球菌ワクチン]]など、小児に必須のワクチンや、中 - 高優先度群へのCOVID-19ワクチン接種の利点よりも低いことを考慮して、国ごとに費用対効果や公衆衛生政策の優先順位などの状況に基づき検討することを奨めた<ref name="care56193" /><ref name="buzz230330" /><ref name="jpeds507">{{Cite web |url=http://www.jpeds.or.jp/modules/activity/index.php?content_id=507 |title=小児への新型コロナワクチン接種に対する考え方(2023.6追補) |publisher =日本小児科学会 |date=2023-06-09 |accessdate=2023-12-09}}</ref>。この提言に対し、[[日本小児科学会]]は、「他国と比べて日本の既感染者は少ない」「小児においても罹患後に[[Long COVID|後遺症]]を残す者がいる」「重症化を予防する手段としてワクチン接種は引き続き重要」「接種に伴う利益は、[[副反応]]等の不利益を上回る」として、すべての小児への推奨を維持すると表明している<ref name="jpeds507" /><ref name="buzz230330" />。 |
|||
この提言を拡大解釈して「追加接種は不要だった」「やはりワクチンは危険だった」と主張するワクチンに批判的な者がいるが、医療資源を確保するために接種をどう計画するか、費用対効果などの面から各国が検討するよう促しているものであり、「ワクチンの効果と安全性」はまったく否定していない<ref name="SAGE230328" /><ref name="care56193" /><ref name="buzz230330" />。文中では、高齢者や基礎疾患のある人を中心にワクチンを接種することの重要性を改めて強調し「健康な子どもについても接種は安全で効果的」と明言している<ref name="SAGE230328" /><ref name="care56193" /><ref name="buzz230330" />。 |
|||
== 沿革 == |
== 沿革 == |
||
| 55行目: | 71行目: | ||
2003年時点、鳥類感染性気管支炎ウイルス ([[:en:Infectious bronchitis virus|infectious bronchitis virus]]) 、[[犬コロナウイルス]]、猫コロナウイルスなど、コロナウイルスによって引き起こされるいくつかの動物の病気に対してワクチンは製造されていた<ref>{{Cite journal2|date=December 2003|title=Severe acute respiratory syndrome vaccine development: experiences of vaccination against avian infectious bronchitis coronavirus|journal=Avian Pathology|volume=32|issue=6|pages=567–82|DOI=10.1080/03079450310001621198|PMID=14676007|PMC=7154303}}</ref>。ヒトに影響を与える[[コロナウイルス科|''コロナウイルス''科]]の''[[コロナウイルス科|ウイルス]]''に対するワクチンを開発するための以前のプロジェクトは、[[重症急性呼吸器症候群]](SARS)と[[中東呼吸器症候群]](MERS)を対象としていた。SARS<ref>{{Cite journal2|date=December 2003|title=Effects of a SARS-associated coronavirus vaccine in monkeys|journal=Lancet|volume=362|issue=9399|pages=1895–96|DOI=10.1016/S0140-6736(03)14962-8|PMID=14667748|PMC=7112457}}</ref> およびMERS<ref>{{Cite journal2|date=October 2014|title=Immunogenicity of an adenoviral-based Middle East Respiratory Syndrome coronavirus vaccine in BALB/c mice|journal=Vaccine|volume=32|issue=45|pages=5975–82|DOI=10.1016/j.vaccine.2014.08.058|PMID=25192975|PMC=7115510}}</ref> に対するワクチンは、ヒト以外の[[モデル生物|動物で]]テストされている。 |
2003年時点、鳥類感染性気管支炎ウイルス ([[:en:Infectious bronchitis virus|infectious bronchitis virus]]) 、[[犬コロナウイルス]]、猫コロナウイルスなど、コロナウイルスによって引き起こされるいくつかの動物の病気に対してワクチンは製造されていた<ref>{{Cite journal2|date=December 2003|title=Severe acute respiratory syndrome vaccine development: experiences of vaccination against avian infectious bronchitis coronavirus|journal=Avian Pathology|volume=32|issue=6|pages=567–82|DOI=10.1080/03079450310001621198|PMID=14676007|PMC=7154303}}</ref>。ヒトに影響を与える[[コロナウイルス科|''コロナウイルス''科]]の''[[コロナウイルス科|ウイルス]]''に対するワクチンを開発するための以前のプロジェクトは、[[重症急性呼吸器症候群]](SARS)と[[中東呼吸器症候群]](MERS)を対象としていた。SARS<ref>{{Cite journal2|date=December 2003|title=Effects of a SARS-associated coronavirus vaccine in monkeys|journal=Lancet|volume=362|issue=9399|pages=1895–96|DOI=10.1016/S0140-6736(03)14962-8|PMID=14667748|PMC=7112457}}</ref> およびMERS<ref>{{Cite journal2|date=October 2014|title=Immunogenicity of an adenoviral-based Middle East Respiratory Syndrome coronavirus vaccine in BALB/c mice|journal=Vaccine|volume=32|issue=45|pages=5975–82|DOI=10.1016/j.vaccine.2014.08.058|PMID=25192975|PMC=7115510}}</ref> に対するワクチンは、ヒト以外の[[モデル生物|動物で]]テストされている。 |
||
2005年と2006年に発表された研究によると、SARSを治療するための新しいワクチンと医薬品の特定と開発は、当時の世界中の政府と衛生行政機関にとって優先事項だった<ref name="PMID |
2005年と2006年に発表された研究によると、SARSを治療するための新しいワクチンと医薬品の特定と開発は、当時の世界中の政府と衛生行政機関にとって優先事項だった<ref name="{{PMID|15655773}}">{{Cite journal2|date=February 2005|title=Development and characterization of a severe acute respiratory syndrome-associated coronavirus-neutralizing human monoclonal antibody that provides effective immunoprophylaxis in mice|journal=The Journal of Infectious Diseases|volume=191|issue=4|pages=507–14|DOI=10.1086/427242|PMID=15655773|PMC=7110081}}</ref><ref name="{{PMID|15885812}}">{{Cite journal2|date=September 2005|title=Monoclonal antibodies to SARS-associated coronavirus (SARS-CoV): identification of neutralizing and antibodies reactive to S, N, M and E viral proteins|journal=Journal of Virological Methods|volume=128|issue=1–2|pages=21–28|DOI=10.1016/j.jviromet.2005.03.021|PMID=15885812|PMC=7112802}}</ref><ref name="{{PMID|16453264}}">{{Cite journal2|date=March 2006|title=Therapy with a severe acute respiratory syndrome-associated coronavirus-neutralizing human monoclonal antibody reduces disease severity and viral burden in golden Syrian hamsters|journal=The Journal of Infectious Diseases|volume=193|issue=5|pages=685–92|DOI=10.1086/500143|PMID=16453264|PMC=7109703}}</ref>。2020年の時点で、ヒトのSARSに対して安全で効果的であることが証明されている治療法や予防ワクチンは無い<ref name="JiangFutureVirology">{{Cite journal2|date=January 2013|title=Development of SARS vaccines and therapeutics is still needed|journal=Future Virology|volume=8|issue=1|pages=1–2|DOI=10.2217/fvl.12.126|PMID=32201503|PMC=7079997}}</ref><ref>{{Cite web2|url=https://www.nhs.uk/conditions/sars/|title=SARS (severe acute respiratory syndrome)|date=5 March 2020|publisher=[[National Health Service]]|archiveurl=https://web.archive.org/web/20200309174230/https://www.nhs.uk/conditions/sars/|archivedate=9 March 2020|accessdate=31 January 2020}}</ref>。 |
||
MERSに対し確立されたワクチンも存在しない<ref>{{Cite journal2|last=Shehata|first=Mahmoud M.|last2=Gomaa|first2=Mokhtar R.|last3=Ali|first3=Mohamed A.|last4=Kayali|first4=Ghazi|date=20 January 2016|title=Middle East respiratory syndrome coronavirus: a comprehensive review|journal=Frontiers of Medicine|volume=10|issue=2|pages=120–36|DOI=10.1007/s11684-016-0430-6|PMID=26791756|PMC=7089261}}</ref>。MERSが普及したとき、既存のSARS研究は、MERS-CoV感染に対するワクチンと治療法を開発するための有用なテンプレートを提供する可能性があると考えられていた<ref name="JiangFutureVirology"/><ref name="Butler3oct2013">{{Cite journal2|date=October 2012|title=SARS veterans tackle coronavirus|journal=Nature|volume=490|issue=7418|page=20|bibcode=2012Natur.490...20B|DOI=10.1038/490020a|PMID=23038444}}</ref>。2020年3月現在、ヒトでの第I相臨床試験を完了した([[デオキシリボ核酸|DNA]]ベースの)MERSワクチンが1種<ref>{{Cite journal2|date=September 2019|title=Safety and immunogenicity of an anti-Middle East respiratory syndrome coronavirus DNA vaccine: a phase 1, open-label, single-arm, dose-escalation trial|journal=The Lancet. Infectious Diseases|volume=19|issue=9|pages=1013–22|DOI=10.1016/S1473-3099(19)30266-X|PMID=31351922|PMC=7185789}}</ref>、その他3種のワクチンが進行中であり、いずれも[[アデノウイルス]][[ウイルスベクター|ベクター]]型2種(ChAdOx1-MERS、BVRS-GamVac)、MVAベクター型1種(MVA-MERS-S)である<ref>{{Cite journal2|year=2019|title=Recent Advances in the Vaccine Development Against Middle East Respiratory Syndrome-Coronavirus|journal=Frontiers in Microbiology|volume=10|page=1781|DOI=10.3389/fmicb.2019.01781|PMID=31428074|PMC=6688523}}</ref>。 |
MERSに対し確立されたワクチンも存在しない<ref>{{Cite journal2|last=Shehata|first=Mahmoud M.|last2=Gomaa|first2=Mokhtar R.|last3=Ali|first3=Mohamed A.|last4=Kayali|first4=Ghazi|date=20 January 2016|title=Middle East respiratory syndrome coronavirus: a comprehensive review|journal=Frontiers of Medicine|volume=10|issue=2|pages=120–36|DOI=10.1007/s11684-016-0430-6|PMID=26791756|PMC=7089261}}</ref>。MERSが普及したとき、既存のSARS研究は、MERS-CoV感染に対するワクチンと治療法を開発するための有用なテンプレートを提供する可能性があると考えられていた<ref name="JiangFutureVirology"/><ref name="Butler3oct2013">{{Cite journal2|date=October 2012|title=SARS veterans tackle coronavirus|journal=Nature|volume=490|issue=7418|page=20|bibcode=2012Natur.490...20B|DOI=10.1038/490020a|PMID=23038444}}</ref>。2020年3月現在、ヒトでの第I相臨床試験を完了した([[デオキシリボ核酸|DNA]]ベースの)MERSワクチンが1種<ref>{{Cite journal2|date=September 2019|title=Safety and immunogenicity of an anti-Middle East respiratory syndrome coronavirus DNA vaccine: a phase 1, open-label, single-arm, dose-escalation trial|journal=The Lancet. Infectious Diseases|volume=19|issue=9|pages=1013–22|DOI=10.1016/S1473-3099(19)30266-X|PMID=31351922|PMC=7185789}}</ref>、その他3種のワクチンが進行中であり、いずれも[[アデノウイルス]][[ウイルスベクター|ベクター]]型2種(ChAdOx1-MERS、BVRS-GamVac)、MVAベクター型1種(MVA-MERS-S)である<ref>{{Cite journal2|year=2019|title=Recent Advances in the Vaccine Development Against Middle East Respiratory Syndrome-Coronavirus|journal=Frontiers in Microbiology|volume=10|page=1781|DOI=10.3389/fmicb.2019.01781|PMID=31428074|PMC=6688523}}</ref>。 |
||
=== 2020年のCOVID-19ワクチン開発 === |
=== 2020年のCOVID-19ワクチン開発 === |
||
[[File:コロナワクチンの覇権構造.jpg|thumb|2021年の日経新聞からCOVID-19ワクチンの使用状況を[[量率グラフ]]で表したもの。タテ軸が国別使用回数、ヨコ軸は国ごとの製薬会社の割合。米英メーカーが圧倒的シェアを占めている。]] |
|||
<!--感染症のワクチンは、これまで数年以内に製造されたことがなく、-->COVID-19が世界的に蔓延し始めた2019年末 - 2020年初頭の時点では、ヒトのコロナウイルス感染を予防するためのワクチンは存在していなかった<ref name="gates2"/>。2019年12月にCOVID-19コロナウイルスが検出された後<ref name="who-time">{{Cite web2|title=World Health Organization timeline – COVID-19|url=https://www.who.int/news-room/detail/27-04-2020-who-timeline---covid-19|publisher=World Health Organization|date=2020-04-27|accessdate=2020-05-02|archiveurl=https://web.archive.org/web/20200429012212/https://www.who.int/news-room/detail/27-04-2020-who-timeline---covid-19|archivedate=29 April 2020}}</ref>、COVID-19の[[塩基配列|遺伝子配列]]が2020年1月11日に公開され、発生に備えて予防ワクチンの開発を早めるための緊急の国際的対応が引き起こされた<ref name="thanh">{{Cite journal2|last=Thanh Le|first=Tung|last2=Andreadakis|first2=Zacharias|last3=Kumar|first3=Arun|last4=Gómez Román|first4=Raúl|last5=Tollefsen|first5=Stig|last6=Saville|first6=Melanie|last7=Mayhew|first7=Stephen|date=9 April 2020|title=The COVID-19 vaccine development landscape|journal=Nature Reviews Drug Discovery|volume=19|issue=5|pages=305–06|DOI=10.1038/d41573-020-00073-5|ISSN=1474-1776|PMID=32273591}}</ref><ref name="gates1">{{Cite journal2|date=February 2020|title=Responding to Covid-19: A once-in-a-century pandemic?|journal=The New England Journal of Medicine|volume=382|issue=18|pages=1677–79|DOI=10.1056/nejmp2003762|PMID=32109012}}</ref><ref name="Fauci">{{Cite journal2|date=March 2020|title=Covid-19: Navigating the uncharted|journal=The New England Journal of Medicine|volume=382|issue=13|pages=1268–69|DOI=10.1056/nejme2002387|PMID=32109011|PMC=7121221}}</ref>。 |
<!--感染症のワクチンは、これまで数年以内に製造されたことがなく、-->COVID-19が世界的に蔓延し始めた2019年末 - 2020年初頭の時点では、ヒトのコロナウイルス感染を予防するためのワクチンは存在していなかった<ref name="gates2"/>。2019年12月にCOVID-19コロナウイルスが検出された後<ref name="who-time">{{Cite web2|title=World Health Organization timeline – COVID-19|url=https://www.who.int/news-room/detail/27-04-2020-who-timeline---covid-19|publisher=World Health Organization|date=2020-04-27|accessdate=2020-05-02|archiveurl=https://web.archive.org/web/20200429012212/https://www.who.int/news-room/detail/27-04-2020-who-timeline---covid-19|archivedate=29 April 2020}}</ref>、COVID-19の[[塩基配列|遺伝子配列]]が2020年1月11日に公開され、発生に備えて予防ワクチンの開発を早めるための緊急の国際的対応が引き起こされた<ref name="thanh">{{Cite journal2|last=Thanh Le|first=Tung|last2=Andreadakis|first2=Zacharias|last3=Kumar|first3=Arun|last4=Gómez Román|first4=Raúl|last5=Tollefsen|first5=Stig|last6=Saville|first6=Melanie|last7=Mayhew|first7=Stephen|date=9 April 2020|title=The COVID-19 vaccine development landscape|journal=Nature Reviews Drug Discovery|volume=19|issue=5|pages=305–06|DOI=10.1038/d41573-020-00073-5|ISSN=1474-1776|PMID=32273591}}</ref><ref name="gates1">{{Cite journal2|date=February 2020|title=Responding to Covid-19: A once-in-a-century pandemic?|journal=The New England Journal of Medicine|volume=382|issue=18|pages=1677–79|DOI=10.1056/nejmp2003762|PMID=32109012}}</ref><ref name="Fauci">{{Cite journal2|date=March 2020|title=Covid-19: Navigating the uncharted|journal=The New England Journal of Medicine|volume=382|issue=13|pages=1268–69|DOI=10.1056/nejme2002387|PMID=32109011|PMC=7121221}}</ref>。 |
||
| 71行目: | 88行目: | ||
2020年の間に、年初からのCOVID-19ワクチン開発の取り組み全体の大きな変化は、[[製薬|多国籍製薬業界]]と各国政府との共同研究の増加と、COVID-19ワクチンに注力する多くの国の[[生物工学|バイオテクノロジー]]企業の多様性と増加である<ref name="thanh2" />。CEPIによると、COVID-19ワクチン開発の一般的な地理的分布は、[[北米]]の組織が世界のCOVID-19ワクチン研究の約40%を占めているのに対し、[[アジア]]と[[オーストラリア]]では30%、ヨーロッパでは26%、[[南アメリカ|南米]]とアフリカではいくつかのプロジェクトが存在している<ref name="thanh"/>。 |
2020年の間に、年初からのCOVID-19ワクチン開発の取り組み全体の大きな変化は、[[製薬|多国籍製薬業界]]と各国政府との共同研究の増加と、COVID-19ワクチンに注力する多くの国の[[生物工学|バイオテクノロジー]]企業の多様性と増加である<ref name="thanh2" />。CEPIによると、COVID-19ワクチン開発の一般的な地理的分布は、[[北米]]の組織が世界のCOVID-19ワクチン研究の約40%を占めているのに対し、[[アジア]]と[[オーストラリア]]では30%、ヨーロッパでは26%、[[南アメリカ|南米]]とアフリカではいくつかのプロジェクトが存在している<ref name="thanh"/>。 |
||
ワクチン開発がスタートすると[[分散コンピューティング]]プロジェクトの[[Folding@home]]への関心が高まったことで、2020年3月下旬には演算能力は約1.22 [[エクサ|E]][[FLOPS]]<ref>{{Cite web|url=https://pc.watch.impress.co.jp/docs/news/1243230.html|title=新型コロナ解析で分散処理プロジェクト「Folding@home」が1EFLOPS超え|date=2020-03-26|accessdate=2020-4-4|publisher=PC Watch|author=佐藤 岳大}}</ref><ref>{{cite web|url=https://stats.foldingathome.org/os|archive-url=https://archive.today/20200412111010/https://stats.foldingathome.org/os|url-status=dead|archive-date=April 12, 2020|title=Client Statistics by OS|author=Pande lab|publisher=Archive.is|accessdate=April 12, 2020}}</ref>、2020年4月中旬には約2.43 EFLOPSを達成し<ref>{{Cite web|url=https://pc.watch.impress.co.jp/docs/news/1246939.html|title=Folding@homeがTOP 500の全スパコンを超える2.4EFLOPSに到達|date=2020-04-14|accessdate=2020-4-14|publisher=PC Watch|author=中村 真司}}</ref><ref>{{Cite web|title=https://twitter.com/foldingathome/status/1249778379634675712|url=https://twitter.com/foldingathome/status/1249778379634675712|website=Twitter|accessdate=2021-04-10|language=en|author=Folding@home}}</ref>、世界初のエクサフロップ・コンピューティング・システムとなり、[[TOP500]]の全[[スーパーコンピュータ]]の合算を上回る能力を獲得した。 |
ワクチン開発がスタートすると[[分散コンピューティング]]プロジェクトの[[Folding@home]]への関心が高まったことで、2020年3月下旬には演算能力は約1.22 [[エクサ|E]][[FLOPS]]<ref>{{Cite web|和書|url=https://pc.watch.impress.co.jp/docs/news/1243230.html|title=新型コロナ解析で分散処理プロジェクト「Folding@home」が1EFLOPS超え|date=2020-03-26|accessdate=2020-4-4|publisher=PC Watch|author=佐藤 岳大}}</ref><ref>{{cite web|url=https://stats.foldingathome.org/os|archive-url=https://archive.today/20200412111010/https://stats.foldingathome.org/os|url-status=dead|archive-date=April 12, 2020|title=Client Statistics by OS|author=Pande lab|publisher=Archive.is|accessdate=April 12, 2020}}</ref>、2020年4月中旬には約2.43 EFLOPSを達成し<ref>{{Cite web|和書|url=https://pc.watch.impress.co.jp/docs/news/1246939.html|title=Folding@homeがTOP 500の全スパコンを超える2.4EFLOPSに到達|date=2020-04-14|accessdate=2020-4-14|publisher=PC Watch|author=中村 真司}}</ref><ref>{{Cite web|title=https://twitter.com/foldingathome/status/1249778379634675712|url=https://twitter.com/foldingathome/status/1249778379634675712|website=Twitter|accessdate=2021-04-10|language=en|author=Folding@home}}</ref>、世界初のエクサフロップ・コンピューティング・システムとなり、[[TOP500]]の全[[スーパーコンピュータ]]の合算を上回る能力を獲得した。 |
||
=== 国際機関 === |
=== 国際機関 === |
||
ワクチン開発を加速させ、流通に備えるための国際的な提携を形成している組織があるが、その中には、2020年5月初旬に81億米ドルの資金調達を開始し、史上前例のない規模で協力、研究の加速化、国際的なコミュニケーションを促進している[[世界保健機関]](WHO)も含まれている<ref name="waked"/>。WHOはまた、世界的なワクチン開発を調整するためのCovid-19 Vaccines Global Access('''COVAX''')を実施し、[[GAVIアライアンス|GAVI]]やCEPIと共同で ''[[:en:Access to COVID-19 Tools Accelerator|Access to COVID-19 Tools (ACT) Accelerator]]'' のワクチンの柱となっている<ref name="thanh2" /><ref name="who-covax">{{Cite web2|title=The Access to COVID-19 Tools (ACT) Accelerator|url=https://www.who.int/initiatives/act-accelerator|publisher=World Health Organization|date=2020|accessdate=2020-08-29|archivedate=25 September 2020|archiveurl=https://web.archive.org/web/20200925122714/https://www.who.int/initiatives/act-accelerator/}}</ref><ref name="covax-gavi">{{Cite web2|title=COVAX: Ensuring global equitable access to COVID-19 vaccines|url=https://www.gavi.org/covid19/covax-facility|publisher=GAVI|accessdate=28 August 2020|date=2020|archivedate=25 September 2020|archiveurl=https://web.archive.org/web/20200925122717/https://www.gavi.org/covid19/covax-facility/}}</ref>。7月、WHOは、世界人口の最大60%を占める165カ国が、最終的な認可ワクチンの公正かつ衡平な配分のためのWHO COVAX計画に合意したことを発表した。COVAXは、COVID-19ワクチンの開発と製造を加速し、「認可ワクチンへのアクセスが全ての国に公平に提供されること」を保証することを目標としている。具体的には2021年末までに、各参加国が最前線の医療従事者やリスクの高い人々を保護し、最も脆弱な20%の人口にワクチンを接種する<ref name="covax">{{Cite web2|title=More than 150 countries engaged in COVID-19 vaccine global access facility|url=https://www.who.int/news-room/detail/15-07-2020-more-than-150-countries-engaged-in-covid-19-vaccine-global-access-facility|publisher=World Health Organization|accessdate=25 July 2020|date=15 July 2020|quote=COVAX is the only truly global solution to the COVID-19 pandemic. For the vast majority of countries, whether they can afford to pay for their own doses or require assistance, it means receiving a guaranteed share of doses and avoiding being pushed to the back of the queue, as we saw during the H1N1 pandemic a decade ago. Even for those countries that are able to secure their own agreements with vaccine manufacturers, this mechanism represents, through its world-leading portfolio of vaccine candidates, a means of reducing the risks associated with individual candidates failing to show efficacy or gain licensure.|archivedate=15 July 2020|archiveurl=https://web.archive.org/web/20200715152301/https://www.who.int/news-room/detail/15-07-2020-more-than-150-countries-engaged-in-covid-19-vaccine-global-access-facility}}</ref> ために、保証された分量を受け取る(最大20億回分を平等に提供する)ことを保証する<ref name="cepi-covax">{{Cite web2|title=COVAX: CEPI's response to COVID-19|url=https://cepi.net/COVAX/ |publisher=Coalition for Epidemic Preparedness Innovations (CEPI) |access-date=15 December 2020 |date=2020}}</ref><ref name="cepi-safer">{{Cite web2|title=New vaccines for a safer world |url=https://cepi.net/ |publisher=CEPI |access-date=15 December 2020 |date=2020}}</ref>。 |
ワクチン開発を加速させ、流通に備えるための国際的な提携を形成している組織があるが、その中には、2020年5月初旬に81億米ドルの資金調達を開始し、史上前例のない規模で協力、研究の加速化、国際的なコミュニケーションを促進している[[世界保健機関]](WHO)も含まれている<ref name="waked"/>。WHOはまた、世界的なワクチン開発を調整するためのCovid-19 Vaccines Global Access('''COVAX''')を実施し、[[GAVIアライアンス|GAVI]]やCEPIと共同で ''[[:en:Access to COVID-19 Tools Accelerator|Access to COVID-19 Tools (ACT) Accelerator]]'' のワクチンの柱となっている<ref name="thanh2" /><ref name="who-covax">{{Cite web2|title=The Access to COVID-19 Tools (ACT) Accelerator|url=https://www.who.int/initiatives/act-accelerator|publisher=World Health Organization|date=2020|accessdate=2020-08-29|archivedate=25 September 2020|archiveurl=https://web.archive.org/web/20200925122714/https://www.who.int/initiatives/act-accelerator/}}</ref><ref name="covax-gavi">{{Cite web2|title=COVAX: Ensuring global equitable access to COVID-19 vaccines|url=https://www.gavi.org/covid19/covax-facility|publisher=GAVI|accessdate=28 August 2020|date=2020|archivedate=25 September 2020|archiveurl=https://web.archive.org/web/20200925122717/https://www.gavi.org/covid19/covax-facility/}}</ref>。7月、WHOは、世界人口の最大60%を占める165カ国が、最終的な認可ワクチンの公正かつ衡平な配分のためのWHO COVAX計画に合意したことを発表した。COVAXは、COVID-19ワクチンの開発と製造を加速し、「認可ワクチンへのアクセスが全ての国に公平に提供されること」を保証することを目標としている。具体的には2021年末までに、各参加国が最前線の医療従事者やリスクの高い人々を保護し、最も脆弱な20%の人口にワクチンを接種する<ref name="covax">{{Cite web2|title=More than 150 countries engaged in COVID-19 vaccine global access facility|url=https://www.who.int/news-room/detail/15-07-2020-more-than-150-countries-engaged-in-covid-19-vaccine-global-access-facility|publisher=World Health Organization|accessdate=25 July 2020|date=15 July 2020|quote=COVAX is the only truly global solution to the COVID-19 pandemic. For the vast majority of countries, whether they can afford to pay for their own doses or require assistance, it means receiving a guaranteed share of doses and avoiding being pushed to the back of the queue, as we saw during the H1N1 pandemic a decade ago. Even for those countries that are able to secure their own agreements with vaccine manufacturers, this mechanism represents, through its world-leading portfolio of vaccine candidates, a means of reducing the risks associated with individual candidates failing to show efficacy or gain licensure.|archivedate=15 July 2020|archiveurl=https://web.archive.org/web/20200715152301/https://www.who.int/news-room/detail/15-07-2020-more-than-150-countries-engaged-in-covid-19-vaccine-global-access-facility}}</ref> ために、保証された分量を受け取る(最大20億回分を平等に提供する)ことを保証する<ref name="cepi-covax">{{Cite web2|title=COVAX: CEPI's response to COVID-19|url=https://cepi.net/COVAX/ |publisher=Coalition for Epidemic Preparedness Innovations (CEPI) |access-date=15 December 2020 |date=2020}}</ref><ref name="cepi-safer">{{Cite web2|title=New vaccines for a safer world |url=https://cepi.net/ |publisher=CEPI |access-date=15 December 2020 |date=2020}}</ref>。 |
||
CEPIは、国際保健当局およびワクチン開発者と協力して、さらに20億米ドルの基金を創設。公的、私的、慈善団体、市民社会の組織間のグローバルパートナーシップで、8つのワクチン候補の研究と臨床試験を加速するために資金を提供し、当面(2020年〜2021年)は、ライセンスの完全な開発のためにいくつかの候補を支援することを目標としている<ref name="thanh2" |
CEPIは、国際保健当局およびワクチン開発者と協力して、さらに20億米ドルの基金を創設。公的、私的、慈善団体、市民社会の組織間のグローバルパートナーシップで、8つのワクチン候補の研究と臨床試験を加速するために資金を提供し、当面(2020年〜2021年)は、ライセンスの完全な開発のためにいくつかの候補を支援することを目標としている<ref name="thanh2" /><ref name="cepi-landmark"/>。英国、カナダ、[[ベルギー]]、[[ノルウェー]]、[[スイス]]、[[ドイツ]]、[[オランダ]]は既に9億1500万米ドルを寄付しており<!--(2020年5月上旬までにCEPIに100万ドル)--><ref name="waked"/><ref name="reuters">{{Cite news|date=2020-04-27|title=Special Report: Countries, companies risk billions in race for coronavirus vaccine|first=Julie|last=Steenhuysen|first2=Peter|author2=Eisler|first3=Allison|author3=Martell|first4=Stephanie|author4=Nebehay|newspaper=Reuters|url=https://www.reuters.com/article/health-coronavirus-vaccine-idUSL2N2CF0JG|accessdate=2020-05-02|archiveurl=https://web.archive.org/web/20200515031817/https://www.reuters.com/article/health-coronavirus-vaccine-idUSL2N2CF0JG|archivedate=15 May 2020}}</ref>、ワクチンの研究と配布を専門とする民間の慈善団体である[[ビル&メリンダ・ゲイツ財団|ビル&メリンダゲイツ財団]](ゲイツ財団)は、2億5000万米ドルを寄付している<!--(COVID‑19ワクチンの研究と公教育支援のためのCEPIの支援で100万人)--><ref name="sanger">{{Cite news|last=Sanger|date=2020-05-02|archiveurl=https://web.archive.org/web/20200511003506/https://www.nytimes.com/2020/05/02/us/politics/vaccines-coronavirus-research.html|issn=0362-4331|accessdate=2020-05-02|url=https://www.nytimes.com/2020/05/02/us/politics/vaccines-coronavirus-research.html|newspaper=[[The New York Times]]|title=With Pressure Growing, Global Race for a Vaccine Intensifies|first5=Sui-Lee|first=David E.|author5=Wee|first4=Katie|author4=Thomas|first3=Carl|author3=Zimmer|first2=David D.|author2=Kirkpatrick|archivedate=11 May 2020}}</ref><ref>{{Cite news|title=Bill Gates thinks there are 8 to 10 promising coronavirus vaccine candidates and one could be ready in as little as 9 months|url=https://www.businessinsider.com/bill-gates-10-promising-coronavirus-vaccine-candidates-2020-5|last=Hamilton|first=Isobel Asher|date=2020-05-01|newspaper=Business Insider|accessdate=2020-05-02|archiveurl=https://web.archive.org/web/20200516101559/https://www.businessinsider.com/bill-gates-10-promising-coronavirus-vaccine-candidates-2020-5|archivedate=16 May 2020}}</ref>。 |
||
2020年6月4日、英国のロンドンから、[[G7]]および[[G20]]諸国の35[[元首|の国家元首を]]含む、52カ国の民間および政府の代表者の間で[[仮想共同体|仮想]]サミットが調整され、88億米ドルが調達された。<!--300のCOVID‑19ワクチン接種に備えるための-->[[GAVIアライアンス|ワクチンと予防接種のためのグローバルアライアンス(GAVI)]]により、[[2025年]]までに発展途上国の3億人の子供たちがワクチンを摂取できるよう準備する<ref name="gavi-summit">{{Cite web2|title=Global Vaccine Summit 2020: World leaders make historic commitments to provide equal access to vaccines for all|url=https://www.gavi.org/news/media-room/world-leaders-make-historic-commitments-provide-equal-access-vaccines-all|accessdate=2020-06-04|publisher=Global Alliance for Vaccines and Immunisation|date=2020-06-04|archiveurl=https://web.archive.org/web/20200606161748/https://www.gavi.org/news/media-room/world-leaders-make-historic-commitments-provide-equal-access-vaccines-all|archivedate=6 June 2020}}</ref>。主な寄付はゲイツ財団からの16億米ドル<ref>{{Cite press release|title=Bill & Melinda Gates Foundation pledges {{US$|1.6}}{{nbsp}}billion to Gavi, the Vaccine Alliance, to protect the next generation with lifesaving vaccines|publisher=The Bill & Melinda Gates Foundation|date=2020-06-04|url=https://www.prnewswire.com/news-releases/bill--melinda-gates-foundation-pledges-1-6-billion-to-gavi-the-vaccine-alliance-to-protect-the-next-generation-with-lifesaving-vaccines-301070878.html|accessdate=2020-06-04|archiveurl=https://web.archive.org/web/20200604165907/https://www.prnewswire.com/news-releases/bill--melinda-gates-foundation-pledges-1-6-billion-to-gavi-the-vaccine-alliance-to-protect-the-next-generation-with-lifesaving-vaccines-301070878.html|archivedate=4 June 2020}}</ref> と英国政府による5年間で年間3億3000万ポンド(2020年6月には約21億米ドル)など。 |
2020年6月4日、英国のロンドンから、[[G7]]および[[G20]]諸国の35[[元首|の国家元首を]]含む、52カ国の民間および政府の代表者の間で[[仮想共同体|仮想]]サミットが調整され、88億米ドルが調達された。<!--300のCOVID‑19ワクチン接種に備えるための-->[[GAVIアライアンス|ワクチンと予防接種のためのグローバルアライアンス(GAVI)]]により、[[2025年]]までに発展途上国の3億人の子供たちがワクチンを摂取できるよう準備する<ref name="gavi-summit">{{Cite web2|title=Global Vaccine Summit 2020: World leaders make historic commitments to provide equal access to vaccines for all|url=https://www.gavi.org/news/media-room/world-leaders-make-historic-commitments-provide-equal-access-vaccines-all|accessdate=2020-06-04|publisher=Global Alliance for Vaccines and Immunisation|date=2020-06-04|archiveurl=https://web.archive.org/web/20200606161748/https://www.gavi.org/news/media-room/world-leaders-make-historic-commitments-provide-equal-access-vaccines-all|archivedate=6 June 2020}}</ref>。主な寄付はゲイツ財団からの16億米ドル<ref>{{Cite press release|title=Bill & Melinda Gates Foundation pledges {{US$|1.6}}{{nbsp}}billion to Gavi, the Vaccine Alliance, to protect the next generation with lifesaving vaccines|publisher=The Bill & Melinda Gates Foundation|date=2020-06-04|url=https://www.prnewswire.com/news-releases/bill--melinda-gates-foundation-pledges-1-6-billion-to-gavi-the-vaccine-alliance-to-protect-the-next-generation-with-lifesaving-vaccines-301070878.html|accessdate=2020-06-04|archiveurl=https://web.archive.org/web/20200604165907/https://www.prnewswire.com/news-releases/bill--melinda-gates-foundation-pledges-1-6-billion-to-gavi-the-vaccine-alliance-to-protect-the-next-generation-with-lifesaving-vaccines-301070878.html|archivedate=4 June 2020}}</ref> と英国政府による5年間で年間3億3000万ポンド(2020年6月には約21億米ドル)など。 |
||
| 83行目: | 100行目: | ||
=== 感染症流行対策イノベーション連合 (CEPI) === |
=== 感染症流行対策イノベーション連合 (CEPI) === |
||
[[感染症流行対策イノベーション連合]]はノルウェー政府、インド政府、[[ビル&メリンダ・ゲイツ財団]]、および公益信託団体[[ウェルカム・トラスト]]の出資によって2017年に[[世界経済フォーラム]]([[ダボス]]会議)にて発足した、公的機関、民間機関、[[慈善団体]]および市民団体の間でのグローバルな協働体である<ref>{{Cite web2|date=2019-03-25|url= |
[[感染症流行対策イノベーション連合]]はノルウェー政府、インド政府、[[ビル&メリンダ・ゲイツ財団]]、および公益信託団体[[ウェルカム・トラスト]]の出資によって2017年に[[世界経済フォーラム]]([[ダボス]]会議)にて発足した、公的機関、民間機関、[[慈善団体]]および市民団体の間でのグローバルな協働体である<ref>{{Cite web2|date=2019-03-25|url=https://www.ims.u-tokyo.ac.jp/jikkendoubutsu/cepi-project_ja.html|title=CEPI ニパウイルスワクチンプロジェクト|publisher=[[東京大学]] 医科学研究所 実験動物研究施設|accessdate=2020-02-02}}</ref>。[[日本]]の[[厚生労働省]]も創設に関わり2017年より拠出を行ってきた<ref name=kose-CEPI/>。 |
||
2020年1月23日、CEPIは以下3研究チームがワクチン開発に向けた作業を開始し、少なくとも1種類のワクチンの[[疫学#臨床試験|臨床試験]]を6月までに開始すると発表した<ref name=kose-CEPI>{{Cite web2|date=2020-01-24|url=https://www.mhlw.go.jp/stf/newpage_09087.html|title=新型コロナウイルスに対するワクチン開発を進めます|publisher=厚生労働省|accessdate=2020-02-02}}</ref><ref>{{Cite web2|date=2020-01-24|url=https://jp.reuters.com/article/china-health-virus-vaccines-idJPKBN1ZM2SX|title=新型肺炎のワクチン開発へ、米など3研究チームが作業開始|publisher=[[ロイター]]|accessdate=2020-02-02}}</ref>。また、夏にも人へ臨床試験を行い、ワクチン承認は早ければ年内になるとも述べた<ref>{{Cite web2|date=2020-01-24|url=https://www.jiji.com/jc/article?k=2020012400266&g=int|title=新型肺炎ワクチンの開発支援 6月にも臨床試験―国際団体|publisher=[[時事通信]]|accessdate=2020-02-02}}</ref>。 |
2020年1月23日、CEPIは以下3研究チームがワクチン開発に向けた作業を開始し、少なくとも1種類のワクチンの[[疫学#臨床試験|臨床試験]]を6月までに開始すると発表した<ref name=kose-CEPI>{{Cite web2|date=2020-01-24|url=https://www.mhlw.go.jp/stf/newpage_09087.html|title=新型コロナウイルスに対するワクチン開発を進めます|publisher=厚生労働省|accessdate=2020-02-02}}</ref><ref>{{Cite web2|date=2020-01-24|url=https://jp.reuters.com/article/china-health-virus-vaccines-idJPKBN1ZM2SX|title=新型肺炎のワクチン開発へ、米など3研究チームが作業開始|publisher=[[ロイター]]|accessdate=2020-02-02}}</ref>。また、夏にも人へ臨床試験を行い、ワクチン承認は早ければ年内になるとも述べた<ref>{{Cite web2|date=2020-01-24|url=https://web.archive.org/web/20200229140054/https://www.jiji.com/jc/article?k=2020012400266&g=int|title=新型肺炎ワクチンの開発支援 6月にも臨床試験―国際団体|publisher=[[時事通信]]|accessdate=2020-02-02}}</ref>。 |
||
# 米医薬品・ワクチン開発の[[:en:Moderna|モデルナ (Moderna, Inc.)]](英語) (MRNA.O) と[[アメリカ国立アレルギー・感染症研究所]] (NIAID) の連携 |
# 米医薬品・ワクチン開発の[[:en:Moderna|モデルナ (Moderna, Inc.)]](英語) (MRNA.O) と[[アメリカ国立アレルギー・感染症研究所]] (NIAID) の連携 |
||
# 製薬会社 [https://www.inovio.com/ イノビオ・ファーマシューティカルズ (Inovio Pharmaceuticals, Inc.)] (INO.O) |
# 製薬会社 [https://www.inovio.com/ イノビオ・ファーマシューティカルズ (Inovio Pharmaceuticals, Inc.)] (INO.O) |
||
# [[オーストラリア|豪]][[クイーンズランド大学]]のチーム |
# [[オーストラリア|豪]][[クイーンズランド大学]]のチーム |
||
| 100行目: | 117行目: | ||
===日本=== |
===日本=== |
||
2020年3月12日、[[田辺三菱製薬]]は、カナダの子会社が製造する植物由来の粒子を利用し、ワクチン開発に着手すると発表した<ref>{{Cite web2|date=2020-03-12 |url=https://www.nikkei.com/article/DGXMZO56735890S0A310C2000000/ |title=田辺三菱製薬、新型コロナのワクチン開発に着手へ |publisher=[[日本経済新聞]] |accessdate=2020-04-18}}</ref>。 |
2020年3月12日、[[田辺三菱製薬]]は、カナダの子会社が製造する植物由来の粒子を利用し、ワクチン開発に着手すると発表した([[CoVLP]])<ref>{{Cite web2|date=2020-03-12 |url=https://www.nikkei.com/article/DGXMZO56735890S0A310C2000000/ |title=田辺三菱製薬、新型コロナのワクチン開発に着手へ |publisher=[[日本経済新聞]] |accessdate=2020-04-18}}</ref>。 |
||
2020年3月5日、[[大阪大学]]発の創薬企業[[アンジェス]]は、[[DNA]][[プラスミド]]技術を活かした[[DNAワクチン]]を大阪大学と共同で開発し、[[タカラバイオ]]が製造すると発表した<ref>{{Cite web2|date=2020-03-05|url=https://www.anges.co.jp/pdf.php?pdf=TLBsg7zsTgnFrWyfK9Uq5jCqvD2xpO3a.pdf|title=[IR<nowiki>]</nowiki> アンジェス、大阪大学が新型コロナウイルス (COVID-19) に対するDNAワクチン共同開発に着手|publisher= |
2020年3月5日、[[大阪大学]]発の創薬企業[[アンジェス]]は、[[DNA]][[プラスミド]]技術を活かした[[DNAワクチン]]を大阪大学と共同で開発し、[[タカラバイオ]]が製造すると発表した<ref>{{Cite web2|date=2020-03-05|url=https://www.anges.co.jp/pdf.php?pdf=TLBsg7zsTgnFrWyfK9Uq5jCqvD2xpO3a.pdf|title=[IR<nowiki>]</nowiki> アンジェス、大阪大学が新型コロナウイルス (COVID-19) に対するDNAワクチン共同開発に着手|publisher=アンジェス|accessdate=2020-03-05}}</ref><ref>{{Cite news|url=https://www.nikkei.com/article/DGXMZO56411830V00C20A3X12000/|title=アンジェス、新型コロナのワクチン開発へ|newspaper=日本経済新聞|date=2020-03-05}}</ref><ref>{{Cite web2|date=2020-03-16 |url=https://business.nikkei.com/atcl/gen/19/00110/030500007/ |title=大阪大などが開発着手、新型コロナワクチンの効き目は? |publisher=[[日経ビジネス]] |accessdate=2020-04-18}}</ref>。同年6月30日より治験を開始し、7月末までに30人を対象に実施する<ref>[https://www.nikkei.com/article/DGXMZO60418800W0A610C2AC1000/ 「アンジェスのワクチン、6月30日治験開始 大阪市長」]日本経済新聞(2020年6月16日)</ref><ref>[https://www.asahi.com/articles/ASN6Z5HSZN6VPLBJ001.html 「コロナワクチン、国内初の治験開始 7月末まで30人に」][[朝日新聞デジタル]](2020年6月30日)</ref>。 |
||
2020年5月7日、[[塩野義製薬]]は、子会社のUMNファーマが[[国立感染症研究所]]と共同で、年内の臨床試験開始を目指していることを公表した。最短で2020年内の臨床試験開始を予定している。市場への投入は2021年秋になる見込みで、同年末までに3,000万人分の生産を目標とする<ref>{{Cite web2|date=2020-05-07 |url=https://www.nikkei.com/article/DGXMZO58824930X00C20A5000000/ |title=塩野義製薬、新型コロナワクチンを21年秋にも市場投入 |publisher=日本経済新聞 |accessdate=2020-05-13}}</ref><ref name="ki200822" />。 |
2020年5月7日、[[塩野義製薬]]は、子会社のUMNファーマが[[国立感染症研究所]]と共同で、年内の臨床試験開始を目指していることを公表した。最短で2020年内の臨床試験開始を予定している。市場への投入は2021年秋になる見込みで、同年末までに3,000万人分の生産を目標とする<ref>{{Cite web2|date=2020-05-07 |url=https://www.nikkei.com/article/DGXMZO58824930X00C20A5000000/ |title=塩野義製薬、新型コロナワクチンを21年秋にも市場投入 |publisher=日本経済新聞 |accessdate=2020-05-13}}</ref><ref name="ki200822" />。 |
||
[[第一三共]]、[[東京大学 |
[[第一三共]]、[[東京大学医科学研究所]]は、最短で2021年3月からワクチンの臨床試験を開始することを目指すと報道された<ref name="ki200822" />。 |
||
2020年6月27日、[[九州大学]]は、九州大学発の[[ベンチャー企業]]である[[KAICO]]と共同で、新型コロナウイルスのワクチン候補となるたんぱく質の開発に成功したと発表した<ref name="KAICO">{{Cite news |url=https://www.nishinippon.co.jp/item/n/620746/ |title=カイコからコロナワクチン候補 「食べて接種」も? 九大など開発 |accessdate=2020-09-29 |date=2020-06-27 |newspaper=[[西日本新聞]] |archiveurl= |archivedate=}}</ref><ref name="KAICO2">{{Cite news |url=https://mainichi.jp/articles/20200630/k00/00m/040/077000c |title=カイコの体内で生成 新型コロナのワクチン候補、来年度にも治験へ 九大 |accessdate=2020-09-29 |date=2020-06-30 |newspaper=[[毎日新聞]] |archiveurl= |archivedate=}}</ref>。2021年からワクチンの臨床試験開始を目指している<ref name="KAICO2" />。 |
2020年6月27日、[[九州大学]]は、九州大学発の[[ベンチャー企業]]である[[KAICO]]と共同で、新型コロナウイルスのワクチン候補となるたんぱく質の開発に成功したと発表した<ref name="KAICO">{{Cite news |url=https://www.nishinippon.co.jp/item/n/620746/ |title=カイコからコロナワクチン候補 「食べて接種」も? 九大など開発 |accessdate=2020-09-29 |date=2020-06-27 |newspaper=[[西日本新聞]] |archiveurl= |archivedate=}}</ref><ref name="KAICO2">{{Cite news |url=https://mainichi.jp/articles/20200630/k00/00m/040/077000c |title=カイコの体内で生成 新型コロナのワクチン候補、来年度にも治験へ 九大 |accessdate=2020-09-29 |date=2020-06-30 |newspaper=[[毎日新聞]] |archiveurl= |archivedate=}}</ref>。2021年からワクチンの臨床試験開始を目指している<ref name="KAICO2" />。 |
||
2020年8月時点でワクチンの開発が急がれた一方、(その時点では)専門家からは「感染そのものを予防する効果は証明が難しい」という懸念が出た。また、東京大学医科学研究所の[[石井健]]教授は「(ワクチン開発を)急げば急ぐほど安全性の担保はおろそかになる」と訴えている<ref name="ki200822" />。この懸念に対し、米国国立研究機関博士研究員でウイルス学、免疫学を専門とする峰宗太郎医は「[[動物実験]]などの結果を踏まえると、『(感染予防効果は)あると考えてよい』と思います」<ref>{{Cite web2|title=新型コロナワクチン、「感染予防効果なし」は誤り。ワクチンの効果、副反応について専門家に聞きました(BuzzFeed Japan)|url=https://news.yahoo.co.jp/articles/3dc22fe9b15d1d70b45af7c14ed3671ea1147cfb|website=[[BuzzFeed]]/[[Yahoo!ニュース]]|accessdate=2021-02-03|language=ja}}</ref> と述べている。 |
2020年8月時点でワクチンの開発が急がれた一方、(その時点では)専門家からは「感染そのものを予防する効果は証明が難しい」という懸念が出た。また、東京大学医科学研究所の[[石井健]]教授は「(ワクチン開発を)急げば急ぐほど安全性の担保はおろそかになる」と訴えている<ref name="ki200822" />。この懸念に対し、米国国立研究機関博士研究員でウイルス学、免疫学を専門とする峰宗太郎医師は「[[動物実験]]などの結果を踏まえると、『(感染予防効果は)あると考えてよい』と思います」<ref>{{Cite web2|title=新型コロナワクチン、「感染予防効果なし」は誤り。ワクチンの効果、副反応について専門家に聞きました(BuzzFeed Japan)|url=https://news.yahoo.co.jp/articles/3dc22fe9b15d1d70b45af7c14ed3671ea1147cfb|website=[[BuzzFeed]]/[[Yahoo!ニュース]]|accessdate=2021-02-03|language=ja}}</ref> と述べている。 |
||
日本国内でも「臨床試験の段階で発熱などの[[副作用]]が発生しているケースも見られる<ref name="ki200822" />」とか、2020年12月20日時点で「ファイザー |
日本国内でも「臨床試験の段階で発熱などの[[副作用]]が発生しているケースも見られる<ref name="ki200822" />」とか、2020年12月20日時点で「ファイザー - ビオンテックのワクチンは、27万人への接種で6人(100万人あたり22人)のアナフィラキシーが報告されている<ref>{{Cite web2|title=日本RNA学会 - mRNAワクチン:新型コロナウイルス感染を抑える切り札となるか?|url=https://www.rnaj.org/component/k2/item/855-iizasa-2|website=www.rnaj.org|accessdate=2021-01-23|language=ja-jp|first=飯笹|last=久([[島根大学]]学術研究院医学・看護学系)}}</ref>」とか、2020年1月23日の報道では「モデルナのワクチンは、400万人の接種でアナフィラキシーが起きたのは10人(100万人あたり2.5人)であり、いずれの患者もその後回復した」と報道された<ref>{{Cite web2|title=モデルナのワクチン接種 400万人中激しいアレルギー反応10人|url=https://www3.nhk.or.jp/news/html/20210123/k10012829461000.html|website=NHKニュース|accessdate=2021-01-23|last=日本放送協会}}</ref>。 |
||
日本では2020年12月18日にファイザーが厚生労働省に承認申請を行ったほか、国内メーカや大学などで実用化を目指して開発が行われているが、いずれも2021年に臨床試験を開始する目標であり、まだ実用化はされていない<ref name="nihon-kaihatsu">{{Cite web2|title=新型コロナワクチンの開発状況について|url=https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000121431_00223.html|website=www.mhlw.go.jp|accessdate=2021-01-23|language=ja|publisher=厚生労働省}}</ref>、とされた。 |
日本では2020年12月18日にファイザーが厚生労働省に承認申請を行ったほか、国内メーカや大学などで実用化を目指して開発が行われているが、いずれも2021年に臨床試験を開始する目標であり、まだ実用化はされていない<ref name="nihon-kaihatsu">{{Cite web2|title=新型コロナワクチンの開発状況について|url=https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000121431_00223.html|website=www.mhlw.go.jp|accessdate=2021-01-23|language=ja|publisher=厚生労働省}}</ref>、とされた。 |
||
| 118行目: | 135行目: | ||
2021年2月5日、アストラゼネカが厚生労働省に承認申請を行った<ref name="yuukou-anzen">{{Cite web2|title=新型コロナワクチンの有効性・安全性について|url=https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/vaccine_yuukousei_anzensei.html|website=www.mhlw.go.jp|accessdate=2021-02-19|language=ja|publisher=厚生労働省}}</ref>。 |
2021年2月5日、アストラゼネカが厚生労働省に承認申請を行った<ref name="yuukou-anzen">{{Cite web2|title=新型コロナワクチンの有効性・安全性について|url=https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/vaccine_yuukousei_anzensei.html|website=www.mhlw.go.jp|accessdate=2021-02-19|language=ja|publisher=厚生労働省}}</ref>。 |
||
2021年2月12日、ファイザー製のコロナワクチン |
2021年2月12日、ファイザー製のコロナワクチン「[[トジナメラン|コミナティ]]」の特例承認が了承され、2021年2月14日に正式に特例承認された<ref>{{Cite web2|url=https://www3.nhk.or.jp/news/html/20210212/k10012863821000.html|title=ファイザーワクチン 14日にも正式に特例承認へ 田村厚労相|accessdate=2021-02-12|publisher=NHK(日本放送協会)}}</ref><ref>{{Cite web2|url=https://web.archive.org/web/20210214082806/https://www.jiji.com/jc/article?k=2021021400352&g=soc|title=コロナワクチン正式承認 ファイザー製、「特例」適用―17日にも接種開始・厚労省|accessdate=2021-02-14|publisher=時事通信社}}</ref>。なお、当該ワクチンの法令上の名称は「コロナウイルス修飾ウリジンRNAワクチン(SARS-CoV-2)」である<ref>『[[官報]]』号外特第13号 令和3年2月12日号</ref>。 |
||
2021年3月5日、モデルナのワクチンについて、日本での窓口企業の[[武田薬品工業]]が厚生労働省に承認申請を行った<ref name="nikkei210305">{{Cite web2|title=武田、モデルナ製ワクチン申請 流通網も整備へ|url=https://www.nikkei.com/article/DGXZQODZ02CBO0S1A300C2000000/|website=[[日本経済新聞]]|date=2021-03-05|accessdate=2021-03-21|language=ja|publisher=日本経済新聞社}}</ref>。 |
|||
2021年5月20日、アストラゼネカのコロナワクチンである「バキスゼブリア」とモデルナのコロナワクチンである「COVID-19ワクチンモデルナ」(後に「スパイクバックス」へ名称変更)の特例承認が了承され、2021年5月21日に正式に特例承認された<ref>{{Cite web2|url=https://web.archive.org/web/20210520113136/https://this.kiji.is/768071846821609472?c=39546741839462401|title=ワクチン2種承認を了承 米モデルナと英アストラ製|accessdate=2021-05-20|publisher=[[共同通信社]]}}</ref><ref>{{Cite web2|url=https://www.mixonline.jp/tabid55.html?artid=71117|title=薬食審 モデルナ・アストラゼネカ2社の新型コロナワクチン 5月20日に審議|accessdate=2021-05-20|publisher=ミクスOnline}}</ref>。なお、アストラゼネカのウイルスベクターワクチンについての法令上の名称は「コロナウイルス(SARS-CoV-2)ワクチン(遺伝子組換えサルアデノウイルスベクター)」である<ref>『官報』号外特第43号2頁 令和3年5月21日号</ref>。ただ、モデルナのワクチンについてはファイザーに続いて公的接種の対象とされたものの(後述する大規模会場で使用されている)、アストラゼネカのワクチンについては、諸外国で副反応と見られる[[血栓症]]の発生があったことから、薬事承認はされたものの公的接種の対象外とされた<ref name="mix210521">{{Cite web2|title=厚労省 モデルナとアストラゼネカの新型コロナワクチンを特例承認 モデルナ製のみ公的接種の対象|url=https://www.mixonline.jp/tabid55.html?artid=71139|website=ミクスOnline|date=2021-05-21|accessdate=2021-05-22|language=ja|publisher=株式会社ミクス}}</ref>。その後、同年8月3日に原則40歳以上を対象に公的接種の対象に追加された<ref name="nihon-kaihatsu" />。 |
|||
2021年5月24日、[[ジョンソン・エンド・ジョンソン]]のワクチンについて、傘下の[[ヤンセンファーマ]]が厚生労働省に承認申請を行った<ref name="nikkei210524">{{Cite web2|title=米J&J、1回投与型のコロナワクチン承認申請|url=https://www.nikkei.com/article/DGXZQOUC2250M0S1A520C2000000/|website=[[日本経済新聞]]|date=2021-05-24|accessdate=2021-05-25|language=ja|publisher=日本経済新聞社}}</ref>。2022年5月30日、厚生労働省の専門部会はジョンソン・エンド・ジョンソンのワクチン「ジェコビデン」について製造販売を承認することを了承した<ref>[https://web.archive.org/web/20220530113358/https://nordot.app/903969780276035584 J&Jワクチンの承認了承 コロナで5種類目] - 共同通信 2022年5月30日</ref>。その後、同年6月20日に厚生労働省は「ジェコビデン」の製造販売を承認した。ただし、当該ワクチンに関しては、厚生労働省は予防接種法上の公費負担で打てるワクチンに含めない方針を示しており、希望する場合は原則自己負担になる見込みである<ref>[https://web.archive.org/web/20220620122154/https://nordot.app/911591869178445824?c=39550187727945729 J&Jワクチンを国内で承認 5種類目、接種は自己負担] - 共同通信 2022年6月20日</ref>。 |
|||
2021年7月12日、第一三共はmRNAワクチンの臨床試験を年内に開始すると発表した<ref name=":11">{{Cite web|和書|title=第一三共 コロナワクチン 年内にも数千人規模の臨床試験実施へ|url=https://www3.nhk.or.jp/news/html/20210712/k10013133761000.html|website=NHKニュース|accessdate=2021-07-12|last=日本放送協会}}</ref><ref>{{Cite web|和書|title=国内初となるか mRNAワクチン開発に向け越えるべき「壁」|url=https://mainichi.jp/articles/20210816/k00/00m/040/340000c|website=毎日新聞|accessdate=2021-08-17|language=ja}}</ref>。国内では既に他のワクチン接種が始まっていることから[[偽薬]]との比較は倫理上の問題があるため、他のワクチンとの効果の差を比較する劣性試験を行う予定<ref name=":11" />。 |
|||
2021年12月16日、武田薬品工業はアメリカのバイオテクノロジー企業[[ノババックス]]の組み換えタンパクワクチンについて、厚生労働省へ製造販売承認申請を行ったと発表した<ref>[https://www.nikkei.com/article/DGXZQOUC3025V0Q1A830C2000000/ 新型コロナ: 米ノババックスのコロナワクチン、武田が国内承認申請] 日本経済新聞(2021年12月17日)</ref>。2022年4月19日、厚生労働省はノババックス製の組み換えタンパクワクチン「ヌバキソビッド」について正式に製造販売を承認した。なお、ノババックスの組み換えタンパクワクチンの法令上の名称は「組換えコロナウイルス(SARS-CoV-2)ワクチン」である<ref>『官報』号外特第44号6頁 令和4年4月19日号</ref>。 |
|||
2022年9月20日、[[オミクロン株]]のBA.1に対応した従来株との2価ワクチンの接種を開始した。12歳以上の3回目以降の接種希望者(ブースター接種)が対象となる<ref>[https://www3.nhk.or.jp/news/html/20220921/k10013829081000.html オミクロン 対応ワクチン いつから?副反応は?わかってきたこと] - NHK NEWS WEB 2022年9月21日</ref>。 |
|||
2022年9月30日、導入されている新型コロナウイルスワクチンのうち、アストラゼネカのワクチンについては供給を受けたすべてが有効期限を迎えたため、この日をもって日本での公的接種終了となった。接種対象者を40歳以上に限定していたことから、同種のワクチン接種は9月末までで12万回と低迷していた。供給を受けた5770万回分のうち、自治体に配送されたのはおよそ20万回分に留まり、途上国を中心に海外に無償で供与したのがおよそ4400万回分で、残りのおよそ1350万回分は廃棄した。また、追加を予定していた6230万回分のワクチンの契約はキャンセルされている<ref>[https://www3.nhk.or.jp/news/html/20221002/k10013845211000.html 新型コロナ アストラゼネカのワクチン 有効期限で接種終了] - NHK NEWS WEB 2022年10月2日</ref>。 |
|||
2021年3月5日、モデルナのワクチンについて、日本での窓口企業の[[武田薬品工業]]が厚生労働省に承認申請を行った<ref name="nikkei210305">{{Cite web2|title=武田、モデルナ製ワクチン申請 流通網も整備へ|url=https://www.nikkei.com/article/DGXZQODZ02CBO0S1A300C2000000/|website=[[日本経済新聞]]|date=2021-03-05|accessdate=2021-03-21|language=ja|publisher=日本経済新聞社}}</ref>。 |
|||
日本政府は2021年6月に「ワクチン開発・生産体制強化戦略」を[[閣議決定]]しており、これに基づいて[[国立研究開発法人]][[日本医療研究開発機構]]が2022年3月22日にワクチン開発を手掛ける先進的研究開発戦略センター(SCARDA)を設立した<ref>[https://www.amed.go.jp/news/topics/20220322.html 先進的研究開発戦略センター(SCARDA)を設置しました]日本医療研究開発機構(2022年3月22日)2022年5月10日閲覧</ref>。 |
|||
2021年5月20日、アストラゼネカのコロナワクチンである「バキスゼブリア」とモデルナのコロナワクチンである「COVID-19ワクチンモデルナ」(後に「スパイクバックス」へ名称変更)の特例承認が了承され、2021年5月21日に正式に特例承認された<ref>{{Cite web2|url=https://this.kiji.is/768071846821609472?c=39546741839462401|title=ワクチン2種承認を了承 米モデルナと英アストラ製|accessdate=2021-05-20|publisher=[[共同通信社]]}}</ref><ref>{{Cite web2|url=https://www.mixonline.jp/tabid55.html?artid=71117|title=薬食審 モデルナ・アストラゼネカ2社の新型コロナワクチン 5月20日に審議|accessdate=2021-05-20|publisher=ミクスOnline}}</ref>。なお、アストラゼネカのウイルスベクターワクチンについての法令上の名称は「コロナウイルス(SARS-CoV-2)ワクチン(遺伝子組換えサルアデノウイルスベクター)」である<ref>『官報』号外特第43号2頁 令和3年5月21日号</ref>。ただ、モデルナのワクチンについてはファイザーに続いて公的接種の対象とされたものの(後述する大規模会場で使用されている)、アストラゼネカのワクチンについては、諸外国で副反応と見られる[[血栓症]]の発生があったことから、薬事承認はされたものの公的接種の対象外とされた<ref name="mix210521">{{Cite web2|title=厚労省 モデルナとアストラゼネカの新型コロナワクチンを特例承認 モデルナ製のみ公的接種の対象|url=https://www.mixonline.jp/tabid55.html?artid=71139|website=ミクスOnline|date=2021-05-21|accessdate=2021-05-22|language=ja|publisher=株式会社ミクス}}</ref>。その後、同年8月3日に原則40歳以上を対象に公的接種の対象に追加された<ref name="nihon-kaihatsu" />。 |
|||
2023年7月31日、厚生労働省の専門部会が、第一三共の新型コロナウイルスmRNAワクチン「ダイチロナ」について製造販売を承認する事を了承し、同年8月2日に厚生労働省が「ダイチロナ」の製造販売を承認した。国内企業が開発した新型コロナウイルスの初の販売承認となるが、流行初期の起源株を用いたワクチンであるため、同年秋に国が予定しているワクチンがオミクロン派生型の変異株対応ワクチンを使用する方針であることから同社は出荷は行わず、変異株対応のワクチンも開発を進め、年内の供給を目指している<ref>[https://www.mixonline.jp/tabid55.html?artid=75159 第一三共の国産新型コロナワクチン「ダイチロナ筋注」など6製品承認へ 薬食審・第二部会] - ミクスOnline 2023年8月1日</ref><ref>[https://www.yomiuri.co.jp/medical/20230801-OYT1T50173/ 純国産コロナワクチン第1号、第一三共は供給しない方針…初期流行株用で使用見通しなく] - 読売新聞 2023年8月1日</ref>。一方で塩野義製薬が開発した新型コロナウイルス組み換えタンパクワクチン「コブゴーズ」については、専門部会で国内治験のデータに有効性の疑義が指摘があったことから「有効性を明確に評価するのは難しい」と判断され、継続審議となった<ref>[https://www.sankei.com/article/20230801-GDYRHLJ72NJUPEK5AWHC2W4QWI/ 継続審議の塩野義ワクチン 「有効性」の評価、明暗分かれる] - 産経ニュース 2023年8月1日</ref>。 |
|||
2021年5月24日、[[ジョンソン・エンド・ジョンソン]]のワクチンについて、傘下の[[ヤンセンファーマ]]が厚生労働省に承認申請を行った<ref name="nikkei210524">{{Cite web2|title=米J&J、1回投与型のコロナワクチン承認申請|url=https://www.nikkei.com/article/DGXZQOUC2250M0S1A520C2000000/|website=[[日本経済新聞]]|date=2021-05-24|accessdate=2021-05-25|language=ja|publisher=日本経済新聞社}}</ref>。 |
|||
2023年11月27日、厚生労働省の専門部会が、第一三共が同年9月に申請したXBB1.5対応型のmRNAワクチン「ダイチロナ」の製造販売を承認する事を了承し、翌28日に厚生労働省が「ダイチロナ」XBB1.5対応型の製造販売を承認した。既に同年11月17日に厚生労働省は薬事承認を条件に「ダイチロナ」について140万回分を購入することで合意しており、同年12月以降に国産初のCOVID-19ワクチンとして接種が開始される<ref name="asahi231127">[https://www.asahi.com/articles/ASRCW4V63RCSUTFL00B.html?iref=pc_apital_top 国産初、第一三共のコロナワクチン承認へ 12月以降の接種で使用] - 朝日新聞デジタル 2023年11月17日</ref><ref>[https://www.jiji.com/jc/article?k=2023112800862 第一三共のコロナワクチン承認 国産初の「XBB」対応―厚労省] - 時事ドットコム 2023年11月28日</ref><ref>[https://www.mixonline.jp/tabid55.html?artid=75666 厚労省 第一三共の新型コロナワクチン140万回分購入で合意 国内企業と初の契約] - ミクスOnline 2023年11月20日</ref>。また、[[Meiji Seika ファルマ]]が製造販売するアメリカのバイオテクノロジー企業{{仮リンク|アークトゥルス・セラピューティクス|en|Arcturus_Therapeutics}}が開発した次世代型ワクチンとなる「レプリコン(自己増殖型)」ワクチン「コスタイベ」についても、同日に厚生労働省が製造販売を承認した。ただし「コスタイベ」は起源株を用いたワクチンであるため、この薬事承認時点では出荷は行わず、変異株に対応した2価ワクチンの早期実用化を目指すとしている。Meiji Seika ファルマは創薬支援を手掛ける[[アルカリス]]と同ワクチンの開発製造受託(CDMO)で連携しており、[[福島県]][[南相馬市]]のアルカリスの工場で生産される予定である<ref name="asahi231127"/><ref>[https://www.nikkei.com/article/DGXZQOUC036KR0T00C23A8000000/ 創薬支援の新興、福島にmRNAの新工場 ワクチンなどに] - 日本経済新聞 2023年8月3日</ref><ref>{{PDFlink|[https://www.meiji.com/pdf/news/2023/hd_notice_01.pdf 明治グループの新型コロナワクチンへの取り組み] - 明治グループ 2023年11月9日}}</ref><ref name="meiji">{{PDFlink|[https://www.meiji-seika-pharma.co.jp/pressrelease/2023/detail/pdf/231128_02.pdf 新型コロナウイルス感染症に対する次世代mRNAワクチン(レプリコン)「コスタイベ筋注用」の国内製造販売承認取得に関するお知らせ~次世代mRNAワクチン(レプリコン)として世界で初めての承認~] - Meiji Seika ファルマ株式会社 2023年11月28日}}</ref>。 |
|||
2021年7月12日、第一三共はmRNAワクチンの臨床試験を年内に開始すると発表した<ref name=":11">{{Cite web|title=第一三共 コロナワクチン 年内にも数千人規模の臨床試験実施へ|url=https://www3.nhk.or.jp/news/html/20210712/k10013133761000.html|website=NHKニュース|accessdate=2021-07-12|last=日本放送協会}}</ref><ref>{{Cite web|title=国内初となるか mRNAワクチン開発に向け越えるべき「壁」|url=https://mainichi.jp/articles/20210816/k00/00m/040/340000c|website=毎日新聞|accessdate=2021-08-17|language=ja}}</ref>。国内では既に他のワクチン接種が始まっていることから[[偽薬]]との比較は倫理上の問題があるため、他のワクチンとの効果の差を比較する劣性試験を行う予定<ref name=":11" />。 |
|||
2023年12月25日、厚生労働省は武田薬品工業から供給を受けたノババックスのワクチンについてはこの日をもって有効期限を迎えたため、国内での公的接種が終了となった。同ワクチンは約824万回分が購入され、このうち、およそ約110万回分が自治体に配送された一方で、未使用分の約714万回分は廃棄となった。厚生労働省は「希望する国民全員に接種の機会を提供するため、廃棄は発生したがむだではなかったと認識している」としている<ref>{{PDFlink|[https://www.mhlw.go.jp/content/10906000/001147149.pdf 武田薬品工業株式会社の新型コロナワクチンの供用終了と活用状況等について] - 厚生労働省 2023年12月25日}}</ref><ref>[https://www3.nhk.or.jp/news/html/20231225/k10014299201000.html ノババックスのワクチン 有効期限で国内接種終了へ 厚労省] - NHK NEWS WEB 2023年12月25日</ref>。 |
|||
2021年12月16日、武田薬品工業はアメリカのバイオテクノロジー企業[[ノババックス]]の組み換えタンパクワクチンについて、厚生労働省へ製造販売承認申請を行ったと発表した<ref>[https://www.nikkei.com/article/DGXZQOUC3025V0Q1A830C2000000/ 新型コロナ: 米ノババックスのコロナワクチン、武田が国内承認申請] - 日本経済新聞 2021年12月17日</ref>。2022年4月19日、厚生労働省はノババックス製の組み換えタンパクワクチン(販売名「ヌバキソビッド筋注」)について正式に製造販売が承認された。なお、ノババックスの組み換えタンパクワクチンの法令上の名称は「組換えコロナウイルス(SARS-CoV-2)ワクチン」である<ref>『官報』号外特第44号6頁 令和4年4月19日号</ref>。 |
|||
[[KMバイオロジクス]]では2023年の実用化を目指し[[不活化ワクチン]]の開発を進めている<ref>{{Cite web|title=最終段階の治験、今秋に開始 KMバイオの新型コロナワクチン {{!}} 熊本日日新聞社|url=https://kumanichi.com/articles/284310|website=[[熊本日日新聞|kumanichi.com]]|date=2021-06-24|accessdate=2021-07-12|language=ja}}</ref>。 |
なお、[[KMバイオロジクス]]では2023年の実用化を目指し[[不活化ワクチン]]の開発を進めている<ref>{{Cite web|和書|title=最終段階の治験、今秋に開始 KMバイオの新型コロナワクチン {{!}} 熊本日日新聞社|url=https://kumanichi.com/articles/284310|website=[[熊本日日新聞|kumanichi.com]]|date=2021-06-24|accessdate=2021-07-12|language=ja}}</ref>。 |
||
=== 中国 === |
=== 中国 === |
||
| 137行目: | 166行目: | ||
(上記と同じものかどうかは不明であるが)開発したワクチンの治験開始が3月17日に中国で承認され、陳薇をリーダーとする[[中国人民解放軍軍事科学院]][[:zh:中国人民解放??事科学院?事医学研究院|軍事医学研究院]]の研究者らが治験を開始<ref>{{Cite web2|date=2020-03-17|url=https://jp.reuters.com/article/health-coronavirus-china-vaccine-idJPL4N2BA4I9|title=中国、新型コロナのワクチン治験開始へ|publisher=[[ロイター]]|accessdate=2020-03-18}}</ref>。3月18日に[[中国中央電視台]]も報道した<ref name=gendai-hei3-24/>。 |
(上記と同じものかどうかは不明であるが)開発したワクチンの治験開始が3月17日に中国で承認され、陳薇をリーダーとする[[中国人民解放軍軍事科学院]][[:zh:中国人民解放??事科学院?事医学研究院|軍事医学研究院]]の研究者らが治験を開始<ref>{{Cite web2|date=2020-03-17|url=https://jp.reuters.com/article/health-coronavirus-china-vaccine-idJPL4N2BA4I9|title=中国、新型コロナのワクチン治験開始へ|publisher=[[ロイター]]|accessdate=2020-03-18}}</ref>。3月18日に[[中国中央電視台]]も報道した<ref name=gendai-hei3-24/>。 |
||
3月23日、軍事科学院軍事医学研究院生物工程研究所と{{仮リンク|カンシノ・バイオロジクス|en|CanSino Biologics}}は、独自に開発した新型コロナウイルスワクチン([[アデノウイルス]]媒体)の108人への第1期臨床試験を開始すると報道した<ref name=afp-wak>[[中華人民共和国科学技術部]]が発行する科技日報報道。華西都市報,[https://www.afpbb.com/articles/-/3274745 「中国、新型コロナウイルスのワクチンのヒト臨床試験を開始」][[フランス通信社|AFPBB]](2020年3月23日14:31配信)</ref>。プロジェクト責任者は陳薇 (Chen Wei) [[少将]]で、複製欠陥型ヒト5型アデノウイルスを媒体とし、新型ウイルスのS抗原を作る<ref name=afp-wak/>。感染予防のため、陳薇チーム7人は既に接種済みである<ref name=afp-wak/>。陳薇少将はウイルスのワクチンの研究で博士号を取得しており、これまでに抗SARSウイルス製剤や[[エボラ出血熱]]のワクチン開発に成功したと発表されている<ref name=gendai-hei3-24>{{Cite news|url=https://gendai. |
3月23日、軍事科学院軍事医学研究院生物工程研究所と{{仮リンク|カンシノ・バイオロジクス|en|CanSino Biologics}}は、独自に開発した新型コロナウイルスワクチン([[アデノウイルス]]媒体)の108人への第1期臨床試験を開始すると報道した<ref name=afp-wak>[[中華人民共和国科学技術部]]が発行する科技日報報道。華西都市報,[https://www.afpbb.com/articles/-/3274745 「中国、新型コロナウイルスのワクチンのヒト臨床試験を開始」][[フランス通信社|AFPBB]](2020年3月23日14:31配信)</ref>。プロジェクト責任者は陳薇 (Chen Wei) [[少将]]で、複製欠陥型ヒト5型アデノウイルスを媒体とし、新型ウイルスのS抗原を作る<ref name=afp-wak/>。感染予防のため、陳薇チーム7人は既に接種済みである<ref name=afp-wak/>。陳薇少将はウイルスのワクチンの研究で博士号を取得しており、これまでに抗SARSウイルス製剤や[[エボラ出血熱]]のワクチン開発に成功したと発表されている<ref name=gendai-hei3-24>{{Cite news|url=https://gendai.media/articles/-/71300|title=「新型コロナワクチン」中国人民解放軍が世界に先駆けて開発した背景|website=現代ビジネス|publisher=[[講談社]]|date=2020-03-24}}</ref>。 |
||
2020年5月25日、カンシノ・バイオロジクスは、同年3月から開始していたウイルスベクターワクチンの第1相臨床試験で、ヒトへの効果を世界で初めて確認したと報告した<ref>{{Cite web2|date=2020-05-25 |url=https://www.nikkei.com/article/DGXMZO59531480V20C20A5FFJ000/ |title=中国カンシノ、コロナワクチン「ヒトへの効果確認」 |publisher=ブルームバーグ |accessdate=2020-08-19}}</ref><ref>{{Cite web2|date=2020-07-03 |url=https://www.bloomberg.co.jp/news/articles/2020-07-03/QCTXWJT1UM0X01 |title=カナダと「海亀」、人民解放軍で飛躍-ワクチン開発の中国カンシノ |publisher=ブルームバーグ |accessdate=2020-08-19}}</ref>。6月25日、[[中華人民共和国中央軍事委員会]]は国産ワクチン「[[Ad5-nCoV]]」の使用を[[中国人民解放軍]]に限定して認可したことを決定した<ref>{{Cite web2|date=2020-07-01 |url=https://www.cnn.co.jp/fringe/35156125.html |title=中国で開発中の新型コロナワクチン、軍への使用に限定して承認 |publisher=CNN|accessdate=2020-08-19}}</ref>。7月22日より、医療従事者らを対象にワクチンの緊急使用を開始した<ref>[https://sp.m.jiji.com/article/show/2430826 「中国、ワクチン緊急接種開始=医療従事者らに、実用化急ぐ―新型コロナ」][[時事通信]]ニュース(2020年8月23日)</ref>。 |
2020年5月25日、カンシノ・バイオロジクスは、同年3月から開始していたウイルスベクターワクチンの第1相臨床試験で、ヒトへの効果を世界で初めて確認したと報告した<ref>{{Cite web2|date=2020-05-25 |url=https://www.nikkei.com/article/DGXMZO59531480V20C20A5FFJ000/ |title=中国カンシノ、コロナワクチン「ヒトへの効果確認」 |publisher=ブルームバーグ |accessdate=2020-08-19}}</ref><ref>{{Cite web2|date=2020-07-03 |url=https://www.bloomberg.co.jp/news/articles/2020-07-03/QCTXWJT1UM0X01 |title=カナダと「海亀」、人民解放軍で飛躍-ワクチン開発の中国カンシノ |publisher=ブルームバーグ |accessdate=2020-08-19}}</ref>。6月25日、[[中華人民共和国中央軍事委員会]]は国産ワクチン「[[Ad5-nCoV]]」の使用を[[中国人民解放軍]]に限定して認可したことを決定した<ref>{{Cite web2|date=2020-07-01 |url=https://www.cnn.co.jp/fringe/35156125.html |title=中国で開発中の新型コロナワクチン、軍への使用に限定して承認 |publisher=CNN|accessdate=2020-08-19}}</ref>。7月22日より、医療従事者らを対象にワクチンの緊急使用を開始した<ref>[https://sp.m.jiji.com/article/show/2430826 「中国、ワクチン緊急接種開始=医療従事者らに、実用化急ぐ―新型コロナ」][[時事通信]]ニュース(2020年8月23日)</ref>。 |
||
2020年12月30日、中国の[[シノファーム]]社は国産ワクチン「[[シノファームCOVID-19ワクチン|BBIBP-CorV]]」の有効性を79.34%とし、同年12月9日に中国より先にワクチンを承認して首相の[[ムハンマド・ビン・ラーシド・アール・マクトゥーム]]らが接種していたアラブ首長国連邦が発表した86%よりも低く発表した<ref>{{Cite web2|author=Nectar Gan|title=China's Sinopharm says its coronavirus vaccine is 79% effective|url=https://www.cnn.com/2020/12/30/asia/china-sinopharm-vaccine-efficacy-intl-hnk/index.html|access-date=2021-01-04|website=CNN}}</ref>。翌31日、中国の国家薬品監督管理局はシノファームの「BBIBP-CorV」を承認した<ref>{{Cite web2|title=中国、国産ワクチン承認 アストラゼネカは30億回分生産|url=https://www.nikkei.com/article/DGXZQODL310XI0R31C20A2000000|date=2020-12-31|access-date=2021-01-04|website=日本経済新聞}}</ref>。 |
2020年12月30日、中国の[[シノファーム]]社は国産ワクチン「[[シノファームCOVID-19ワクチン|BBIBP-CorV]]」の有効性を79.34%とし、同年12月9日に中国より先にワクチンを承認して首相の[[ムハンマド・ビン・ラーシド・アール・マクトゥーム]]らが接種していたアラブ首長国連邦が発表した86%よりも低く発表した<ref>{{Cite web2|author=Nectar Gan|title=China's Sinopharm says its coronavirus vaccine is 79% effective|url=https://www.cnn.com/2020/12/30/asia/china-sinopharm-vaccine-efficacy-intl-hnk/index.html|access-date=2021-01-04|website=CNN}}</ref>。翌31日、中国の国家薬品監督管理局はシノファームの「BBIBP-CorV」を承認した<ref>{{Cite web2|title=中国、国産ワクチン承認 アストラゼネカは30億回分生産|url=https://www.nikkei.com/article/DGXZQODL310XI0R31C20A2000000/|date=2020-12-31|access-date=2021-01-04|website=日本経済新聞}}</ref>。 |
||
2021年2月、中国の国家薬品監督管理局は[[シノバック・バイオテック]]社の[[CoronaVac]]とカンシノ・バイオロジクス社の国産ワクチン2種類を承認した<ref>{{Cite web2|title=中国、シノバックの新型コロナワクチン承認 一般向けで2例目|url=https://jp.reuters.com/article/health-coronavirus-vaccine-sinovac-idJPKBN2A70U5|date=2020-02-08|access-date=2021-07-07|website=ロイター}}</ref><ref>{{Cite web2|title=中国、国産コロナワクチンの承認4種に |
2021年2月、中国の国家薬品監督管理局は[[シノバック・バイオテック]]社の[[CoronaVac]]とカンシノ・バイオロジクス社の国産ワクチン2種類を承認した<ref>{{Cite web2|title=中国、シノバックの新型コロナワクチン承認 一般向けで2例目|url=https://jp.reuters.com/article/health-coronavirus-vaccine-sinovac-idJPKBN2A70U5|date=2020-02-08|access-date=2021-07-07|website=ロイター}}</ref><ref>{{Cite web2|title=中国、国産コロナワクチンの承認4種に カンシノなど|url=https://www.nikkei.com/article/DGXZQOGM262WC0W1A220C2000000/|date=2021-02-27|access-date=2021-03-11|website=日本経済新聞}}</ref>。 |
||
2021年5月、世界保健機関は欧米以外のワクチンでは初めてシノファーム社のBBIBP-CorVの緊急使用を承認し<ref>{{Cite web2|title=WHO、中国シノファーム製ワクチンの緊急使用を承認 |
2021年5月、世界保健機関は欧米以外のワクチンでは初めてシノファーム社のBBIBP-CorVの緊急使用を承認し<ref>{{Cite web2|title=WHO、中国シノファーム製ワクチンの緊急使用を承認 欧米以外で初|url=https://www.bbc.com/japanese/57035047|date=2021-05-07|access-date=2021-05-08|website=[[BBC]]}}</ref>、有効性は79%と推定した<ref>{{Cite web2|title=WHO、中国製ワクチン承認 有効性79%、2件目も審査中―新型コロナ|url=https://www.nikkei.com/article/DGXZQOGM262WC0W1A220C2000000/|date=2021-05-08|access-date=2021-05-11|website=[[時事通信]]}}</ref>。 |
||
=== ロシア=== |
=== ロシア=== |
||
| 153行目: | 182行目: | ||
=== アメリカ合衆国 === |
=== アメリカ合衆国 === |
||
[[アメリカ合衆国連邦政府]]は2020年、ワクチンの研究・製造への補助や買取事前契約などに100億ドル以上を投じる「[[オペレーション・ワープ・スピード]]」(超高速作戦)を開始した<ref>「米英、進む接種」『読売新聞』朝刊2021年5月23日2面</ref>。[[アメリカ生物医学先端研究開発局]]は[[アストラゼネカ]](イギリス)や[[サノフィ]](フランス)など他国の製薬企業のワクチン開発も支援している<ref name=":14">{{Cite web|date=2020-05-21|url=https://www.bloomberg.co.jp/news/articles/2020-05-21/QAO518DWRGG701|title=英アストラゼネカ、新型コロナのワクチン開発で米から支援獲得|publisher=ブルームバーグ|accessdate=2020-05-21}}</ref>。 |
[[アメリカ合衆国連邦政府]]は2020年、ワクチンの研究・製造への補助や買取事前契約などに100億ドル以上を投じる「[[オペレーション・ワープ・スピード]]」(超高速作戦)を開始した<ref>「米英、進む接種」『読売新聞』朝刊2021年5月23日2面</ref>。[[アメリカ生物医学先端研究開発局]]は[[アストラゼネカ]](イギリス)や[[サノフィ]](フランス)など他国の製薬企業のワクチン開発も支援している<ref name=":14">{{Cite web|和書|date=2020-05-21|url=https://www.bloomberg.co.jp/news/articles/2020-05-21/QAO518DWRGG701|title=英アストラゼネカ、新型コロナのワクチン開発で米から支援獲得|publisher=ブルームバーグ|accessdate=2020-05-21}}</ref>。 |
||
2020年1月21日、アメリカの感染症薬メーカー、{{仮リンク|ノババックス|en|Novavax}}(Novavax Inc.) は、本ウイルスの感染予防のためのワクチンの開発を始めたと語った<ref>{{Cite web2|date=2020-01-21|url=https://www.bioworld.com/articles/432528-novavax-developing-nanoparticle-vaccine-for-wuhan-coronavirus|title=Novavax developing nanoparticle vaccine for Wuhan coronavirus|publisher=BioWorld|accessdate=2020-02-08}}</ref><ref>{{Cite web2|date=2020-01-29|url=https://bio.nikkeibp.co.jp/atcl/news/p1/20/01/28/06478/|title=新型コロナウイルス、多様なワクチン開発へ世界中で参入企業相次ぐ|publisher=[[日経BP]]|accessdate=2020-02-08}}</ref>。 |
2020年1月21日、アメリカの感染症薬メーカー、{{仮リンク|ノババックス|en|Novavax|redirect=1}}(Novavax Inc.) は、本ウイルスの感染予防のためのワクチンの開発を始めたと語った<ref>{{Cite web2|date=2020-01-21|url=https://www.bioworld.com/articles/432528-novavax-developing-nanoparticle-vaccine-for-wuhan-coronavirus|title=Novavax developing nanoparticle vaccine for Wuhan coronavirus|publisher=BioWorld|accessdate=2020-02-08}}</ref><ref>{{Cite web2|date=2020-01-29|url=https://bio.nikkeibp.co.jp/atcl/news/p1/20/01/28/06478/|title=新型コロナウイルス、多様なワクチン開発へ世界中で参入企業相次ぐ|publisher=[[日経BP]]|accessdate=2020-02-08}}</ref>。 |
||
2020年1月29日、米医薬品・日用品大手[[ジョンソン・エンド・ジョンソン]] (J&J) は、COVID-19 ワクチンの開発に着手したと発表した。[[エボラ出血熱]]のワクチン開発に利用した技術を応用する。このワクチンは現在、[[コンゴ民主共和国]]と[[ルワンダ]]で投与されている<ref name="reuter20200131">{{Cite web2|date=2020-01-31|url=https://jp.reuters.com/article/roche-coronavirus-idJPKBN1ZT2FB|title=ロシュ、新型ウイルス検出キットの供給困難 中国の都市閉鎖で|publisher=[[ロイター]]|accessdate=2020-02-02}}</ref>。「すでに多数の研究者をワクチン開発に投入しており、1カ月以内には何らかの成果が出せると確信している。世界市場に向けた量産体制はすでに整っているので、ワクチンが完成すれば、1年以内に億単位の出荷が可能」という<ref>{{Cite news|date=2020-02-06|url=https://www.mixonline.jp/tabid55.html?artid=68730|title=J&J新型コロナのワクチン開発に自信 ギリアドも開発に乗り出す|publisher=[https://www.mixonline.jp/ ミクス]|accessdate=2020-02-06}}</ref>。 |
2020年1月29日、米医薬品・日用品大手[[ジョンソン・エンド・ジョンソン]] (J&J) は、COVID-19 ワクチンの開発に着手したと発表した。[[エボラ出血熱]]のワクチン開発に利用した技術を応用する。このワクチンは現在、[[コンゴ民主共和国]]と[[ルワンダ]]で投与されている<ref name="reuter20200131">{{Cite web2|date=2020-01-31|url=https://jp.reuters.com/article/roche-coronavirus-idJPKBN1ZT2FB|title=ロシュ、新型ウイルス検出キットの供給困難 中国の都市閉鎖で|publisher=[[ロイター]]|accessdate=2020-02-02}}</ref>。「すでに多数の研究者をワクチン開発に投入しており、1カ月以内には何らかの成果が出せると確信している。世界市場に向けた量産体制はすでに整っているので、ワクチンが完成すれば、1年以内に億単位の出荷が可能」という<ref>{{Cite news|date=2020-02-06|url=https://www.mixonline.jp/tabid55.html?artid=68730|title=J&J新型コロナのワクチン開発に自信 ギリアドも開発に乗り出す|publisher=[https://www.mixonline.jp/ ミクス]|accessdate=2020-02-06}}</ref>。 |
||
| 170行目: | 199行目: | ||
しかし、アストラゼネカのワクチンについてはその後、各国で懸念が示されることとなる。2021年1月29日にはフランスの[[エマニュエル・マクロン]]大統領が、同社製のワクチンは60 - 65歳以上の高齢者にはほぼ効果がないと発言し<ref name=afpbb3329244>{{Cite news|url=https://www.afpbb.com/articles/-/3329244|title=アストラゼネカ製ワクチン65歳以上に効果なし、仏大統領が主張|work=AFPBB News|agency=[[フランス通信社]]|date=2021-01-30|accessdate=2021-03-18}}</ref>、同国保健当局が2月2日に65歳以上の高齢者には接種しないよう勧告したのをはじめ、ドイツ、イタリア、スウェーデンの保健当局も高齢者への接種を行わないよう勧告した<ref>{{Cite news|url=https://www.afpbb.com/articles/-/3329824|title=アストラゼネカ製ワクチン、仏も推奨65歳以下 欧州に同様の動き|work=AFPBB News|agency=フランス通信社|date=2021-02-03|accessdate=2021-03-18}}</ref>。ただし、[[欧州医薬品庁]](EMA)は全年齢層の成人への接種を推奨した<ref name=afpbb3329244 />。 |
しかし、アストラゼネカのワクチンについてはその後、各国で懸念が示されることとなる。2021年1月29日にはフランスの[[エマニュエル・マクロン]]大統領が、同社製のワクチンは60 - 65歳以上の高齢者にはほぼ効果がないと発言し<ref name=afpbb3329244>{{Cite news|url=https://www.afpbb.com/articles/-/3329244|title=アストラゼネカ製ワクチン65歳以上に効果なし、仏大統領が主張|work=AFPBB News|agency=[[フランス通信社]]|date=2021-01-30|accessdate=2021-03-18}}</ref>、同国保健当局が2月2日に65歳以上の高齢者には接種しないよう勧告したのをはじめ、ドイツ、イタリア、スウェーデンの保健当局も高齢者への接種を行わないよう勧告した<ref>{{Cite news|url=https://www.afpbb.com/articles/-/3329824|title=アストラゼネカ製ワクチン、仏も推奨65歳以下 欧州に同様の動き|work=AFPBB News|agency=フランス通信社|date=2021-02-03|accessdate=2021-03-18}}</ref>。ただし、[[欧州医薬品庁]](EMA)は全年齢層の成人への接種を推奨した<ref name=afpbb3329244 />。 |
||
また2021年3月になってアストラゼネカ製のワクチンに接種後に[[血栓]]が発生するなどの副反応事例が報告されたためドイツ、フランス、イタリア、スペイン、デンマーク<ref>{{Cite news|url=https://news.tbs.co.jp/newseye/tbs_newseye4219991.html|title=デンマークでアストラゼネカ製ワクチンの接種中断、一部患者に血栓症|agency=[[TBSテレビ|TBS]] News|date=2021-03-12|accessdate=2021-03-18}}</ref>、アイスランド、ノルウェー<ref>{{Cite news|url=https://www.cnn.co.jp/world/35167714.html|title=アストラゼネカ製ワクチン、欧州各国が相次ぎ使用中断 血栓との関係調査|work=CNN.co.jp|agency=[[CNN]]|date=2021-03-12|accessdate=2021-03-18}}</ref>、オランダ<ref>{{Cite news|url=https://www.bbc.com/japanese/56399467|title=アストラゼネカ製ワクチン、オランダも使用停止|work=BBC News|agency=[[英国放送協会|BBC]]|date=2021-03-15|accessdate=2021-03-18}}</ref>、タイ<ref>{{Cite news|url=https://www.bbc.com/japanese/56369666|title=タイ、英アストラゼネカ製ワクチンの使用延期 血栓報告受け|work=BBC News|agency=BBC|date=2021-03-12|accessdate=2021-03-18}}</ref> など接種を中断する国が続出した。3月15日にはWHOが同社製ワクチンと血栓の発生に因果関係は認められず、ワクチン接種を継続するようコメントを発表する事態となった<ref>{{Cite news|url=https://www.bbc.com/japanese/56398360|title=アストラゼネカのワクチン、WHOが接種継続呼びかけ |
また2021年3月になってアストラゼネカ製のワクチンに接種後に[[血栓]]が発生するなどの副反応事例が報告されたためドイツ、フランス、イタリア、スペイン、デンマーク<ref>{{Cite news|url=https://news.tbs.co.jp/newseye/tbs_newseye4219991.html|title=デンマークでアストラゼネカ製ワクチンの接種中断、一部患者に血栓症|agency=[[TBSテレビ|TBS]] News|date=2021-03-12|accessdate=2021-03-18}}</ref>、アイスランド、ノルウェー<ref>{{Cite news|url=https://www.cnn.co.jp/world/35167714.html|title=アストラゼネカ製ワクチン、欧州各国が相次ぎ使用中断 血栓との関係調査|work=CNN.co.jp|agency=[[CNN]]|date=2021-03-12|accessdate=2021-03-18}}</ref>、オランダ<ref>{{Cite news|url=https://www.bbc.com/japanese/56399467|title=アストラゼネカ製ワクチン、オランダも使用停止|work=BBC News|agency=[[英国放送協会|BBC]]|date=2021-03-15|accessdate=2021-03-18}}</ref>、タイ<ref>{{Cite news|url=https://www.bbc.com/japanese/56369666|title=タイ、英アストラゼネカ製ワクチンの使用延期 血栓報告受け|work=BBC News|agency=BBC|date=2021-03-12|accessdate=2021-03-18}}</ref> など接種を中断する国が続出した。3月15日にはWHOが同社製ワクチンと血栓の発生に因果関係は認められず、ワクチン接種を継続するようコメントを発表する事態となった<ref>{{Cite news|url=https://www.bbc.com/japanese/56398360|title=アストラゼネカのワクチン、WHOが接種継続呼びかけ 血栓と因果「証拠なし」と|work=BBC News|agency=BBC|date=2021-03-16|accessdate=2021-03-18}}</ref>。これを受けフランスやドイツでは接種を再開した<ref name=nhk20210323>{{Cite news|url=https://www3.nhk.or.jp/news/html/20210323/k10012930031000.html|title=アストラゼネカ ワクチン“79%の有効性” 米などで臨床試験|work=NHK NEWSWEB|agency=NHK|date=2021-03-23|accessdate=2021-03-24}}</ref>。 |
||
アストラゼネカによる臨床試験では79%の有効性が確認されたと2021年3月22日に発表されている<ref name=nhk20210323 />。しかし[[アメリカ国立アレルギー・感染症研究所]]は、古い不完全な治験データが含まれていた可能性があると指摘し、最新の正確な情報を提供するよう要求。アストラゼネカも48時間以内の最新データ提供を表明した<ref>{{Cite news|url=https://jp.reuters.com/article/health-coronavirus-astrazeneca-u-s-idJPKBN2BF0IM|title=英アストラ製ワクチン、米治験データは不完全な可能性=米感染研|agency=ロイター|date=2021-03-23|accessdate=2021-03-24}}</ref>。その結果、有効性は76%へと訂正された<ref>{{Cite news|url=https://www.afpbb.com/articles/-/3338677|title=アストラゼネカ、新型コロナワクチンの有効性76%に修正|work=AFPBB News|agency=フランス通信社|date=2021-03-25|accessdate=2021-03-25}}</ref>。 |
アストラゼネカによる臨床試験では79%の有効性が確認されたと2021年3月22日に発表されている<ref name=nhk20210323 />。しかし[[アメリカ国立アレルギー・感染症研究所]]は、古い不完全な治験データが含まれていた可能性があると指摘し、最新の正確な情報を提供するよう要求。アストラゼネカも48時間以内の最新データ提供を表明した<ref>{{Cite news|url=https://jp.reuters.com/article/health-coronavirus-astrazeneca-u-s-idJPKBN2BF0IM|title=英アストラ製ワクチン、米治験データは不完全な可能性=米感染研|agency=ロイター|date=2021-03-23|accessdate=2021-03-24}}</ref>。その結果、有効性は76%へと訂正された<ref>{{Cite news|url=https://www.afpbb.com/articles/-/3338677|title=アストラゼネカ、新型コロナワクチンの有効性76%に修正|work=AFPBB News|agency=フランス通信社|date=2021-03-25|accessdate=2021-03-25}}</ref>。 |
||
| 178行目: | 207行目: | ||
=== インド === |
=== インド === |
||
[[インド]]では国産ワクチン2種の接種が2021年1月16日に開始された。インドには世界最大級のワクチン製造機関であるインド血清研究所(SII)があり、輸出も行われているが、原材料はアメリカやEUからの輸入に頼っている<ref name=":12">{{Cite web|title=ワクチン製造大国のはずが、国民には「在庫切れで接種できず」…海外には6400万回分輸出 : 国際 : ニュース|url=https://www.yomiuri.co.jp/world/20210412-OYT1T50171/|website=読売新聞オンライン|date=2021-04-12|accessdate=2021-07-23|language=ja}}</ref>。 |
[[インド]]では国産ワクチン2種の接種が2021年1月16日に開始された。インドには世界最大級のワクチン製造機関であるインド血清研究所(SII)があり、輸出も行われているが、原材料はアメリカやEUからの輸入に頼っている<ref name=":12">{{Cite web|和書|title=ワクチン製造大国のはずが、国民には「在庫切れで接種できず」…海外には6400万回分輸出 : 国際 : ニュース|url=https://www.yomiuri.co.jp/world/20210412-OYT1T50171/|website=読売新聞オンライン|date=2021-04-12|accessdate=2021-07-23|language=ja}}</ref>。 |
||
国内で流通するのは国内の製薬企業{{ |
国内で流通するのは国内の製薬企業{{仮リンク|バーラト・バイオテック|en|Bharat Biotech}}社と{{仮リンク|インド医学研究評議会|en|Indian Council of Medical Research}}が共同開発しSIIで製造されている「[[Covaxin|コバクシン]]」<ref name=":12" /> と、アストラゼネカが開発しバーラト・バイオテックが[[ライセンス生産]]する「[[AZD1222|コビシールド]]」であり、前者は承認段階で有効性を証明するデータが示されていなかった<ref>「印、国産ワクチン接種開始 2種承認 安全性懸念も」『読売新聞』朝刊2021年1月17日(国際面)</ref>。その後の治験では有効性81%と評価されている<ref>{{Cite news|url=https://www.cnn.co.jp/business/35167314.html|title=インド国産ワクチン「コバクシン」、有効性81%|work=CNN.co.jp|agency=[[CNN]]|date=2021-03-04|accessdate=2021-03-18}}</ref>。 |
||
=== |
=== 中華民国 === |
||
[[台湾]]では、{{ |
[[中華民国]]([[台湾]])では、{{仮リンク|メディジェン・ワクチン・バイオロジクス|zh|高端疫苗生物製劑}}({{Lang-zh|高端疫苗生物製剤}}、[[新竹県]])が[[アメリカ国立衛生研究所]]の協力を得て開発した{{仮リンク|MVC COVID-19ワクチン|en|MVC COVID-19 vaccine}}対して2021年7月に緊急使用許可が出された。2021年8月23日に接種が開始され、[[蔡英文]][[中華民国総統|総統]]は同日早朝に率先して接種を受けた<ref>{{Cite news|title=台湾、自主開発ワクチンの接種開始 批判の声も|url=https://www.bbc.com/japanese/58302101|work=BBCニュース|accessdate=2021-08-28|language=ja}}</ref><ref>{{Cite web|和書|title=台湾が自前のワクチン開発、蔡総統が率先し市民に接種呼びかけ…野党は緊急使用許可の経緯に疑義 : 国際 : ニュース|url=https://www.yomiuri.co.jp/world/20210823-OYT1T50126/|website=読売新聞オンライン|date=2021-08-23|accessdate=2021-08-28|language=ja}}</ref>。 |
||
蔡英文は、従来は中国の妨害により民間の調達や日本やアメリカからの無償供与以外ではワクチンの輸入が難しかったと述べている<ref>{{Cite news|title=台湾と独ビオンテックのワクチン契約、中国が妨害=蔡総統|url=https://jp.reuters.com/article/health-coronavirus-taiwan-china-idJPKCN2D70ZD|work=Reuters|date=2021-05-26|accessdate=2021-08-25|language=ja|first=Reuters|last=Staff}}</ref>。 |
蔡英文は、従来は中華人民共和国の妨害により、民間の調達や日本やアメリカからの無償供与以外では、ワクチンの輸入が難しかったと述べている<ref>{{Cite news|title=台湾と独ビオンテックのワクチン契約、中国が妨害=蔡総統|url=https://jp.reuters.com/article/health-coronavirus-taiwan-china-idJPKCN2D70ZD|work=Reuters|date=2021-05-26|accessdate=2021-08-25|language=ja|first=Reuters|last=Staff}}</ref>。 |
||
=== 東南アジア諸国 === |
=== 東南アジア諸国 === |
||
[[ベトナム]]のナノジェン製薬バイオテクノロジーは[[ベトナム人民軍|ベトナム軍医大学]]と共同で「ナノコバックス」を開発中であり、2021年2月に[[治験#第II相試験(フェーズ II)|第2段階の治験]]、6月10日に最終段階の治験を開始した<ref>{{Cite web|title=ベトナム、国産ワクチンの最終治験開始 年内製品化へ|url=https://www.nikkei.com/article/DGXZQOGM11DQY0R10C21A6000000/|website=日本経済新聞|date=2021-06-14|accessdate=2021-07-23|language=ja}}</ref>。 |
[[ベトナム]]のナノジェン製薬バイオテクノロジーは[[ベトナム人民軍|ベトナム軍医大学]]と共同で「ナノコバックス」を開発中であり、2021年2月に[[治験#第II相試験(フェーズ II)|第2段階の治験]]、6月10日に最終段階の治験を開始した<ref>{{Cite web|和書|title=ベトナム、国産ワクチンの最終治験開始 年内製品化へ|url=https://www.nikkei.com/article/DGXZQOGM11DQY0R10C21A6000000/|website=日本経済新聞|date=2021-06-14|accessdate=2021-07-23|language=ja}}</ref>。 |
||
[[インドネシア]]では[[アイルランガ大学]]など7つの研究機関が開発中<ref name=":13" />。 |
[[インドネシア]]では[[アイルランガ大学]]など7つの研究機関が開発中<ref name=":13" />。 |
||
| 199行目: | 228行目: | ||
=== キューバ === |
=== キューバ === |
||
[[キューバ]]は、WHO未承認であるものの国産ワクチンを製造しており、2021年9月16日には子供(2 - 11歳)にも接種対象を広げた<ref>「2〜11歳接種 キューバ開始」『読売新聞』朝刊2021年9月18日(国際面)</ref>。 |
[[キューバ]]は、WHO未承認であるものの国産ワクチンを製造しており、2021年9月16日には子供(2 - 11歳)にも接種対象を広げた<ref>「2〜11歳接種 キューバ開始」『読売新聞』朝刊2021年9月18日(国際面)</ref>。 |
||
=== 韓国 === |
|||
2022年6月29日、[[大韓民国|韓国]]政府はSKバイオサイエンス社が開発した新型コロナウイルスのワクチン[[SKYCovione]]を認可したと発表した<ref name=":6">{{Cite web|和書|title=韓国、コロナ国産ワクチンを初認可 |url=https://www.sankei.com/article/20220629-FOFHXCCOAZMCLM65745TPQ7X3Q/ |website=産経ニュース |date=2022-06-29 |access-date=2022-07-17 |publisher=産経新聞社}}</ref>。韓国の国産ワクチンの認可は初めて<ref name=":6" />。新型コロナのワクチンと治療薬両方を独自に開発・生産するのは米英に続き3カ国目<ref name=":6" />。当局によると、同ワクチンは冷蔵保管が可能で、超低温冷凍などは不要<ref name=":6" />。一方、オミクロン変異株などに対する有効性は「研究中」としており、具体的な供給計画は固まっていない<ref name=":6" />。 |
|||
== {{Anchors|テクノロジープラットフォーム}}ワクチンの種類 == |
== {{Anchors|テクノロジープラットフォーム}}ワクチンの種類 == |
||
| 205行目: | 237行目: | ||
臨床試験中のワクチン候補のプラットフォームのほとんどは、COVID-19感染の主要[[抗原]]としてのコロナウイルス[[SARSコロナウイルス2#構造|スパイクタンパク質]]とその変異体に焦点を当てている<ref name="thanh2" />。2020年に開発されたプラットフォームには、[[核酸]]技術([[ヌクレオシド修飾メッセンジャーRNA]]および[[DNA]])、[[ウイルスベクター#ワクチン|非複製ウイルスベクター]]、[[ペプチドワクチン|ペプチド]]、[[組換えタンパク質]]、[[弱毒化ウイルス]]、[[不活化ウイルス]]などがある<ref name="diamond"/><ref name="gates2"/><ref name="thanh"/>。 |
臨床試験中のワクチン候補のプラットフォームのほとんどは、COVID-19感染の主要[[抗原]]としてのコロナウイルス[[SARSコロナウイルス2#構造|スパイクタンパク質]]とその変異体に焦点を当てている<ref name="thanh2" />。2020年に開発されたプラットフォームには、[[核酸]]技術([[ヌクレオシド修飾メッセンジャーRNA]]および[[DNA]])、[[ウイルスベクター#ワクチン|非複製ウイルスベクター]]、[[ペプチドワクチン|ペプチド]]、[[組換えタンパク質]]、[[弱毒化ウイルス]]、[[不活化ウイルス]]などがある<ref name="diamond"/><ref name="gates2"/><ref name="thanh"/>。 |
||
COVID-19のために開発されている多くのワクチン技術は、インフルエンザを予防するために既に使用されているワクチンとは異なり、COVID‑19感染メカニズムの精度を高めるために「次世代」戦略を使用している<ref name="diamond"/><ref name="thanh2" />。いくつかの合成ワクチンでは、2P変異を利用して[[スパイクタンパク質]]を融合前構造に固定し、ウイルスがヒトの細胞に付着する前に免疫応答を刺激する<ref>{{Cite journal2|last1=Cross|first1=Ryan|date=29 September 2020|title=The tiny tweak behind COVID-19 vaccines|url=https://cen.acs.org/pharmaceuticals/vaccines/tiny-tweak-behind-COVID-19/98/i38|journal=Chemical & Engineering News|volume=98|issue=38}}</ref>。開発中のワクチンプラットフォームは、抗原操作の柔軟性を高め、医療従事者、高齢者、子供、妊婦、[[免疫系|免疫力]]が低下している人など、COVID-19の感染しやすい人々の感染メカニズムをターゲットとした効果が期待できる |
COVID-19のために開発されている多くのワクチン技術は、インフルエンザを予防するために既に使用されているワクチンとは異なり、COVID‑19感染メカニズムの精度を高めるために「次世代」戦略を使用している<ref name="diamond"/><ref name="thanh2" />。いくつかの合成ワクチンでは、2P変異を利用して[[スパイクタンパク質]]を融合前構造に固定し、ウイルスがヒトの細胞に付着する前に免疫応答を刺激する<ref>{{Cite journal2|last1=Cross|first1=Ryan|date=29 September 2020|title=The tiny tweak behind COVID-19 vaccines|url=https://cen.acs.org/pharmaceuticals/vaccines/tiny-tweak-behind-COVID-19/98/i38|journal=Chemical & Engineering News|volume=98|issue=38}}</ref>。開発中のワクチンプラットフォームは、抗原操作の柔軟性を高め、医療従事者、高齢者、子供、妊婦、[[免疫系|免疫力]]が低下している人など、COVID-19の感染しやすい人々の感染メカニズムをターゲットとした効果が期待できる<ref name="thanh2" /><ref name="thanh"/>。 |
||
{{Gallery |
{{Gallery |
||
|width=530 |
|width=530 |
||
|ファイル:Vaccine_candidate_mechanisms_for_SARS-CoV-2_(49948301838).jpg|SARS-CoV-2タンパク質を形成して免疫反応を促すための3種類のワクチンを示す概念図。(1)[[RNAワクチン]]、(2)[[サブユニットワクチン]]、(3)[[ウイルスベクター |
|ファイル:Vaccine_candidate_mechanisms_for_SARS-CoV-2_(49948301838).jpg|SARS-CoV-2タンパク質を形成して免疫反応を促すための3種類のワクチンを示す概念図。(1)[[RNAワクチン]]、(2)[[サブユニットワクチン]]、(3)[[ウイルスベクターワクチン]] |
||
|ファイル:Fimmu-11-579250-g004.jpg|SARS-CoV-2に採用されているワクチンのプラットフォーム。全ウイルスワクチンには、[[生ワクチン|弱毒化されたウイルス]]と[[不活化ワクチン|不活性化されたウイルス]]の両方が含まれる。タンパク質および[[ペプチドワクチン|ペプチド]][[サブユニットワクチン|サブユニット]]ワクチンは通常、免疫原性を高めるために[[アジュバント]]と組み合わされる。SARS-CoV-2ワクチン開発では、三量体の[[スパイクタンパク質]]全体、または受容体結合領域([[:en:Binding domain|RBD]])などの構成要素を使用することに重点が置かれている。複数の非複製[[ウイルスベクターワクチン]]が開発されており、特に[[アデノウイルス]]に焦点が当てられている。一方、複製ウイルスベクターのコンストラクトはあまり重視されていない |
|ファイル:Fimmu-11-579250-g004.jpg|SARS-CoV-2に採用されているワクチンのプラットフォーム。全ウイルスワクチンには、[[生ワクチン|弱毒化されたウイルス]]と[[不活化ワクチン|不活性化されたウイルス]]の両方が含まれる。タンパク質および[[ペプチドワクチン|ペプチド]][[サブユニットワクチン|サブユニット]]ワクチンは通常、免疫原性を高めるために[[アジュバント]]と組み合わされる。SARS-CoV-2ワクチン開発では、三量体の[[スパイクタンパク質]]全体、または受容体結合領域([[:en:Binding domain|RBD]])などの構成要素を使用することに重点が置かれている。複数の非複製[[ウイルスベクターワクチン]]が開発されており、特に[[アデノウイルス]]に焦点が当てられている。一方、複製ウイルスベクターのコンストラクトはあまり重視されていない<ref>{{Cite journal2|last1=Flanagan|first1=Katie L.|last2=Best|first2=Emma|last3=Crawford|first3=Nigel W.|last4=Giles|first4=Michelle|last5=Koirala|first5=Archana|last6=Macartney|first6=Kristine|last7=Russell|first7=Fiona|last8=Teh|first8=Benjamin W.|last9=Wen|first9=Sophie CH|date=2020|title=Progress and Pitfalls in the Quest for Effective SARS-CoV-2 (COVID-19) Vaccines|journal=Frontiers in Immunology|volume=11|page=579250|doi=10.3389/fimmu.2020.579250|issn=1664-3224|pmid=33123165|pmc=7566192|doi-access=free}}</ref>。 |
||
}} |
}} |
||
=== RNAワクチン === |
=== RNAワクチン === |
||
| 216行目: | 248行目: | ||
[[RNAワクチン]]には[[リボ核酸|RNA]]が含まれており、組織に導入されると[[メッセンジャーRNA]](mRNA)として働き、細胞に外来タンパク質を作らせ、[[適応免疫|適応免疫反応]]を刺激して、対応する[[病原体]]や[[悪性腫瘍|がん細胞]]を識別して破壊する方法を体に教える。RNAワクチンは、[[ヌクレオシド修飾メッセンジャーRNA]]を使用することがよくあるが、必ずしもそうとは限らない。mRNAの送達は、RNA鎖を保護し、細胞への吸収を助ける[[脂質ナノ粒子]]に分子を共製剤化することによって実現される<ref>{{Cite journal2|date=October 2020|title=SARS-CoV-2 vaccines in development|url=http://www.nature.com/articles/s41586-020-2798-3|journal=Nature|volume=586|issue=7830|pages=516–27|bibcode=2020Natur.586..516K|doi=10.1038/s41586-020-2798-3|pmid=32967006|vauthors=Krammer F|doi-access=free|s2cid=221887746}}</ref><ref name="pmid33340620">{{Cite journal2|date=December 2020|title=Non-viral COVID-19 vaccine delivery systems|journal=Advanced Drug Delivery Reviews|volume=169|pages=137–51|doi=10.1016/j.addr.2020.12.008|pmid=33340620|pmc=7744276|vauthors=Park KS, Sun X, Aikins ME, Moon JJ}}</ref><ref name="Kowalski">{{Cite journal2|date=April 2019|title=Delivering the Messenger: Advances in Technologies for Therapeutic mRNA Delivery|journal=Mol Ther|volume=27|issue=4|pages=710–28|doi=10.1016/j.ymthe.2019.02.012|pmid=30846391|pmc=6453548|vauthors=Kowalski PS, Rudra A, Miao L, Anderson DG}}</ref><ref name="Verbeke_2019">{{Cite journal2|date=October 2019|title=Three decades of messenger RNA vaccine development|url=https://biblio.ugent.be/publication/8628303|journal=Nano Today|volume=28|pages=100766|doi=10.1016/j.nantod.2019.100766|vauthors=Verbeke R, Lentacker I, De Smedt SC, Dewitte H}}</ref>。この技術の開発は、[[ペンシルベニア大学]]の免疫学者、[[ドリュー・ワイスマン]]と[[カリコー・カタリン]]による<ref>{{Cite web|title=The story of mRNA: From a loose idea to a tool that may help curb Covid|url=https://www.statnews.com/2020/11/10/the-story-of-mrna-how-a-once-dismissed-idea-became-a-leading-technology-in-the-covid-vaccine-race/|website=STAT|date=2020-11-10|accessdate=2021-07-31|language=en-US}}</ref><ref>{{Cite web|title=Lewis S. Rosenstiel Award for Distinguished Work in Basic Medical Research|url=https://www.brandeis.edu/rosenstiel/rosenstiel-award/index.html|website=www.brandeis.edu|accessdate=2021-07-31|language=en}}</ref>。 |
[[RNAワクチン]]には[[リボ核酸|RNA]]が含まれており、組織に導入されると[[メッセンジャーRNA]](mRNA)として働き、細胞に外来タンパク質を作らせ、[[適応免疫|適応免疫反応]]を刺激して、対応する[[病原体]]や[[悪性腫瘍|がん細胞]]を識別して破壊する方法を体に教える。RNAワクチンは、[[ヌクレオシド修飾メッセンジャーRNA]]を使用することがよくあるが、必ずしもそうとは限らない。mRNAの送達は、RNA鎖を保護し、細胞への吸収を助ける[[脂質ナノ粒子]]に分子を共製剤化することによって実現される<ref>{{Cite journal2|date=October 2020|title=SARS-CoV-2 vaccines in development|url=http://www.nature.com/articles/s41586-020-2798-3|journal=Nature|volume=586|issue=7830|pages=516–27|bibcode=2020Natur.586..516K|doi=10.1038/s41586-020-2798-3|pmid=32967006|vauthors=Krammer F|doi-access=free|s2cid=221887746}}</ref><ref name="pmid33340620">{{Cite journal2|date=December 2020|title=Non-viral COVID-19 vaccine delivery systems|journal=Advanced Drug Delivery Reviews|volume=169|pages=137–51|doi=10.1016/j.addr.2020.12.008|pmid=33340620|pmc=7744276|vauthors=Park KS, Sun X, Aikins ME, Moon JJ}}</ref><ref name="Kowalski">{{Cite journal2|date=April 2019|title=Delivering the Messenger: Advances in Technologies for Therapeutic mRNA Delivery|journal=Mol Ther|volume=27|issue=4|pages=710–28|doi=10.1016/j.ymthe.2019.02.012|pmid=30846391|pmc=6453548|vauthors=Kowalski PS, Rudra A, Miao L, Anderson DG}}</ref><ref name="Verbeke_2019">{{Cite journal2|date=October 2019|title=Three decades of messenger RNA vaccine development|url=https://biblio.ugent.be/publication/8628303|journal=Nano Today|volume=28|pages=100766|doi=10.1016/j.nantod.2019.100766|vauthors=Verbeke R, Lentacker I, De Smedt SC, Dewitte H}}</ref>。この技術の開発は、[[ペンシルベニア大学]]の免疫学者、[[ドリュー・ワイスマン]]と[[カリコー・カタリン]]による<ref>{{Cite web|title=The story of mRNA: From a loose idea to a tool that may help curb Covid|url=https://www.statnews.com/2020/11/10/the-story-of-mrna-how-a-once-dismissed-idea-became-a-leading-technology-in-the-covid-vaccine-race/|website=STAT|date=2020-11-10|accessdate=2021-07-31|language=en-US}}</ref><ref>{{Cite web|title=Lewis S. Rosenstiel Award for Distinguished Work in Basic Medical Research|url=https://www.brandeis.edu/rosenstiel/rosenstiel-award/index.html|website=www.brandeis.edu|accessdate=2021-07-31|language=en}}</ref>。 |
||
RNAワクチンは、米国および欧州連合で認可された最初のCOVID-19ワクチンである<ref>{{Cite web2|title=COVID-19 ACIP Vaccine Recommendations|website=[[:en:Centers for Disease Control and Prevention|Centers for Disease Control and Prevention]] (CDC)|url=https://www.cdc.gov/vaccines/hcp/acip-recs/vacc-specific/covid-19.html|access-date=18 February 2021}}</ref><ref>{{Cite web2|url=https://ec.europa.eu/info/live-work-travel-eu/coronavirus-response/safe-covid-19-vaccines-europeans_en|title=Safe COVID-19 vaccines for Europeans|website=European Commission – European Commission|access-date=19 February 2021}}</ref>。2021年1月時点、このタイプの認可されたワクチンは、[[ |
RNAワクチンは、米国および欧州連合で認可された最初のCOVID-19ワクチンである<ref>{{Cite web2|title=COVID-19 ACIP Vaccine Recommendations|website=[[:en:Centers for Disease Control and Prevention|Centers for Disease Control and Prevention]] (CDC)|url=https://www.cdc.gov/vaccines/hcp/acip-recs/vacc-specific/covid-19.html|access-date=18 February 2021}}</ref><ref>{{Cite web2|url=https://ec.europa.eu/info/live-work-travel-eu/coronavirus-response/safe-covid-19-vaccines-europeans_en|title=Safe COVID-19 vaccines for Europeans|website=European Commission – European Commission|access-date=19 February 2021}}</ref>。2021年1月時点、このタイプの認可されたワクチンは、[[トジナメラン|ファイザー - ビオンテックワクチン]]<ref name="hcreg2">{{Cite web2|date=9 December 2020|title=Regulatory Decision Summary – Pfizer-BioNTech COVID-19 Vaccine|url=https://covid-vaccine.canada.ca/info/regulatory-decision-summary-detailTwo.html?linkID=RDS00730|access-date=9 December 2020|publisher=Health Canada, Government of Canada}}</ref><ref name="NCT043687282">{{Cite web2|title=Study to Describe the Safety, Tolerability, Immunogenicity, and Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Adults|url=https://clinicaltrials.gov/ct2/show/NCT04368728|website=[[ClinicalTrials.gov]]|publisher=[[United States National Library of Medicine]]|id=NCT04368728|date=30 April 2020|access-date=14 July 2020|archive-date=11 October 2020|archive-url=https://web.archive.org/web/20201011084828/https://clinicaltrials.gov/ct2/show/NCT04368728/|url-status=live}}</ref><ref name="EudraCT-2020-001038-362">{{Cite web2|title=A Multi-site Phase I/II, 2-Part, Dose-Escalation Trial Investigating the Safety and Immunogenicity of four Prophylactic SARS-CoV-2 RNA Vaccines Against COVID-19 Using Different Dosing Regimens in Healthy Adults|url=https://www.clinicaltrialsregister.eu/ctr-search/trial/2020-001038-36/DE|website=EU Clinical Trials Register|publisher=European Union|id=[[EudraCT]] 2020-001038-36|date=14 April 2020|access-date=22 April 2020|archive-url=https://web.archive.org/web/20200422111024/https://www.clinicaltrialsregister.eu/ctr-search/trial/2020-001038-36/DE|archive-date=22 April 2020|url-status=live}}</ref> と[[MRNA-1273|モデルナワクチン]]<ref name="NCT044704272">{{Cite web2|title=A Study to Evaluate Efficacy, Safety, and Immunogenicity of mRNA-1273 Vaccine in Adults Aged 18 Years and Older to Prevent COVID-19|url=https://clinicaltrials.gov/ct2/show/NCT04470427|website=[[ClinicalTrials.gov]]|publisher=[[United States National Library of Medicine]]|id=NCT04470427|date=14 July 2020|access-date=27 July 2020|archive-date=11 October 2020|archive-url=https://web.archive.org/web/20201011084833/https://clinicaltrials.gov/ct2/show/NCT04470427/|url-status=live}}</ref><ref name="palca2">{{cite news|last1=Palca|first1=Joe|title=COVID-19 vaccine candidate heads to widespread testing in U.S.|url=https://www.npr.org/sections/coronavirus-live-updates/2020/07/27/895672859/us-vaccine-candidate-heads-to-widespread-testing-in-people|access-date=27 July 2020|publisher=NPR|date=27 July 2020|name-list-style=vanc|archive-date=11 October 2020|archive-url=https://web.archive.org/web/20201011084836/https://www.npr.org/sections/coronavirus-live-updates/2020/07/27/895672859/us-vaccine-candidate-heads-to-widespread-testing-in-people/|url-status=live}}</ref> である。2021年2月現在、EUではCureVac社の{{仮リンク|CVnCoV|en|CureVac COVID-19 vaccine}} RNAワクチンが認可を待っている<ref name="EU CVnCoV rolling review">{{cite press release|title=EMA starts rolling review of CureVac's COVID-19 vaccine (CVnCoV)|website=European Medicines Agency|date=1 December 2020|url=https://www.ema.europa.eu/en/news/ema-starts-rolling-review-curevacs-covid-19-vaccine-cvncov|access-date=12 February 2021}}</ref>。 |
||
重度のアレルギー反応はまれである。2020年12月、ファイザー- |
重度のアレルギー反応はまれである。2020年12月、ファイザー - ビオンテックCOVID-19ワクチンの初回投与1,893,360回では、重度のアレルギー反応が175例発生し、そのうち21件が[[アナフィラキシー]]であった<ref name="pmid33571463">{{Cite journal2|author=Moghimi SM|year=2021|title=Allergic Reactions and Anaphylaxis to LNP-Based COVID-19 Vaccines|journal=[[Molecular Therapy]]|volume=29|issue=3|pages=898–900|doi=10.1016/j.ymthe.2021.01.030|pmid=33571463|pmc=7862013}}</ref>。2020年12月および2021年1月に行われたモデルナ COVID-19ワクチンの4,041,396回の投与では、アナフィラキシーの報告は10件のみであった<ref name="pmid33571463" />。[[脂質ナノ粒子]]がアレルギー反応に関与している可能性が最も高い<ref name="pmid33571463" />。 |
||
=== アデノウイルス・ベクター・ワクチン === |
=== アデノウイルス・ベクター・ワクチン === |
||
これらのワクチンは、SARS-CoV-2タンパク質をコードするDNAを含む[[アデノウイルス]]・シェルを用いた、非複製[[ウイルスベクター]]の例である<ref name="vv-gavi">{{Cite web2|title=What are viral vector-based vaccines and how could they be used against COVID-19?|url=https://www.gavi.org/vaccineswork/what-are-viral-vector-based-vaccines-and-how-could-they-be-used-against-covid-19|publisher=GAVI|access-date=26 January 2021|year=2020}}</ref>。COVID-19に対するウイルスベクターを用いたワクチンは、新しいウイルス粒子を生成するのではなく、全身の免疫反応を誘発する抗原のみを生成するという非複製性を持っている |
これらのワクチンは、SARS-CoV-2タンパク質をコードするDNAを含む[[アデノウイルス]]・シェルを用いた、非複製[[ウイルスベクター]]の例である<ref name="vv-gavi">{{Cite web2|title=What are viral vector-based vaccines and how could they be used against COVID-19?|url=https://www.gavi.org/vaccineswork/what-are-viral-vector-based-vaccines-and-how-could-they-be-used-against-covid-19|publisher=GAVI|access-date=26 January 2021|year=2020}}</ref>。COVID-19に対するウイルスベクターを用いたワクチンは、新しいウイルス粒子を生成するのではなく、全身の免疫反応を誘発する抗原のみを生成するという非複製性を持っている<ref name="vv-gavi" />。 |
||
2021年1月時点、[[ウイルスベクター|このタイプのワクチン]]として認可されているのは、英国の[[オックスフォードアストラゼネカワクチン|オックスフォード-アストラゼネカワクチン]]<ref name="NCT044008382">{{Cite web2|title=Investigating a Vaccine Against COVID-19|url=https://clinicaltrials.gov/ct2/show/NCT04400838|website=[[ClinicalTrials.gov]]|publisher=[[United States National Library of Medicine]]|id=NCT04400838|date=26 May 2020|access-date=14 July 2020|archive-date=11 October 2020|archive-url=https://web.archive.org/web/20201011084750/https://clinicaltrials.gov/ct2/show/NCT04400838/|url-status=live}}</ref><ref name="EudraCT-2020-001228-322">{{Cite web2|url=https://www.clinicaltrialsregister.eu/ctr-search/trial/2020-001228-32/GB|title=A Phase 2/3 study to determine the efficacy, safety and immunogenicity of the candidate Coronavirus Disease (COVID-19) vaccine ChAdOx1 nCoV-19|website=EU Clinical Trials Register|publisher=European Union|id=[[EudraCT]] 2020-001228-32|date=21 April 2020|access-date=3 August 2020|archive-date=5 October 2020|archive-url=https://web.archive.org/web/20201005201654/https://www.clinicaltrialsregister.eu/ctr-search/trial/2020-001228-32/GB|url-status=live}}</ref><ref name="ISRCTN899514242">{{Cite journal2|last1=O'Reilly|first1=Peter|date=26 May 2020|title=A Phase III study to investigate a vaccine against COVID-19|doi=10.1186/ISRCTN89951424|website=ISRCTN|id=ISRCTN89951424|name-list-style=vanc|doi-access=free}}</ref>、ロシアの[[スプートニクV COVID-19ワクチン|スプートニクV]]<ref name="sputnik">{{cite news|last1=Corum|first1=Jonathan|first2=Carl|last2=Zimmer|date=8 January 2021|title=How Gamaleya's Vaccine Works|url=https://www.nytimes.com/interactive/2021/health/gamaleya-covid-19-vaccine.html|work=[[The New York Times]]|access-date=27 January 2021}}</ref>、中国の[[Convidicea|コンビディシア]]、そして[[ジョンソン・エンド・ジョンソンワクチン]]である<ref name=":2">{{Cite web2|title=A Study of Ad26.COV2.S in Adults|url=https://clinicaltrials.gov/ct2/show/NCT04436276|access-date=23 August 2020|website=[[ClinicalTrials.gov]]|date=4 August 2020|archive-date=16 September 2020|archive-url=https://web.archive.org/web/20200916063346/https://clinicaltrials.gov/ct2/show/NCT04436276|url-status=live}}</ref><ref name=":3">{{Cite web2|title=A Study of Ad26.COV2.S for the Prevention of SARS-CoV-2-Mediated COVID-19 in Adult Participants|url=https://clinicaltrials.gov/ct2/show/NCT04505722|url-status=live|archive-url=https://web.archive.org/web/20200926145744/https://clinicaltrials.gov/ct2/show/NCT04505722|archive-date=26 September 2020|website=[[ClinicalTrials.gov]]|publisher=US National Library of Medicine|accessdate=2021-03-11}}</ref>。 |
2021年1月時点、[[ウイルスベクター|このタイプのワクチン]]として認可されているのは、英国の[[オックスフォードアストラゼネカワクチン|オックスフォード-アストラゼネカワクチン]]<ref name="NCT044008382">{{Cite web2|title=Investigating a Vaccine Against COVID-19|url=https://clinicaltrials.gov/ct2/show/NCT04400838|website=[[ClinicalTrials.gov]]|publisher=[[United States National Library of Medicine]]|id=NCT04400838|date=26 May 2020|access-date=14 July 2020|archive-date=11 October 2020|archive-url=https://web.archive.org/web/20201011084750/https://clinicaltrials.gov/ct2/show/NCT04400838/|url-status=live}}</ref><ref name="EudraCT-2020-001228-322">{{Cite web2|url=https://www.clinicaltrialsregister.eu/ctr-search/trial/2020-001228-32/GB|title=A Phase 2/3 study to determine the efficacy, safety and immunogenicity of the candidate Coronavirus Disease (COVID-19) vaccine ChAdOx1 nCoV-19|website=EU Clinical Trials Register|publisher=European Union|id=[[EudraCT]] 2020-001228-32|date=21 April 2020|access-date=3 August 2020|archive-date=5 October 2020|archive-url=https://web.archive.org/web/20201005201654/https://www.clinicaltrialsregister.eu/ctr-search/trial/2020-001228-32/GB|url-status=live}}</ref><ref name="ISRCTN899514242">{{Cite journal2|last1=O'Reilly|first1=Peter|date=26 May 2020|title=A Phase III study to investigate a vaccine against COVID-19|doi=10.1186/ISRCTN89951424|website=ISRCTN|id=ISRCTN89951424|name-list-style=vanc|doi-access=free}}</ref>、ロシアの[[スプートニクV COVID-19ワクチン|スプートニクV]]<ref name="sputnik">{{cite news|last1=Corum|first1=Jonathan|first2=Carl|last2=Zimmer|date=8 January 2021|title=How Gamaleya's Vaccine Works|url=https://www.nytimes.com/interactive/2021/health/gamaleya-covid-19-vaccine.html|work=[[The New York Times]]|access-date=27 January 2021}}</ref>、中国の[[Convidicea|コンビディシア]]、そして[[ジョンソン・エンド・ジョンソンワクチン]]である<ref name=":2">{{Cite web2|title=A Study of Ad26.COV2.S in Adults|url=https://clinicaltrials.gov/ct2/show/NCT04436276|access-date=23 August 2020|website=[[ClinicalTrials.gov]]|date=4 August 2020|archive-date=16 September 2020|archive-url=https://web.archive.org/web/20200916063346/https://clinicaltrials.gov/ct2/show/NCT04436276|url-status=live}}</ref><ref name=":3">{{Cite web2|title=A Study of Ad26.COV2.S for the Prevention of SARS-CoV-2-Mediated COVID-19 in Adult Participants|url=https://clinicaltrials.gov/ct2/show/NCT04505722|url-status=live|archive-url=https://web.archive.org/web/20200926145744/https://clinicaltrials.gov/ct2/show/NCT04505722|archive-date=26 September 2020|website=[[ClinicalTrials.gov]]|publisher=US National Library of Medicine|accessdate=2021-03-11}}</ref>。 |
||
| 240行目: | 272行目: | ||
===自己増殖型RNAワクチン=== |
===自己増殖型RNAワクチン=== |
||
自己増殖RNAワクチンや自己複製RNAワクチンと呼ばれる、自ら増殖や複製するワクチンである。次世代のRNAワクチンであり、接種後に体内でRNAを増やすタンパク質を増殖させ、自らRNAを増やすワクチンである。VLPセラピューティクス・ジャパンしたワクチンの場合、自ら増殖するため、レプリコンの粒子が127gあれば、日本の全人口に接種出来るだけのワクチンが作れる計算になるとされる。また、保管も4°Cの環境で1 - 2か月は保存可能であるとされる<ref>{{Cite web |
自己増殖RNAワクチンや自己複製RNAワクチンと呼ばれる、自ら増殖や複製するワクチンである。次世代のRNAワクチンであり、接種後に体内でRNAを増やすタンパク質を増殖させ、自らRNAを増やすワクチンである。VLPセラピューティクス・ジャパンしたワクチンの場合、自ら増殖するため、レプリコンの粒子が127gあれば、日本の全人口に接種出来るだけのワクチンが作れる計算になるとされる。また、保管も4°Cの環境で1 - 2か月は保存可能であるとされる<ref>{{Cite web|和書| url = https://vlptherapeutics.co.jp/post/3649/ | title = 【書籍掲載】VLPセラピューティクス・赤畑渉、宝島社『新型コロナウイルスワクチンのすべてがわかる本』で紹介 | publisher = VLPセラピューティクス・ジャパン | accessdate = 2021-08-03 }}</ref><ref>{{Cite web|和書| url = https://www.pref.niigata.lg.jp/uploaded/attachment/256915.pdf | title = 新型コロナウイルス ワクチンの基礎と原理 | publisher = 峰 宗太郎 | accessdate = 2021-08-03 }}</ref><ref>{{Citation|title=127gで全国民に接種“少量で効果”ワクチン治験開始(2021年10月18日)|last=ANNnewsCH|date=2021-10-18|url=https://www.youtube.com/watch?v=gdynySuQgmY|access-date=2024-09-24}}</ref>。VLPセラピューティクス・ジャパン、[[大阪市立大学]]、[[国立国際医療研究センター]]、[[医薬基盤・健康・栄養研究所]]、[[大分大学]]などが開発中である<ref>{{Cite web|和書| url = https://genkihoriuchi.com/wp-content/uploads/2021/04/0f6543bef0ea630aca0e9a09254340da.pdf | title = 国産ワクチンの開発状況について令和3年4月14日 | publisher = 内閣府 健康・医療戦略推進事務局 | accessdate = 2021-08-03 }}</ref>。他にも米国メリーランド州ボルチモアのElixirgen Therapeutics, Inc.(エリクサジェン・セラピューティックス社)が自己複製型RNAワクチン「EXG-5003」を開発し、日本では藤田医科大学(愛知県豊明市)にて、第 1/2 相臨床試験を開始している。 |
||
[[新型コロナウイルス]]のmRNAワクチンは、'''自己増殖型レプリコンワクチン'''と呼ばれる<ref>{{Cite web|url=https://www.mhlw.go.jp/content/10906000/001266060.pdf|title=次世代mRNAワクチン(レプリコン)「コスタイベ筋注用」|accessdate=2024-09-07|publisher=厚生労働省}}</ref>。 |
|||
2024年9月12日 厚生労働省薬事審議会医薬品第二部会が非公開で開催され、[[Meiji Seika ファルマ|Meiji Seikaファルマ]]株式会社の「医薬品コスタイベ筋注用」の製造販売が承認された<ref>{{Cite web | url =https://www.mhlw.go.jp/stf/newpage_43003.html | title = 薬事審議会 医薬品第二部会を開催します| publisher = 厚生労働省|date=2024-9-12|accessdate = 2024-09-18}}</ref><ref>{{Cite web | url =https://www.pmda.go.jp/PmdaSearch/iyakuDetail/GeneralList/631341P| title = コロナウイルス(SARS-CoV-2)RNAワクチン| publisher = 医薬品医療機器総合機構| accessdate = 2024-09-18}}</ref>。海外・国内臨床試験の日誌から記録・収集された副反応の発現割合から、これまでのmRNAワクチンと同様の下記副反応が見られた<ref>{{Cite web |url=https://www.pmda.go.jp/PmdaSearch/iyakuDetail/780009_631341PE1020_1_02#HDR_AdverseEvents |title=医療用医薬品 詳細表示 コスタイベ筋注用 - 11.副反応 |publisher=医薬品医療機器総合機構 |accessdate=2024-09-18}}</ref>。 |
|||
{| class="wikitable mw-collapsible mw-collapsed" |
|||
|+重大な副反応 |
|||
! |
|||
!頻度不明 |
|||
|- |
|||
!重大な副反応 |
|||
|ショック、アナフィラキシー、心筋炎、心膜炎 |
|||
|} |
|||
{| class="wikitable mw-collapsible mw-collapsed" |
|||
|+その他の副反応 |
|||
! |
|||
!10%以上 |
|||
!1~10%未満 |
|||
!1%未満 |
|||
|- |
|||
!局所症状(注射部位) |
|||
|圧痛(92.9%)、疼痛(83.8%)、腫脹(14.0%)、硬結(12.4%)、紅斑(12.4%) |
|||
|そう痒感 |
|||
| |
|||
|- |
|||
!過敏症 |
|||
| |
|||
| |
|||
|発疹、過敏症、そう痒症 |
|||
|- |
|||
!精神神経系 |
|||
|頭痛(39.0%)、めまい(19.2%) |
|||
| |
|||
|感覚鈍麻、傾眠 |
|||
|- |
|||
!心・血管系 |
|||
| |
|||
| |
|||
|動悸 |
|||
|- |
|||
!消化器 |
|||
| |
|||
|下痢、悪心、嘔吐 |
|||
|腹痛、上腹部痛、軟便、腹部不快感 |
|||
|- |
|||
!呼吸器 |
|||
| |
|||
| |
|||
|鼻漏、咳嗽 |
|||
|- |
|||
!筋・骨格系 |
|||
|筋肉痛(28.8%)、関節痛(26.7%) |
|||
| |
|||
|背部痛 |
|||
|- |
|||
!全身症状 |
|||
|倦怠感(44.8%)、悪寒(30.0%)、発熱(20.1%) |
|||
| |
|||
|異常感 |
|||
|- |
|||
!感染症 |
|||
| |
|||
| |
|||
|咽頭炎 |
|||
|} |
|||
2024年9月17日 [[武見敬三]]厚生労働大臣は、[[Meiji Seika ファルマ]]の新型コロナウイルスワクチン「コスタイベ筋注用」について「安全性に問題なし」と述べた。<ref>{{Cite web |title=「コスタイベ」、安全性に問題なし 武見厚労相 |url=https://nk.jiho.jp/article/192947 |website=日刊薬業 - 医薬品産業の総合情報サイト |date=2024-09-19 |access-date=2024-09-19 |language=ja}}</ref> |
|||
=== その他の種類 === |
=== その他の種類 === |
||
| 247行目: | 344行目: | ||
経口ワクチンや経鼻ワクチンも開発・研究されている<ref>https://www.npr.org/sections/health-shots/2021/04/06/984486776/scientists-race-to-develop-next-generation-of-covid-vaccines</ref>。経鼻ワクチンについては、[[アイ (植物)|タデ藍]]([[青森県]]産の『あおもり藍』)の葉から抽出したエキス([[トリプタンスリン]]含有)が、ウイルスの細胞への侵入を防ぐ働きを持つことや、自然素材で副作用が少ないことから、藍の葉のエキスを配合した点鼻薬の市販化を目指している<ref>『北日本新聞』2022年2月11日付25面『藍の葉にコロナ予防効果 エキス抽出 点鼻薬販売へ』より。</ref>。 |
経口ワクチンや経鼻ワクチンも開発・研究されている<ref>https://www.npr.org/sections/health-shots/2021/04/06/984486776/scientists-race-to-develop-next-generation-of-covid-vaccines</ref>。経鼻ワクチンについては、[[アイ (植物)|タデ藍]]([[青森県]]産の『あおもり藍』)の葉から抽出したエキス([[トリプタンスリン]]含有)が、ウイルスの細胞への侵入を防ぐ働きを持つことや、自然素材で副作用が少ないことから、藍の葉のエキスを配合した点鼻薬の市販化を目指している<ref>『北日本新聞』2022年2月11日付25面『藍の葉にコロナ予防効果 エキス抽出 点鼻薬販売へ』より。</ref>。 |
||
[[免疫記憶|終生免疫]]の獲得を目指したワクチンの研究開発もおこなわれており、東京都医学総合研究所が研究開発する天然痘ワクチンである[[ワクシニアウイルス]]を更に弱毒化したDIs株に、SARS-CoV-2遺伝子を組み込んだ遺伝子組換え[[生ワクチン]]や<ref>{{Cite web |
[[免疫記憶|終生免疫]]の獲得を目指したワクチンの研究開発もおこなわれており、東京都医学総合研究所が研究開発する天然痘ワクチンである[[ワクシニアウイルス]]を更に弱毒化したDIs株に、SARS-CoV-2遺伝子を組み込んだ遺伝子組換え[[生ワクチン]]や<ref>{{Cite web|和書| url = https://www.igakuken.or.jp/topics/2021/0107.html | title = ワクシニアウイルスベクターを用いた新型コロナウイルスワクチンの開発 | publisher = 東京都医学総合研究所 | accessdate = 2021-08-20 }}</ref><ref>{{Cite web|和書| url = https://www.bousai.metro.tokyo.lg.jp/_res/projects/default_project/_page_/001/012/674/2021010707.pdf | title = ワクシニアウイルスベクターを用いた 新型コロナウイルスワクチンの開発 | publisher = 東京都 | accessdate = 2021-08-20 }}</ref><ref>{{Cite web|和書| url = https://www.m3.com/news/open/iryoishin/864210 | title = 対新型コロナで「終生免疫」の可能性、動物実験で発症予防効果確認 | publisher = m3.com | accessdate = 2021-08-20 }}</ref>、東京大学生産技術研究所が[[麻疹ウイルス]]をベクターとして用いた遺伝子組換え生ワクチンを研究開発している |
||
<ref>{{Cite web |
<ref>{{Cite web|和書| url = https://www.iis.u-tokyo.ac.jp/ja/news/3529/ | title = 時間との闘い [UTokyo-IIS Bulletin Vol.7] 画期的な手法で、より効果的な新型コロナウイルスワクチンの開発に一歩近づく | publisher = 東京大学生産技術研究所 | accessdate = 2021-08-20 }}</ref>。 |
||
科学者たちは、関連性のない疾患に対する既存のワクチンが、免疫系を活性化し、COVID-19感染の重症度を軽減できるかどうかを調査した<ref>{{Cite news|last1=Johnson|first1=Carolyn Y.|last2=Mufson|first2=Steven|title=Can old vaccines from science's medicine cabinet ward off coronavirus?|work=[[The Washington Post]]|url=https://www.washingtonpost.com/health/2020/06/11/can-old-vaccines-sciences-medicine-cabinet-ward-off-coronavirus/|access-date=31 December 2020|issn=0190-8286}}</ref>。結核用の[[BCGワクチン]]が免疫系に非特異的な作用を及ぼすという実験的証拠はあるが、このワクチンがCOVID-19に有効であるという証拠はない<ref>{{Cite web2|date=12 April 2020|title=Bacille Calmette-Guérin (BCG) vaccination and COVID-19|url=https://www.who.int/news-room/commentaries/detail/bacille-calmette-gu%C3%A9rin-(bcg)-vaccination-and-covid-19|url-status=live|archive-url=https://web.archive.org/web/20200430121126/https://www.who.int/news-room/commentaries/detail/bacille-calmette-gu%C3%A9rin-(bcg)-vaccination-and-covid-19|archive-date=30 April 2020|access-date=1 May 2020|publisher=[[:en:World Health Organization|World Health Organization]] (WHO)}}</ref>。 |
科学者たちは、関連性のない疾患に対する既存のワクチンが、免疫系を活性化し、COVID-19感染の重症度を軽減できるかどうかを調査した<ref>{{Cite news|last1=Johnson|first1=Carolyn Y.|last2=Mufson|first2=Steven|title=Can old vaccines from science's medicine cabinet ward off coronavirus?|work=[[The Washington Post]]|url=https://www.washingtonpost.com/health/2020/06/11/can-old-vaccines-sciences-medicine-cabinet-ward-off-coronavirus/|access-date=31 December 2020|issn=0190-8286}}</ref>。結核用の[[BCGワクチン]]が免疫系に非特異的な作用を及ぼすという実験的証拠はあるが、このワクチンがCOVID-19に有効であるという証拠はない<ref>{{Cite web2|date=12 April 2020|title=Bacille Calmette-Guérin (BCG) vaccination and COVID-19|url=https://www.who.int/news-room/commentaries/detail/bacille-calmette-gu%C3%A9rin-(bcg)-vaccination-and-covid-19|url-status=live|archive-url=https://web.archive.org/web/20200430121126/https://www.who.int/news-room/commentaries/detail/bacille-calmette-gu%C3%A9rin-(bcg)-vaccination-and-covid-19|archive-date=30 April 2020|access-date=1 May 2020|publisher=[[:en:World Health Organization|World Health Organization]] (WHO)}}</ref>。 |
||
== 有効性 == |
== 有効性 == |
||
[[File:BNT162b2 vaccine efficacy data.png|thumb|upright=1.2|[[二重盲検法|二重盲検臨床試験]]におけるファイザー- |
[[File:BNT162b2 vaccine efficacy data.png|thumb|upright=1.2|[[二重盲検法|二重盲検臨床試験]]におけるファイザー - ビオンテック社製ワクチン([[トジナメラン]])と[[偽薬|プラセボ]]の初回投与後の症候性COVID-19感染症の累積発生曲線。縦軸は累積発生率、横軸は初回投与後の経過日数。青がトジナメラン、赤がプラセボ。<ref>{{Cite web2|date=10 December 2020|title=FDA Briefing Document: Pfizer-BioNTech COVID-19 Vaccine|url=https://www.fda.gov/media/144245/download|access-date=1 January 2021|publisher=U.S. Food and Drug Administration|format=PDF}}</ref>]] |
||
[[ワクチン有効性]](vaccine efficacy)とは対照試験において、ワクチンを接種した被験者が病気にかかるリスクと、ワクチンを接種していない被験者が病気にかかるリスクを比較したものである<ref name="NYT-20201120">{{cite news|last=Zimmer|first=Carl|author-link=Carl Zimmer|date=20 November 2020|title=2 Companies Say Their Vaccines Are 95% Effective. What Does That Mean? You might assume that 95 out of every 100 people vaccinated will be protected from Covid-19. But that's not how the math works.|work=[[The New York Times]]|url=https://www.nytimes.com/2020/11/20/health/covid-vaccine-95-effective.html|access-date=21 November 2020}}</ref>。有効性0%とは、ワクチンが効かないことを意味する([[偽薬|プラセボ]]と同じ)。 有効性が50%の場合は、ワクチン未接種の人と比べてワクチン接種した人の感染症例が半分になることを意味する。 |
[[ワクチン有効性]](vaccine efficacy)とは対照試験において、ワクチンを接種した被験者が病気にかかるリスクと、ワクチンを接種していない被験者が病気にかかるリスクを比較したものである<ref name="NYT-20201120">{{cite news|last=Zimmer|first=Carl|author-link=Carl Zimmer|date=20 November 2020|title=2 Companies Say Their Vaccines Are 95% Effective. What Does That Mean? You might assume that 95 out of every 100 people vaccinated will be protected from Covid-19. But that's not how the math works.|work=[[The New York Times]]|url=https://www.nytimes.com/2020/11/20/health/covid-vaccine-95-effective.html|access-date=21 November 2020}}</ref>。有効性0%とは、ワクチンが効かないことを意味する([[偽薬|プラセボ]]と同じ)。 有効性が50%の場合は、ワクチン未接種の人と比べてワクチン接種した人の感染症例が半分になることを意味する。 |
||
| 280行目: | 377行目: | ||
|<ref name="Moderna COVID-19 Vaccine FDA label">{{Cite web2|title=Moderna COVID-19 Vaccine – cx-024414 injection, suspension|url=https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=e0651c7a-2fe2-459d-a766-0d59e919f058|url-status=live|access-date=20 December 2020|website=DailyMed|publisher=U.S. National Institutes of Health}}</ref> |
|<ref name="Moderna COVID-19 Vaccine FDA label">{{Cite web2|title=Moderna COVID-19 Vaccine – cx-024414 injection, suspension|url=https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=e0651c7a-2fe2-459d-a766-0d59e919f058|url-status=live|access-date=20 December 2020|website=DailyMed|publisher=U.S. National Institutes of Health}}</ref> |
||
|- |
|- |
||
|[[ファイザー |
|[[トジナメラン|ファイザー - ビオンテックワクチン]] |
||
|~95% (90–98%){{efn2|Mild/Moderate COVID-19 symptoms observed in the Pfizer-BioNTech vaccine trials, were only counted as such for vaccinated individuals if they began more than 7 days after their second dose, and required presence of a positive [[:en:Reverse transcription polymerase chain reaction|RT-PCR test]] result along with at least one of the following symptoms: fever; new or increased cough; new or increased shortness of breath; chills; new or increased muscle pain; new loss of taste or smell; sore throat; diarrhea; or vomiting.<ref name="Pfizer-BioNTech COVID-19 Vaccine FDA label"/>|name=PfizerSymptoms}} |
|~95% (90–98%){{efn2|Mild/Moderate COVID-19 symptoms observed in the Pfizer-BioNTech vaccine trials, were only counted as such for vaccinated individuals if they began more than 7 days after their second dose, and required presence of a positive [[:en:Reverse transcription polymerase chain reaction|RT-PCR test]] result along with at least one of the following symptoms: fever; new or increased cough; new or increased shortness of breath; chills; new or increased muscle pain; new loss of taste or smell; sore throat; diarrhea; or vomiting.<ref name="Pfizer-BioNTech COVID-19 Vaccine FDA label"/>|name=PfizerSymptoms}} |
||
|{{n/a|Not reported}} |
|{{n/a|Not reported}} |
||
| 382行目: | 479行目: | ||
[[インフルエンザワクチン#効果と有効性|ワクチン実効性]](vaccine effectiveness)に関する実社会での研究では、特定のワクチンが、理想的とは言えない日常的な条件下で、大規模な集団におけるワクチン接種者のCOVID-19の感染、症状、入院、死亡をどの程度防ぐことができたかを測定する<ref>{{Cite web2|title=What is the difference between efficacy and effectiveness?|url=https://www.gavi.org/vaccineswork/what-difference-between-efficacy-and-effectiveness|website=www.gavi.org|accessdate=2021-05-13|language=en}}</ref>。 |
[[インフルエンザワクチン#効果と有効性|ワクチン実効性]](vaccine effectiveness)に関する実社会での研究では、特定のワクチンが、理想的とは言えない日常的な条件下で、大規模な集団におけるワクチン接種者のCOVID-19の感染、症状、入院、死亡をどの程度防ぐことができたかを測定する<ref>{{Cite web2|title=What is the difference between efficacy and effectiveness?|url=https://www.gavi.org/vaccineswork/what-difference-between-efficacy-and-effectiveness|website=www.gavi.org|accessdate=2021-05-13|language=en}}</ref>。 |
||
* [[イスラエル]]では、2020年12月20日から2021年1月28日までの期間にモデルナまたはファイザー- |
* [[イスラエル]]では、2020年12月20日から2021年1月28日までの期間にモデルナまたはファイザー - ビオンテックのワクチンを接種した715,425人のうち、2回目の接種から7日後からの期間に、317人(0.04%)のみが軽度/中等度のCovid-19症状で発病し、16人(0.002%)のみが入院したことが確認された<ref>{{Cite web2|title=Israel's health data suggests Pfizer and Moderna vaccines may be more effective than we thought|url=https://edition.cnn.com/world/live-news/coronavirus-pandemic-vaccine-updates-01-29-21/h_a52c58a8bb72bb98f7668ed869afb927|website=CNN|date=2021-01-29|accessdate=2021-05-13|language=en|author=By Zahid Mahmood, Hannah Strange, Julia Hollingsworth and Adam Renton}}</ref>。 |
||
* [[アメリカ疾病予防管理センター|米国疾病予防管理センター]]の報告書によると、ファイザー- |
* [[アメリカ疾病予防管理センター|米国疾病予防管理センター]]の報告書によると、ファイザー - ビオンテック社およびモデルナ社のCovid-19ワクチンは、非常に効果的な防御を提供する<ref name=":10">{{Cite journal2|last=Thompson|first=Mark G.|date=2021|title=Interim Estimates of Vaccine Effectiveness of BNT162b2 and mRNA-1273 COVID-19 Vaccines in Preventing SARS-CoV-2 Infection Among Health Care Personnel, First Responders, and Other Essential and Frontline Workers — Eight U.S. Locations, December 2020–March 2021|url=https://www.cdc.gov/mmwr/volumes/70/wr/mm7013e3.htm|journal=MMWR. Morbidity and Mortality Weekly Report|volume=70|language=en-us|doi=10.15585/mmwr.mm7013e3|issn=0149-2195}}</ref>。実際の環境下では、症状の状態にかかわらず、SARS-CoV-2感染に対して、完全免疫(2回目の投与から14日以上後)のmRNAワクチンの実効性は90%、部分免疫(1回目の投与から14日以上で2回目の投与前)のワクチン実効性は80%であった。 |
||
* 英国の104の病院に勤務する15,121人の医療従事者は、調査前に全員のCOVID-19[[抗体]]が陰性であったが、2020年12月7日から2021年2月5日まで、[[SARSコロナウイルス2-アルファ株|系統 B.1.1.7]]が優勢変異株として循環していた時期に、週2回の[[逆転写ポリメラーゼ連鎖反応|逆転写ポリメラーゼ連鎖反応(RT-PCR)検査]]で追跡調査を行った。この研究では、ワクチンを接種した90.7%のコホート(母集団)と、ワクチンを接種しなかった9.3%のコホートの陽性結果を比較し、ファイザー- |
* 英国の104の病院に勤務する15,121人の医療従事者は、調査前に全員のCOVID-19[[抗体]]が陰性であったが、2020年12月7日から2021年2月5日まで、[[SARSコロナウイルス2-アルファ株|系統 B.1.1.7]]が優勢変異株として循環していた時期に、週2回の[[逆転写ポリメラーゼ連鎖反応|逆転写ポリメラーゼ連鎖反応(RT-PCR)検査]]で追跡調査を行った。この研究では、ワクチンを接種した90.7%のコホート(母集団)と、ワクチンを接種しなかった9.3%のコホートの陽性結果を比較し、ファイザー - ビオンテック社のワクチンは、全ての感染症(無症候性を含む)を、1回目の接種から3週間後には72%(58-86%)減少させ、2回目の接種から1週間後には86%(76-97%)減少させたことがわかった<ref name="UKstudy">{{cite ssrn|author1=Victoria Jane Hall|author14=Jameel Khawam|display-authors=6|ssrn=3790399|date=February 2021|title=Effectiveness of BNT162b2 mRNA Vaccine Against Infection and COVID-19 Vaccine Coverage in Healthcare Workers in England, Multicentre Prospective Cohort Study (the SIREN Study)|author20=Susan Hopkins|author19=Jamie Lopez Bernal|author18=Mary E. Ramsay|author17=Colin Brown|author16=Meera A. Chand|author15=The SIREN Study Group|author13=Katie Munro|author2=Sarah Foulkes|author12=Ioannis Karagiannis|author11=Jasmin Islam|author10=Ana Atti|author9=Natalie Gillson|author8=Julia Stowe|author7=Edgar Wellington|author6=Andre Charlett|author5=Blanche Oguti|author4=Nick Andrews|author3=Ayoub Saei|name-list-style=vanc}}</ref>。 |
||
* 2021年1月17日から3月6日まで、系統B.1.1.7が優勢変異株として循環していた時期に、[[イスラエル]]の一般住民を対象に行われた研究では、ファイザー社ワクチンにより、無症候性COVID-19感染症が94%、症候性COVID-19感染症が97%減少したことが明らかになった<ref name="ISRstudy">{{Cite web2|url=https://www.pfizer.com/news/press-release/press-release-detail/real-world-evidence-confirms-high-effectiveness-pfizer|author=Pfizer|title=Real-World Evidence Confirms High Effectiveness of Pfizer–BioNTech COVID-19 Vaccine and Profound Public Health Impact of Vaccination One Year After Pandemic Declared|publisher=|date=11 March 2021|access-date=1 April 2021}}</ref>。 |
* 2021年1月17日から3月6日まで、系統B.1.1.7が優勢変異株として循環していた時期に、[[イスラエル]]の一般住民を対象に行われた研究では、ファイザー社ワクチンにより、無症候性COVID-19感染症が94%、症候性COVID-19感染症が97%減少したことが明らかになった<ref name="ISRstudy">{{Cite web2|url=https://www.pfizer.com/news/press-release/press-release-detail/real-world-evidence-confirms-high-effectiveness-pfizer|author=Pfizer|title=Real-World Evidence Confirms High Effectiveness of Pfizer–BioNTech COVID-19 Vaccine and Profound Public Health Impact of Vaccination One Year After Pandemic Declared|publisher=|date=11 March 2021|access-date=1 April 2021}}</ref>。 |
||
* アメリカの[[メイヨー・クリニック]]の術前患者を対象とした研究では、mRNAワクチンが無症候性感染症に対して80%の防御効果があることが示された<ref name="MCSstudy">{{Cite journal2|date=10 March 2021|title=Impact of the COVID-19 Vaccine on Asymptomatic Infection Among Patients Undergoing Pre-Procedural COVID-19 Molecular Screening|journal=Clinical Infectious Diseases|volume=|issue=|pages=|doi=10.1093/cid/ciab229|pmid=33704435|pmc=7989519|author1=Aaron J Tande|author2=Benjamin D Pollock|author9=Elie F Berbari|author8=Matthew Binnicker|author7=Laura Breeher|author6=Melanie Swift|author5=Abinash Virk|author4=Gianrico Farrugia|author3=Nilay D Shah|doi-access=free}}</ref>。 |
* アメリカの[[メイヨー・クリニック]]の術前患者を対象とした研究では、mRNAワクチンが無症候性感染症に対して80%の防御効果があることが示された<ref name="MCSstudy">{{Cite journal2|date=10 March 2021|title=Impact of the COVID-19 Vaccine on Asymptomatic Infection Among Patients Undergoing Pre-Procedural COVID-19 Molecular Screening|journal=Clinical Infectious Diseases|volume=|issue=|pages=|doi=10.1093/cid/ciab229|pmid=33704435|pmc=7989519|author1=Aaron J Tande|author2=Benjamin D Pollock|author9=Elie F Berbari|author8=Matthew Binnicker|author7=Laura Breeher|author6=Melanie Swift|author5=Abinash Virk|author4=Gianrico Farrugia|author3=Nilay D Shah|doi-access=free}}</ref>。 |
||
* 中国疾病管理センターの所長である[[高福]]は、2021年4月10日に開催された会議で、中国製ワクチンは「防御率はあまり高くない」と認めた。民間企業である[[シノバック・バイオテック|シノバック]]社が開発した[[CoronaVac]]ワクチンは、[[ブラジル]]での臨床試験で有効率が50.4%にとどまることが判明した。[[トルコ]]で行われた別の試験では、83.5%の実効性が示された。国営の[[シノファーム]]社によると、その2つのワクチンの有効率<!--efficacy rates-->は79.4%と72.5%である<ref>{{Cite web2| |
* 中国疾病管理センターの所長である[[高福]]は、2021年4月10日に開催された会議で、中国製ワクチンは「防御率はあまり高くない」と認めた。民間企業である[[シノバック・バイオテック|シノバック]]社が開発した[[CoronaVac]]ワクチンは、[[ブラジル]]での臨床試験で有効率が50.4%にとどまることが判明した。[[トルコ]]で行われた別の試験では、83.5%の実効性が示された。国営の[[シノファーム]]社によると、その2つのワクチンの有効率<!--efficacy rates-->は79.4%と72.5%である<ref>{{Cite web2|author=Nectar Gan|title=Chinese Covid-19 vaccine efficacy is 'not high', top health official admits|url=https://www.cnn.com/2021/04/12/china/china-vaccine-efficacy-intl-hnk/index.html|access-date=2021-04-14|website=CNN}}</ref>。 |
||
{| class="wikitable sortable" |
{| class="wikitable sortable" |
||
| 400行目: | 497行目: | ||
!死亡<!--Death--> |
!死亡<!--Death--> |
||
|- |
|- |
||
| rowspan="3" |[[ |
| rowspan="3" |[[トジナメラン|ファイザー - ビオンテック]] |
||
| colspan="2" |〜86% (76-97%) |
| colspan="2" |〜86% (76-97%) |
||
|{{n/a|Not reported}} |
|{{n/a|Not reported}} |
||
| 443行目: | 540行目: | ||
変異株は、回復者やワクチン接種者が獲得する中和抗体から逃避するリスクが懸念されているが、国立感染症研究所と日本医療研究開発機構の研究にて、新型コロナウイルス感染症(COVID-19)回復者の中和抗体の総量は時間と共に減衰するが、変異株に交差結合する抗体を獲得し、この抗体の質(中和比活性・交差性)は時間と共に向上することを発見した。この現象は、変異株へのワクチン戦略に重要な知見になるとしている |
変異株は、回復者やワクチン接種者が獲得する中和抗体から逃避するリスクが懸念されているが、国立感染症研究所と日本医療研究開発機構の研究にて、新型コロナウイルス感染症(COVID-19)回復者の中和抗体の総量は時間と共に減衰するが、変異株に交差結合する抗体を獲得し、この抗体の質(中和比活性・交差性)は時間と共に向上することを発見した。この現象は、変異株へのワクチン戦略に重要な知見になるとしている |
||
<ref>{{Cite press release | title = 新型コロナウイルス変異株に対する中和抗体の質が時間と共に向上することを発見 | publisher = 国立研究開発法人日本医療研究開発機構 | date = 2021-07-02 | url = https://www.amed.go.jp/news/release_20210705-02.html | accessdate = 2021-09-05 }}</ref><ref>{{Cite journal|和書 | author = Saya Moriyama | author2 = Yu Adachi | author3 = Takashi Sato | author4 = Takaji Wakita | author5 = Tadaki Suzuki | author6 = Yoshimasa Takahashi | year = 2021 | title = Temporal maturation of neutralizing antibodies in COVID-19 convalescent individuals improves potency and breadth to circulating SARS-CoV-2 variants | journal = Immunity | volume = 54 | issue = 8 | pages = 1841-1852 | doi = 10.1016/j.immuni.2021.06.015 | ref = harv }}</ref>。 |
<ref>{{Cite press release | 和書 | title = 新型コロナウイルス変異株に対する中和抗体の質が時間と共に向上することを発見 | publisher = 国立研究開発法人日本医療研究開発機構 | date = 2021-07-02 | url = https://www.amed.go.jp/news/release_20210705-02.html | accessdate = 2021-09-05 }}</ref><ref>{{Cite journal|和書 | author = Saya Moriyama | author2 = Yu Adachi | author3 = Takashi Sato | author4 = Takaji Wakita | author5 = Tadaki Suzuki | author6 = Yoshimasa Takahashi | year = 2021 | title = Temporal maturation of neutralizing antibodies in COVID-19 convalescent individuals improves potency and breadth to circulating SARS-CoV-2 variants | journal = Immunity | volume = 54 | issue = 8 | pages = 1841-1852 | doi = 10.1016/j.immuni.2021.06.015 | ref = harv }}</ref>。 |
||
====アルファ株(系統 B.1.1.7) ==== |
====アルファ株(系統 B.1.1.7) ==== |
||
{{seealso|SARSコロナウイルス2-アルファ株}} |
{{seealso|SARSコロナウイルス2-アルファ株}} |
||
2020年12月、英国で新たな変異株である系統 B.1.1.7が確認された<ref>{{cite news | title=Inside the B.1.1.7 Coronavirus Variant | website=The New York Times | date=18 January 2021 | url=https://www.nytimes.com/interactive/2021/health/coronavirus-mutations-B117-variant.html | access-date=29 January 2021}}</ref>。初期の結果では、[[トジナメラン|ファイザー- |
2020年12月、英国で新たな変異株である系統 B.1.1.7が確認された<ref>{{cite news | title=Inside the B.1.1.7 Coronavirus Variant | website=The New York Times | date=18 January 2021 | url=https://www.nytimes.com/interactive/2021/health/coronavirus-mutations-B117-variant.html | access-date=29 January 2021}}</ref>。初期の結果では、[[トジナメラン|ファイザー - ビオンテックワクチン]]と[[mRNA-1273|モデルナワクチン]]の両方が英国の変異株に対して保護することを示唆している<ref>{{Cite web2|date=26 January 2021|title=Moderna vaccine appears to work against variants|url=https://www.rnz.co.nz/news/covid-19/435174/moderna-vaccine-appears-to-work-against-variants|access-date=30 January 2021|website=RNZ}}</ref><ref>{{Cite journal2|last1=Muik|first1=Alexander|last2=Wallisch|first2=Ann-Kathrin|last3=Sänger|first3=Bianca|last4=Swanson|first4=Kena A.|last5=Mühl|first5=Julia|last6=Chen|first6=Wei|last7=Cai|first7=Hui|last8=Maurus|first8=Daniel|last9=Sarkar|first9=Ritu|last10=Türeci|first10=Özlem|last11=Dormitzer|first11=Philip R.|date=2021-01-29|title=Neutralization of SARS-CoV-2 lineage B.1.1.7 pseudovirus by BNT162b2 vaccine–elicited human sera|url=https://science.sciencemag.org/content/early/2021/01/28/science.abg6105|journal=Science|pages=eabg6105|doi=10.1126/science.abg6105|issn=0036-8075|pmid=33514629|doi-access=free}}</ref>。 |
||
ある研究では、[[AZD1222|オックスフォード-アストラゼネカワクチン]]は、B.1.1.7に対して42〜89%の有効性を示し、B.1.1.7以外の変異株に対しては71〜91%の有効性を示した<ref>{{Cite journal2|last=Emary|first=Katherine R. W.|last2=Golubchik|first2=Tanya|last3=Aley|first3=Parvinder K.|last4=Ariani|first4=Cristina V.|last5=Angus|first5=Brian John|last6=Bibi|first6=Sagida|last7=Blane|first7=Beth|last8=Bonsall|first8=David|last9=Cicconi|first9=Paola|date=2021|title=Efficacy of ChAdOx1 nCoV-19 (AZD1222) Vaccine Against SARS-CoV-2 VOC 202012/01 (B.1.1.7)|url=https://www.ssrn.com/abstract=3779160|journal=SSRN Electronic Journal|language=en|doi=10.2139/ssrn.3779160|issn=1556-5068|last10=Charlton|first10=Sue|last11=Clutterbuck|first11=Elizabeth}}</ref>。臨床試験の予備データによると、[[Novavax COVID-19ワクチン|Novavaxワクチン]]は、オリジナルの変異株に対して〜96%、B.1.1.7に対して〜86%、[[南アフリカ共和国|南アフリカ]]のB.1.351(501.V2 変異株)に対して〜60%の症状改善効果があることが示されている<ref>{{Cite journal2|last=Mahase|first=Elisabeth|date=2021-02-01|title=Covid-19: Novavax vaccine efficacy is 86% against UK variant and 60% against South African variant|url=https://www.bmj.com/lookup/doi/10.1136/bmj.n296|journal=BMJ|pages=n296|language=en|doi=10.1136/bmj.n296|issn=1756-1833}}</ref>。 |
ある研究では、[[AZD1222|オックスフォード-アストラゼネカワクチン]]は、B.1.1.7に対して42〜89%の有効性を示し、B.1.1.7以外の変異株に対しては71〜91%の有効性を示した<ref>{{Cite journal2|last=Emary|first=Katherine R. W.|last2=Golubchik|first2=Tanya|last3=Aley|first3=Parvinder K.|last4=Ariani|first4=Cristina V.|last5=Angus|first5=Brian John|last6=Bibi|first6=Sagida|last7=Blane|first7=Beth|last8=Bonsall|first8=David|last9=Cicconi|first9=Paola|date=2021|title=Efficacy of ChAdOx1 nCoV-19 (AZD1222) Vaccine Against SARS-CoV-2 VOC 202012/01 (B.1.1.7)|url=https://www.ssrn.com/abstract=3779160|journal=SSRN Electronic Journal|language=en|doi=10.2139/ssrn.3779160|issn=1556-5068|last10=Charlton|first10=Sue|last11=Clutterbuck|first11=Elizabeth}}</ref>。臨床試験の予備データによると、[[Novavax COVID-19ワクチン|Novavaxワクチン]]は、オリジナルの変異株に対して〜96%、B.1.1.7に対して〜86%、[[南アフリカ共和国|南アフリカ]]のB.1.351(501.V2 変異株)に対して〜60%の症状改善効果があることが示されている<ref>{{Cite journal2|last=Mahase|first=Elisabeth|date=2021-02-01|title=Covid-19: Novavax vaccine efficacy is 86% against UK variant and 60% against South African variant|url=https://www.bmj.com/lookup/doi/10.1136/bmj.n296|journal=BMJ|pages=n296|language=en|doi=10.1136/bmj.n296|issn=1756-1833}}</ref>。 |
||
| 454行目: | 551行目: | ||
{{seealso|SARSコロナウイルス2-ベータ株}} |
{{seealso|SARSコロナウイルス2-ベータ株}} |
||
{{Further|en:SARS-CoV-2 Beta variantt#Differential vaccine efficacy}} |
{{Further|en:SARS-CoV-2 Beta variantt#Differential vaccine efficacy}} |
||
モデルナは、南アフリカの系統 B.1.351(501.V2 変異株)に取り組むための新しいワクチンの試験を開始した<ref>{{Cite web2|title=Moderna develops new vaccine to tackle mutant Covid strain|work=[[Financial Times]]|url=https://www.ft.com/content/c0c8f72c-e58e-4319-80c4-0db153ad85db|access-date=30 January 2021|first=Hannah|last=Kuchler|date=25 January 2021|url-access=subscription}}</ref>。2021年2月17日、ファイザーはB.1.351の中和活性が2/3に低下したと発表したが、この変異株に対するワクチンの疾病予防効果については、まだ主張できないとしている<ref>{{Cite journal2|last1=Liu|first1=Yang|last2=Liu|first2=Jianying|last3=Xia|first3=Hongjie|last4=Zhang|first4=Xianwen|last5=Fontes-Garfias|first5=Camila R.|last6=Swanson|first6=Kena A.|last7=Cai|first7=Hui|last8=Sarkar|first8=Ritu|last9=Chen|first9=Wei|date=17 February 2021|title=Neutralizing Activity of BNT162b2-Elicited Serum — Preliminary Report|url=https://www.nejm.org/doi/10.1056/NEJMc2102017|journal=New England Journal of Medicine|doi=10.1056/nejmc2102017|pmid=33596352|access-date=25 February 2021|first16=Xuping|first18=Pei-Yong|last18=Shi|first17=Philip R.|last17=Dormitzer|last12=Weaver|last16=Xie|first15=Kathrin U.|last15=Jansen|first14=Ugur|last14=Sahin|first13=Alexander|last13=Muik|first12=Scott C.|first11=David|last11=Cooper|first10=Mark|last10=Cutler|doi-access=free}}</ref>。B.1.351に対するモデルナおよびファイザーのワクチンを接種した患者からの[[血清]]の中和活性の低下は、その後、いくつかの研究で確認された<ref name="nature.b117.B1351">{{Cite journal2|date=March 2021|title=Antibody Resistance of SARS-CoV-2 Variants B.1.351 and B.1.1.7|journal=Nature|doi=10.1038/s41586-021-03398-2|pmid=33684923|vauthors=Wang P, Nair MS, Liu L, Iketani S, Luo Y, Guo Y, Wang M, Yu J, Zhang B, Kwong PD, Graham BS, Mascola JR, Chang JY, Yin MT, Sobieszczyk M, Kyratsous CA, Shapiro L, Sheng Z, Huang Y, Ho DD|display-authors=6|doi-access=free}}</ref><ref name="cell.B1351.P12">{{Cite journal2|date=March 2021|title=1 SARS-CoV-2 variants B.1.351 and P.1 escape from neutralizing antibodies|journal=Cell|doi=10.1016/j.cell.2021.03.036|pmid=33794143|vauthors=Hoffmann M, Arora P, Gross R, Seidel A, Hoernich BF, Hahn AS, Krueger N, Graichen L, Hofmann-Winkler H, Kempf A, Winkler MS, Schulz S, Jaeck HM, Jahrsdoerfer B, Schrezenmeier H, Mueller M, Kleger A, Muench J, Poehlmann S|display-authors=6|doi-access=free}}</ref>。4月1日、ファイザー- |
モデルナは、南アフリカの系統 B.1.351(501.V2 変異株)に取り組むための新しいワクチンの試験を開始した<ref>{{Cite web2|title=Moderna develops new vaccine to tackle mutant Covid strain|work=[[Financial Times]]|url=https://www.ft.com/content/c0c8f72c-e58e-4319-80c4-0db153ad85db|access-date=30 January 2021|first=Hannah|last=Kuchler|date=25 January 2021|url-access=subscription}}</ref>。2021年2月17日、ファイザーはB.1.351の中和活性が2/3に低下したと発表したが、この変異株に対するワクチンの疾病予防効果については、まだ主張できないとしている<ref>{{Cite journal2|last1=Liu|first1=Yang|last2=Liu|first2=Jianying|last3=Xia|first3=Hongjie|last4=Zhang|first4=Xianwen|last5=Fontes-Garfias|first5=Camila R.|last6=Swanson|first6=Kena A.|last7=Cai|first7=Hui|last8=Sarkar|first8=Ritu|last9=Chen|first9=Wei|date=17 February 2021|title=Neutralizing Activity of BNT162b2-Elicited Serum — Preliminary Report|url=https://www.nejm.org/doi/10.1056/NEJMc2102017|journal=New England Journal of Medicine|doi=10.1056/nejmc2102017|pmid=33596352|access-date=25 February 2021|first16=Xuping|first18=Pei-Yong|last18=Shi|first17=Philip R.|last17=Dormitzer|last12=Weaver|last16=Xie|first15=Kathrin U.|last15=Jansen|first14=Ugur|last14=Sahin|first13=Alexander|last13=Muik|first12=Scott C.|first11=David|last11=Cooper|first10=Mark|last10=Cutler|doi-access=free}}</ref>。B.1.351に対するモデルナおよびファイザーのワクチンを接種した患者からの[[血清]]の中和活性の低下は、その後、いくつかの研究で確認された<ref name="nature.b117.B1351">{{Cite journal2|date=March 2021|title=Antibody Resistance of SARS-CoV-2 Variants B.1.351 and B.1.1.7|journal=Nature|doi=10.1038/s41586-021-03398-2|pmid=33684923|vauthors=Wang P, Nair MS, Liu L, Iketani S, Luo Y, Guo Y, Wang M, Yu J, Zhang B, Kwong PD, Graham BS, Mascola JR, Chang JY, Yin MT, Sobieszczyk M, Kyratsous CA, Shapiro L, Sheng Z, Huang Y, Ho DD|display-authors=6|doi-access=free}}</ref><ref name="cell.B1351.P12">{{Cite journal2|date=March 2021|title=1 SARS-CoV-2 variants B.1.351 and P.1 escape from neutralizing antibodies|journal=Cell|doi=10.1016/j.cell.2021.03.036|pmid=33794143|vauthors=Hoffmann M, Arora P, Gross R, Seidel A, Hoernich BF, Hahn AS, Krueger N, Graichen L, Hofmann-Winkler H, Kempf A, Winkler MS, Schulz S, Jaeck HM, Jahrsdoerfer B, Schrezenmeier H, Mueller M, Kleger A, Muench J, Poehlmann S|display-authors=6|doi-access=free}}</ref>。4月1日、ファイザー - ビオンテックによる南アフリカでのワクチン試験の最新情報では、ワクチンの効果は今のところ100%(つまり、ワクチンを接種した被験者には症例が発生しなかった)で、[[対照実験|プラセボ対照群]]では9件の感染のうち6件がB.1.351であったと述べられている<ref>{{Cite web2|title=Pfizer and BioNTech Confirm High Efficacy and No Serious Safety Concerns Through Up to Six Months Following Second Dose in Updated Topline Analysis of Landmark COVID-19 Vaccine Study|url=https://www.pfizer.com/news/press-release/press-release-detail/pfizer-and-biontech-confirm-high-efficacy-and-no-serious|publisher=Pfizer|access-date=2 April 2021|date=1 April 2021}}</ref>。 |
||
2021年1月、南アフリカで[[ジョンソン・エンド・ジョンソンCOVID-19ワクチン|Ad26.COV2.S ワクチン]]の臨床試験を実施したジョンソン・エンド・ジョンソンは、中等度から重度のCOVID-19感染に対する防御レベルは、米国で72%、南アフリカで57%であったと報告した<ref>{{Cite press release|title=Johnson & Johnson Announces Single-Shot Janssen COVID-19 Vaccine Candidate Met Primary Endpoints in Interim Analysis of its Phase 3 ENSEMBLE Trial|publisher=Johnson & Johnson|date=29 January 2021|url=https://www.jnj.com/johnson-johnson-announces-single-shot-janssen-covid-19-vaccine-candidate-met-primary-endpoints-in-interim-analysis-of-its-phase-3-ensemble-trial|access-date=29 January 2021}}</ref>。 |
2021年1月、南アフリカで[[ジョンソン・エンド・ジョンソンCOVID-19ワクチン|Ad26.COV2.S ワクチン]]の臨床試験を実施したジョンソン・エンド・ジョンソンは、中等度から重度のCOVID-19感染に対する防御レベルは、米国で72%、南アフリカで57%であったと報告した<ref>{{Cite press release|title=Johnson & Johnson Announces Single-Shot Janssen COVID-19 Vaccine Candidate Met Primary Endpoints in Interim Analysis of its Phase 3 ENSEMBLE Trial|publisher=Johnson & Johnson|date=29 January 2021|url=https://www.jnj.com/johnson-johnson-announces-single-shot-janssen-covid-19-vaccine-candidate-met-primary-endpoints-in-interim-analysis-of-its-phase-3-ensemble-trial|access-date=29 January 2021}}</ref>。 |
||
| 462行目: | 559行目: | ||
==== ガンマ株(系統 P.1) ==== |
==== ガンマ株(系統 P.1) ==== |
||
{{seealso|SARSコロナウイルス2-ガンマ株}} |
{{seealso|SARSコロナウイルス2-ガンマ株}} |
||
ブラジルで最初に同定された変異株である系統 P.1(20J/501Y.V3)は、ファイザー- |
ブラジルで最初に同定された変異株である系統 P.1(20J/501Y.V3)は、ファイザー - ビオンテックによるワクチン接種の効果を部分的に免れている可能性がある<ref name="cell.B1351.P12"/>。 |
||
==== 系統 B.1.617(デルタ株/カッパ株) ==== |
==== 系統 B.1.617(デルタ株/カッパ株) ==== |
||
{{seealso|SARSコロナウイルス2の変異株B.1.617系統}} |
{{seealso|SARSコロナウイルス2の変異株B.1.617系統}} |
||
2020年10月、インドで新たな二重変異変異体が発見され、系統 B.1.617と名付けられた。2021年1月まではほとんど検出されず、4月には[[南極大陸]]と[[南米大陸]]を除く各大陸の少なくとも20カ国に広がった<ref>{{Cite web2|title=PANGO lineages|url=https://cov-lineages.org/lineages/lineage_B.1.617.html|access-date=2021-04-18|website=cov-lineages.org}}</ref><ref name="Koshy">{{cite news|vauthors=Koshy J|title=Coronavirus {{!}} Indian 'double mutant' strain named B.1.617|url=https://www.thehindu.com/news/national/indian-double-mutant-strain-named-b1617/article34274663.ece/amp/|work=The Hindu|date=8 April 2021|language=en-IN}}</ref><ref>{{cite news|url=https://torontosun.com/news/local-news/indias-variant-fuelled-second-wave-coincided-with-spike-in-infected-flights-landing-in-canada|title=India's variant-fuelled second wave coincided with spike in infected flights landing in Canada|publisher=[[:en:Toronto Sun|Toronto Sun]]|date=10 April 2021|access-date=10 April 2021}}</ref>。約15種ある定義された変異の中で、これにはスパイク変異D111D(同義)、G142D<ref>{{Cite |
2020年10月、インドで新たな二重変異変異体が発見され、系統 B.1.617と名付けられた。2021年1月まではほとんど検出されず、4月には[[南極大陸]]と[[南米大陸]]を除く各大陸の少なくとも20カ国に広がった<ref>{{Cite web2|title=PANGO lineages|url=https://cov-lineages.org/lineages/lineage_B.1.617.html|access-date=2021-04-18|website=cov-lineages.org}}</ref><ref name="Koshy">{{cite news|vauthors=Koshy J|title=Coronavirus {{!}} Indian 'double mutant' strain named B.1.617|url=https://www.thehindu.com/news/national/indian-double-mutant-strain-named-b1617/article34274663.ece/amp/|work=The Hindu|date=8 April 2021|language=en-IN}}</ref><ref>{{cite news|url=https://torontosun.com/news/local-news/indias-variant-fuelled-second-wave-coincided-with-spike-in-infected-flights-landing-in-canada|title=India's variant-fuelled second wave coincided with spike in infected flights landing in Canada|publisher=[[:en:Toronto Sun|Toronto Sun]]|date=10 April 2021|access-date=10 April 2021}}</ref>。約15種ある定義された変異の中で、これにはスパイク変異D111D(同義)、G142D<ref>{{Cite report|last1=Cherian|first1=Sarah|last2=Potdar|first2=Varsha|last3=Jadhav|first3=Santosh|last4=Yadav|first4=Pragya|last5=Gupta|first5=Nivedita|last6=Das|first6=Mousmi|last7=Rakshit|first7=Partha|last8=Singh|first8=Sujeet|last9=Abraham|first9=Priya|date=24 April 2021|title="Convergent evolution of SARS-CoV-2 spike mutations, L452R, E484Q and P681R, in the second wave of COVID-19 in Maharashtra, India"|url=https://www.biorxiv.org/content/10.1101/2021.04.22.440932v1|doi=10.1101/2021.04.22.440932|access-date=25 April 2021|last10=Panda|first10=Samiran|s2cid=233415787}}</ref>、P681R、E484Q<ref>{{Cite web2|last=Shrutirupa|date=2021-04-17|title=IS THIS COVID – 20? {{!}} Double Mutant Strain Explained|url=https://selfimmune.com/2021/04/17/double-mutant-strain-explained/|access-date=2021-04-18|website=Self Immune|language=en-US}}</ref>、L452R<ref>{{cite news|url=https://www.bbc.co.uk/news/world-asia-india-56517495|title='Double mutant': What are the risks of India's new Covid-19 variant|website=www.bbc.co.uk/news|date=25 March 2021|access-date=11 April 2021}}</ref> があり、後者の2つは容易に[[抗体]]を回避する原因になる可能性がある<ref>[https://www.forbes.com/sites/williamhaseltine/2021/04/12/an-indian-sars-cov-2-variant-lands-in-california-more-danger-ahead/?sh=7b8c566d3b29 Haseltine WA. An Indian SARS-CoV-2 Variant Lands In California. More Danger Ahead?] ''Forbes.com'', Apr 12, 2021, accessed 14 April 2021</ref>(※後述の系統 B.1.617.2にはG142DとE484Qの変異がなく、代わりにT478K変異がある)。<!--PHEは、2021年4月15日の更新でB.1.617を「調査中の変異株」VUI-21APR-01として指定した<ref name="IndiaPHE">{{cite news|url=https://www.gov.uk/government/news/confirmed-cases-of-covid-19-variants-identified-in-uk|title=Confirmed cases of COVID-19 variants identified in UK|website=Public Health England|date=15 April 2021|access-date=16 April 2021}}</ref>。--> |
||
なお、亜系統として[[SARSコロナウイルス2-カッパ株|系統 B.1.617.1]]('''カッパ株''')、[[SARSコロナウイルス2-デルタ株|系統 B.1.617.2]]('''デルタ株''')、[[SARSコロナウイルス2-系統 B.1.617.3|系統 B.1.617.3]]の3つがあり、系統 B.1.617.2はWHOなどにより[[懸念される変異株]] (VOC) に指定されている。 |
なお、亜系統として[[SARSコロナウイルス2-カッパ株|系統 B.1.617.1]]('''カッパ株''')、[[SARSコロナウイルス2-デルタ株|系統 B.1.617.2]]('''デルタ株''')、[[SARSコロナウイルス2-系統 B.1.617.3|系統 B.1.617.3]]の3つがあり、系統 B.1.617.2はWHOなどにより[[懸念される変異株]] (VOC) に指定されている。 |
||
デルタ株はウイルス量が多く、感染力が強いとされている。ワクチンを打っていたとしても従来株に比べ感染するリスクが高くなっている、一方でワクチンの効果により重症化リスクは低く抑えられている。また、ワクチン接種者が感染した場合でも、軽症や無症状であったとしても、ワクチン非接種者と同様に体内で大量に増殖しウイルスの感染源となる可能性が指摘されている<ref>{{Cite web |
デルタ株はウイルス量が多く、感染力が強いとされている。ワクチンを打っていたとしても従来株に比べ感染するリスクが高くなっている、一方でワクチンの効果により重症化リスクは低く抑えられている。また、ワクチン接種者が感染した場合でも、軽症や無症状であったとしても、ワクチン非接種者と同様に体内で大量に増殖しウイルスの感染源となる可能性が指摘されている<ref>{{Cite web|和書| url = https://www.pharm.or.jp/news/news_20210817471.html | title = 新型コロナウイルスワクチンに関するQ&A その3 | publisher = 日本薬学会 | accessdate = 2021-08-20 }}</ref>。 |
||
== {{Anchors|ワクチン候補}}臨床試験および認可状況 == |
== {{Anchors|ワクチン候補}}臨床試験および認可状況 == |
||
第I相試験では、主に数十人の健康な被験者を対象に安全性と予備的投与量を試験し、第II相試験では、第I相試験の成功を受けて免疫原性、投与量レベル([[バイオマーカー]]に基づく有効性)、および候補ワクチンの副作用を評価し、通常は数百人を対象としている。第I–II相試験は、予備的な安全性と免疫原性試験で構成され、通常は無作為化、プラセボ対照試験で、より正確で効果的な用量を決定する。第III相試験では通常、複数の施設でより多くの被験者が参加し、[[対照群]]を含めて、最適な用量で[[有害作用]]を監視しながら、病気を予防するためのワクチンの有効性を試験する(「介入試験」または「ピボタル試験」)<ref name="Vaccines.gov">{{Cite web2|title=Vaccine Safety – Vaccines|url=https://www.vaccines.gov/basics/safety|website=vaccines.gov|publisher=US Department of Health and Human Services|accessdate=13 April 2020|archiveurl=https://web.archive.org/web/20200422073442/https://www.vaccines.gov/basics/safety|archivedate=22 April 2020}}</ref><ref name="fda-ddp">{{Cite web2|title=The drug development process|url=https://www.fda.gov/patients/learn-about-drug-and-device-approvals/drug-development-process|publisher=U.S. [[Food and Drug Administration]] (FDA)|accessdate=12 April 2020|date=4 January 2018|archiveurl=https://web.archive.org/web/20200222182002/https://www.fda.gov/patients/learn-about-drug-and-device-approvals/drug-development-process|archivedate=22 February 2020}}</ref>。第III相試験におけるワクチンの安全性、有効性、および{{仮リンク|臨床エンドポイント|en|Clinical endpoint}}の定義は、副作用の程度、感染または感染量の定義、ワクチンが中等度または重度のCOVID-19感染を予防するかどうかなど、各社の試験によって異なる場合がある<ref name="cohen6-19">{{Cite journal2|last=Cohen|first=Jon|date=2020-06-19|title=Pandemic vaccines are about to face the real test|journal=Science|volume=368|issue=6497|pages=1295–96|bibcode=2020Sci...368.1295C|DOI=10.1126/science.368.6497.1295|PMID=32554572}}</ref><ref name="cdc-eff">{{Cite web2|title=How flu vaccine effectiveness and efficacy are measured|url=https://www.cdc.gov/flu/vaccines-work/effectivenessqa.htm?CDC_AA_refVal=https%3A%2F%2Fwww.cdc.gov%2Fflu%2Fprofessionals%2Fvaccination%2Feffectivenessqa.htm|date=2016-01-29|publisher=Centers for Disease Control and Prevention, National Center for Immunization and Respiratory Diseases, US Department of Health and Human Services|accessdate=2020-05-06|archivedate=7 May 2020|archiveurl=https://web.archive.org/web/20200507083203/https://www.cdc.gov/flu/vaccines-work/effectivenessqa.htm?CDC_AA_refVal=https%3A%2F%2Fwww.cdc.gov%2Fflu%2Fprofessionals%2Fvaccination%2Feffectivenessqa.htm}}</ref><ref>{{Cite web2|title=Principles of epidemiology, Section 8: Concepts of disease occurrence|url=https://www.cdc.gov/csels/dsepd/ss1978/lesson1/section8.html|date=2012-05-18|publisher=Centers for Disease Control and Prevention, Center for Surveillance, Epidemiology, and Laboratory Services, US Department of Health and Human Services|accessdate=2020-05-06|archiveurl=https://web.archive.org/web/20200406212227/https://www.cdc.gov/csels/dsepd/ss1978/lesson1/section8.html|archivedate=6 April 2020}}</ref>。 |
第I相試験では、主に数十人の健康な被験者を対象に安全性と予備的投与量を試験し、第II相試験では、第I相試験の成功を受けて免疫原性、投与量レベル([[バイオマーカー (薬学)|バイオマーカー]]に基づく有効性)、および候補ワクチンの副作用を評価し、通常は数百人を対象としている。第I–II相試験は、予備的な安全性と免疫原性試験で構成され、通常は無作為化、プラセボ対照試験で、より正確で効果的な用量を決定する。第III相試験では通常、複数の施設でより多くの被験者が参加し、[[対照群]]を含めて、最適な用量で[[有害作用]]を監視しながら、病気を予防するためのワクチンの有効性を試験する(「介入試験」または「ピボタル試験」)<ref name="Vaccines.gov">{{Cite web2|title=Vaccine Safety – Vaccines|url=https://www.vaccines.gov/basics/safety|website=vaccines.gov|publisher=US Department of Health and Human Services|accessdate=13 April 2020|archiveurl=https://web.archive.org/web/20200422073442/https://www.vaccines.gov/basics/safety|archivedate=22 April 2020}}</ref><ref name="fda-ddp">{{Cite web2|title=The drug development process|url=https://www.fda.gov/patients/learn-about-drug-and-device-approvals/drug-development-process|publisher=U.S. [[Food and Drug Administration]] (FDA)|accessdate=12 April 2020|date=4 January 2018|archiveurl=https://web.archive.org/web/20200222182002/https://www.fda.gov/patients/learn-about-drug-and-device-approvals/drug-development-process|archivedate=22 February 2020}}</ref>。第III相試験におけるワクチンの安全性、有効性、および{{仮リンク|臨床エンドポイント|en|Clinical endpoint}}の定義は、副作用の程度、感染または感染量の定義、ワクチンが中等度または重度のCOVID-19感染を予防するかどうかなど、各社の試験によって異なる場合がある<ref name="cohen6-19">{{Cite journal2|last=Cohen|first=Jon|date=2020-06-19|title=Pandemic vaccines are about to face the real test|journal=Science|volume=368|issue=6497|pages=1295–96|bibcode=2020Sci...368.1295C|DOI=10.1126/science.368.6497.1295|PMID=32554572}}</ref><ref name="cdc-eff">{{Cite web2|title=How flu vaccine effectiveness and efficacy are measured|url=https://www.cdc.gov/flu/vaccines-work/effectivenessqa.htm?CDC_AA_refVal=https%3A%2F%2Fwww.cdc.gov%2Fflu%2Fprofessionals%2Fvaccination%2Feffectivenessqa.htm|date=2016-01-29|publisher=Centers for Disease Control and Prevention, National Center for Immunization and Respiratory Diseases, US Department of Health and Human Services|accessdate=2020-05-06|archivedate=7 May 2020|archiveurl=https://web.archive.org/web/20200507083203/https://www.cdc.gov/flu/vaccines-work/effectivenessqa.htm?CDC_AA_refVal=https%3A%2F%2Fwww.cdc.gov%2Fflu%2Fprofessionals%2Fvaccination%2Feffectivenessqa.htm}}</ref><ref>{{Cite web2|title=Principles of epidemiology, Section 8: Concepts of disease occurrence|url=https://www.cdc.gov/csels/dsepd/ss1978/lesson1/section8.html|date=2012-05-18|publisher=Centers for Disease Control and Prevention, Center for Surveillance, Epidemiology, and Laboratory Services, US Department of Health and Human Services|accessdate=2020-05-06|archiveurl=https://web.archive.org/web/20200406212227/https://www.cdc.gov/csels/dsepd/ss1978/lesson1/section8.html|archivedate=6 April 2020}}</ref>。 |
||
進行中の臨床試験の計画は、試験でデータを蓄積することにより、治療法の有効性についての肯定的または否定的な早期の洞察が得られる場合には、{{仮リンク|適応デザイン (医学)|en|Adaptive design (medicine)|label=適応デザイン}}として変更されることがある<ref name="pallmann">{{Cite journal2|date=February 2018|title=Adaptive designs in clinical trials: why use them, and how to run and report them|journal=BMC Medicine|volume=16|issue=1|page=29|doi=10.1186/s12916-018-1017-7|pmid=29490655|pmc=5830330|display-authors=6|vauthors=Pallmann P, Bedding AW, Choodari-Oskooei B, Dimairo M, Flight L, Hampson LV, Holmes J, Mander AP, Odondi L, Sydes MR, Villar SS, Wason JM, Weir CJ, Wheeler GM, Yap C, Jaki T}}</ref><ref name="fda-adaptive">{{Cite web2|date=1 November 2019|title=Adaptive designs for clinical trials of drugs and biologics: Guidance for industry|url=https://www.fda.gov/media/78495/download|url-status=live|archive-url=https://web.archive.org/web/20191213234438/https://www.fda.gov/media/78495/download|archive-date=13 December 2019|access-date=3 April 2020|publisher=U.S. [[Food and Drug Administration]] (FDA)|format=PDF}}</ref>。候補ワクチンに関する進行中の第II-III相臨床試験における適応デザインは、試験期間を短縮し、被験者数を減らすことができ、早期終了または成功の判断を迅速化し、研究努力の重複を回避し、国際的な拠点間での連帯試験(Solidarity trial)の計画変更について調整を強化する<ref name="pallmann" /><ref name="solidarity-vacc2">{{Cite web2|date=9 April 2020|title=An international randomised trial of candidate vaccines against COVID-19: Outline of Solidarity vaccine trial|url=https://www.who.int/blueprint/priority-diseases/key-action/Outline_CoreProtocol_vaccine_trial_09042020.pdf|url-status=live|archive-url=https://web.archive.org/web/20200512115627/https://www.who.int/blueprint/priority-diseases/key-action/Outline_CoreProtocol_vaccine_trial_09042020.pdf|archive-date=12 May 2020|access-date=9 May 2020|publisher=[[World Health Organization]] (WHO)}}</ref>。 |
進行中の臨床試験の計画は、試験でデータを蓄積することにより、治療法の有効性についての肯定的または否定的な早期の洞察が得られる場合には、{{仮リンク|適応デザイン (医学)|en|Adaptive design (medicine)|label=適応デザイン}}として変更されることがある<ref name="pallmann">{{Cite journal2|date=February 2018|title=Adaptive designs in clinical trials: why use them, and how to run and report them|journal=BMC Medicine|volume=16|issue=1|page=29|doi=10.1186/s12916-018-1017-7|pmid=29490655|pmc=5830330|display-authors=6|vauthors=Pallmann P, Bedding AW, Choodari-Oskooei B, Dimairo M, Flight L, Hampson LV, Holmes J, Mander AP, Odondi L, Sydes MR, Villar SS, Wason JM, Weir CJ, Wheeler GM, Yap C, Jaki T}}</ref><ref name="fda-adaptive">{{Cite web2|date=1 November 2019|title=Adaptive designs for clinical trials of drugs and biologics: Guidance for industry|url=https://www.fda.gov/media/78495/download|url-status=live|archive-url=https://web.archive.org/web/20191213234438/https://www.fda.gov/media/78495/download|archive-date=13 December 2019|access-date=3 April 2020|publisher=U.S. [[Food and Drug Administration]] (FDA)|format=PDF}}</ref>。候補ワクチンに関する進行中の第II-III相臨床試験における適応デザインは、試験期間を短縮し、被験者数を減らすことができ、早期終了または成功の判断を迅速化し、研究努力の重複を回避し、国際的な拠点間での連帯試験(Solidarity trial)の計画変更について調整を強化する<ref name="pallmann" /><ref name="solidarity-vacc2">{{Cite web2|date=9 April 2020|title=An international randomised trial of candidate vaccines against COVID-19: Outline of Solidarity vaccine trial|url=https://www.who.int/blueprint/priority-diseases/key-action/Outline_CoreProtocol_vaccine_trial_09042020.pdf|url-status=live|archive-url=https://web.archive.org/web/20200512115627/https://www.who.int/blueprint/priority-diseases/key-action/Outline_CoreProtocol_vaccine_trial_09042020.pdf|archive-date=12 May 2020|access-date=9 May 2020|publisher=[[World Health Organization]] (WHO)}}</ref>。 |
||
| 481行目: | 578行目: | ||
各国の[[医療品規制|規制当局]]は、22種のワクチンの[[緊急使用許可]]を与えている。そのうち6つのワクチンは、少なくとも1つの[[:en:List of stringent regulatory authorities|WHO認定の厳格な規制当局]]によって緊急使用または一般使用が承認されている。 |
各国の[[医療品規制|規制当局]]は、22種のワクチンの[[緊急使用許可]]を与えている。そのうち6つのワクチンは、少なくとも1つの[[:en:List of stringent regulatory authorities|WHO認定の厳格な規制当局]]によって緊急使用または一般使用が承認されている。 |
||
<gallery widths="300" heights="150"> |
<gallery widths="300" heights="150"> |
||
ファイル:COVID-19 RNA and DNA vaccines authorization map.svg|[[RNAワクチン]]・[[DNAワクチン]]{{Legend|#800080|[[トジナメラン|ファイザー- |
ファイル:COVID-19 RNA and DNA vaccines authorization map.svg|[[RNAワクチン]]・[[DNAワクチン]]{{Legend|#800080|[[トジナメラン|ファイザー - ビオンテック]](初期型)}}{{Legend|#8C00FF|ファイザー - ビオンテック(オミクロン対応型)}}{{Legend|#008800|[[mRNA-1273|モデルナ]](初期型)}}{{Legend|#8CFF00|モデルナ(オミクロン対応型)}}{{Legend|#008CFF|[[ZyCoV-D]]}} |
||
ファイル:COVID-19 adenovirus vaccines authorization map.svg|[[ウイルスベクター#ワクチン|アデノウイルスベクターワクチン]]{{Legend|#000088|[[AZD1222|オックスフォード=アストラゼネカ]]}}{{Legend|#880000|[[スプートニクV COVID-19ワクチン|スプートニクV]]}}{{Legend|#008800|[[ジョンソン・エンド・ジョンソンCOVID-19ワクチン|ジョンソン・エンド・ジョンソン]]}}{{Legend|#888800|[[Ad5-nCoV]]}}{{Legend|#FF008C|[[スプートニクV COVID-19ワクチン#スプートニク・ライト|スプートニク・ライト]]}} |
ファイル:COVID-19 adenovirus vaccines authorization map.svg|[[ウイルスベクター#ワクチン|アデノウイルスベクターワクチン]]{{Legend|#000088|[[AZD1222|オックスフォード=アストラゼネカ]]}}{{Legend|#880000|[[スプートニクV COVID-19ワクチン|スプートニクV]]}}{{Legend|#008800|[[ジョンソン・エンド・ジョンソンCOVID-19ワクチン|ジョンソン・エンド・ジョンソン]]}}{{Legend|#888800|[[Ad5-nCoV]]}}{{Legend|#FF008C|[[スプートニクV COVID-19ワクチン#スプートニク・ライト|スプートニク・ライト]]}} |
||
ファイル:COVID-19 inactivated vaccines authorization map.svg|[[不活化ワクチン]]{{Legend|#008888|[[シノファームCOVID-19ワクチン|シノファーム (BBIBP-CorV)]]}}{{Legend|#888800|[[CoronaVac]]}}{{Legend|#880088|[[Covaxin]]}}{{Legend|#FF8C00|{{仮リンク|WIBP-CorV|label=シノファーム (WIBP-CorV)|en|WIBP-CorV}}}}{{Legend|# |
ファイル:COVID-19 inactivated vaccines authorization map.svg|[[不活化ワクチン]]{{Legend|#008888|[[シノファームCOVID-19ワクチン|シノファーム (BBIBP-CorV)]]}}{{Legend|#888800|[[CoronaVac]]}}{{Legend|#880088|[[Covaxin]]}}{{Legend|#FF8C00|{{仮リンク|WIBP-CorV|label=シノファーム (WIBP-CorV)|en|WIBP-CorV}}}}{{Legend|#FF008C|[[VLA2001|Valneva]]}}{{Legend|#666666|その他}} |
||
ファイル:COVID-19 subunit and VLP vaccines authorization map.svg|[[サブユニットワクチン]]{{Legend|#088|[[EpiVacCorona]]}}{{Legend|#8C00FF|{{仮リンク|ZF2001|label=Zifivax|en|ZF2001}}}}{{Legend|#008CFF|{{仮リンク|Abdala|en|Abdala (vaccine)}}}}{{Legend|#00FF8C|[[FINLAY-FR-2|Soberana 02]]}}{{Legend|#FF8C00|[[Novavax COVID-19ワクチン|ノババックス]]}}{{Legend|#666|その他}} |
ファイル:COVID-19 subunit and VLP vaccines authorization map.svg|[[サブユニットワクチン]]{{Legend|#088|[[EpiVacCorona]]}}{{Legend|#8C00FF|{{仮リンク|ZF2001|label=Zifivax|en|ZF2001}}}}{{Legend|#008CFF|{{仮リンク|Abdala|en|Abdala (vaccine)}}}}{{Legend|#00FF8C|[[FINLAY-FR-2|Soberana 02]]}}{{Legend|#FF8C00|[[Novavax COVID-19ワクチン|ノババックス]]}}{{Legend|#666|その他}} |
||
</gallery> |
</gallery> |
||
| 490行目: | 587行目: | ||
|+ 緊急利用許可または一般認可により承認されたワクチン |
|+ 緊急利用許可または一般認可により承認されたワクチン |
||
|- |
|- |
||
! ワクチン候補薬、開発者、出資者 |
! ワクチン候補薬、開発者、出資者 |
||
!開発国!! ワクチン種類(技術) |
!開発国!! ワクチン種類(技術) |
||
!接種間隔 |
!接種間隔 |
||
!保管温度 |
!保管温度 |
||
| 507行目: | 604行目: | ||
|143 |
|143 |
||
|- |
|- |
||
| '''[[ファイザー- |
| '''[[トジナメラン|ファイザー - ビオンテックCOVID-19ワクチン]]''' <small>(コミナティ, トジナメラン)</small><ref name="hcreg" /><ref name="NCT04368728">{{Cite web2|title=Study to Describe the Safety, Tolerability, Immunogenicity, and Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Adults |url=https://clinicaltrials.gov/ct2/show/NCT04368728 |website=[[ClinicalTrials.gov]] |publisher=[[United States National Library of Medicine]] |type=Registry |id=NCT04368728 |date=30 April 2020 |access-date=14 July 2020 |archive-date=11 October 2020 |archive-url=https://web.archive.org/web/20201011084828/https://clinicaltrials.gov/ct2/show/NCT04368728/ |url-status=live }}</ref><ref name="EudraCT-2020-001038-36">{{Cite web2|title=A Multi-site Phase I/II, 2-Part, Dose-Escalation Trial Investigating the Safety and Immunogenicity of four Prophylactic SARS-CoV-2 RNA Vaccines Against COVID-19 Using Different Dosing Regimens in Healthy Adults |url=https://www.clinicaltrialsregister.eu/ctr-search/trial/2020-001038-36/DE |website=EU Clinical Trials Register |publisher=European Union |type=Registry |id=[[EudraCT]] 2020-001038-36 |date=14 April 2020 |access-date=22 April 2020 |archive-url=https://web.archive.org/web/20200422111024/https://www.clinicaltrialsregister.eu/ctr-search/trial/2020-001038-36/DE |archive-date=22 April 2020 |url-status=live}}</ref><br /><small>[[ビオンテック]]、[[ファイザー]]</small> |
||
|米国、ドイツ|| [[RNAワクチン|RNA]] ([[ヌクレオシド修飾メッセンジャーRNA|modRNA]]を[[脂質ナノ粒子]]に分散) |
|米国、ドイツ|| [[RNAワクチン|RNA]] ([[ヌクレオシド修飾メッセンジャーRNA|modRNA]]を[[脂質ナノ粒子]]に分散) |
||
|2回 |
|2回 |
||
3-4週 |
3-4週 |
||
| -70±10℃<wbr />{{efn-la|Long-term storage temperature. The Pfizer–BioNTech COVID-19 vaccine can be kept between {{Convert|-25|and|-15|C|F|abbr=}} for up to two weeks before use, and between {{Convert|2|and|8|C|F|abbr=}} for up to five days before use.<ref>{{cite press release |date=25 February 2021 |title=Coronavirus (COVID-19) Update: FDA Allows More Flexible Storage, Transportation Conditions for Pfizer-BioNTech COVID-19 Vaccine |url=https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-allows-more-flexible-storage-transportation-conditions-pfizer |publisher=[[Food and Drug Administration]] (FDA) |access-date=5 March 2021}}</ref><ref name="Pfizer-BioNTech COVID-19 Vaccine EUA fact sheet" />}}([[超低温冷凍庫]]) |
| -70±10℃<wbr />{{efn-la|Long-term storage temperature. The Pfizer–BioNTech COVID-19 vaccine can be kept between {{Convert|-25|and|-15|C|F|abbr=}} for up to two weeks before use, and between {{Convert|2|and|8|C|F|abbr=}} for up to five days before use.<ref>{{cite press release |date=25 February 2021 |title=Coronavirus (COVID-19) Update: FDA Allows More Flexible Storage, Transportation Conditions for Pfizer-BioNTech COVID-19 Vaccine |url=https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-allows-more-flexible-storage-transportation-conditions-pfizer |publisher=[[Food and Drug Administration]] (FDA) |access-date=5 March 2021}}</ref><ref name="Pfizer-BioNTech COVID-19 Vaccine EUA fact sheet">{{Cite web2| title=Pfizer-BioNTech COVID-19 Vaccine EUA Fact Sheet for Healthcare Providers | publisher=Pfizer | date=25 February 2021 | access-date=25 February 2021 | url=https://www.fda.gov/media/144413/download | format=PDF}}</ref>}}([[超低温冷凍庫]]) |
||
|第III相 (43,448) |
|第III相 (43,448) |
||
|5||93 |
|5||93 |
||
|- |
|- |
||
| '''[[スプートニクV COVID-19ワクチン]]''' <small>(Gam-COVID-Vac)</small> |
| '''[[スプートニクV COVID-19ワクチン]]''' <small>(Gam-COVID-Vac)</small> |
||
[[ガマレヤ記念国立疫学・微生物学研究センター|<small>ガマレヤ記念国立疫学・微生物学研究センター</small>]] |
[[ガマレヤ記念国立疫学・微生物学研究センター|<small>ガマレヤ記念国立疫学・微生物学研究センター</small>]] |
||
|ロシア|| [[アデノウイルス]] [[ベクター]] ([[組み換えワクチン]]、Ad5およびAd26型) |
|ロシア|| [[アデノウイルス]] [[ベクター]] ([[組み換えワクチン]]、Ad5およびAd26型) |
||
|2回 |
|2回 |
||
3週 |
3週 |
||
| 525行目: | 622行目: | ||
|- |
|- |
||
| '''[[モデルナCOVID-19ワクチン]]''' <ref name="NCT04470427">{{Cite web2|title=A Study to Evaluate Efficacy, Safety, and Immunogenicity of mRNA-1273 Vaccine in Adults Aged 18 Years and Older to Prevent COVID-19 |url=https://clinicaltrials.gov/ct2/show/NCT04470427 |website=[[ClinicalTrials.gov]] |publisher=[[United States National Library of Medicine]] |type=Registry |id=NCT04470427 |date=14 July 2020 |access-date=27 July 2020 |archive-date=11 October 2020 |archive-url=https://web.archive.org/web/20201011084833/https://clinicaltrials.gov/ct2/show/NCT04470427/ |url-status=live }}</ref><ref name="palca">{{cite news |last1=Palca |first1=Joe |title=COVID-19 vaccine candidate heads to widespread testing in U.S. |url=https://www.npr.org/sections/coronavirus-live-updates/2020/07/27/895672859/us-vaccine-candidate-heads-to-widespread-testing-in-people |access-date=27 July 2020 |work=NPR |date=27 July 2020 |name-list-style=vanc |archive-date=11 October 2020 |archive-url=https://web.archive.org/web/20201011084836/https://www.npr.org/sections/coronavirus-live-updates/2020/07/27/895672859/us-vaccine-candidate-heads-to-widespread-testing-in-people/ |url-status=live }}</ref><br /><small>[[モデルナ]]、[[アメリカ国立アレルギー・感染症研究所|NIAID]]、[[アメリカ生物医学先端研究開発局|BARDA]]、CEPI</small> |
| '''[[モデルナCOVID-19ワクチン]]''' <ref name="NCT04470427">{{Cite web2|title=A Study to Evaluate Efficacy, Safety, and Immunogenicity of mRNA-1273 Vaccine in Adults Aged 18 Years and Older to Prevent COVID-19 |url=https://clinicaltrials.gov/ct2/show/NCT04470427 |website=[[ClinicalTrials.gov]] |publisher=[[United States National Library of Medicine]] |type=Registry |id=NCT04470427 |date=14 July 2020 |access-date=27 July 2020 |archive-date=11 October 2020 |archive-url=https://web.archive.org/web/20201011084833/https://clinicaltrials.gov/ct2/show/NCT04470427/ |url-status=live }}</ref><ref name="palca">{{cite news |last1=Palca |first1=Joe |title=COVID-19 vaccine candidate heads to widespread testing in U.S. |url=https://www.npr.org/sections/coronavirus-live-updates/2020/07/27/895672859/us-vaccine-candidate-heads-to-widespread-testing-in-people |access-date=27 July 2020 |work=NPR |date=27 July 2020 |name-list-style=vanc |archive-date=11 October 2020 |archive-url=https://web.archive.org/web/20201011084836/https://www.npr.org/sections/coronavirus-live-updates/2020/07/27/895672859/us-vaccine-candidate-heads-to-widespread-testing-in-people/ |url-status=live }}</ref><br /><small>[[モデルナ]]、[[アメリカ国立アレルギー・感染症研究所|NIAID]]、[[アメリカ生物医学先端研究開発局|BARDA]]、CEPI</small> |
||
|米国|| [[RNAワクチン|RNA]] ([[ヌクレオシド修飾メッセンジャーRNA|modRNA]]を[[脂質ナノ粒子]]に分散) |
|米国|| [[RNAワクチン|RNA]] ([[ヌクレオシド修飾メッセンジャーRNA|modRNA]]を[[脂質ナノ粒子]]に分散) |
||
|2回 |
|2回 |
||
4週 |
4週 |
||
| 540行目: | 637行目: | ||
|4||50 |
|4||50 |
||
|- |
|- |
||
|'''[[ジョンソン・エンド・ジョンソンCOVID-19ワクチン]]''' <ref>{{Cite web2|title=A Study of Ad26.COV2.S in Adults|url=https://clinicaltrials.gov/ct2/show/NCT04436276|access-date=2020-08-23|publisher=ClinicalTrials.gov, US National Library of Medicine|date=2020-08-04|archive-date=16 September 2020|archive-url=https://web.archive.org/web/20200916063346/https://clinicaltrials.gov/ct2/show/NCT04436276|url-status=live}}</ref><ref>{{Cite report|last1=Sadoff|last9=Van Damme|archive-url=https://web.archive.org/web/20201103080320/https://www.medrxiv.org/content/10.1101/2020.09.23.20199604v1|archive-date=2020-11-03|name-list-style=vanc|type=none|access- |
|'''[[ジョンソン・エンド・ジョンソンCOVID-19ワクチン]]''' <ref>{{Cite web2|title=A Study of Ad26.COV2.S in Adults|url=https://clinicaltrials.gov/ct2/show/NCT04436276|access-date=2020-08-23|publisher=ClinicalTrials.gov, US National Library of Medicine|date=2020-08-04|archive-date=16 September 2020|archive-url=https://web.archive.org/web/20200916063346/https://clinicaltrials.gov/ct2/show/NCT04436276|url-status=live}}</ref><ref>{{Cite report|last1=Sadoff|last9=Van Damme|archive-url=https://web.archive.org/web/20201103080320/https://www.medrxiv.org/content/10.1101/2020.09.23.20199604v1|archive-date=2020-11-03|name-list-style=vanc|type=none|access-date=2020-12-28|url=https://www.medrxiv.org/content/10.1101/2020.09.23.20199604v1|title=Safety and immunogenicity of the Ad26.COV2.S COVID-19 vaccine candidate: interim results of a phase 1/2a, double-blind, randomized, placebo-controlled trial|date=2020-09-25|first11=Pieter-Jan|last11=Berghmans|first10=Isabel|last10=Leroux-Roels|first9=Wim|first8=Sarah|first1=Jerry|last8=Tete|first7=Jeroen|last7=Stoop|first6=Anna Marit|last6=de Groot|first5=Carla|last5=Truyers|first4=Dirk|last4=Heerwegh|first3=Georgi|last3=Shukarev|first2=Mathieu|last2=Le Gars|url-status=live}}</ref><ref>{{Cite web2|title=A Study of Ad26.COV2.S for the Prevention of SARS-CoV-2-Mediated COVID-19 in Adult Participants|url=https://clinicaltrials.gov/ct2/show/NCT04505722|url-status=live|archive-url=https://web.archive.org/web/20200926145744/https://clinicaltrials.gov/ct2/show/NCT04505722|archive-date=26 September 2020|website=ClinicalTrials.gov|publisher=US National Library of Medicine|accessdate=2020-12-08}}</ref><br /><small>[[ヤンセン ファーマ]]、[[ジョンソン・エンド・ジョンソン]]、[[ベス・イスラエル・ディーコネス医療センター|BIDMC]]</small> |
||
|米国、オランダ |
|米国、オランダ |
||
|[[アデノウイルス]] [[ベクター]] ([[組み換えワクチン]]、Ad26) |
|[[アデノウイルス]] [[ベクター]] ([[組み換えワクチン]]、Ad26) |
||
| 550行目: | 647行目: | ||
|- |
|- |
||
| '''[[CoronaVac]]'''<ref name="NCT04383574">{{Cite web2|title=Safety and Immunogenicity Study of Inactivated Vaccine for Prevention of SARS-CoV-2 Infection (COVID-19) (Renqiu) |url=https://clinicaltrials.gov/ct2/show/NCT04383574 |website=[[ClinicalTrials.gov]] |publisher=[[United States National Library of Medicine]] |type=Registry |id=NCT04383574 |date=12 May 2020 |access-date=14 July 2020 |archive-date=11 October 2020 |archive-url=https://web.archive.org/web/20201011084809/https://clinicaltrials.gov/ct2/show/NCT04383574/ |url-status=live }}</ref><ref name="NCname= nct04456595=">{{Cite web2|url=https://clinicaltrials.gov/ct2/show/NCT04456595 |title=Clinical Trial of Efficacy and Safety of Sinovac's Adsorbed COVID-19 (Inactivated) Vaccine in Healthcare Professionals (PROFISCOV) |website=[[ClinicalTrials.gov]] |publisher=[[United States National Library of Medicine]] |type=Registry |id=NCT04456595 |date=2 July 2020 |access-date=3 August 2020 |archive-date=11 October 2020 |archive-url=https://web.archive.org/web/20201011084811/https://clinicaltrials.gov/ct2/show/NCT04456595/ |url-status=live }}</ref><ref>{{Cite journal2|last1=PT. Bio Farma |title=A Phase III, observer-blind, randomized, placebo-controlled study of the efficacy, safety, and immunogenicity of SARS-COV-2 inactivated vaccine in healthy adults aged 18–59 years in Indonesia |journal=Registri Penyakit Indonesia |date=10 August 2020 |url=https://www.ina-registry.org/index.php?act=registry_trial_detail&code_trial=16202009080721WXFM0YX |access-date=15 August 2020 }}</ref><br /><small>[[シノバック・バイオテック|シノバック]]</small> |
| '''[[CoronaVac]]'''<ref name="NCT04383574">{{Cite web2|title=Safety and Immunogenicity Study of Inactivated Vaccine for Prevention of SARS-CoV-2 Infection (COVID-19) (Renqiu) |url=https://clinicaltrials.gov/ct2/show/NCT04383574 |website=[[ClinicalTrials.gov]] |publisher=[[United States National Library of Medicine]] |type=Registry |id=NCT04383574 |date=12 May 2020 |access-date=14 July 2020 |archive-date=11 October 2020 |archive-url=https://web.archive.org/web/20201011084809/https://clinicaltrials.gov/ct2/show/NCT04383574/ |url-status=live }}</ref><ref name="NCname= nct04456595=">{{Cite web2|url=https://clinicaltrials.gov/ct2/show/NCT04456595 |title=Clinical Trial of Efficacy and Safety of Sinovac's Adsorbed COVID-19 (Inactivated) Vaccine in Healthcare Professionals (PROFISCOV) |website=[[ClinicalTrials.gov]] |publisher=[[United States National Library of Medicine]] |type=Registry |id=NCT04456595 |date=2 July 2020 |access-date=3 August 2020 |archive-date=11 October 2020 |archive-url=https://web.archive.org/web/20201011084811/https://clinicaltrials.gov/ct2/show/NCT04456595/ |url-status=live }}</ref><ref>{{Cite journal2|last1=PT. Bio Farma |title=A Phase III, observer-blind, randomized, placebo-controlled study of the efficacy, safety, and immunogenicity of SARS-COV-2 inactivated vaccine in healthy adults aged 18–59 years in Indonesia |journal=Registri Penyakit Indonesia |date=10 August 2020 |url=https://www.ina-registry.org/index.php?act=registry_trial_detail&code_trial=16202009080721WXFM0YX |access-date=15 August 2020 }}</ref><br /><small>[[シノバック・バイオテック|シノバック]]</small> |
||
|中国|| [[不活化ワクチン|不活化]] [[SARS-CoV-2]] ([[ベロ細胞]]) |
|中国|| [[不活化ワクチン|不活化]] [[SARS-CoV-2]] ([[ベロ細胞]]) |
||
|2回 |
|2回 |
||
2週 |
2週 |
||
| 568行目: | 665行目: | ||
|- |
|- |
||
| '''[[Ad5-nCoV]]''' <small>(コンビディシア)</small><br /><small>{{仮リンク|CanSinoBIO|en|CanSino Biologics}}, {{仮リンク|中国陸軍医科学院|en|Beijing Institute of Biotechnology of the Academy of Military Medical Sciences}}</small><ref name="NCT04540419">{{Cite web2|title=Clinical Trial of Recombinant Novel Coronavirus Vaccine (Adenovirus Type 5 Vector) Against COVID-19 |url=https://clinicaltrials.gov/ct2/show/NCT04540419 |website=[[ClinicalTrials.gov]] |publisher=[[United States National Library of Medicine]] |type=Registry |id=NCT04540419 |date=13 November 2020 |access-date=17 November 2020}}</ref>{{efn-la|name="Ad5-nCoV-manufacture"|Manufacturing partnership with the [[National Research Council (Canada)|National Research Council of Canada]] and Canadian Center for Vaccinology, [[Halifax, Nova Scotia|Halifax]], Nova Scotia<ref>{{Cite web2|title=The National Research Council of Canada and CanSino Biologics Inc. announce collaboration to advance vaccine against COVID-19|url=https://www.canada.ca/en/national-research-council/news/2020/05/the-national-research-council-of-canada-and-cansino-biologics-inc-announce-collaboration-to-advance-vaccine-against-covid-19.html|publisher=National Research Council, Government of Canada|date=2020-05-12|access-date=2020-05-22|archive-url=https://web.archive.org/web/20200522153344/https://www.canada.ca/en/national-research-council/news/2020/05/the-national-research-council-of-canada-and-cansino-biologics-inc-announce-collaboration-to-advance-vaccine-against-covid-19.html|archive-date=22 May 2020|url-status=live}}</ref>}} |
| '''[[Ad5-nCoV]]''' <small>(コンビディシア)</small><br /><small>{{仮リンク|CanSinoBIO|en|CanSino Biologics}}, {{仮リンク|中国陸軍医科学院|en|Beijing Institute of Biotechnology of the Academy of Military Medical Sciences}}</small><ref name="NCT04540419">{{Cite web2|title=Clinical Trial of Recombinant Novel Coronavirus Vaccine (Adenovirus Type 5 Vector) Against COVID-19 |url=https://clinicaltrials.gov/ct2/show/NCT04540419 |website=[[ClinicalTrials.gov]] |publisher=[[United States National Library of Medicine]] |type=Registry |id=NCT04540419 |date=13 November 2020 |access-date=17 November 2020}}</ref>{{efn-la|name="Ad5-nCoV-manufacture"|Manufacturing partnership with the [[National Research Council (Canada)|National Research Council of Canada]] and Canadian Center for Vaccinology, [[Halifax, Nova Scotia|Halifax]], Nova Scotia<ref>{{Cite web2|title=The National Research Council of Canada and CanSino Biologics Inc. announce collaboration to advance vaccine against COVID-19|url=https://www.canada.ca/en/national-research-council/news/2020/05/the-national-research-council-of-canada-and-cansino-biologics-inc-announce-collaboration-to-advance-vaccine-against-covid-19.html|publisher=National Research Council, Government of Canada|date=2020-05-12|access-date=2020-05-22|archive-url=https://web.archive.org/web/20200522153344/https://www.canada.ca/en/national-research-council/news/2020/05/the-national-research-council-of-canada-and-cansino-biologics-inc-announce-collaboration-to-advance-vaccine-against-covid-19.html|archive-date=22 May 2020|url-status=live}}</ref>}} |
||
|中国|| [[アデノウイルス]] [[ベクター]] ([[組み換えワクチン]]、Ad5) |
|中国|| [[アデノウイルス]] [[ベクター]] ([[組み換えワクチン]]、Ad5) |
||
|1回 |
|1回 |
||
|2-8℃ |
|2-8℃ |
||
| 606行目: | 703行目: | ||
|2 |
|2 |
||
|- |
|- |
||
| |
|'''[[CoviVac]]'''<ref>{{Cite web2|url=http://government.ru/en/news/41342/|title=Briefing with Deputy Prime Minister Tatyana Golikova, Health Minister Mikhail Murashko and Head of Rospotrebnadzor Anna Popova|publisher=Government of Russia|date=18 January 2021|access-date=20 February 2021}}</ref> |
||
<small>The Chumakov Centre at the [[:en:Russian Academy of Sciences|Russian Academy of Sciences]]</small> |
<small>The Chumakov Centre at the [[:en:Russian Academy of Sciences|Russian Academy of Sciences]]</small> |
||
|ロシア |
|ロシア |
||
| 647行目: | 744行目: | ||
|第III相 (5,120) |
|第III相 (5,120) |
||
|0 |
|0 |
||
| |
|3 |
||
|- |
|- |
||
|} |
|} |
||
| 683行目: | 780行目: | ||
|{{Euro|7.56}} |
|{{Euro|7.56}} |
||
|- |
|- |
||
|[[ファイザー]] / [[ |
|[[ファイザー]] / [[ビオンテック]] |
||
|[[ファイザー- |
|[[トジナメラン|ファイザー - ビオンテックCOVID-19ワクチン]] |
||
|{{Euro|12.00}} |
|{{Euro|12.00}} |
||
|- |
|- |
||
| 747行目: | 844行目: | ||
コールドチェーンはさらに、バイクや[[ドローン宅配便|ドローン]]などの地方コミュニティにおけるワクチンの輸送の方法、ブースター投与の必要性、希釈剤の使用、医療従事者、子供、高齢者などの脆弱な人々へのアクセスによっても課題となっている<ref name="gates2" /><ref name="unicef" /><ref name="durbha">{{Cite web2|first1=Madhav | last1=Durbha | name-list-style=vanc |title=The extra mile: preparing a supply chain for a COVID-19 vaccine |url=https://www.europeanpharmaceuticalreview.com/article/122358/the-extra-mile-preparing-a-supply-chain-for-a-covid-19-vaccine/ |publisher=European Pharmaceutical Review |access-date=13 September 2020 |date=29 June 2020 |archive-date=11 September 2020 |archive-url=https://web.archive.org/web/20200911074323/https://www.europeanpharmaceuticalreview.com/article/122358/the-extra-mile-preparing-a-supply-chain-for-a-covid-19-vaccine/ |url-status=live }}</ref>。 |
コールドチェーンはさらに、バイクや[[ドローン宅配便|ドローン]]などの地方コミュニティにおけるワクチンの輸送の方法、ブースター投与の必要性、希釈剤の使用、医療従事者、子供、高齢者などの脆弱な人々へのアクセスによっても課題となっている<ref name="gates2" /><ref name="unicef" /><ref name="durbha">{{Cite web2|first1=Madhav | last1=Durbha | name-list-style=vanc |title=The extra mile: preparing a supply chain for a COVID-19 vaccine |url=https://www.europeanpharmaceuticalreview.com/article/122358/the-extra-mile-preparing-a-supply-chain-for-a-covid-19-vaccine/ |publisher=European Pharmaceutical Review |access-date=13 September 2020 |date=29 June 2020 |archive-date=11 September 2020 |archive-url=https://web.archive.org/web/20200911074323/https://www.europeanpharmaceuticalreview.com/article/122358/the-extra-mile-preparing-a-supply-chain-for-a-covid-19-vaccine/ |url-status=live }}</ref>。 |
||
国によってはワクチンの長期保管に対応した[[超低温冷凍庫]]の数が限られていることや<ref>{{Cite web|url=https://www.mhlw.go.jp/content/000728180.pdf|title=ディープフリーザー(超低温冷凍庫)|accessdate=2021年7月22日|publisher=厚生労働省}}</ref>、接種が夏期となるため冷凍庫から接種会場までワクチンを小分けして運べる保冷機材も必要となり、費用の負担が大きい<ref>{{Cite web|title=“使われなくなる日を願って” 小さな黒い箱に込められた思い|url=https://www3.nhk.or.jp/news/html/20210720/k10013149581000.html|website=NHKニュース|accessdate=2021-07-22|last=日本放送協会}}</ref>。コールドチェーンの末端では医薬品の専門家以外も多く関わることから、機材の不適切な取り扱いにより低温が維持出来なくなり廃棄に至った事例もある<ref>{{Cite web|title=冷凍庫の電源コード、清掃員が接続部分を緩ませたか…ワクチン1000回分廃棄で県謝罪 : 社会 : ニュース|url=https://www.yomiuri.co.jp/national/20210706-OYT1T50092/|website=読売新聞オンライン|date=2021-07-06|accessdate=2021-07-23|language=ja}}</ref>。 |
国によってはワクチンの長期保管に対応した[[超低温冷凍庫]]の数が限られていることや<ref>{{Cite web|和書|url=https://www.mhlw.go.jp/content/000728180.pdf|title=ディープフリーザー(超低温冷凍庫)|accessdate=2021年7月22日|publisher=厚生労働省}}</ref>、接種が夏期となるため冷凍庫から接種会場までワクチンを小分けして運べる保冷機材も必要となり、費用の負担が大きい<ref>{{Cite web|和書|title=“使われなくなる日を願って” 小さな黒い箱に込められた思い|url=https://www3.nhk.or.jp/news/html/20210720/k10013149581000.html|website=NHKニュース|accessdate=2021-07-22|last=日本放送協会}}</ref>。コールドチェーンの末端では医薬品の専門家以外も多く関わることから、機材の不適切な取り扱いにより低温が維持出来なくなり廃棄に至った事例もある<ref>{{Cite web|和書|title=冷凍庫の電源コード、清掃員が接続部分を緩ませたか…ワクチン1000回分廃棄で県謝罪 : 社会 : ニュース|url=https://www.yomiuri.co.jp/national/20210706-OYT1T50092/|website=読売新聞オンライン|date=2021-07-06|accessdate=2021-07-23|language=ja}}</ref>。 |
||
=== 航空輸送・陸上輸送 === |
=== 航空輸送・陸上輸送 === |
||
| 773行目: | 870行目: | ||
=== ワクチン有効期限 === |
=== ワクチン有効期限 === |
||
事例としてファイザー製([[トジナメラン]]、ファイザー - |
事例としてファイザー製([[トジナメラン]]、ファイザー - ビオンテック、BNT162b2、コミナティ筋注)は超低温冷凍庫(マイナス90℃ - 60℃)での保管でも製造日から有効期限'''6か月'''<ref name=":23">{{Cite web|和書|url=https://www.mhlw.go.jp/content/000785623.pdf|title=ファイザー社ワクチンの特性について - 厚生労働省|accessdate=2021-10-18|publisher=厚生労働省|format=PDF}}</ref>(ただし、2021年9月10日発行の同ワクチンの添付文書第6版においては、マイナス90℃ - 60℃保管の場合の有効期限が6か月から'''9か月'''に延長されている<ref name=":31">{{Cite web|和書|url=https://www.mhlw.go.jp/content/10906000/000834748.pdf|title=ファイザー社ワクチンの特性について 総括 - 厚生労働省|accessdate=2021-10-18|publisher=厚生労働省|format=PDF}}</ref>)、一般低温冷凍庫で保管可能なモデルナ製([[mRNA-1273]]、スパイクバックス筋注)でも現場到着後2 - 3か月程度が限度であり<ref name=":24">{{Cite web|和書|title=【茨城新聞】新型コロナ 職域接種、進む一般開放 余剰ワクチン廃棄回避 茨城|url=https://ibarakinews.jp/news/newsdetail.php?f_jun=16332712842100|website=ibarakinews.jp|accessdate=2021-10-18}}</ref>、需要と供給を見据えた在庫・流通管理が重要となる。 |
||
2021年10月頃までに、一部の先進国では住民の2回目までの接種がある程度の割合まで一巡し、接種率の伸びが頭打ちになると共に、予め多めに確保していたワクチンに余剰が出る見通しがでてきた。欧米諸国では2021年末までに約2億回分が、日本でも2022年3月末までに約1億回分が有効期限切れに到達する見通しである。有効期限の迫った余剰ワクチンを不足する国へと国際的に融通しあう枠組みの構築が叫ばれている<ref>{{Cite web|title=先進国でワクチン余剰|url=https://www.nikkei.com/article/DGKKZO76408760X01C21A0MM8000/|website=日本経済新聞|date=2021-10-07|accessdate=2021-10-18|language=ja}}</ref>。 |
2021年10月頃までに、一部の先進国では住民の2回目までの接種がある程度の割合まで一巡し、接種率の伸びが頭打ちになると共に、予め多めに確保していたワクチンに余剰が出る見通しがでてきた。欧米諸国では2021年末までに約2億回分が、日本でも2022年3月末までに約1億回分が有効期限切れに到達する見通しである。有効期限の迫った余剰ワクチンを不足する国へと国際的に融通しあう枠組みの構築が叫ばれている<ref>{{Cite web|和書|title=先進国でワクチン余剰|url=https://www.nikkei.com/article/DGKKZO76408760X01C21A0MM8000/|website=日本経済新聞|date=2021-10-07|accessdate=2021-10-18|language=ja}}</ref>。 |
||
ファイザー製では有効期限が9か月に延長されているが製品ごとに有効期限日が打刻されており既存品の期限延長は原則として行わない。ただし、島根県[[松江市]]では、専門医による同市の予防接種委員会の見解として有効性や安全性に問題なしとし、延長された期限内であれば問題ないとして今後も接種する方針である<ref>{{Cite web|title=期限切れワクチンも「効果あり」…市が2回目接種へ、ファイザー社の有効期限変更で : 医療・健康 : ニュース|url=https://www.yomiuri.co.jp/medical/20210925-OYT1T50223/|website=読売新聞オンライン|date=2021-09-26|accessdate=2021-10-18|language=ja}}</ref>。 |
ファイザー製では有効期限が9か月に延長されているが製品ごとに有効期限日が打刻されており既存品の期限延長は原則として行わない。ただし、島根県[[松江市]]では、専門医による同市の予防接種委員会の見解として有効性や安全性に問題なしとし、延長された期限内であれば問題ないとして今後も接種する方針である<ref>{{Cite web|和書|title=期限切れワクチンも「効果あり」…市が2回目接種へ、ファイザー社の有効期限変更で : 医療・健康 : ニュース|url=https://www.yomiuri.co.jp/medical/20210925-OYT1T50223/|website=読売新聞オンライン|date=2021-09-26|accessdate=2021-10-18|language=ja}}</ref>。 |
||
== ワクチンの確保・接種状況 == |
== ワクチンの確保・接種状況 == |
||
| 786行目: | 883行目: | ||
100人あたりの接種回数 / 累計接種回数 |
100人あたりの接種回数 / 累計接種回数 |
||
*[[イスラエル]] |
* [[イスラエル]] 112.5 / 10,189,198 |
||
*[[セーシェル]] 104.6 / |
* [[セーシェル]] 104.6 / 102,080 |
||
*[[アラブ首長国連邦|UAE]] 89.1 / 8,707,073 |
* [[アラブ首長国連邦|UAE]] 89.1 / 8,707,073 |
||
*[[パラオ]] |
* [[パラオ]] 74.6 / 13,435 |
||
*[[ブータン]] 61.7 / 470,976 |
* [[ブータン]] 61.7 / 470,976 |
||
*[[チリ]] 60.1 / 11,396,072 |
* [[チリ]] 60.1 / 11,396,072 |
||
*[[イギリス|英国]] 56.1 / 37,736,162 |
* [[イギリス|英国]] 56.1 / 37,736,162 |
||
*[[バーレーン]] |
* [[バーレーン]] 53.6 / 879,825 |
||
2021年3月下旬時点で、日本の100人あたりのワクチン接種回数は0.4回であり、[[経済協力開発機構|OECD]]の37か国中で最下位であった<ref>{{Cite web2|title=<3>国はワクチン確保に全力を…新型コロナ【読売新聞社提言】 : 医療・健康|url=https://www.yomiuri.co.jp/medical/20210321-OYT1T50061/|website=読売新聞オンライン|date=2021-03-21|accessdate=2021-04-10|language=ja}}</ref><ref>{{Cite web2|title=菅首相 気候変動問題 “米と協力 中国に働きかけ” 参院決算委|url=https://www3.nhk.or.jp/news/html/20210405/k10012957911000.html|website=NHKニュース|accessdate=2021-04-10|last=日本放送協会}}</ref>。 |
2021年3月下旬時点で、日本の100人あたりのワクチン接種回数は0.4回であり、[[経済協力開発機構|OECD]]の37か国中で最下位であった<ref>{{Cite web2|title=<3>国はワクチン確保に全力を…新型コロナ【読売新聞社提言】 : 医療・健康|url=https://www.yomiuri.co.jp/medical/20210321-OYT1T50061/|website=読売新聞オンライン|date=2021-03-21|accessdate=2021-04-10|language=ja}}</ref><ref>{{Cite web2|title=菅首相 気候変動問題 “米と協力 中国に働きかけ” 参院決算委|url=https://web.archive.org/web/20210405113206/https://www3.nhk.or.jp/news/html/20210405/k10012957911000.html|website=NHKニュース|accessdate=2021-04-10|last=日本放送協会}}</ref>。 |
||
2021年9月5日時点での世界でのCOVID-19ワクチンの接種状況は以下の通り<ref name=":15" />。 |
2021年9月5日時点での世界でのCOVID-19ワクチンの接種状況は以下の通り<ref name=":15" />。 |
||
100人あたりの接種回数 / 累計接種回数 |
100人あたりの接種回数 / 累計接種回数 |
||
*[[イスラエル]] |
* [[イスラエル]] 155.2 / 14,050,538 |
||
*[[セーシェル]] 147.0 / |
* [[セーシェル]] 147.0 / 143,490 |
||
*[[アラブ首長国連邦|UAE]] 187.7 / 18,339,225 |
* [[アラブ首長国連邦|UAE]] 187.7 / 18,339,225 |
||
*[[パラオ]] |
* [[パラオ]] 162.0 / 29,165 |
||
*[[ブータン]] 137.0 / 1,045,074 |
* [[ブータン]] 137.0 / 1,045,074 |
||
*[[チリ]] 154.8 / 29,331,816 |
* [[チリ]] 154.8 / 29,331,816 |
||
*[[イギリス|英国]] 137.0 / 92,213,900 |
* [[イギリス|英国]] 137.0 / 92,213,900 |
||
*[[バーレーン]] |
* [[バーレーン]] 152.3 / 2,499,774 |
||
2021年9月5日時点で、日本の100人あたりのワクチン接種回数は107.5回であり、3月から半年足らずで累計1.3億回を超えて急速に進んだ<ref name=":15" />。 |
2021年9月5日時点で、日本の100人あたりのワクチン接種回数は107.5回であり、3月から半年足らずで累計1.3億回を超えて急速に進んだ<ref name=":15" />。 |
||
=== 日本 === |
=== 日本 === |
||
{{Main|日本におけるCOVID-19ワクチンの接種}} |
{{Main|日本におけるCOVID-19ワクチンの接種|日本における2019年コロナウイルス感染症の流行状況#ワクチン}} |
||
日本国内のワクチン接種率に関しては、2021年10月4日時点で、ワクチンの2回目接種済人数が全人口の60.9%、1回目完了では71.3%であった<ref name=":17">{{Cite web|title=ワクチン2回目接種終了 全人口の60%超に|url=https://www3.nhk.or.jp/news/html/20211004/k10013290451000.html|website=NHKニュース|accessdate=2021-10-17|last=日本放送協会}}</ref>。NHK報道によるイギリスの統計任意団体「{{仮リンク|Our World in Data|en|Our World in Data}}」の調べによれば、各国の保健当局が予定した接種回数(通常2回、国により3回)までの接種率(接種済人数の人口比統計)では、日本は同年10月17時点統計で66.47%と、イギリスの65.7%、ドイツの65.15%、米国の56.17%を抜いており世界的にも遜色のないレベルとなっている<ref>{{Cite web|title=世界のワクチン接種状況|NHK|url=https://www3.nhk.or.jp/news/special/coronavirus/vaccine/world_progress/|website=www3.nhk.or.jp|accessdate=2021-10-17|last=日本放送協会}}</ref>。 |
日本国内のワクチン接種率に関しては、2021年10月4日時点で、ワクチンの2回目接種済人数が全人口の60.9%、1回目完了では71.3%であった<ref name=":17">{{Cite web|和書|title=ワクチン2回目接種終了 全人口の60%超に|url=https://www3.nhk.or.jp/news/html/20211004/k10013290451000.html|website=NHKニュース|accessdate=2021-10-17|last=日本放送協会}}</ref>。NHK報道によるイギリスの統計任意団体「{{仮リンク|Our World in Data|en|Our World in Data}}」の調べによれば、各国の保健当局が予定した接種回数(通常2回、国により3回)までの接種率(接種済人数の人口比統計)では、日本は同年10月17時点統計で66.47%と、イギリスの65.7%、ドイツの65.15%、米国の56.17%を抜いており世界的にも遜色のないレベルとなっている<ref>{{Cite web|和書|title=世界のワクチン接種状況|NHK|url=https://www3.nhk.or.jp/news/special/coronavirus/vaccine/world_progress/|website=www3.nhk.or.jp|accessdate=2021-10-17|last=日本放送協会}}</ref>。 |
||
{{See also|日本における2019年コロナウイルス感染症の流行状況#ワクチン}} |
|||
=== イスラエル === |
=== イスラエル === |
||
2021年3月時点でも4月時点でも人口当たりのCOVID-19ワクチンの接種率が世界一となっているのは[[イスラエル]]である。[[ユダヤ人]][[ディアスポラ]]とのコネクションを通じてファイザー社の経営幹部から大量のワクチンの優先的な提供を受ける約束をリークすることにより、政治的不安定に直面する[[ベンヤミン・ネタニヤフ|ネタニヤフ]]首相の挽回戦略だとメディアが分析した<ref>{{Cite web|title=「ワクチン実績」に政治生命かけるネタニヤフ氏 イスラエル総選挙|url=https://mainichi.jp/articles/20210225/k00/00m/030/150000c|website=毎日新聞|accessdate=2021-06-16|language=ja|date=2021/2/25}}</ref><ref>{{Cite web|title=ワクチン戦略に賭けたネタニヤフ氏、2年で4回目のイスラエル総選挙|url=https://wedge.ismedia.jp/articles/-/22529|website=[[WEDGE]] Infinity|date=2021-03-23|accessdate=2021-06-16}}</ref>。2021年8月に3回目接種を、2022年1月3日に4回目接種を開始した<ref>「4回目ワクチン イスラエル開始」『読売新聞』朝刊2022年1月5日(国際面)</ref>。 |
2021年3月時点でも4月時点でも人口当たりのCOVID-19ワクチンの接種率が世界一となっているのは[[イスラエル]]である。[[ユダヤ人]][[ディアスポラ]]とのコネクションを通じてファイザー社の経営幹部から大量のワクチンの優先的な提供を受ける約束をリークすることにより、政治的不安定に直面する[[ベンヤミン・ネタニヤフ|ネタニヤフ]]首相の挽回戦略だとメディアが分析した<ref>{{Cite web|和書|title=「ワクチン実績」に政治生命かけるネタニヤフ氏 イスラエル総選挙|url=https://mainichi.jp/articles/20210225/k00/00m/030/150000c|website=毎日新聞|accessdate=2021-06-16|language=ja|date=2021/2/25}}</ref><ref>{{Cite web|和書|title=ワクチン戦略に賭けたネタニヤフ氏、2年で4回目のイスラエル総選挙|url=https://wedge.ismedia.jp/articles/-/22529|website=[[WEDGE]] Infinity|date=2021-03-23|accessdate=2021-06-16}}</ref>。2021年8月に3回目接種を、2022年1月3日に4回目接種を開始した<ref>「4回目ワクチン イスラエル開始」『読売新聞』朝刊2022年1月5日(国際面)</ref>。 |
||
イスラエルのコロナワクチン対策専門家チーム代表で、イスラエル国内最大の保健機構「クラリット」のチーフ・イノベーション・オフィサーでもあるラン・バリチェルが2021年3月24日に、[[日本記者クラブ]]主催のリモート講演会で語ったところによると<ref name="wedge22563">{{Cite web|title=なぜ、イスラエルのコロナワクチン接種率は高いのか?|url=https://wedge.ismedia.jp/articles/-/22563|website=WEDGE Infinity|date=2021-03-26|accessdate=2021-06-16}}</ref>、「昨年(2020年)の12月19日から高齢者優先で始まったワクチン接種は、16歳以上の全住民に対象が拡大され、イスラエル国民約920万人の60%が既に既に接種済みで、50%が2回接種済み。特に50歳以上は80%が2回目の接種を受けており、高齢者はワクチンで守られている<ref name="wedge22563" />」とのことであり、イスラエルが世界で最も早くワクチン調達できた理由は「昨年の12月より前にワクチンメーカーと事前購入契約を結んでいた。さらに感染が増えた場合にはファイザーや、ほかのメーカーと優先的に提供してもらう契約をしていた。」と説明<ref name="wedge22563" />。そして「その代わり、感染に関するデータは世界で共有するという条件が付いていた。つまりイスラエルがワクチン接種の『テストベッド』になることで大事なワクチンをより早く調達できた」と説明した<ref name="wedge22563" />。 |
イスラエルのコロナワクチン対策専門家チーム代表で、イスラエル国内最大の保健機構「クラリット」のチーフ・イノベーション・オフィサーでもあるラン・バリチェルが2021年3月24日に、[[日本記者クラブ]]主催のリモート講演会で語ったところによると<ref name="wedge22563">{{Cite web|和書|title=なぜ、イスラエルのコロナワクチン接種率は高いのか?|url=https://wedge.ismedia.jp/articles/-/22563|website=WEDGE Infinity|date=2021-03-26|accessdate=2021-06-16}}</ref>、「昨年(2020年)の12月19日から高齢者優先で始まったワクチン接種は、16歳以上の全住民に対象が拡大され、イスラエル国民約920万人の60%が既に既に接種済みで、50%が2回接種済み。特に50歳以上は80%が2回目の接種を受けており、高齢者はワクチンで守られている<ref name="wedge22563" />」とのことであり、イスラエルが世界で最も早くワクチン調達できた理由は「昨年の12月より前にワクチンメーカーと事前購入契約を結んでいた。さらに感染が増えた場合にはファイザーや、ほかのメーカーと優先的に提供してもらう契約をしていた。」と説明<ref name="wedge22563" />。そして「その代わり、感染に関するデータは世界で共有するという条件が付いていた。つまりイスラエルがワクチン接種の『テストベッド』になることで大事なワクチンをより早く調達できた」と説明した<ref name="wedge22563" />。 |
||
イスラエルでのワクチン接種のしかたについては、「イスラエルではワクチン接種するためにワクチンクリニックを各地にオープンした<ref name="wedge22563" />」と言い、数百というクリニックを1週間でイスラエル全土に展開した、という。大きな病院や広場にテントを張るなどしてクリニックを設営し、接種を受けた人の管理は、20年前にデジタル化した[[電子カルテ]]を使って行い、誰が接種を受けたか、2回目の接種の日時の案内も1回目を受けた時点で決まるようにした、と言い、イスラエルでは[[デジタル化]]が進展していることが効率的なワクチン接種に大いに役立ったと明かした<ref name="wedge22563" />。また「透明性の確保が重要だった。われわれが知っていることと、分からないことをクリアなメッセージとして隠さず国民に伝えた<ref name="wedge22563" />。」と語った。 |
イスラエルでのワクチン接種のしかたについては、「イスラエルではワクチン接種するためにワクチンクリニックを各地にオープンした<ref name="wedge22563" />」と言い、数百というクリニックを1週間でイスラエル全土に展開した、という。大きな病院や広場にテントを張るなどしてクリニックを設営し、接種を受けた人の管理は、20年前にデジタル化した[[電子カルテ]]を使って行い、誰が接種を受けたか、2回目の接種の日時の案内も1回目を受けた時点で決まるようにした、と言い、イスラエルでは[[デジタル化]]が進展していることが効率的なワクチン接種に大いに役立ったと明かした<ref name="wedge22563" />。また「透明性の確保が重要だった。われわれが知っていることと、分からないことをクリアなメッセージとして隠さず国民に伝えた<ref name="wedge22563" />。」と語った。 |
||
| 838行目: | 934行目: | ||
また、ワクチン・パスポートを得るために渡航する[[医療観光#ワクチンツーリズム|ワクチンツーリズム]]も始まっている<ref>{{Cite web2|title=‘Shot Trips’ To Dubai, Florida, Tel Aviv, Havana: Covid-19 Vaccine Tourism Takes Off|url=https://www.forbes.com/sites/alexledsom/2021/02/14/shot-trips-to-dubai-florida-tel-aviv-havana-covid-19-vaccine-tourism-takes-off/|date=2021-02-14|access-date=2021-04-03|website=[[フォーブス (雑誌)|Forbes]]}}</ref>。 |
また、ワクチン・パスポートを得るために渡航する[[医療観光#ワクチンツーリズム|ワクチンツーリズム]]も始まっている<ref>{{Cite web2|title=‘Shot Trips’ To Dubai, Florida, Tel Aviv, Havana: Covid-19 Vaccine Tourism Takes Off|url=https://www.forbes.com/sites/alexledsom/2021/02/14/shot-trips-to-dubai-florida-tel-aviv-havana-covid-19-vaccine-tourism-takes-off/|date=2021-02-14|access-date=2021-04-03|website=[[フォーブス (雑誌)|Forbes]]}}</ref>。 |
||
日本では、2021年7月26日から、海外渡航者を対象に、ワクチン接種の事実を'''公的に証明'''する証明書の交付申請の受け付けを各市区町村で開始する。ただし、日本への帰国時の[[検疫]]措置の緩和はない<ref name="shoumei">{{Cite web|title=海外渡航用の新型コロナワクチン接種証明書について|url=https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/vaccine_certificate.html|author=|website=厚生労働省|publisher=|date=|accessdate=2021-07-26|language=ja}}</ref>。 |
日本では、2021年7月26日から、海外渡航者を対象に、ワクチン接種の事実を'''公的に証明'''する証明書の交付申請の受け付けを各市区町村で開始する。ただし、日本への帰国時の[[検疫]]措置の緩和はない<ref name="shoumei">{{Cite web|和書|title=海外渡航用の新型コロナワクチン接種証明書について|url=https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/vaccine_certificate.html|author=|website=厚生労働省|publisher=|date=|accessdate=2021-07-26|language=ja}}</ref>。 |
||
== 子供への接種 == |
|||
== 安全性に関する諸問題 == |
|||
何歳から接種対象とするかの判断は国によって分かれるが、デメリット(副反応)よりもワクチンを接種するメリット(重症化予防、家族への感染拡大予防など)が大きく上回るという判断は各国で共通している<ref>{{Cite web |url=https://www.who.int/news/item/11-08-2022-interim-statement-on-covid-19-vaccination-for-children |title=Interim statement on COVID-19 vaccination for children |publisher =WHO |date=2022-08-11 |accessdate=2022-08-12}}</ref><ref name="jpeds_20220810" />。 |
|||
=== 子供への接種 === |
|||
子供の何歳から接種対象とするかの判断は国によって分かれている。2021年11月時点で、[[キューバ]]は2歳から接種対象とし、中華人民共和国は3歳以上は接種を義務付けることを通達。中国製の供給を受けている[[チリ]]、[[カンボジア]]、[[インドネシア]]は6歳以上の接種を認めている。[[アメリカ疾病対策センター]](CDC)は2021年11月2日、5 - 11歳への接種も推奨すると発表したが、接種を世界的に最も早く進めてきたイスラエルでも低年齢者への接種には国民から慎重論が根強い<ref>[https://mainichi.jp/articles/20211107/ddm/007/040/079000c 【新型コロナ】5〜11歳接種 保護者懸念/イスラエル 政府方針に「拙速」■中国は3歳から開始]『毎日新聞』朝刊2021年11月7日(国際面)同日閲覧</ref>。 |
|||
アメリカやカナダ、フランス、イスラエル、日本などでは全ての5 - 11歳の小児にワクチンの接種を推奨している<ref name="mhlw_5-11">{{Cite web|和書|url=https://www.cov19-vaccine.mhlw.go.jp/qa/0119.html |title=海外ではどのくらい小児(5~11歳)の接種が行われていますか。 |publisher =厚生労働省 |accessdate=2022-08-11}}</ref><ref name="jpeds_20220810">{{Cite web|和書|url=http://www.jpeds.or.jp/uploads/files/20220810_5-17.pdf |title=5~17 歳の小児への新型コロナワクチン接種に対する考え方 |format=PDF |publisher =日本小児科学会 |date=2022-08-10 |accessdate=2022-08-11}}</ref>。アメリカでは2022年5月に5 - 11歳への3回目のブースター接種が推奨され、6月には生後6カ月からの接種が推奨された<ref>{{Cite web |url=https://www.healthychildren.org/English/health-issues/conditions/COVID-19/Pages/covid-vaccines-for-kids-6-months-and-older-faqs-for-families.aspx |title=COVID Vaccines for Kids 6 Months & Older: FAQs for Families |publisher =米国小児科学会 |date=2022-06-18 |accessdate=2022-08-12}}</ref><ref>{{Cite web |url=https://doh.wa.gov/newsroom/children-ages-5-11-now-eligible-pfizer-biontech-covid-19-booster-dose |title=Children ages 5-11 now eligible for Pfizer-BioNTech COVID-19 booster dose |publisher =Washington State Department of Health |date=2022-05-20 |accessdate=2022-08-12}}</ref>。カナダや香港でも2022年8月から生後6カ月からの接種が始まった<ref>{{Cite web |url=https://www.canada.ca/en/health-canada/news/2022/07/health-canada-authorizes-use-of-moderna-covid-19-vaccine-in-children-6-months-to-5-years-of-age.html |title=Health Canada authorizes use of Moderna COVID-19 vaccine in children 6 months to 5 years of age |publisher =カナダ政府 |date=2022-07-14 |accessdate=2022-08-11}}</ref><ref>{{Cite web |url=https://std.stheadline.com/realtime/article/1860536/即時-港聞-6個月以上幼童本周四起可預約打科興-50至59歲人士同日可約打第4針 |title=6個月以上幼童本周四起可預約打科興 50至59歲人士同日可約打第4針 |publisher =星島日報 |date=2022-08-02 |accessdate=2022-08-11}}</ref>。 |
|||
=== 賠償責任 === |
|||
物理的に長期の安全性は確認できないため、製造業者には将来的なリスクがあった。これに対し、2020年2月4日、[[アレックス・アザー]]米保健福祉長官は、COVID-19に対する医療対策のための「公共の準備と緊急事態への備えに関する法律([[:en:Public Readiness and Emergency Preparedness Act|Public Readiness and Emergency Preparedness Act]])」に基づく通知を公表した。対象を「COVID-19、またはSARS-CoV-2またはその変異ウイルスの感染を治療、診断、治癒、予防または軽減するために使用される任意のワクチン」とし、宣言は「ワクチンの作成における製造業者の過失、または誤った投与量を処方した医療提供者の過失を主張する賠償請求は、故意の不法行為がない限り、除外される」としている<ref>{{Cite web2|url=https://www.phe.gov/Preparedness/legal/prepact/Pages/COVID19.aspx|title=Notice of Declaration under the Public Readiness and Emergency Preparedness Act for medical countermeasures against COVID-19|first=Alex|last=Azar|date=4 February 2020|name-list-style=vanc|access-date=22 April 2020|archive-url=https://web.archive.org/web/20200425015411/https://www.phe.gov/Preparedness/legal/prepact/Pages/COVID19.aspx|archive-date=25 April 2020|url-status=live}}</ref>。この宣言は米国では2024年10月1日まで有効である。 |
|||
2022年8月11日時点でオーストラリアの5 - 15歳の2回接種率は約55%<ref>{{Cite web |url=https://www.health.gov.au/initiatives-and-programs/covid-19-vaccines/numbers-statistics |title=Vaccination numbers and statistics |publisher =Australia Government Department of Health and Aged Care |accessdate=2022-08-12}}</ref>、アメリカの5 - 11歳の2回接種率は30.1%<ref>{{Cite web |url=https://covid.cdc.gov/covid-data-tracker/#vaccinations_vacc-people-additional-dose-pop5 |title=COVID-19 Vaccinations in the United States |publisher =CDC |accessdate=2022-08-12}}</ref>、カナダの5 - 11歳の2回接種率は42.44%<ref>{{Cite web |url=https://health-infobase.canada.ca/covid-19/vaccination-coverage/ |title=COVID-19 vaccination in Canada |publisher =カナダ政府 |accessdate=2022-08-12}}</ref>、日本の5 - 11歳の2回接種率は18.5%となっている<ref>{{Cite web|和書|url=https://www.kantei.go.jp/jp/headline/kansensho/vaccine.html |title=新型コロナワクチンについて |publisher =首相官邸 |accessdate=2022-08-12}}</ref>。 |
|||
日本においては、他のワクチンと同様に副反応による健康被害が起きた場合、[[予防接種法]]に基づく[[予防接種#予防接種健康被害救済制度|国の救済制度]]の対象とされた<ref>{{Cite web2|url=https://www.cov19-vaccine.mhlw.go.jp/qa/0003.html|title=副反応による健康被害が起きた場合の補償はどうなっていますか。 |date= |access-date=2021-04-29|website=新型コロナワクチンについてのQ&A |publisher=厚生労働省 |archive-url= |archive-date= |url-status= }}</ref>。 |
|||
{{See also|日本におけるCOVID-19ワクチンの接種#5_-_11歳への接種}} |
|||
EU諸国における2022年8月11日時点の5 - 9歳の2回接種率は、スペイン31.3%、ポルトガル31.0%、デンマーク28.8%、アイスランド28.1%、オーストリア22.0%、アイルランド20.6%である<ref>{{Cite web |url=https://vaccinetracker.ecdc.europa.eu/public/extensions/covid-19/vaccine-tracker.html#age-group-tab |title= European Centre for Disease Prevention and Control COVID-19 Vaccine Tracker |publisher =vaccinetracker.ecdc.europa.eu |accessdate=2022-08-12}}</ref>。ドイツは、健康な5 - 11歳の子どものほとんどが1度はCOVID-19に感染したことがあるため、1回の接種で十分に免疫を獲得できるとし、すべての子どもに1回の接種を推奨している<ref name="infektionsschutz" /><ref name="ZAWYA" />。また、基礎疾患を持つ子どもは3回目のブースター接種を、リスクのある人と同居・接触する子どもには2回の接種を推奨する<ref name="infektionsschutz">{{Cite web |url=https://www.infektionsschutz.de/coronavirus/schutzimpfung/impfung-bei-kindern-und-jugendlichen/ |title=Corona-Schutzimpfung bei Kindern und Jugendlichen |publisher =Bundeszentrale für gesundheitliche Aufklärung (BZgA) |date=2022-07-08 |accessdate=2022-08-12}}</ref><ref name="ZAWYA">{{Cite web |url=https://www.zawya.com/en/special-coverage/covid-19-updates/germanys-vaccine-panel-says-one-covid-shot-enough-for-children-bgfayewa |title=Germany's vaccine panel says one COVID shot enough for children |publisher =ZAWYA |date=2022-05-24 |accessdate=2022-08-12}}</ref>。ドイツの5 - 11歳の接種率は2022年5月24日時点で22%である<ref>{{Cite web |url=https://english.news.cn/20220525/3bc5f4d984b541c983f9c586d4c14a25/c.html |title=Germany's COVID-19 vaccine panel recommends single dose for kids aged 5 to 11 |publisher =XINHUANET |date=2022-05-25 |accessdate=2022-08-12}}</ref>。 |
|||
== 賠償責任 == |
|||
いくつかの政府は、以前のパンデミックのように、COVID-19ワクチンおよび治療薬に関する過失請求からファイザーやモデルナなどの製薬会社を保護することに合意し、政府もその責任を負った。 |
|||
2020年2月4日、アメリカでは[[アレックス・アザー]]米保健福祉長官がCOVID-19に対する医療対策として「[[:en:Public Readiness and Emergency Preparedness Act|公共の準備と緊急事態への備えに関する法律]]」に基づく通知を公表した<ref name="Liability-phe" />。宣言は「COVID-19、またはSARS-CoV-2やその変異ウイルスの感染の治療、診断、治癒、予防、緩和に用いられるあらゆるワクチン」を対象に、「故意の不法行為がなければ、ワクチン製造における製造者の過失、または誤った用量を処方した医療従事者の過失を主張する賠償請求は、除外される」としている<ref name="Liability-phe">{{Cite web2|url=https://www.phe.gov/Preparedness/legal/prepact/Pages/COVID19.aspx|title=Notice of Declaration under the Public Readiness and Emergency Preparedness Act for medical countermeasures against COVID-19|first=Alex|last=Azar|date=4 February 2020|name-list-style=vanc|access-date=22 April 2020|archive-url=https://web.archive.org/web/20200425015411/https://www.phe.gov/Preparedness/legal/prepact/Pages/COVID19.aspx|archive-date=25 April 2020|url-status=live}}</ref>。この宣言は米国では2024年10月1日まで有効である<ref name="Liability-phe" />。 |
|||
2020年12月、英国政府はファイザーにCOVID-19ワクチンに関する法的補償を与えた<ref>{{cite web|vauthors=Lintern S|date=2 December 2020|title=Pfizer given protection from legal action over coronavirus vaccine by UK government|url=https://www.independent.co.uk/news/health/coronavirus-pfizer-vaccine-legal-indemnity-safety-ministers-b1765124.html|access-date=8 May 2021|website=The Independent|archive-date=5 May 2021|archive-url=https://web.archive.org/web/20210505000529/https://www.independent.co.uk/news/health/coronavirus-pfizer-vaccine-legal-indemnity-safety-ministers-b1765124.html|url-status=live}}</ref>。欧州連合では、COVID-19ワクチンは、民事および行政責任の請求から製造者を免除しない条件付き販売認可の下で認可されている<ref>{{cite web|date=11 December 2020|title=Questions and Answers: Conditional Marketing Authorisation of COVID-19 Vaccines in the EU|url=https://ec.europa.eu/commission/presscorner/detail/en/qanda_20_2390|access-date=29 December 2020|publisher=[[European Commission]]|at=Question: What is the difference in liability between EU Conditional Marketing Authorisation vs Emergency Use Authorisations?|archive-date=4 October 2021|archive-url=https://web.archive.org/web/20211004172148/https://ec.europa.eu/commission/presscorner/detail/en/qanda_20_2390|url-status=live}}</ref>。ワクチン製薬会社との購買契約は秘密のままであるが、認可の時点で知られていなかった副作用に対しても、責任免除の内容は含まれていない<ref>{{cite web|vauthors=Haahr T|date=7 September 2020|title=COVID-19: MEPs want safe vaccines, full transparency and liability for companies|url=https://www.europarl.europa.eu/news/en/press-room/20200904IPR86419/covid-19-meps-want-safe-vaccines-full-transparency-and-liability-for-companies|access-date=29 December 2020|website=European Parliament|at=Ms. Gallina stressed negotiations with companies had been difficult but underlined that those companies developing and manufacturing COVID-19 vaccines would indeed be liable according to current laws and if something goes wrong they could be taken to court. This also goes for compensation for hidden defects.|archive-date=13 October 2021|archive-url=https://web.archive.org/web/20211013122000/https://www.europarl.europa.eu/news/en/press-room/20200904IPR86419/covid-19-meps-want-safe-vaccines-full-transparency-and-liability-for-companies|url-status=live}}</ref>。 |
|||
日本においては、他のワクチンと同様に副反応による健康被害が起きた場合、[[予防接種法]]に基づく[[予防接種#予防接種健康被害救済制度|国の救済制度]]の対象とされる<ref>{{Cite web2|url=https://www.cov19-vaccine.mhlw.go.jp/qa/0003.html|title=副反応による健康被害が起きた場合の補償はどうなっていますか。 |date= |access-date=2021-04-29|website=新型コロナワクチンについてのQ&A |publisher=厚生労働省 |archive-url= |archive-date= |url-status= }}</ref>。 |
|||
{{See also|日本におけるCOVID-19ワクチンの接種#概要|日本におけるCOVID-19ワクチンの接種#副反応}} |
|||
2024年4月17日、日本では、新型コロナワクチン接種後の健康被害について国民に広報せず、国が接種を推し進めたとして、ワクチンの接種後に亡くなった人の遺族や健康被害を訴える患者らが、総額約9150万円の賠償を国に求める集団訴訟を東京地裁に起こした<ref>{{Cite web |title=新型コロナワクチンで国を集団提訴 総額9152万円の損害賠償求める 接種後死亡も危険性「広報せず」|FNNプライムオンライン |url=https://www.fnn.jp/articles/-/687250 |website=FNNプライムオンライン |date=2024-04-18 |access-date=2024-04-18}}</ref><ref>{{Cite web |title=新型コロナのワクチン被害は“薬害” 体調不良に悩む患者と遺族が国を提訴 厚労省“重大な懸念は認められない” {{!}} 東海地方のニュース【CBC news】 {{!}} CBC web (1ページ) |url=https://newsdig.tbs.co.jp/articles/cbc/1120356 |website=CBCニュース |date=2024-04-17 |access-date=2024-04-18 |language=ja}}</ref><ref>{{Cite web |title=サンテレビニュース |url=http://sun-tv.co.jp/suntvnews/ |website=サンテレビニュース |date=2024-04-17 |access-date=2024-04-18}}</ref><ref>{{Cite web |title=コロナワクチン接種後死亡 遺族ら「国の広報不十分」と集団提訴 |url=https://mainichi.jp/articles/20240417/k00/00m/040/067000c |website=毎日新聞 |access-date=2024-04-18 |language=ja}}</ref>。 |
|||
{{main|日本におけるCOVID-19ワクチンの接種#裁判}} |
|||
== 誤った情報 == |
== 誤った情報 == |
||
{{See also|2019年コロナウイルス感染症流行に関連する誤情報}} |
{{See also|2019年コロナウイルス感染症流行に関連する誤情報|ワクチン忌避#COVID-19ワクチン}} |
||
[[ソーシャル・ネットワーキング・サービス|SNS]]では、COVID-19ワクチンが利用できなかった時期に「既に利用可能である」という[[陰謀論]]も見られた。様々なSNSの投稿で引用された[[特許]]には、[[SARSコロナウイルス]]などの他の株の遺伝子配列やワクチンに関する既存の特許が参照されているが、COVID-19については参照されていない<ref>{{Cite web2|url=https://www.politifact.com/factchecks/2020/jan/23/facebook-posts/there-outbreak-china-wuhan-coronavirus-there-not-v/|title=No, there is no vaccine for the Wuhan coronavirus|last=Kertscher|first=Tom| name-list-style = vanc |date=23 January 2020|website=[[PolitiFact]]|publisher=[[Poynter Institute]]|url-status=live|archive-url=https://web.archive.org/web/20200207133056/https://www.politifact.com/factchecks/2020/jan/23/facebook-posts/there-outbreak-china-wuhan-coronavirus-there-not-v/|archive-date=7 February 2020|access-date=7 February 2020}}</ref><ref name="20200124factcheckA">{{Cite web2|url=https://www.factcheck.org/2020/01/social-media-posts-spread-bogus-coronavirus-conspiracy-theory/|title=Social Media Posts Spread Bogus Coronavirus Conspiracy Theory|last=McDonald|first=Jessica| name-list-style = vanc |date=24 January 2020|website=[[FactCheck.org]]|publisher=[[Annenberg Public Policy Center]]|url-status=live|archive-url=https://web.archive.org/web/20200206102802/https://www.factcheck.org/2020/01/social-media-posts-spread-bogus-coronavirus-conspiracy-theory/|archive-date=6 February 2020|access-date=8 February 2020}}</ref>。 |
[[ソーシャル・ネットワーキング・サービス|SNS]]では、COVID-19ワクチンが利用できなかった時期に「既に利用可能である」という[[陰謀論]]も見られた。様々なSNSの投稿で引用された[[特許]]には、[[SARSコロナウイルス]]などの他の株の遺伝子配列やワクチンに関する既存の特許が参照されているが、COVID-19については参照されていない<ref>{{Cite web2|url=https://www.politifact.com/factchecks/2020/jan/23/facebook-posts/there-outbreak-china-wuhan-coronavirus-there-not-v/|title=No, there is no vaccine for the Wuhan coronavirus|last=Kertscher|first=Tom| name-list-style = vanc |date=23 January 2020|website=[[PolitiFact]]|publisher=[[Poynter Institute]]|url-status=live|archive-url=https://web.archive.org/web/20200207133056/https://www.politifact.com/factchecks/2020/jan/23/facebook-posts/there-outbreak-china-wuhan-coronavirus-there-not-v/|archive-date=7 February 2020|access-date=7 February 2020}}</ref><ref name="20200124factcheckA">{{Cite web2|url=https://www.factcheck.org/2020/01/social-media-posts-spread-bogus-coronavirus-conspiracy-theory/|title=Social Media Posts Spread Bogus Coronavirus Conspiracy Theory|last=McDonald|first=Jessica| name-list-style = vanc |date=24 January 2020|website=[[FactCheck.org]]|publisher=[[Annenberg Public Policy Center]]|url-status=live|archive-url=https://web.archive.org/web/20200206102802/https://www.factcheck.org/2020/01/social-media-posts-spread-bogus-coronavirus-conspiracy-theory/|archive-date=6 February 2020|access-date=8 February 2020}}</ref>。 |
||
| 859行目: | 969行目: | ||
他のワクチンに関するデマとしては、次のようなものが挙げられる。 |
他のワクチンに関するデマとしては、次のようなものが挙げられる。 |
||
*[[不妊]]になる<ref name="毎日20220105">[https://mainichi.jp/articles/20220105/ddm/001/040/101000c 【オシント新時代 荒れる情報の海】(5)「ワクチンで不妊」拡散/医療デマ SNS攻防/発信者は少数 影響多大]『毎日新聞』朝刊2022年1月5日1面(2022年1月8日閲覧)</ref><ref name="210702NHK">{{Cite web|title=ワクチン打つと不妊?流産?専門家「誤情報に惑わされないで」|url=https://www3.nhk.or.jp/news/html/20210702/k10013116231000.html|website=NHK|date=2021年7月2日|accessdate=2021-07-12|language=ja}}</ref>{{efn2|COVID-19ワクチンが不妊を引き起こすという主張を根拠なく行っている人物としては[[マイケル・イードン]]らが挙げられる<ref>{{Cite web|date=2021-08-11|last=シュレア|first=レイチェル|title=新型ウイルスワクチン、妊娠にまつわる偽情報をファクトチェック|website=[[BBCニュース|BBC NEWS]]|publisher=[[英国放送協会]]|url=https://www.bbc.com/japanese/features-and-analysis-58168338|accessdate=2021-09-09}}</ref>。}}。 |
* [[不妊]]になる<ref name="毎日20220105">[https://mainichi.jp/articles/20220105/ddm/001/040/101000c 【オシント新時代 荒れる情報の海】(5)「ワクチンで不妊」拡散/医療デマ SNS攻防/発信者は少数 影響多大]『毎日新聞』朝刊2022年1月5日1面(2022年1月8日閲覧)</ref><ref name="210702NHK">{{Cite web|和書|title=ワクチン打つと不妊?流産?専門家「誤情報に惑わされないで」|url=https://www3.nhk.or.jp/news/html/20210702/k10013116231000.html|website=NHK|date=2021年7月2日|accessdate=2021-07-12|language=ja}}</ref>{{efn2|COVID-19ワクチンが不妊を引き起こすという主張を根拠なく行っている人物としては[[マイケル・イードン]]らが挙げられる<ref>{{Cite web|和書|date=2021-08-11|last=シュレア|first=レイチェル|title=新型ウイルスワクチン、妊娠にまつわる偽情報をファクトチェック|website=[[BBCニュース|BBC NEWS]]|publisher=[[英国放送協会]]|url=https://www.bbc.com/japanese/features-and-analysis-58168338|accessdate=2021-09-09}}</ref>。}}。 |
||
* コロナワクチンには[[RFIDタグ]]や[[マイクロチップ (動物用)|マイクロチップ]]が混入されており<ref name="210619gendai1">{{Cite web|title=トンデモな「ワクチン陰謀論」に心酔する人が、ジワジワと増えている背景|url=https://www3.nhk.or.jp/news/html/20210702/k10013116231000.html|author=真鍋厚|website=マネー現代|publisher=講談社|date=2021年6月19日|accessdate=2021-07-16|language=ja}}</ref>、政府がタグやチップを埋め込んで人間を管理する<ref name="210719yomiuri02" />。 |
* コロナワクチンには[[RFIDタグ]]や[[マイクロチップ (動物用)|マイクロチップ]]が混入されており<ref name="210619gendai1">{{Cite web|和書|title=トンデモな「ワクチン陰謀論」に心酔する人が、ジワジワと増えている背景|url=https://www3.nhk.or.jp/news/html/20210702/k10013116231000.html|author=真鍋厚|website=マネー現代|publisher=講談社|date=2021年6月19日|accessdate=2021-07-16|language=ja}}</ref>、政府がタグやチップを埋め込んで人間を管理する<ref name="210719yomiuri02" />。 |
||
* コロナワクチンを接種すると[[Bluetooth]]を通じて周辺機器に[[インターネット]]接続される<ref name="210619gendai1" />。 |
* コロナワクチンを接種すると[[Bluetooth]]を通じて周辺機器に[[インターネット]]接続される<ref name="210619gendai1" />。 |
||
* [[第5世代移動通信システム|5G通信]]に接続される<ref name="210701zakzak1">{{Cite web|title=【ギモン解消!!ワクチン接種Q&A】「コロナワクチン陰謀論」に信憑性はあるのか「身体が磁石になる」「マイクロチップが含まれる」「不妊にする」など|url=https://www.zakzak.co.jp/ |
* [[第5世代移動通信システム|5G通信]]に接続される<ref name="210701zakzak1">{{Cite web|和書|title=【ギモン解消!!ワクチン接種Q&A】「コロナワクチン陰謀論」に信憑性はあるのか「身体が磁石になる」「マイクロチップが含まれる」「不妊にする」など|url=https://www.zakzak.co.jp/article/20210701-EIQOHBYYGFKY5KA5IAZ3W2NJ64/|author=|website=zakzak([[夕刊フジ]])|publisher=|date=2021年7月1日|accessdate=2021-07-16|language=ja}}</ref>。 |
||
* 身体が[[磁石]]になる<ref name="210701zakzak1" />。 |
* 身体が[[磁石]]になる<ref name="210701zakzak1" />。 |
||
* [[ヒト免疫不全ウイルス]](HIV)に感染する<ref name="210719yomiuri02">{{Cite web|title=「ワクチン効果ない」「不妊になる」SNSでデマ拡散、信じて接種しない若者たち (2ページ目)|url=https://www.yomiuri.co.jp/national/20210718-OYT1T50103/2/|author=|website=読売新聞オンライン|publisher=読売新聞社|date=2021年7月19日|accessdate=2021-07-19|language=ja}}</ref> |
* [[ヒト免疫不全ウイルス]](HIV)に感染する<ref name="210719yomiuri02">{{Cite web|和書|title=「ワクチン効果ない」「不妊になる」SNSでデマ拡散、信じて接種しない若者たち (2ページ目)|url=https://www.yomiuri.co.jp/national/20210718-OYT1T50103/2/|author=|website=読売新聞オンライン|publisher=読売新聞社|date=2021年7月19日|accessdate=2021-07-19|language=ja}}</ref> |
||
* [[自閉症]]を引き起こす<ref name="210719yomiuri02" />。 |
* [[自閉症]]を引き起こす<ref name="210719yomiuri02" />。 |
||
* mRNAワクチンを接種したらヒト[[デオキシリボ核酸|DNA]]が改変される<ref name="210619gendai1" />。 |
* mRNAワクチンを接種したらヒト[[デオキシリボ核酸|DNA]]が改変される<ref name="210619gendai1" />。 |
||
* 政府が[[遺伝子工学|遺伝子操作]]しようとしている<ref name="210719yomiuri02" />。 |
* 政府が[[遺伝子工学|遺伝子操作]]しようとしている<ref name="210719yomiuri02" />。 |
||
2021年7月19日の[[読売新聞]]オンラインの報道<ref name="210719yomiuri01">{{Cite web|title=「ワクチン効果ない」「不妊になる」SNSでデマ拡散、信じて接種しない若者たち (1ページ目)|url=https://www.yomiuri.co.jp/national/20210718-OYT1T50103/|author=|website=読売新聞オンライン|publisher=読売新聞社|date=2021年7月19日|accessdate=2021-07-19|language=ja}}</ref> では、「英NPO『[[w:Center for Countering Digital Hate|反デジタルヘイトセンター(CCDH)]]』の調査によると、SNS上のワクチンに関するデマの65%は、12の個人・団体が発信源」とし、発信源には元[[アメリカ合衆国司法長官]][[ロバート・ケネディ|ロバート・F・ケネディ]]の息子のロバート・F・ケネディ・ジュニアも含まれるとしている。対策として、[[Facebook]]や[[Twitter]]で、保健機関が否定した情報の削除、リツイートや「[[いいね!ボタン|いいね]]」機能の停止などの措置が行われている<ref name="210719yomiuri02" />。 |
2021年7月19日の[[読売新聞]]オンラインの報道<ref name="210719yomiuri01">{{Cite web|和書|title=「ワクチン効果ない」「不妊になる」SNSでデマ拡散、信じて接種しない若者たち (1ページ目)|url=https://www.yomiuri.co.jp/national/20210718-OYT1T50103/|author=|website=読売新聞オンライン|publisher=読売新聞社|date=2021年7月19日|accessdate=2021-07-19|language=ja}}</ref> では、「英NPO『[[w:Center for Countering Digital Hate|反デジタルヘイトセンター(CCDH)]]』の調査によると、SNS上のワクチンに関するデマの65%は、12の個人・団体が発信源」とし、発信源には元[[アメリカ合衆国司法長官]][[ロバート・ケネディ|ロバート・F・ケネディ]]の息子のロバート・F・ケネディ・ジュニアも含まれるとしている。対策として、[[Facebook]]や[[Twitter]]で、保健機関が否定した情報の削除、リツイートや「[[いいね!ボタン|いいね]]」機能の停止などの措置が行われている<ref name="210719yomiuri02" />。 |
||
===ターボ癌=== |
|||
{{main|ターボ癌}} |
|||
ターボ癌({{Lang-en-short|''Turbo cancer''}})とは、「新型コロナウイルスワクチンをはじめ、mRNAワクチンを接種することによって人間の免疫機能が破壊され癌が発生する。または進行を加速([[ターボチャージャー]])させる」という反ワクチン神話である。「mRNAワクチン誘発性急速転移癌」と呼称する者もいるが、いつ誰が命名したのかは不明である。正式な医療用語ではなく、[[都市伝説]]の類に属する。ファクトチェックチームが検証を依頼した医師たちはこの主張を否定し、「何の根拠もない情報。癌患者がコロナウイルス流行前に比べて増加したり、進行したがん患者が増えているのは、コロナウイルスの流行により癌検診が行えず発見が遅れたり、治療開始が遅くなったりしたことによるものによる可能性が高い」としている。ターボ癌の存在を主張する者は、具体的な情報源を明らかにしない、適切な根拠を明示しない、統計情報の有意な変化というかたちで主張の裏付けがないなどの理由で信用されていない。<br /> |
|||
「新型コロナウイルスには、例え軽症であっても心臓病など様々な病気のリスクを高める後遺症がある」という研究結果があるが<ref>{{cite news |title= Long-term cardiovascular outcomes of COVID-19 |author=Yan Xie, Evan Xu, Benjamin Bowe & Ziyad Al-Aly |agency=|publisher=nature medicine|date=2022-2-10|url=https://www.nature.com/articles/s41591-022-01689-3|accessdate=2023-11-19}}</ref>、肯定する者たちは問題の原因が感染の後遺症によるものなのか、ワクチンによるものなのかの検証をしないまま、ワクチンが原因であるとしている。<br>そして、著名人が癌で亡くなる度に、ターボ癌を肯定する医師や学者の主張を根拠に「新型コロナウイルスワクチンを接種したことによって、ターボ癌で死亡した」とSNSや動画サイトなどで主張する者達がいる。「ターボ癌はの存在を裏付ける科学的根拠・論文・統計情報は存在しない」と否定しても、ターボ癌の存在を主張する者達は「ワクチンは毒であり、その[[薬害]]を隠すための情報操作である」などの[[陰謀論]]を主張している。こうした主張をする者は世界中におり、日本国内にも多数存在している<ref>{{cite news |title= X JAPANのHEATHさん死去で科学的根拠なき「ターボ癌」トレンド入り 反ワクチン陰謀論が再燃か |author= |agency=日刊ゲンダイDIGITAL|publisher=日刊ゲンダイ|date=2023-11-8|url=https://www.nikkan-gendai.com/articles/view/geino/331759|accessdate=2023-11-10}}</ref>。 |
|||
=== 日本での誤情報 === |
=== 日本での誤情報 === |
||
日本では医療従事者へのワクチン先行接種が始まったのとほぼ同時期の2021年2月頃から「ワクチン接種で不妊になる」旨のTwitter投稿が拡散し始めた。その半数は7つのアカウントが起点になっており([[東京大学]]教授[[鳥海不二夫]]の分析による)、他の主張も反グローバリズムや陰謀論の傾向がみられた<ref name="毎日20220105"/>。 |
日本では医療従事者へのワクチン先行接種が始まったのとほぼ同時期の2021年2月頃から「ワクチン接種で不妊になる」旨のTwitter投稿が拡散し始めた。その半数は7つのアカウントが起点になっており([[東京大学]]教授[[鳥海不二夫]]の分析による)、他の主張も[[反グローバリズム]]や陰謀論の傾向がみられた<ref name="毎日20220105"/>。 |
||
[[武田邦彦]]は[[YouTube]]の番組で、イギリスのワクチン接種の結果から「日本の高校生320万人全員にワクチンをうったら、確率的には50人が死亡するか、それに相当する副作用に見舞われる」と発言した。しかし、イギリスにおいて、ファイザー社・アストラゼネカ社のワクチンを接種したこととの因果関係が認められる死亡例や、それに相当する副反応は報告されておらず、武田の発言は誤りである<ref>{{Cite web|和書|title=「日本の高校生にワクチン、50人が死亡か半身不随などの副作用に」は誤り。大学教授の発言、YouTubeで30万回再生|url=https://www.buzzfeed.com/jp/kotahatachi/vakzin-fc-1|website=BuzzFeed|accessdate=2021-04-04|language=ja|first=Kota|last=Hatachi}}</ref>。 |
|||
また、日本国内においてはしばしば厚生労働省が発表する接種後の死者数を引用して「COVID-19ワクチン接種後に多くの人が死亡しており危険」などという風説が流布されることがある<ref>{{Cite web|url=https://www.tokyo-np.co.jp/article/138684|title=接種後の死亡報告は1200件超なのに…コロナワクチンが死因、なぜゼロ?|access-date=2021-10-28}}</ref>が、厚生労働省が公開している事例はあくまで副反応疑い報告制度に基づき報告のあったものの件数であり、ワクチン接種直後に死亡した者の総数とも、あるいは接種と死亡の因果関係が認定された者の総数とも一致しない<ref>{{Cite web|url=https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/vaccine_hukuhannou_youshikietc.html|title=医師等の皆さまへ~新型コロナワクチンの副反応疑い報告のお願い~|access-date=2021-10-28}}</ref><ref |
また、日本国内においてはしばしば厚生労働省が発表する接種後の死者数を引用して「COVID-19ワクチン接種後に多くの人が死亡しており危険」などという風説が流布されることがある<ref>{{Cite web|和書|url=https://www.tokyo-np.co.jp/article/138684|title=接種後の死亡報告は1200件超なのに…コロナワクチンが死因、なぜゼロ?|access-date=2021-10-28}}</ref>が、厚生労働省が公開している事例はあくまで副反応疑い報告制度に基づき報告のあったものの件数であり、ワクチン接種直後に死亡した者の総数とも、あるいは接種と死亡の因果関係が認定された者の総数とも一致しない<ref>{{Cite web|和書|url=https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/vaccine_hukuhannou_youshikietc.html|title=医師等の皆さまへ~新型コロナワクチンの副反応疑い報告のお願い~|access-date=2021-10-28}}</ref><ref group="注">このページ中程には「ワクチン接種との因果関係が示されていない症状も含め、幅広く評価を行うため、当面の間、以下の症状について、報告を積極的にご検討ください。」と記載があり、報告のあった案件の全てが必ずしもワクチン接種との因果関係があるものではない。また同ページには「アナフィラキシーの診断に至らない症状で、報告基準にも該当しない場合には、報告の対象にはなりません。」との記載があり、例えば接種を受けた直後に交通事故による出血多量で死亡したような場合は、当然ながら報告の対象とはならない。</ref>。 |
||
似たような風説で、「厚生労働省が発表するCOVID-19ワクチン接種後の死亡者の殆どは、接種と死亡の因果関係が不明と結論づけられており、このようなワクチンは信用できない」というものもある<ref>{{Cite web|url=https://news.yahoo.co.jp/articles/93bf87d8abe5ea6f1a6e65da02d13592e73a6b57|title=ワクチン接種後死亡例 ほとんど因果関係不明|access-date=2021-10-28}}</ref>が、これは日本国内における[[行政解剖]]の件数が極めて少ないという、COVID-19ワクチンに限らない問題が原因でもあり<ref>{{Cite web|url=https://diamond.jp/articles/-/282431?page=3|title=なぜ「ワクチン接種で死亡」の原因究明が進まないのか、法医学者に聞く|access-date=2021-10-28}}</ref>、インフルエンザワクチンにおいても同様の事象がかねてより発生している<ref>{{Cite web|url=https://www.yakuji.co.jp/entry76774.html#:~:text=%E5%8E%9A%E7%94%9F%E5%8A%B4%E5%83%8D%E7%9C%81%E3%81%AF%E3%80%812018%E5%B9%B4,%E3%80%8C%E8%A9%95%E4%BE%A1%E3%81%A7%E3%81%8D%E3%81%AA%E3%81%84%E3%80%8D%E3%81%A8%E3%81%97%E3%81%9F%E3%80%82|title=【厚労省】重篤な副反応疑いは131件‐インフルエンザワクチンで報告|access-date=2021-10-28}}</ref>。ただし、上記の通り解剖による直接的な死因究明があまり行われていないことは事実ではあるものの、[[プラセボ]]対照試験においてワクチン群ととプラセボ群の間に重篤な有害事象の発現頻度の差がないことは既に実証されている<ref>{{Cite web|url=https://www.mhlw.go.jp/content/10601000/000738928.pdf|title=新型コロナウイルスワクチンの 副反応の収集・評価について - 厚生労働省|access-date=2022-01-08}}</ref>。 |
似たような風説で、「厚生労働省が発表するCOVID-19ワクチン接種後の死亡者の殆どは、接種と死亡の因果関係が不明と結論づけられており、このようなワクチンは信用できない」というものもある<ref>{{Cite web|和書|url=https://news.yahoo.co.jp/articles/93bf87d8abe5ea6f1a6e65da02d13592e73a6b57|title=ワクチン接種後死亡例 ほとんど因果関係不明|access-date=2021-10-28}}</ref>が、これは日本国内における[[行政解剖]]の件数が極めて少ないという、COVID-19ワクチンに限らない問題が原因でもあり<ref>{{Cite web|和書|url=https://diamond.jp/articles/-/282431?page=3|title=なぜ「ワクチン接種で死亡」の原因究明が進まないのか、法医学者に聞く|access-date=2021-10-28}}</ref>、インフルエンザワクチンにおいても同様の事象がかねてより発生している<ref>{{Cite web|和書|url=https://www.yakuji.co.jp/entry76774.html#:~:text=%E5%8E%9A%E7%94%9F%E5%8A%B4%E5%83%8D%E7%9C%81%E3%81%AF%E3%80%812018%E5%B9%B4,%E3%80%8C%E8%A9%95%E4%BE%A1%E3%81%A7%E3%81%8D%E3%81%AA%E3%81%84%E3%80%8D%E3%81%A8%E3%81%97%E3%81%9F%E3%80%82|title=【厚労省】重篤な副反応疑いは131件‐インフルエンザワクチンで報告|access-date=2021-10-28}}</ref>。ただし、上記の通り解剖による直接的な死因究明があまり行われていないことは事実ではあるものの、[[プラセボ]]対照試験においてワクチン群ととプラセボ群の間に重篤な有害事象の発現頻度の差がないことは既に実証されている<ref>{{Cite web|和書|url=https://www.mhlw.go.jp/content/10601000/000738928.pdf|title=新型コロナウイルスワクチンの 副反応の収集・評価について - 厚生労働省|access-date=2022-01-08|format=PDF}}</ref>。 |
||
利権とかもあるから隠蔽してんだよ |
|||
なお、副反応疑い報告制度に基づいて報告のあった案件は、厚生労働省の審議会に報告され、専門家による審査が行われる<ref>{{Cite web|url=https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/vaccine_hukuhannou-utagai-houkoku.html|title=新型コロナワクチンの副反応疑い報告について|access-date=2021-10-28}}</ref>が、2021年10月時点で、日本国内においてCOVID-19ワクチンの接種と死亡に因果関係が認定されたケースは皆無である<ref>{{Cite web|url=https://www.tokyo-np.co.jp/article/138684|title=接種後の死亡報告は1200件超なのに…コロナワクチンが死因、なぜゼロ?|access-date=2021-10-28}}</ref>。 |
なお、副反応疑い報告制度に基づいて報告のあった案件は、厚生労働省の審議会に報告され、専門家による審査が行われる<ref>{{Cite web|和書|url=https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/vaccine_hukuhannou-utagai-houkoku.html|title=新型コロナワクチンの副反応疑い報告について|access-date=2021-10-28}}</ref>が、2021年10月時点で、日本国内においてCOVID-19ワクチンの接種と死亡に因果関係が認定されたケースは皆無である<ref>{{Cite web|和書|url=https://www.tokyo-np.co.jp/article/138684|title=接種後の死亡報告は1200件超なのに…コロナワクチンが死因、なぜゼロ?|access-date=2021-10-28}}</ref>。 |
||
このため厚生労働省では「安全性において重大な懸念は認められない」との評価を下しており<ref>{{Cite web|url=https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/vaccine_hukuhannou-utagai-houkoku.html|title=新型コロナワクチンの副反応疑い報告について|access-date=2021-10-28}}</ref>、一般市民向けのQ&Aサイトにおいては「新型コロナワクチンの接種が原因で多くの方が亡くなったということはありません。」と説明している<ref>{{Cite web|url=https://www.cov19-vaccine.mhlw.go.jp/qa/0081.html|title=新型コロナワクチンの接種が原因で多くの方が亡くなっているというのは本当ですか。|access-date=2021-10-28}}</ref>。 |
このため厚生労働省では「安全性において重大な懸念は認められない」との評価を下しており<ref>{{Cite web|和書|url=https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/vaccine_hukuhannou-utagai-houkoku.html|title=新型コロナワクチンの副反応疑い報告について|access-date=2021-10-28}}</ref>、一般市民向けのQ&Aサイトにおいては「新型コロナワクチンの接種が原因で多くの方が亡くなったということはありません。」と説明している<ref>{{Cite web|和書|url=https://www.cov19-vaccine.mhlw.go.jp/qa/0081.html|title=新型コロナワクチンの接種が原因で多くの方が亡くなっているというのは本当ですか。|access-date=2021-10-28}}</ref>。 |
||
大阪の[[通天閣]]のネオンサインを「治験中 射ったらあかん」「射っちゃダメだよ」{{sic}}と改竄した2枚の画像が、2021年11月にTwitter上で拡散された。COVID-19ワクチンを接種しないよう呼びかけるために改竄したとみられ、運営会社は公式Twitter上で「悪質なデマ」として注意喚起している<ref>{{Cite web|title=通天閣の悪質デマ画像広がり、苦情など相次ぐ ワクチン巡り|url=https://mainichi.jp/articles/20211105/k00/00m/040/192000c|website=毎日新聞|accessdate=2021-12-25|language=ja}}</ref><ref>{{Cite web|title=通天閣ネオンサインに「治験中、射ったらあかん」…ニセ画像がSNSで拡散 : 社会 : ニュース|url=https://www.yomiuri.co.jp/national/20211106-OYT1T50037/|website=読売新聞オンライン|date=2021-11-06|accessdate=2021-12-25|language=ja}}</ref>。 |
大阪の[[通天閣]]のネオンサインを「治験中 射ったらあかん」「射っちゃダメだよ」{{sic}}と改竄した2枚の画像が、2021年11月にTwitter上で拡散された。COVID-19ワクチンを接種しないよう呼びかけるために改竄したとみられ、運営会社は公式Twitter上で「悪質なデマ」として注意喚起している<ref>{{Cite web|和書|title=通天閣の悪質デマ画像広がり、苦情など相次ぐ ワクチン巡り|url=https://mainichi.jp/articles/20211105/k00/00m/040/192000c|website=毎日新聞|accessdate=2021-12-25|language=ja}}</ref><ref>{{Cite web|和書|title=通天閣ネオンサインに「治験中、射ったらあかん」…ニセ画像がSNSで拡散 : 社会 : ニュース|url=https://www.yomiuri.co.jp/national/20211106-OYT1T50037/|website=読売新聞オンライン|date=2021-11-06|accessdate=2021-12-25|language=ja}}</ref>。 |
||
ワクチンに関する真偽不明あるいは明らかな誤情報の拡散は反ワクチン思想や陰謀論を主張する一般アカウントにとどまらず、同様の思想を持つ医療関係者、研究者、論客のほか政治家といった公人による発信もしばしばみられる。 |
|||
その中でも、元内閣総理大臣の[[鳩山由紀夫]]は2022年7月13日に自身のTwitterで、(医師から聞いた話として)「WHOがワクチンを打った人の方が打たない人より3倍入院する確率が高いことを認めたとのこと。ファイザーは大量のデータを消したとの内部告発も発表された。今までワクチン利権は聞いていたが、陰謀論と切り捨てられるようなものではないことが明らかになった」とツイートし、投稿がSNS上で拡散された。これに対し、元新型コロナワクチン接種推進担当大臣の[[河野太郎]]は「元首相がワクチンデマを流していた。いったい何が起きたんだろう」と鳩山を批判するツイートを行い、BuzzFeed Japanによるファクトチェックにおいても、鳩山のツイートは専門家によって事実が否定されており、「国民の命・健康と生活に関わる情報については特に、情報の真偽と発信が及ぼす影響について、発信者も十分に注意することが大切であり、元首相のように影響の大きな人物は自らの発する情報の正確性には十分注意してほしいと思います」と釘を刺している<ref>[https://www.buzzfeed.com/jp/kotahatachi/yukio-hatoyama-fc 「ワクチンを打つと入院確率が3倍になるとWHOが認めた」鳩山元首相のツイートを専門家が否定。河野太郎氏は「ワクチンデマ」と批判] - BuzzFeed Japan 2022年8月12日</ref>。 |
|||
しかし、その後も鳩山は9月14日にTwitter投稿でも「白澤卓二先生(国際予防医学協会理事長)にあらためて訊きました。WHOがワクチンで重症になる確率はコロナで入院する確率の3倍とWHOが認めたのは事実ですかと。河野太郎大臣はデマと否定されましたがと。白澤先生は事実ですと答えられました。私はアンチエイジングの権威の白澤先生の言葉を信じます」と再びワクチン接種に対する根拠の乏しい持論を展開し、各メディアのファクトチェックでも誤りとされるなど、総理経験者でもある鳩山の科学的根拠に基づかない軽率なツイートに対して、専門家などから厳しい批判が続いている<ref>[https://mainichi.jp/articles/20220922/k00/00m/040/024000c ファクトチェック:ワクチン巡り鳩山由紀夫元首相がまた誤情報 専門家「影響大きい」] - 毎日新聞 2022年9月22日</ref>。 |
|||
== 脚注 == |
== 脚注 == |
||
{{脚注ヘルプ}} |
{{脚注ヘルプ}} |
||
=== 注釈 === |
=== 注釈 === |
||
{{notelist2}} |
{{notelist2}} |
||
=== 出典 === |
=== 出典 === |
||
{{Reflist| |
{{Reflist|2}} |
||
<ref name="Pfizer-BioNTech COVID-19 Vaccine EUA fact sheet">{{Cite web2| title=Pfizer-BioNTech COVID-19 Vaccine EUA Fact Sheet for Healthcare Providers | publisher=Pfizer | date=25 February 2021 | access-date=25 February 2021 | url=https://www.fda.gov/media/144413/download | format=PDF}}</ref> |
|||
}} |
|||
== 関連項目 == |
== 関連項目 == |
||
{{div col|small=yes|colwidth=20em}} |
|||
* [[2009年新型インフルエンザの世界的流行#新型インフルエンザワクチン|2009年新型インフルエンザワクチン]] |
|||
* [[日本におけるCOVID-19ワクチンの接種]] |
|||
* [[日本における2019年コロナウイルス感染症の流行状況#ワクチン]] |
|||
* [[新型コロナウイルス感染症の世界的流行_(2019年-)#ワクチンの開発と接種|COVID-19ワクチンの開発と接種]] |
|||
* [[RNAワクチン#COVID-19に対するmRNAワクチンの有効性]] |
|||
* [[ウイルスベクターワクチン]] |
|||
* [[不活化ワクチン]] |
|||
* [[免疫系]] - [[獲得免疫]] - [[液性免疫]] - [[細胞性免疫]] |
|||
* [[中和抗体]] - [[T細胞]] |
|||
* [[集団免疫]] |
|||
* [[COVAX]] |
|||
* [[COVID-19に対する薬剤研究]] |
* [[COVID-19に対する薬剤研究]] |
||
* [[COVID-19に対する薬剤転用研究]] |
* [[COVID-19に対する薬剤転用研究]] |
||
* [[新型 |
* [[2009年新型インフルエンザの世界的流行#新型インフルエンザワクチン|2009年新型インフルエンザワクチン]] |
||
* [[ |
* [[DreamLab]] |
||
{{div col end}} |
|||
* [[獲得免疫]] |
|||
* [[集団免疫]] |
|||
== 外部リンク == |
== 外部リンク == |
||
'''全般''' |
|||
* [https://www.who.int/emergencies/diseases/novel-coronavirus-2019/covid-19-vaccines COVID-19 vaccines]{{en icon}} - World Health Organization (WHO) |
|||
* [https://www.who.int/initiatives/act-accelerator/covax COVAX]{{en icon}} - World Health Organization (WHO) |
|||
* [https://www.gavi.org/covax-facility COVAX Facility]{{en icon}} - Gavi |
|||
* [https://www.cdc.gov/coronavirus/2019-ncov/vaccines/ Vaccines for COVID-19]{{en icon}} - [[アメリカ疾病予防管理センター|CDC]] |
|||
* [https://ourworldindata.org/covid-vaccinations Coronavirus (COVID-19) Vaccinations]{{en icon}} - Oxford Martin School |
|||
* [https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/vaccine_00184.html 新型コロナワクチンについて] - 厚生労働省 |
* [https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/vaccine_00184.html 新型コロナワクチンについて] - 厚生労働省 |
||
* [https://v-sys.mhlw.go.jp/ コロナワクチンナビ] - 厚生労働省 |
* [https://v-sys.mhlw.go.jp/ コロナワクチンナビ] - 厚生労働省 |
||
* [https://www. |
* [https://www.mhlw.go.jp/stf/shingi/shingi-kousei_127713.html 厚生科学審議会 (予防接種・ワクチン分科会)] - 厚生労働省 |
||
* [https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/vaccine_kenkoujoukyoutyousa.html 新型コロナワクチンの接種後の健康状況調査] - 厚生労働省 |
|||
* [https://www.kantei.go.jp/jp/headline/kansensho/vaccine.html 新型コロナワクチンについて] - [[内閣総理大臣官邸|総理大臣官邸]] |
|||
* [https://info.vrs.digital.go.jp/dashboard 新型コロナワクチンの接種状況] - [[デジタル庁]] |
|||
* [https://www.kansensho.or.jp/modules/guidelines/index.php?content_id=43 COVID-19ワクチンに関する提言] - [[日本感染症学会]] |
* [https://www.kansensho.or.jp/modules/guidelines/index.php?content_id=43 COVID-19ワクチンに関する提言] - [[日本感染症学会]] |
||
* [https://www.niid.go.jp/niid/ja/vaccine-j/249-vaccine/10273-cov19vac.html 新型コロナワクチンに関する情報] - [[国立感染症研究所]] |
* [https://www.niid.go.jp/niid/ja/vaccine-j/249-vaccine/10273-cov19vac.html 新型コロナワクチンに関する情報] - [[国立感染症研究所]] |
||
* [https:// |
* [https://www3.nhk.or.jp/news/special/coronavirus/vaccine/qa/ NHK特設サイト「新型コロナウイルス:ワクチンQ&A」] - [[NHK]] |
||
* {{NHK放送史|D0009030854_00000|新型コロナウイルス ワクチン接種始まる}} |
|||
* [http://www.jpma.or.jp/coronavirus/initiative_01.html 製薬協加盟各社による、治療薬・ワクチンの研究開発の取り組みについて] - [[日本製薬工業協会]] |
|||
* [https://www.amed.go.jp/program/list/01/06/covid-19.html 新型コロナウイルス感染症(COVID-19)の研究開発課題について] - [[日本医療研究開発機構]] (AMED) |
|||
* [https://www.jpma.or.jp/coronavirus/initiative_01.html 製薬協加盟各社による、治療薬・ワクチンの研究開発の取り組みについて] - [[日本製薬工業協会]] |
|||
* [https://ourworldindata.org/covid-vaccinations Coronavirus (COVID-19) Vaccinations]{{en icon}} - Oxford Martin School |
|||
* [https://www.who.int/emergencies/diseases/novel-coronavirus-2019/covid-19-vaccines COVID-19 vaccines]{{en icon}} - World Health Organization (WHO) |
|||
* [https://www.who.int/initiatives/act-accelerator/covax COVAX]{{en icon}} - World Health Organization (WHO) |
|||
* [https://www.gavi.org/covax-facility COVAX Facility]{{en icon}} - Gavi |
|||
* [https://www.cdc.gov/coronavirus/2019-ncov/vaccines/ Vaccines for COVID-19]{{en icon}} - [[アメリカ疾病予防管理センター]] (CDC) |
|||
'''小児''' |
|||
* [http://www.jpeds.or.jp/uploads/files/20220810_5-17.pdf 5~17 歳の小児への新型コロナワクチン接種に対する考え方] - [[日本小児科学会]] 2022/8/10更新 |
|||
* [http://www.jpeds.or.jp/modules/activity/index.php?content_id=379 「新型コロナワクチン~子どもならびに子どもに接する成人への接種に対する考え方~」に関するQ&A] - [[日本小児科学会]] 2022/5/31更新 |
|||
* [https://www.cov19-vaccine.mhlw.go.jp/qa/child/ 新型コロナワクチンQ&A 小児接種(5~11歳)] - [[厚生労働省]] |
|||
* [https://www.cdc.gov/coronavirus/2019-ncov/vaccines/why-vaccinate-children-teens.html 子供と10代の若者がCOVID-19のワクチン接種を受けるべき理由] - [[アメリカ疾病予防管理センター]](CDC) 2022/7/21更新{{en icon}} |
|||
* [https://www.canada.ca/en/public-health/services/vaccination-children/covid-19.html 子どものためのワクチン COVID-19] - [[カナダ政府]] 2022/7/14更新{{en icon}} |
|||
* [https://www.who.int/news/item/11-08-2022-interim-statement-on-covid-19-vaccination-for-children 小児に対するCOVID-19ワクチン接種に関する中間声明] - [[WHO]] 2022/8/11更新{{en icon}} |
|||
{{2019-nCoV}} |
{{2019-nCoV}} |
||
2024年11月13日 (水) 22:09時点における最新版
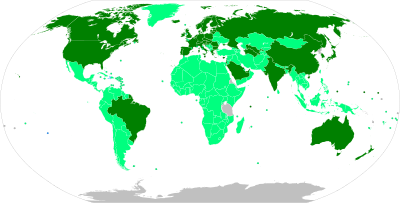

COVID-19ワクチン(コビッド19ワクチン、英: COVID-19 vaccine)は、新型コロナウイルス感染症(COVID-19)の原因ウイルスであるSARSコロナウイルス2(SARS-CoV-2)に対して、ヒトに獲得免疫を提供することを目的としたワクチンである。新型コロナウイルスワクチン、新型コロナワクチンとも呼ばれる。
2021年5月時点で、接種開始済みから開発中まで、複数の方式や製造元のワクチンが存在する(mRNAワクチン、DNAワクチン、ウイルスベクターワクチン、不活化ワクチン、組換えタンパクワクチン、ペプチドワクチンなど)[1]。
世界的に見て、2020年末や2021年初頭から複数の製薬企業が開発・製造した複数種のCOVID-19ワクチンの接種が始まっている。各国のワクチンの接種状況を概観すると、早期にワクチン調達契約を結ぶことに成功して既に大規模に接種が行われた国がある一方、ワクチン調達で遅れをとり接種がほとんど進んでいない国も存在する(後節の「ワクチンの確保・接種状況」を参照)。オーストリアのように接種の義務化を決定した国もある[2]。
概要
[編集]
既に複数の製薬企業によってワクチンは臨床試験も済んでおり、世界各地で接種は行われている。有効性は各ワクチンごとに異なる(後節の「有効性」を参照)。
各国・各地の接種状況については後節の「ワクチンの確保・接種状況」を参照のこと。
いまだにワクチン開発に成功していない製薬会社の中には、今も新たな種類のCOVID-19ワクチンの開発の努力を続けている企業もある。なお2021年5月18日時点で、日本の製薬企業はいずれも自社のCOVID-19ワクチンの承認を得ることに成功していない。
開発開始までの経緯と開発の加速
[編集]COVID-19の大流行に先立ち、重症急性呼吸器症候群(SARS)や中東呼吸器症候群(MERS)などの病気を引き起こすコロナウイルスの構造と機能に関する知識が確立されていた為、2020年初頭に様々なワクチン技術の開発を加速できた、とされた[3]。2020年1月10日、SARS-CoV-2の遺伝子配列データがGISAIDを通じて共有され、同年3月19日までに、世界の製薬業界がCOVID-19への取り組みを大々的に発表した[4]。
2020年代に入り、COVID-19は世界規模で急ピッチに広がりを見せたことから、各国の研究機関や医薬品メーカーは、新たなワクチンの開発や他のウイルス用に開発された既存ワクチンの再評価に乗り出した。世界保健機関(WHO)は、2020年5月までに世界で118の計画が進行中とするリストを公表。うち8の計画は、その時点で既に欧米や中華人民共和国(中国)で臨床試験の段階に入っていた[5]。また、WHOはワクチン開発に各国が共同出資・購入する枠組み「COVAX(コバックス)」を立ち上げた[6]。
なお、2020年6月時点では、「最初に開発されるワクチンについては、感染防止よりも重症化や死亡を防ぐタイプのワクチンを開発する可能性がある」などと報道されていた[7]。また、高齢者にはワクチンが効きにくいと指摘する声もあった[8]。
COVID-19用ワクチンの製造に当たり、新たな製造手法を模索する企業も現れた。これは、従来の鶏卵によるインフルエンザワクチンの生産手法を応用した場合、生産性が低いうえに時間がかかるというリスクがあること、また、卵に注入したウイルスが変異して、ワクチンの有効性が低下することも考えられるためである[9]。具体的には、DNAワクチンやmRNAワクチンの開発が進められることとなった[10]。
2020年5月時点で、WHO、感染症流行対策イノベーション連合(Coalition for Epidemic Preparedness Innovations, CEPI)、およびゲイツ財団(GF)は、COVID-19感染症の継続を防ぐためにいくつかのワクチンが必要になるという見通しのため、資金と組織のリソースを投入していた[11]。ワクチン候補の迅速な投資と開発のために20億ドルの世界基金を組織しているCEPI[12] は、2020年9月に、ライセンス取得を支援するための臨床データが同年末までに入手できる可能性があることを示した。2020年5月4日には、WHOが主催したテレソン(長時間特別番組)で、40カ国から81億ドルの誓約書が寄せられた[13]。同時に、WHOは、第II/III相臨床試験に到達した複数のワクチン候補の同時評価のための国際的な「連帯試験」の展開も発表した[14]。
2020年11月、バーレーンは中国のシノファーム社製ワクチンの緊急販売承認を与え、アラブ首長国連邦(UAE)がこれに続いた。12月には、バーレーンと英国が米ファイザー社製ワクチンを緊急時の使用を承認した一方[15][16]、UAEとカナダは一般使用を承認した[17][18][19]。
臨床試験の状況
[編集]第III相臨床試験では、いくつかのCOVID-19ワクチンが、症候性COVID-19感染症の予防に95%という高い有効性を示している。2021年4月現在、16種のワクチンが少なくとも1つの国の規制当局から一般公衆用として認可を受けている。2種類のRNAワクチン(ファイザー - ビオンテック社製ワクチン、モデルナ社製ワクチン)、7種類の従来型不活化ワクチン(BBIBP-CorV、CoronaVac、Covaxin、WIBP-CorV、CoviVac、Minhai-Kangtai、QazVac)、5種類のウイルスベクターワクチン(スプートニク・ライト、スプートニクV、オックスフォード-アストラゼネカ、コンビディシア、ジョンソン・エンド・ジョンソン)、2種類のタンパク質サブユニットワクチン(EpiVacCorona、RBD-Dimer)である[20]。合計すると、2021年3月時点で、308のワクチン候補が様々な段階で開発されており、73件が臨床研究中で、そのうち24が第I相試験、33が第I/II相試験、16が第III相試験となっている[20][21][22][23]。
生産・配布計画
[編集]多くの国では、高齢者などの合併症のリスクが最も高い人や、医療従事者などのウイルスへの曝露・感染のリスクが高い人を優先して段階的に配布する計画が実施されている[24]。また、ワクチンの入手性が向上するまでの間、できるだけ多くの人々に接種を拡大するために、単回接種による暫定使用が検討されている[25][26][27][28]。2021年5月19日時点、各国の保健機関からの公式報告によると、全世界で13億回のCOVID-19ワクチンが投与された[29]。アストラゼネカ-オックスフォードは2021年に30億回、ファイザー - ビオンテック社13億回、スプートニクV、シノファーム、シノバック、ジョンソン・エンド・ジョンソン社はそれぞれ10億回の生産を見込んでいる。モデルナは2021年に6億回、コンビディシアは5億回の投与を目標としている[30][31]。2020年12月までに100億回以上のワクチンが各国から予約注文されており[32]、世界人口の14%を占める高所得国がその約半数を購入している[33]。
欧米企業のワクチンを十分に調達する経済力がない中・低所得国に対しては中華人民共和国やロシア連邦、インドが大量のワクチンを輸出しており、外交的影響力を拡大する意図が指摘されている[34]。日本政府は購入したアストラゼネカ製ワクチンを、台湾やベトナム、インドネシア、タイ、フィリピン、マレーシア、ブルネイへ無償提供している[35][36]。
接種状況
[編集]既に世界各地でワクチンの接種が開始されている。日本含む各国・各地の接種状況については後節の「ワクチンの確保・接種状況」を参照のこと。
接種を行った人々に様々なインセンティブ(優遇)・特典を与えて接種を加速させる取り組み[37] や、接種済みであることを証明する「ワクチンパスポート」を発行する動きもある[34]。ガイダンスによると、完全に予防接種を受けた人は、マスクなしで、また物理的な距離を置くことなく、屋内と屋外のすべての活動に参加できるようになった[38][39]。しかし、2021年7月、アメリカ疾病予防管理センターは、完全にワクチン接種された人を含むすべての人に、ウイルスの感染がかなりまたは多い地域の公共の屋内の場所でマスクを着用するように勧告した[40]。
ワクチンの余剰・廃棄問題
[編集]ワクチンの開発・生産が進んで供給量が増えたことや、接種への忌避感が根強い地域があることなどで、ワクチンおよびその生産能力の余剰と、使用期限切れによる廃棄が生じている。先進国[41]のほか、南アフリカ共和国で製薬会社アスペンが他のアフリカ諸国への供給用に建設したワクチン工場は、アフリカ諸国の接種率が低いにもかかわらず2022年6月時点で受注が得られず閉鎖危機にある[42]。
接種推奨の更新
[編集]2022年1月、欧州医薬品庁(EMA)は、ブースター接種を頻繁(4か月毎)に繰り返しすぎると、ワクチン接種に対する免疫反応が弱まる可能性があると指摘し、ブースター接種は季節性インフルエンザと同じく寒い時期のはじめに行うよう推奨した[43][44][45]。
2023年3月28日、世界保健機関(WHO)は、感染やワクチン接種により多くの人が免疫を持っている状態であることを前提としたうえで、医療資源の最適な分配について検討し、重症化および死亡のリスクが高い者へのワクチン接種が優先されるように提言を行った[46][47][48][49][50]。この提言は、医療費が限られた低・中所得国を含む全世界に向けて出されたものであり[51][52]、ワクチン接種の優先度を「高・中・低」の3つのグループにわけ、「疾病負担や費用対効果などに基づき各国で判断する」ことを促している[46][48][49]。
- 「高優先度群」:高齢者、重い基礎疾患(糖尿病や心臓病など)を持つ成人、小児を含む免疫不全状態の人(HIV感染者や移植患者など)、妊婦、医療従事者。
- 「中優先度群」:60歳未満の健康な成人、基礎疾患を持つ小児と青年。
- 「低優先度群」:生後6ヵ月 - 17歳の健康な小児[53]。
- 初回接種と追加接種は各国で決定、定期的な接種は推奨しない(同上)[47][48][49]。この群に対する1次接種と追加接種の安全性と有効性は確認されているが、麻疹やロタウイルス、肺炎球菌ワクチンなど、小児に必須のワクチンや、中 - 高優先度群へのCOVID-19ワクチン接種の利点よりも低いことを考慮して、国ごとに費用対効果や公衆衛生政策の優先順位などの状況に基づき検討することを奨めた[48][49][53]。この提言に対し、日本小児科学会は、「他国と比べて日本の既感染者は少ない」「小児においても罹患後に後遺症を残す者がいる」「重症化を予防する手段としてワクチン接種は引き続き重要」「接種に伴う利益は、副反応等の不利益を上回る」として、すべての小児への推奨を維持すると表明している[53][49]。
この提言を拡大解釈して「追加接種は不要だった」「やはりワクチンは危険だった」と主張するワクチンに批判的な者がいるが、医療資源を確保するために接種をどう計画するか、費用対効果などの面から各国が検討するよう促しているものであり、「ワクチンの効果と安全性」はまったく否定していない[46][48][49]。文中では、高齢者や基礎疾患のある人を中心にワクチンを接種することの重要性を改めて強調し「健康な子どもについても接種は安全で効果的」と明言している[46][48][49]。
沿革
[編集]SARSとMERSのワクチン開発
[編集]2003年時点、鳥類感染性気管支炎ウイルス (infectious bronchitis virus) 、犬コロナウイルス、猫コロナウイルスなど、コロナウイルスによって引き起こされるいくつかの動物の病気に対してワクチンは製造されていた[54]。ヒトに影響を与えるコロナウイルス科のウイルスに対するワクチンを開発するための以前のプロジェクトは、重症急性呼吸器症候群(SARS)と中東呼吸器症候群(MERS)を対象としていた。SARS[55] およびMERS[56] に対するワクチンは、ヒト以外の動物でテストされている。
2005年と2006年に発表された研究によると、SARSを治療するための新しいワクチンと医薬品の特定と開発は、当時の世界中の政府と衛生行政機関にとって優先事項だった[57][58][59]。2020年の時点で、ヒトのSARSに対して安全で効果的であることが証明されている治療法や予防ワクチンは無い[60][61]。
MERSに対し確立されたワクチンも存在しない[62]。MERSが普及したとき、既存のSARS研究は、MERS-CoV感染に対するワクチンと治療法を開発するための有用なテンプレートを提供する可能性があると考えられていた[60][63]。2020年3月現在、ヒトでの第I相臨床試験を完了した(DNAベースの)MERSワクチンが1種[64]、その他3種のワクチンが進行中であり、いずれもアデノウイルスベクター型2種(ChAdOx1-MERS、BVRS-GamVac)、MVAベクター型1種(MVA-MERS-S)である[65]。
2020年のCOVID-19ワクチン開発
[編集]
COVID-19が世界的に蔓延し始めた2019年末 - 2020年初頭の時点では、ヒトのコロナウイルス感染を予防するためのワクチンは存在していなかった[11]。2019年12月にCOVID-19コロナウイルスが検出された後[66]、COVID-19の遺伝子配列が2020年1月11日に公開され、発生に備えて予防ワクチンの開発を早めるための緊急の国際的対応が引き起こされた[67][68][69]。
2020年2月時点では、世界保健機関(WHO)は、原因ウイルスであるSARSコロナウイルス2(SARS-CoV-2)に対するワクチンが18カ月以内に利用可能になるとは予想していないと述べていた[70]。2020年初頭に世界的にCOVID-19の感染率が急増したことで、国際的なアライアンスや政府の取り組みが刺激され、複数のワクチンを短期間で製造するためのリソースを緊急に整理し[14]、3月には4つのワクチン候補がヒト評価に入ることとなった(後節の「2020年に開始された臨床試験」の表を参照)[67][71]。
2020年4月、WHOは、異なる技術と流通を持つ3種類以上のワクチンを開発するための総費用を80億米ドルと見積もった[14][72]。2020年4月までに、「19カ国のほぼ80の企業や研究機関」がこの仮想的なゴールドラッシュに取り組んでいた[73]。また、4月には、CEPIは、COVID-19に対するワクチン候補のうち、6つのワクチンが国際的な連合によって第II-III相試験を経て開発のために選ばれ、3つのワクチンは最終的なライセンス取得に向けて規制と品質保証を経て合理化されなければならないと見積もっている[11][21][71]。別の分析によると、10のワクチン候補が同時に初期開発を必要とし、そのうちのいくつかがライセンス取得に向けた最終的な道筋として選ばれる前に、10のワクチン候補が同時に初期開発を必要とすると見積もっている。
2020年7月、英国国家サイバーセキュリティ―センター (National Cyber Security Centre) として、それぞれの政府および軍隊の英米諜報機関およびセキュリティ組織が、カナダ通信保安局 (Communications Security Establishment) 、アメリカ合衆国国土安全保障省国家保護・プログラム総局 (Cybersecurity Infrastructure Security Agency) 、アメリカ国家安全保障局(NSA)は、ロシアの国家支援ハッカーが他の国の学術機関や製薬機関からCOVID‑19治療とワクチン研究を盗もうとした可能性があると主張した。ロシアはそれを否定した[74]。
開発状況
[編集]2020年の間に、年初からのCOVID-19ワクチン開発の取り組み全体の大きな変化は、多国籍製薬業界と各国政府との共同研究の増加と、COVID-19ワクチンに注力する多くの国のバイオテクノロジー企業の多様性と増加である[21]。CEPIによると、COVID-19ワクチン開発の一般的な地理的分布は、北米の組織が世界のCOVID-19ワクチン研究の約40%を占めているのに対し、アジアとオーストラリアでは30%、ヨーロッパでは26%、南米とアフリカではいくつかのプロジェクトが存在している[67]。
ワクチン開発がスタートすると分散コンピューティングプロジェクトのFolding@homeへの関心が高まったことで、2020年3月下旬には演算能力は約1.22 EFLOPS[75][76]、2020年4月中旬には約2.43 EFLOPSを達成し[77][78]、世界初のエクサフロップ・コンピューティング・システムとなり、TOP500の全スーパーコンピュータの合算を上回る能力を獲得した。
国際機関
[編集]ワクチン開発を加速させ、流通に備えるための国際的な提携を形成している組織があるが、その中には、2020年5月初旬に81億米ドルの資金調達を開始し、史上前例のない規模で協力、研究の加速化、国際的なコミュニケーションを促進している世界保健機関(WHO)も含まれている[13]。WHOはまた、世界的なワクチン開発を調整するためのCovid-19 Vaccines Global Access(COVAX)を実施し、GAVIやCEPIと共同で Access to COVID-19 Tools (ACT) Accelerator のワクチンの柱となっている[21][79][80]。7月、WHOは、世界人口の最大60%を占める165カ国が、最終的な認可ワクチンの公正かつ衡平な配分のためのWHO COVAX計画に合意したことを発表した。COVAXは、COVID-19ワクチンの開発と製造を加速し、「認可ワクチンへのアクセスが全ての国に公平に提供されること」を保証することを目標としている。具体的には2021年末までに、各参加国が最前線の医療従事者やリスクの高い人々を保護し、最も脆弱な20%の人口にワクチンを接種する[81] ために、保証された分量を受け取る(最大20億回分を平等に提供する)ことを保証する[82][83]。
CEPIは、国際保健当局およびワクチン開発者と協力して、さらに20億米ドルの基金を創設。公的、私的、慈善団体、市民社会の組織間のグローバルパートナーシップで、8つのワクチン候補の研究と臨床試験を加速するために資金を提供し、当面(2020年〜2021年)は、ライセンスの完全な開発のためにいくつかの候補を支援することを目標としている[21][72]。英国、カナダ、ベルギー、ノルウェー、スイス、ドイツ、オランダは既に9億1500万米ドルを寄付しており[13][84]、ワクチンの研究と配布を専門とする民間の慈善団体であるビル&メリンダゲイツ財団(ゲイツ財団)は、2億5000万米ドルを寄付している[85][86]。
2020年6月4日、英国のロンドンから、G7およびG20諸国の35の国家元首を含む、52カ国の民間および政府の代表者の間で仮想サミットが調整され、88億米ドルが調達された。ワクチンと予防接種のためのグローバルアライアンス(GAVI)により、2025年までに発展途上国の3億人の子供たちがワクチンを摂取できるよう準備する[87]。主な寄付はゲイツ財団からの16億米ドル[88] と英国政府による5年間で年間3億3000万ポンド(2020年6月には約21億米ドル)など。
2020年12月時点では、ACTアクセラレーターにより24億米ドルが調達されており、9つのワクチン候補がCOVAXとCEPIによって資金提供され、189カ国が最終的なワクチンの展開計画に取り組んでいる[89][90]。
感染症流行対策イノベーション連合 (CEPI)
[編集]感染症流行対策イノベーション連合はノルウェー政府、インド政府、ビル&メリンダ・ゲイツ財団、および公益信託団体ウェルカム・トラストの出資によって2017年に世界経済フォーラム(ダボス会議)にて発足した、公的機関、民間機関、慈善団体および市民団体の間でのグローバルな協働体である[91]。日本の厚生労働省も創設に関わり2017年より拠出を行ってきた[92]。
2020年1月23日、CEPIは以下3研究チームがワクチン開発に向けた作業を開始し、少なくとも1種類のワクチンの臨床試験を6月までに開始すると発表した[92][93]。また、夏にも人へ臨床試験を行い、ワクチン承認は早ければ年内になるとも述べた[94]。
- 米医薬品・ワクチン開発のモデルナ (Moderna, Inc.)(英語) (MRNA.O) とアメリカ国立アレルギー・感染症研究所 (NIAID) の連携
- 製薬会社 イノビオ・ファーマシューティカルズ (Inovio Pharmaceuticals, Inc.) (INO.O)
- 豪クイーンズランド大学のチーム
この他、米Vir Biotechnology社もワクチン開発計画に加わり、SARSやMERSの生存者から同定されたモノクローナル抗体(mAbs)が本ウイルスに有効かどうか調べる[95]。
イノビオはMERSの最も先進的なワクチン候補 INO-4700をもっており[96]、ウイルスのDNA塩基配列が公表されて3時間以内にウイルスをデザインできた。CEPIから最大900万ドル(約9億8000万円)の助成金を受け、2020年初夏にも中東・アフリカ現地での第II相臨床試験に入る予定[97][98] で、大規模な臨床試験は年末までに中国で行いたいという[99]。
2月3日、英グラクソ・スミスクライン (GSK) はパンデミックワクチンで確立されたアジュバント(抗原性補強剤)の基盤技術を提供するためにCEPIの協働に参加すると発表した[100]。
2月25日、モデルナは開発中のCOVID-19のワクチンを、ヒトに投与する安全性試験(第I相試験)向けに米国立アレルギー感染症研究所 (NIAID) に出荷した。ヒトへの臨床試験は2カ月以内の開始を見込むが、一般に入手できるようになるには1年半かかる可能性があるという[101]。
日本
[編集]2020年3月12日、田辺三菱製薬は、カナダの子会社が製造する植物由来の粒子を利用し、ワクチン開発に着手すると発表した(CoVLP)[102]。
2020年3月5日、大阪大学発の創薬企業アンジェスは、DNAプラスミド技術を活かしたDNAワクチンを大阪大学と共同で開発し、タカラバイオが製造すると発表した[103][104][105]。同年6月30日より治験を開始し、7月末までに30人を対象に実施する[106][107]。
2020年5月7日、塩野義製薬は、子会社のUMNファーマが国立感染症研究所と共同で、年内の臨床試験開始を目指していることを公表した。最短で2020年内の臨床試験開始を予定している。市場への投入は2021年秋になる見込みで、同年末までに3,000万人分の生産を目標とする[108][109]。
第一三共、東京大学医科学研究所は、最短で2021年3月からワクチンの臨床試験を開始することを目指すと報道された[109]。
2020年6月27日、九州大学は、九州大学発のベンチャー企業であるKAICOと共同で、新型コロナウイルスのワクチン候補となるたんぱく質の開発に成功したと発表した[110][111]。2021年からワクチンの臨床試験開始を目指している[111]。
2020年8月時点でワクチンの開発が急がれた一方、(その時点では)専門家からは「感染そのものを予防する効果は証明が難しい」という懸念が出た。また、東京大学医科学研究所の石井健教授は「(ワクチン開発を)急げば急ぐほど安全性の担保はおろそかになる」と訴えている[109]。この懸念に対し、米国国立研究機関博士研究員でウイルス学、免疫学を専門とする峰宗太郎医師は「動物実験などの結果を踏まえると、『(感染予防効果は)あると考えてよい』と思います」[112] と述べている。
日本国内でも「臨床試験の段階で発熱などの副作用が発生しているケースも見られる[109]」とか、2020年12月20日時点で「ファイザー - ビオンテックのワクチンは、27万人への接種で6人(100万人あたり22人)のアナフィラキシーが報告されている[113]」とか、2020年1月23日の報道では「モデルナのワクチンは、400万人の接種でアナフィラキシーが起きたのは10人(100万人あたり2.5人)であり、いずれの患者もその後回復した」と報道された[114]。
日本では2020年12月18日にファイザーが厚生労働省に承認申請を行ったほか、国内メーカや大学などで実用化を目指して開発が行われているが、いずれも2021年に臨床試験を開始する目標であり、まだ実用化はされていない[115]、とされた。
2021年2月5日、アストラゼネカが厚生労働省に承認申請を行った[116]。
2021年2月12日、ファイザー製のコロナワクチン「コミナティ」の特例承認が了承され、2021年2月14日に正式に特例承認された[117][118]。なお、当該ワクチンの法令上の名称は「コロナウイルス修飾ウリジンRNAワクチン(SARS-CoV-2)」である[119]。
2021年3月5日、モデルナのワクチンについて、日本での窓口企業の武田薬品工業が厚生労働省に承認申請を行った[120]。
2021年5月20日、アストラゼネカのコロナワクチンである「バキスゼブリア」とモデルナのコロナワクチンである「COVID-19ワクチンモデルナ」(後に「スパイクバックス」へ名称変更)の特例承認が了承され、2021年5月21日に正式に特例承認された[121][122]。なお、アストラゼネカのウイルスベクターワクチンについての法令上の名称は「コロナウイルス(SARS-CoV-2)ワクチン(遺伝子組換えサルアデノウイルスベクター)」である[123]。ただ、モデルナのワクチンについてはファイザーに続いて公的接種の対象とされたものの(後述する大規模会場で使用されている)、アストラゼネカのワクチンについては、諸外国で副反応と見られる血栓症の発生があったことから、薬事承認はされたものの公的接種の対象外とされた[124]。その後、同年8月3日に原則40歳以上を対象に公的接種の対象に追加された[115]。
2021年5月24日、ジョンソン・エンド・ジョンソンのワクチンについて、傘下のヤンセンファーマが厚生労働省に承認申請を行った[125]。2022年5月30日、厚生労働省の専門部会はジョンソン・エンド・ジョンソンのワクチン「ジェコビデン」について製造販売を承認することを了承した[126]。その後、同年6月20日に厚生労働省は「ジェコビデン」の製造販売を承認した。ただし、当該ワクチンに関しては、厚生労働省は予防接種法上の公費負担で打てるワクチンに含めない方針を示しており、希望する場合は原則自己負担になる見込みである[127]。
2021年7月12日、第一三共はmRNAワクチンの臨床試験を年内に開始すると発表した[128][129]。国内では既に他のワクチン接種が始まっていることから偽薬との比較は倫理上の問題があるため、他のワクチンとの効果の差を比較する劣性試験を行う予定[128]。
2021年12月16日、武田薬品工業はアメリカのバイオテクノロジー企業ノババックスの組み換えタンパクワクチンについて、厚生労働省へ製造販売承認申請を行ったと発表した[130]。2022年4月19日、厚生労働省はノババックス製の組み換えタンパクワクチン「ヌバキソビッド」について正式に製造販売を承認した。なお、ノババックスの組み換えタンパクワクチンの法令上の名称は「組換えコロナウイルス(SARS-CoV-2)ワクチン」である[131]。
2022年9月20日、オミクロン株のBA.1に対応した従来株との2価ワクチンの接種を開始した。12歳以上の3回目以降の接種希望者(ブースター接種)が対象となる[132]。
2022年9月30日、導入されている新型コロナウイルスワクチンのうち、アストラゼネカのワクチンについては供給を受けたすべてが有効期限を迎えたため、この日をもって日本での公的接種終了となった。接種対象者を40歳以上に限定していたことから、同種のワクチン接種は9月末までで12万回と低迷していた。供給を受けた5770万回分のうち、自治体に配送されたのはおよそ20万回分に留まり、途上国を中心に海外に無償で供与したのがおよそ4400万回分で、残りのおよそ1350万回分は廃棄した。また、追加を予定していた6230万回分のワクチンの契約はキャンセルされている[133]。
日本政府は2021年6月に「ワクチン開発・生産体制強化戦略」を閣議決定しており、これに基づいて国立研究開発法人日本医療研究開発機構が2022年3月22日にワクチン開発を手掛ける先進的研究開発戦略センター(SCARDA)を設立した[134]。
2023年7月31日、厚生労働省の専門部会が、第一三共の新型コロナウイルスmRNAワクチン「ダイチロナ」について製造販売を承認する事を了承し、同年8月2日に厚生労働省が「ダイチロナ」の製造販売を承認した。国内企業が開発した新型コロナウイルスの初の販売承認となるが、流行初期の起源株を用いたワクチンであるため、同年秋に国が予定しているワクチンがオミクロン派生型の変異株対応ワクチンを使用する方針であることから同社は出荷は行わず、変異株対応のワクチンも開発を進め、年内の供給を目指している[135][136]。一方で塩野義製薬が開発した新型コロナウイルス組み換えタンパクワクチン「コブゴーズ」については、専門部会で国内治験のデータに有効性の疑義が指摘があったことから「有効性を明確に評価するのは難しい」と判断され、継続審議となった[137]。
2023年11月27日、厚生労働省の専門部会が、第一三共が同年9月に申請したXBB1.5対応型のmRNAワクチン「ダイチロナ」の製造販売を承認する事を了承し、翌28日に厚生労働省が「ダイチロナ」XBB1.5対応型の製造販売を承認した。既に同年11月17日に厚生労働省は薬事承認を条件に「ダイチロナ」について140万回分を購入することで合意しており、同年12月以降に国産初のCOVID-19ワクチンとして接種が開始される[138][139][140]。また、Meiji Seika ファルマが製造販売するアメリカのバイオテクノロジー企業アークトゥルス・セラピューティクスが開発した次世代型ワクチンとなる「レプリコン(自己増殖型)」ワクチン「コスタイベ」についても、同日に厚生労働省が製造販売を承認した。ただし「コスタイベ」は起源株を用いたワクチンであるため、この薬事承認時点では出荷は行わず、変異株に対応した2価ワクチンの早期実用化を目指すとしている。Meiji Seika ファルマは創薬支援を手掛けるアルカリスと同ワクチンの開発製造受託(CDMO)で連携しており、福島県南相馬市のアルカリスの工場で生産される予定である[138][141][142][143]。
2023年12月25日、厚生労働省は武田薬品工業から供給を受けたノババックスのワクチンについてはこの日をもって有効期限を迎えたため、国内での公的接種が終了となった。同ワクチンは約824万回分が購入され、このうち、およそ約110万回分が自治体に配送された一方で、未使用分の約714万回分は廃棄となった。厚生労働省は「希望する国民全員に接種の機会を提供するため、廃棄は発生したがむだではなかったと認識している」としている[144][145]。
なお、KMバイオロジクスでは2023年の実用化を目指し不活化ワクチンの開発を進めている[146]。
中国
[編集]2020年1月26日、中国CDC(疾病管理予防センター)の関係者は、ワクチンの開発を開始したと語った[147]。1月29日、広州のロシア領事館は新型コロナウイルスのゲノムが中国からロシアに提供され、中露がワクチンの共同開発に着手したと発表した[148]。
(上記と同じものかどうかは不明であるが)開発したワクチンの治験開始が3月17日に中国で承認され、陳薇をリーダーとする中国人民解放軍軍事科学院軍事医学研究院の研究者らが治験を開始[149]。3月18日に中国中央電視台も報道した[150]。
3月23日、軍事科学院軍事医学研究院生物工程研究所とカンシノ・バイオロジクスは、独自に開発した新型コロナウイルスワクチン(アデノウイルス媒体)の108人への第1期臨床試験を開始すると報道した[151]。プロジェクト責任者は陳薇 (Chen Wei) 少将で、複製欠陥型ヒト5型アデノウイルスを媒体とし、新型ウイルスのS抗原を作る[151]。感染予防のため、陳薇チーム7人は既に接種済みである[151]。陳薇少将はウイルスのワクチンの研究で博士号を取得しており、これまでに抗SARSウイルス製剤やエボラ出血熱のワクチン開発に成功したと発表されている[150]。
2020年5月25日、カンシノ・バイオロジクスは、同年3月から開始していたウイルスベクターワクチンの第1相臨床試験で、ヒトへの効果を世界で初めて確認したと報告した[152][153]。6月25日、中華人民共和国中央軍事委員会は国産ワクチン「Ad5-nCoV」の使用を中国人民解放軍に限定して認可したことを決定した[154]。7月22日より、医療従事者らを対象にワクチンの緊急使用を開始した[155]。
2020年12月30日、中国のシノファーム社は国産ワクチン「BBIBP-CorV」の有効性を79.34%とし、同年12月9日に中国より先にワクチンを承認して首相のムハンマド・ビン・ラーシド・アール・マクトゥームらが接種していたアラブ首長国連邦が発表した86%よりも低く発表した[156]。翌31日、中国の国家薬品監督管理局はシノファームの「BBIBP-CorV」を承認した[157]。
2021年2月、中国の国家薬品監督管理局はシノバック・バイオテック社のCoronaVacとカンシノ・バイオロジクス社の国産ワクチン2種類を承認した[158][159]。
2021年5月、世界保健機関は欧米以外のワクチンでは初めてシノファーム社のBBIBP-CorVの緊急使用を承認し[160]、有効性は79%と推定した[161]。
ロシア
[編集]2020年8月中旬にロシア政府が国内で製造されたワクチンを薬事承認し、10月以降医療従事者などを対象とした接種を開始する予定と発表した[162]。その後、8月11日にウラジーミル・プーチン大統領がガマレヤ記念国立疫学・微生物学研究センターの国産ワクチン「Gam-COVID-Vac」(スプートニクV)を世界に先駆けて認可したことを発表した[163]。
2020年11月11日、スプートニクVが発症を防ぐ有効性が92%に上ったとする最終第3段階の臨床試験の第1回中間結果をロシアは発表した[164]。
アメリカ合衆国
[編集]アメリカ合衆国連邦政府は2020年、ワクチンの研究・製造への補助や買取事前契約などに100億ドル以上を投じる「オペレーション・ワープ・スピード」(超高速作戦)を開始した[165]。アメリカ生物医学先端研究開発局はアストラゼネカ(イギリス)やサノフィ(フランス)など他国の製薬企業のワクチン開発も支援している[166]。
2020年1月21日、アメリカの感染症薬メーカー、ノババックス(Novavax Inc.) は、本ウイルスの感染予防のためのワクチンの開発を始めたと語った[167][168]。
2020年1月29日、米医薬品・日用品大手ジョンソン・エンド・ジョンソン (J&J) は、COVID-19 ワクチンの開発に着手したと発表した。エボラ出血熱のワクチン開発に利用した技術を応用する。このワクチンは現在、コンゴ民主共和国とルワンダで投与されている[169]。「すでに多数の研究者をワクチン開発に投入しており、1カ月以内には何らかの成果が出せると確信している。世界市場に向けた量産体制はすでに整っているので、ワクチンが完成すれば、1年以内に億単位の出荷が可能」という[170]。
2020年3月16日、アメリカ国立衛生研究所は、アメリカ国立アレルギー・感染症研究所とバイオ医薬企業のモデルナが開発していたmRNAワクチンが治験に至ったことを発表。治験は、ワシントン州シアトル市内で始まり[171]、同年5月18日までに複数の治験参加者から抗体を確認することができた[172]。全世界に1年間で5〜10億回分の供給を計画している[109]。
ファイザーのワクチンが2020年に供給開始予定。2021年までに数億人規模の接種を目指す。日本にはワクチンが完成した場合には、2021年6月までに1億2,000回分を供給することで、日本国政府と基本合意されている[109]。その後、2020年11月9日に初期の治験のデータが発表され、予防の有効性が90%越えとなった[173]。これを受け、2020年11月中にもアメリカの食品医薬品局に承認の申請を行う[173]。
ノババックスのワクチンは、1年に1億回分の生産を目標としている。生産はアメリカ合衆国の富士フイルム子会社と協力し、日本では武田薬品工業が原薬から製造し販売する予定[109]。
イギリス
[編集]アストラゼネカがオックスフォード大学と共同でワクチン開発を開始し、そ2020年4月より臨床試験を開始した。同年9月以降、翌21年にかけて10億回分の生産が可能と目され、5月の時点で既に4億回分(アメリカ3億回分、イギリス1億回分)の供給を9月から開始することが予定されていた[174]。その後に供給計画を20億回分に増加し、日本には1億2,000万回分、うち3,000万回分は2021年3月までに供給することをが日本国政府と基本合意された[109]。治験については、参加者の中に深刻な副反応の疑いが確認されたため、9月9日から中断していた[175] が、9月12日に再開したことを明らかにした[176]。
しかし、アストラゼネカのワクチンについてはその後、各国で懸念が示されることとなる。2021年1月29日にはフランスのエマニュエル・マクロン大統領が、同社製のワクチンは60 - 65歳以上の高齢者にはほぼ効果がないと発言し[177]、同国保健当局が2月2日に65歳以上の高齢者には接種しないよう勧告したのをはじめ、ドイツ、イタリア、スウェーデンの保健当局も高齢者への接種を行わないよう勧告した[178]。ただし、欧州医薬品庁(EMA)は全年齢層の成人への接種を推奨した[177]。
また2021年3月になってアストラゼネカ製のワクチンに接種後に血栓が発生するなどの副反応事例が報告されたためドイツ、フランス、イタリア、スペイン、デンマーク[179]、アイスランド、ノルウェー[180]、オランダ[181]、タイ[182] など接種を中断する国が続出した。3月15日にはWHOが同社製ワクチンと血栓の発生に因果関係は認められず、ワクチン接種を継続するようコメントを発表する事態となった[183]。これを受けフランスやドイツでは接種を再開した[184]。
アストラゼネカによる臨床試験では79%の有効性が確認されたと2021年3月22日に発表されている[184]。しかしアメリカ国立アレルギー・感染症研究所は、古い不完全な治験データが含まれていた可能性があると指摘し、最新の正確な情報を提供するよう要求。アストラゼネカも48時間以内の最新データ提供を表明した[185]。その結果、有効性は76%へと訂正された[186]。
フランス
[編集]2020年2月18日、フランスのサノフィは、米国保健福祉省 (HHS) の生物医学先端研究開発局 (BARDA) と協力して、COVID-19のための遺伝子組換えワクチンの速やかな開発を目指すと発表した[187]。アメリカ生物医学先端研究開発局からも支援を受けている[166]。
インド
[編集]インドでは国産ワクチン2種の接種が2021年1月16日に開始された。インドには世界最大級のワクチン製造機関であるインド血清研究所(SII)があり、輸出も行われているが、原材料はアメリカやEUからの輸入に頼っている[188]。
国内で流通するのは国内の製薬企業バーラト・バイオテック社とインド医学研究評議会が共同開発しSIIで製造されている「コバクシン」[188] と、アストラゼネカが開発しバーラト・バイオテックがライセンス生産する「コビシールド」であり、前者は承認段階で有効性を証明するデータが示されていなかった[189]。その後の治験では有効性81%と評価されている[190]。
中華民国
[編集]中華民国(台湾)では、メディジェン・ワクチン・バイオロジクス(中国語: 高端疫苗生物製剤、新竹県)がアメリカ国立衛生研究所の協力を得て開発したMVC COVID-19ワクチン対して2021年7月に緊急使用許可が出された。2021年8月23日に接種が開始され、蔡英文総統は同日早朝に率先して接種を受けた[191][192]。
蔡英文は、従来は中華人民共和国の妨害により、民間の調達や日本やアメリカからの無償供与以外では、ワクチンの輸入が難しかったと述べている[193]。
東南アジア諸国
[編集]ベトナムのナノジェン製薬バイオテクノロジーはベトナム軍医大学と共同で「ナノコバックス」を開発中であり、2021年2月に第2段階の治験、6月10日に最終段階の治験を開始した[194]。
インドネシアではアイルランガ大学など7つの研究機関が開発中[195]。
タイ王国ではタイ製薬公団(GPO)とマヒドン大学熱帯医学部が共同開発を進めている[195]。
イラン
[編集]イランの最高指導者アリー・ハーメネイーが2021年6月25日に接種を受けたワクチンは、イランで開発されている複数のワクチンのうち、同月に緊急承認されたものとイラン国営メディアにより報道された[196]。
キューバ
[編集]キューバは、WHO未承認であるものの国産ワクチンを製造しており、2021年9月16日には子供(2 - 11歳)にも接種対象を広げた[197]。
韓国
[編集]2022年6月29日、韓国政府はSKバイオサイエンス社が開発した新型コロナウイルスのワクチンSKYCovioneを認可したと発表した[198]。韓国の国産ワクチンの認可は初めて[198]。新型コロナのワクチンと治療薬両方を独自に開発・生産するのは米英に続き3カ国目[198]。当局によると、同ワクチンは冷蔵保管が可能で、超低温冷凍などは不要[198]。一方、オミクロン変異株などに対する有効性は「研究中」としており、具体的な供給計画は固まっていない[198]。
ワクチンの種類
[編集]2021年1月時点、COVID-19に対する有効なワクチンを作成するために、9つの異なる技術プラットフォーム(多数の候補の技術が未定義のまま)が研究開発中である[21]。
臨床試験中のワクチン候補のプラットフォームのほとんどは、COVID-19感染の主要抗原としてのコロナウイルススパイクタンパク質とその変異体に焦点を当てている[21]。2020年に開発されたプラットフォームには、核酸技術(ヌクレオシド修飾メッセンジャーRNAおよびDNA)、非複製ウイルスベクター、ペプチド、組換えタンパク質、弱毒化ウイルス、不活化ウイルスなどがある[3][11][67]。
COVID-19のために開発されている多くのワクチン技術は、インフルエンザを予防するために既に使用されているワクチンとは異なり、COVID‑19感染メカニズムの精度を高めるために「次世代」戦略を使用している[3][21]。いくつかの合成ワクチンでは、2P変異を利用してスパイクタンパク質を融合前構造に固定し、ウイルスがヒトの細胞に付着する前に免疫応答を刺激する[199]。開発中のワクチンプラットフォームは、抗原操作の柔軟性を高め、医療従事者、高齢者、子供、妊婦、免疫力が低下している人など、COVID-19の感染しやすい人々の感染メカニズムをターゲットとした効果が期待できる[21][67]。
-
SARS-CoV-2に採用されているワクチンのプラットフォーム。全ウイルスワクチンには、弱毒化されたウイルスと不活性化されたウイルスの両方が含まれる。タンパク質およびペプチドサブユニットワクチンは通常、免疫原性を高めるためにアジュバントと組み合わされる。SARS-CoV-2ワクチン開発では、三量体のスパイクタンパク質全体、または受容体結合領域(RBD)などの構成要素を使用することに重点が置かれている。複数の非複製ウイルスベクターワクチンが開発されており、特にアデノウイルスに焦点が当てられている。一方、複製ウイルスベクターのコンストラクトはあまり重視されていない[200]。
RNAワクチン
[編集]
RNAワクチンにはRNAが含まれており、組織に導入されるとメッセンジャーRNA(mRNA)として働き、細胞に外来タンパク質を作らせ、適応免疫反応を刺激して、対応する病原体やがん細胞を識別して破壊する方法を体に教える。RNAワクチンは、ヌクレオシド修飾メッセンジャーRNAを使用することがよくあるが、必ずしもそうとは限らない。mRNAの送達は、RNA鎖を保護し、細胞への吸収を助ける脂質ナノ粒子に分子を共製剤化することによって実現される[201][202][203][204]。この技術の開発は、ペンシルベニア大学の免疫学者、ドリュー・ワイスマンとカリコー・カタリンによる[205][206]。
RNAワクチンは、米国および欧州連合で認可された最初のCOVID-19ワクチンである[207][208]。2021年1月時点、このタイプの認可されたワクチンは、ファイザー - ビオンテックワクチン[209][210][211] とモデルナワクチン[212][213] である。2021年2月現在、EUではCureVac社のCVnCoV RNAワクチンが認可を待っている[214]。
重度のアレルギー反応はまれである。2020年12月、ファイザー - ビオンテックCOVID-19ワクチンの初回投与1,893,360回では、重度のアレルギー反応が175例発生し、そのうち21件がアナフィラキシーであった[215]。2020年12月および2021年1月に行われたモデルナ COVID-19ワクチンの4,041,396回の投与では、アナフィラキシーの報告は10件のみであった[215]。脂質ナノ粒子がアレルギー反応に関与している可能性が最も高い[215]。
アデノウイルス・ベクター・ワクチン
[編集]これらのワクチンは、SARS-CoV-2タンパク質をコードするDNAを含むアデノウイルス・シェルを用いた、非複製ウイルスベクターの例である[216]。COVID-19に対するウイルスベクターを用いたワクチンは、新しいウイルス粒子を生成するのではなく、全身の免疫反応を誘発する抗原のみを生成するという非複製性を持っている[216]。
2021年1月時点、このタイプのワクチンとして認可されているのは、英国のオックスフォード-アストラゼネカワクチン[217][218][219]、ロシアのスプートニクV[220]、中国のコンビディシア、そしてジョンソン・エンド・ジョンソンワクチンである[221][222]。
コンビディシアとジョンソン・エンド・ジョンソンのワクチンは、いずれもワンショットワクチンで、物流の煩雑さがなく、通常の冷蔵保存で数か月間保存できる[223][224]。
スプートニクVは、ジョンソン・エンド・ジョンソン社のワクチンと同じAd26を1回目に使用し、コンビディシアと同じAd5を2回目に使用しており、単回投与と同様の有効性を得ることができ、1回の投与で同じ効果があるか完全試験が行われている。
不活化ウイルスワクチン
[編集]不活化ワクチンとは、培養したウイルス粒子を熱やホルムアルデヒドなどの方法で死滅させることにより、病気を引き起こす能力を失わせ、かつ免疫反応を起こさせるワクチンである[225]。
2021年1月時点、中国のCoronaVac[226][227][228]、BBIBP-CorV[229]、IBP-CorV、インドのCovaxin、ロシアのCoviVac[230] が認可されている。臨床試験中のワクチンには、KMバイオロジクスやValneva社のワクチンがある[231][232]。
サブユニットワクチン
[編集]サブユニットワクチンは、病原体の粒子全体を導入することなく、1つまたは複数の抗原を提示する。抗原はしばしばタンパク質サブユニットであるが、病原体の断片であればどのような分子でもよいとされている[233]。
2021年4月時点、このタイプのワクチンとして承認されているのは、ペプチドワクチンのEpiVacCorona[234] とRBD-Dimer[235] の2つである。認可が保留されているワクチンには、Novavax COVID-19ワクチン[236] と、SOVERANA 02(コンジュゲートワクチン)、Sanofi-GSKワクチンがある。V451ワクチンは以前、臨床試験が行われていたが、その後のHIV検査で誤った結果を引き起こす可能性があることが判明したため中止された[237][238]。
自己増殖型RNAワクチン
[編集]自己増殖RNAワクチンや自己複製RNAワクチンと呼ばれる、自ら増殖や複製するワクチンである。次世代のRNAワクチンであり、接種後に体内でRNAを増やすタンパク質を増殖させ、自らRNAを増やすワクチンである。VLPセラピューティクス・ジャパンしたワクチンの場合、自ら増殖するため、レプリコンの粒子が127gあれば、日本の全人口に接種出来るだけのワクチンが作れる計算になるとされる。また、保管も4°Cの環境で1 - 2か月は保存可能であるとされる[239][240][241]。VLPセラピューティクス・ジャパン、大阪市立大学、国立国際医療研究センター、医薬基盤・健康・栄養研究所、大分大学などが開発中である[242]。他にも米国メリーランド州ボルチモアのElixirgen Therapeutics, Inc.(エリクサジェン・セラピューティックス社)が自己複製型RNAワクチン「EXG-5003」を開発し、日本では藤田医科大学(愛知県豊明市)にて、第 1/2 相臨床試験を開始している。
新型コロナウイルスのmRNAワクチンは、自己増殖型レプリコンワクチンと呼ばれる[243]。
2024年9月12日 厚生労働省薬事審議会医薬品第二部会が非公開で開催され、Meiji Seikaファルマ株式会社の「医薬品コスタイベ筋注用」の製造販売が承認された[244][245]。海外・国内臨床試験の日誌から記録・収集された副反応の発現割合から、これまでのmRNAワクチンと同様の下記副反応が見られた[246]。
| 頻度不明 | |
|---|---|
| 重大な副反応 | ショック、アナフィラキシー、心筋炎、心膜炎 |
| 10%以上 | 1~10%未満 | 1%未満 | |
|---|---|---|---|
| 局所症状(注射部位) | 圧痛(92.9%)、疼痛(83.8%)、腫脹(14.0%)、硬結(12.4%)、紅斑(12.4%) | そう痒感 | |
| 過敏症 | 発疹、過敏症、そう痒症 | ||
| 精神神経系 | 頭痛(39.0%)、めまい(19.2%) | 感覚鈍麻、傾眠 | |
| 心・血管系 | 動悸 | ||
| 消化器 | 下痢、悪心、嘔吐 | 腹痛、上腹部痛、軟便、腹部不快感 | |
| 呼吸器 | 鼻漏、咳嗽 | ||
| 筋・骨格系 | 筋肉痛(28.8%)、関節痛(26.7%) | 背部痛 | |
| 全身症状 | 倦怠感(44.8%)、悪寒(30.0%)、発熱(20.1%) | 異常感 | |
| 感染症 | 咽頭炎 |
2024年9月17日 武見敬三厚生労働大臣は、Meiji Seika ファルマの新型コロナウイルスワクチン「コスタイベ筋注用」について「安全性に問題なし」と述べた。[247]
その他の種類
[編集]臨床試験が行われているその他のワクチンには、ウイルス様粒子ワクチン、複数のDNAプラスミドワクチン[248]
経口ワクチンや経鼻ワクチンも開発・研究されている[257]。経鼻ワクチンについては、タデ藍(青森県産の『あおもり藍』)の葉から抽出したエキス(トリプタンスリン含有)が、ウイルスの細胞への侵入を防ぐ働きを持つことや、自然素材で副作用が少ないことから、藍の葉のエキスを配合した点鼻薬の市販化を目指している[258]。
終生免疫の獲得を目指したワクチンの研究開発もおこなわれており、東京都医学総合研究所が研究開発する天然痘ワクチンであるワクシニアウイルスを更に弱毒化したDIs株に、SARS-CoV-2遺伝子を組み込んだ遺伝子組換え生ワクチンや[259][260][261]、東京大学生産技術研究所が麻疹ウイルスをベクターとして用いた遺伝子組換え生ワクチンを研究開発している [262]。
科学者たちは、関連性のない疾患に対する既存のワクチンが、免疫系を活性化し、COVID-19感染の重症度を軽減できるかどうかを調査した[263]。結核用のBCGワクチンが免疫系に非特異的な作用を及ぼすという実験的証拠はあるが、このワクチンがCOVID-19に有効であるという証拠はない[264]。
有効性
[編集]
ワクチン有効性(vaccine efficacy)とは対照試験において、ワクチンを接種した被験者が病気にかかるリスクと、ワクチンを接種していない被験者が病気にかかるリスクを比較したものである[266]。有効性0%とは、ワクチンが効かないことを意味する(プラセボと同じ)。 有効性が50%の場合は、ワクチン未接種の人と比べてワクチン接種した人の感染症例が半分になることを意味する。
臨床試験は、異なる集団、地域、ウイルスの亜種を用いて実施されたため、異なるワクチンの有効性を比較するのは簡単ではない[267]。COVID-19の場合、ワクチン有効率が67%であればパンデミックを遅らせるのに十分かもしれないが、これはワクチンが感染を防ぐために必要な殺菌免疫(ウイルスを感染前に排除する免疫系の作用)を与えることを前提としている。ワクチン有効性は疾病予防を反映したものであり、無症状の人は感染力が強い可能性があるため、SARS-CoV-2の感染性を示す指標としては不十分である[268]。米国食品医薬品局(FDA)と欧州医薬品庁(EMA)は、COVID-19ワクチンの承認に必要な有効性として50%をカットオフ値として設定している[269][270]。現実的な集団ワクチン接種率を75%を目標とし、実際の基本再生産数に応じてCOVID-19ワクチンに必要な有効性は、流行を防ぐためには70%以上、社会的距離を置くなどの措置をとらずに流行を消滅させるためには80%以上であると予想されている[271]。
有効性の計算において、症候性COVID-19とは、一般的にPCR(ポリメラーゼ連鎖反応)検査が陽性であり、かつCOVID-19の症状の定義済リストのうち少なくとも1つまたは2つの症状を有するものと定義されているが、正確な仕様は試験によって異なる。国によってSARS-CoV-2変異株の有病率が異なるため、試験場所も報告された有効性に影響を与える。以下の範囲は、特に記載のない限り95%信頼区間であり、全ての値は年齢に関係なく全ての被験者に対するものである。重症化したCOVID-19に対する有効性は最も重要で、入院や死亡が公衆衛生上の負担となり、その予防が優先される[272]。認可・承認されているワクチンでは、以下のような有効性が示されている。
| ワクチン | COVID-19の重症度による有効性 | 臨床試験実施場所 | 参照先 | ||
|---|---|---|---|---|---|
| 軽度または中等度[注 1] | 入院や死亡を伴わない重篤な症状[注 2] | 入院や死亡を伴う重篤な症状[注 3] | |||
| モデルナワクチン | ~94% (89–97%)[注 4] | ~100%[注 5] | ~100% | United States | [273] |
| ファイザー - ビオンテックワクチン | ~95% (90–98%)[注 6] | Not reported | Not reported | Multinational | [274] |
| スプートニク・ライト | ~79% | Not reported | Not reported | Russia | [275] |
| スプートニクVワクチン | ~92% (86–95%) | ~100% (94–100%) | ~100% | Russia | [276] |
| オックスフォード-アストラゼネカワクチン | ~81% (60–91%)[注 7] | ~100% (72–100%) | ~100% | Multinational | [277] |
| ~76% (68–82%)[注 8] | ~100% | ~100% | United States | [278] | |
| BBIBP-CorV | ~79% | ~100% | ~100% | Multinational | [279] |
| CoronaVac | ~78% | ~100% | ~100% | Brazil | [280][281][282] |
| ノババックスワクチン | ~89% (75–95%) | ~100%[注 9] | ~100%[注 9] | United Kingdom | [283][284] |
| ~60% (20–80%) | ~100%[注 9] | ~100%[注 9] | South Africa | ||
| ジョンソン・エンド・ジョンソンワクチン | ~66% (55–75%)[注 10][注 11] | ~85% (54–97%)[注 12] | ~100%[注 13] | Multinational | [285] |
| ~72% (58–82%) | ~86% (−9–100%) | ~100% | United States | ||
| ~68% (49–81%) | ~88% (8–100%) | ~100% | Brazil | ||
| ~64% (41–79%) | ~82% (46–95%) | ~100% | South Africa | ||
| Covaxin | ~78% (61-88%) | ~100% | ~100% | India | [287][288] |
| Convidicea | ~66% | ~91% | Not reported | Multinational | [289][信頼性の低い医学の情報源?] |
- ^ 軽度の症状:発熱、乾いた咳、疲労感、筋肉痛、関節痛、喉の痛み、下痢、吐き気、嘔吐、頭痛、無嗅覚、無味覚、鼻づまり、鼻出血、結膜炎、皮疹、悪寒、めまいなど。中等度の症状:軽度の肺炎。
- ^ 個人の入院や死亡に至らない重篤な症状は、観察期間中の任意の時点で安静時に測定された以下の重篤な呼吸器症状のいずれかである(肺炎、深部静脈血栓症、呼吸困難、低酸素症、持続的胸部痛、食欲不振、錯乱、38℃以上の発熱のいずれかを有するが、入院や死亡に至るほどの持続性・重篤性はない)。呼吸数が30回/分以上、心拍数が125回/分以上、酸素飽和度(SpO2)が93%以下(海面上の室内空気)、または酸素分圧/吸気酸素分圧(PaO2/FiO2)が300mmHg未満のもの。
- ^ 入院や死亡の原因となる重篤な症状とは、病院での治療を必要としたり、死亡に至ったりするもの:呼吸困難、低酸素症、持続性胸痛、食欲不振、錯乱、38℃以上の発熱、呼吸不全、腎不全、多臓器不全、敗血症、ショック。
- ^ Mild/Moderate COVID-19 symptoms observed in the Moderna vaccine trials, were only counted as such for vaccinated individuals if they began more than 14 days after their second dose, and required presence of a positive RT-PCR test result along with at least two systemic symptoms (fever above 38ºC, chills, myalgia, headache, sore throat, new olfactory and taste disorder) or just one respiratory symptom (cough, shortness of breath or difficulty breathing, or clinical or radiographical evidence of pneumonia).[273]
- ^ Severe COVID-19 symptoms observed in the Moderna vaccine trials, were defined as symptoms having met the criteria for mild/moderate symptoms plus any of the following observations: Clinical signs indicative of severe systemic illness, respiratory rate ≥30 per minute, heart rate ≥125 beats per minute, SpO2 ≤93% on room air at sea level or PaO2/FIO2 <300 mm Hg; or respiratory failure or ARDS, (defined as needing high-flow oxygen, non-invasive or mechanical ventilation, or ECMO), evidence of shock (systolic blood pressure <90 mmHg, diastolic BP <60 mmHg or requiring vasopressors); or significant acute renal, hepatic, or neurologic dysfunction; or admission to an intensive care unit or death. No severe cases were detected for vaccinated individuals in the trials, compared with 30 severe cases reported in the placebo group (incidence rate 9.1 per 1000 person-years).[273]
- ^ Mild/Moderate COVID-19 symptoms observed in the Pfizer-BioNTech vaccine trials, were only counted as such for vaccinated individuals if they began more than 7 days after their second dose, and required presence of a positive RT-PCR test result along with at least one of the following symptoms: fever; new or increased cough; new or increased shortness of breath; chills; new or increased muscle pain; new loss of taste or smell; sore throat; diarrhea; or vomiting.[274]
- ^ 投与間隔が12週間以上の場合。6週間未満の間隔では有効性は約55%(33-70%)であった。
- ^ 投与の間隔は4週間。有効性は「症候性COVID-19の予防」とされている。
- ^ a b c d 試験で症例は検出されなかった。
- ^ 中程度の場合。
- ^ Efficacy reported 28 days post-vaccination for the Johnson & Johnson single shot vaccine. A lower efficacy was found for the vaccinated individuals 14 days post-vaccination.[285]
- ^ The source does actually say negative 9.
- ^ No hospitalizations or deaths were detected 28 days post-vaccination for 19,630 vaccinated individuals in the trials, compared with 16 hospitalizations reported in the placebo group of 19,691 individuals (incidence rate 5.2 per 1000 person-years)[285] and 7 COVID-19 related deaths for the same placebo group.[286]
ワクチン実効性
[編集]ワクチン実効性(vaccine effectiveness)に関する実社会での研究では、特定のワクチンが、理想的とは言えない日常的な条件下で、大規模な集団におけるワクチン接種者のCOVID-19の感染、症状、入院、死亡をどの程度防ぐことができたかを測定する[290]。
- イスラエルでは、2020年12月20日から2021年1月28日までの期間にモデルナまたはファイザー - ビオンテックのワクチンを接種した715,425人のうち、2回目の接種から7日後からの期間に、317人(0.04%)のみが軽度/中等度のCovid-19症状で発病し、16人(0.002%)のみが入院したことが確認された[291]。
- 米国疾病予防管理センターの報告書によると、ファイザー - ビオンテック社およびモデルナ社のCovid-19ワクチンは、非常に効果的な防御を提供する[292]。実際の環境下では、症状の状態にかかわらず、SARS-CoV-2感染に対して、完全免疫(2回目の投与から14日以上後)のmRNAワクチンの実効性は90%、部分免疫(1回目の投与から14日以上で2回目の投与前)のワクチン実効性は80%であった。
- 英国の104の病院に勤務する15,121人の医療従事者は、調査前に全員のCOVID-19抗体が陰性であったが、2020年12月7日から2021年2月5日まで、系統 B.1.1.7が優勢変異株として循環していた時期に、週2回の逆転写ポリメラーゼ連鎖反応(RT-PCR)検査で追跡調査を行った。この研究では、ワクチンを接種した90.7%のコホート(母集団)と、ワクチンを接種しなかった9.3%のコホートの陽性結果を比較し、ファイザー - ビオンテック社のワクチンは、全ての感染症(無症候性を含む)を、1回目の接種から3週間後には72%(58-86%)減少させ、2回目の接種から1週間後には86%(76-97%)減少させたことがわかった[293]。
- 2021年1月17日から3月6日まで、系統B.1.1.7が優勢変異株として循環していた時期に、イスラエルの一般住民を対象に行われた研究では、ファイザー社ワクチンにより、無症候性COVID-19感染症が94%、症候性COVID-19感染症が97%減少したことが明らかになった[294]。
- アメリカのメイヨー・クリニックの術前患者を対象とした研究では、mRNAワクチンが無症候性感染症に対して80%の防御効果があることが示された[295]。
- 中国疾病管理センターの所長である高福は、2021年4月10日に開催された会議で、中国製ワクチンは「防御率はあまり高くない」と認めた。民間企業であるシノバック社が開発したCoronaVacワクチンは、ブラジルでの臨床試験で有効率が50.4%にとどまることが判明した。トルコで行われた別の試験では、83.5%の実効性が示された。国営のシノファーム社によると、その2つのワクチンの有効率は79.4%と72.5%である[296]。
| ワクチン | COVID-19の重症度別の実効性 | 調査国 | Refs | ||
|---|---|---|---|---|---|
| 無症候 | 症候性 | 死亡 | |||
| ファイザー - ビオンテック | 〜86% (76-97%) | Not reported | United Kingdom | [293] | |
| 〜90% (68-97%) | 〜100%[i] | United States | [292] | ||
| 〜94% | 〜97% | Israel | [294] | ||
| モデルナ | 〜90% (68-97%) | 〜100%[i] | United States | [292] | |
| CoronaVac | Not reported | 〜67% (65-69%) | 〜80% (73-86%) | Chile | [297][298][299][300] |
| スプートニクV | Not reported | 〜98% | Not reported | Russia | [301][302] |
変異株に対する有効性
[編集]現行のCOVID-19ワクチンによって誘発される抗体応答に対して中程度または完全に耐性を持つSARS-CoV-2変異株が出現した場合、ワクチンの変更が必要になる可能性がある[303]。初期株用に開発された多くのワクチンが、症候性COVID-19の一部の変異株に対する有効性が低いことが試験で示されている[304]。2021年2月の時点で、米国食品医薬品局(FDA)は、FDAが認可した全てのワクチンはSARS-CoV-2の循環株に対する保護効果を維持していると捉えている[303]。
変異株は、回復者やワクチン接種者が獲得する中和抗体から逃避するリスクが懸念されているが、国立感染症研究所と日本医療研究開発機構の研究にて、新型コロナウイルス感染症(COVID-19)回復者の中和抗体の総量は時間と共に減衰するが、変異株に交差結合する抗体を獲得し、この抗体の質(中和比活性・交差性)は時間と共に向上することを発見した。この現象は、変異株へのワクチン戦略に重要な知見になるとしている [305][306]。
アルファ株(系統 B.1.1.7)
[編集]2020年12月、英国で新たな変異株である系統 B.1.1.7が確認された[307]。初期の結果では、ファイザー - ビオンテックワクチンとモデルナワクチンの両方が英国の変異株に対して保護することを示唆している[308][309]。
ある研究では、オックスフォード-アストラゼネカワクチンは、B.1.1.7に対して42〜89%の有効性を示し、B.1.1.7以外の変異株に対しては71〜91%の有効性を示した[310]。臨床試験の予備データによると、Novavaxワクチンは、オリジナルの変異株に対して〜96%、B.1.1.7に対して〜86%、南アフリカのB.1.351(501.V2 変異株)に対して〜60%の症状改善効果があることが示されている[311]。
ベータ株(系統 B.1.351/501.V2 変異株)
[編集]モデルナは、南アフリカの系統 B.1.351(501.V2 変異株)に取り組むための新しいワクチンの試験を開始した[312]。2021年2月17日、ファイザーはB.1.351の中和活性が2/3に低下したと発表したが、この変異株に対するワクチンの疾病予防効果については、まだ主張できないとしている[313]。B.1.351に対するモデルナおよびファイザーのワクチンを接種した患者からの血清の中和活性の低下は、その後、いくつかの研究で確認された[314][315]。4月1日、ファイザー - ビオンテックによる南アフリカでのワクチン試験の最新情報では、ワクチンの効果は今のところ100%(つまり、ワクチンを接種した被験者には症例が発生しなかった)で、プラセボ対照群では9件の感染のうち6件がB.1.351であったと述べられている[316]。
2021年1月、南アフリカでAd26.COV2.S ワクチンの臨床試験を実施したジョンソン・エンド・ジョンソンは、中等度から重度のCOVID-19感染に対する防御レベルは、米国で72%、南アフリカで57%であったと報告した[317]。
2月6日、『フィナンシャル・タイムズ』紙は、南アフリカのウィットウォーターズランド大学がオックスフォード大学と共同で実施した試験の暫定試験データで、オックスフォード-アストラゼネカワクチン(AZD1222)のB.1.351に対する有効性の低下を示したと報じた[318]。この研究では、2,000人のサンプルサイズにおいて、AZD1222 ワクチンは、COVID-19の最も重篤な症例を除く全ての症例において「最小限の保護」しか提供しないことが分かった[319]。2月7日、南アフリカ保健大臣はデータを検討し、どのように進めるべきかアドバイスを待つ間、約100万回分のワクチンの配備計画を中止した[320][321]。
ガンマ株(系統 P.1)
[編集]ブラジルで最初に同定された変異株である系統 P.1(20J/501Y.V3)は、ファイザー - ビオンテックによるワクチン接種の効果を部分的に免れている可能性がある[315]。
系統 B.1.617(デルタ株/カッパ株)
[編集]2020年10月、インドで新たな二重変異変異体が発見され、系統 B.1.617と名付けられた。2021年1月まではほとんど検出されず、4月には南極大陸と南米大陸を除く各大陸の少なくとも20カ国に広がった[322][323][324]。約15種ある定義された変異の中で、これにはスパイク変異D111D(同義)、G142D[325]、P681R、E484Q[326]、L452R[327] があり、後者の2つは容易に抗体を回避する原因になる可能性がある[328](※後述の系統 B.1.617.2にはG142DとE484Qの変異がなく、代わりにT478K変異がある)。
なお、亜系統として系統 B.1.617.1(カッパ株)、系統 B.1.617.2(デルタ株)、系統 B.1.617.3の3つがあり、系統 B.1.617.2はWHOなどにより懸念される変異株 (VOC) に指定されている。
デルタ株はウイルス量が多く、感染力が強いとされている。ワクチンを打っていたとしても従来株に比べ感染するリスクが高くなっている、一方でワクチンの効果により重症化リスクは低く抑えられている。また、ワクチン接種者が感染した場合でも、軽症や無症状であったとしても、ワクチン非接種者と同様に体内で大量に増殖しウイルスの感染源となる可能性が指摘されている[329]。
臨床試験および認可状況
[編集]第I相試験では、主に数十人の健康な被験者を対象に安全性と予備的投与量を試験し、第II相試験では、第I相試験の成功を受けて免疫原性、投与量レベル(バイオマーカーに基づく有効性)、および候補ワクチンの副作用を評価し、通常は数百人を対象としている。第I–II相試験は、予備的な安全性と免疫原性試験で構成され、通常は無作為化、プラセボ対照試験で、より正確で効果的な用量を決定する。第III相試験では通常、複数の施設でより多くの被験者が参加し、対照群を含めて、最適な用量で有害作用を監視しながら、病気を予防するためのワクチンの有効性を試験する(「介入試験」または「ピボタル試験」)[330][331]。第III相試験におけるワクチンの安全性、有効性、および臨床エンドポイントの定義は、副作用の程度、感染または感染量の定義、ワクチンが中等度または重度のCOVID-19感染を予防するかどうかなど、各社の試験によって異なる場合がある[332][333][334]。
進行中の臨床試験の計画は、試験でデータを蓄積することにより、治療法の有効性についての肯定的または否定的な早期の洞察が得られる場合には、適応デザインとして変更されることがある[335][336]。候補ワクチンに関する進行中の第II-III相臨床試験における適応デザインは、試験期間を短縮し、被験者数を減らすことができ、早期終了または成功の判断を迅速化し、研究努力の重複を回避し、国際的な拠点間での連帯試験(Solidarity trial)の計画変更について調整を強化する[335][337]。
認可または承認されたワクチンのリスト
[編集]各国の規制当局は、22種のワクチンの緊急使用許可を与えている。そのうち6つのワクチンは、少なくとも1つのWHO認定の厳格な規制当局によって緊急使用または一般使用が承認されている。
| ワクチン候補薬、開発者、出資者 | 開発国 | ワクチン種類(技術) | 接種間隔 | 保管温度 | 現在の相(被験者数) | 承認数 | 緊急使用許可数 |
|---|---|---|---|---|---|---|---|
| オックスフォードアストラゼネカCOVID-19ワクチン (Vaxzevria, コビシールド) [a][339][340][341] オックスフォード大学、アストラゼネカ、CEPI |
英国 | アデノウイルス ベクター (ChAdOx1) | 2回
4-12週 |
2-8℃ | 第III相 (30,000) | 2 | 143 |
| ファイザー - ビオンテックCOVID-19ワクチン (コミナティ, トジナメラン)[17][342][343] ビオンテック、ファイザー |
米国、ドイツ | RNA (modRNAを脂質ナノ粒子に分散) | 2回
3-4週 |
-70±10℃ |
第III相 (43,448) | 5 | 93 |
| スプートニクV COVID-19ワクチン (Gam-COVID-Vac) | ロシア | アデノウイルス ベクター (組み換えワクチン、Ad5およびAd26型) | 2回
3週 |
-18 ℃ (冷凍庫) | 第III相 (40,000) | 2 | 6 |
| モデルナCOVID-19ワクチン [346][347] モデルナ、NIAID、BARDA、CEPI |
米国 | RNA (modRNAを脂質ナノ粒子に分散) | 2回
4週 |
-20±5℃ (冷凍庫) | 第III相 (30,000) | 2 | 50 |
| BBIBP-CorV[348] シノファーム: 北京生物製品研究所 |
中国 | 不活化 SARS-CoV-2 (ベロ細胞) | 2回
3-4週 |
2-8℃ | 第III相 (48,000) | 4 | 50 |
| ジョンソン・エンド・ジョンソンCOVID-19ワクチン [349][350][351] ヤンセン ファーマ、ジョンソン・エンド・ジョンソン、BIDMC |
米国、オランダ | アデノウイルス ベクター (組み換えワクチン、Ad26) | 1回 | 2-8℃ | 第III相 (40,000) | 0 | 46 |
| CoronaVac[352][353][354] シノバック |
中国 | 不活化 SARS-CoV-2 (ベロ細胞) | 2回
2週 |
2-8℃ | 第III相 (33,620) | 1 | 32 |
| BBV152 (コバクシン) Bharat Biotech、インド医学研究評議会 |
インド | 不活化 SARS-CoV-2 (ベロ細胞) | 2回
4週 |
2-8℃ | 第III相 (25,800) | 0 | 14 |
| Ad5-nCoV (コンビディシア) CanSinoBIO, 中国陸軍医科学院[355][c] |
中国 | アデノウイルス ベクター (組み換えワクチン、Ad5) | 1回 | 2-8℃ | 第III相 (40,000) | 1 | 5 |
| EpiVacCorona[357] Vector Institute |
ロシア | サブユニット (ペプチド)[357] | 2回
3週 |
2-8℃ | 第III相 (40,000) | 1 | 2 |
| ZF2001(RBD-Dimer)[235]
Anhui Zhifei Longcom Biopharmaceutical Co. Ltd. |
中国 | サブユニットワクチン(組み換えワクチン) | 3回
30日 |
第III相 (29,000) | 0 | 2 | |
| WIBP-CorV
シノファーム: 武漢生物製品研究所 |
中国 | 不活化 SARS-CoV-2 (ベロ細胞) | 1回[要出典] | 第III相 (51,600) | 0 | 2 | |
| CoviVac[358]
The Chumakov Centre at the Russian Academy of Sciences |
ロシア | 不活化 SARS-CoV-2 | 2回
2週 |
2-8℃ | 第III相 (3,000) | 0 | 1 |
| QazCovid-in (QazVac)[359]
Research Institute for Biological Safety Problems |
カザフスタン | 不活化 SARS-CoV-2 | 2回
3週 |
2-8℃ | 第III相 (3,000) | 0 | 1 |
| スプートニク・ライト[360] | ロシア | アデノウイルス ベクター (組み換えワクチン、Ad26型)[361] | 1回 | 2-8℃ | 第III相 (7,000) | 0 | 3 |
| 高端(メディジェン)COVID-19ワクチン(英語: MVC-COV1901)[362]
Medigen Vaccine Biologics(中国語: 高端疫苗生物製劑), Dynavax Technologies[363] |
台湾 | サブユニットワクチン(S-2Pタンパク質+CpG 1018) | 2回
28日 |
2-8℃ | 第III相 (5,120) | 0 | 3 |
- ^ Oxford name: ChAdOx1 nCoV-19. Manufacturing in Brazil to be carried out by Oswaldo Cruz Foundation.[338]
- ^ Long-term storage temperature. The Pfizer–BioNTech COVID-19 vaccine can be kept between −25 and −15 °C (−13 and 5 °F) for up to two weeks before use, and between 2 and 8 °C (36 and 46 °F) for up to five days before use.[344][345]
- ^ Manufacturing partnership with the National Research Council of Canada and Canadian Center for Vaccinology, Halifax, Nova Scotia[356]
ヒト臨床試験中のワクチン候補
[編集]製剤
[編集]2020年現在、臨床開発中のワクチン候補のうち11種は、免疫原性を高めるためにアジュバントを使用している[21]。免疫アジュバントとは、COVID-19ウイルスやインフルエンザウイルスなどの抗原に対する免疫反応を高めるためにワクチンに配合される物質である[364]。具体的には、アジュバントを使用してCOVID-19ワクチン候補を製剤化し、その免疫原性と有効性を高めて、ワクチン接種を受けた個体におけるCOVID-19感染を低減または予防することができる[364][365]。COVID-19ワクチンの製剤化で使用されるアジュバントは、不活化COVID-19ウイルス、および組換えタンパク質ベース、またはベクターベースのワクチンを使用する技術において特に効果的となる可能性がある[365]。ミョウバンとして知られるアルミニウム塩は、認可されたワクチンに使用された最初のアジュバントであり、アジュバント化ワクチンの約80%で選択されるアジュバントである[365]。ミョウバンアジュバントは、炎症性サイトカインの放出を含む免疫原性を高めるために、多様な分子および細胞メカニズムを開始する[364][365]。
費用
[編集]ある専門家によると、COVID-19に対する効果的なワクチンは、世界的な経済的影響において何兆ドルもの節約となる可能性があり、したがって、数十億ドルの費用はそれに比べれば小さく見えるという[366]。 パンデミックの初期段階では、このウイルスに対する安全性・信頼性が高く、手頃な価格のワクチンを作成できるかどうかは知られておらず、ワクチン開発にどれくらいの費用がかかるかも正確には知られていなかった[11][68][85]。 成功せずに何十億ドルもの投資が行われる可能性もあった[84]。
効果的なワクチンが開発されると、数十億回分のワクチンを製造し、世界中に流通させる必要がある。2020年4月、ゲイツ財団は、製造と流通には250億米ドルもの費用がかかると見積もっている[367]。第I相臨床試験では、ワクチン候補の84 - 90%[67][368] が開発途中で最終承認に至らず、第III相臨床試験では25.7%が承認に至らない[368]。ワクチン候補に対する製造業者の投資額は10億米ドルを超え、先進的な製造契約を結んだ場合には何百万もの投与が無駄に終わる可能性がある[11][84][85]。
2020年11月現在、米国の「ワープ・スピード作戦(Operation Warp Speed)」プログラムの下で補助金を受けている企業は、初期価格をインフルエンザワクチンに合わせて1回あたり19.50米ドルから25米ドルに設定している[369]。 2020年12月には、ベルギーの政治家がワクチン生産者とEUの間で合意された機密価格を簡単に公表した[370]:
| 製造者 | ワクチン | EUにおける投与1回あたりの価格[371] |
|---|---|---|
| アストラゼネカ | オックスフォード-アストラゼネカCOVID-19ワクチン | €1.78 |
| ジョンソン・エンド・ジョンソン | ジョンソン・エンド・ジョンソンCOVID-19ワクチン | US$ 8.50 |
| サノフィ / GSK | €7.56 | |
| ファイザー / ビオンテック | ファイザー - ビオンテックCOVID-19ワクチン | €12.00 |
| CureVac | CureVac COVID-19ワクチン | €10.00 |
| R-Pharm | スプートニクV COVID-19ワクチン | US$ 10.00 |
| モデルナ | モデルナCOVID-19ワクチン | US$ 18.00 |
サプライチェーン
[編集]2021年以降にCOVID-19ワクチン接種を展開するには、100〜190億本(バイアル)の世界的な輸送と追跡が必要となる可能性があり、この取り組みは容易に史上最大のサプライチェーンの課題となる[11][372][373]。2020年9月の時点で、サプライチェーンとロジスティクス(物流)の専門家は、認可ワクチンを流通させるための国際的および国内的なネットワークが量・緊急性ともに対応する準備ができていないと懸念を表明している。その理由は主に2020年のパンデミックのロックダウンと供給能力を低下させるダウンサイジングの間のリソースの悪化が原因としている[372][374][375]。COVAX(The COVID-19 Vaccines Global Access)パートナーシップ、世界の製薬会社、契約ワクチンメーカー、国境を越えた輸送、保管施設、各国の保健機関など、多数の組織を調整することで直面している世界的な課題について、GAVIの最高経営責任者(CEO)であるセス・バークレーは次のように述べている。"何十億ものワクチンを効率的に全世界に届けるためには、サプライチェーンに沿った非常に複雑なロジスティックとプログラム上の障害を伴うことになる”[376]。
課題の大きさを強調する例として、国際航空運送協会は、COVID-19パンデミックを経験している200カ国以上の人々に1回分の投与量のみを輸送するだけでも、8,000機の747型貨物機(精密ワクチン保冷装置を導入)が必要であると述べている[377]。GAVIは、「動きの速いパンデミックでは、全員が安全でなければ誰も安全ではない」と述べている[80]。
ワクチン技術や初期段階の臨床研究への数十億ドルの投資とは対照的に、ワクチンのライセンス取得後のサプライチェーンは、同様な計画、調整、セキュリティ、または投資を受けていない[372][374][378]。主な懸念は、低・中所得国、特に子どもたちへのワクチン接種のためのワクチン流通資源が不足しているか、または存在しないということである[80][379]。9月には、COVAXのパートナーシップには、172カ国がCOVID-19ワクチンのサプライチェーンを最適化するための計画を調整することが含まれており[380]、国連児童基金(ユニセフ)はCOVAXと協力して、92の開発途上国における子どもたちのワクチン接種のための、資金調達とサプライチェーンを準備することになった[381][382]。
物流
[編集]ワクチン接種のための物流サービスは、必要な機器、スタッフ、国際的な国境を越えた認可ワクチンの供給を保証するものである[383]。物流の中核には、ワクチンの取り扱いとモニタリング、コールドチェーン管理、ワクチン接種ネットワーク内での流通の安全性などが含まれる[384]。COVAX施設の目的は、製造、輸送、および全体的なサプライチェーンのインフラを統合し、参加国間の物流資源を一元化し、平等に管理することである[80][378]。ワクチン予測とニーズ推定、国内ワクチン管理、無駄遣いの可能性、および在庫管理のための物流ツールが含まれている[384]。
COVID-19ワクチンの輸送中に国際的に実施される他の物流要因には、以下のものがある[372][385][386]:
- 個々のワクチンバイアルをバーコードによる可視化し、追跡可能にする(visibility and traceability)
- サプライヤー監査の共有化
- 製造から被接種者へのワクチンバイアル輸送証拠保全の共有化
- ワクチン温度監視ツールの使用
- 温度安定性試験と保証
- 新しい包装・配送技術
- 備蓄
- 各国内の物資調整(個人用保護具(PPE)、希釈剤、注射器、針、ゴム栓、冷凍庫の電源、廃棄物処理など
- 通信技術
- 各国の環境影響
あるワクチン開発者によると、いずれかの段階で物流が不足すると、サプライチェーン全体が脱線する可能性があるという[387]。ワクチンのサプライチェーンが失敗した場合、パンデミックの経済的・人的コストは何年にもわたって長期化する可能性がある[375]。
製造能力
[編集]2020年8月時点で、安全性と有効性の確立から数カ月が経過した段階で、いくつかのワクチン候補が第III相試験に入った段階にもかかわらず、多くの政府が50億米ドル以上の費用をかけて20億回分以上のワクチンを予約注文した[373][387][388]。英国政府からの2021年のワクチン予約注文は、1人当たり5回分であった[373]。9月には、CEPIは、2021年末までに認可された3種のワクチンを20億回分製造するという資金調達の約束の下、9種のワクチン候補の基礎研究と臨床研究を資金面で支援している[380]。2022年までに全体で70億〜100億回分のCOVID-19ワクチンが世界中で製造される可能性があるが、富裕国による大量の事前注文(「ワクチンナショナリズム」と呼ばれる)は、より貧しい国のワクチン利用を脅かすものである[11][373][387]。
インド血清研究所は、少なくとも10億回分のワクチンを生産する計画であるが、その半分はインドで使用されると述べている[373]。
中国は、10月にCOVAXに参加した後、2020年末までに6億回分のワクチンを生産し、2021年にはさらに10億回分のワクチンを生産することを明らかにしたが、14億人の自国の人口に対して何回分のワクチンを生産するのかは不明であった[389]。シノファーム社は、2021年に10億用量以上の生産能力を持つ可能性があると述べている[390]。Sinovac社は、2020年末までに第2の生産施設を完成させ、CoronaVacの生産能力をそれまでの3億用量から6億用量に引き上げることを目指していると述べている[391]。
アストラゼネカのパスカル・ソリオCEOは次のように述べている。"課題はワクチンそのものの製造ではなく、バイアルへの充填にある。世界には十分なバイアルが無い」[392] バイアル製造の高い需要に備えて、アメリカのガラスメーカーは7月にバイアル工場のために1億6,300万ドルを投資した。バイアル製造のためのガラスの入手可能性と、汚染物質の管理が懸念されているが[393]、手頃な価格のワクチンが求められる中、製造コストの上昇と開発者の利益の可能性の低下を示している[80][373][375]。
ワクチンは、国際的な規則を用いて取り扱われ、輸送され、ワクチン技術によって異なる温度管理された状態で維持され、保管中に劣化する前に予防接種に使用されなければならない[373][387]。COVID-19ワクチンのサプライチェーンの規模は、脆弱な集団への世界的な配送を確実にするために、膨大なものになると予想される[11][374]。このような流通のための施設を準備するための優先事項には、温度管理された施設や設備、インフラの最適化、予防接種スタッフの訓練、厳格なモニタリングが含まれる[374][376][381]。RFID技術は、製造業者からワクチン接種までのサプライチェーン全体に沿ってワクチンの投与量を追跡し、認証するために実施されている[394]。
2020年9月、グランドリバー・アセプティック・マニュファクチャリング社は、ジョンソン・エンド・ジョンソン社と、技術移転と充填・仕上げ製造を含むワクチン候補の製造を支援することで合意した[395]。2020年10月には、2020年12月に最初の投与量を製造する予定のパートナーであるロンザグループが、スイスのフィスプでワクチン候補のモデルナを製造することが発表された[396]。新たに建設された2,000平方メートルの施設では、年間3億投与量の製造が開始される予定である。ここで製造されたものは、製造の最終段階のために、スペインのLaboratorios Farmacéuticos Rovi SAに-70℃で冷凍出荷される予定である[396]。ニューハンプシャー州ポーツマスにあるロンザの拠点は、早ければ11月にも米国専用のワクチン原料の製造を開始することを目指している[396]。
コールドチェーン
[編集]ワクチン(およびアジュバント)は、温度変化に対して本質的に不安定であり、サプライチェーン全体を通してコールドチェーン管理を必要とし、通常は2〜8℃(36〜46°F)の温度で保たれる[386][397]。COVID-19ワクチンの技術は、いくつかの新しい技術の中でも多様であるため、コールドチェーン管理には新たな課題があり、凍結中は安定しているが熱に弱いワクチンもあれば、凍結すべきではないワクチンもあり、また温度を超えて安定しているワクチンもある[397]。凍結による損傷や、現地での接種プロセスにおける人員のトレーニング不足が大きな懸念事項である[398]。複数のCOVID-19ワクチンが承認された場合、ワクチンのコールドチェーンは、気候条件や温度維持のための現地資源が変化する、異なる国の間で、これら全ての温度感受性に対応しなければならない可能性がある[397]。シノファームとSinovacのワクチンは、既存のコールドチェーンシステムを使用して輸送できる第III相試験中の不活化ワクチンの例であるが、CoronaVac自体は凍結する必要はない[399][400]。
開発中のmodRNAワクチン技術は、大量生産や分解の制御が難しく、超低温での保管や輸送を必要とする場合がある[375]。例として、モデルナのRNAワクチン候補は、氷点下ぎりぎりの温度でコールドチェーン管理をおこなったとしたら保管期間が制限されてしまう。BioNTech-PfizerのRNA候補は、ワクチンの製造から接種までの輸送保管中、-70℃以下での保管を必要とする[401][402]。
ワクチンバイアルには数回分のワクチンが入っているが、はじめの投与のために穿刺された後は時間制限があり、それを超えると廃棄されなければならないため、現地での低温保管と接種プロセスの管理に注意を払う必要がある[11][403]。COVID-19ワクチンは、初期展開の間、多くの場所で供給が不足する可能性が高いため、保健当局、各機関および接種スタッフは、供給量が十分な他の一般のワクチンにおいては供給量の30%程度にものぼる腐敗・廃棄処分を、可能な限り回避する事が求められている[372][403]。
コールドチェーンはさらに、バイクやドローンなどの地方コミュニティにおけるワクチンの輸送の方法、ブースター投与の必要性、希釈剤の使用、医療従事者、子供、高齢者などの脆弱な人々へのアクセスによっても課題となっている[11][381][404]。
国によってはワクチンの長期保管に対応した超低温冷凍庫の数が限られていることや[405]、接種が夏期となるため冷凍庫から接種会場までワクチンを小分けして運べる保冷機材も必要となり、費用の負担が大きい[406]。コールドチェーンの末端では医薬品の専門家以外も多く関わることから、機材の不適切な取り扱いにより低温が維持出来なくなり廃棄に至った事例もある[407]。
航空輸送・陸上輸送
[編集]国際航空貨物の調整は、COVID-19ワクチンの、時間と温度に敏感な配布に不可欠な要素であるが、2020年9月の時点では、航空貨物ネットワークは多国籍展開の準備ができていない[374][377][408]。「COVID-19ワクチンを安全に届けることは、世界の航空貨物産業にとって今世紀の使命となるだろう。しかし、それは慎重な事前の計画なしには実現しない。そして、そのための時期は今だ。私たちは、各国政府に対し、物流チェーン全体での協力を促進するために主導権を握ることを強く求め、施設、セキュリティの手配、および国境手続きが、前途多難で複雑なタスクに備えられるようにする」と、国際航空運送協会(IATA)の事務局長兼CEOであるアレクサンドル・ドゥ・ジュニアックは2020年9月に発言した[408]。
2020年、旅客航空交通量の深刻な減少のために、航空会社は経費を抑えるため人員の削減(レイオフ)、路線の縮小、航空機の保管・売却などで対応していた[374][408]。WHO COVAX施設内でのCOVID-19ワクチンの調達と供給の主導機関として、GAVIアライアンスとユニセフは、これまでで最大かつ最速のワクチン展開に向けて準備を進めており、国際的な航空貨物輸送の協力、税関と国境管理、そして複数の国に1回分のワクチンを届けるための8,000機もの貨物機を必要とする可能性がある[381][408]。
安全保障と汚職
[編集]医薬品は世界最大の市場であり、年間約2,000億ドルの価値があるため、COVID-19ワクチンの広範な需要は、サプライチェーン全体で模倣品、盗難、悪徳商法、サイバー攻撃に対して脆弱である[378][409]。偽造ワクチンと本物のワクチンを識別し追跡するための技術的能力の低さ、アクセスの制約、効果的でない能力など、各国間で調和のとれた規制の枠組みが存在しないことは、ワクチン接種を受ける者の命を脅かす可能性があり、COVID-19のパンデミックを永続させる可能性がある[409][410]。包装資材に用いる追跡システム技術は、サプライチェーン全体でワクチンバイアルを追跡するため、製造業者によって使用されており[378]、また、ワクチン接種チームのセキュリティを保証するためにデジタルおよび生体認証ツールを使用している[394][411]。
2020年12月、インターポールは、犯罪組織がワクチンのサプライチェーンに潜入し、物理的手段で製品を盗み、情報窃盗を行い、さらには偽造ワクチンを供与する可能性があると警告した[412]。
国のインフラ整備
[編集]WHOは「効果的なワクチン管理」システムを実施しているが[413]、これには、ワクチン配布のための国・準国家の人員や施設を準備するための優先順位を構築することが含まれており、これには以下のようなものがある:
- 時間や温度に敏感なワクチンを扱うスタッフの育成
- ワクチンの保管と輸送を最適化するための堅牢なモニタリング機能
- 温度管理された設備・機器
- トレーサビリティ
- セキュリティ
個々の国内での効率的な取扱い、及び通関のための国境プロセスには、以下のものが含まれる[383][413]:
- 離陸と着陸の許可を容易にする
- 航空乗務員の検疫要件の免除
- 効率的な国内展開のための柔軟な運用の促進
- ワクチン温度要件を維持するための着陸優先権の付与
ワクチン有効期限
[編集]事例としてファイザー製(トジナメラン、ファイザー - ビオンテック、BNT162b2、コミナティ筋注)は超低温冷凍庫(マイナス90℃ - 60℃)での保管でも製造日から有効期限6か月[414](ただし、2021年9月10日発行の同ワクチンの添付文書第6版においては、マイナス90℃ - 60℃保管の場合の有効期限が6か月から9か月に延長されている[415])、一般低温冷凍庫で保管可能なモデルナ製(mRNA-1273、スパイクバックス筋注)でも現場到着後2 - 3か月程度が限度であり[416]、需要と供給を見据えた在庫・流通管理が重要となる。
2021年10月頃までに、一部の先進国では住民の2回目までの接種がある程度の割合まで一巡し、接種率の伸びが頭打ちになると共に、予め多めに確保していたワクチンに余剰が出る見通しがでてきた。欧米諸国では2021年末までに約2億回分が、日本でも2022年3月末までに約1億回分が有効期限切れに到達する見通しである。有効期限の迫った余剰ワクチンを不足する国へと国際的に融通しあう枠組みの構築が叫ばれている[417]。
ファイザー製では有効期限が9か月に延長されているが製品ごとに有効期限日が打刻されており既存品の期限延長は原則として行わない。ただし、島根県松江市では、専門医による同市の予防接種委員会の見解として有効性や安全性に問題なしとし、延長された期限内であれば問題ないとして今後も接種する方針である[418]。
ワクチンの確保・接種状況
[編集]世界の概況
[編集]2021年4月10日時点での世界でのCOVID-19ワクチンの接種状況は以下の通り[419]。
100人あたりの接種回数 / 累計接種回数
- イスラエル 112.5 / 10,189,198
- セーシェル 104.6 / 102,080
- UAE 89.1 / 8,707,073
- パラオ 74.6 / 13,435
- ブータン 61.7 / 470,976
- チリ 60.1 / 11,396,072
- 英国 56.1 / 37,736,162
- バーレーン 53.6 / 879,825
2021年3月下旬時点で、日本の100人あたりのワクチン接種回数は0.4回であり、OECDの37か国中で最下位であった[420][421]。
2021年9月5日時点での世界でのCOVID-19ワクチンの接種状況は以下の通り[419]。
100人あたりの接種回数 / 累計接種回数
- イスラエル 155.2 / 14,050,538
- セーシェル 147.0 / 143,490
- UAE 187.7 / 18,339,225
- パラオ 162.0 / 29,165
- ブータン 137.0 / 1,045,074
- チリ 154.8 / 29,331,816
- 英国 137.0 / 92,213,900
- バーレーン 152.3 / 2,499,774
2021年9月5日時点で、日本の100人あたりのワクチン接種回数は107.5回であり、3月から半年足らずで累計1.3億回を超えて急速に進んだ[419]。
日本
[編集]日本国内のワクチン接種率に関しては、2021年10月4日時点で、ワクチンの2回目接種済人数が全人口の60.9%、1回目完了では71.3%であった[422]。NHK報道によるイギリスの統計任意団体「Our World in Data」の調べによれば、各国の保健当局が予定した接種回数(通常2回、国により3回)までの接種率(接種済人数の人口比統計)では、日本は同年10月17時点統計で66.47%と、イギリスの65.7%、ドイツの65.15%、米国の56.17%を抜いており世界的にも遜色のないレベルとなっている[423]。
イスラエル
[編集]2021年3月時点でも4月時点でも人口当たりのCOVID-19ワクチンの接種率が世界一となっているのはイスラエルである。ユダヤ人ディアスポラとのコネクションを通じてファイザー社の経営幹部から大量のワクチンの優先的な提供を受ける約束をリークすることにより、政治的不安定に直面するネタニヤフ首相の挽回戦略だとメディアが分析した[424][425]。2021年8月に3回目接種を、2022年1月3日に4回目接種を開始した[426]。
イスラエルのコロナワクチン対策専門家チーム代表で、イスラエル国内最大の保健機構「クラリット」のチーフ・イノベーション・オフィサーでもあるラン・バリチェルが2021年3月24日に、日本記者クラブ主催のリモート講演会で語ったところによると[427]、「昨年(2020年)の12月19日から高齢者優先で始まったワクチン接種は、16歳以上の全住民に対象が拡大され、イスラエル国民約920万人の60%が既に既に接種済みで、50%が2回接種済み。特に50歳以上は80%が2回目の接種を受けており、高齢者はワクチンで守られている[427]」とのことであり、イスラエルが世界で最も早くワクチン調達できた理由は「昨年の12月より前にワクチンメーカーと事前購入契約を結んでいた。さらに感染が増えた場合にはファイザーや、ほかのメーカーと優先的に提供してもらう契約をしていた。」と説明[427]。そして「その代わり、感染に関するデータは世界で共有するという条件が付いていた。つまりイスラエルがワクチン接種の『テストベッド』になることで大事なワクチンをより早く調達できた」と説明した[427]。
イスラエルでのワクチン接種のしかたについては、「イスラエルではワクチン接種するためにワクチンクリニックを各地にオープンした[427]」と言い、数百というクリニックを1週間でイスラエル全土に展開した、という。大きな病院や広場にテントを張るなどしてクリニックを設営し、接種を受けた人の管理は、20年前にデジタル化した電子カルテを使って行い、誰が接種を受けたか、2回目の接種の日時の案内も1回目を受けた時点で決まるようにした、と言い、イスラエルではデジタル化が進展していることが効率的なワクチン接種に大いに役立ったと明かした[427]。また「透明性の確保が重要だった。われわれが知っていることと、分からないことをクリアなメッセージとして隠さず国民に伝えた[427]。」と語った。
接種を促進する手法については「接種を受けた人には『グリーンバッジ』を付けてもらっている。」と説明。「スマホで接種を受けたことを証明するマークを受信しておけば、レストランの店内で食事ができ、コンサートや文化イベント等にも参加可。それに対して、接種を受けていない人はレストランの店外でしか食事ができないとするなど、接種を受けた人と受けてない人に違うルールを適用したことで、経済活動を安心して再開することができ、接種を増やすインセンティブにもなった」と説明[427]。
アメリカ合衆国
[編集]アメリカ合衆国は2021年7月時点で、総人口に対するワクチン接種率が49%で頭打ち傾向にある。アメリカ合衆国大統領ジョー・バイデンは同年7月29日の演説で、アメリカ合衆国連邦政府の財政負担により、各地方当局がワクチン接種者に100ドルを給付して接種を促すよう呼びかけたほか、連邦政府の職員と取引企業従業員に対する接種状況開示の義務化を表明した[428]。
ワクチン接種者・非接種者の処遇
[編集]COVID-19ワクチンを接種済みであるか未接種であるかの明示や、職種によっては接種を義務化する国もあり、医学的な理由や自由意思で接種を受けない人との取り扱いの差をどうするかという課題も浮上している。米国政府は2022年1月4日から、従業員数が100人以上の企業など接種を義務付けると2021年11月4日に発表した[429]。これに先立って、同国ニューヨーク市が接種しない職員の無給休暇扱い(医学・宗教上の理由を除く)を表明したところ、抗議デモが起きた[430]。
日本では厚生労働省が雇用や求人における指針をホームページで公表しており、接種拒否だけを理由とした解雇や雇い止めは許されないといった基準を示している[431]。
ワクチン・パスポート
[編集]COVID-19ワクチンの接種証明書(ワクチン・パスポート)を発行する国もあり、2021年2月に世界で最も接種が進んでいるイスラエルが、翌3月には中国が開始[432] し、各国もこれに続くとされている。同年4月1日時点でヨーロッパの一部諸国(アイスランド、エストニア、キプロス、ジョージア、ポーランド、ルーマニア)、中南米でグアテマラやベリーズ、エクアドル、インド洋の島国セイシェルといった国々が、ワクチン・パスポート保持者の旅行入国解禁を開始している。但し、国によっては接種したワクチンの製薬会社によって有効・無効の違いがある[433]。
また、ワクチン・パスポートを得るために渡航するワクチンツーリズムも始まっている[434]。
日本では、2021年7月26日から、海外渡航者を対象に、ワクチン接種の事実を公的に証明する証明書の交付申請の受け付けを各市区町村で開始する。ただし、日本への帰国時の検疫措置の緩和はない[435]。
子供への接種
[編集]何歳から接種対象とするかの判断は国によって分かれるが、デメリット(副反応)よりもワクチンを接種するメリット(重症化予防、家族への感染拡大予防など)が大きく上回るという判断は各国で共通している[436][437]。
アメリカやカナダ、フランス、イスラエル、日本などでは全ての5 - 11歳の小児にワクチンの接種を推奨している[438][437]。アメリカでは2022年5月に5 - 11歳への3回目のブースター接種が推奨され、6月には生後6カ月からの接種が推奨された[439][440]。カナダや香港でも2022年8月から生後6カ月からの接種が始まった[441][442]。
2022年8月11日時点でオーストラリアの5 - 15歳の2回接種率は約55%[443]、アメリカの5 - 11歳の2回接種率は30.1%[444]、カナダの5 - 11歳の2回接種率は42.44%[445]、日本の5 - 11歳の2回接種率は18.5%となっている[446]。
EU諸国における2022年8月11日時点の5 - 9歳の2回接種率は、スペイン31.3%、ポルトガル31.0%、デンマーク28.8%、アイスランド28.1%、オーストリア22.0%、アイルランド20.6%である[447]。ドイツは、健康な5 - 11歳の子どものほとんどが1度はCOVID-19に感染したことがあるため、1回の接種で十分に免疫を獲得できるとし、すべての子どもに1回の接種を推奨している[448][449]。また、基礎疾患を持つ子どもは3回目のブースター接種を、リスクのある人と同居・接触する子どもには2回の接種を推奨する[448][449]。ドイツの5 - 11歳の接種率は2022年5月24日時点で22%である[450]。
賠償責任
[編集]いくつかの政府は、以前のパンデミックのように、COVID-19ワクチンおよび治療薬に関する過失請求からファイザーやモデルナなどの製薬会社を保護することに合意し、政府もその責任を負った。
2020年2月4日、アメリカではアレックス・アザー米保健福祉長官がCOVID-19に対する医療対策として「公共の準備と緊急事態への備えに関する法律」に基づく通知を公表した[451]。宣言は「COVID-19、またはSARS-CoV-2やその変異ウイルスの感染の治療、診断、治癒、予防、緩和に用いられるあらゆるワクチン」を対象に、「故意の不法行為がなければ、ワクチン製造における製造者の過失、または誤った用量を処方した医療従事者の過失を主張する賠償請求は、除外される」としている[451]。この宣言は米国では2024年10月1日まで有効である[451]。
2020年12月、英国政府はファイザーにCOVID-19ワクチンに関する法的補償を与えた[452]。欧州連合では、COVID-19ワクチンは、民事および行政責任の請求から製造者を免除しない条件付き販売認可の下で認可されている[453]。ワクチン製薬会社との購買契約は秘密のままであるが、認可の時点で知られていなかった副作用に対しても、責任免除の内容は含まれていない[454]。
日本においては、他のワクチンと同様に副反応による健康被害が起きた場合、予防接種法に基づく国の救済制度の対象とされる[455]。
2024年4月17日、日本では、新型コロナワクチン接種後の健康被害について国民に広報せず、国が接種を推し進めたとして、ワクチンの接種後に亡くなった人の遺族や健康被害を訴える患者らが、総額約9150万円の賠償を国に求める集団訴訟を東京地裁に起こした[456][457][458][459]。
誤った情報
[編集]SNSでは、COVID-19ワクチンが利用できなかった時期に「既に利用可能である」という陰謀論も見られた。様々なSNSの投稿で引用された特許には、SARSコロナウイルスなどの他の株の遺伝子配列やワクチンに関する既存の特許が参照されているが、COVID-19については参照されていない[460][461]。
2020年5月21日、「nCoV19 spike protein vaccine」と称するワクチンを販売していた、米国シアトルに本拠を置くNorth Coast Biologics社に対し、アメリカ食品医薬品局(FDA)は中止通知を送ったことを公表した[462]。
オーストラリア戦略政策研究所(ASPI)は、西側で開発されたワクチンに関わるフェイクニュースあるいはプロパガンダを中国・ロシアが流布していると主張している[463][464]。国際的なNGO「デジタルヘイト対抗センター」は、英語圏で反ワクチン発信をするインフルエンサーが広告などで巨額の利益を得ている可能性を指摘している[465]。
他のワクチンに関するデマとしては、次のようなものが挙げられる。
- 不妊になる[466][467][注 1]。
- コロナワクチンにはRFIDタグやマイクロチップが混入されており[469]、政府がタグやチップを埋め込んで人間を管理する[470]。
- コロナワクチンを接種するとBluetoothを通じて周辺機器にインターネット接続される[469]。
- 5G通信に接続される[471]。
- 身体が磁石になる[471]。
- ヒト免疫不全ウイルス(HIV)に感染する[470]
- 自閉症を引き起こす[470]。
- mRNAワクチンを接種したらヒトDNAが改変される[469]。
- 政府が遺伝子操作しようとしている[470]。
2021年7月19日の読売新聞オンラインの報道[472] では、「英NPO『反デジタルヘイトセンター(CCDH)』の調査によると、SNS上のワクチンに関するデマの65%は、12の個人・団体が発信源」とし、発信源には元アメリカ合衆国司法長官ロバート・F・ケネディの息子のロバート・F・ケネディ・ジュニアも含まれるとしている。対策として、FacebookやTwitterで、保健機関が否定した情報の削除、リツイートや「いいね」機能の停止などの措置が行われている[470]。
ターボ癌
[編集]ターボ癌(英: Turbo cancer)とは、「新型コロナウイルスワクチンをはじめ、mRNAワクチンを接種することによって人間の免疫機能が破壊され癌が発生する。または進行を加速(ターボチャージャー)させる」という反ワクチン神話である。「mRNAワクチン誘発性急速転移癌」と呼称する者もいるが、いつ誰が命名したのかは不明である。正式な医療用語ではなく、都市伝説の類に属する。ファクトチェックチームが検証を依頼した医師たちはこの主張を否定し、「何の根拠もない情報。癌患者がコロナウイルス流行前に比べて増加したり、進行したがん患者が増えているのは、コロナウイルスの流行により癌検診が行えず発見が遅れたり、治療開始が遅くなったりしたことによるものによる可能性が高い」としている。ターボ癌の存在を主張する者は、具体的な情報源を明らかにしない、適切な根拠を明示しない、統計情報の有意な変化というかたちで主張の裏付けがないなどの理由で信用されていない。
「新型コロナウイルスには、例え軽症であっても心臓病など様々な病気のリスクを高める後遺症がある」という研究結果があるが[473]、肯定する者たちは問題の原因が感染の後遺症によるものなのか、ワクチンによるものなのかの検証をしないまま、ワクチンが原因であるとしている。
そして、著名人が癌で亡くなる度に、ターボ癌を肯定する医師や学者の主張を根拠に「新型コロナウイルスワクチンを接種したことによって、ターボ癌で死亡した」とSNSや動画サイトなどで主張する者達がいる。「ターボ癌はの存在を裏付ける科学的根拠・論文・統計情報は存在しない」と否定しても、ターボ癌の存在を主張する者達は「ワクチンは毒であり、その薬害を隠すための情報操作である」などの陰謀論を主張している。こうした主張をする者は世界中におり、日本国内にも多数存在している[474]。
日本での誤情報
[編集]日本では医療従事者へのワクチン先行接種が始まったのとほぼ同時期の2021年2月頃から「ワクチン接種で不妊になる」旨のTwitter投稿が拡散し始めた。その半数は7つのアカウントが起点になっており(東京大学教授鳥海不二夫の分析による)、他の主張も反グローバリズムや陰謀論の傾向がみられた[466]。
武田邦彦はYouTubeの番組で、イギリスのワクチン接種の結果から「日本の高校生320万人全員にワクチンをうったら、確率的には50人が死亡するか、それに相当する副作用に見舞われる」と発言した。しかし、イギリスにおいて、ファイザー社・アストラゼネカ社のワクチンを接種したこととの因果関係が認められる死亡例や、それに相当する副反応は報告されておらず、武田の発言は誤りである[475]。
また、日本国内においてはしばしば厚生労働省が発表する接種後の死者数を引用して「COVID-19ワクチン接種後に多くの人が死亡しており危険」などという風説が流布されることがある[476]が、厚生労働省が公開している事例はあくまで副反応疑い報告制度に基づき報告のあったものの件数であり、ワクチン接種直後に死亡した者の総数とも、あるいは接種と死亡の因果関係が認定された者の総数とも一致しない[477][注 2]。
似たような風説で、「厚生労働省が発表するCOVID-19ワクチン接種後の死亡者の殆どは、接種と死亡の因果関係が不明と結論づけられており、このようなワクチンは信用できない」というものもある[478]が、これは日本国内における行政解剖の件数が極めて少ないという、COVID-19ワクチンに限らない問題が原因でもあり[479]、インフルエンザワクチンにおいても同様の事象がかねてより発生している[480]。ただし、上記の通り解剖による直接的な死因究明があまり行われていないことは事実ではあるものの、プラセボ対照試験においてワクチン群ととプラセボ群の間に重篤な有害事象の発現頻度の差がないことは既に実証されている[481]。
なお、副反応疑い報告制度に基づいて報告のあった案件は、厚生労働省の審議会に報告され、専門家による審査が行われる[482]が、2021年10月時点で、日本国内においてCOVID-19ワクチンの接種と死亡に因果関係が認定されたケースは皆無である[483]。 このため厚生労働省では「安全性において重大な懸念は認められない」との評価を下しており[484]、一般市民向けのQ&Aサイトにおいては「新型コロナワクチンの接種が原因で多くの方が亡くなったということはありません。」と説明している[485]。
大阪の通天閣のネオンサインを「治験中 射ったらあかん」「射っちゃダメだよ」〔ママ〕と改竄した2枚の画像が、2021年11月にTwitter上で拡散された。COVID-19ワクチンを接種しないよう呼びかけるために改竄したとみられ、運営会社は公式Twitter上で「悪質なデマ」として注意喚起している[486][487]。
ワクチンに関する真偽不明あるいは明らかな誤情報の拡散は反ワクチン思想や陰謀論を主張する一般アカウントにとどまらず、同様の思想を持つ医療関係者、研究者、論客のほか政治家といった公人による発信もしばしばみられる。
その中でも、元内閣総理大臣の鳩山由紀夫は2022年7月13日に自身のTwitterで、(医師から聞いた話として)「WHOがワクチンを打った人の方が打たない人より3倍入院する確率が高いことを認めたとのこと。ファイザーは大量のデータを消したとの内部告発も発表された。今までワクチン利権は聞いていたが、陰謀論と切り捨てられるようなものではないことが明らかになった」とツイートし、投稿がSNS上で拡散された。これに対し、元新型コロナワクチン接種推進担当大臣の河野太郎は「元首相がワクチンデマを流していた。いったい何が起きたんだろう」と鳩山を批判するツイートを行い、BuzzFeed Japanによるファクトチェックにおいても、鳩山のツイートは専門家によって事実が否定されており、「国民の命・健康と生活に関わる情報については特に、情報の真偽と発信が及ぼす影響について、発信者も十分に注意することが大切であり、元首相のように影響の大きな人物は自らの発する情報の正確性には十分注意してほしいと思います」と釘を刺している[488]。 しかし、その後も鳩山は9月14日にTwitter投稿でも「白澤卓二先生(国際予防医学協会理事長)にあらためて訊きました。WHOがワクチンで重症になる確率はコロナで入院する確率の3倍とWHOが認めたのは事実ですかと。河野太郎大臣はデマと否定されましたがと。白澤先生は事実ですと答えられました。私はアンチエイジングの権威の白澤先生の言葉を信じます」と再びワクチン接種に対する根拠の乏しい持論を展開し、各メディアのファクトチェックでも誤りとされるなど、総理経験者でもある鳩山の科学的根拠に基づかない軽率なツイートに対して、専門家などから厳しい批判が続いている[489]。
脚注
[編集]注釈
[編集]- ^ COVID-19ワクチンが不妊を引き起こすという主張を根拠なく行っている人物としてはマイケル・イードンらが挙げられる[468]。
- ^ このページ中程には「ワクチン接種との因果関係が示されていない症状も含め、幅広く評価を行うため、当面の間、以下の症状について、報告を積極的にご検討ください。」と記載があり、報告のあった案件の全てが必ずしもワクチン接種との因果関係があるものではない。また同ページには「アナフィラキシーの診断に至らない症状で、報告基準にも該当しない場合には、報告の対象にはなりません。」との記載があり、例えば接種を受けた直後に交通事故による出血多量で死亡したような場合は、当然ながら報告の対象とはならない。
出典
[編集]- ^ 新型コロナワクチンについて > 開発状況について 厚生労働省(2021年5月25日閲覧)
- ^ 「ワクチン義務化に賛否 オーストリア可決、米は差し止め」日本経済新聞ニュースサイト(2022年1月21日)同日閲覧
- ^ a b c Diamond, Michael S; Pierson, Theodore C (13 May 2020). "The challenges of vaccine development against a new virus during a pandemic". Cell Host and Microbe. 27 (5): 699–703. doi:10.1016/j.chom.2020.04.021. PMC 7219397. PMID 32407708。
- ^ Padilla, Teodoro (24 February 2021). “No one is safe unless everyone is safe”. BusinessWorld 24 February 2021閲覧。
- ^ "新型コロナの開発中ワクチン、有効性を確認". 福井新聞. 19 May 2020. 2020年5月26日閲覧。
- ^ "More than 150 countries engaged in COVID-19 vaccine global access facility". WHO. 15 July 2020. 2020年12月11日閲覧。
- ^ “新型コロナ、最初のワクチンは感染防がない可能性-重症化防止に重点”. Bloomberg. (2020年6月15日)
- ^ 「新型コロナワクチンが高齢者に効きにくい可能性」NATIONAL GEOGRAPHIC(2020年7月21日)
- ^ "インフルワクチン製造に使うニワトリ、米秘密農場で飼育 コロナには望み薄". CNN. 18 April 2020. 2020年4月18日閲覧。
- ^ "新型コロナウイルス 治療薬・ワクチンの開発動向まとめ【COVID-19】". News answers. 17 April 2020. 2020年4月18日閲覧。
- ^ a b c d e f g h i j k Gates, Bill (30 April 2020). "The vaccine race explained: What you need to know about the COVID-19 vaccine". The Gates Notes. 2020年5月14日時点のオリジナルよりアーカイブ。2020年5月2日閲覧。
- ^ "CEPI welcomes UK Government's funding and highlights need for $2 billion to develop a vaccine against COVID-19". Coalition for Epidemic Preparedness Innovations, Oslo, Norway. 6 March 2020. 2020年3月22日時点のオリジナルよりアーカイブ。2020年3月23日閲覧。
- ^ a b c Wake, Damon (4 May 2020). "EU spearheads $8 billion virus fundraiser". Yahoo Finance. 2020年6月29日時点のオリジナルよりアーカイブ。2020年5月4日閲覧。
- ^ a b c "Update on WHO Solidarity Trial – Accelerating a safe and effective COVID-19 vaccine". World Health Organization. 27 April 2020. 2020年4月30日時点のオリジナルよりアーカイブ。2020年5月2日閲覧。
It is vital that we evaluate as many vaccines as possible as we cannot predict how many will turn out to be viable. To increase the chances of success (given the high level of attrition during vaccine development), we must test all candidate vaccines until they fail. [The] WHO is working to ensure that all of them have the chance of being tested at the initial stage of development. The results for the efficacy of each vaccine are expected within three to six months and this evidence, combined with data on safety, will inform decisions about whether it can be used on a wider scale.
- ^ "UK medicines regulator gives approval for first UK COVID-19 vaccine". Medicines and Healthcare Products Regulatory Agency, Government of the UK. 2 December 2020. 2020年12月2日閲覧。
- ^ “Bahrain second in the world to approve the Pfizer/BioNTech Covid-19 vaccine”. Bahrain News Agency. (4 December 2020) 9 December 2020閲覧。
- ^ a b "Regulatory Decision Summary - Pfizer-BioNTech COVID-19 Vaccine". Health Canada, Government of Canada. 9 December 2020. 2020年12月9日閲覧。
- ^ "Drug and vaccine authorizations for COVID-19: List of applications received". Health Canada, Government of Canada. 9 December 2020. 2020年12月9日閲覧。
- ^ Zimmer, Carl; Corum, Jonathan; Wee, Sui-Lee (2020年6月10日). “Coronavirus Vaccine Tracker” (英語). The New York Times. ISSN 0362-4331 2020年12月10日閲覧。
- ^ a b "COVID-19 vaccine development pipeline (Refresh URL to update)". Vaccine Centre, London School of Hygiene and Tropical Medicine. 30 November 2020. 2020年12月2日閲覧。
- ^ a b c d e f g h i j Le, Tung Thanh; Cramer, Jakob P.; Chen, Robert; Mayhew, Stephen (4 September 2020). "Evolution of the COVID-19 vaccine development landscape". Nature Reviews Drug Discovery. 19 (10): 667–68. doi:10.1038/d41573-020-00151-8. ISSN 1474-1776. PMID 32887942。
- ^ "COVID-19 vaccine tracker (Choose vaccines tab, apply filters to view select data)". Milken Institute. 16 November 2020. 2020年11月9日閲覧。
- ^ "Draft landscape of COVID 19 candidate vaccines". World Health Organization. 12 November 2020. 2020年11月16日閲覧。
- ^ Beaumont, Peter (2020年11月18日). “Covid-19 vaccine: who are countries prioritising for first doses?” (英語). The Guardian. ISSN 0261-3077 2020年12月26日閲覧。
- ^ Plotkin SA, Halsey N (January 2021). "Accelerate COVID-19 Vaccine Rollout by Delaying the Second Dose of mRNA Vaccines". Clinical Infectious Diseases. doi:10.1093/cid/ciab068. PMC 7929065. PMID 33502467。
- ^ Epperly, David (January 2021). "Evidence For COVID-19 Vaccine Deferred Dose 2 Boost Timing". SSRN 3760833。
- ^ Wang X (February 2021). "Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine". N Engl J Med (letter). 384 (11): 1576–78. doi:10.1056/NEJMc2036242. PMID 33596350。
- ^ "More Evidence: Evidence For COVID-19 Vaccine Deferred Dose 2 Boost Timing". ReallyCorrect.com. 2021年5月13日閲覧。
- ^ "Coronavirus (COVID-19) Vaccinations - Statistics and Research". Our World in Data. 2021年2月7日閲覧。
- ^ "Which companies will likely produce the most COVID-19 vaccine in 2021?". Pharmaceutical Processing World. 5 February 2021. 2021年3月1日閲覧。
- ^ "China can hit 500-mln-dose annual capacity of CanSinoBIO COVID-19 vaccine this year". Yahoo! Sport. 2021年3月1日閲覧。
- ^ Mullard, Asher (30 November 2020). "How COVID vaccines are being divvied up around the world Canada leads the pack in terms of doses secured per capita". Nature. doi:10.1038/d41586-020-03370-6. PMID 33257891. S2CID 227246811. 2020年12月11日閲覧。
- ^ So AD, Woo J (December 2020). "Reserving coronavirus disease 2019 vaccines for global access: cross sectional analysis". BMJ: m4750. doi:10.1136/bmj.m4750. ISSN 1756-1833。
- ^ a b 【チャートは語る】ワクチン輸出 中国席巻/70国・地域で承認・契約 外交・経済で攻勢も『日本経済新聞』朝刊2021年4月4日1面(2021年5月2日閲覧)
- ^ 日本放送協会. “日本が無償提供したワクチン マレーシアとインドネシアに到着”. NHKニュース. 2021年8月25日閲覧。
- ^ 新型コロナウイルスワクチンによる国際貢献について (PDF, 450KB) . 厚生労働省、2021年10月20日閲覧。
- ^ 「米国でワクチン特典続々 抽選で1億円、1週間乗り放題」朝日新聞デジタル(2021年5月13日配信)2021年5月25日閲覧
- ^ “COVID-19 vaccines” (英語). Harvard Health (2021年1月13日). 2021年6月4日閲覧。
- ^ “Coronavirus Resource Center” (英語). Harvard Health (2020年2月28日). 2021年6月4日閲覧。
- ^ “COVID-19 vaccines” (英語). Harvard Health (2021年1月13日). 2021年11月20日閲覧。
- ^ 「先進国でワクチン余剰 欧米2億回・日本1億回分の期限迫る 途上国へ再配分急務」日本経済新聞ニュースサイト(2021年10月7日)2022年7月9日閲覧
- ^ 【新型コロナ】南ア産ワクチン 受注ゼロ/低接種率でも工場閉鎖危機/アフリカ自給計画 風前」『毎日新聞』朝刊2022年6月14日1面(2022年7月9日閲覧)
- ^ “EMA press briefing 11 January 2022”. European Medicines Agency (2022年1月11日). 2023年12月9日閲覧。
- ^ “What to know about the COVID-19 vaccine and the immune system”. Medical News Today (2022年12月12日). 2023年12月11日閲覧。
- ^ “ブースター接種の繰り返し、免疫反応に悪影響も-EU当局 (訂正)”. ブルームバーグ (2022年1月13日). 2023年12月9日閲覧。
- ^ a b c d e f “SAGE updates COVID-19 vaccination guidance”. WHO (2023年3月28日). 2023年12月9日閲覧。
- ^ a b c “WHOの新型コロナワクチンの利用に関する指針(概要)( 2 0 2 3 年 3 月 3 0 日 公 表 )” (PDF). 厚生労働省 (2023年3月29日). 2023年12月8日閲覧。
- ^ a b c d e f g h i “新型コロナワクチン接種ガイダンスを改訂/WHO”. ケアネット (2023年3月31日). 2023年12月9日閲覧。
- ^ a b c d e f g h i j “「WHO、コロナワクチン接種勧告を修正。健康な子ども必要なし」拡散したニュースはミスリード。安全性と効果は強調されているが…”. BuzzFeed News (2023年3月30日). 2023年12月9日閲覧。
- ^ “WHO コロナワクチン定期接種の推奨対象を公表 高齢者 妊婦など”. NHK (2023年3月29日). 2023年12月9日閲覧。
- ^ “突然のWHO「ワクチン推奨しない」発表に「打つんじゃなかった」と思った人へ…手を洗う救急医Takaさんに本当の意味を聞いてみた”. 週刊現代 (2023年4月12日). 2023年12月9日閲覧。
- ^ “「子どもにワクチン打たせるべきか」「打ちたくない人も打つべき?」…WHOの「突然の発表」に戸惑うなか、手を洗う救急医Takaさんが答えた”. 週刊現代 (2023年4月12日). 2023年12月9日閲覧。
- ^ a b c “小児への新型コロナワクチン接種に対する考え方(2023.6追補)”. 日本小児科学会 (2023年6月9日). 2023年12月9日閲覧。
- ^ "Severe acute respiratory syndrome vaccine development: experiences of vaccination against avian infectious bronchitis coronavirus". Avian Pathology. 32 (6): 567–82. December 2003. doi:10.1080/03079450310001621198. PMC 7154303. PMID 14676007。
- ^ "Effects of a SARS-associated coronavirus vaccine in monkeys". Lancet. 362 (9399): 1895–96. December 2003. doi:10.1016/S0140-6736(03)14962-8. PMC 7112457. PMID 14667748。
- ^ "Immunogenicity of an adenoviral-based Middle East Respiratory Syndrome coronavirus vaccine in BALB/c mice". Vaccine. 32 (45): 5975–82. October 2014. doi:10.1016/j.vaccine.2014.08.058. PMC 7115510. PMID 25192975。
- ^ "Development and characterization of a severe acute respiratory syndrome-associated coronavirus-neutralizing human monoclonal antibody that provides effective immunoprophylaxis in mice". The Journal of Infectious Diseases. 191 (4): 507–14. February 2005. doi:10.1086/427242. PMC 7110081. PMID 15655773。
- ^ "Monoclonal antibodies to SARS-associated coronavirus (SARS-CoV): identification of neutralizing and antibodies reactive to S, N, M and E viral proteins". Journal of Virological Methods. 128 (1–2): 21–28. September 2005. doi:10.1016/j.jviromet.2005.03.021. PMC 7112802. PMID 15885812。
- ^ "Therapy with a severe acute respiratory syndrome-associated coronavirus-neutralizing human monoclonal antibody reduces disease severity and viral burden in golden Syrian hamsters". The Journal of Infectious Diseases. 193 (5): 685–92. March 2006. doi:10.1086/500143. PMC 7109703. PMID 16453264。
- ^ a b "Development of SARS vaccines and therapeutics is still needed". Future Virology. 8 (1): 1–2. January 2013. doi:10.2217/fvl.12.126. PMC 7079997. PMID 32201503。
- ^ "SARS (severe acute respiratory syndrome)". National Health Service. 5 March 2020. 2020年3月9日時点のオリジナルよりアーカイブ。2020年1月31日閲覧。
- ^ Shehata, Mahmoud M.; Gomaa, Mokhtar R.; Ali, Mohamed A.; Kayali, Ghazi (20 January 2016). "Middle East respiratory syndrome coronavirus: a comprehensive review". Frontiers of Medicine. 10 (2): 120–36. doi:10.1007/s11684-016-0430-6. PMC 7089261. PMID 26791756。
- ^ "SARS veterans tackle coronavirus". Nature. 490 (7418): 20. October 2012. Bibcode:2012Natur.490...20B. doi:10.1038/490020a. PMID 23038444。
- ^ "Safety and immunogenicity of an anti-Middle East respiratory syndrome coronavirus DNA vaccine: a phase 1, open-label, single-arm, dose-escalation trial". The Lancet. Infectious Diseases. 19 (9): 1013–22. September 2019. doi:10.1016/S1473-3099(19)30266-X. PMC 7185789. PMID 31351922。
- ^ "Recent Advances in the Vaccine Development Against Middle East Respiratory Syndrome-Coronavirus". Frontiers in Microbiology. 10: 1781. 2019. doi:10.3389/fmicb.2019.01781. PMC 6688523. PMID 31428074。
- ^ "World Health Organization timeline – COVID-19". World Health Organization. 27 April 2020. 2020年4月29日時点のオリジナルよりアーカイブ。2020年5月2日閲覧。
- ^ a b c d e f Thanh Le, Tung; Andreadakis, Zacharias; Kumar, Arun; Gómez Román, Raúl; Tollefsen, Stig; Saville, Melanie; Mayhew, Stephen (9 April 2020). "The COVID-19 vaccine development landscape". Nature Reviews Drug Discovery. 19 (5): 305–06. doi:10.1038/d41573-020-00073-5. ISSN 1474-1776. PMID 32273591。
- ^ a b "Responding to Covid-19: A once-in-a-century pandemic?". The New England Journal of Medicine. 382 (18): 1677–79. February 2020. doi:10.1056/nejmp2003762. PMID 32109012。
- ^ "Covid-19: Navigating the uncharted". The New England Journal of Medicine. 382 (13): 1268–69. March 2020. doi:10.1056/nejme2002387. PMC 7121221. PMID 32109011。
- ^ Grenfell, Rob (14 February 2020). "Here's why the WHO says a coronavirus vaccine is 18 months away". Business Insider. 2020年11月11日閲覧。
- ^ a b "Ensuring global access to COVID‑19 vaccines". Lancet. 395 (10234): 1405–06. May 2020. doi:10.1016/S0140-6736(20)30763-7. PMC 7271264. PMID 32243778。
- ^ a b "Landmark global collaboration launched to defeat COVID-19 pandemic". CEPI. 24 April 2020. 2020年5月2日時点のオリジナルよりアーカイブ。2020年5月2日閲覧。
The global nature of a pandemic means that any vaccine or medicine that is successfully developed will be needed immediately all over the world. That means that the challenge we face is not only one of R&D but one of manufacturing at scale, and equitable access.
- ^ Schmidt, Charles (1 June 2020). “Genetic Engineering Could Make a COVID-19 Vaccine in Months Rather Than Years”. Scientific American. オリジナルの11 October 2020時点におけるアーカイブ。 26 August 2020閲覧。
- ^ Fox, Chris; Kelion, Leo (2020年7月16日). “Russian spies 'target coronavirus vaccine'”. BBC News Online. オリジナルの11 October 2020時点におけるアーカイブ。 2020年8月1日閲覧。
- ^ 佐藤 岳大 (2020年3月26日). “新型コロナ解析で分散処理プロジェクト「Folding@home」が1EFLOPS超え”. PC Watch. 2020年4月4日閲覧。
- ^ Pande lab. “Client Statistics by OS”. Archive.is. April 12, 2020時点のオリジナルよりアーカイブ。April 12, 2020閲覧。
- ^ 中村 真司 (2020年4月14日). “Folding@homeがTOP 500の全スパコンを超える2.4EFLOPSに到達”. PC Watch. 2020年4月14日閲覧。
- ^ Folding@home. “https://twitter.com/foldingathome/status/1249778379634675712” (英語). Twitter. 2021年4月10日閲覧。
- ^ "The Access to COVID-19 Tools (ACT) Accelerator". World Health Organization. 2020. 2020年9月25日時点のオリジナルよりアーカイブ。2020年8月29日閲覧。
- ^ a b c d e "COVAX: Ensuring global equitable access to COVID-19 vaccines". GAVI. 2020. 2020年9月25日時点のオリジナルよりアーカイブ。2020年8月28日閲覧。
- ^ "More than 150 countries engaged in COVID-19 vaccine global access facility". World Health Organization. 15 July 2020. 2020年7月15日時点のオリジナルよりアーカイブ。2020年7月25日閲覧。
COVAX is the only truly global solution to the COVID-19 pandemic. For the vast majority of countries, whether they can afford to pay for their own doses or require assistance, it means receiving a guaranteed share of doses and avoiding being pushed to the back of the queue, as we saw during the H1N1 pandemic a decade ago. Even for those countries that are able to secure their own agreements with vaccine manufacturers, this mechanism represents, through its world-leading portfolio of vaccine candidates, a means of reducing the risks associated with individual candidates failing to show efficacy or gain licensure.
- ^ "COVAX: CEPI's response to COVID-19". Coalition for Epidemic Preparedness Innovations (CEPI). 2020. 2020年12月15日閲覧。
- ^ "New vaccines for a safer world". CEPI. 2020. 2020年12月15日閲覧。
- ^ a b c Steenhuysen, Julie; Eisler, Peter; Martell, Allison; Nebehay, Stephanie (2020年4月27日). “Special Report: Countries, companies risk billions in race for coronavirus vaccine”. Reuters. オリジナルの15 May 2020時点におけるアーカイブ。 2020年5月2日閲覧。
- ^ a b c Sanger, David E.; Kirkpatrick, David D.; Zimmer, Carl; Thomas, Katie; Wee, Sui-Lee (2020年5月2日). “With Pressure Growing, Global Race for a Vaccine Intensifies”. The New York Times. ISSN 0362-4331. オリジナルの11 May 2020時点におけるアーカイブ。 2020年5月2日閲覧。
- ^ Hamilton, Isobel Asher (2020年5月1日). “Bill Gates thinks there are 8 to 10 promising coronavirus vaccine candidates and one could be ready in as little as 9 months”. Business Insider. オリジナルの16 May 2020時点におけるアーカイブ。 2020年5月2日閲覧。
- ^ "Global Vaccine Summit 2020: World leaders make historic commitments to provide equal access to vaccines for all". Global Alliance for Vaccines and Immunisation. 4 June 2020. 2020年6月6日時点のオリジナルよりアーカイブ。2020年6月4日閲覧。
- ^ "Bill & Melinda Gates Foundation pledges US$1.6 billion to Gavi, the Vaccine Alliance, to protect the next generation with lifesaving vaccines" (Press release). The Bill & Melinda Gates Foundation. 4 June 2020. 2020年6月4日時点のオリジナルよりアーカイブ。2020年6月4日閲覧。
- ^ "Our portfolio: partnerships to develop vaccines against COVID-19". CEPI. 2020. 2020年12月15日閲覧。
- ^ "Global equitable access to COVID-19 vaccines estimated to generate economic benefits of at least US$ 153 billion in 2020–21, and US$ 466 billion by 2025, in 10 major economies, according to new report by the Eurasia Group". World Health Organization. 4 December 2020. 2020年12月11日閲覧。
- ^ "CEPI ニパウイルスワクチンプロジェクト". 東京大学 医科学研究所 実験動物研究施設. 25 March 2019. 2020年2月2日閲覧。
- ^ a b "新型コロナウイルスに対するワクチン開発を進めます". 厚生労働省. 24 January 2020. 2020年2月2日閲覧。
- ^ "新型肺炎のワクチン開発へ、米など3研究チームが作業開始". ロイター. 24 January 2020. 2020年2月2日閲覧。
- ^ "新型肺炎ワクチンの開発支援 6月にも臨床試験―国際団体". 時事通信. 24 January 2020. 2020年2月2日閲覧。
- ^ "Coronavirus: Vir Biotechnology and Novavax announce vaccine plans-GB". 23 January 2020. 2020年1月26日閲覧。
- ^ "CEPIが新型コロナウイルスのワクチン開発でInovioを選定". PR Newswire. 24 January 2020. 2020年2月2日閲覧。
- ^ "感染症治療薬や防護服のメーカーの株価急伸-新型ウイルス感染拡大で". ブルームバーグ. 28 January 2020. 2020年2月2日閲覧。
- ^ "Inovioが2020年の臨床プログラム計画の最新情報を提供". 共同通信. 7 January 2020. 2020年2月2日閲覧。
- ^ “新型コロナウイルス、世界の研究者がワクチン開発急ぐ 今夏の臨床試験を視野に”. BBCニュース. (2020年1月31日) 2020年2月5日閲覧。
- ^ "GSK、アジュバントの基盤技術を提供". 株式会社QLife. 14 February 2020. 2020年2月16日閲覧。
- ^ "モデルナ株急騰、新型ウイルスワクチンを米第1相試験向けに出荷". ブルームバーグ. 26 February 2020. 2020年2月28日閲覧。
- ^ "田辺三菱製薬、新型コロナのワクチン開発に着手へ". 日本経済新聞. 12 March 2020. 2020年4月18日閲覧。
- ^ "[IR] アンジェス、大阪大学が新型コロナウイルス (COVID-19) に対するDNAワクチン共同開発に着手" (PDF). アンジェス. 5 March 2020. 2020年3月5日閲覧。
- ^ “アンジェス、新型コロナのワクチン開発へ”. 日本経済新聞. (2020年3月5日)
- ^ "大阪大などが開発着手、新型コロナワクチンの効き目は?". 日経ビジネス. 16 March 2020. 2020年4月18日閲覧。
- ^ 「アンジェスのワクチン、6月30日治験開始 大阪市長」日本経済新聞(2020年6月16日)
- ^ 「コロナワクチン、国内初の治験開始 7月末まで30人に」朝日新聞デジタル(2020年6月30日)
- ^ "塩野義製薬、新型コロナワクチンを21年秋にも市場投入". 日本経済新聞. 7 May 2020. 2020年5月13日閲覧。
- ^ a b c d e f g h 『北日本新聞』2020年8月22日付3面「開発進むコロナワクチン 政府 支援や確保急ぐ」
- ^ “カイコからコロナワクチン候補 「食べて接種」も? 九大など開発”. 西日本新聞. (2020年6月27日) 2020年9月29日閲覧。
- ^ a b “カイコの体内で生成 新型コロナのワクチン候補、来年度にも治験へ 九大”. 毎日新聞. (2020年6月30日) 2020年9月29日閲覧。
- ^ "新型コロナワクチン、「感染予防効果なし」は誤り。ワクチンの効果、副反応について専門家に聞きました(BuzzFeed Japan)". BuzzFeed/Yahoo!ニュース. 2021年2月3日閲覧。
- ^ 久(島根大学学術研究院医学・看護学系), 飯笹. "日本RNA学会 - mRNAワクチン:新型コロナウイルス感染を抑える切り札となるか?". www.rnaj.org. 2021年1月23日閲覧。
- ^ 日本放送協会. "モデルナのワクチン接種 400万人中激しいアレルギー反応10人". NHKニュース. 2021年1月23日閲覧。
- ^ a b "新型コロナワクチンの開発状況について". www.mhlw.go.jp. 厚生労働省. 2021年1月23日閲覧。
- ^ "新型コロナワクチンの有効性・安全性について". www.mhlw.go.jp. 厚生労働省. 2021年2月19日閲覧。
- ^ "ファイザーワクチン 14日にも正式に特例承認へ 田村厚労相". NHK(日本放送協会). 2021年2月12日閲覧。
- ^ "コロナワクチン正式承認 ファイザー製、「特例」適用―17日にも接種開始・厚労省". 時事通信社. 2021年2月14日閲覧。
- ^ 『官報』号外特第13号 令和3年2月12日号
- ^ "武田、モデルナ製ワクチン申請 流通網も整備へ". 日本経済新聞. 日本経済新聞社. 5 March 2021. 2021年3月21日閲覧。
- ^ "ワクチン2種承認を了承 米モデルナと英アストラ製". 共同通信社. 2021年5月20日閲覧。
- ^ "薬食審 モデルナ・アストラゼネカ2社の新型コロナワクチン 5月20日に審議". ミクスOnline. 2021年5月20日閲覧。
- ^ 『官報』号外特第43号2頁 令和3年5月21日号
- ^ "厚労省 モデルナとアストラゼネカの新型コロナワクチンを特例承認 モデルナ製のみ公的接種の対象". ミクスOnline. 株式会社ミクス. 21 May 2021. 2021年5月22日閲覧。
- ^ "米J&J、1回投与型のコロナワクチン承認申請". 日本経済新聞. 日本経済新聞社. 24 May 2021. 2021年5月25日閲覧。
- ^ J&Jワクチンの承認了承 コロナで5種類目 - 共同通信 2022年5月30日
- ^ J&Jワクチンを国内で承認 5種類目、接種は自己負担 - 共同通信 2022年6月20日
- ^ a b 日本放送協会. “第一三共 コロナワクチン 年内にも数千人規模の臨床試験実施へ”. NHKニュース. 2021年7月12日閲覧。
- ^ “国内初となるか mRNAワクチン開発に向け越えるべき「壁」”. 毎日新聞. 2021年8月17日閲覧。
- ^ 新型コロナ: 米ノババックスのコロナワクチン、武田が国内承認申請 日本経済新聞(2021年12月17日)
- ^ 『官報』号外特第44号6頁 令和4年4月19日号
- ^ オミクロン 対応ワクチン いつから?副反応は?わかってきたこと - NHK NEWS WEB 2022年9月21日
- ^ 新型コロナ アストラゼネカのワクチン 有効期限で接種終了 - NHK NEWS WEB 2022年10月2日
- ^ 先進的研究開発戦略センター(SCARDA)を設置しました日本医療研究開発機構(2022年3月22日)2022年5月10日閲覧
- ^ 第一三共の国産新型コロナワクチン「ダイチロナ筋注」など6製品承認へ 薬食審・第二部会 - ミクスOnline 2023年8月1日
- ^ 純国産コロナワクチン第1号、第一三共は供給しない方針…初期流行株用で使用見通しなく - 読売新聞 2023年8月1日
- ^ 継続審議の塩野義ワクチン 「有効性」の評価、明暗分かれる - 産経ニュース 2023年8月1日
- ^ a b 国産初、第一三共のコロナワクチン承認へ 12月以降の接種で使用 - 朝日新聞デジタル 2023年11月17日
- ^ 第一三共のコロナワクチン承認 国産初の「XBB」対応―厚労省 - 時事ドットコム 2023年11月28日
- ^ 厚労省 第一三共の新型コロナワクチン140万回分購入で合意 国内企業と初の契約 - ミクスOnline 2023年11月20日
- ^ 創薬支援の新興、福島にmRNAの新工場 ワクチンなどに - 日本経済新聞 2023年8月3日
- ^ 明治グループの新型コロナワクチンへの取り組み - 明治グループ 2023年11月9日 (PDF)
- ^ 新型コロナウイルス感染症に対する次世代mRNAワクチン(レプリコン)「コスタイベ筋注用」の国内製造販売承認取得に関するお知らせ~次世代mRNAワクチン(レプリコン)として世界で初めての承認~ - Meiji Seika ファルマ株式会社 2023年11月28日 (PDF)
- ^ 武田薬品工業株式会社の新型コロナワクチンの供用終了と活用状況等について - 厚生労働省 2023年12月25日 (PDF)
- ^ ノババックスのワクチン 有効期限で国内接種終了へ 厚労省 - NHK NEWS WEB 2023年12月25日
- ^ “最終段階の治験、今秋に開始 KMバイオの新型コロナワクチン | 熊本日日新聞社”. kumanichi.com (2021年6月24日). 2021年7月12日閲覧。
- ^ "China CDC developing novel coronavirus vaccine". Xinhua. 26 January 2020. 2020年1月26日時点のオリジナルよりアーカイブ。2020年1月28日閲覧。
- ^ “ロシアと中国、新型コロナウイルスのワクチンの共同開発に着手” (日本語). ロイター. (2020年1月29日) 2020年2月3日閲覧。
- ^ "中国、新型コロナのワクチン治験開始へ". ロイター. 17 March 2020. 2020年3月18日閲覧。
- ^ a b “「新型コロナワクチン」中国人民解放軍が世界に先駆けて開発した背景”. 講談社. (2020年3月24日)
- ^ a b c 中華人民共和国科学技術部が発行する科技日報報道。華西都市報,「中国、新型コロナウイルスのワクチンのヒト臨床試験を開始」AFPBB(2020年3月23日14:31配信)
- ^ "中国カンシノ、コロナワクチン「ヒトへの効果確認」". ブルームバーグ. 25 May 2020. 2020年8月19日閲覧。
- ^ "カナダと「海亀」、人民解放軍で飛躍-ワクチン開発の中国カンシノ". ブルームバーグ. 3 July 2020. 2020年8月19日閲覧。
- ^ "中国で開発中の新型コロナワクチン、軍への使用に限定して承認". CNN. 1 July 2020. 2020年8月19日閲覧。
- ^ 「中国、ワクチン緊急接種開始=医療従事者らに、実用化急ぐ―新型コロナ」時事通信ニュース(2020年8月23日)
- ^ Nectar Gan. "China's Sinopharm says its coronavirus vaccine is 79% effective". CNN. 2021年1月4日閲覧。
- ^ "中国、国産ワクチン承認 アストラゼネカは30億回分生産". 日本経済新聞. 31 December 2020. 2021年1月4日閲覧。
- ^ "中国、シノバックの新型コロナワクチン承認 一般向けで2例目". ロイター. 8 February 2020. 2021年7月7日閲覧。
- ^ "中国、国産コロナワクチンの承認4種に カンシノなど". 日本経済新聞. 27 February 2021. 2021年3月11日閲覧。
- ^ "WHO、中国シノファーム製ワクチンの緊急使用を承認 欧米以外で初". BBC. 7 May 2021. 2021年5月8日閲覧。
- ^ "WHO、中国製ワクチン承認 有効性79%、2件目も審査中―新型コロナ". 時事通信. 8 May 2021. 2021年5月11日閲覧。
- ^ "露、8月中旬にも国産コロナワクチン承認…安全面から懸念も". 讀賣新聞オンライン. 3 August 2020. 2020年8月3日閲覧。
- ^ "プーチン大統領、ロシア製ワクチンに使用認可 欧米は懐疑的". 日本経済新聞. 12 August 2020. 2020年8月19日閲覧。
- ^ 『北日本新聞』2020年11月12日付8面「ロのワクチン有効性92% 臨床試験中間結果」
- ^ 「米英、進む接種」『読売新聞』朝刊2021年5月23日2面
- ^ a b “英アストラゼネカ、新型コロナのワクチン開発で米から支援獲得”. ブルームバーグ (2020年5月21日). 2020年5月21日閲覧。
- ^ "Novavax developing nanoparticle vaccine for Wuhan coronavirus". BioWorld. 21 January 2020. 2020年2月8日閲覧。
- ^ "新型コロナウイルス、多様なワクチン開発へ世界中で参入企業相次ぐ". 日経BP. 29 January 2020. 2020年2月8日閲覧。
- ^ "ロシュ、新型ウイルス検出キットの供給困難 中国の都市閉鎖で". ロイター. 31 January 2020. 2020年2月2日閲覧。
- ^ “J&J新型コロナのワクチン開発に自信 ギリアドも開発に乗り出す”. ミクス. (2020年2月6日) 2020年2月6日閲覧。
- ^ "米NIH、新型コロナのワクチン治験開始". 日本経済新聞. 17 March 2020. 2020年4月18日閲覧。
- ^ "モデルナ、コロナワクチン抗体確認 7月に大規模治験". 日本経済新聞. 18 May 2020. 2020年5月14日閲覧。
- ^ a b ニューヨーク=中山修志「米ファイザー、ワクチンの効果9割超に」『日本経済新聞』2020年11月9日。2020年11月10日閲覧。
- ^ "英製薬大手「コロナワクチン9月供給予定」 臨床試験結果はまだ". NHK. 22 May 2020. 2020年5月23日閲覧。
- ^ “アストラゼネカのワクチン治験が中断 深刻な副反応疑い”. 朝日新聞. (2020年9月9日)
- ^ “アストラゼネカ コロナのワクチン 英国内での臨床試験を再開”. NHK. (2020年9月13日)
- ^ a b “アストラゼネカ製ワクチン65歳以上に効果なし、仏大統領が主張”. AFPBB News. フランス通信社. (2021年1月30日) 2021年3月18日閲覧。
- ^ “アストラゼネカ製ワクチン、仏も推奨65歳以下 欧州に同様の動き”. AFPBB News. フランス通信社. (2021年2月3日) 2021年3月18日閲覧。
- ^ “デンマークでアストラゼネカ製ワクチンの接種中断、一部患者に血栓症”. TBS News. (2021年3月12日) 2021年3月18日閲覧。
- ^ “アストラゼネカ製ワクチン、欧州各国が相次ぎ使用中断 血栓との関係調査”. CNN.co.jp. CNN. (2021年3月12日) 2021年3月18日閲覧。
- ^ “アストラゼネカ製ワクチン、オランダも使用停止”. BBC News. BBC. (2021年3月15日) 2021年3月18日閲覧。
- ^ “タイ、英アストラゼネカ製ワクチンの使用延期 血栓報告受け”. BBC News. BBC. (2021年3月12日) 2021年3月18日閲覧。
- ^ “アストラゼネカのワクチン、WHOが接種継続呼びかけ 血栓と因果「証拠なし」と”. BBC News. BBC. (2021年3月16日) 2021年3月18日閲覧。
- ^ a b “アストラゼネカ ワクチン“79%の有効性” 米などで臨床試験”. NHK NEWSWEB. NHK. (2021年3月23日) 2021年3月24日閲覧。
- ^ “英アストラ製ワクチン、米治験データは不完全な可能性=米感染研”. ロイター. (2021年3月23日) 2021年3月24日閲覧。
- ^ “アストラゼネカ、新型コロナワクチンの有効性76%に修正”. AFPBB News. フランス通信社. (2021年3月25日) 2021年3月25日閲覧。
- ^ "サノフィ、米国保健福祉省(HHS)と協働で新型コロナウイルスワクチンを開発へ" (PDF). サノフィ. 18 February 2020. 2020年3月5日閲覧。
- ^ a b “ワクチン製造大国のはずが、国民には「在庫切れで接種できず」…海外には6400万回分輸出 : 国際 : ニュース”. 読売新聞オンライン (2021年4月12日). 2021年7月23日閲覧。
- ^ 「印、国産ワクチン接種開始 2種承認 安全性懸念も」『読売新聞』朝刊2021年1月17日(国際面)
- ^ “インド国産ワクチン「コバクシン」、有効性81%”. CNN.co.jp. CNN. (2021年3月4日) 2021年3月18日閲覧。
- ^ 「台湾、自主開発ワクチンの接種開始 批判の声も」『BBCニュース』。2021年8月28日閲覧。
- ^ “台湾が自前のワクチン開発、蔡総統が率先し市民に接種呼びかけ…野党は緊急使用許可の経緯に疑義 : 国際 : ニュース”. 読売新聞オンライン (2021年8月23日). 2021年8月28日閲覧。
- ^ Staff, Reuters「台湾と独ビオンテックのワクチン契約、中国が妨害=蔡総統」『Reuters』2021年5月26日。2021年8月25日閲覧。
- ^ “ベトナム、国産ワクチンの最終治験開始 年内製品化へ”. 日本経済新聞 (2021年6月14日). 2021年7月23日閲覧。
- ^ a b 「東南ア、自前ワクチン競う/ベトナムは輸出も タイは政府主導/医療産業 育成めざす」『日本経済新聞』朝刊2021年5月13日(国際・アジアBiz面)同日閲覧
- ^ イラン・ハメネイ師が国産ワクチン接種 米英製「信用できない」毎日新聞ニュースサイト(2021年6月27日配信)2021年7月31日閲覧
- ^ 「2〜11歳接種 キューバ開始」『読売新聞』朝刊2021年9月18日(国際面)
- ^ a b c d e “韓国、コロナ国産ワクチンを初認可”. 産経ニュース. 産経新聞社 (2022年6月29日). 2022年7月17日閲覧。
- ^ Cross, Ryan (29 September 2020). "The tiny tweak behind COVID-19 vaccines". Chemical & Engineering News. 98 (38).
- ^ Flanagan, Katie L.; Best, Emma; Crawford, Nigel W.; Giles, Michelle; Koirala, Archana; Macartney, Kristine; Russell, Fiona; Teh, Benjamin W.; Wen, Sophie CH (2020). "Progress and Pitfalls in the Quest for Effective SARS-CoV-2 (COVID-19) Vaccines". Frontiers in Immunology. 11: 579250. doi:10.3389/fimmu.2020.579250. ISSN 1664-3224. PMC 7566192. PMID 33123165。
- ^ Krammer F (October 2020). "SARS-CoV-2 vaccines in development". Nature. 586 (7830): 516–27. Bibcode:2020Natur.586..516K. doi:10.1038/s41586-020-2798-3. PMID 32967006. S2CID 221887746。
- ^ Park KS, Sun X, Aikins ME, Moon JJ (December 2020). "Non-viral COVID-19 vaccine delivery systems". Advanced Drug Delivery Reviews. 169: 137–51. doi:10.1016/j.addr.2020.12.008. PMC 7744276. PMID 33340620。
- ^ Kowalski PS, Rudra A, Miao L, Anderson DG (April 2019). "Delivering the Messenger: Advances in Technologies for Therapeutic mRNA Delivery". Mol Ther. 27 (4): 710–28. doi:10.1016/j.ymthe.2019.02.012. PMC 6453548. PMID 30846391。
- ^ Verbeke R, Lentacker I, De Smedt SC, Dewitte H (October 2019). "Three decades of messenger RNA vaccine development". Nano Today. 28: 100766. doi:10.1016/j.nantod.2019.100766。
- ^ “The story of mRNA: From a loose idea to a tool that may help curb Covid” (英語). STAT (2020年11月10日). 2021年7月31日閲覧。
- ^ “Lewis S. Rosenstiel Award for Distinguished Work in Basic Medical Research” (英語). www.brandeis.edu. 2021年7月31日閲覧。
- ^ "COVID-19 ACIP Vaccine Recommendations". Centers for Disease Control and Prevention (CDC). 2021年2月18日閲覧。
- ^ "Safe COVID-19 vaccines for Europeans". European Commission – European Commission. 2021年2月19日閲覧。
- ^ "Regulatory Decision Summary – Pfizer-BioNTech COVID-19 Vaccine". Health Canada, Government of Canada. 9 December 2020. 2020年12月9日閲覧。
- ^ "Study to Describe the Safety, Tolerability, Immunogenicity, and Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Adults". ClinicalTrials.gov. United States National Library of Medicine. 30 April 2020. NCT04368728. 2020年10月11日時点のオリジナルよりアーカイブ。2020年7月14日閲覧。
- ^ "A Multi-site Phase I/II, 2-Part, Dose-Escalation Trial Investigating the Safety and Immunogenicity of four Prophylactic SARS-CoV-2 RNA Vaccines Against COVID-19 Using Different Dosing Regimens in Healthy Adults". EU Clinical Trials Register. European Union. 14 April 2020. EudraCT 2020-001038-36. 2020年4月22日時点のオリジナルよりアーカイブ。2020年4月22日閲覧。
- ^ "A Study to Evaluate Efficacy, Safety, and Immunogenicity of mRNA-1273 Vaccine in Adults Aged 18 Years and Older to Prevent COVID-19". ClinicalTrials.gov. United States National Library of Medicine. 14 July 2020. NCT04470427. 2020年10月11日時点のオリジナルよりアーカイブ。2020年7月27日閲覧。
- ^ Palca, Joe (27 July 2020). “COVID-19 vaccine candidate heads to widespread testing in U.S.”. NPR. オリジナルの11 October 2020時点におけるアーカイブ。 27 July 2020閲覧。
- ^ "EMA starts rolling review of CureVac's COVID-19 vaccine (CVnCoV)". European Medicines Agency (Press release). 1 December 2020. 2021年2月12日閲覧。
- ^ a b c Moghimi SM (2021). "Allergic Reactions and Anaphylaxis to LNP-Based COVID-19 Vaccines". Molecular Therapy. 29 (3): 898–900. doi:10.1016/j.ymthe.2021.01.030. PMC 7862013. PMID 33571463。
- ^ a b "What are viral vector-based vaccines and how could they be used against COVID-19?". GAVI. 2020. 2021年1月26日閲覧。
- ^ "Investigating a Vaccine Against COVID-19". ClinicalTrials.gov. United States National Library of Medicine. 26 May 2020. NCT04400838. 2020年10月11日時点のオリジナルよりアーカイブ。2020年7月14日閲覧。
- ^ "A Phase 2/3 study to determine the efficacy, safety and immunogenicity of the candidate Coronavirus Disease (COVID-19) vaccine ChAdOx1 nCoV-19". EU Clinical Trials Register. European Union. 21 April 2020. EudraCT 2020-001228-32. 2020年10月5日時点のオリジナルよりアーカイブ。2020年8月3日閲覧。
- ^ O'Reilly P (26 May 2020). "A Phase III study to investigate a vaccine against COVID-19". ISRCTN. doi:10.1186/ISRCTN89951424. ISRCTN89951424。
- ^ Corum, Jonathan; Zimmer, Carl (8 January 2021). “How Gamaleya's Vaccine Works”. The New York Times 27 January 2021閲覧。
- ^ "A Study of Ad26.COV2.S in Adults". ClinicalTrials.gov. 4 August 2020. 2020年9月16日時点のオリジナルよりアーカイブ。2020年8月23日閲覧。
- ^ "A Study of Ad26.COV2.S for the Prevention of SARS-CoV-2-Mediated COVID-19 in Adult Participants". ClinicalTrials.gov. US National Library of Medicine. 2020年9月26日時点のオリジナルよりアーカイブ。2021年3月11日閲覧。
- ^ Johnson, Carolyn; McGinley, Laura. “Johnson & Johnson seeks emergency FDA authorization for single-shot coronavirus vaccine”. The Washington Post
- ^ "It's not just Johnson & Johnson: China has a single-dose COVID-19 vaccine that's 65% effective". Fortune. 2021年2月28日閲覧。
- ^ Petrovsky N, Aguilar JC (28 September 2004). "Vaccine adjuvants: Current state and future trends". Immunology and Cell Biology. 82 (5): 488–96. doi:10.1111/j.0818-9641.2004.01272.x. ISSN 0818-9641. PMID 15479434. S2CID 154670。
- ^ "Safety and Immunogenicity Study of Inactivated Vaccine for Prevention of SARS-CoV-2 Infection (COVID-19) (Renqiu)". ClinicalTrials.gov. United States National Library of Medicine. 12 May 2020. NCT04383574. 2020年10月11日時点のオリジナルよりアーカイブ。2020年7月14日閲覧。
- ^ "Clinical Trial of Efficacy and Safety of Sinovac's Adsorbed COVID-19 (Inactivated) Vaccine in Healthcare Professionals (PROFISCOV)". ClinicalTrials.gov. United States National Library of Medicine. 2 July 2020. NCT04456595. 2020年10月11日時点のオリジナルよりアーカイブ。2020年8月3日閲覧。
- ^ PT. Bio Farma (10 August 2020). "A Phase III, observer-blind, randomized, placebo-controlled study of the efficacy, safety, and immunogenicity of SARS-COV-2 inactivated vaccine in healthy adults aged 18–59 years in Indonesia". Registri Penyakit Indonesia. 2020年8月15日閲覧。
- ^ Chen W, Al Kaabi N (18 July 2020). "A Phase III clinical trial for inactivated novel coronavirus pneumonia (COVID-19) vaccine (Vero cells)". Chinese Clinical Trial Registry. 2020年8月15日閲覧。
- ^ https://www.reuters.com/article/us-health-coronavirus-russia-vaccine-idUSKBN2AK07H
- ^ "VLA2001 COVID-19 Vaccine". Precision Vaccinations. 31 December 2020. 2021年1月11日閲覧。
- ^ "Dose Finding Study to Evaluate Safety, Tolerability and Immunogenicity of an Inactiviated Adjuvanted Sars-Cov-2 Virus Vaccine Candidate Against Covid-19 in Healthy Adults". clinicaltrials.gov. U.S. National Library of Medicine. 30 December 2020. 2021年1月11日閲覧。
- ^ "Module 2 – Subunit vaccines". WHO Vaccine Safety Basics. 2021年3月11日閲覧。
- ^ "Study of the Safety, Reactogenicity and Immunogenicity of "EpiVacCorona" Vaccine for the Prevention of COVID-19 (EpiVacCorona)". ClinicalTrials.gov. United States National Library of Medicine. 22 September 2020. NCT04368988. 2020年11月16日閲覧。
- ^ a b "COVID-19 vaccine development pipeline (Refresh URL to update)". Vaccine Centre, London School of Hygiene and Tropical Medicine. 1 March 2021. 2021年3月10日閲覧。
- ^ "Evaluation of the Safety and Immunogenicity of a SARS-CoV-2 rS (COVID-19) Nanoparticle Vaccine With/Without Matrix-M Adjuvant". ClinicalTrials.gov. United States National Library of Medicine. 30 April 2020. NCT04368988. 2020年7月14日時点のオリジナルよりアーカイブ。2020年7月14日閲覧。
- ^ "A Study on the Safety, Tolerability and Immune Response of SARS-CoV-2 Sclamp (COVID-19) Vaccine in Healthy Adults". ClinicalTrials.gov. United States National Library of Medicine. 3 August 2020. NCT04495933. 2020年10月11日時点のオリジナルよりアーカイブ。2020年8月4日閲覧。
- ^ "UQ-CSL V451 Vaccine". precisionvaccinations.com. 2020年12月11日閲覧。
- ^ “【書籍掲載】VLPセラピューティクス・赤畑渉、宝島社『新型コロナウイルスワクチンのすべてがわかる本』で紹介”. VLPセラピューティクス・ジャパン. 2021年8月3日閲覧。
- ^ “新型コロナウイルス ワクチンの基礎と原理”. 峰 宗太郎. 2021年8月3日閲覧。
- ^ ANNnewsCH (2021-10-18), 127gで全国民に接種“少量で効果”ワクチン治験開始(2021年10月18日) 2024年9月24日閲覧。
- ^ “国産ワクチンの開発状況について令和3年4月14日”. 内閣府 健康・医療戦略推進事務局. 2021年8月3日閲覧。
- ^ “次世代mRNAワクチン(レプリコン)「コスタイベ筋注用」”. 厚生労働省. 2024年9月7日閲覧。
- ^ “薬事審議会 医薬品第二部会を開催します”. 厚生労働省 (2024年9月12日). 2024年9月18日閲覧。
- ^ “コロナウイルス(SARS-CoV-2)RNAワクチン”. 医薬品医療機器総合機構. 2024年9月18日閲覧。
- ^ “医療用医薬品 詳細表示 コスタイベ筋注用 - 11.副反応”. 医薬品医療機器総合機構. 2024年9月18日閲覧。
- ^ “「コスタイベ」、安全性に問題なし 武見厚労相”. 日刊薬業 - 医薬品産業の総合情報サイト (2024年9月19日). 2024年9月19日閲覧。
- ^ "A prospective, randomized, adaptive, phase I/II clinical study to evaluate the safety and immunogenicity of Novel Corona Virus −2019-nCov vaccine candidate of M/s Cadila Healthcare Limited by intradermal route in healthy subjects". ctri.nic.in. Clinical Trials Registry India. 15 December 2020. CTRI/2020/07/026352. 2020年11月22日時点のオリジナルよりアーカイブ。2021年7月7日閲覧。
- ^ "Safety, Tolerability and Immunogenicity of INO-4800 for COVID-19 in Healthy Volunteers". ClinicalTrials.gov. United States National Library of Medicine. 7 April 2020. NCT04336410. 2020年10月11日時点のオリジナルよりアーカイブ。2020年7月14日閲覧。
- ^ "IVI, INOVIO, and KNIH to partner with CEPI in a Phase I/II clinical trial of INOVIO's COVID-19 DNA vaccine in South Korea". International Vaccine Institute. 16 April 2020. 2020年4月23日閲覧。
- ^ "Study of COVID-19 DNA Vaccine (AG0301-COVID19)". ClinicalTrials.gov. United States National Library of Medicine. 9 July 2020. NCT04463472. 2020年10月11日時点のオリジナルよりアーカイブ。2020年7月14日閲覧。
- ^ "Safety and Immunogenicity Study of GX-19, a COVID-19 Preventive DNA Vaccine in Healthy Adults". ClinicalTrials.gov. United States National Library of Medicine. 24 June 2020. NCT04445389. 2020年10月11日時点のオリジナルよりアーカイブ。2020年7月14日閲覧。
- ^ “S. Korea's Genexine begins human trial of coronavirus vaccine”. Reuters. (19 June 2020). オリジナルの11 October 2020時点におけるアーカイブ。 25 June 2020閲覧。
- ^ "Safety and Immunity of Covid-19 aAPC Vaccine". ClinicalTrials.gov. United States National Library of Medicine. 9 March 2020. NCT04299724. 2020年10月11日時点のオリジナルよりアーカイブ。2020年7月14日閲覧。
- ^ "Immunity and Safety of Covid-19 Synthetic Minigene Vaccine". ClinicalTrials.gov. United States National Library of Medicine. 19 February 2020. NCT04276896. 2020年10月11日時点のオリジナルよりアーカイブ。2020年7月14日閲覧。
- ^ "A Phase I/II Randomized, Multi-Center, Placebo-Controlled, Dose-Escalation Study to Evaluate the Safety, Immunogenicity and Potential Efficacy of an rVSV-SARS-CoV-2-S Vaccine (IIBR-100) in Adults". ClinicalTrials.gov. United States National Library of Medicine. 1 November 2020. NCT04608305. 2021年7月7日閲覧。
- ^ https://www.npr.org/sections/health-shots/2021/04/06/984486776/scientists-race-to-develop-next-generation-of-covid-vaccines
- ^ 『北日本新聞』2022年2月11日付25面『藍の葉にコロナ予防効果 エキス抽出 点鼻薬販売へ』より。
- ^ “ワクシニアウイルスベクターを用いた新型コロナウイルスワクチンの開発”. 東京都医学総合研究所. 2021年8月20日閲覧。
- ^ “ワクシニアウイルスベクターを用いた 新型コロナウイルスワクチンの開発”. 東京都. 2021年8月20日閲覧。
- ^ “対新型コロナで「終生免疫」の可能性、動物実験で発症予防効果確認”. m3.com. 2021年8月20日閲覧。
- ^ “時間との闘い [UTokyo-IIS Bulletin Vol.7 画期的な手法で、より効果的な新型コロナウイルスワクチンの開発に一歩近づく]”. 東京大学生産技術研究所. 2021年8月20日閲覧。
- ^ Johnson, Carolyn Y.; Mufson, Steven. “Can old vaccines from science's medicine cabinet ward off coronavirus?”. The Washington Post. ISSN 0190-8286 31 December 2020閲覧。
- ^ "Bacille Calmette-Guérin (BCG) vaccination and COVID-19". World Health Organization (WHO). 12 April 2020. 2020年4月30日時点のオリジナルよりアーカイブ。2020年5月1日閲覧。
- ^ "FDA Briefing Document: Pfizer-BioNTech COVID-19 Vaccine" (PDF). U.S. Food and Drug Administration. 10 December 2020. 2021年1月1日閲覧。
- ^ Zimmer, Carl (20 November 2020). “2 Companies Say Their Vaccines Are 95% Effective. What Does That Mean? You might assume that 95 out of every 100 people vaccinated will be protected from Covid-19. But that's not how the math works.”. The New York Times 21 November 2020閲覧。
- ^ Branswell, Helen (2 February 2021). "Comparing three Covid-19 vaccines: Pfizer, Moderna, J&J". Stat. 2021年2月28日閲覧。
- ^ Randolph HE, Barreiro LB (May 2020). "Herd Immunity: Understanding COVID-19". Immunity. 52 (5): 737–41. doi:10.1016/j.immuni.2020.04.012. PMC 7236739. PMID 32433946。
- ^ "The FDA's cutoff for Covid-19 vaccine effectiveness is 50 percent. What does that mean?". NBC News. 2021年1月8日閲覧。
- ^ "EMA sets 50% efficacy goal – with flexibility – for COVID vaccines". www.raps.org. 2021年1月8日閲覧。
- ^ Bartsch SM, O'Shea KJ, Ferguson MC, Bottazzi ME, Wedlock PT, Strych U, et al. (October 2020). "Vaccine Efficacy Needed for a COVID-19 Coronavirus Vaccine to Prevent or Stop an Epidemic as the Sole Intervention". American Journal of Preventive Medicine. 59 (4): 493–503. doi:10.1016/j.amepre.2020.06.011. PMC 7361120. PMID 32778354。
- ^ Dean, Natalie; Madewell, Zachary (5 March 2021). "Understanding the spectrum of vaccine efficacy measures". The BMJ Opinion. 2021年3月10日閲覧。
- ^ a b c "Moderna COVID-19 Vaccine – cx-024414 injection, suspension". DailyMed. U.S. National Institutes of Health. 2020年12月20日閲覧。
- ^ a b "Pfizer-BioNTech COVID-19 Vaccine – rna ingredient bnt-162b2 injection, suspension". DailyMed. U.S. National Institutes of Health. 2020年12月14日閲覧。
- ^ “Russia okays single-dose Sputnik Light Covid-19 vaccine, has 79.4% efficacy”. India Today. (6 May 2021)
- ^ Logunov DY, Dolzhikova IV, Shcheblyakov DV, Tukhvatulin AI, Zubkova OV, Dzharullaeva AS, et al. (February 2021). "Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia". The Lancet. 397 (10275): 671–681. doi:10.1016/S0140-6736(21)00234-8. ISSN 0140-6736. PMC 7852454. PMID 33545094。
- ^ “Single-dose administration and the influence of the timing of the booster dose on immunogenicity and efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine: a pooled analysis of four randomised trials”. Lancet 397 (10277): 881–91. (March 2021). doi:10.1016/S0140-6736(21)00432-3. PMC 7894131. PMID 33617777.
- ^ "AZD1222 US Phase III primary analysis confirms safety and efficacy". 2021年3月25日閲覧。
- ^ Wee, Sui-Lee; Qin, Amy (30 December 2020). “A Chinese Covid-19 Vaccine Has Proved Effective, Its Maker Says”. The New York Times 30 December 2020閲覧。
- ^ “Sinovac says COVID-19 vaccine effective in preventing hospitalization, death”. Reuters. (5 February 2021) 10 March 2021閲覧。
- ^ “Sinovac's Covid Shot Proves 78% Effective in Brazil Trial”. Bloomberg. (7 January 2021) 7 January 2021閲覧。
- ^ “Chile Approves Chinese Coronavirus Vaccine”. Barron's. Agence France-Presse. (20 January 2021) 10 March 2021閲覧。
- ^ Wadman M, Cohen J (28 January 2021). "Novavax vaccine delivers 89% efficacy against COVID-19 in UK – but is less potent in South Africa". Science. doi:10.1126/science.abg8101。
- ^ "Novavax COVID-19 Vaccine Demonstrates 89.3% Efficacy in UK Phase 3 Trial | Novavax Inc. - IR Site". ir.novavax.com. 2021年3月3日閲覧。
- ^ a b c "Janssen COVID-19 Vaccine - ad26.cov2.s injection, suspension". DailyMed. U.S. National Institutes of Health. 2021年3月15日閲覧。
- ^ "FDA Briefing Document: Janssen Ad26.COV2.S Vaccine for the Prevention of COVID-19". US Food & Drug Administration (FDA). 26 February 2021. 2021年4月1日閲覧。
- ^ “Bharat Biotech's Covaxin found 81% effective in interim phase 3 trials”. mint. (3 March 2021)
- ^ "Bharat Biotech Announces Phase 3 Results of COVAXIN: India's First COVID-19 Vaccine Demonstrates Interim Clinical Efficacy of 81%" (PDF) (Press release). Hyderabad: Bharat Biotech. 3 March 2021. 2021年3月10日閲覧。
- ^ “CanSinoBIO's COVID-19 vaccine 65.7% effective in global trials, Pakistan official says”. Reuters (Islamabad). (8 February 2021) 5 March 2021閲覧. "its single-dose regimen and normal refrigerator storage requirement could make it a favourable option for many countries"
- ^ "What is the difference between efficacy and effectiveness?". www.gavi.org (英語). 2021年5月13日閲覧。
- ^ By Zahid Mahmood, Hannah Strange, Julia Hollingsworth and Adam Renton (29 January 2021). "Israel's health data suggests Pfizer and Moderna vaccines may be more effective than we thought". CNN (英語). 2021年5月13日閲覧。
- ^ a b c Thompson, Mark G. (2021). "Interim Estimates of Vaccine Effectiveness of BNT162b2 and mRNA-1273 COVID-19 Vaccines in Preventing SARS-CoV-2 Infection Among Health Care Personnel, First Responders, and Other Essential and Frontline Workers — Eight U.S. Locations, December 2020–March 2021". MMWR. Morbidity and Mortality Weekly Report (アメリカ英語). 70. doi:10.15585/mmwr.mm7013e3. ISSN 0149-2195。
- ^ a b Victoria Jane Hall, Sarah Foulkes, Ayoub Saei, Nick Andrews, Blanche Oguti, Andre Charlett, et al. (February 2021). "Effectiveness of BNT162b2 mRNA Vaccine Against Infection and COVID-19 Vaccine Coverage in Healthcare Workers in England, Multicentre Prospective Cohort Study (the SIREN Study)". SSRN 3790399。
- ^ a b Pfizer (11 March 2021). "Real-World Evidence Confirms High Effectiveness of Pfizer–BioNTech COVID-19 Vaccine and Profound Public Health Impact of Vaccination One Year After Pandemic Declared". 2021年4月1日閲覧。
- ^ Aaron J Tande; Benjamin D Pollock; Nilay D Shah; Gianrico Farrugia; Abinash Virk; Melanie Swift; Laura Breeher; Matthew Binnicker; Elie F Berbari (10 March 2021). "Impact of the COVID-19 Vaccine on Asymptomatic Infection Among Patients Undergoing Pre-Procedural COVID-19 Molecular Screening". Clinical Infectious Diseases. doi:10.1093/cid/ciab229. PMC 7989519. PMID 33704435。
- ^ Nectar Gan. "Chinese Covid-19 vaccine efficacy is 'not high', top health official admits". CNN. 2021年4月14日閲覧。
- ^ "La vacuna CoronaVac demostró ser efectiva en un 89% para evitar hospitalizaciones UCI" [CoronaVac vaccine proved to be 89% effective in preventing ICU hospitalizations] (Press release) (Spanish). Santiago: Ministry of Health (Chile). 16 April 2021. 2021年4月18日閲覧。
- ^ Araos, Rafael (16 April 2021). Efectividad de la vacuna CoronaVac con virus inactivo contra SARS-CoV-2 en Chile [Effectiveness of the CoronaVac vaccine with inactivated virus against SARS-CoV-2 in Chile] (PDF) (Report) (Spanish). Ministry of Health (Chile). p. 12-13. 2021年4月18日閲覧。
- ^ Estudio "Efectividad de la vacuna CoronaVac con virus inactivado contra SARS-CoV-2 en Chile"tran [Study "Effectiveness of the CoronaVac vaccine with inactivated virus against SARS-CoV-2 in Chile"] (Online video) (Spanish). Ministry of Health (Chile). 16 April 2021. 該当時間: 10:12-13:42, 16:59-17:45. 2021年4月18日閲覧。
- ^ “China's Coronavac 80% effective at preventing Covid deaths: Chile results”. Agence France-Presse. Santiago: France 24. (2021年4月16日) 2021年4月18日閲覧。
- ^ “Russia's Sputnik V vaccine 97.6% effective in real-world study”. Reuters (Moscow). (2021年4月19日) 2021年4月21日閲覧。
- ^ "Sputnik V demonstrates 97.6% efficacy according to analysis of data from 3.8 million vaccinated persons in Russia making it the most efficient COVID-19 vaccine in the world" (Press release). Moscow: Russian Direct Investment Fund. 19 April 2021. 2021年4月21日閲覧。
- ^ a b Commissioner, Office of the (23 February 2021). "Coronavirus (COVID-19) Update: FDA Issues Policies to Guide Medical Product Developers Addressing Virus Variants". FDA (英語). 2021年3月7日閲覧。
- ^ Mahase, Elisabeth (2 March 2021). "Covid-19: Where are we on vaccines and variants?". BMJ (英語). 372: n597. doi:10.1136/bmj.n597. ISSN 1756-1833. PMID 33653708. S2CID 232093175。
- ^ 『新型コロナウイルス変異株に対する中和抗体の質が時間と共に向上することを発見』(プレスリリース)国立研究開発法人日本医療研究開発機構、2021年7月2日。2021年9月5日閲覧。
- ^ Saya Moriyama、Yu Adachi、Takashi Sato、Takaji Wakita、Tadaki Suzuki、Yoshimasa Takahashi「Temporal maturation of neutralizing antibodies in COVID-19 convalescent individuals improves potency and breadth to circulating SARS-CoV-2 variants」『Immunity』第54巻第8号、2021年、1841-1852頁、doi:10.1016/j.immuni.2021.06.015。
- ^ “Inside the B.1.1.7 Coronavirus Variant”. (18 January 2021) 29 January 2021閲覧。
- ^ "Moderna vaccine appears to work against variants". RNZ. 26 January 2021. 2021年1月30日閲覧。
- ^ Muik, Alexander; Wallisch, Ann-Kathrin; Sänger, Bianca; Swanson, Kena A.; Mühl, Julia; Chen, Wei; Cai, Hui; Maurus, Daniel; Sarkar, Ritu; Türeci, Özlem; Dormitzer, Philip R. (29 January 2021). "Neutralization of SARS-CoV-2 lineage B.1.1.7 pseudovirus by BNT162b2 vaccine–elicited human sera". Science: eabg6105. doi:10.1126/science.abg6105. ISSN 0036-8075. PMID 33514629。
- ^ Emary, Katherine R. W.; Golubchik, Tanya; Aley, Parvinder K.; Ariani, Cristina V.; Angus, Brian John; Bibi, Sagida; Blane, Beth; Bonsall, David; Cicconi, Paola; Charlton, Sue; Clutterbuck, Elizabeth (2021). "Efficacy of ChAdOx1 nCoV-19 (AZD1222) Vaccine Against SARS-CoV-2 VOC 202012/01 (B.1.1.7)". SSRN Electronic Journal (英語). doi:10.2139/ssrn.3779160. ISSN 1556-5068。
- ^ Mahase, Elisabeth (1 February 2021). "Covid-19: Novavax vaccine efficacy is 86% against UK variant and 60% against South African variant". BMJ (英語): n296. doi:10.1136/bmj.n296. ISSN 1756-1833。
- ^ Kuchler, Hannah (25 January 2021). "Moderna develops new vaccine to tackle mutant Covid strain". Financial Times. 2021年1月30日閲覧。
- ^ Liu, Yang; Liu, Jianying; Xia, Hongjie; Zhang, Xianwen; Fontes-Garfias, Camila R.; Swanson, Kena A.; Cai, Hui; Sarkar, Ritu; Chen, Wei; Cutler, Mark; Cooper, David; Weaver, Scott C.; Muik, Alexander; Sahin, Ugur; Jansen, Kathrin U.; Xie, Xuping; Dormitzer, Philip R.; Shi, Pei-Yong (17 February 2021). "Neutralizing Activity of BNT162b2-Elicited Serum — Preliminary Report". New England Journal of Medicine. doi:10.1056/nejmc2102017. PMID 33596352. 2021年2月25日閲覧。
- ^ Wang P, Nair MS, Liu L, Iketani S, Luo Y, Guo Y, et al. (March 2021). "Antibody Resistance of SARS-CoV-2 Variants B.1.351 and B.1.1.7". Nature. doi:10.1038/s41586-021-03398-2. PMID 33684923。
- ^ a b Hoffmann M, Arora P, Gross R, Seidel A, Hoernich BF, Hahn AS, et al. (March 2021). "1 SARS-CoV-2 variants B.1.351 and P.1 escape from neutralizing antibodies". Cell. doi:10.1016/j.cell.2021.03.036. PMID 33794143。
- ^ "Pfizer and BioNTech Confirm High Efficacy and No Serious Safety Concerns Through Up to Six Months Following Second Dose in Updated Topline Analysis of Landmark COVID-19 Vaccine Study". Pfizer. 1 April 2021. 2021年4月2日閲覧。
- ^ "Johnson & Johnson Announces Single-Shot Janssen COVID-19 Vaccine Candidate Met Primary Endpoints in Interim Analysis of its Phase 3 ENSEMBLE Trial" (Press release). Johnson & Johnson. 29 January 2021. 2021年1月29日閲覧。
- ^ Francis, Derek; Andy, Bruce (6 February 2021). “Oxford/AstraZeneca COVID shot less effective against South African variant: study”. ロイター 2021年2月8日閲覧。
- ^ “South Africa halts AstraZeneca jab over new strain”. BBC News (London). (7 February 2021) 2021年2月8日閲覧。
- ^ Booth, William; Johnson, Carolyn Y. (7 February 2021). “South Africa suspends Oxford-AstraZeneca vaccine rollout after researchers report 'minimal' protection against coronavirus variant”. The Washington Post (London) 2021年2月8日閲覧. "South Africa will suspend use of the coronavirus vaccine being developed by Oxford University and AstraZeneca after researchers found it provided "minimal protection" against mild to moderate coronavirus infections caused by the new variant first detected in that country."
- ^ “Covid: South Africa halts AstraZeneca vaccine rollout over new variant”. BBC News. (8 February 2021) 12 February 2021閲覧。
- ^ "PANGO lineages". cov-lineages.org. 2021年4月18日閲覧。
- ^ “Coronavirus | Indian 'double mutant' strain named B.1.617” (英語). The Hindu. (8 April 2021)
- ^ “India's variant-fuelled second wave coincided with spike in infected flights landing in Canada”. Toronto Sun. (10 April 2021) 10 April 2021閲覧。
- ^ Cherian, Sarah; Potdar, Varsha; Jadhav, Santosh; Yadav, Pragya; Gupta, Nivedita; Das, Mousmi; Rakshit, Partha; Singh, Sujeet; Abraham, Priya; Panda, Samiran (24 April 2021). "Convergent evolution of SARS-CoV-2 spike mutations, L452R, E484Q and P681R, in the second wave of COVID-19 in Maharashtra, India" (Report). doi:10.1101/2021.04.22.440932. S2CID 233415787. 2021年4月25日閲覧。
- ^ Shrutirupa (17 April 2021). "IS THIS COVID – 20? | Double Mutant Strain Explained". Self Immune (アメリカ英語). 2021年4月18日閲覧。
- ^ “'Double mutant': What are the risks of India's new Covid-19 variant”. (25 March 2021) 11 April 2021閲覧。
- ^ Haseltine WA. An Indian SARS-CoV-2 Variant Lands In California. More Danger Ahead? Forbes.com, Apr 12, 2021, accessed 14 April 2021
- ^ “新型コロナウイルスワクチンに関するQ&A その3”. 日本薬学会. 2021年8月20日閲覧。
- ^ "Vaccine Safety – Vaccines". vaccines.gov. US Department of Health and Human Services. 2020年4月22日時点のオリジナルよりアーカイブ。2020年4月13日閲覧。
- ^ "The drug development process". U.S. Food and Drug Administration (FDA). 4 January 2018. 2020年2月22日時点のオリジナルよりアーカイブ。2020年4月12日閲覧。
- ^ Cohen, Jon (19 June 2020). "Pandemic vaccines are about to face the real test". Science. 368 (6497): 1295–96. Bibcode:2020Sci...368.1295C. doi:10.1126/science.368.6497.1295. PMID 32554572。
- ^ "How flu vaccine effectiveness and efficacy are measured". Centers for Disease Control and Prevention, National Center for Immunization and Respiratory Diseases, US Department of Health and Human Services. 29 January 2016. 2020年5月7日時点のオリジナルよりアーカイブ。2020年5月6日閲覧。
- ^ "Principles of epidemiology, Section 8: Concepts of disease occurrence". Centers for Disease Control and Prevention, Center for Surveillance, Epidemiology, and Laboratory Services, US Department of Health and Human Services. 18 May 2012. 2020年4月6日時点のオリジナルよりアーカイブ。2020年5月6日閲覧。
- ^ a b Pallmann P, Bedding AW, Choodari-Oskooei B, Dimairo M, Flight L, Hampson LV, et al. (February 2018). "Adaptive designs in clinical trials: why use them, and how to run and report them". BMC Medicine. 16 (1): 29. doi:10.1186/s12916-018-1017-7. PMC 5830330. PMID 29490655。
- ^ "Adaptive designs for clinical trials of drugs and biologics: Guidance for industry" (PDF). U.S. Food and Drug Administration (FDA). 1 November 2019. 2019年12月13日時点のオリジナルよりアーカイブ。2020年4月3日閲覧。
- ^ "An international randomised trial of candidate vaccines against COVID-19: Outline of Solidarity vaccine trial" (PDF). World Health Organization (WHO). 9 April 2020. 2020年5月12日時点のオリジナルよりアーカイブ (PDF)。2020年5月9日閲覧。
- ^ Walsh, Nick; Shelley, Jo; Duwe, Eduardo; Bonnett, William (27 July 2020). “The world's hopes for a coronavirus vaccine may run in these health care workers' veins”. CNN (São Paulo). オリジナルの3 August 2020時点におけるアーカイブ。 3 August 2020閲覧。
- ^ "Investigating a Vaccine Against COVID-19". ClinicalTrials.gov (Registry). United States National Library of Medicine. 26 May 2020. NCT04400838. 2020年10月11日時点のオリジナルよりアーカイブ。2020年7月14日閲覧。
- ^ "A Phase 2/3 study to determine the efficacy, safety and immunogenicity of the candidate Coronavirus Disease (COVID-19) vaccine ChAdOx1 nCoV-19". EU Clinical Trials Register (Registry). European Union. 21 April 2020. EudraCT 2020-001228-32. 2020年10月5日時点のオリジナルよりアーカイブ。2020年8月3日閲覧。
- ^ O'Reilly P (26 May 2020). "A Phase III study to investigate a vaccine against COVID-19". ISRCTN (Registry). doi:10.1186/ISRCTN89951424. ISRCTN89951424。
- ^ "Study to Describe the Safety, Tolerability, Immunogenicity, and Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Adults". ClinicalTrials.gov (Registry). United States National Library of Medicine. 30 April 2020. NCT04368728. 2020年10月11日時点のオリジナルよりアーカイブ。2020年7月14日閲覧。
- ^ "A Multi-site Phase I/II, 2-Part, Dose-Escalation Trial Investigating the Safety and Immunogenicity of four Prophylactic SARS-CoV-2 RNA Vaccines Against COVID-19 Using Different Dosing Regimens in Healthy Adults". EU Clinical Trials Register (Registry). European Union. 14 April 2020. EudraCT 2020-001038-36. 2020年4月22日時点のオリジナルよりアーカイブ。2020年4月22日閲覧。
- ^ "Coronavirus (COVID-19) Update: FDA Allows More Flexible Storage, Transportation Conditions for Pfizer-BioNTech COVID-19 Vaccine" (Press release). Food and Drug Administration (FDA). 25 February 2021. 2021年3月5日閲覧。
- ^ "Pfizer-BioNTech COVID-19 Vaccine EUA Fact Sheet for Healthcare Providers" (PDF). Pfizer. 25 February 2021. 2021年2月25日閲覧。
- ^ "A Study to Evaluate Efficacy, Safety, and Immunogenicity of mRNA-1273 Vaccine in Adults Aged 18 Years and Older to Prevent COVID-19". ClinicalTrials.gov (Registry). United States National Library of Medicine. 14 July 2020. NCT04470427. 2020年10月11日時点のオリジナルよりアーカイブ。2020年7月27日閲覧。
- ^ Palca, Joe (27 July 2020). “COVID-19 vaccine candidate heads to widespread testing in U.S.”. NPR. オリジナルの11 October 2020時点におけるアーカイブ。 27 July 2020閲覧。
- ^ Chen W, Al Kaabi N (18 July 2020). "A Phase III clinical trial for inactivated novel coronavirus pneumonia (COVID-19) vaccine (Vero cells)". Chinese Clinical Trial Registry. 2020年8月15日閲覧。
- ^ "A Study of Ad26.COV2.S in Adults". ClinicalTrials.gov, US National Library of Medicine. 4 August 2020. 2020年9月16日時点のオリジナルよりアーカイブ。2020年8月23日閲覧。
- ^ Sadoff J, Le Gars M, Shukarev G, Heerwegh D, Truyers C, de Groot AM, Stoop J, Tete S, Van Damme W, Leroux-Roels I, Berghmans P (25 September 2020). Safety and immunogenicity of the Ad26.COV2.S COVID-19 vaccine candidate: interim results of a phase 1/2a, double-blind, randomized, placebo-controlled trial. 2020年11月3日時点のオリジナルよりアーカイブ。2020年12月28日閲覧。
- ^ "A Study of Ad26.COV2.S for the Prevention of SARS-CoV-2-Mediated COVID-19 in Adult Participants". ClinicalTrials.gov. US National Library of Medicine. 2020年9月26日時点のオリジナルよりアーカイブ。2020年12月8日閲覧。
- ^ "Safety and Immunogenicity Study of Inactivated Vaccine for Prevention of SARS-CoV-2 Infection (COVID-19) (Renqiu)". ClinicalTrials.gov (Registry). United States National Library of Medicine. 12 May 2020. NCT04383574. 2020年10月11日時点のオリジナルよりアーカイブ。2020年7月14日閲覧。
- ^ "Clinical Trial of Efficacy and Safety of Sinovac's Adsorbed COVID-19 (Inactivated) Vaccine in Healthcare Professionals (PROFISCOV)". ClinicalTrials.gov (Registry). United States National Library of Medicine. 2 July 2020. NCT04456595. 2020年10月11日時点のオリジナルよりアーカイブ。2020年8月3日閲覧。
- ^ PT. Bio Farma (10 August 2020). "A Phase III, observer-blind, randomized, placebo-controlled study of the efficacy, safety, and immunogenicity of SARS-COV-2 inactivated vaccine in healthy adults aged 18–59 years in Indonesia". Registri Penyakit Indonesia. 2020年8月15日閲覧。
- ^ "Clinical Trial of Recombinant Novel Coronavirus Vaccine (Adenovirus Type 5 Vector) Against COVID-19". ClinicalTrials.gov (Registry). United States National Library of Medicine. 13 November 2020. NCT04540419. 2020年11月17日閲覧。
- ^ "The National Research Council of Canada and CanSino Biologics Inc. announce collaboration to advance vaccine against COVID-19". National Research Council, Government of Canada. 12 May 2020. 2020年5月22日時点のオリジナルよりアーカイブ。2020年5月22日閲覧。
- ^ a b "Study of the Safety, Reactogenicity and Immunogenicity of "EpiVacCorona" Vaccine for the Prevention of COVID-19 (EpiVacCorona)". ClinicalTrials.gov (Registry). United States National Library of Medicine. 22 September 2020. NCT04368988. 2020年11月16日閲覧。
- ^ "Briefing with Deputy Prime Minister Tatyana Golikova, Health Minister Mikhail Murashko and Head of Rospotrebnadzor Anna Popova". Government of Russia. 18 January 2021. 2021年2月20日閲覧。
- ^ "COVID-19 mass vaccination campaign". government.ru (英語). 2021年5月13日閲覧。
- ^ “Russia Approves Single-Dose Sputnik Light Covid Vaccine For Use”. NDTV Coronavirus. (6 May 2021)
- ^ Study to Evaluate Efficacy, Immunogenicity and Safety of the Sputnik-Light (SPUTNIK-LIGHT)
- ^ “MVC COVID-19 Vaccine Obtains Taiwan EUA Approval”. Medigen Vaccine Biologics Corp. (19 July 2021)
- ^ “Dynavax and Medigen Announce Collaboration to Develop a Novel Adjuvanted COVID-19 Vaccine Candidate”. GlobeNewswire. (23 July 2020) 7 June 2021閲覧。
- ^ a b c Tregoning JS, Russell RF, Kinnear E (25 January 2018). "Adjuvanted influenza vaccines". Human Vaccines and Immunotherapeutics. 14 (3): 550–64. doi:10.1080/21645515.2017.1415684. ISSN 2164-5515. PMC 5861793. PMID 29232151。
- ^ a b c d Wang J, Peng Y, Xu H, Cui Z, Williams RO (5 August 2020). "The COVID-19 vaccine race: Challenges and opportunities in vaccine formulation". AAPS PharmSciTech. 21 (6): 225. doi:10.1208/s12249-020-01744-7. ISSN 1530-9932. PMC 7405756. PMID 32761294。
- ^ Gates B (23 April 2020). "The first modern pandemic: The scientific advances we need to stop COVID-19". The Gates Notes. 2020年5月13日時点のオリジナルよりアーカイブ。2020年5月6日閲覧。
- ^ Blanchfield, Mike (30 April 2020). “Global philanthropists, experts call for COVID-19 vaccine distribution plan”. Toronto Star. オリジナルの7 May 2020時点におけるアーカイブ。 6 May 2020閲覧。
- ^ a b "Clinical Development Success Rates 2006–2015" (PDF). BIO Industry Analysis. June 2016. 2019年9月12日時点のオリジナルよりアーカイブ (PDF)。2020年3月23日閲覧。
- ^ Jennings, Katie (17 November 2020). "How Much Will A Covid-19 Vaccine Cost?". Forbes. 2020年12月6日閲覧。
- ^ "European vaccine prices revealed in Belgian Twitter blunder". The Brussels Times. 18 December 2020. 2021年1月4日閲覧。
- ^ Bossaert, Jeroen (17 December 2020). "Zoveel gaan we betalen voor de coronavaccins: staatssecretaris zet confidentiële prijzen per ongeluk online". Het Laatste Nieuws. 2020年12月18日閲覧。
- ^ a b c d e "How the massive plan to deliver the COVID-19 vaccine could make history – and leverage blockchain like never before". World Economic Forum. 17 July 2020. 2020年9月16日時点のオリジナルよりアーカイブ。2020年9月16日閲覧。
- ^ a b c d e f g Callaway, Ewen (27 August 2020). "The unequal scramble for coronavirus vaccines – by the numbers". Nature. 584 (7822): 506–07. Bibcode:2020Natur.584..506C. doi:10.1038/d41586-020-02450-x. PMID 32839593. S2CID 221285160。
- ^ a b c d e f Brendan Murray and Riley Griffin (24 July 2020). “The world's supply chain isn't ready for a Covid-19 vaccine”. Bloomberg World. オリジナルの28 August 2020時点におけるアーカイブ。 13 September 2020閲覧。
- ^ a b c d Kominers, Scott Duke; Tabarrok, Alex (18 August 2020). “Vaccines use bizarre stuff. We need a supply chain now”. Bloomberg Business. オリジナルの29 August 2020時点におけるアーカイブ。 13 September 2020閲覧。
- ^ a b "The time to prepare for COVID-19 vaccine transport is now". UNICEF. 10 September 2020. 2020年9月13日時点のオリジナルよりアーカイブ。2020年9月13日閲覧。
- ^ a b Desai, Devika (10 September 2020). “Transporting one single dose of COVID-19 vaccine could take up to 8,000 jumbo planes, says aviation body”. National Post 13 September 2020閲覧. "The IATA estimated that 8,000 747 cargo planes, at minimum, would be needed to transport a single dose of the vaccine worldwide, but more equipment could be required as administering the vaccine might mean several doses. Vaccines would also have to be stored at a temperature range between two and eight degrees Celsius, which could rule out the use of some types of planes."
- ^ a b c d Quelch, Rich (14 August 2020). "COVID-19 vaccine delivery – overcoming the supply chain challenges". PharmiWeb.com. 2020年9月13日閲覧。
Delivering a new vaccine for COVID-19 worldwide will be one of the greatest challenges faced by modern pharma. The difficulties are intensified by pre-existing shortcomings in the supply chain.
- ^ Seidman, Gabriel; Atun, Rifat (2017). "Do changes to supply chains and procurement processes yield cost savings and improve availability of pharmaceuticals, vaccines or health products? A systematic review of evidence from low-income and middle-income countries". BMJ Global Health. 2 (2): e000243. doi:10.1136/bmjgh-2016-000243. ISSN 2059-7908. PMC 5435270. PMID 28589028。
- ^ a b "172 countries and multiple candidate vaccines engaged in COVID-19 Vaccine Global Access Facility". GAVI. 4 September 2020. 2020年9月16日時点のオリジナルよりアーカイブ。2020年9月15日閲覧。
- ^ a b c d "UNICEF to lead procurement and supply of COVID-19 vaccines in world's largest and fastest ever operation of its kind". UNICEF. 4 September 2020. 2020年9月16日時点のオリジナルよりアーカイブ。2020年9月15日閲覧。
- ^ Cook E (4 September 2020). "UNICEF to lead supply chain for COVID-19 vaccine". Manufacturing. 2020年11月1日時点のオリジナルよりアーカイブ。2020年9月13日閲覧。
- ^ a b Hessel, Luc (2009). "Pandemic influenza vaccines: meeting the supply, distribution and deployment challenges". Influenza and Other Respiratory Viruses. 3 (4): 165–70. doi:10.1111/j.1750-2659.2009.00085.x. ISSN 1750-2640. PMC 4634681. PMID 19627373。
- ^ a b "Vaccine management and logistics support". World Health Organization. 2020. 2020年9月13日時点のオリジナルよりアーカイブ。2020年9月14日閲覧。
- ^ Jarrett, Stephen; Yang, Lingjiang; Pagliusi, Sonia (9 June 2020). "Roadmap for strengthening the vaccine supply chain in emerging countries: Manufacturers' perspectives". Vaccine X. 5: 100068. doi:10.1016/j.jvacx.2020.100068. ISSN 2590-1362. PMC 7394771. PMID 32775997。
- ^ a b Lloyd, John; Cheyne, James (2017). "The origins of the vaccine cold chain and a glimpse of the future". Vaccine. 35 (17): 2115–20. doi:10.1016/j.vaccine.2016.11.097. ISSN 0264-410X. PMID 28364918。
- ^ a b c d "How can we make enough vaccine for 2 billion people?". World Economic Forum. 25 August 2020. 2020年9月16日時点のオリジナルよりアーカイブ。2020年9月16日閲覧。
- ^ “Coronavirus vaccine pre-orders worldwide top 5 billion”. The Japan Times. (12 August 2020). オリジナルの20 September 2020時点におけるアーカイブ。 13 September 2020閲覧。
- ^ C, Hannah (10 October 2020). "China Commits to Producing 600 Million Vaccine Doses by the End of 2020". Science Times. 2020年10月10日時点のオリジナルよりアーカイブ。2020年10月10日閲覧。
- ^ Staff, Reuters (2020年10月20日). “Sinopharm says may be able to make over 1 billion coronavirus vaccine doses in 2021” (英語). Reuters 2020年12月7日閲覧。
- ^ Staff, Reuters (2020年12月7日). “Sinovac secures $515 million to boost COVID-19 vaccine production” (英語). Reuters 2020年12月7日閲覧。
- ^ Molteni M (26 June 2020). "Vaccine makers turn to microchip tech to beat glass shortages". Wired. 2020年9月16日時点のオリジナルよりアーカイブ。2020年9月17日閲覧。
- ^ Burger, Ludwig; Blamont, Matthias (11 June 2020). “Bottlenecks? Glass vial makers prepare for COVID-19 vaccine”. Reuters. オリジナルの29 September 2020時点におけるアーカイブ。 17 September 2020閲覧。
- ^ a b Kaplan DA (7 July 2020). "3 applications for RFID in the fight against COVID-19". Supply Chain Dive. 2020年10月2日時点のオリジナルよりアーカイブ。2020年9月17日閲覧。
- ^ Kristin Brooks (3 November 2020). "Ramping Up COVID-19 Vaccine Fill and Finish Capacity". Contract Pharma. 2020年11月25日閲覧。
- ^ a b c "Swiss factory rushes to prepare for Moderna Covid-19 vaccine". SwissInfo. 7 October 2020. 2020年11月1日閲覧。
- ^ a b c Kartoglu, Umit; Milstien, Julie (28 May 2014). "Tools and approaches to ensure quality of vaccines throughout the cold chain". Expert Review of Vaccines. 13 (7): 843–54. doi:10.1586/14760584.2014.923761. ISSN 1476-0584. PMC 4743593. PMID 24865112。
- ^ Hanson, Celina M.; George, Anupa M.; Sawadogo, Adama; Schreiber, Benjamin (19 April 2017). "Is freezing in the vaccine cold chain an ongoing issue? A literature review". Vaccine. 35 (17): 2127–33. doi:10.1016/j.vaccine.2016.09.070. ISSN 0264-410X. PMID 28364920。
- ^ "There are clear frontrunners in the COVID-19 vaccine race — but getting it to a clinic is a challenge in itself". Australian Broadcasting Corporation. 24 October 2020. 2020年11月15日閲覧。
- ^ "CoronaVac: Doses will come from China on nine flights and can..." AlKhaleej Today (アラビア語). 1 November 2020. 2020年11月15日閲覧。
- ^ Blankenship K (28 August 2020). "Pfizer, Moderna's coronavirus shot rollouts could freeze up, experts say, citing cold-storage needs". FiercePharma, Questex LLC. 2020年11月11日閲覧。
- ^ O'Donnell, Carl (9 November 2020). “Why Pfizer's ultra-cold COVID-19 vaccine will not be at the local pharmacy any time soon”. Reuters 11 November 2020閲覧。
- ^ a b Weise, Elizabeth (6 September 2020). “'Mind-bogglingly complex': Here's what we know about how COVID-19 vaccine will be distributed when it's approved”. USA Today. オリジナルの12 September 2020時点におけるアーカイブ。 13 September 2020閲覧。
- ^ Durbha M (29 June 2020). "The extra mile: preparing a supply chain for a COVID-19 vaccine". European Pharmaceutical Review. 2020年9月11日時点のオリジナルよりアーカイブ。2020年9月13日閲覧。
- ^ “ディープフリーザー(超低温冷凍庫)”. 厚生労働省. 2021年7月22日閲覧。
- ^ 日本放送協会. ““使われなくなる日を願って” 小さな黒い箱に込められた思い”. NHKニュース. 2021年7月22日閲覧。
- ^ “冷凍庫の電源コード、清掃員が接続部分を緩ませたか…ワクチン1000回分廃棄で県謝罪 : 社会 : ニュース”. 読売新聞オンライン (2021年7月6日). 2021年7月23日閲覧。
- ^ a b c d "The time to prepare for COVID-19 vaccine transport is now". International Air Transport Association. 9 September 2020. 2020年9月12日時点のオリジナルよりアーカイブ。2020年9月13日閲覧。
- ^ a b "COVID-19-related trafficking of medical products as a threat to public health" (PDF). United Nations Office on Drugs and Crime. 2020. 2020年9月19日時点のオリジナルよりアーカイブ (PDF)。2020年9月16日閲覧。
- ^ Kohler, Jillian Clare; Dimancesco, Deirdre (3 February 2020). "The risk of corruption in public pharmaceutical procurement: how anti-corruption, transparency and accountability measures may reduce this risk". Global Health Action. 13 (sup1): 1694745. doi:10.1080/16549716.2019.1694745. ISSN 1654-9716. PMC 7170361. PMID 32194011。
- ^ Subramanian, Samanth (13 August 2020). “Biometric tracking can ensure billions have immunity against Covid-19”. Bloomberg Businessweek. オリジナルの16 September 2020時点におけるアーカイブ。 16 September 2020閲覧。
- ^ "INTERPOL warns of organized crime threat to COVID-19 vaccines". Interpol (Orange Notice). Retrieved December 10 2020.
- ^ a b "Effective Vaccine Management (EVM) Initiative:Vaccine Management Handbook". World Health Organization. 9 September 2020. 2018年10月5日時点のオリジナルよりアーカイブ。2020年9月16日閲覧。
- ^ “ファイザー社ワクチンの特性について - 厚生労働省” (PDF). 厚生労働省. 2021年10月18日閲覧。
- ^ “ファイザー社ワクチンの特性について 総括 - 厚生労働省” (PDF). 厚生労働省. 2021年10月18日閲覧。
- ^ “【茨城新聞】新型コロナ 職域接種、進む一般開放 余剰ワクチン廃棄回避 茨城”. ibarakinews.jp. 2021年10月18日閲覧。
- ^ “先進国でワクチン余剰”. 日本経済新聞 (2021年10月7日). 2021年10月18日閲覧。
- ^ “期限切れワクチンも「効果あり」…市が2回目接種へ、ファイザー社の有効期限変更で : 医療・健康 : ニュース”. 読売新聞オンライン (2021年9月26日). 2021年10月18日閲覧。
- ^ a b c 日経:世界の接種状況
- ^ "<3>国はワクチン確保に全力を…新型コロナ【読売新聞社提言】 : 医療・健康". 読売新聞オンライン. 21 March 2021. 2021年4月10日閲覧。
- ^ 日本放送協会. "菅首相 気候変動問題 "米と協力 中国に働きかけ" 参院決算委". NHKニュース. 2021年4月10日閲覧。
- ^ 日本放送協会. “ワクチン2回目接種終了 全人口の60%超に”. NHKニュース. 2021年10月17日閲覧。
- ^ 日本放送協会. “世界のワクチン接種状況|NHK”. www3.nhk.or.jp. 2021年10月17日閲覧。
- ^ “「ワクチン実績」に政治生命かけるネタニヤフ氏 イスラエル総選挙”. 毎日新聞 (2021年2月25日). 2021年6月16日閲覧。
- ^ “ワクチン戦略に賭けたネタニヤフ氏、2年で4回目のイスラエル総選挙”. WEDGE Infinity (2021年3月23日). 2021年6月16日閲覧。
- ^ 「4回目ワクチン イスラエル開始」『読売新聞』朝刊2022年1月5日(国際面)
- ^ a b c d e f g h “なぜ、イスラエルのコロナワクチン接種率は高いのか?”. WEDGE Infinity (2021年3月26日). 2021年6月16日閲覧。
- ^ 「ワクチン接種者に100ドルドル支給、バイデン氏が各州に呼び掛け」 読売新聞オンライン(2021年7月30日配信)同日閲覧
- ^ 「米民間企業のワクチン義務化、来年1月から 全労働者の3分の3強が対象」 CNN(2021年11月5日)同日閲覧
- ^ 「消防士ら市職員、ワクチン義務化に抗議 米NY」 AFP(2021年10月26日)2021年11月5日閲覧
- ^ ワクチン拒否 解雇「許されず」厚労省が企業に指針 採用条件「明示が望ましい」『日本経済新聞』朝刊2021年11月2日(経済・政策面)2021年11月5日閲覧
- ^ "China introduces world's first 'virus passport' programme". France 24. 10 March 2021. 2021年3月11日閲覧。
- ^ "The destinations open to travelers vaccinated against Covid-19". KAKE. 1 April 2021. 2021年4月3日閲覧。
- ^ "'Shot Trips' To Dubai, Florida, Tel Aviv, Havana: Covid-19 Vaccine Tourism Takes Off". Forbes. 14 February 2021. 2021年4月3日閲覧。
- ^ “海外渡航用の新型コロナワクチン接種証明書について”. 厚生労働省. 2021年7月26日閲覧。
- ^ “Interim statement on COVID-19 vaccination for children”. WHO (2022年8月11日). 2022年8月12日閲覧。
- ^ a b “5~17 歳の小児への新型コロナワクチン接種に対する考え方” (PDF). 日本小児科学会 (2022年8月10日). 2022年8月11日閲覧。
- ^ “海外ではどのくらい小児(5~11歳)の接種が行われていますか。”. 厚生労働省. 2022年8月11日閲覧。
- ^ “COVID Vaccines for Kids 6 Months & Older: FAQs for Families”. 米国小児科学会 (2022年6月18日). 2022年8月12日閲覧。
- ^ “Children ages 5-11 now eligible for Pfizer-BioNTech COVID-19 booster dose”. Washington State Department of Health (2022年5月20日). 2022年8月12日閲覧。
- ^ “Health Canada authorizes use of Moderna COVID-19 vaccine in children 6 months to 5 years of age”. カナダ政府 (2022年7月14日). 2022年8月11日閲覧。
- ^ “6個月以上幼童本周四起可預約打科興 50至59歲人士同日可約打第4針”. 星島日報 (2022年8月2日). 2022年8月11日閲覧。
- ^ “Vaccination numbers and statistics”. Australia Government Department of Health and Aged Care. 2022年8月12日閲覧。
- ^ “COVID-19 Vaccinations in the United States”. CDC. 2022年8月12日閲覧。
- ^ “COVID-19 vaccination in Canada”. カナダ政府. 2022年8月12日閲覧。
- ^ “新型コロナワクチンについて”. 首相官邸. 2022年8月12日閲覧。
- ^ “European Centre for Disease Prevention and Control COVID-19 Vaccine Tracker”. vaccinetracker.ecdc.europa.eu. 2022年8月12日閲覧。
- ^ a b “Corona-Schutzimpfung bei Kindern und Jugendlichen”. Bundeszentrale für gesundheitliche Aufklärung (BZgA) (2022年7月8日). 2022年8月12日閲覧。
- ^ a b “Germany's vaccine panel says one COVID shot enough for children”. ZAWYA (2022年5月24日). 2022年8月12日閲覧。
- ^ “Germany's COVID-19 vaccine panel recommends single dose for kids aged 5 to 11”. XINHUANET (2022年5月25日). 2022年8月12日閲覧。
- ^ a b c Azar A (4 February 2020). "Notice of Declaration under the Public Readiness and Emergency Preparedness Act for medical countermeasures against COVID-19". 2020年4月25日時点のオリジナルよりアーカイブ。2020年4月22日閲覧。
- ^ “Pfizer given protection from legal action over coronavirus vaccine by UK government”. The Independent (2 December 2020). 5 May 2021時点のオリジナルよりアーカイブ。8 May 2021閲覧。
- ^ “Questions and Answers: Conditional Marketing Authorisation of COVID-19 Vaccines in the EU”. European Commission (11 December 2020). 4 October 2021時点のオリジナルよりアーカイブ。29 December 2020閲覧。
- ^ “COVID-19: MEPs want safe vaccines, full transparency and liability for companies”. European Parliament (7 September 2020). 13 October 2021時点のオリジナルよりアーカイブ。29 December 2020閲覧。
- ^ "副反応による健康被害が起きた場合の補償はどうなっていますか。". 新型コロナワクチンについてのQ&A. 厚生労働省. 2021年4月29日閲覧。
- ^ “新型コロナワクチンで国を集団提訴 総額9152万円の損害賠償求める 接種後死亡も危険性「広報せず」|FNNプライムオンライン”. FNNプライムオンライン (2024年4月18日). 2024年4月18日閲覧。
- ^ “新型コロナのワクチン被害は“薬害” 体調不良に悩む患者と遺族が国を提訴 厚労省“重大な懸念は認められない” | 東海地方のニュース【CBC news】 | CBC web (1ページ)”. CBCニュース (2024年4月17日). 2024年4月18日閲覧。
- ^ “サンテレビニュース”. サンテレビニュース (2024年4月17日). 2024年4月18日閲覧。
- ^ “コロナワクチン接種後死亡 遺族ら「国の広報不十分」と集団提訴”. 毎日新聞. 2024年4月18日閲覧。
- ^ Kertscher T (23 January 2020). "No, there is no vaccine for the Wuhan coronavirus". PolitiFact. Poynter Institute. 2020年2月7日時点のオリジナルよりアーカイブ。2020年2月7日閲覧。
- ^ McDonald J (24 January 2020). "Social Media Posts Spread Bogus Coronavirus Conspiracy Theory". FactCheck.org. Annenberg Public Policy Center. 2020年2月6日時点のオリジナルよりアーカイブ。2020年2月8日閲覧。
- ^ "Warning Letter – North Coast Biologics – MARCS-CMS 607532". U.S. Food and Drug Administration (FDA). 21 May 2020. 2020年5月26日時点のオリジナルよりアーカイブ。2020年5月23日閲覧。
- ^ "自国のワクチンにケチがついた腹いせにファイザーのワクチンが危ないと言いふらす中国". Newsweek日本版. 1 February 2021. 2021年3月21日閲覧。
- ^ "Chinese and Russian influence campaigns risk undermining Covid-19 vaccination programs". The Strategist (オーストラリア英語). 22 January 2021. 2021年3月21日閲覧。
- ^ オシント新時代 荒れる情報の海】(5)関連記事「巨利生む反ワクチン活動」『毎日新聞』朝刊2022年1月5日3面
- ^ a b 【オシント新時代 荒れる情報の海】(5)「ワクチンで不妊」拡散/医療デマ SNS攻防/発信者は少数 影響多大『毎日新聞』朝刊2022年1月5日1面(2022年1月8日閲覧)
- ^ “ワクチン打つと不妊?流産?専門家「誤情報に惑わされないで」”. NHK (2021年7月2日). 2021年7月12日閲覧。
- ^ シュレア, レイチェル (2021年8月11日). “新型ウイルスワクチン、妊娠にまつわる偽情報をファクトチェック”. BBC NEWS. 英国放送協会. 2021年9月9日閲覧。
- ^ a b c 真鍋厚 (2021年6月19日). “トンデモな「ワクチン陰謀論」に心酔する人が、ジワジワと増えている背景”. マネー現代. 講談社. 2021年7月16日閲覧。
- ^ a b c d e “「ワクチン効果ない」「不妊になる」SNSでデマ拡散、信じて接種しない若者たち (2ページ目)”. 読売新聞オンライン. 読売新聞社 (2021年7月19日). 2021年7月19日閲覧。
- ^ a b “【ギモン解消!!ワクチン接種Q&A】「コロナワクチン陰謀論」に信憑性はあるのか「身体が磁石になる」「マイクロチップが含まれる」「不妊にする」など”. zakzak(夕刊フジ) (2021年7月1日). 2021年7月16日閲覧。
- ^ “「ワクチン効果ない」「不妊になる」SNSでデマ拡散、信じて接種しない若者たち (1ページ目)”. 読売新聞オンライン. 読売新聞社 (2021年7月19日). 2021年7月19日閲覧。
- ^ Yan Xie, Evan Xu, Benjamin Bowe & Ziyad Al-Aly (2022年2月10日). “Long-term cardiovascular outcomes of COVID-19”. nature medicine 2023年11月19日閲覧。
- ^ “X JAPANのHEATHさん死去で科学的根拠なき「ターボ癌」トレンド入り 反ワクチン陰謀論が再燃か”. 日刊ゲンダイDIGITAL. 日刊ゲンダイ. (2023年11月8日) 2023年11月10日閲覧。
- ^ Hatachi, Kota. “「日本の高校生にワクチン、50人が死亡か半身不随などの副作用に」は誤り。大学教授の発言、YouTubeで30万回再生”. BuzzFeed. 2021年4月4日閲覧。
- ^ “接種後の死亡報告は1200件超なのに…コロナワクチンが死因、なぜゼロ?”. 2021年10月28日閲覧。
- ^ “医師等の皆さまへ~新型コロナワクチンの副反応疑い報告のお願い~”. 2021年10月28日閲覧。
- ^ “ワクチン接種後死亡例 ほとんど因果関係不明”. 2021年10月28日閲覧。
- ^ “なぜ「ワクチン接種で死亡」の原因究明が進まないのか、法医学者に聞く”. 2021年10月28日閲覧。
- ^ “【厚労省】重篤な副反応疑いは131件‐インフルエンザワクチンで報告”. 2021年10月28日閲覧。
- ^ “新型コロナウイルスワクチンの 副反応の収集・評価について - 厚生労働省” (PDF). 2022年1月8日閲覧。
- ^ “新型コロナワクチンの副反応疑い報告について”. 2021年10月28日閲覧。
- ^ “接種後の死亡報告は1200件超なのに…コロナワクチンが死因、なぜゼロ?”. 2021年10月28日閲覧。
- ^ “新型コロナワクチンの副反応疑い報告について”. 2021年10月28日閲覧。
- ^ “新型コロナワクチンの接種が原因で多くの方が亡くなっているというのは本当ですか。”. 2021年10月28日閲覧。
- ^ “通天閣の悪質デマ画像広がり、苦情など相次ぐ ワクチン巡り”. 毎日新聞. 2021年12月25日閲覧。
- ^ “通天閣ネオンサインに「治験中、射ったらあかん」…ニセ画像がSNSで拡散 : 社会 : ニュース”. 読売新聞オンライン (2021年11月6日). 2021年12月25日閲覧。
- ^ 「ワクチンを打つと入院確率が3倍になるとWHOが認めた」鳩山元首相のツイートを専門家が否定。河野太郎氏は「ワクチンデマ」と批判 - BuzzFeed Japan 2022年8月12日
- ^ ファクトチェック:ワクチン巡り鳩山由紀夫元首相がまた誤情報 専門家「影響大きい」 - 毎日新聞 2022年9月22日
関連項目
[編集]外部リンク
[編集]全般
- 新型コロナワクチンについて - 厚生労働省
- コロナワクチンナビ - 厚生労働省
- 厚生科学審議会 (予防接種・ワクチン分科会) - 厚生労働省
- 新型コロナワクチンの接種後の健康状況調査 - 厚生労働省
- 新型コロナワクチンについて - 総理大臣官邸
- 新型コロナワクチンの接種状況 - デジタル庁
- COVID-19ワクチンに関する提言 - 日本感染症学会
- 新型コロナワクチンに関する情報 - 国立感染症研究所
- NHK特設サイト「新型コロナウイルス:ワクチンQ&A」 - NHK
- 新型コロナウイルス ワクチン接種始まる - NHK放送史
- 新型コロナウイルス感染症(COVID-19)の研究開発課題について - 日本医療研究開発機構 (AMED)
- 製薬協加盟各社による、治療薬・ワクチンの研究開発の取り組みについて - 日本製薬工業協会
- Coronavirus (COVID-19) Vaccinations - Oxford Martin School
- COVID-19 vaccines - World Health Organization (WHO)
- COVAX - World Health Organization (WHO)
- COVAX Facility - Gavi
- Vaccines for COVID-19 - アメリカ疾病予防管理センター (CDC)
小児
- 5~17 歳の小児への新型コロナワクチン接種に対する考え方 - 日本小児科学会 2022/8/10更新
- 「新型コロナワクチン~子どもならびに子どもに接する成人への接種に対する考え方~」に関するQ&A - 日本小児科学会 2022/5/31更新
- 新型コロナワクチンQ&A 小児接種(5~11歳) - 厚生労働省
- 子供と10代の若者がCOVID-19のワクチン接種を受けるべき理由 - アメリカ疾病予防管理センター(CDC) 2022/7/21更新
- 子どものためのワクチン COVID-19 - カナダ政府 2022/7/14更新
- 小児に対するCOVID-19ワクチン接種に関する中間声明 - WHO 2022/8/11更新


![SARS-CoV-2に採用されているワクチンのプラットフォーム。全ウイルスワクチンには、弱毒化されたウイルスと不活性化されたウイルスの両方が含まれる。タンパク質およびペプチドサブユニットワクチンは通常、免疫原性を高めるためにアジュバントと組み合わされる。SARS-CoV-2ワクチン開発では、三量体のスパイクタンパク質全体、または受容体結合領域(RBD)などの構成要素を使用することに重点が置かれている。複数の非複製ウイルスベクターワクチンが開発されており、特にアデノウイルスに焦点が当てられている。一方、複製ウイルスベクターのコンストラクトはあまり重視されていない[200]。](http://upload.wikimedia.org/wikipedia/commons/thumb/e/ee/Fimmu-11-579250-g004.jpg/234px-Fimmu-11-579250-g004.jpg)